1-固体氢氧化钠的质量检验-氢氧化钠和碳酸钠含量的测定
浙教版九年级上册 第一章 物质及其变化 试探探究题 专项突破 (含答案)

第一章物质及其变化试探探究题一、基础题1.化学现象中包含发光、发热现象,许多物质燃烧时都伴随着发光、放热的现象。
小明同学认为有发光、放热现象的变化不一定是化学变化,于是学习小组对此展开了探究与讨论。
【提出问题】有发光、放热现象的变化都是化学变化吗?【猜想】一、都是化学变化;二、不一定都是化学变化。
【验证过程】(1)将干冷的烧杯罩在蜡烛燃烧的火焰上,观察到:a.烧杯内壁上出现水珠,b.手摸烧杯有发烫的感觉,c.蜡烛火焰逐渐变小至熄灭。
分析:蜡烛燃烧生成新物质的名称是____ ____,蜡烛燃烧为__ ______变化。
(2)观察白炽灯(灯丝为钨丝)。
分析:通电前后,钨丝本身没有发生变化,灯丝通电发热、放热属于________变化。
2.某兴趣小组对氢氧化钡溶液和稀盐酸混合后是否发生了化学反应展开了系列实验。
【实验操作】用试管取6毫升氢氧化钡溶液,往试管中加入6毫升稀盐酸,等分成两份。
【实验证明】(1)往其中一份混合液中滴入几滴酚酞试液,发现溶液呈无色。
说明溶液中不存在的离子是________,证明两者发生了反应。
(2)【继续探究】能否再设计一个实验证明盐酸中H+参加了反应?于是往混合液中滴入石蕊试液,发现变红色,溶液呈酸性,这不能证明盐酸中H+参加了反应。
讨论后,形成了新的对照实验方案,将步骤补充完整:①往盛有另一份混合液的试管中,加入足量的镁片;②________,加入等量的镁片。
(3)证明原混合液的盐酸中H+参加了反应的现象是_____ ___。
(4)【微观解释】从微观上分析:氢氧化钡溶液和稀盐酸反应的实质是___ _____。
3.科学课堂上老师演示了如图所示的几个实验:(1)图1中蜡烛熄灭的原因是________;(2)图2实验中,________(填化学式)使紫色干花(用石蕊溶液浸泡过)变红;(3)图3实验中,应观察到的实验现象是(填序号)。
A. 试管内液体上升B. 试管变瘪C. 试管内液体变红D. 试管内澄清的石灰水变浑浊4.某实验小组的同学想用碳酸钠溶液与饱和石灰水反应来制取少量氢氧化钠。
实验室NaOH和 Na2CO3含量的测定

NaOH和 Na2CO3含量的测定1.测定原理样品同时测定氢氧化钠和碳酸钠含量,滴定包含有两个滴定终点。
这个方法适应现场快速测定。
2 仪器2.1 移液管2.2 称量瓶, 25 x 15-mm - 准备一支滴管,用于70%NaOH的分析。
3 试剂3.1 盐酸溶液, 0.33 N3.2 氢氧化钠溶液, 0.33 N3.3 百里酚酞指示剂溶液, 1% - 溶解1 g百里酚酞指示剂在100 mL 的50% 乙醇中。
3.4甲基紫指示剂溶液4 测定步骤4.1 称取2.0 ~2.4 g 50% 烧碱样品到烧杯中, 精确到0.0001 g,用新煮沸的冷至室温的蒸馏水溶解稀释到500 mL容量瓶中,稀释至刻度。
对于70% 的浓碱,首先将样品加热到105℃使其完全融化,在25 x 15 mm称量瓶中充分混匀,用滴管吸取1.3 ~1.8 g 的样品到500 mL 存有100 mL新煮沸的冷至室温的蒸馏水的堆形瓶中。
4.2 加5-8 滴的百里酚酞指示剂,用0.33 N HCl,滴定至终点。
4.3 加3-5 滴的甲基紫指示剂,继续用0.33 N HCl,滴定至出现紫色。
3.4 记录滴定每一个终点消耗盐酸的体积,引入温度校正和滴定管体积校正。
5 计算(M - 2(M-T)) x N x 0.04001----------------------------------- x 100 = NaOH % 式(1)样品的重量(M - T ) x N x 0.1060------------------------------ x 100 = Na2CO3% 式(2)样品的重量下列:M =滴定甲基紫终点消耗酸的mLT =滴定百里酚酞终点消耗酸的mLN =盐酸标准溶液的浓度0.04001 = NaOH毫克当量0.1060= Na2CO3毫克当量东莞德信诚精品培训课程(部分) (点击课程名称打开课程详细介绍)内审员系列培训课程查看详情A01 ISO9001:2008内审员培训班(ISO9001内审员)A02 ISO14001:2004内审员培训班A03 ISO/TS16949:2009内审员培训A04 OHSAS18001:2007标准理解及内审员培训A05 IECQ-HSPM QC080000内审员培训A06 ISO13485:2003医疗器械质量体系内审员培训A07 SA8000社会责任内审员培训(SA8000内审员)A08 ICTI玩具商业行为守则内审员培训班A09 ISO14064:2006内审员培训班A10 GB/T23331-2009能源管理体系内审员培训A15 量规仪器校验与管理实务课程(仪校员培训内校员培训)A16 ISO管理代表及体系推行专员训练营A17 ISO文控员培训/文管员培训实务课程A18 优秀管理者代表训练营 (MR管理代表训练)JIT精益生产现场管理系列课程查看详情P01 JIT精益生产与现场改善培训班P02 生产合理化改善-IE工业工程实务训练营P03 PMC生产计划管理实务培训班(生管员培训)P04 高效仓储管理与盘点技巧培训班(仓管员培训)P05 目视管理与5S运动推行实务培训班P06 采购与供应链管理实务 (采购员培训)中基层管理干部TWI系列训练查看详情M01 优秀班组长管理实务公开课(班组长公培训)M02 优秀班组长现场管理实务培训班M03 优秀班组长品质管理实务培训班M04 优秀班组长生产安全管理实务培训班M06 提升团队执行力训练课程 (执行力培训)M07 如何做一名优秀的现场主管培训班M08 中基层现场干部TWI管理技能提升(TWI培训)M09 有效沟通技巧培训班(团队沟通企业内外部沟通) M10 企业内部讲师培训班(东莞TTT培训)M11 MTP中阶主管管理才能提升培训班(东莞MTP培训) M12 高效能时间管理培训班TS16949五大工具与QC/QA/QE品质管理类查看详情Q05 TS16949五大工具实战训练 (五大工具培训)Q06 APQP&CP先期质量策划及控制计划培训Q07 DFMEA设计潜在失效模式分析培训(DFMEA培训)Q08 PFMEA过程潜在失效模式及效应分析训练营Q09 MSA测量系统分析与仪器校验实务Q10 SPC统计过程控制培训课程(SPC训练)Q11 CPK制程能力分析与SPC统计制程管制应用训练Q12 QC七大手法与SPC实战训练班(QC7 & SPC培训)Q03 品质工程师(QE质量工程师)实务培训班Q02 品质主管训练营(品质经理人训练)Q01 杰出品质检验员QC培训班Q13 品管常用工具QC七大手法培训(旧QC7培训)Q14 新QC七大手法实战培训(新QC7培训)Q04 QCC品管圈活动训练课程 (QCC培训)节能环保安全EHS公开课程查看详情E01 节约能源管理培训(节能降耗培训)E03 GBT23331-2009能源管理体系知识培训(GBT23331标准理解)A18 ISO50001能源管理体系内审员培训(ISO50001内审员) A12 ISO9000/ISO14000一体化内审员培训班A13 ISO14001/OHSAS18001体系二合一内审员培训班A14 ISO9000/ISO14000/OHSAS18001一体化内审员培训班东莞精品企业内训课程查看详情M05 优秀班组长管理技能提升内训班(1-3天)P07 年终盘点与库存管理实务内训班( 1-2天课程 )M13 高绩效团队及执行力提升训练营(团队执行力 1-2天) Q15 FMEA失效模式分析实战训练内训(FMEA内训 1-3天)Q16 新旧QC七大手法实战内训(QC7内训 1-2天)A11 ISO内审员审核技巧提高班(ISO内审员提高班)A07 SA8000社会责任内审员培训(SA8000内审员)A08 ISO9001:2008内审员培训班(ISO9001内审员)A09 ISO14001:2004内审员培训班A10 ISO/TS16949:2009内审员培训A19 ISO10015培训管理体系标准理解与实施培训东莞德信诚公开课培训计划>>> 培训报名表下载>>> /download/dgSignUp.doc。
氢氧化钠(45%)质量检验操作规程2009.5.6[1]
![氢氧化钠(45%)质量检验操作规程2009.5.6[1]](https://img.taocdn.com/s3/m/97bf2dea6f1aff00bed51edb.png)
东北制药总厂标准操作规程1.目的:建立一个关于进厂原料氢氧化钠(粒碱)质量检验操作规程。
2.方法来源:GB209-2006、中国药典2005年版二部。
3.适用范围:本规程适应于进厂原料粒碱的检验。
4.责任人:本岗位操作者和复核者对实施本规程负责。
5.规程内容:5.1外观:按《外观检测操作规程911》检测,应符合规定。
5.2鉴别:本品的水溶液显钠盐的鉴别反应。
具体操作详见《一般鉴别检测操作规程946》。
5.3氢氧化钠和碳酸钠含量的测定5.3.1 氢氧化钠含量的测定原理试样溶液中先加入氯化钡,将碳酸钠转化为碳酸钡沉淀,然后以酚酞为指示剂,用盐酸标准滴定溶液滴定至终点。
反应如下:Na2CO3+BaCl2→BaCO3↓+2NaClNaOH+HCl→NaCl+H2O5.3.2 碳酸钠含量的测定原理试样溶液以溴甲酚绿-甲基红混合指示剂为指示剂,用盐酸标准滴定溶液滴定至终点,测得氢氧化钠和碳酸钠总和,再减去氢氧化钠含量,则可测得碳酸钠含量。
5.3.3试剂和材料5.3.3.1盐酸标准滴定溶液:c(HCl)=1.000mol/L,同中国药典2005年版二部。
5.3.3.2氯化钡溶液:100g/L。
溶解10g氯化钡于100ml水中。
使用前,以酚酞为指示剂,用氢氧化钠标准溶液调至微红色。
规程编号:64-QOP-736-00 页码:2/65.3.3.3酚酞指示剂:10g/L。
溶解1g酚酞于100ml95%乙醇中。
5.3.3.4溴甲酚绿-甲基红混合指示剂:将三份0.1g/L溴甲酚绿的乙醇溶液和一份0.2g/L甲基红的乙醇溶液混合。
5.3.4 仪器、设备一般实验室仪器和磁力搅拌器。
5.3.5分析步骤5.3.5.1 试样溶液的制备用已知质量干燥、洁净的称量瓶,迅速从样品瓶中移取液体氢氧化钠50g ±1g(精确至0.01g)。
将已称取的样品置于已盛有约300mL水的1000mL 容量瓶中,冲洗称量瓶,将洗液加入容量瓶中。
工业用氢氧化钠

工业用氢氧化钠警示——如果不采取适当的防范措施,本标准所属产品在生产、运输、装卸、贮运和使用等过程中可能存在危险。
本标准无意对与本产品有关的所有安全问题提出建议。
用户在使用本标准之前,有责任建立适当的安全和防范措施,并确定相关规章限制的适用性。
1 范围本标准规定了工业用氢氧化钠的要求、采样、试验方法、检验规则及标志、包装、运输、贮存。
本标准适用于工业用氢氧化钠产品。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB 190 危险货物包装标志GB/T 191 包装储运图示标志GB/T 601 化学试剂标准滴定溶液的制备GB/T 603 化学试剂试验方法中所用制剂及制品的制备GB/T 4348.1 工业用氢氧化钠氢氧化钠和碳酸钠含量的测定GB/T 4348.2 工业用氢氧化钠氯化钠含量的测定汞量法GB/T 4348.3 工业用氢氧化钠铁含量的测定1,10-菲啰啉分光光度法GB/T 6678 化工产品采样总则GB/T 6679 固体化工产品采样通则GB/T 6680 液体化工产品采样通则GB/T 7698 工业用氢氧化钠碳酸盐含量的测定滴定法GB/T 8170 数值修约规则与极限数值的表示和判定GB/T 9725 化学试剂电位滴定法通则GB/T 11213.2 化纤用氢氧化钠氯化钠含量的测定分光光度法GB/T 15915 包装容器固碱钢桶3 符号下列符号适用于本文件。
IL-液体工业用氢氧化钠;IS-固体工业用氢氧化钠。
4 要求4.1 外观。
固体(包括片状、粒状、块状等)氢氧化钠主体为白色,有光泽,允许微带颜色。
液体氢氧化钠为无色透明、稠状液体。
4.2 工业用氢氧化钠应符合表1的规定。
表1 工业用氢氧化钠指标5 采样产品按批检验。
铁桶包装的固体氢氧化钠产品以每锅包装量为一批;袋装的片状、粒状、块状等固体氢氧化钠产品以每天或每一生产周期生产量为一批;液体氢氧化钠产品以贮槽或槽车为一批。
分析化学第七版答案

分析化学第七版答案【篇一:分析化学(第7版)习题参考解答】txt>1、指出下列各种误差是系统误差还是偶然误差?如果是系统误差,请区别方法误差、仪器和试剂误差或操作误差,并给出它们的减免方法。
答:①砝码受腐蚀:系统误差(仪器误差);更换砝码。
②天平的两臂不等长:系统误差(仪器误差);校正仪器。
③容量瓶与移液管未经校准:系统误差(仪器误差);校正仪器。
④在重量分析中,试样的非被测组分被共沉淀:系统误差(方法误差);修正方法,严格沉淀条件。
⑤试剂含被测组分:系统误差(试剂误差);做空白实验。
⑥试样在称量过程中吸潮:系统误差(操作误差);严格按操作规程操作。
⑦化学计量点不在指示剂的变色范围内:系统误差(方法误差);另选指示剂。
⑧读取滴定管读数时,最后一位数字估计不准:偶然误差;严格按操作规程操作,增加测定次数。
⑨在分光光度法测定中,波长指示器所示波长与实际波长不符:系统误差(仪器误差);校正仪器。
⑩在hplc测定中,待测组分峰与相邻杂质峰部分重叠系统误差(方法误差);改进分析方法6、两人测定同一标准试样,各得一组数据的偏差如下:②为什么两组数据计算出的平均偏差相等,而标准偏差不等;③哪组数据的精密度高?解:①d?s?d1?d2?d3???dnn?di2n?1 d1?0.24 d2?0.24 s1?0.28 s2?0.31②标准偏差能突出大偏差。
③第一组数据精密度高。
解:①x??②s?③s?xi?12.0104 n?(xi?x)2?0.0012 n?1sn ?0.00038snu?x?t?t④置信限=s查表2-2,f?9时,t0.01?3.25 n=?3.25?0.00038??0.00128、在用氯丁二烯氯化生产二氯丁二烯时,产品中总有少量的三氯丁二烯杂质存在。
分析表明,杂质的平均含量为1.60%。
改变反应条件进行试生产,取样测定,共取6次,测定杂质含量分别为:1.46%、1.62%、1.37%、1.71%、s?0.13 %x?s/n?0.13%/6?0.053% 解:x?1.51%t计?x??sx?1.51%?1.60%?1.7 0.053%查表2-2,t5,0.05=2.571,t计算 t临界值。
工业用氢氧化钠试验方法

工业用氢氧化钠试验方法l 适用范围本方法适用于隔膜法、苛化法制取的工业氢氧化钠的纯度及其他杂质含量的测定,符合本标准的工业用氢氧化钠,可使用于火力发电厂补给水处理系统阴离子交换器的再生(还原)。
2 引用标准GB 209 工业用氢氧化钠GB 4348.1 工业用氢氧化钠中氢氧化钠和碳酸钠含量的测定GB 4348.2 工业用氢氧化钠中氯化钠含量的测定—汞量法GB 4348.3 工业用氢氧化钠中铁的测定—邻菲罗啉分光光度法3 检验规则、采样方法及安全注意事项3.1 检验规则使用单位有权按本标准规定的技术要求、检验规则和检验方法,对所收到的工业用氢氧化钠进行验收。
3.2 采样方法3.2.1 工业用固态氢氧化钠由总桶数的5%中采取试样,小批量时不得少于3桶。
顺桶竖接口处剖开桶皮,将碱击开,用不锈钢工具或电钻(钻头不得有铁锈)从上、中、下三处迅速取出有代表性的样品,混匀,取出不少于400 g的样品,装于带胶塞的清洁广口瓶中,密封。
如因取样方法不同,影响产品质量而发生争执时,仍以剖桶取样为准。
3.2.2 工业用液态氢氧化钠用槽车或贮槽装运时,从上、中、下三处(上部离液面1/10液层、下部离底部1/10液层)取出等量试样(总样量不少于500mL),混匀。
3.2.3 以上取样时,在试样瓶上应说明生产厂名称、产品名称、类型、批号或槽车号、取样日期及取样人姓名。
3.2.4 如检验结果有一项指标不符合附录A(参考件)的规定,应重新自两倍量的桶中或槽车中采取试样进行复验。
复验的结果,只要有一项指标不符合附录A(参考件)的规定,则整批产品为不合格品。
3.3 安全注意事项氢氧化钠具有腐蚀性,操作时必须穿防护服、戴防护眼镜和胶皮手套,使用相应的劳动保护用具。
附录 A工业用氢氧化钠的技术指标(参考件)本附录摘自CB 209《工业用氢氧化钠》。
表A1 工业用固态氢氧化钠指标要求级别指标指标名称苛化法隔膜法1 级2 级l 级 2 级氢氧化钠(NaOH) %>97.0 >96.0 >96.0 >95.0 碳酸钠(Na2CO3) %<1.7 <2.5 <1.4 <1.8 氯化钠(NaCl) %<1.2 <1.4 <2.8 <3.3 三氧化二铁(Fe2O3) <0.01 <0.0l <0.01 <0.02表A2 工业用液态氢氧化钠指标要求级别指标指标名称苛化法隔膜法1 级2 级 1 级 2 级氢氧化钠(Na0H) %>45.0 >42.0 >42.0 >30.0 碳酸钠(Na2C03) %<1.1 <1.5 <0.8 <0.8 氯化钠(NaCl) %<0.8 <1.0 <2.0 <5.0 三氧化二铁(Fe2O3) %<0.02 <0.03 <0.01 <0.01工业氢氧化钠—滴定法本标准适用于GB 209《工业用氢氧化钠》中规定的各级工业用氢氧化钠。
工业氢氧化钠浓度标准和分析方法
工业氢氧化钠1、目的;本标准依据GB 209-2006《工业氢氧化钠》,规定了工业氢氧化钠的要求、试验方法。
本标准适用于本公司离子膜电解法生产的31%氢氧化钠和蒸发后生产的49%氢氧化钠。
分子式:NaOH相对分子质量:40.062、要求2.1外观:稠状液体2.2 GB 209-2006《工业氢氧化钠》规定了工业氢氧化钠,应符合下表要求3、试验方法GB 209-2006规定的所有项目为型式检验项目,其中氢氧化钠、氯化钠为出厂检验项目,每月进行一次型式检验。
LGBH所有项目均为出厂检验项目。
3.1氢氧化钠含量的测定3.1.1原理在试样溶液中加入氯化钡,将碳酸钠转化为碳酸钡沉淀,然后以酚酞为指示剂,用盐酸标准滴定溶液滴定至终点。
反应式如下:Na2CO3+BaCl2=BaCO3+2NaClNaOH+HCl=NaCl+H2O3.1.2仪器、试剂;3.1.2.1仪器:一般实验室常用仪器3.1.2.2试剂:1)C(HCl)=1.0mol/L。
2)酚酞指示剂:10g/L乙醇溶液。
3)氯化钡溶液:100g/L使用前,以酚酞为指示剂,用氢氧化钠标准溶液调至微红色。
3.1.3.分析步骤1)取一干燥的带盖的称量瓶,用此称量瓶快速称取固体氢氧化钠36g±1g 或液体氢氧化钠50±1g(精确至0.0001g)。
2)将此样品转移到已盛有300ml水的1000ml容量瓶中,冲洗称量瓶,将洗液加入容量瓶中。
冷却至室温后稀释至刻度,摇匀。
3)量取50.00ml试样溶液,注入250ml具塞三角瓶中,加入10ml氯化钡溶液,摇匀,静置15分钟,加入2~3滴酚酞指示剂,在磁力搅拌器搅拌下,用HCl标准溶液密闭滴定至微红色为终点。
3.1.4分析结果的表述式中:C——HCl标准溶液的浓度,mol/L;V——HCl标准溶液的体积,ml;m——样品质量,g。
项目一 工业氢氧化钠中氢氧化钠及碳酸钠含量测定

项目一工业氢氧化钠中氢氧化钠及碳酸钠含量测定一、实验目的(1)掌握酸碱滴定的相关知识在工业氢氧化钠分析检验的应用。
(2)掌握工业氢氧化钠分析检验中各项技术指标的分析条件二.实验原理1 氢氧化钠含量测定的原理试样溶液中先加入氯化钡,将碳酸钠转化为碳酸钡沉淀,然后以酚酞为指示剂,用盐酸标准滴定溶液滴定至终点。
反应如下:Na2CO3+BaCl2→BaCO3↓+2NaClNaOH+HCl→NaCl+H2O2 碳酸钠含量测定的原理试样溶液以溴甲酚绿一甲基红为指示剂,用盐酸标准滴定溶液滴定至终点,测得氢氧化钠和碳酸钠总和,再减去氢氧化钠含量,则可测得碳酸钠含量。
Na2CO3+2HCl→CO2+2NaCl+H2ONaOH+HCl→NaCl+H2O三.试剂仪器准备1、药品及试剂配制NaOH、无水Na2CO3、甲酚红、百里酚蓝、氯化钡、无水乙醇或95乙醇、溴甲酚绿、甲基红、酚酞[溴甲酚绿—甲基红混合指示剂配置]0.1%的溴甲酚绿乙醇溶液配制:称取0.10g溴甲酚绿,溶于乙醇,用乙醇稀释至100ml即可。
0.2%的甲基红乙醇溶液配制:称取0.20g甲基红,溶于乙醇,用乙醇稀释至100ml即可。
将0.1%的溴甲酚绿乙醇溶液与0.2%的甲基红乙醇溶液按3:1的体积比混合摇匀即得溴甲酚绿—甲基红混合指示剂。
甲酚红指示剂1份,0.1%百里酚蓝溶液3份混合即得甲酚红指示液取甲酚红0.1g,加0.05mol/L氢氧化钠溶液5.3ml使溶解,再加水稀释至100ml,即得。
百里酚蓝指示剂:0.1g百里酚蓝溶于20mL乙醇中,加水至100mL。
酚酞指示剂(10g/L)[盐酸滴定液(1.000mol/L)][配制] 取盐酸90ml ,加水适量使成1000ml ,摇匀。
[试样配制]取36g 工业氢氧化钠固体,溶解于1L 容量瓶内,摇匀。
(或称取180g 试样,溶于500ml 容量瓶内,使用使稀释10倍即可)2、器皿250ml 锥形瓶、50ml 移液管、磁力搅拌器、酸式滴定管四、实验步骤1、盐酸标准滴定液的标定取干燥至恒重的无水碳酸钠约1.5g ,精密称定,加水50ml 使溶解,加甲基红-溴甲酚绿混合指示剂10滴,用本液滴定至溶液由绿色变为紫红色,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
工业氢氧化钠GB209

2.5 允许差
平行测定结果的绝对值之差不超过下列值:
氢氧化钠(NaOH): 0.1%;
碳酸钠(Na2 C03):0. 05%。 取平行测定结果的算术平均值为测定结果。
搅拌下,用盐酸标准滴定溶液滴定至微红色为终点。记下滴定
所消耗的盐酸标准滴定溶液的体积(V1 ) 。
2.3. 3氢氧化钠和碳酸钠含量的测定 用单刻度吸量管移取50 mL试样溶液,注入250 mL三 角瓶中,加人10滴溴甲酚绿—甲基红混合指示液,在磁 力搅拌器搅拌下,用盐酸标准滴定溶液滴定至暗红色为
终点。记下滴定所消耗的盐酸标准滴定溶液的体积(V2 ) 。
2.1 仪器
2.1. 1 单刻度吸量管:50 mL, A类; 2.1. 2 滴定管:50 mL,有0. 1 mL的分度值,A类; 2.1. 3 磁力搅拌器。 2.2 .1氢氧化钠测定原理
试样溶液中加人氯化钡,将碳酸钠转化为碳酸钡沉淀,然后
以酚酞为指示液,用盐酸标准滴定溶液滴定至终点。反应如下:
2.2.2碳酸钠含量的测定原理
试样溶液以澳甲酚绿一甲基红混合指示液为指示液, 用盐酸标准滴定溶液滴定至终点,测得氢氧化钠和碳酸 钠总和,再减去氢氧化钠含量,则可测得碳酸钠含量。
2.3 分析步骤 2.3. 1试样溶液的制备
用称量瓶迅速称取固体氢氧化钠30 g士1g或液体氢氧化钠50
g士1g(精确至0. O1 g),将已称取的样品置于已盛有约300 mL水 的1 000 mL容量瓶中,加水,溶解。冷却至室温,稀释至刻度, 摇匀。 2.3. 2氢氧化钠含量的测定 用单刻度吸量管移取50 mL试样溶液,注入250 mI.三角瓶中, 加10入 mL氯化钡溶液,加人2-3滴酚酞指示液,在磁力搅拌器
Hale Waihona Puke 2.4 结果计算2.4. 1 氢氧化钠含量以氢氧化钠(NaOH)质量分数二w1计,数值以 %表示,按式(1)计算:
氢氧化钠质量标准及检验操作规程
XXXXXXXXX有限公司辅料质量标准及检验操作规程1 品名:1.1 中文名:氢氧化钠1.2 汉语拼音:Qing yang hua na2 代码:3 供应商:4 取样文件编号:5 检验方法文件编号:6 依据:《中国药典》(2020年版第四部)。
7 质量标准:7 检验操作规程:7.1 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.2 鉴别:本品的水溶液显钠盐的鉴别反应(附录21)。
7.3检查:7.3.1碱度:取本品,加水溶解制成每1ml中含0.1mg的溶液,依法测定(附录11),pH值不得小于11.0。
7.3.2溶液的澄清度与颜色:取本品1.0g,加水20ml溶解,溶液应澄清无色。
7.3.3氯化物:取本品0.50g,依法检查(附录26),与标准氯化钠溶液5.0ml 制成的对照液比较,不得更浓(0.005%)。
7.3.4硫酸盐:取本品1.0g 检查(附录40),与标准硫酸钾溶液2.0制成的对照液比较,不得更浓(0.015%)。
7.3.5钾盐:取本品0.25g,加水5ml溶解后,加醋酸使成酸性,置冰浴中冷却,再加亚硝酸钴钠试液数滴,不得产生浑浊。
7.3.6铝盐与铁盐:取本品5.0g,加稀盐酸50ml溶解后,煮沸,放冷,加氨试液使成碱性,滤过,滤渣用水洗净,并炽灼至恒重,遗留残渣不得过5mg。
7.3.7重金属:取本品1.0g,加水5ml与稀盐酸11ml溶解后,煮沸,放冷,加酚酞指示液1滴与氨试液适量至溶液显淡红色,加醋酸盐缓冲液(PH3.5)2ml 与水适量使成25ml,依法检查(附录13第一法),含重金属不得过百万分之二十。
7.4 含量测定:取本品1.5g,精密称定,加新沸过的冷水40ml溶解,放冷至室温,加酚酞指示液3滴,用硫酸滴定液(0.5m ol/L)滴定至红色消失,记录消耗硫酸滴定液的体积,再加甲基橙指示液2滴,继续滴加硫酸滴定液至显持续的橙红色。
根据消耗硫酸滴定液的体积,算出供试量中的总碱量(作为NaOH 计算),并根据加甲基橙指示液后消耗硫酸滴定液的体,算出供试量中Na2CO3的含量。
第十单元酸和碱单元测试卷(A卷基础篇)(解析版)

班级姓名学号分数第十单元:《酸和碱》单元测试卷(A卷)相对原子质量:H:1、C:12、O:16、Cl:35.5、Ca:40(时间:60分钟,满分100分)一、选择题(每小题2分,共40分)1、下列物质呈酸性的是()A.柠檬水B.肥皂水C.石灰水D.浓氨水【答案】A【解析】A、柠檬水中含有柠檬酸,显酸性,故选项正确;B、肥皂水显碱性,故选项错误;C、石灰水是氢氧化钙的水溶液,显碱性,故选项错误;D、浓氨水是氨气的水溶液,是一种碱溶液,显碱性,故选项错误;故选A。
2、【山东临沂】人体内一些液体的正常pH范围如下:液体胃液唾液胆汁胰液pH 0.9﹣1.5 6.6﹣7.1 7.1﹣7.3 7.5﹣8.0下列说法中不正确的是()A.胆汁和胰液显碱性 B.胃液比唾液酸性弱C.胰液比胆汁碱性强 D.服用含氢氧化铝[Al(OH3)]的药物可以治疗胃酸过多症【答案】B【解析】A、胆汁、胰液的pH均大于7,均显碱性,故选项说法正确。
B、胃液的pH比唾液的小,胃液比唾液酸性强,故选项说法错误。
C、胰液的pH比胆汁的大,胰液比胆汁碱性强,故选项说法正确。
D、氢氧化铝能与胃酸发生中和反应,且无毒、无害,服用含氢氧化铝[Al(OH3)]的药物可以治疗胃酸过多症,故选项说法正确。
故选:B。
3、下列对盐酸的叙述正确的是( )A.盐酸是氯化氢气体的水溶液 B.纯净的盐酸往往带有黄色C.浓盐酸在空气中会冒白烟 D.盐酸具有强烈的吸水性【答案】A【解析】纯净的盐酸是无色的;浓盐酸在空气中会形成白雾而不是白烟;盐酸具有挥发性,不具有吸水性。
4、下列气体会污染空气并且可以用氢氧化钠溶液来吸收的是()A.CO2 B.O2 C.SO2 D.CO【答案】C【解析】氢氧化钠可以和某些非金属氧化物反应,例如二氧化碳、二氧化硫,但不能吸收一氧化碳,本题要求该气体是大气污染物,所以答案是C。
5、下列有关酸的说法中,正确的是()A.酸的组成中一定含有氢元素 B.能够导电的溶液是酸C.滴加无色酚酞不变色的溶液是酸 D.能与碱发生反应的物质是酸【答案】A【解析】A.电离时,产生的阳离子全部是氢离子的化合物属于酸,所以酸中一定含有氢元素,故正确;B.酸、碱、盐的水溶液都具有导电性,能导电的不一定是酸,故错误;C.酸性溶液与中性溶液均不能使无色酚酞试液变色,故错误;D.部分非金属氧化物也能与碱反应,如二氧化碳与氢氧化钠反应生成碳酸钠和水,故错误。
碳酸钠含量测定
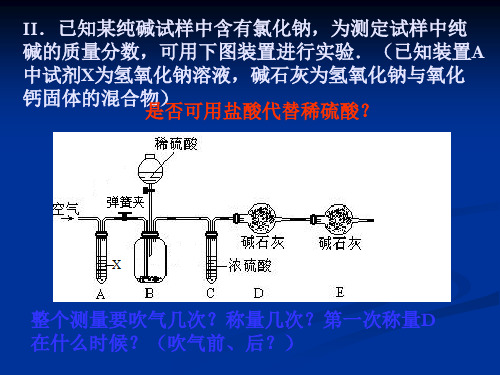
(2)有同学提出以图2代替图1中的收集装置,若不考虑所加硫 酸带来的体积影响,则所测CO2气体的体积 _偏__小__(填“偏大”、 “偏小”、“不变”),理由是_C_O__2能__溶__于__水__且__与__水__反__应_, 你的改进方案是 __在__水__面__上__覆__盖__一__层__植__物__油__。
三、测pH滴定法
( pH=7时所加酸的体积、密度、质量分数)
3、为测定某部分变质的氢氧化钠固体中氢氧化钠 的质量分数,设计以下装置进行试验(假设每步实 验都完全进行)
(1)要确定该样品中氢氧化钠的质量分数, 做需要的数据是(A 、C) A.固体样品质量 B.浓硫酸实验前后的质量 C.浓氢氧化钠实验前后质量 D.氢氧化钠固体实验前后质量
(2)没有最后一个装置,对氢氧化钠质量分 数的测定结果影响是__偏__大________ (填“偏大”、“偏小”或“不变”)
二、样品中NaOH的含量测定 有哪些方法?
小刚认为可以通过沉淀法计算碳酸钠的质量,他称取了
该混合物样品10.0g,按下列步骤进行实验:
CaCl2 + Na2CO3→CaCO3 ↓ + 2NaCl
【方案二】沉淀分析法 .(先静置后过滤,余下的搅拌后过滤、
为什么?)
(1)溶液A中的溶质有______.如何正确过滤? (2)操作Ⅰ是_______(3)若缺少操作Ⅰ,会导致测 定结果.(偏大、偏 小、无影响) (4)若加入的CaCl2溶液的量不足,会导致测定结果 _________.(偏大、偏小、无影响)根据沉淀的质量计
改进措施
在干燥管之前添加一个装 有浓硫酸的干燥装置
在发生装置上再连接一个装
空气中的CO2被装置C吸收, 导致测定的CO2质量偏大
2020人教版中考化学实验题突破04 教材基础实验及拓展测试(2)【带答案解析】

04 教材基础实验及拓展(二)(测试)1、【2019山东泰安】如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。
下列相关叙述中正确的是()①一段时间后,铁丝会由下向上出现锈蚀现象;②一段时间后,水面处铁丝锈蚀严重;③一段时间后,塑料瓶会变膨胀,因为铁生锈要放热;④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关A.①②B.②④C.②③D.③④【答案】B【解析】在水面处的铁丝与水和氧气充分接触,最先生锈,由于铁生锈需要消耗氧气,导致瓶内的气压减小,故一段时间后塑料瓶会变瘪;故选:B。
2、【2019年安徽省】某同学用一系列实验探究物质的燃烧,得到下列结论,其中不正确的是()A.镁条在氧气和二氧化碳中均能燃烧,说明二氧化碳分子中有氧气B.玻璃棒不能燃烧而火柴棒可以燃烧,说明燃烧与物质本身性质有关C.蜡烛在氧气中比在空气中燃烧更旺,说明燃烧与氧气的浓度有关D.燃烧是一种化学反应,需考虑两方面因素:反应物(内因)和反应条件(外因)【答案】A【解析】A.镁条在氧气和二氧化碳中均能燃烧,说明二氧化碳一定条件下也能支持燃烧,二氧化碳分子中不含氧气,故A错误。
B.玻璃棒不能燃烧而火柴棒可以燃烧,玻璃棒不是可燃物,火柴棒是可燃物,说明燃烧与物质本身性质有关,故B正确。
C.蜡烛在氧气中比在空气中燃烧更旺,空气中氧气浓度比纯氧中地,说明燃烧与氧气的浓度有关,故C正确。
D.燃烧是一种化学反应,需考虑两方面因素:反应物(内因)和反应条件(外因),故D正确。
故选A3、【2018山东德州】下图是水电解实验示意图,下列有关说法正确的是( )A. 正极连接的玻璃管内产生氢气B. 产生两种气体质量比为2:1C. 水是由氢分子和氧分子组成D. 在化学变化中原子重新组合【答案】D【解析】与电源正极相连的玻璃管内产生的是氧气;与直流电源的正极和负极相连管内产生气体的质量比为8:1,体积比为1:2;水通电分解是化学变化,水通电后生成氢气和氧气,说明水是由氢元素和氧元素组成的;在化学变化中,构成物质的的分子分裂成原子,原子重新组合成新的分。
项目一--工业氢氧化钠中氢氧化钠和碳酸钠含量测定

项目一工业氢氧化钠中氢氧化钠及碳酸钠含量测定一、实验目的(1)掌握酸碱滴定的相关知识在工业氢氧化钠分析检验的应用。
(2)掌握工业氢氧化钠分析检验中各项技术指标的分析条件二.实验原理1 氢氧化钠含量测定的原理试样溶液中先加入氯化钡,将碳酸钠转化为碳酸钡沉淀,然后以酚酞为指示剂,用盐酸标准滴定溶液滴定至终点。
反应如下:Na2CO3+BaCl2→BaCO3↓+2NaClNaOH+HCl→NaCl+H2O2 碳酸钠含量测定的原理试样溶液以溴甲酚绿一甲基红为指示剂,用盐酸标准滴定溶液滴定至终点,测得氢氧化钠和碳酸钠总和,再减去氢氧化钠含量,则可测得碳酸钠含量。
Na2CO3+2HCl→CO2+2NaCl+H2ONaOH+HCl→NaCl+H2O三.试剂仪器准备1、药品及试剂配制NaOH、无水Na2CO3、甲酚红、百里酚蓝、氯化钡、无水乙醇或95乙醇、溴甲酚绿、甲基红、酚酞[溴甲酚绿—甲基红混合指示剂配置]0.1%的溴甲酚绿乙醇溶液配制:称取0.10g溴甲酚绿,溶于乙醇,用乙醇稀释至100ml即可。
0.2%的甲基红乙醇溶液配制:称取0.20g甲基红,溶于乙醇,用乙醇稀释至100ml即可。
将0.1%的溴甲酚绿乙醇溶液与0.2%的甲基红乙醇溶液按3:1的体积比混合摇匀即得溴甲酚绿—甲基红混合指示剂。
甲酚红指示剂1份,0.1%百里酚蓝溶液3份混合即得甲酚红指示液取甲酚红0.1g,加0.05mol/L氢氧化钠溶液5.3ml使溶解,再加水稀释至100ml,即得。
百里酚蓝指示剂:0.1g百里酚蓝溶于20mL乙醇中,加水至100mL。
酚酞指示剂(10g/L)[盐酸滴定液(1.000mol/L)][配制] 取盐酸90ml ,加水适量使成1000ml ,摇匀。
[试样配制]取36g 工业氢氧化钠固体,溶解于1L 容量瓶内,摇匀。
(或称取180g 试样,溶于500ml 容量瓶内,使用使稀释10倍即可)2、器皿250ml 锥形瓶、50ml 移液管、磁力搅拌器、酸式滴定管四、实验步骤1、盐酸标准滴定液的标定取干燥至恒重的无水碳酸钠约1.5g ,精密称定,加水50ml 使溶解,加甲基红-溴甲酚绿混合指示剂10滴,用本液滴定至溶液由绿色变为紫红色,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
DLT 425.2-1991工业氢氧化钠中氢氧化钠和碳酸钠含量的测定——滴定法

中华人民共和国电力行业标准DL 425.2—91工业氢氧化钠中氢氧化钠和碳酸钠含量的测定——滴定法中华人民共和国能源部1991-10-04批准 1992-04-01实施本标准适用于 GB 209《工业用氢氧化钠》中规定的各级工业用氢氧化钠。
1 方法概要1.1 氢氧化钠含量的测定试样溶液中先加入氯化钡,则碳酸钠转化为碳酸钡沉淀,然后以酚酞为指示 剂,用盐酸标准溶液滴定,溶液由红色变为无色即为终点,反应如下:Na CO BaCl BaCO NaCl 2323+→↓+2NaOH HCl NaCl H O 2+→+1.2 碳酸钠含量的测定以甲基橙为指示剂,用盐酸标准溶液滴定,溶液由黄色变为橙色即为终点。
测 得氢氧化钠与碳酸钠的总和,再减去氢氧化钠含量,即可算出碳酸钠含量。
2 试剂2.1 10%氯化钡(分析纯)溶液(m/V )。
2.2 1%酚酞乙醇溶液(m/V )。
2.3 0.1%甲基橙溶液(m/V )。
2.4 1 mol/L 盐酸(优级纯)标准溶液。
3 测定方法3.1 试样溶液的制备用已知质量的称量瓶,迅速称取固态氢氧化钠35±1g 或液态氢氧化钠50g(称 准至0.01g),放入1000mL 容量瓶中,加二级试剂水溶解,冷却到室温后稀释至刻 度,摇匀。
3.2 氢氧化钠含量的测定吸取50.0mL 试样溶液(见3.1条),注入250mL 锥形瓶中,加入20mL 氯化钡 溶液(见2.1条),再加入2~3滴酚酞指示剂溶液(见2.2条),充分摇匀,用1mol/L 盐酸标准溶液(见2.4条)滴定,溶液由红色变为无色为终点,记录所消耗 盐酸标准溶液的体积(V)。
3.3 氢氧化钠和碳酸钠含量的测定吸取50mL 试样溶液(见3.1条),注入250mL 锥形瓶中,加2~3滴甲基橙指 示剂溶液(见2.3条),充分摇匀,用1mol/L 盐酸标准溶液(见2.4条)滴定,溶液由 黄色变为橙色为终点,记录所消耗盐酸标准溶液体积(V 1)。
工业氢氧化钠中氢氧化钠和碳酸钠含量检测

工业氢氧化钠中氢氧化钠和碳酸钠含量检测作者:侯小伟来源:《中小企业管理与科技·上中下旬刊》 2015年第3期侯小伟(乌海职业技术学院)摘要:本文分别采用GB 4348.1-2013 中规定的氢氧化钠和碳酸钠含量的测定方法和双指示剂法对工业氢氧化钠品质进行分析。
通过实验测定得知用双指示剂法分析工业氢氧化钠中氢氧化钠和碳酸钠含量,与其实际值相差悬殊,不准确;GB 4348.1-2013 法分析工业氢氧化钠中氢氧化钠和碳酸钠含量与实际值相符;因此,建议采用GB 4348.1-2013 规定的氯化钡法进行分析。
关键词:工业氢氧化钠双指示剂法国标法0 引言作为重要的基本化工原料,氢氧化钠在石油、化工、纺织等行业得到广泛的应用,具有较高的经济延伸价值。
氢氧化钠和碳酸钠含量作为主要性能指标,通常情况下可以反映工业用氢氧化钠产品的质量,所以,测定氢氧化钠和碳酸钠含量对氯碱生产具有重要的意义。
笔者利用国标规定方法———氯化钡法和双指示剂法对工业氢氧化钠产品中氢氧化钠和碳酸钠含量进行测定,并对实验结果进行分析。
1 双指示剂法测定氢氧化钠和碳酸钠含量1.1 测定原理利用盐酸滴定氢氧化钠和碳酸钠时,可用酚酞和甲基橙两种不同指示剂测定工业氢氧化钠中的氢氧化钠、碳酸钠含量,滴定过程中会出现两个终点,反应方程式为:NaOH+HCl →NaCl+H2O;Na2CO3+HCl →NaHCO3+NaCl。
加入甲基橙指示剂,这时碳酸氢钠生成二氧化碳,反应的方程式为:NaHCO3+HCl→NaCl+H2O+CO2↓。
氢氧化钠和碳酸钠的含量可以根据两次消耗盐酸标准溶液的体积及盐酸标准溶液的浓度进行计算。
1.2 试剂和仪器浓度为1mol/L 的盐酸标准溶液,质量浓度为1g/L 的甲基橙指示剂,质量浓度为10g/L 的酚酞指示剂;1 支酸式滴定管,1 只1000mL 的容量瓶,1 支50mL 的移液管,若干个三角瓶、称量瓶。
1.3 测定步骤1.3.1 盐酸标准溶液的标定。
项目3 工业氢氧化钠含量测定

酸碱指示剂:一类有颜色的有机物(弱酸 或弱碱),随溶液pH的不同结构发生变化, 而呈现不同颜色,颜色与结构相互关联。
HIn
H+ + In-
酸式色
碱式色
如:
有机弱酸:酚酞、石蕊等;
有机弱碱:甲基橙、甲基红等。
16
3.1.2 常用酸碱指示剂的变色范围
HIn + H2O
H3O+ + In-
KHIn=
[H3O+][In-] [HIn]
(4)酸碱滴定反应的终点是如何判断的?在近终点 时应如何操作滴定管?
(5)如何计算酸碱水溶液中的[H+]的浓度?
13Biblioteka 项目导学3.1 酸碱指示剂 3.2 滴定曲线与指示剂的选择
14
3.1 酸碱指示剂
3.1.1 指示剂变色原理 3.1.2 常用酸碱指示剂的变色范围
返回
15
3.1.1 指示剂变色原理
pH=4.30
26
滴定曲线的讨论(指示剂的选择):
滴定过程中,溶液总体积不断增加,计算时应注意: ① 滴定前19.98mL,pH变化慢:4.3-1=3.3; ② 化学计量点前后0.04 mL(约1滴),pH发生突跃变化:
9.7-4.3=5.4; ③ 滴定终点与化学计量点并不一定相同,但相差不
超过±0.02mL,滴定误差不超过±0.1%;符合滴 定分析要求。 ④ 指示剂选择原则:指示剂的变色范围全部或一部 分在滴定突跃范围内。
用(1)1.000 mol·L-1 (2)0.100 0 mol·L-1
(3)0.010 00mol·L-1 NaOH溶液滴定相应
浓度的 HCl溶液
29
3.2.2 弱酸或弱碱的滴定
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碳酸钠
氯化钠 三氧化二铁
%
% %
≤1.3
≤2.7 ≤0.008
≤1.4
≤2.8 ≤0.01
≤1.6
≤3.2 ≤0.02
任务1 氢氧化钠和碳酸钠含 量的测定
一、教学目标---能力目标
(1)能用双指示剂法测定氢氧化钠和碳酸钠含量;
(2)巩固酸碱平衡理论和酸碱滴定法相关操作;
(3)熟悉化学分析的基本操作技术;
V1-V2 V1
HCl标液
酚酞 红
NaCl Na2CO3
HCl标液
V2 V2
NaCl NaHCO3 V2 NaCl
HCl标液
终点1 红色刚消失 甲基橙
黄 终点2 橙色
CO2+H2O
当 V1>V2 时,试液为 NaOH 和 Na2CO3 的混合物,
NaOH 和 Na2CO3 的含量(以质量浓度 g•L-1 表示)可由
下式计算:
ω (NaOH)= c(HCl ) (V1 V2 ) M( NaOH)
ms
ω (Na2CO3)= c(HCl) V2 M( Na 2 CO 3 )
ms
试样为 Na2CO3 与 NaHCO3 的混合物,V1<V2 , ω (Na2CO3)= c(HCl ) V1 M ( Na 2 CO 3 )
定容 250mL锥形 瓶L 2d酚酞
记下V1
准确记录HCl体积V2 平行滴定三次
黄色变 橙色
四、数据记录
混合碱样品质量m /g :
测定时混合碱样品质量ms /g(ms=m×25/250 ):
测定序号 第一化学计量点 V1(HCl) /mL (酚酞变色) 第二化学计量点 V2 ( HCl ) (甲基橙变色)/mL V2- V1 V2+ V1 ω(Na2CO3) ω(NaOH或NaHCO3) I II III
(Na2CO3)
结果分析:
判断氢氧化钠和碳酸钠含量的等级。
总结
实验原理 操作步骤 数据记录 结果分析
ms
ω (NaHCO3)= c(HCl) (V2 V1 ) M ( NaHCO3 )
ms
三、操作步骤
1. 准确称取2克 混合碱试样 定量转移到 250.00mL容量瓶 2. 用移液管移取 25.00mL试液 HCl标液滴至 恰好红色消失 再加入2d 甲基橙
HCl 滴定
50mL蒸馏水溶 解(150mL烧杯)
引入
氢氧化钠在我们的生活生产中具有重要的应用的 作用,不同等级的氢氧化钠具有不同的用途,那 么我们就来分析一下氢氧化钠的技术指标,判断 氢氧化钠的等级。
固体氢氧化钠技术标准GB209-93
指标名称 氢氧化钠 单位 % 优质品技 一等品技 合格品技
术指标
≥96.0
术指标
≥96.0
术指标
≥95.0
(4)熟悉滴定管、容量瓶、移液管和吸量管的使
用;
(5)能记录和处理实验数据及书写实验报告
(6)能对实验结果进行评价。
ห้องสมุดไป่ตู้
一、教学目标---知识目标
(一)双指示剂法测定氢氧化钠和碳酸钠 的含量 (1)实验原理; (2)实验注意事项; (3)计算公式。
二、实验原理
双指示剂法
NaOH Na2CO3
