胎鼠脑组织 病理切片 步骤
大脑切片图(特选资料)
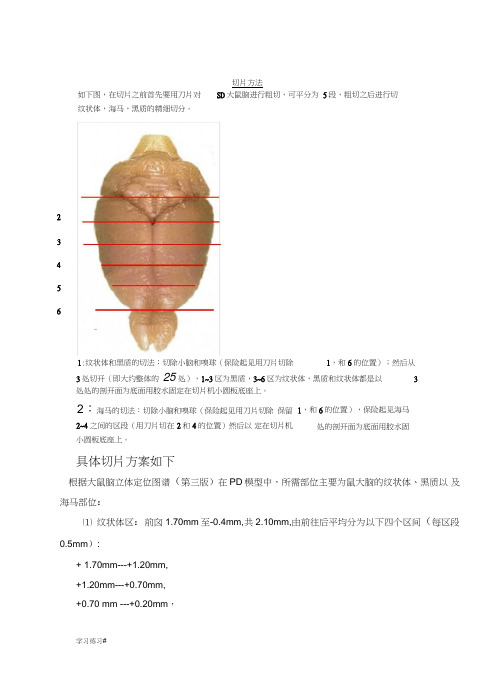
切片方法如下图,在切片之前首先要用刀片对 SD 大鼠脑进行粗切,可平分为 5段,粗切之后进行切纹状体,海马,黑质的精细切分。
3处切开(即大约整体的 25处),1~3区为黑质,3~6区为纹状体,黑质和纹状体都是以 3处处的剖开面为底面用胶水固定在切片机小圆板底座上。
2:海马的切法:切除小脑和嗅球(保险起见用刀片切除 保留2~4之间的区段(用刀片切在 2和4的位置)然后以 定在切片机小圆板底座上。
具体切片方案如下根据大鼠脑立体定位图谱(第三版)在PD 模型中,所需部位主要为鼠大脑的纹状体、黑质以 及海马部位:⑴ 纹状体区:前囟1.70mm 至-0.4mm,共2.10mm,由前往后平均分为以下四个区间(每区段 0.5mm ):+ 1.70mm---+1.20mm, +1.20mm---+0.70mm, +0.70 mm ---+0.20mm ,学习练习#1,和6的位置);然后从1,和6的位置),保险起见海马处的剖开面为底面用胶水固2 3 4 5 61:纹状体和黑质的切法:切除小脑和嗅球(保险起见用刀片切除蕊丸1乂供参肴,豆僭旋脚可测除+0.20mm ——0.40mm ,可分为四个小瓶来装片,于10ml 的棕色玻璃瓶中(内盛6ml 的0.01mM PBS,pH7.4配制 的5%多聚甲醛溶液),每个区段长度为0.50mm ,理论上可切30卩m 的脑片16张,实际保留 时至少保证12张脑片。
并从前到后标明区段1(+1.70mm-+1.20mm),区段2(+1.20mm-+0.70mm), 区段 3(+0.70mm-+0.2mm),区段 4(+0.2mm-- -0.4mm ).⑵ 黑质区:前囟-4.52mm 至-6.04mm,共1.52mm,理论上一共可切 56张30卩m 的脑片。
进入 脑区-4.16mm 后先连续切100卩m 的脑片共3片,接着切30卩m 的脑片共2张,均不保存,理论 上此时已到-4.52mm 的脑区位置。
病理组织切片的制作过程

病理组织切片的制作过程1.取材组织取材的方法是制作切片的一个重要程序,根据教学、科研及外检的具体要求取自人体(外科手术切除标本、活检标本、尸检标本)或动物,并确定取材的部位和方法。
取材者需要掌握解剖学、组织学、病理学的基本理论知识,还要掌握实际操作技术,每个组织器官的取材都有一定的部位和方法,不能任意切取组织作为制片材料,不然,无法达到教学、科研和临床诊断的目的,具体要求如下:(1)材料新鲜:取材组织愈新鲜愈好,人体组织一般在离体后,动物组织在处死后迅速固定,以保证原有的形态学结构。
(2)组织块的大小:所取组织块较理想的体积为2.0cm×2.0cm×0.3cm,以使固定液能迅速而均匀地渗入组织内部,但根据制片材料和目的不同,组织块的较理想体积也不同,如制作病理外检、科研切片,其组织块可以薄取0.1~0.2cm 即可,这样可以缩短固定脱水透明的时间,若制作教学切片厚取0.3 ~0.5cm,这样可以同一蜡块制作出较多的教学切片。
(3)勿挤压组织块: 切取组织块用的刀剪要锋利,切割时不可来回锉动。
夹取组织时切勿过紧,以免因挤压而使组织、细胞变形。
(4)规范取材部位: 要准确地按解剖部位取材,病理标本取材按照各病变部位、性质的不同,根据要求规范化取材。
(5)选好组织块的切面:根据各器官的组织结构,决定其切面的走向。
纵切或横切往往是显示组织形态结构的关键,如长管状器官以横切为好。
(6)保持材料的清洁:组织块上如有血液、污物、粘液、食物、粪便等,可用水冲洗干净后再放入固定液中。
(7)保持组织的原有形态:新鲜组织固定后,或多或少会产生收缩现象,有时甚至完全变形。
为此可将组织展平,以尽可能维持原形。
2.固定(1)小块组织固定法:这是最常用的方法,从人体或动物体取下的小块组织,须立即置入液态固定剂中进行固定,通常,标本与固定液的比例为1:4~20,但组织块不宜过大过厚,否则固定液不能迅速渗透。
鼠类标本制作参考

鼠类标本制作参考一、工具及材料:乙醚、塑料袋:用于捕获的野外鼠体表寄生虫处理。
直尺、标签、采集本、电子天平:测量及记录动物标本的名称、身体特征、性别、采集地点等。
解剖刀、解剖剪、骨剪、长镊子、小镊子、解剖盘、滑石粉:用于标本的剥皮、解剖。
针、线:用于标本皮毛的缝合。
不同粗细铁丝(或竹筷)、钢丝钳、尖嘴钳、棉花(脱脂棉和普通棉花各半):用于标本内部填充及造型。
大头针、木板(硬纸板或泡沫板):用于标本制作后的固定。
取脑勺(取铁丝一段,前端砸扁弯成勺状)、黄粉虫(面包虫)、84消毒液、烧杯、记号笔(也可用锅煮沸头骨剔除肉质):用于头骨清理。
防腐剂(砒霜防腐粉:砒霜、明矾、樟脑按2∶7∶1研成粉末混匀;硼酸防腐粉:硼酸粉、明矾粉、樟脑粉按5∶3∶2混匀即可,可代替砒霜防腐粉,较砒霜防腐粉差,但使用较安全。
)二、操作步骤:1.标本处死:对实验室饲养鼠类标本一般采用断颈处死,对于反抗比较激烈的可以先用乙醚麻醉后再进行断颈处死。
2.体表寄生虫处理:野外捕获的鼠类连同鼠布袋放入塑料袋内并倒入适量乙醚扎紧袋口,密闭十分钟后取出,收集鼠布袋上面的体表寄生虫。
3.记录:辨别鼠种类和性别,测量其体重、体长、耳长、后足长、尾长,做好记录。
按照标签内容填写采集和测量信息备用。
4.剥皮:将鼠体仰放在解剖盘上用解剖刀沿腹部正中肛门前部开始向胸骨后端切开皮肤,开口大小为略大于鼠头为宜,操作时用力不要太猛,以免将腹腔切破而污染皮毛,然后用刀背或小镊子将切口与后肢相连的皮肤与肌肉分离,将后肢分别往切口处推出,剪断膝关节并除去小腿上的肌肉,剥离背部等周围的肌肉,再把生殖器、直肠与皮肤联接处剪断,清理好尾基部周围的结缔组织,用左手捏紧尾基部,右手捏住尾椎骨缓慢往上拉,直至完全抽出,若出现体液渗出可撒上滑石粉避免污染毛皮,继续剥至前肢,在肘关节处剪断,清除肌肉再剥至头部,用解剖刀紧贴头骨至耳部,剪或切断耳根至眼部时,可看到一层白色网膜状的眼睑缘,细心切开网膜的下端后,即露出眼球了。
动物病理玻片制作方法

动物病理玻片制作方法一、引言动物病理学是研究动物疾病病因、发病机制和病理变化的学科。
在动物病理学研究中,制作病理玻片是非常重要的步骤之一。
本文将介绍动物病理玻片的制作方法。
二、材料准备制作动物病理玻片所需的材料包括:1. 动物组织标本:包括取自动物器官的组织块或细胞涂片等。
2. 石蜡:用于包埋组织标本。
3. 切片机:用于切割组织标本的切片机器。
4. 玻片:用于固定切割好的组织标本。
5. 碱性溶液:用于去除石蜡。
6. 脱水溶液:用于去除水分。
7. 染色剂:用于染色组织切片。
8. 封片剂:用于封闭组织切片。
三、制作步骤1. 组织标本固定:将取自动物器官的组织块或细胞涂片等进行固定,常用的固定剂有福尔马林和缓冲形式的乙醛等。
2. 组织标本包埋:将固定好的组织标本放入石蜡中,经过一系列的处理,使其逐渐渗透并替代组织中的水分,最终形成石蜡包埋的组织标本。
3. 组织切片:将包埋好的组织标本放入切片机中,用刀片切割成薄片,通常为4-6微米。
4. 切片处理:将切好的组织标本片放入碱性溶液中,去除石蜡。
5. 脱水处理:将去除石蜡的组织标本片放入脱水溶液中,逐渐去除水分。
6. 染色:将脱水处理后的组织标本片放入染色剂中,使其染色,常用的染色剂有血液学常用的伊红染色和组织学常用的苏木精-伊红染色等。
7. 清洗:将染色好的组织标本片放入清水中洗涤,去除多余的染色剂。
8. 封片:将清洗干净的组织标本片放入封片剂中,再放入加热的平台上,使其干燥并形成封闭的玻片。
四、注意事项1. 在制作病理玻片的过程中,要保持操作环境的清洁和无尘。
2. 切片机的刀片要保持锋利,以确保切割出的组织标本片薄而均匀。
3. 染色剂的选择要根据研究目的来确定,不同的染色剂可以突出不同组织结构和病理变化。
4. 制作玻片时,要注意标本的编号和记录,以免混淆和丢失。
5. 制作好的病理玻片要妥善保存,避免受潮和损坏。
五、结论动物病理玻片的制作是动物病理学研究中不可或缺的一环。
脑组织采集操作流程

脑组织采集操作流程概述本文档旨在提供脑组织采集的操作流程,确保实验的顺利进行。
准备工作1. 确保实验室环境整洁、无菌。
2. 准备好以下工具和材料:- 手套- 外科刀具- 确保脑组织完整的冰冻- 乙醚或异氟醚的麻醉药物操作步骤1. 麻醉动物:- 将动物置于适当的麻醉设备中。
- 使用乙醚或异氟醚等麻醉药物使动物失去知觉。
2. 杀死动物:- 确保动物已经完全麻醉。
- 使用合适的方式将动物安全地杀死。
3. 切割头皮:- 用外科刀具将动物的头部皮肤切开,暴露出颅骨。
4. 打开颅骨:- 使用外科刀具小心地在颅骨上切开一个小孔。
- 用鹦鹉嘴钳将颅骨完全开放,暴露出脑组织。
5. 采集脑组织:- 使用手套小心地将脑组织取出,并放入冰冻中。
- 确保脑组织完整,并尽量避免污染。
6. 处理采集的脑组织:- 将采集的脑组织储存到合适的中,确保冷冻保存。
- 根据后续实验的需求,可以进行进一步处理,如切片等。
清理工作1. 将使用过的刀具和其他工具进行高温高压灭菌处理。
2. 清理实验室环境,保持整洁和无菌。
注意事项:- 在进行脑组织采集实验前,需要得到合适的伦理审批,并遵守相关的法律法规。
- 操作过程中要保证自身和他人的安全,注意使用麻醉药物时的剂量和注意事项。
- 在进行切割和操作时,要小心谨慎,避免对动物和人员造成伤害。
- 采集和处理脑组织时要保持无菌条件,避免可能的污染。
以上为脑组织采集的操作流程,希望能对您有所帮助。
小鼠脑组织病理总结

冰冻切片的制作
• 取材和固定: 灌注后立即切取组织块,并 快速投入固定液中,或者处死后直接冷冻。
• 脱水和透明:梯度蔗糖 • 包埋:OCT,3%聚乙烯醇。 • 切片制作:切片 • 贴片:直接贴 • 固定:冰冻丙酮3-5分 • 保存:-20°C
灌注
0.5%戊巴比妥钠100mg/Kg麻醉小鼠,5分钟 左右小鼠麻醉好,仰卧位固定四肢,用酒 精棉球擦胸腹部毛,前开皮肤暴露胸部肌 肉层,剑突上成V型剪开胸廓,暴露心脏, 剪掉右心耳(即视野下心脏上色暗红组 织),与心尖处30°角刺入左心室,37° 左右生理盐水约10ml缓慢注入,冲净血液 止,换4%多聚甲醛溶液(4°预冷),1020分钟,鼠僵硬为好。
切片
• 石蜡:冷水——温水(54°-56°)—— 烤片(80°) 切好烤片后可以室温保存。
• 冰冻:切片温度-18°—-20° 直接贴 切好于冰冻丙酮中固定5分后-20° 保存。
固定方法注意事项
1.组织块大小2cmx2cmx0.5cm 2.组织标本应及时放入固定液中,切忌干涸 3.组织固定后必须冲洗,除去多余的固定液 4.一般固定剂温度以室温,某些病毒则须低温
• 苏木素:
• 100g硫酸铝钾加热溶于1250ml水中 • 5g苏木素精粉末溶于100ml无水乙醇中
• 溶解后硫酸铝钾稍凉,加入醇溶苏木素煮沸 20-30分,加入g氧化汞煮沸2分钟,
注意事项
• 安全 • 解剖位置 • 液体配制 • 染色时间 • 原因查找
Thank you!
脱水和透明,浸蜡
• 石蜡切片:75%,80%,85%,90%,95% (2个),无水乙醇(2)中每个4小时-过夜, 正丁醇1-2天。二甲苯(2个)20-30分钟。 三个蜡,每个大于2小时。
动物病理解剖学实验教程

动物病理解剖学实验教程动物病理解剖学实验教程是动物医学专业中一门重要的实践课程,旨在通过实验操作,加深学生对动物病理学的理解,提高其病理诊断能力。
以下是一些常见的动物病理解剖学实验教程:1. 实验一:动物病理切片的制作与观察实验目的:通过制作动物病理切片,观察病变部位的组织学变化,学习病理学的基本概念和诊断方法。
实验材料:动物病理组织块、显微镜、切片刀、染色剂等。
实验步骤:(1)将病理组织块放入包埋盒中,用石蜡或树脂等材料进行包埋。
(2)将包埋好的组织块进行切片,制作成病理切片。
(3)将切片放在显微镜下观察,记录病变部位的组织学变化。
(4)对病变部位进行病理诊断,并与正常组织进行对比分析。
2. 实验二:动物尸体剖检与病理诊断实验目的:通过动物尸体剖检,观察动物内脏器官的病理变化,学习病理诊断的方法和技巧。
实验材料:动物尸体、手术刀、手套、器官固定液等。
实验步骤:(1)进行动物尸体剖检前的准备工作,如穿戴手套等。
(2)按照规定的剖检程序,对动物内脏器官进行观察和检查。
(3)记录内脏器官的病理变化,并进行病理诊断。
(4)对病变器官进行组织取样,制作成病理切片,进一步观察病变。
3. 实验三:肿瘤的病理诊断与鉴别实验目的:通过观察动物肿瘤的病理切片,学习肿瘤的分类、分级和鉴别诊断方法。
实验材料:动物肿瘤病理切片、显微镜、染色剂等。
实验步骤:(1)将肿瘤病理切片放在显微镜下观察,记录肿瘤的组织学特征。
(2)根据肿瘤的组织学特征,对肿瘤进行分类和分级。
(3)学习不同类型肿瘤的鉴别诊断方法,对比正常组织与肿瘤组织的差异。
4. 实验四:呼吸系统病理诊断实验目的:通过观察动物呼吸系统的病理变化,学习呼吸系统疾病的诊断方法和技巧。
实验材料:动物呼吸系统病理切片、显微镜、染色剂等。
实验步骤:(1)将呼吸系统病理切片放在显微镜下观察,记录病变部位的组织学变化。
(2)学习呼吸系统疾病的诊断标准和方法,如肺炎、支气管炎等。
取小鼠脑组织

丁香园上面总结的方法,排版有点乱。
其实过程与大鼠近似,我的经验是:1.?材料准备;大剪刀、眼科剪、眼科镊、大镊子、滤纸、竹签等;2.?步骤:处死小鼠,取头颅;剪开皮肤,漏出颅骨;用大尖镊子夹住两侧眼眶,用眼科剪稍剪除颅骨中线;再用眼科镊夹住颅骨从内向外夹,从下向上逐步去除颅骨;当全脑露出时,再用眼科镊去除脑膜和血管;然后用竹签从嗅球处向下取出全脑,即可。
3.?注意事项:用力轻柔,否则容易弄破脑部;用剪刀剪颅骨时,一定要贴壁向上剪,否则容易剪破脑部;去除脑膜时,不能硬拉,否则容易弄破大脑;取出全脑时应把头顶朝下,用竹签轻轻取出,离桌面也不要太远、高;若留病理,建议一定要取完整无损的大脑。
做免疫组化的话,稍微麻烦一点儿,因为脑组织含水量多,要固定的好,就需要先灌注。
先麻醉小鼠剪开胸腔,找到心脏,从心尖入针,剪开右心耳先用生理盐水灌注直到从心耳流出来的水清亮了再改用固定液(一般是4%多聚甲醛)灌注至小鼠四肢僵硬小鼠只需要用注射器就行了,我做的25~35g的小鼠一般用50mLNS+30mL多聚甲醛。
具体步骤:常规麻醉小鼠,将其固定,用剪刀剪开胸部皮肤,暴露出皮下组织,剪开时注意钝性分离,以免误伤。
然后用镊子提起剑突,用剪刀剪开胸腔,剪断两侧肋骨,暴露整个胸腔,小心误伤肺及心脏、大血管。
用镊子撕开心包膜,暴露心脏,用眼科剪剪开右心耳,然后提起心尖将准备好的生理盐水注射器插入左心室,注射,注射时小心针头滑脱。
生理盐水灌流至肺和肝的颜色都变成灰白色即可。
然后用多聚甲醛灌流,针孔最好是同一个,多聚灌流时小鼠四肢会抽搐,待抽搐结束,小鼠僵硬即可。
取下小鼠,用剪刀在颈部离断头颅,用剪刀在小鼠头颅中间皮肤剪一刀,将两边皮肤向下翻用手捏住,暴露整个颅骨,用眼科剪从脊髓端插入椎孔,沿着颅正中线剪开颅骨,注意剪刀向上翘一些,以免误伤脑组织,剪开后用弯眼科镊分离颅骨,小心分离,直至暴露整个大脑,然后用弯镊伸入颅底离断颅底神经,就可以取出整个脑子了。
小鼠脑组织冰冻切片步骤

小鼠脑组织冰冻切片步骤
嘿,朋友们!今天咱就来讲讲小鼠脑组织冰冻切片那些事儿!这可是个技术活儿呢!
首先啊,你得把小鼠那小脑袋准备好呀。
就像厨师要准备好食材才能做出美味佳肴一样,咱得把小鼠的脑组织小心地取出来。
这可不是随随便便就能搞定的,得轻点儿、柔点儿,别把脑组织给弄坏喽。
然后呢,把脑组织放到专门的冰冻模具里。
这就好比给脑组织找了个小窝,让它舒舒服服地待着。
接下来,把模具放进液氮里速冻,那速度,可快啦,就像闪电一样!
速冻好了,就该切片啦!这就像是在给脑组织做造型呢,不过可得小心别切坏了。
切片机就像是个神奇的魔法工具,能把脑组织切成薄薄的一片片。
想象一下,那薄得像纸一样的切片,多神奇呀!
切好片后,把它们放到载玻片上。
这就像是给这些小切片找到了它们的舞台,准备开始它们的表演啦。
然后再进行一些处理,让这些切片能更好地展示出它们的秘密。
在这个过程中,每一步都得细心细心再细心,就像走钢丝一样,不能有一点儿马虎。
要是不小心出了差错,那可就前功尽弃啦!你说是不是?
哎呀,这小鼠脑组织冰冻切片可真是个有趣又有挑战的活儿呀!每一步都充满了奥秘和技巧。
只有用心去做,才能做出漂亮的切片,才能更好地去研究那些隐藏在脑组织里的秘密。
所以呀,朋友们,要是你们也对这个感兴趣,可得好好记住这些步骤,大胆地去尝试哦!相信你们一定能做出让自己满意的切片,去探索那些神奇的科学世界!这可不是开玩笑的哟,这是实实在在的技术活呢!加油吧!。
病理切片的流程

病理切片的流程病理切片是一种常用的医学检查方法,它通过将组织样本切割成极薄的切片,然后染色和显微镜观察,以帮助医生诊断疾病。
下面将详细描述病理切片的流程步骤和流程。
1. 样本获取首先需要从患者身上获取组织样本。
常见的样本来源包括手术切除物、活检、穿刺等。
手术切除物通常是大块的组织,活检则是小块或细针抽吸得到的组织。
2. 样本固定获取到样本后,需要立即进行固定处理,以防止组织腐败和变形。
最常用的固定剂是10%中性缓冲福尔马林(neutral buffered formalin),它可以使组织保持形态和结构不变,并能够杀灭病原体。
将样本完全浸泡在足够量的福尔马林溶液中,并确保其充分渗透进入组织内部。
通常需要固定24小时以上,以确保固定效果达到最佳。
3. 组织处理在固定完成后,需要对样本进行一系列的组织处理步骤,以使其适合切片。
3.1 去水脱脂福尔马林会使组织中的水分增加,因此需要将其去除。
首先将样本从福尔马林中取出,然后放入含有逐渐浓度乙醇的溶液中进行脱水。
常用的脱水级别是70%、80%、95%和100%乙醇。
每个浓度的乙醇溶液中浸泡时间一般为30分钟至1小时。
脱水过程中要轻轻摇晃容器,以确保组织均匀浸泡。
3.2 渗透剂处理在去水脱脂之后,需要将样本置于渗透剂中。
渗透剂通常是芳香烃类物质(如苯),可以与石蜡相互溶解。
渗透剂的作用是将石蜡渗入组织内部,以增加刚性和硬度。
将样本转移到含有石蜡和渗透剂混合物的容器中,并在恒温槽中加热慢慢进行渗透。
通常需要至少3个小时,以确保组织充分渗透。
3.3 石蜡浸渍渗透剂处理完成后,需要将样本浸泡在纯石蜡中,使其充分浸润。
将样本转移到含有熔融石蜡的容器中,并在恒温槽中加热慢慢进行浸渍。
通常需要至少2个小时,以确保组织完全浸润。
此外,还可以使用自动化的石蜡浸渍机来加快浸润过程。
4. 组织包埋组织处理完成后,需要将其包埋到切片所需的形状和大小。
包埋是将组织样本固定在切片机上的过程。
如何制作鼠脑切片,并进行免疫荧光组织化学染色?

如何制作鼠脑切片,并进行免疫荧光组织化学染色?1.组织准备1) 灌注固定:用 100 mg/kg的戊巴比妥溶液腹膜腔注射,使动物深度麻醉;同用心脏灌注的方法,将动物的心脏完全暴露,将灌注的尖针插入动物的左心室,先用约20 ml 的生理盐水冲去体内血液,而后用含 4%(w/v)多聚甲醛的 0.1 M PB 溶液 50 ml 进行灌注固定;2) 取材、后固定、脱水:去除颅骨后将小鼠全脑完整取出,放入上述 4%的多聚甲醛固定液中后固定,4℃后固定 6 -24h,而后将脑组织浸泡于 30%蔗糖溶液中,4℃至组织沉底(72 h左右);3) 包埋切片:分别将脑组织用 OCT 包埋后,用恒冷箱切片机做冠状切片,片厚为40 μm,放入 0.01 M PBS 中,漂洗 3 次后进行后续的组织化学染色。
2. 免疫荧光组织化学染色1) 封闭非特异性抗原:将上述漂洗后的切片用含 1% 山羊血清0.01 M PBS 室温下孵育封闭 40min-1 h;2) 孵育一抗:将封闭后的切片直接放入用抗体稀释液稀释的一抗混合液中,4°摇床孵育过夜;3) 孵育二抗:孵育完一抗的切片用 0.01 M PBS 漂洗后,移入二抗混合液中;室温下孵育 2-5 小时(避光);4) 孵育 FITC 结合的 avidin:最后一组切片用 0.01 M PBS 漂洗后,加入用 0.01 M PBS 稀释的 FITC 结合的 avidin(1: 1, 000),室温下孵育 2 小时;如果抗体带荧光,省略该步骤。
5) 裱片、封片:步骤 3)和步骤 4)中的切片用 0.01 M PBS 漂洗后,在避光环境下裱到干净的载玻片上,晾干后用上述的含抗淬灭剂的荧光封片剂封片(如果抗体带荧光则使用普通载玻片),4℃避光保存。
6)显微镜观察。
小鼠vta脑区取材方法

小鼠vta脑区取材方法小鼠VTA脑区取材方法简介脑区取材是研究神经科学中至关重要的步骤之一。
而小鼠VTA(腹侧被盖区)是一个具有重要生理功能的脑区,因此其取材方法尤为重要。
本文将详细介绍几种常用的小鼠VTA脑区取材方法。
方法一:冰冻切片法1.准备工具和材料:小鼠脑,乙醇,刀片,冰冻剂(如乙脑)。
2.将小鼠的脑取出并迅速冷冻。
3.利用刀片将冷冻的小鼠脑切片,切得越薄越好。
4.将切片收集起来放入乙醇中浸泡,以去除残留的冰冻剂。
5.制备好的小鼠VTA脑区切片即可用于后续研究。
方法二:脑电图指导法1.准备工具和材料:小鼠,脑电图仪器,电极。
2.将小鼠进行麻醉操作,将电极植入小鼠脑内。
3.进行脑电图记录,根据脑电图上的信号变化找到VTA脑区的位置。
4.通过电极位置引导,取出VTA脑区样本。
方法三:免疫组织化学法1.准备工具和材料:小鼠脑,加权剂,抗体。
2.将小鼠的脑取出并固定在福尔马林中。
3.进行脱水、透明化等处理,以使脑组织适合免疫组织化学操作。
4.制备适当浓度的抗体,对小鼠脑组织进行免疫染色,以标记VTA脑区。
5.根据免疫染色结果,准确取出VTA脑区进行后续实验。
方法四:多色荧光染色法1.准备工具和材料:小鼠脑,荧光染料。
2.将小鼠的脑取出并固定在福尔马林中。
3.进行脱水、透明化等处理,使脑组织适合染色。
4.制备多种荧光染料的混合液,对小鼠脑组织进行染色,以区分VTA脑区。
5.利用荧光显微镜观察染色结果,准确定位并取出VTA脑区。
方法五:遗传学标记法1.准备工具和材料:转基因小鼠。
2.鉴定具有特定遗传学标记的小鼠品系,如tdTomato表达转基因小鼠。
3.麻醉小鼠,取出脑组织。
4.根据遗传学标记的特异性,轻松找到VTA脑区,取出样本。
总结本文介绍了几种常用的小鼠VTA脑区取材方法,包括冰冻切片法、脑电图指导法、免疫组织化学法、多色荧光染色法和遗传学标记法。
选择合适的方法取样,对于研究VTA脑区的生理功能具有重要意义。
大鼠脑冰冻切片

我做大鼠脑冰冻切片的程序如下,没有出现碎裂和冰晶。
(1)麻醉,开胸,经主动脉关注0.9%的生理盐水(主动脉可用丝线或动脉夹固定针头),待心脏鼓起时剪开右心耳,灌注到经右心耳流出液清澈为止。
(2)前固定:灌注4%多聚甲醛(用0.1M PB配置),先快后慢,开始会出现四肢抽搐,直到肝脏变硬,灌注量约300 ml,时间30-40 min。
(3)取脑,后固定在4%多聚甲醛过夜。
(4)脱水:30%蔗糖溶液(用0.1M PB配置)脱水层底,最多可放置1周。
(5)冰冻切片:先从液氮罐中取出适量液氮放在保温杯中,将脑用OCT包埋在探头上,探头用绳子固定好,放进保温杯中保持15s后取出,但不要将脑浸入液氮中,以防止碎裂。
(6)取出探头放入冰冻切片机机箱内平衡(-26度)1小时后开始切片。
描述大鼠剥取脑组织的步骤操作要点,注意事项

描述大鼠剥取脑组织的步骤操作要点,注意事项大鼠剥取脑组织是一项非常重要的实验操作,需要严格按照步骤进行,以保证实验结果的准确性。
下面是描述大鼠剥取脑组织的步骤操作要点和注意事项:
步骤操作要点:
1. 麻醉大鼠:使用适当的麻醉剂将大鼠麻醉,注意麻醉剂的剂量和作用时间,以免对实验结果产生影响。
2. 体表消毒:在开始操作之前,对大鼠的手术部位进行消毒,以避免感染。
3. 穿刺颅骨:使用适当的工具在大鼠头部穿刺颅骨,以便进行脑组织的剥离。
4. 剥离脑组织:使用适当的工具将脑组织分离出来,注意不要损伤脑组织,以保证实验结果的准确性。
5. 存储脑组织:在完成剥离后,将脑组织存储在适当的容器中,以便进行后续实验操作。
注意事项:
1. 需要遵守实验室安全规定,穿戴适当的个人防护用品,如手套、口罩等。
2. 在操作过程中,需要保持手术部位的清洁,并注意避免感染。
3. 在麻醉大鼠时,需要根据大鼠的体重和生理状态确定适当的麻醉剂剂量,并在麻醉过程中监测大鼠的生命体征,如呼吸、心率等。
4. 在剥离脑组织时,需要使用适当的工具,并注意不要损伤脑
组织。
5. 在存储脑组织时,需要选择适当的容器,并注意储存条件,如温度、湿度等。
临床试验病理切片流程

临床试验病理切片流程一、样本采集。
这可是个挺关键的开头呢。
就像是一场奇妙旅行的起点。
医生或者研究人员得小心翼翼地从患者或者实验对象那儿获取组织样本。
这个过程得特别精准,就像从花丛里采一朵花,还不能把旁边的花给弄伤了。
比如说要是从肿瘤患者身上取组织,那可就得找对地方,取到能代表病变情况的那块组织。
而且这个采集的工具啊,也都是经过精心挑选的,要保证干净、卫生,不能把外界的脏东西带进去,就像你出门不能把泥巴带到干净的屋子里一样。
二、样本固定。
采好样本啦,接着就得把样本固定住。
这就好比给小昆虫做标本一样,让它保持住原来的样子。
一般会用到福尔马林之类的固定液。
把样本泡在里面,这样就能防止组织腐败、变形啦。
这个过程也得注意浓度和时间哦。
要是浓度不对或者泡的时间太长太短,都可能影响到后面的结果。
就像做菜放盐,多了少了都不好吃。
三、样本处理。
固定好之后,就到处理样本这一步啦。
这时候就像是给样本做个小改造。
要把样本切成合适的大小,方便后面的操作。
这个切割可不能马虎,得像艺术家雕刻作品一样精细。
切完之后呢,还得把样本脱水。
想象一下把样本里的水分像挤海绵里的水一样慢慢弄出来,不过这个过程得用专业的试剂,一步一步来,不能太着急。
脱水之后还要进行透明化处理,让样本变得像玻璃一样透明,这样在显微镜下观察的时候才能看得更清楚呢。
四、包埋。
样本处理好了,就该包埋啦。
这就像是给样本做个小房子。
把样本放到石蜡里,让石蜡把样本包裹起来。
这个过程得保证样本在石蜡里的位置合适,就像你把小玩具放在盒子里,要放得正正的。
而且石蜡的温度啊,也得控制好,太热了可能会把样本弄坏,太冷了又包不好。
五、切片制作。
包埋完了就开始切片啦。
这可是个技术活呢。
就像切面包一样,不过这个面包可娇贵多啦。
要用专门的切片机,把包埋好的样本切成很薄很薄的片子。
这个片子的厚度那是相当有讲究的,太薄了可能会破掉,太厚了又看不清楚。
切好的片子就像一片片小雪花,又薄又精致。
六、染色。
制作鼠组织石蜡切片方法的探讨

目录
01 鼠组织石蜡切片制作 方法的探讨
03 二、切片方法
02
一、鼠组织采集和处 理
04 三、切片工艺流程
目录
05 四、包埋剂和染色方 法
07 六、结论
06 五、质量控制
鼠组织石蜡切片制作方法的探讨
在生物医学研究中,对动物组织进行石蜡切片制作是一项非常重要的技术。石 蜡切片制作主要包括取材、处理、脱水、包埋、切片、染色等步骤,对于诊断 疾病、研究病理过程以及探讨治疗方法等具有重要意义。本次演示以鼠组织为 例,详细探讨石蜡切片的制作方法。
1、切片外观应完整、平滑、无 皱褶和气泡。
2、切片结构应清晰,组织形态保存完好,无过度收缩或扩张。
3、细胞形态应正常,无凋亡和坏死现象,细胞核和细胞质应界限分明。
为了达到以上标准,需要注意以下几点:
1、取材时要选择新鲜、健康的组织,避免使用腐败或变性的组织。
2、固定液的选择和固定时间要适宜,以便更好地保存组织形态和结构。
三、切片工艺流程
1、烘焙:将固定好的组织进行烘焙,以使组织内的水分蒸发,同时使石蜡渗 透到组织中。
2、固定:将烘焙后的组织放入脱水缸中,进行第一次脱水。然后将其移入包 埋剂中,进行第二次脱水。
3、脱水:将组织从包埋剂中取出,放入脱水缸中脱水,以去除组织内的水分。
4、包埋:将脱水后的组织置于模具中,倒入融化的石蜡,冷却凝固后取出。
3、脱水过程中要逐步降低组织的湿度,以避免组织变形和皱褶的产生。
4、包埋时要将组织放置在正确的位置,避免组织的移位和变形。
5、切片时要注意刀具的锋利程度和切片的厚度,以获得更优质的切片。
6、染色时要选择合适的染色液和染色时间,以便更好地显示组织的病理变化。
不同胎龄小鼠全胚切片标本的制做与观察

不同胎龄小鼠全胚切片标本的制做与观察
刘小蓉;安靓;李进
【期刊名称】《解剖科学进展》
【年(卷),期】2004(10)B08
【摘要】材料与方法:一级达标的昆明小鼠,体重26—34克。
动情期确认,外阴部暗红色,充血,阴道口开放,阴道涂片可见大量无核角化上皮细胞。
雄性与雌性小鼠以1:2或1:1合笼,次晨8时检查阴栓或精子涂片,确定是否怀孕。
阴栓观察法:出现阴栓即可认为是妊娠第一天,亦即胎龄的第0天。
阴栓是雄、雌性小鼠交配后精液与阴道分泌物凝结而成,一般在交配后数分钟即能出现,
【总页数】1页(P62-62)
【关键词】胎龄;雌性小鼠;观察;外阴部;阴道口;标本;阴道涂片;交配;动情期;雄性【作者】刘小蓉;安靓;李进
【作者单位】第一军医大学组胚教研室,广州510515
【正文语种】中文
【中图分类】Q959;R722
【相关文献】
1.不同胎龄小鼠胎肝干细胞的性状比较★ [J], 吴必刚;常静;张晓刚
2.不同胎龄小鼠胎肝干细胞的性状比较 [J], 吴必刚;常静;张晓刚;
3.不同胚龄大鼠胚胎组织切片制作体会 [J], 杨世明; 汪薇曦; 李宏莲; 贺军; 李和
4.不同胎龄的适于胎龄儿和小于胎龄儿及其孕母血游离氨基酸水平 [J], 冯泽康;肖
昕;李着算;万忠和
5.小鼠不同胎龄全胚切片标本的制作与观察 [J], 刘小蓉;安靓;李进
因版权原因,仅展示原文概要,查看原文内容请购买。
大小鼠剖检标准操作规程

大小鼠剖检标准操作规程目的:本标准描述实验人员进行大小鼠脏器采集的操作规程。
适用范围:适用于大小鼠尸检操作。
职责:第一负责人负责监督、管理;规程:1.用镊子夹住眼球根部将其摘出,检查结膜、视网膜。
2.沿环枕关节横断颈部,使头颈分离,再去掉头盖骨,用镊子提起脑膜,用剪刀剪开,检查颅腔液体数量、颜色、透明度等情况。
用镊子钝性剥离大脑与周围的连结,然后将大脑从颅腔内取出。
3.取出垂体,检查有无肿大、充血。
4.动物取背卧位,使其四肢摊开,剥去下颌部和颈部皮肤,取出淋巴结和唾液腺。
5.沿腹部正中线切开剑突至肛门之间的腹前壁,再沿最低位肋骨分别向左右两侧切开侧腹壁至脊柱两旁,完全暴露腹腔器官。
观察有无积液、血液和炎性渗出物。
6.用镊子夹住胸骨剑状突,剪断横膈膜与胸骨的连接,然后提起胸骨,在靠近胸椎基部,剪断左右胸壁的肋骨,将整个胸壁取下。
7.分离出淡黄色的一对胸腺。
8.分离出心脏。
9.用镊子夹住气管向上提起,剪断心脏与胸膜的连结韧带,将肺脏取出。
10.将下颌骨的两下颌支内侧与舌连结的肌肉剪断,将咽、喉、气管、食道与周围组织分离一并取出。
11.在腹腔左侧可见到红色的脾脏,一手用镊子将脾脏提起,一手持剪刀剪断韧带,采出脾脏。
12.胰脏靠近胃大弯和十二指肠,可将胰脏连同周围的脂肪组织一同取出,浸入10%甲醛溶液中,数秒后胰脏变硬成灰白色,脂肪不变色,此时可剔除脂肪。
13.用镊子提起胃贲门部,切断靠近贲门的食道,一边牵拉,一边切断周围韧带,使胃同周围组织分离,然后按着十二指肠、空肠、回肠、盲肠、结肠、直肠的顺序,切断这些肠管的肠系膜根部,将胃肠从腹腔内采出,动作要轻,以免拉断肠管。
14.一手提起动物让其直立,使肝脏自然下垂,切断肝脏周围的血管和韧带,使其自然滑落。
15.用镊子剥离肾上腺周围的脂肪,将肾上腺取出。
16.用镊子剥离肾脏周围的脂肪,将肾脏采出。
17.采出膀胱和生殖器。
18.骨盆腔脏器采出先切离直肠与盆腔上壁的结缔组织,雌性动物还要切离子宫与卵巢,再由骨盆腔下壁切离膀胱颈、阴道及生殖腺,最后将肛门、阴门作圆形切离,即可取出骨盆腔脏器。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胎鼠脑组织病理切片步骤引言概述:
胎鼠脑组织病理切片是一项重要的实验技术,用于研究胎儿发育过程中的神经系统疾病。
通过对胎鼠脑组织进行病理切片,可以观察和分析组织的形态结构、细胞组织学和病理学变化,为研究胎儿神经系统疾病提供重要的依据。
本文将从胎鼠脑组织病理切片的步骤、技术要点、切片染色、显微镜观察和结果分析等方面进行详细阐述。
正文内容:
1. 步骤
1.1. 选取合适的胎鼠
在进行胎鼠脑组织病理切片前,首先需要选择合适的胎鼠。
一般选择胎龄较大的胎鼠,以确保其神经系统已经发育到一定程度。
1.2. 组织固定
将选取的胎鼠脑组织进行固定处理,常用的固定剂包括10%的中性缓冲福尔马林和4%的聚乙烯醇。
固定时间一般为24-48小时,以确保组织充分固定。
1.3. 组织处理
固定后的胎鼠脑组织需要进行脱水、透明化和浸渍等处理。
脱水处理常用乙醇梯度浓度,透明化处理常用甘油和二甲苯等溶剂。
1.4. 切片制备
将经过处理的胎鼠脑组织进行切片制备。
常用的方法有冰冻切片和石蜡包埋切片两种,选择合适的方法根据实验需要和设备条件来决定。
1.5. 切片染色
制备好的切片需要进行染色处理,以增强组织结构的对比度。
常用的染色方法有血液学染色、组织学染色和免疫组织化学染色等。
2. 技术要点
2.1. 切片厚度
胎鼠脑组织切片的厚度一般为4-6μm,厚度的选择需要根据实验需求和显微镜的分辨率来决定。
2.2. 切片方向
切片方向的选择也十分重要,一般选择垂直于组织结构的方向进行切片,以获得更准确的组织形态信息。
2.3. 切片保存
制备好的切片需要进行保存,常用的方法是将切片放置在玻片上,用封片剂密封,然后存放在干燥、阴凉的地方。
3. 切片染色
3.1. 血液学染色
血液学染色常用于观察胎鼠脑组织中的血管结构和血细胞情况,常用的染色剂有伊红染色和苏木精染色。
3.2. 组织学染色
组织学染色可以观察组织细胞的形态和结构,常用的染色剂有苏木精-伊红染色和伊红-胚胎红染色。
3.3. 免疫组织化学染色
免疫组织化学染色可以检测特定蛋白质的表达情况,常用的染色方法有免疫组织化学染色和免疫荧光染色。
4. 显微镜观察
制备好的切片需要使用显微镜进行观察和拍摄。
通过显微镜观察,可以获得切片中组织结构和细胞学变化的详细信息。
5. 结果分析
在观察和拍摄完胎鼠脑组织切片后,需要对结果进行分析。
根据切片染色的结果,可以进一步研究胎儿神经系统疾病的发生机制和病理变化。
总结:
胎鼠脑组织病理切片是研究胎儿神经系统疾病的重要手段。
通过严格的步骤和技术要点,结合适当的切片染色和显微镜观察,可以获得准确的组织学和病理学信息。
对于研究胎儿神经系统疾病的机制和治疗方法具有重要的意义。
