第一章 溶液(2011.9)
初中化学《溶液》课件

目录
• 溶液的组成 • 溶液的性质 • 溶液的分类 • 溶液的应用 • 实验:物质在水中溶解的实验 • 练习与巩固
01 溶液的组成
溶液的定义
总结词ቤተ መጻሕፍቲ ባይዱ
明确溶液的基本概念
详细描述
溶液是一种物质分散于另一种物质中形成的均一、稳定的混合物。其中被分散 的物质称为溶质,而分散的物质称为溶剂。
结果
通过实验观察,记录物质溶解的过程和现象,得出溶解度、溶解平衡和结晶现象的相关 结论。
讨论
分析实验结果,探讨不同物质在水中的溶解能力差异,理解溶解度的概念及其影响因素 ,讨论溶解平衡和结晶现象在实际生产和生活中的应用。
06 练习与巩固
选择题
选择题1: 下列关于溶液的说法正确的是
溶液一定是无色的。
计算题2
将50毫升酒精与50毫升水混合,求所得溶液的体积 。
谢谢聆听
4. 记录实验现象
记录物质溶解的时间、温度变 化、溶液的颜色和透明度等。
1. 准备实验材料
选择适当的物质(如食盐、糖 、硫酸铜等)和蒸馏水。
3. 进行实验操作
将一定量的物质加入烧杯中, 加入适量的蒸馏水,用玻璃棒 搅拌,观察物质溶解的过程。
5. 实验后处理
清洗实验器具,整理实验材料 。
实验结果与讨论
VS
详细描述
溶液的稳定性取决于溶质和溶剂之间的相 互作用。在稳定的溶液中,溶质颗粒不会 与溶剂发生化学反应,也不会自行分解或 沉淀。这种稳定性使得溶液可以在一定时 间内保持其性质和特点。
溶液的酸碱度
总结词
溶液的酸碱度是指溶液中氢离子浓度的度量,用来表示溶液酸碱性的强弱。
详细描述
酸碱度通常用pH值来表示,范围从0到14。pH值越低,酸性越强;pH值越高,碱性越强。了解溶液 的酸碱度对于化学反应和实验操作非常重要,因为许多化学反应和实验需要在特定的酸碱度条件下进 行。
大学基础化学 第一章 溶液 PPT课件

(IUPAC建议用饱和溶液的浓度cb表示溶解度Sb,
单位为mol⋅dm-3)。
相似相容规则 (Like Dissolves Like)
一种溶质在某种溶剂中的溶解度是否有办法 来预测?
到目前为止还没有建立普遍的理论。只能凭 经验性的规则近似预测溶解度的相对大小。
常见的经验规则是相似相容规则: 溶质与溶剂分子间结构、分子极性相似则溶
气态溶液 空气
溶质为固体
根据溶质状态不同
液态溶液
椐溶质粒子大小 胶体溶液 d =1~100nm
粗分散系 d>100nm
第一节 溶解 dissolution
溶解过程是一种特殊的物理化学过程。
溶液形成的过程总伴随着能量变化、体积变化, 有时还有颜色变化。
奥斯瓦尔德把这类性质命名为“依数性”。
气体或容易挥发的液体可用理想气体方程 求摩尔质量。而难挥发的液体或固体可从其稀 溶液的依数性测定摩尔质量。
蒸气压 Vapor pressure
在一定温度下,当液体与其蒸气达到液、气两相 平衡时,液面上方的蒸气称为饱和蒸气,饱和蒸气所 产生的压强称为该温度下液体的饱和蒸气压,简称蒸 气压。
整个过程是放热还是吸热,体积是缩小还是增 大,受这两个因素制约。
饱和溶液与溶解度
saturated solution and solubility
溶解过程也是一个双向的动态平衡过程。 达到平衡时,与溶质固体共存的溶液叫饱和溶液。 在一定温度与压力下,一定量饱和溶液中溶质的含
量叫溶解度。 习惯上常用100g溶剂所能溶解溶质的最大克数表
比较
物质的量浓度 cB
cB
nB V (L)
单位: mol·L-1 , mmol·L-1
七年级下册第一章溶液知识点

七年级下册第一章溶液知识点七年级下册第一章:溶液知识点一、什么是溶液?在化学中,当固体溶解在液体中或气体溶解在液体中时,就会形成溶液。
其中,固体或气体被溶解的物质称为溶质,溶解溶质的液体称为溶剂。
例如,在水中加入食盐,形成的就是食盐水溶液。
在这个例子中,食盐是溶质,水是溶剂,食盐水溶液则是由溶质和溶剂组成的混合物。
二、怎样描述溶液?在描述溶液时,我们需要了解以下几个概念:1.浓度浓度指的是溶质在溶剂中的质量比例或浓度比例。
假设我们有一个100克的食盐水溶液,其中含有20克的食盐,那么这个溶液的浓度就是20%。
其中,在化学中,常用的浓度单位有以下几种:·百分比(mass percent, %):溶质质量占溶液总质量的百分比。
·每升(per liter, mol/L or M):溶质的摩尔数与溶液体积之比。
·饱和度(saturation, S):溶液中已溶质的摩尔数与该溶质最大可溶性的摩尔数之比。
2.溶解度溶解度指的是在特定的温度和压力下,某种溶质在溶剂中溶解的最大量。
例如,在常温常压下,氧气的溶解度约为0.0004mol/L,这意味着每升水中最多只能溶解0.0004mol的氧气。
3.饱和溶液饱和溶液指的是在特定温度和压力下,溶剂中已经溶解了最大量的溶质的溶液。
如果向这样的溶液中再加入一些溶质,就不会再被溶解,而会沉淀出来。
三、溶解度的影响因素溶解度受到以下几个因素的影响:1.温度对于大多数固体溶质来说,随着温度的升高,溶解度也会增加。
但对于气体溶质来说,情况则相反。
例如,饱和食盐水溶液的溶解度约为360g/L,而在80℃时,饱和食盐水溶液的溶解度可以达到470g/L。
2.压力对于气体溶质来说,随着压力的升高,溶解度也会增加。
例如,空气中的氧气是一种气体溶质。
在高山上,氧气分压较低,人体吸入氧气的量也会减少,这就会造成氧气不足的情况。
3.溶质之间的相互作用对于某些溶质来说,其溶解度受到溶质之间相互作用的影响。
九年级化学第一章溶液

九年级化学第一单元《溶液》知识点一、溶液的形成1、溶液(1)溶液的概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物,叫做溶液。
(2)溶液的基本特征:均一性、稳定性的混合物注意:a、溶液不一定无色,如CuSO4为蓝色 FeSO4为浅绿色 Fe2(SO4)3为黄色b、溶质可以是固体、液体或气体;水是最常用的溶剂c、溶液的质量 = 溶质的质量 + 溶剂的质量溶液的体积≠溶质的体积 + 溶剂的体积d、溶液的名称:溶质的溶剂溶液(如:碘酒——碘的酒精溶液)固体、气体溶于液体,液体为溶剂2、溶质和溶剂的判断有水,水为溶剂液体溶于液体无水,量多的为溶剂(1)概念:在溶液中被溶解的物质是溶质,能溶解其他物质的物质是溶剂。
3、饱和溶液、不饱和溶液(1)概念:饱和溶液,是指在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时所得的溶液。
不饱和溶液,是指在一定温度下,向一定量溶剂里加入某种溶质,还能继续溶解的溶液。
(2)判断方法:看有无不溶物或继续加入该溶质,看能否溶解(3)饱和溶液和不饱和溶液之间的转化注:①Ca(OH)2②最可靠的方法是:加溶质、蒸发溶剂(4)浓、稀溶液与饱和不饱和溶液之间的关系①饱和溶液不一定是浓溶液②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液③在一定温度时,同一种溶质的饱和溶液一定要比它的不饱和溶液浓(5)溶解时放热、吸热现象溶解吸热:如NH4NO3溶解溶解放热:如NaOH溶解、浓H2SO4溶解溶解没有明显热现象:如NaCl二、溶解度1、固体的溶解度(1)溶解度定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:单位:克(2)溶解度的含义:20℃时NaCl的溶液度为36g含义:在20℃时,在100克水中最多能溶解36克NaCl或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类)②温度大多数固体物的溶解度随温度升高而升高;如KNO3少数固体物质的溶解度受温度的影响很小;如NaCl极少数物质溶解度随温度升高而降低。
【北京大学】《分析化学》第一章-溶液

0.500mol L1
bB
nB mA
0.500mol 0.975kg
0.513mol kg 1
北京大学
《分析化学》
【例1-2】将8.0gNaOH溶解在180g水中配成溶
液, 求该溶液中NaOH和H2O的摩尔分数。
nNaOH
8.0g 40g mol1
0.20mol
nH2O
18
180g g mol
北京大学
《分析化学》
cB
nB V
1000ml 1.84g ml1 0.980 98g mol1 1.00L
18.4mol L1
98g
bB
nB mA
(100g
98g mol 1 98g) 103 kg g 1
5.00 102 mol kg 1
98g
xH2SO4
nH2SO4
n n H2SO4
《分析化学》
第一章 溶 液
北京大学
《分析化学》
本章教学要求
1.掌握关于溶液的基本概念:分散系、物质的量及其单位、 摩尔质量、溶液的浓度、溶解度与相似相溶原理。 2.理解非电解质稀溶液的依数性; 3.初步掌握溶液依数性在实际工作中的应用; 4.了解渗透压在生物医学上的应用。
北京大学
《分析化学》
一、概述
溶质:
北京大学
《分析化学》
四: 溶液及其浓度的表示方法
(一)质量摩尔浓度
= bB
nB mA
SI单位:mol·kg-1
特别要注意的是:指每1kg溶剂中含溶质的物质的量.
(二)物质的量浓度
cB =
nB V
SI单位:mol·L-1
北京大学
《分析化学》
第一章 溶液

例1 0.2mol/L氢氧化钠溶液的质量浓 度是多少?
例2 临床上用的生理盐水的质量 浓度 ρ ( NaCl ) =9g/L ,其物质的 量浓度是多少?
课堂练习:
1. 浓硫酸的质量分数为98%,密 度为1.84 kg/L,计算浓硫酸的 质量浓度和物质的量浓度。
H SO 1.84 98%1000 1800(g/L)
第三节
稀溶液的依数性
溶液的性质通常取决于溶质的性质,如溶液的密度、颜色、气味、导 电性等都与溶质的性质有关。但是溶液有些性质与溶质的本性无关, 而与溶质本性无关的性质称为溶液的依数性。 溶液的依数性只有在溶液很稀时才有规律,溶液浓度越小,其依数性 的规律越强。 溶液的依数性有蒸汽压下降、沸点升高、凝固点下降和渗透压。
相:体系中物理性质和化学性质完全相同的均匀部分。 相与相间有明显的界面。 均相体系:只含有一个相的体系。 非均相体系:含有两个或多个相的体系。
例如纯水、食盐水等体系中都只含有一个相,均属单 相体系;而冰、水、水蒸气共存的体系属多相体系。
基本概念
分散系:一种或几种物质分散在另一种物质中所得 到的体系。 分散相:被分散的物质。 分散介质:容纳分散相的物质。
表示方法
2. 体积分数:溶液中溶质B的体积(VB)除以溶液的体积 B 或 (B)表示。 (V)。用符号
VB B V
式中VB和V的单位相同,体积分数可用小数或百 分数表示,药学上常用符号%(ml/ml)表示。
课堂练习:
溶液中蔗糖的质量分数是多少?
表示方法
1. 将60.0克庶糖溶于水,配制成500克蔗糖溶液,此
500ml NaOH溶液,求此溶液的物质的量浓度。
nNaOH
初中化学溶液一章全 ppt课件

80 70
A
60
50
40
B
30
20
C
10 P
0 20 40 60 80 100
温 度 / ℃47
5、把温度从80℃降 低到20℃,有溶液 变为不饱和的是 ______有晶体析出 的是_____,溶液质 量减少的是____
6、把温度从80℃ 降低到20℃,等质 量的AB饱和溶液析 出晶体的质量比较 多的是__
思考:
1、横坐标60,纵坐标110 的交点 表示什么意义?
100
硝
90
酸
80
钾
2、40℃时氯化铵的溶解度为_4_4_g__, 70℃时氯化铵的溶解度为_6__0_g_。
70
氯化铵
70℃时氯化钾的溶解度为_4_6_g_。
60
氯化钾
50
40
氯化钠
30
20
硼酸
10
42
0 10 20 30 40 50 60 70 80 90 100 温度/℃
100
硝
90
酸
钾
讨论:
80 70
固体物质溶解度受
60 50
氯化铵 氯化钾
温度变化影响情况:
40
氯化钠
30
20
硼酸
10
41
0 10 20 30 40 50 60 70 80 90 100 温度/℃
/g
200
溶
解 190 度 180
硝 酸
170
铵
160 150
140
130
120
110
硝 酸 钠
A.
固体的溶解度曲线:
(2)同一物质在不同 温度时的溶解度是 不同的;
初中化学《溶液》 PPT课件 图文

知识精要
• 结晶是溶液中的溶质形成晶体的过程. 从溶液中结晶析出晶体的方法主要有: ①蒸发溶剂法——— 适用于溶解度受温度影响较
小的固体溶质.如蒸发海水获得食盐晶体。 ②冷却热饱和溶液法——— 适用于溶解度受温度
影响较大的固体溶质.如冷却热的硝酸钾饱和 溶液获得硝酸钾晶体.
注意:①固体溶质结晶后往往还需要过滤来取得
知识精要
4、气体物质的溶解度 气体物体溶解度是指该气体在压强为101kPa, 一定温度时溶解在1体积水里达到饱和状态时的 气体体积.
规律 气体的溶解度与温度和压强有关,随 温度升高而减小,随压强增大而增大
知识精要
• 三.混合物的分离 把混合物里的几种物质分开,得到较纯净的物 质,叫做混合物的分离 过滤和结晶是常用的混合物分离的方法
(5)溶解度的表示方法 ————溶解 度随温度变化有两种表示方法: ①列表法;②溶解度曲线。
3、溶解度曲线
(1)溶解度曲线的意义 :
同一种物质在不同温度时的溶解度;不同物 质在同一温度时的溶解度,交点温度下两种 物质的溶解度相等;可以确定从饱和溶液中 析出晶体或进行混合物分离提纯的方法;能 进行有关的计算.
溶液的稀释、配制、混合问题
抓住溶质相等列等式
稀释前溶质质量 稀释后溶质质量
配制前溶质质量 = 配制后溶质质量
混合前溶质质量
混合后溶质质量
关键是记住溶
质的表示方法 M质=M液A%=Vρ ×A%
谢谢! 学妹给我打电话,说她又换工作了,这次是销售。电话里,她絮絮叨叨说着一年多来工作上的不如意,她说工作一点都不开心,找不到半点成就感。 末了,她问我:学姐,为什么想 找一份 自己热 爱的工 作这么 难呢? 我问她上一份工作干了多久,她 说不到 三个月 ,做的 还是行 政助理 的工作 ,
《溶液》 讲义

《溶液》讲义一、溶液的定义在化学的世界里,溶液是一种非常重要的混合物。
简单来说,溶液是由一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。
这里的“均一”指的是溶液中各部分的组成和性质完全相同。
比如,一杯糖水,无论你从杯子的哪个部位品尝,甜度都是一样的。
而“稳定”则表示在外界条件不变(如温度、压强等)的情况下,溶质不会从溶液中分离出来。
二、溶液的组成溶液由溶质和溶剂两部分组成。
溶质是被溶解的物质,溶剂则是能溶解其他物质的物质。
例如,在盐水溶液中,盐是溶质,水就是溶剂。
溶质可以是固体、液体或气体。
当溶质和溶剂都是液体时,通常把量多的一种称为溶剂,量少的一种称为溶质。
三、溶液的分类1、按照溶质在溶剂中的溶解性,溶液可以分为饱和溶液和不饱和溶液。
饱和溶液是指在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液。
而不饱和溶液则是在同样条件下,溶质还能继续溶解的溶液。
2、按照溶液中溶质的状态,溶液可以分为固溶体、液溶体和气溶体。
固溶体常见的如合金,液溶体如酒精溶液,气溶体像空气(可以看作是氧气、氮气等气体在其他气体中的溶液)。
四、影响溶液溶解性的因素1、温度一般来说,大多数固体溶质的溶解度随温度的升高而增大。
例如硝酸钾,在温度升高时,能够溶解更多的硝酸钾。
但也有少数固体溶质的溶解度受温度影响不大,比如氯化钠。
而气体溶质的溶解度通常随温度的升高而减小。
2、压强对于气体溶质,压强越大,溶解度越大。
比如,打开碳酸饮料瓶时,压强减小,二氧化碳气体的溶解度降低,从而冒出大量气泡。
3、溶剂的性质不同的溶剂对同一溶质的溶解性可能不同。
例如,碘在水中的溶解度较小,但在酒精中的溶解度较大。
五、溶液的浓度溶液的浓度是表示溶液中溶质含量多少的物理量,常用的表示方法有质量分数、物质的量浓度等。
1、质量分数质量分数是溶质质量与溶液质量之比,通常用百分数表示。
计算公式为:溶质质量分数=溶质质量÷溶液质量× 100% 。
第一节 溶液
5、溶液中只有一种溶质。X 6、一杯食盐水下部比上部咸。X
7、溶液一定是均一、稳定的。√
8、凡是均一、稳定的液体都是溶液。X 9、溶液中只有固体可以做溶质。X 10、溶液中只有水可以做溶剂。X
• 蔗糖的溶解过程
氯化钠的溶解过程
一、溶 液
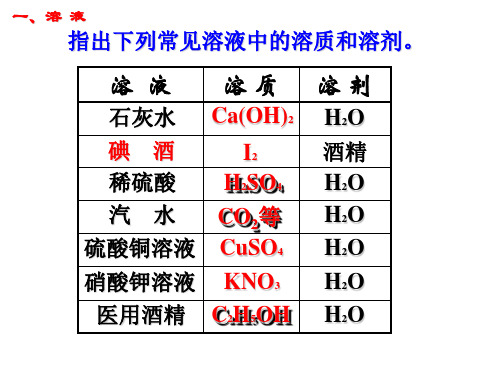
指出下列常见溶液中的溶质和溶剂。
溶 液 溶质
石灰水 Ca(OH)2碘酒 稀酸I2 H2SO4汽 水 CO2等 硫酸铜溶液 CuSO4
硝酸钾溶液 KNO3
医用酒精 C2H5OH
溶剂
H2O 酒精 H2O H2O H2O H2O H2O
判断:
1.溶液是无色的液体。 2.冰水混合体是溶液。 3.把食盐溶液倒掉一半后,变稀了。 4.在温度不变,水不蒸发的条件下 ,蔗糖溶液中的蔗糖会从水中分离 出来。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、通常所说的“溶液浓度”实际上是指溶液的 “物质的量浓度”。
二.质量浓度(ρ B)
1. 定义:ρ B=mB/V 2. 常用单位:g·L-1 ;mg·L-1 ; μ g·L-1 3. cB和ρ B的关系:ρ B=cB·MB
注意:临床上用固体物质配制的溶液常用质量浓度表示。 如:9 g·L-1生理盐水
0.3mol/LC6H12O6 Π 2 (i=1) 则 Π 1=2 Π 2
例:1L溶液中含5.0g的马血红素,在298K 时测得溶液的渗透压为1.8102Pa,求马血 红素的相对分子量。
三. 渗透压在医学上的意义
(一) 渗透浓度Cos(osmotic concentration)
定义:是指溶液中渗透活性物质的质点(分子、离 子)的总浓度。
应用
在临床生化检验中,凡是相对分子质量已知 的物质在人体的组成量度,原则上均应用物质的 量浓度表示;对于相对分子质量尚未准确测得的 物质,则可用质量浓度表示。
对于注射液,世界卫生组织认为,在绝 大多数情况下,标签上应同时标明质量浓度 ρ B和物质的量浓度cB。
如:静脉注射的氯化钠溶液,应同时标明
实验2:将正常红细胞置入1.5%NaCl溶液
在1.5%NaCl溶液中的红细 胞逐渐皱缩,医学上称胞浆 分离。
实验2结论
这一现象的产生: 是由于1.5%NaCl溶液的渗透压大于红细胞内
液,为高渗溶液,红细胞内液的水分子便自发地透 出膜外而引起的。
实验3:将正常红细胞置入0.9%NaCl溶液
只有在0.9%NaCl中红细胞,既 不胀大,也不缩小,形态保持 正常。
仅约为 4 kPa。
晶体渗透压 胶体渗透压
产生根源
压力大小及 原因
生理功能
低分子晶体物质: NaCl、NaHCO3、 葡萄糖、氨基酸等
高分子胶体物质: 蛋白质、核酸等
大(759.9 ~ 767kPa); 小(2.9~4.0kPa);
ρ B小(7.5g/L); ic大→π 大
ρ B小(70g/L); ic小→π 小
用符号“Cos”表示 医学上的单位:
渗量·升-1Osmol/L 毫渗量·升-1 mOsmol/L 渗透浓度实际上反映了溶液的渗透压的大小。
例题1:
求50g/L葡萄糖溶液的渗透浓度( mOsmol/L )
例题2:
求9.0g/LNaCl溶液的渗透浓度( mOsmol/L )
(二)等渗、高渗、低渗溶液
1、定义
B
VB V
2、单位为1,或用百分数表示。
例:取750ml乙醇加水配成1000ml医用消毒酒 精溶液,计算此酒精溶液中酒精的体积分数。
五、分子浓度(CB)
1、定义: CB=NB/V 2、常用单位:L-1
医学上常用分子浓度来表示体液中细胞的含量。
浓度相互换算
各种浓度表示法有各自的特点,从各种浓度的基本定义 出发,可进行各种浓度的相互换算。 溶液浓度的换算只是单位的变换,而溶质的量和溶液的 量均未改变。
当两种非电解质溶液的c不同时,c大,它的Π就大
计算电解质溶液的渗透压
由于电解质分子在溶液中发生电离产生离子, 使溶液中粒子的数目成倍增加,用Π=cRT计算电 解质溶液的渗透压将会产生较大的误差。
为了消除误差,必需引入一个校正系数i
渗透压公式改写为: Π=icRT
i-校正因子
------是溶质的一个分子在溶液中能产生的粒子数 例如:0.3mol/LNaCl Π 1(i=2)
渗透现象的结果与方向
结果:缩小膜两侧的浓度差。 方向:溶剂(水)分子从纯溶剂向溶液渗透或
从稀溶液向浓溶液中渗透。
渗透现象产生的原因
∵单位体积内纯溶剂中的溶剂分子数目 大于溶液中的溶剂分子数目
∴在单位时间内,由纯溶剂通过半透膜 进入溶液中的溶剂分子比由溶液进入纯溶剂 中的溶剂分子多。
液面升高
渗透压
ρ (NaCl)=9 g·L-1,c(NaCl)=0.154 mol·L1。
第二节 溶液的渗透压
一.渗透现象和渗透压
渗透现象:由溶剂(水)分子通过半 透膜,由纯溶剂进入溶液(或由稀溶液 进入浓溶液)的自发过程。
渗透现象
渗透现象产生的条件
(1)半透膜的存在;
(2)半透膜两侧的溶液浓度不相等,即 膜两侧的溶液存在浓度差;
临床上常用的等渗溶液
1、生理盐水(0.154mol·L-1或9.0g·L-1NaCl溶 液),毫渗透量浓度为308mOsm·L-1。
2、0.278mol·L-1或50g·L-1葡萄糖溶液,亳渗量 溶液浓度为278mOsm·L-1(近似于 280mOsm·L-1)。
3、0.149mol·L-1或12.5g·L-1碳酸氢钠溶液,毫 渗透量浓度为298mOsm·L-1
(三) 晶体渗透压和胶体渗透压
血浆中的渗透压力分为晶体渗透压和胶体渗透压两种。 由小分子和小离子所产生的渗透压力称为晶体渗透压力。 由大分子和大离子所产生的渗透压力称为胶体渗透压力。
ቤተ መጻሕፍቲ ባይዱ
血浆的渗透压力主要是晶体渗透压力,而胶体渗透压力很
小。在 37℃ 时,血浆的渗透压力为 770 kPa,其中胶体渗透压
例:100ml正常人的血清中含有10.0mgCa2+离子, 计算正常人血清中Ca2+离子的物质的量浓度?
解:已知 M=40g/mol
mB
10.0
cB
nB V
M V
40.01000 2.50103 100
1000
例:在100ml生理盐水中含有0.90gNaCl,计算 生理盐水的质量浓度。
医学上是以人血浆的渗透浓度为标准来衡量: 正常血浆的渗透压约为280-320mmol/L
临床上规定 渗透压在280-320mmol/L范围内的溶液为等渗溶液 大于320mmol/L的溶液为高渗溶液 小于280mmol/L的溶液为低渗溶液
思考
1、为什么用9.0 g/L NaCl 溶液作为补液? 2、等渗溶液有哪些?
如果大量饮水或输入过多的葡萄糖溶液(葡萄 糖在体内氧化成二氧化碳和水),又会造成细胞外 液晶体渗透压力减小,细胞外液的水分子进入细胞 内液,使细胞肿胀,严重时可引起水中毒。
因此,晶体渗透压力对维持细胞内、外水的相 对平衡起着重要作用。
临床上治疗方案:常使用小分子晶体物质的溶液来 纠正某些疾病所引起的水盐失调。
第一章 溶液
第一节 溶液浓度的表示方法 第二节 溶液的渗透压
溶液是由溶质和溶剂两部分组成的分散 系统。
没有溶液,也就没有生命。
第一节 溶液浓度的表示方法
溶液的稀或浓,常用其浓度来表示。 溶液的浓度:在一定量溶液或溶剂中所含
溶质的量。
医学上常用的表示方法
物质的量浓度(cB) 质量浓度(ρ B) 质量分数(ωB) 体积分数( B ) 分子浓度(CB)
•以红细胞在不同浓度的NaCl溶液中的形态变化实验 来说明。
实验1:将正常红细胞置入0.5%NaCl溶液
溶液中的红细胞逐渐胀大, 直至破裂,血红蛋白释放出, 使溶液变红,医学上称为溶 血现象。
实验1结论:
这一现象的产生: 是由于0.5%NaCl溶液的渗透压小于红细胞内
液,为低渗溶液,0.5%NaCl中的水分子便透过红 细胞膜,不断进入红细胞内而造成的。
实验3结论
这是因为0.9%NaCl溶液(生理盐水)和红细胞 内液的渗透压相等,为等渗溶液,细胞膜内、外液 体处于渗透平衡状态的缘故
红细胞在不同浓度NaCl溶液中的形态示意图
例:血红细胞置在下列哪个溶液中,将会引起 溶血(细胞破裂)现象( )
A. 9.0 g/L NaCl
B. 90.0 g/L NaCl C. 50.0 g/L 葡萄糖 D. 生理盐水的10倍稀释液 E. 100.0 g/L 葡萄糖溶液
(1)定义 恰能阻止渗透现象继续发生而达到动态平衡时的压力
称为渗透压力,用符号Π表示。
(2)单位 kPa或Pa
(3)渗透平衡(了解) 随着溶液液面的升高,静水压增加,溶液中的溶剂
分子透过半透膜进入纯溶剂中的速度加快,当单位时间 内半透膜两侧透过的溶剂分子数相等时,液面不再升高, 此时体系达到了渗透平衡。
Π=cRT的重要意义
在一定温度下,溶液的渗透压与溶液的浓度成正比;
即Π与溶液中溶质的数目成正比,而与溶质的本性无关;
不论溶质微粒是小分子或大分子,只要溶液中溶质粒子 的数目相等,则渗透压就相同。
Π=cRT适用范围
特别指出: Π=cRT只适用于非电解质稀溶液
如:0.3mol/L葡萄糖溶液与0.3mol/L蔗糖溶液, 其Π相同。
1885年被选为荷兰皇家科学院成员。
1886年,范霍夫根据实验数据提出范霍夫定律—— 渗透压与溶液的浓度和温度成正比,它的比例常数 就是气体状态方程式中的常数R。
由Π=cRT可知:
1、稀溶液的渗透压与溶质及溶剂的种类无关
2、在一定温度下,溶液的渗透压与它的浓度 成正比。 Π c
3、在一定浓度下,溶液的渗透压与绝对温度 成正比。 Π T
范托夫(Jacobus Henricus Van 't Hoff ,1852-1911)
范托夫,荷兰化学家,由于“发现了溶液中
的化学动力学法则和渗透压规律以及对立体 化学和化学平衡理论作出的贡献”,成为第 一位诺贝尔化学奖的获得者(1901年)。
1875年发表了《空间化学》一文,提出分子的空间 立体结构的假说,首创“不对称碳原子”概念,以 及碳的正四面体构型假说(又称范霍夫—勒·贝尔模 型),即一个碳原子连接四个不同的原子或基团,初 步解决了物质的旋光性与结构的关系。
调节细胞间液和细胞 调节细胞间液与血浆 内液之间的水分转移 之间的水分转移
