最新氧化还原反应高考真题及解析
高三化学氧化还原反应试题答案及解析

高三化学氧化还原反应试题答案及解析1.(14分)2013年6月,我国“蛟龙”号再次刷新“中国深度”——下潜7062米,为我国深海矿物资源的开发奠定了基础。
海洋深处有丰富的锰结核矿,锰结核的主要成分是MnO2,同时还含有黄铜矿。
Ⅰ、“蛟龙”号外壳是用特殊的钛合金材料制成,它可以在7000m的深海中承受重压,Ti是以钛白粉(TiO2)为原料进行生产,钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。
TiO2+发生水解的离子方程式为____________________________。
Ⅱ、MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如下图所示:(1)步骤Ⅱ中以NaClO3为氧化剂,当生成0.05molMnO2时,消耗0.1mol/L的NaClO3溶液200ml,该反应离子方程式为_______________________________。
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是____________。
Ⅲ、利用黄铜矿炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)可制备Fe2O3,方法为:(A)用过量的稀盐酸浸取炉渣、过滤;(B)向滤液中加入5%的H2O2,再向其中加入过量的NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得到Fe2O3。
根据以上信息回答下列问题:(1)(B)中向滤液中加入5%的H2O2,其目的是_________________________________。
(2)设计实验证明炉渣中含有FeO___________________________________________。
(3)将煅烧得到的Fe2O3还原为Fe单质,再将质量为m g的Fe单质分成相等的四份,分别与50mL、100mL、150mL、200mL的等浓度的稀硝酸反应,反应产物NO在标况下的体积见附表:②写出实验②发生反应的化学方程式:_____________________________。
高三化学有关氧化还原反应的的计算试题答案及解析

高三化学有关氧化还原反应的的计算试题答案及解析1.在100ml含等物质的量的HBr和H2SO3的溶液中通入0.025molCl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。
则原溶液中HBr和H2SO3的浓度都等于A.0.16mol/L B.0.02mol/L C.0.20mol/L D.0.25mol/L【答案】C【解析】根据溴能氧化亚硫酸可知,溴离子的还原性比亚硫酸根离子弱,所以氯气先与亚硫酸反应,设原溶液中HBr和H2SO3的物质的量都是nmol,则失去电子的物质的量是2n+n/2=5n/2mol,得到电子的物质的量是0.025mol×2=0.05mol,所以5n/2=0.05,n=0.02,所以原溶液中HBr和H2SO3的浓度都等于0.02mol/0.1L=0.2mol/L,答案选C。
【考点】考查氧化还原反应的计算2.做实验时不小心粘了一些高锰酸钾,皮肤上的斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:关于此反应的叙述正确的是()A.该反应的氧化剂是C2O42-B.该反应右边方框内的产物是OH-C.该反应中生成1molCO2电子转移数总是5NAD.配平该反应式后,H+的系数是16【答案】D【解析】A、该反应中Mn元素的化合价降低,所以高锰酸根离子作氧化剂,错误;B、溶液中有锰离子存在,所以方框内的产物不能是氢氧根离子,而是水,错误;C、该反应中C元素的化合价升高1价,所以生成1mol二氧化碳时转移电子的数目是NA,错误;D、根据氧化还原反应的配平原则,MnO4-的系数是2,C2O42-的系数是5,CO2的系数是10,根据电荷守恒可知,H+的系数是16,正确,答案选D。
【考点】考查对氧化还原反应的分析,产物的判断,方程式的配平3.Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。
一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是A.Na2O2只作氧化剂B.Na2FeO4既是氧化产物又是还原产物C.O2是还原产物D.2 mol FeSO4发生反应时,反应中共有8 mol电子转移【答案】B【解析】在反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中,Na2O2中的O化合价部分升高变为O2,部分降低变为Na2FeO4,所以Na2O2既作氧化剂,也作还原剂,而FeSO4中的Fe元素的化合价升高,失去电子,被氧化为Na2FeO4,所以FeSO4作还原剂,Na2FeO4既是氧化产物又是还原产物,O2是氧化产物。
高考化学真题专题解析—氧化还原反应

高考化学真题专题解析—氧化还原反应【母题来源】2022年北京卷【母题题文】某MOFs 的多孔材料刚好可将24N O “固定”,实现了2NO 与24N O 分离并制备3HNO ,如图所示:己知:2242NO (g)N O (g)ΔH<0下列说法不正确...的是 A .气体温度升高后,不利于24N O 的固定B .24N O 被固定后,平衡正移,有利于2NO 的去除C .制备3HNO 的原理为:242232N O O 2H O=4HNO ++D .每制备30.4mol HNO ,转移电子数约为226.0210⨯ 【答案】D 【试题解析】A .二氧化氮转化为四氧化二氮的反应为放热反应,升高温度,平衡向逆反应方向移动,四氧化二氮的浓度减小,所以气体温度升高后,不利于四氧化二氮的固定,故A 正确;B .四氧化二氮被固定后,四氧化二氮的浓度减小,二氧化氮转化为四氧化二氮的平衡向正反应方向移动,二氧化氮的浓度减小,所以四氧化二氮被固定后,有利于二氧化氮的去除,故B 正确;C .由题意可知,被固定后的四氧化二氮与氧气和水反应生成硝酸,反应的化学方程式为242232N O O 2H O=4HNO ++,故C 正确;D .四氧化二氮转化为硝酸时,生成1mol 硝酸,反应转移1mol 电子,则每制备0.4mol 硝酸,转移电子数约为0.4mol×6.02×1023=2.408×1023,故D 错误; 故选D 。
【命题意图】本题以氧化还原反应有关判断为基础,考查氧化还原反应的基本概念、氧化还原反应的判断及相关计算。
旨在考查学生获取信息的能力去解决实际问题的能力,有利于培养学生的逻辑思维能力。
考查了学生对知识理解、综合运用能力,对氧化还原反应概念和规律的掌握运用情况。
是一道基础性试题,能较好的考查学生的能力。
【命题方向】该考点为高中化学的常考点,试题的考查形式主要有两种,一种是通过氧化还原反应规律确定产物,另一种是通过氧化还原反应确定某物质含量。
氧化还原反应高考真题精选及解析

氧化还原反应1.高温下焙烧CuFeS2的反应之一为: 2CuFeS2+7O2CuSO4+CuO+Fe2O3 +3SO2下列关于该反应的叙述正确的是()A. CuFeS2中硫的化合价为-1B. CuFeS2发生还原反应C. 1 mol CuFeS2完全反应转移13 mol电子D. CuSO4和SO2既是氧化产物, 又是还原产物[答案] D[解析]CuFeS2中Cu为+2价, Fe为+2价, S为-2价, A选项错误; CuFeS2中S、Fe化合价都升高, 发生氧化反应, B选项错误; 1 mol CuFeS2完全反应转移14 mol电子, C选项错误; D正确。
2.三氟化氮(NF3) 在微电子工业中有重要用途, 可由氨气和氟气反应得到, 它在潮湿的空气中与水蒸气反应的产物有HF、NO和HNO3。
下列说法错误的是()A. 原子半径: N> FB. 在与水蒸气反应中, NF3既是氧化剂又是还原剂C. 若NF3泄漏, 可用石灰水喷淋的方法减少污染D. 在潮湿空气中反应, 被氧化与被还原的元素的物质的量之比为2∶1[答案] D[解析]原子半径: N> F, A正确; 三氟化氮与水蒸气反应生成HF、NO和HNO3, 三氟化氮中氮元素为+3价, 部分N元素化合价升高转化为HNO3, 部分N元素化合价降低转化为NO, 所以NF3既是氧化剂又是还原剂, B正确; 石灰水可除去HF、HNO3, 所以若NF3泄漏, 可用石灰水喷淋的方法减少污染, C正确; 根据化合价升高总数和降低总数相等, 可得被氧化与被还原的元素的物质的量之比为1∶2, D错误。
3.已知: ①Na3N+3H2O3NaOH+NH3↑, ②NaH+H2O NaOH+H2↑。
下列叙述正确的是()A. 离子半径: Na+> > H+B. 反应①和②都是氧化还原反应C. 反应②每生成1 mol H2, 转移的电子数为N AD. Na3N和NaH与盐酸反应都只生成一种盐[答案] C[解析]离子半径: N3-> Na+> H+, A不正确; 反应①中元素的化合价均未变化, 不是氧化还原反应, B不正确; 根据反应①可知Na3N与盐酸反应生成氯化钠和氯化铵两种盐, D不正确。
氧化还原反应高考专题训练(详解版)

A.KClO3 是氧化剂 B.被氧化与被还原的氯元素的质量比为 5:1 C.H2SO4 既不是氧化剂又不是还原剂 D.1mol KClO3 参加反应时有 10mol 电子转移 答案:D 【解析】
C.原电池放电过程中,负极质量一定减轻,正极的质量一定增加 D.由于 Ksp(MgCO3)<Ksp[Mg(OH)2],因此水垢中 MgCO3 会逐渐转化为 Mg(OH)2 答案:A 【解析】 试题分析:A 项,该反应气体体积增加,是熵增加反应,即 ΔS>0,而 ΔG=ΔH-T·ΔS,故 该反应 ΔG<0,能自发进行;B项用 H2O2 效果好,更加经济环保;C项,原电池放电 过程中,负极质量不一定减轻,如铅蓄电池,质量要增加,正极的质量也不一定增加, 如铜锌原电池,质量不增加;D项,不同类型难溶电解质的 Ksp 不能比较其溶解度的大小, 故该项不正确。 考点:氧化还原反应,原电池,难溶电解质的溶解平衡 点评:本题属于综合性的题目,考查了氧化还原反应自发进行的条件,海带提取碘,原 电池正负极质量前后变化,难溶电解质的溶解平衡等,难度较大。 8..下列变化需要加入氧化剂才能实现的是
A. N2O
B. NO
C. NO2
D. N2O5
答案:B
【解析】氮气是还原产物,CO2 是氧化产物。根据得失的得失守恒可知,生成 1mol 氮气, 转移 4mol 电子,所以平均 1 个氮原子得到 2 个电子,因此氧化物中氮元素的化合价是+
2 价,选项 B 正确,答案选 B。
3..氢化钙中的氢元素为-1 价,它可用作生氢剂,反应的化学方程式是:
氧化还原反应高考真题及解析

氧化还原真题及模拟1.高温下焙烧CuFeS2的反应之一为: 2CuFeS2+7O2CuSO4+CuO+Fe2O3 +3SO2下列关于该反应的叙述正确的是()A. CuFeS2中硫的化合价为-1B. CuFeS2发生还原反应C. 1 mol CuFeS2完全反应转移13 mol电子D. CuSO4和SO2既是氧化产物, 又是还原产物[答案] D[解析]CuFeS2中Cu为+2价, Fe为+2价, S为-2价, A选项错误; CuFeS2中S、Fe化合价都升高, 发生氧化反应, B选项错误; 1 mol CuFeS2完全反应转移14 mol电子, C选项错误; D正确。
2.三氟化氮(NF3) 在微电子工业中有重要用途, 可由氨气和氟气反应得到, 它在潮湿的空气中与水蒸气反应的产物有HF、NO和HNO3。
下列说法错误的是()A. 原子半径: N> FB. 在与水蒸气反应中, NF3既是氧化剂又是还原剂C. 若NF3泄漏, 可用石灰水喷淋的方法减少污染D. 在潮湿空气中反应, 被氧化与被还原的元素的物质的量之比为2∶1[答案] D[解析]原子半径: N> F, A正确; 三氟化氮与水蒸气反应生成HF、NO和HNO3, 三氟化氮中氮元素为+3价, 部分N元素化合价升高转化为HNO3, 部分N元素化合价降低转化为NO, 所以NF3既是氧化剂又是还原剂, B正确; 石灰水可除去HF、HNO3, 所以若NF3泄漏, 可用石灰水喷淋的方法减少污染, C正确; 根据化合价升高总数和降低总数相等, 可得被氧化与被还原的元素的物质的量之比为1∶2, D错误。
3.已知: ①Na3N+3H2O3NaOH+NH3↑, ②NaH+H2O NaOH+H2↑。
下列叙述正确的是()A. 离子半径: Na+> > H+B. 反应①和②都是氧化还原反应C. 反应②每生成1 mol H2, 转移的电子数为N AD. Na3N和NaH与盐酸反应都只生成一种盐[答案] C[解析]离子半径: N3-> Na+> H+, A不正确; 反应①中元素的化合价均未变化, 不是氧化还原反应, B不正确; 根据反应①可知Na3N与盐酸反应生成氯化钠和氯化铵两种盐, D不正确。
2025高考新题速递之氧化还原反应(9月)

2025高考新题速递之氧化还原反应(9月)一.选择题(共25小题)1.(2024•桃城区校级开学)爆炸盐(2Na2CO3•3H2O2)是一种日常生活中的无机盐,白色粉末,易溶于水,遇水后迅速分解产生氧气和水。
它可以用作洗涤助剂、漂白剂和园艺用品。
下列有关爆炸盐的说法正确的是()A.漂白原理与SO2相同B.溶于水后所得溶液呈中性,该反应为氧化还原反应C.0.1mol爆炸盐与足量的酸性高锰酸钾溶液反应生成标准状况下11.2L气体D.可与硫、磷等在同一个药品柜中存放2.(2024秋•罗湖区校级月考)PtF6是极强的氧化剂,用Xe和PtF6可制备六氟合铂酸氙[XeF]+[Pt2F11]﹣,制备方式如图所示。
下列说法错误的是()A.六氟合铂酸氙是离子化合物B.六氟合铂酸氙中Xe元素的化合价为+2价C.上述制备过程的催化剂是F﹣和D.上述制备过程中属于氧化还原反应的有②③3.(2024•安徽模拟)雌黄(As2S3)和雄黄(As4S4)都是自然界中常见的砷化物,中国自古有“信口雌黄”、“雄黄入药”之说。
早期曾用作绘画颜料,因有抗病毒疗效也用来入药。
砷元素有+2、+3 两种常见价态。
一定条件下,雌黄和雄黄的转化关系如图所示。
下列说法错误的是()A.反应Ⅰ中Sn4+为氧化产物B.反应Ⅰ中As2S3和Sn2+恰好完全反应时,其物质的量a之比为2:1C.若反应Ⅱ中转移电子0.7mol,则生成0.1mol SO2D.反应Ⅲ和Ⅳ均属于非氧化还原反应4.(2023秋•宝安区月考)FeSO4可用于制备一种新型、多功能绿色水处理剂高铁酸钠(Na2FeO4),主要反应:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列说法不正确的是()A.Na2FeO4具有强氧化性,能杀菌消毒B.该反应中,还原剂是FeSO4和Na2O2C.由上述反应可得,Na2O2的氧化性比Na2FeO4的强D.上述反应中,理论上若有4mol电子发生转移,可生成1mol Na2FeO45.(2024•浙江开学)发蓝工艺是一种材料保护技术,钢铁零件经历如图转化进行发蓝处理,已知NaNO2的还原产物为NH3。
全国高考化学氧化还原反应的综合高考真题汇总及答案解析

全国高考化学氧化还原反应的综合高考真题汇总及答案解析一、高中化学氧化还原反应1.224Na S O (连二亚硫酸钠)是易溶于水,不溶于甲醇的白色固体,在空气中极易被氧化,是一种还原性漂白剂。
制取224Na S O 的方法很多,(1)在碱性溶液中用4NaBH 还原3NaHSO 法制备224Na S O 的反应原理为:3222244NaBH NaHSO NaOH Na S O NaBO H O ++→++(未配平)反应装置如图所示:①实验开始及整个过程中均需通入2N ,其目的是__________________________________。
②制备过程中温度需控制在10~45℃,采用水浴加热的主要优点是______________________。
③为使3NaHSO 尽可能完全被还原,加入三口烧瓶中的反应液,应控制()()34n NaHSO n NaBH ______________。
(2)用HCOONa 还原2SO 制备224Na S O 的装置(夹持加热仪器略)如下:①装置a 烧瓶中发生反应的化学方程式为_________________________________。
②装置b 用于净化2SO ,适宜的试剂是______________________________。
③装置c 在70~83℃生成224Na S O 并析出,同时逸出2CO ,该反应的化学方程式为________________________,加入3CH OH 的目的是________________________;利用反应后的浊液分离提纯224Na S O 需经过的操作为_____________________________________________________。
【答案】排出装置内空气,使反应在无氧状况下进行 使反应液均匀受热 小于8:1(或<8) 2322Na SO 2HCl 2NaCl H O SO +=++↑ 饱和3NaHSO 溶液223224222HCOONa 4SO Na CO 2Na S O H O 3CO ++=++ 降低224Na S O 的溶解度 过滤、洗涤、重结晶、过滤、干燥【解析】【分析】(1)①224Na S O 在空气中极易被氧化,通入2N 其目的是排出装置内空气;②采用水浴加热的主要优点是使反应液均匀受热;③3222244NaBH NaHSO NaOH Na S O NaBO H O ++→++,根据得失电子守恒可知,()()34n NaHSO n NaBH =8; (2)①装置a 烧瓶中发生Na 2SO 3与盐酸反应生成SO 2的反应;②生成的SO 2气体中含有HCl 气体,根据性质选择除杂溶液;③装置c 在70~83℃HCOONa 和2SO 、23Na CO 反应生成224Na S O 并析出,同时逸出2CO ;224Na S O 不溶于甲醇,加入3CH OH 可降低224Na S O 的溶解度;利用反应后的浊液分离提纯224Na S O 需重结晶。
高考化学《氧化还原反应基本概念》真题练习含答案

高考化学《氧化还原反应基本概念》真题练习含答案一、选择题催化剂1.[2024·浙江1月]汽车尾气中的NO和CO在催化剂作用下发生反应:2NO+2CO=====2CO2+N2,下列说法不正确的是(N A为阿伏加德罗常数的值)A.生成1 mol CO2转移电子的数目为2N AB.催化剂降低NO与CO反应的活化能C.NO是氧化剂,CO是还原剂D.N2既是氧化产物又是还原产物答案:D解析:由题给方程式可知,1 mol CO失去2 mol e-生成1 mol CO2,故生成1 mol CO2时转移电子的数目为2N A,A项正确;催化剂可以降低反应的活化能,提高反应速率,B项正确;NO中N为+2价,N2中N为0价,N元素的化合价降低,发生还原反应,则NO作氧化剂,N2为还原产物,同理可得,CO作还原剂,CO2为氧化产物,C项正确、D项错误。
2.[2024·全国乙卷]下列应用中涉及到氧化还原反应的是()A.使用明矾对水进行净化B.雪天道路上撒盐融雪C.暖贴中的铁粉遇空气放热D.荧光指示牌被照发光答案:C解析:使用明矾对水进行净化的过程中,明矾电离出的铝离子发生水解生成氢氧化铝胶体,氢氧化铝胶体粒子吸附水中的悬浮颗粒并沉降下来而水变得澄清,该过程中没有任何一种元素的化合价发生变化,因此没有涉及到氧化还原反应,A不符合题意;雪天道路上撒盐融雪,是因为雪遇到盐而使其熔点降低并熔化,该过程中没有任何一种元素的化合价发生变化,因此没有涉及到氧化还原反应,B不符合题意;使用暖贴时,铁粉与空气中的O2发生氧化还原反应,C符合题意;荧光指示牌被照发光,没有涉及到氧化还原反应,D不符合题意;综上所述,本题选C。
3.[2022·北京卷]下列物质混合后,因发生氧化还原反应使溶液pH减小的是()A.向NaHSO4溶液中加入少量BaCl2溶液,生成白色沉淀B.向NaOH和Fe(OH)2的悬浊液中通入空气,生成红褐色沉淀C.向NaHCO3溶液中加入少量CuSO4溶液,生成蓝绿色沉淀[Cu2(OH)2CO3]D.向H2S溶液中通入氯气,生成黄色沉淀答案:D解析:向NaHSO4溶液中加入少量BaCl2溶液,发生反应NaHSO4+BaCl2===BaSO4↓+NaCl+HCl,为非氧化还原反应,且溶液pH不变,A项错误;向NaOH和Fe(OH)2的悬浊液中通入空气,发生氧化还原反应4Fe(OH)2+2H2O+O2===4Fe(OH)3,c(OH-)增大,pH增大,B项错误;向NaHCO3溶液中加入少量CuSO4溶液,发生反应2Cu2++4HCO-3===Cu2(OH)2CO3↓+H2O+3CO2↑,为非氧化还原反应,C项错误;向H2S溶液中通入氯气,发生氧化还原反应H2S+Cl2===2HCl+S↓,且c(H+)增大,pH减小,D项正确。
高考真题专题0氧化还原反应解析版(2021-2023)(解析版)

专题03(二)氧化还原反应考点1 氧化还原反应基本概念 1.(2023浙江1月选考,6)关于反应322222NH OH 4Fe N O O =4Fe 4H H ++++↑+++,下列说法正确的是A .生成21molN O ,转移4mol 电子B .2NH OH 是还原产物C .2NH OH 既是氧化剂又是还原剂D .若设计成原电池,2Fe +为负极产物 【答案】A【解析】反应生成1mol 一氧化二氮,转移4mol 电子,A 正确;反应中氮元素的化合价升高被氧化,NH 2OH 是反应的还原剂,B 错误;反应中氮元素的化合价升高被氧化,NH 2OH 是反应的还原剂,铁元素的化合价降低被还原,铁离子是反应的氧化剂,C 错误;反应中铁元素的化合价降低被还原,铁离子是反应的氧化剂,若设计成原电池,铁离子在正极得到电子发生还原反应生成亚铁离子,亚铁离子为正极产物,D 错误。
2.(2022·浙江6月选考,10)关于反应Na 2S 2O 3+H 2SO 4Na 2SO 4+S↓+SO 2↑+H 2O,下列说法正确的是A.H 2SO 4发生还原反应B.Na 2S 2O 3既是氧化剂又是还原剂C.氧化产物与还原产物的物质的量之比为2∶1D.1 mol Na 2S 2O 3发生反应,转移4 mol 电子【答案】B【解析】H 2SO 4转化为Na 2SO 4和水,其中所含元素的化合价均未发生变化,故其没有发生还原反应,A 错误;Na 2S 2O 3中S 的化合价为+2价,其发生歧化反应生成S(S 为0价)和SO 2(S 为+4价),故Na 2S 2O 3既是氧化剂又是还原剂,B 正确;该反应的氧化产物是SO 2,还原产物为S,氧化产物与还原产物的物质的量之比为1∶1,C 错误;根据其中S 元素的化合价变化情况可知,1 mol Na 2S 2O 3发生反应,转移2 mol 电子,D 错误。
3.(2022·浙江1月选考,10)关于反应4CO 2+SiH 44CO+2H 2O+SiO 2,下列说法正确的是 A.CO 是氧化产物B.SiH 4发生还原反应C.氧化剂与还原剂的物质的量之比为1∶4D.生成1 mol SiO 2时,转移8 mol 电子【答案】D【解析】CO 2→CO,碳元素的化合价降低,发生还原反应,CO 为还原产物,A 项错误;SiH 4、H 2O 中H 元素的化合价分别为-1价、+1价,则SiH 4发生氧化反应,B 项错误;CO 2是氧化剂,SiH 4是还原剂,则氧化剂与还原剂的物质的量之比为4∶1,C 项错误;生成1 mol SiO 2时,转移8 mol 电子,D 项正确。
氧化还原反应练习题高考卷

氧化还原反应练习题高考卷一、选择题(每题4分,共40分)1. 下列反应中,属于氧化还原反应的是()A. HCl + NaOH → NaCl + H₂OB. CaCO₃ → CaO + CO₂C. Zn + CuSO₄ → ZnSO₄ + CuD. AgNO₃ + NaCl → AgCl↓ + NaNO₃2. 在氧化还原反应中,下列哪种物质既可以作为氧化剂,也可以作为还原剂?()A. H₂OB. Cl₂C. O₂D. CO3. 下列哪个过程是还原反应?()A. Fe → Fe²⁺ + 2e⁻B. Cu²⁺ + 2e⁻ → CuC. Zn → Zn²⁺ + 2e⁻D. Mg → Mg²⁺ + 2e⁻4. 下列哪种物质具有氧化性?()A. H₂SB. SO₂C. H₂O₂D. CO₂5. 在下列反应中,哪个元素被氧化?()2H₂S + SO₂ → 3S↓ + 2H₂OA. HB. SC. OD. 无法确定6. 下列氧化还原反应中,哪个是歧化反应?()A. Cl₂ + H₂O → HCl + HClOB. Zn + CuSO₄ → ZnSO₄ + CuC. 2H₂S + SO₂ → 3S↓ + 2H₂OD. 2KClO₃ → 2KCl + 3O₂↑7. 下列哪种物质具有还原性?()A. KMnO₄B. K₂Cr₂O₇C. FeSO₄D. CuSO₄8. 在下列反应中,哪个元素被还原?()CuO + H₂ → Cu + H₂OA. CuB. OC. HD. 无法确定9. 下列哪个反应是置换反应?()A. 2H₂ + O₂ → 2H₂OB. CaCO₃ → CaO + CO₂C. Zn + CuSO₄ → ZnSO₄ + CuD. AgNO₃ + NaCl → AgCl↓ + NaNO₃10. 下列哪个反应是分解反应?()A. 2KClO₃ → 2KCl + 3O₂↑B. 2H₂ + O₂ → 2H₂OC. Zn + CuSO₄ → ZnSO₄ + CuD. AgNO₃ + NaCl → AgCl↓ + NaNO₃二、填空题(每题4分,共40分)1. 氧化还原反应包括____、____、____三种基本类型。
高考化学 氧化还原反应综合试题附答案解析
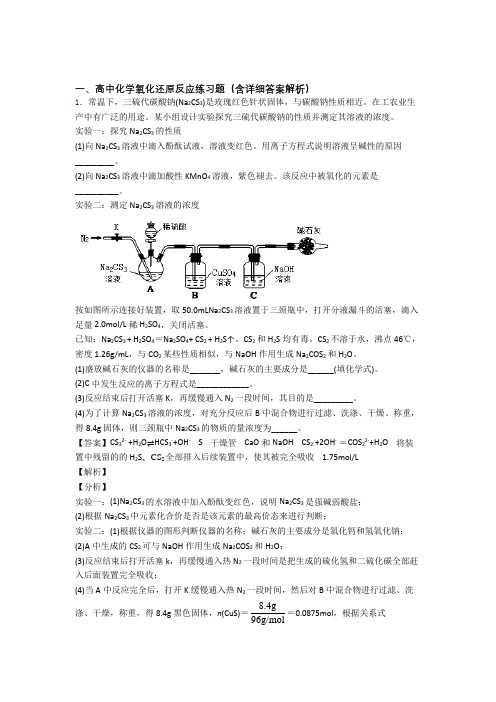
一、高中化学氧化还原反应练习题(含详细答案解析)1.常温下,三硫代碳酸钠(Na 2CS 3)是玫瑰红色针状固体,与碳酸钠性质相近。
在工农业生产中有广泛的用途。
某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验一:探究Na 2CS 3的性质(1)向Na 2CS 3溶液中滴入酚酞试液,溶液变红色。
用离子方程式说明溶液呈碱性的原因_________。
(2)向Na 2CS 3溶液中滴加酸性KMnO 4溶液,紫色褪去。
该反应中被氧化的元素是__________。
实验二:测定Na 2CS 3溶液的浓度按如图所示连接好装置,取50.0mLNa 2CS 3溶液置于三颈瓶中,打开分液漏斗的活塞,滴入足量2.0mol/L 稀H 2SO 4,关闭活塞。
已知:Na 2CS 3 + H 2SO 4=Na 2SO 4+ CS 2 + H 2S↑。
CS 2和H 2S 均有毒。
CS 2不溶于水,沸点46℃,密度1.26g/mL ,与CO 2某些性质相似,与NaOH 作用生成Na 2COS 2和H 2O 。
(1)盛放碱石灰的仪器的名称是_______,碱石灰的主要成分是______(填化学式)。
(2)C 中发生反应的离子方程式是____________。
(3)反应结束后打开活塞K ,再缓慢通入N 2一段时间,其目的是_________。
(4)为了计算Na 2CS 3溶液的浓度,对充分反应后B 中混合物进行过滤、洗涤、干燥、称重,得8.4g 固体,则三颈瓶中Na 2CS 3的物质的量浓度为______。
【答案】CS 32- +H 2O ⇌HCS 3-+OH - S 干燥管 CaO 和NaOH CS 2 +2OH - =COS 22-+H 2O 将装置中残留的的H 2S 、CS 2全部排入后续装置中,使其被完全吸收 1.75mol/L【解析】【分析】实验一:(1)Na 2CS 3的水溶液中加入酚酞变红色,说明Na 2CS 3是强碱弱酸盐;(2)根据Na 2CS 3中元素化合价是否是该元素的最高价态来进行判断;实验二:(1)根据仪器的图形判断仪器的名称;碱石灰的主要成分是氧化钙和氢氧化钠;(2)A 中生成的CS 2可与NaOH 作用生成Na 2COS 2和H 2O ;(3)反应结束后打开活塞k ,再缓慢通入热N 2一段时间是把生成的硫化氢和二硫化碳全部赶入后面装置完全吸收;(4)当A 中反应完全后,打开K 缓慢通入热N 2一段时间,然后对B 中混合物进行过滤、洗涤、干燥,称重,得8.4g 黑色固体,n (CuS)=96g 8.4g /mol=0.0875mol ,根据关系式Na 2CS 3~H 2S ~CuS 得n (Na 2CS 3)=n (CuS)=0.0875mol ,根据c =n V 计算A 中Na 2CS 3溶液的浓度。
高考化学《氧化还原反应规律及应用》真题练习含答案

高考化学《氧化还原反应规律及应用》真题练习含答案1.[2024·江苏淮安期中]室温下进行下列实验,根据实验操作和现象所得到的结论不正解析:Cl从-1价升高到0价,被氧化,PbO2具有氧化性,A项正确;滴加淀粉溶液后变蓝色,说明有I2生成,可证明NO-2的氧化性比I2的强,B项正确;Fe2+遇KSCN溶液不变红,Fe3+遇KSCN溶液变红,由此说明加入的H2O2能使Fe2+氧化为Fe3+,则Fe2+是该反应中的还原剂,只表现出还原性,不表现出氧化性,C项错误;新制氯水与KI反应生成I2,I2易溶于四氯化碳,则溶液下层呈紫红色,可知I-的还原性强于Cl-,D项正确。
2.[2024·辽宁朝阳期中]关于反应:KClO3+6HCl===KCl+3H2O+3Cl2↑,用同位素示踪法进行研究,反应前将KClO3标记为K37ClO3,HCl标记为H35Cl,下列说法正确的是() A.反应后,37Cl全部存在于氯化钾中B.产物氯气的摩尔质量为72 g·mol-1C.在氯气和氯化钾中都含有37ClD.产物氯气中37Cl与35Cl的原子个数比为1∶5答案:D解析:反应KClO3+6HCl===KCl+3H2O+3Cl2↑中,只有Cl元素化合价发生了变化,根据氧化还原反应中“化合价只靠近不交叉”的原则可知,用双线桥法表示该反应中转移电子的情况为将KClO3标记为K37ClO3,37Cl应全部存在于氯气中,A、C错误;根据得失电子守恒可知,产物氯气中37Cl与35Cl的原子个数比为1∶5,因此产物氯气的摩尔质量为1×37+5×35-1≈70.67 g·mol-1,B错误、D正确。
3g·mol3.[2024·哈尔滨师大附中高三考试]在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是()A.等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Fe2+、Br-B.等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:H+、Fe3+、Cu2+、Fe2+C.等物质的量的Ba(OH)2、KOH的溶液中通入CO2:Ba(OH)2、KOH、BaCO3、K2CO3 D.等物质的量的AlO-2、OH-、CO2-3溶液中,逐滴加入盐酸:OH-、CO2-3、AlO-2、Al(OH)3答案:A解析:在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2,氯气具有氧化性,先和还原性强的离子反应,离子的还原性顺序:I->Fe2+>Br-,故A正确;在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn,金属锌先是和氧化性强的离子发生反应,离子的氧化性顺序是:Fe3+>Cu2+>H+>Fe2+,故B错误;在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2,反应顺序为:Ba(OH)2、KOH、K2CO3、BaCO3,故C错误;若H+先与CO2-3反应,生成二氧化碳,而二氧化碳与溶液中AlO-2反应生成Al(OH)3,反应顺序为OH-、AlO-2、CO2-3、Al(OH)3,故D错误。
高考化学 氧化还原反应 综合题含详细答案

高考化学 氧化还原反应 综合题含详细答案一、高中化学氧化还原反应1.2ClO 是一种优良的消毒剂,浓度过高时易发生分解,为了运输和贮存便利常将其制成2NaClO 固体,模拟工业上用过氧化氢法制备2NaClO 固体的实验装置如图所示。
已知:2ClO 熔点-59℃、沸点11℃、22H O 沸点150℃A 中的化学方程式:32224222422NaClO H O H SO 2ClO O Na SO 2H O ++=↑+↑++(1)3NaClO 放入仪器A 中,仪器B 中的药品是__________(写化学式)。
如果仪器B 改成分液漏斗,实验过程中可能会出现的实验现象__________。
(2)C 装置有明显缺陷,请绘出合理的装置图(标明气流方向)__________。
(3)向A 装置中通入空气,其作用是赶出2ClO ,然后通过C 再到D 中反应。
通空气不能过快的原因是__________,通空气也不能过慢原因是__________。
(4)冰水浴冷却的目的是__________。
a.降低2NaClO 的溶解度b.减少22H O 的分解c.使2ClO 变为液态d.加快反应速率(5)写出D 中发生反应的化学方程式__________,22H O 在反应起到__________作用。
假设在反应中消耗掉22H O a g 则有__________mol 电子转移。
【答案】H 2O 2 液体无法顺利滴落 空气流速快时,2ClO 不能被充分吸收 空气流速过慢时,2ClO 不能及时被移走,浓度过高导致分解 abc2ClO 2+H 2O 2+2NaOH=2NaClO 2+O 2↑+2H 2O 还原剂 a/17【解析】【分析】氯酸钠(NaClO 3)在酸性条件下与过氧化氢生二氧化氯,ClO 2与氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO 2,NaClO 2的溶解度随温度升高而增大,通过冷却结晶,过滤洗涤得到晶体NaClO 2•3H 2O 。
高三化学氧化还原反应试题答案及解析

高三化学氧化还原反应试题答案及解析1.氮化铝广泛应用于电子、陶瓷等工业领域。
在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。
下列叙述正确的是A.上述反应中,N2是还原剂,Al2O3是氧化剂B.上述反应中,每生成1 mol AlN需转移3 mol电子C.AlN中氮元素的化合价为+3D.AlN的摩尔质量为41 g【答案】B【解析】标三种反应物的化合价可知:N由0价到-3价,做氧化剂,生成1 mol AlN需转移3mol电子,A错误,B正确;AlN中N为非金属,化合价应为-3价,C错误;摩尔质量的单位为:g/moL,D错误。
【考点】考察氧化还原反应,氧化剂还原剂、电子转移等知识。
2.(8分)氧化还原反应中实际上包含氧化和还原两个过程。
下面是一个还原过程的反应式:NO+4H++3e-―→NO+2H2O, KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:________________________________________________________________。
(2)反应中硝酸体现了________、________的性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是____________________________________________________。
【答案】22. (8分)(1)14HNO3+3Cu2O===6Cu(NO3)2+2NO↑+7H2O(2分)(2)酸性氧化性(2分)(3)0.6(2分)(4)使用了较浓的硝酸,产物中有部分二氧化氮生成(2分)【解析】(1)KMnO4、Na2CO3、Fe2(SO4)3中Mn、C、Fe元素都处在最高价,具有氧化性,只有Cu2O中Cu处在较低价,具有还原性,在NO3-+4H++3e→NO+2H2O中发生氧化剂被还原的反应,则该氧化还原反应为Cu2O+HNO3→NO↑+Cu(NO3)2+H2O,Cu元素由+1价升高到+2价,N元素由+5价降低到+2价,由电子守恒及质量守恒定律,配平的化学反应为3Cu2O+14HNO3═2NO↑+6Cu(NO3)2+7H2O,(2)因硝酸中的N元素的化合价为+5价,NO中N元素的化合价为+2价,在该反应中N元素的化合价降低,则体现硝酸的氧化性,而硝酸与硝酸中N元素的化合价相同,则体现硝酸具有酸性,所以,反应中硝酸体现了氧化性、酸性的性质;(3)由反应可知,NO为0.2mol,由2NO~6e-则,0.2molNO生成时转移的电子数为0.6mol;(4)Cu2O+6HNO3(浓)═2Cu(NO3)2+2NO2↑+3H2O ①,14HNO3+3Cu2O═6Cu(NO3)2+2NO↑+7H2O ②,将②式子系数除以3得到14/3HNO3+Cu2O═2Cu(NO3)2+2/3NO↑+7/3H2O,可知用稀硝酸氧化1molCu2O需要2/3mol硝酸作氧化剂,用浓硝酸需要2mol硝酸作氧化剂,质量当然增加,使用浓硝酸,产物中有NO2生成.【考点】考查氧化还原反应以及氧化还原反应电子转移数目的计算与配平,硝酸的化学性质等知识。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化还原真题及模拟1.高温下焙烧CuFeS2的反应之一为: 2CuFeS2+7O2CuSO4+CuO+Fe2O3 +3SO2下列关于该反应的叙述正确的是()A. CuFeS2中硫的化合价为-1B. CuFeS2发生还原反应C. 1 mol CuFeS2完全反应转移13 mol电子D. CuSO4和SO2既是氧化产物, 又是还原产物[答案] D[解析]CuFeS2中Cu为+2价, Fe为+2价, S为-2价, A选项错误; CuFeS2中S、Fe化合价都升高, 发生氧化反应, B选项错误; 1 mol CuFeS2完全反应转移14 mol电子, C选项错误; D正确。
2.三氟化氮(NF3) 在微电子工业中有重要用途, 可由氨气和氟气反应得到, 它在潮湿的空气中与水蒸气反应的产物有HF、NO和HNO3。
下列说法错误的是()A. 原子半径: N> FB. 在与水蒸气反应中, NF3既是氧化剂又是还原剂C. 若NF3泄漏, 可用石灰水喷淋的方法减少污染D. 在潮湿空气中反应, 被氧化与被还原的元素的物质的量之比为2∶1[答案] D[解析]原子半径: N> F, A正确; 三氟化氮与水蒸气反应生成HF、NO和HNO3, 三氟化氮中氮元素为+3价, 部分N元素化合价升高转化为HNO3, 部分N元素化合价降低转化为NO, 所以NF3既是氧化剂又是还原剂, B正确; 石灰水可除去HF、HNO3, 所以若NF3泄漏, 可用石灰水喷淋的方法减少污染, C正确; 根据化合价升高总数和降低总数相等, 可得被氧化与被还原的元素的物质的量之比为1∶2, D错误。
3.已知: ①Na3N+3H2O3NaOH+NH3↑, ②NaH+H2O NaOH+H2↑。
下列叙述正确的是()A. 离子半径: Na+> > H+B. 反应①和②都是氧化还原反应C. 反应②每生成1 mol H2, 转移的电子数为N AD. Na3N和NaH与盐酸反应都只生成一种盐[答案] C[解析]离子半径: N3-> Na+> H+, A不正确; 反应①中元素的化合价均未变化, 不是氧化还原反应, B不正确; 根据反应①可知Na3N与盐酸反应生成氯化钠和氯化铵两种盐, D不正确。
4.金属铜的提炼多从黄铜矿开始, 黄铜矿的熔烧过程主要反应之一为: 2CuFeS2+O2+2FeS+SO2, 则下列说法正确的是()A. 2CuFeS2中的S为-2价B. CuFeS2仅是还原剂C. 横线上的物质应是CuSD. 若有1 mol O2参加反应, 则反应中有4 mol电子转移[答案] A[解析]根据原子守恒知横线上的物质为Cu2S。
因为Fe3+能氧化S2-, 所以CuFeS2中Cu为+2价、Fe为+2价、S为-2价, 反应前后Cu、S、O三种元素的化合价都发生了变化, CuFeS2既是还原剂也是氧化剂。
反应中除O2得电子外, +2价Cu也得电子, 若有1 mol O2参加反应, 则有6 mol电子转移。
5.将51.2 g Cu完全溶于适量浓硝酸中, 收集到氮的氧化物(含NO、N2O4、NO2) 的混合物, 这些气体恰好能被500 mL 2.0 mol/L NaOH溶液完全吸收, 生成含NaNO3和NaNO2的盐溶液, 其中NaNO3的物质的量是()A. 0.2 molB. 0.4 molC. 0.6 molD. 0.8 mol[答案] A[解析]本题考查氧化还原反应。
整个反应过程中Cu失电子生成Cu2+, N得电子生成N。
设NaNO3、NaNO2的物质的量分别为x mol和y mol, 则根据得失电子守恒有: 2y=×2=1.6, 根据原子守恒有:x+y=0.5×2.0=1.0, 解得x=0.2, 故选A。
6.三氟化氮(NF3) 是微电子工业中优良的等离子刻蚀气体, 它在潮湿的环境中能发生反应: 3NF3+5H2O2NO+HNO3+9HF。
下列有关该反应的说法正确的是()A. NF3是氧化剂, H2O是还原剂B. 还原剂和氧化剂的物质的量之比是2∶1C. 若生成0.2 mol HNO3, 则转移0.2 mol电子D. NF3在潮湿的空气中泄漏会产生红棕色气体[答案] D[解析], 所以NF3既是氧化剂又是还原剂, 作氧化剂的NF3占总量的2/3, 每生成1 mol HNO3, 转移2 mol电子, 所以若生成0.2 mol HNO3, 则转移0.4 mol电子。
7.关于氧化还原反应10AgF+5Cl2+5H2O9+AgClO3+10HF+O2, 下列说法不正确的是()A. 每生成1 mol O2, 该反应转移电子的物质的量是4N AB. 该反应中Cl2既是氧化剂, 又是还原剂C.中的物质是AgClD. 该反应消耗的水有被氧化[答案] A[解析]由原子守恒可知中的物质是AgCl; 由元素化合价的变化可知Cl2既是氧化剂又是还原剂, H2O是还原剂; 由得失电子守恒可知, 生成1 mol O2时转移电子的物质的量是9 mol; 被氧化的H2O占反应中消耗的水的。
故选A。
8.在pH=1的某溶液中, 可能存在N、I-、Fe3+中的一种或两种, 向该溶液中滴入Br2, 单质Br2被还原, 由此推断该溶液里, 上述三种离子中一定存在的离子为()A. N、Fe3+B. 只有NC. I-、Fe3+D. 只有I-[答案] D[解析]单质Br2被还原说明溶液中一定存在I-, 则N、Fe3+都不存在, 原因是Fe3+具有强氧化性, 能氧化I-, N在酸性条件下也能氧化I-。
9.下表中对应关系正确的是()A CH3CH3+Cl2CH3CH2Cl+HClCH2CH2+HCl CH3CH2Cl均为取代反应B 由油脂得到甘油由淀粉得到葡萄糖均发生了水解反应C Cl2+2Br-2Cl-+Br2Zn+Cu2+Zn2++Cu均为单质被还原的置换反应D 2Na2O2+2H2O4NaOH+O2↑Cl2+H2O HCl+HClO均为水作还原剂的氧化还原反应[答案] B[解析]CH2CH2+HCl CH3CH2Cl是加成反应, A项错误; Zn+Cu2+Zn2++Cu中单质Zn被氧化, C项错误; D项两个反应中水既不是氧化剂也不是还原剂, D项错误。
10.运用有关概念判断下列叙述正确的是()A. 1 mol H2燃烧放出的热量为H2的燃烧热B. Na2SO3与H2O2的反应为氧化还原反应C. 和互为同系物D. BaSO4的水溶液不易导电, 故BaSO4是弱电解质[答案] B[解析]没有给出氢气燃烧对应的反应环境及生成物的状态, 所以放出的热量不一定是燃烧热, A项错误; 同系物结构相似, 即必须是同类物质, 但该项所给物质一个是苯酚, 一个是苯甲醇, C项错误; BaSO4水溶液不易导电的原因是BaSO4溶解度小, 水溶液中离子浓度小, 但BaSO4是强电解质, D项错误。
11.下列应用不涉及氧化还原反应的是()A. Na2O2用作呼吸面具的供氧剂B. 工业上电解熔融状态的Al2O3制备AlC. 工业上利用合成氨实现人工固氮D. 实验室用NH4Cl和Ca(OH) 2制备NH3[答案] D[解析]NH4Cl与Ca(OH) 2制取NH3的反应为复分解反应, 不是氧化还原反应。
12.下列单质或化合物性质的描述正确的是()A. NaHSO4水溶液显中性B. SiO2与酸、碱均不反应C. NO2溶于水时发生氧化还原反应D. Fe在足量Cl2中燃烧生成FeCl2和FeCl3[答案] C[解析]A项, 在水溶液中, NaHSO4Na++H++S, 故NaHSO4水溶液显酸性; B项, SiO2能与NaOH等强碱溶液反应, 也能与氢氟酸反应; C项, 3NO2+H2O2HNO3+NO, 该反应属于氧化还原反应; D项, Fe与足量Cl2反应只生成FeCl3。
13.高铁酸钾(K2FeO4) 是一种新型的自来水处理剂, 它的性质和作用是()A. 有强氧化性, 可消毒杀菌, 还原产物能吸附水中杂质B. 有强还原性, 可消毒杀菌, 氧化产物能吸附水中杂质C. 有强氧化性, 能吸附水中杂质, 还原产物能消毒杀菌D. 有强还原性, 能吸附水中杂质, 氧化产物能消毒杀菌[答案] A[解析]在K2FeO4中, Fe显+6价, 为铁的非常见高价态, 有强氧化性, 可杀菌消毒, 还原产物Fe3+水解生成的Fe(OH) 3胶体能吸附水中杂质。
14.氧化还原反应中, 水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。
下列反应与Br2+SO2+2H2O H2SO4+2HBr相比较, 水的作用不相同的是()A. 2Na2O2+2H2O4NaOH+O2↑B. 4Fe(OH) 2+O2+2H2O4Fe(OH) 3C. 2F2+2H2O4HF+O2D. 2Al+2NaOH+2H2O2NaAlO2+3H2↑[答案]CD[解析]分析反应Br2+SO2+2H2O H2SO4+2HBr可知, 水在该氧化还原反应中既不是氧化剂又不是还原剂。
A项, Na2O2既是氧化剂又是还原剂, 水既不是氧化剂又不是还原剂, 故A项不符合题意; B项, Fe(OH) 2是还原剂, O2是氧化剂, H2O既不是氧化剂又不是还原剂, 故B项不符合题意; C项, H2, H2O作还原剂, 符合题意; D项, 该反应的实质是H2O先将Al氧化, NaOH再将Al与H2O反应生成的Al(OH) 3变成NaAlO2, 反应中水是氧化剂, 故D项符合题意。
15.下表各选项中, 不能利用置换反应通过Y得到W的一组化合物是()选项A B C D化合物Y CO2Fe2O3C2H5OH FeCl3W MgO Al2O3C2H5ONa CuCl2[答案] D[解析]A项, Mg与CO2反应可生成MgO; B项, Al与Fe2O3在高温条件下反应可生成Al2O3; C项, C2H5OH与Na反应可生成C2H5ONa; D项, 虽然FeCl3和Cu反应可以得到CuCl2, 但该反应不是置换反应。
16.亚氨基锂(Li2NH) 是一种储氢容量高、安全性好的固体储氢材料, 其储氢原理可表示为: Li2NH+H2 LiNH2+LiH。
下列有关说法正确的是()A. Li2NH中N的化合价是-1B. 该反应中H2既是氧化剂又是还原剂C. Li+和H-的离子半径相等D. 此法储氢和钢瓶储氢的原理相同[答案] B[解析]A项, Li2NH中N的化合价是-3。
B项, 该反应中H2一部分生成LiNH2, 一部分生成LiH, 故H2既是氧化剂又是还原剂, B正确。
C项, Li+的离子半径小于H-的离子半径。
