药物溶液的形成理论.
药剂学学习指导与习题集-03药物溶解及溶出与释放

4、研磨法(机械分散法)
将药物与较大比例的载体材料混合后,强力持久 地研磨一定时间,借助机械力降低药物的粒度, 形成固体分散体。
常用的载体材料有微晶纤维素、乳糖、PVP等。
(四)固体分散体的物相鉴定
1.溶解度及溶出速率 2.热分析法 3.X射线衍射法 4.红外光谱法 5.拉曼光谱 6.核磁共振谱法
( pHm)
6.48
lg
4.0102 3.07 104 3.07 104
8.59
计算结果表明,输液的PH值不得低于8.59, 若低于此PH值则磺胺嘧啶将从输液中析出。
例:普鲁卡因在25℃ pKa=9.0,S0=0.5g/100ml, 配制20mg/ml的盐酸普鲁卡因注射液,其PH不应高 于多少?
(三)固体分散体的制备
1、熔融法 2、溶剂法 3、溶剂-熔融法 4、机械分散法
1、熔融法
药物 载体材料
加热 熔融
剧烈搅拌 迅速冷却
骤冷成固体
本法简便、经济,适用于对热稳定的药物,多用于 熔点低、不溶于有机溶剂的载体材料。
也可将熔融物滴入冷凝液中制成滴丸。
2、溶剂法(共沉淀法)
药物 载体材料
4、溶剂化物
药物在结晶过程中,因溶剂分子加入而使结晶 的结构发生改变,得到的结晶称为溶剂化物。 如溶剂是水,则称为水合物。
多数情况下,在水中的溶解度和溶解速度: 水合物 < 无水物 < 有机化物
5.粒子大小的影响
Ostwald-Freundlich方程
药物微粒半径
药物的溶解度
药物的固有常数
计算表明注射液PH值不应高于8.52,同时要考虑 药物的稳定性,因此盐酸普鲁卡因注射液PH应为4.5。
药剂学第二章预习

3.恒温搅拌并考虑药物达到溶解平衡的时间
4.温度:测定取样时要保持温度和测试温度一致并滤除未溶的药物
数份不同程度过饱和溶液
横坐标:药物质量-溶剂体积的比率
纵坐标:测得药物溶液浓度
正偏差:表明在该溶液中药物发生解离,或者杂质成分或溶剂对药物有复合及增溶作用等。
增加溶出速度的方法
固体的粒径和表面积
微粉化增加溶出速度
温度
温度升高,药物的溶解度增大、有利于扩散、粘度降低,从而加快药物的溶出速度
溶出介质的性质
溶出介质的体积
扩散系数
药物在边界层的扩散系数越大,溶出速度越快。
扩散层的厚度
扩散层的厚度与搅拌程度有关,搅拌速度快,扩散层薄,溶出速度快。
第二章药物溶液的形成理论
1.药物的特性溶解度与平衡溶解度的异同。
药物溶解度:一定温度(人体:37℃;存放4-5℃)下药物溶解在一定溶剂中达饱和时溶解的最大药量。表示:100ml溶剂中溶解溶质的最大克数,或mol/L
溶解度
相同点
不同点
溶液测定曲线Fra bibliotek测定曲线的含义
特性溶解度
1.测定条件:一般需要在低温(4-5℃)和体温(37℃)两种条件下进行
1、有机弱酸弱碱药物可制成可溶性盐增加其溶解度。
2、难溶性药物分子中引入亲水基团可增加其在水中的溶解度。
溶剂化作用与水合作用
晶型
将药物制成无定型,即无结晶结构的药物
溶剂化物
粒子大小
对于难溶性药物,在药物微粒小于100nm时,其溶解度与微粒的大小有关,溶解度随微粒径减小而增加。
温度
吸热时,溶解度随温度的升高而升高;放热时,溶解度随温度的升高而下降。
药剂学——液体制剂
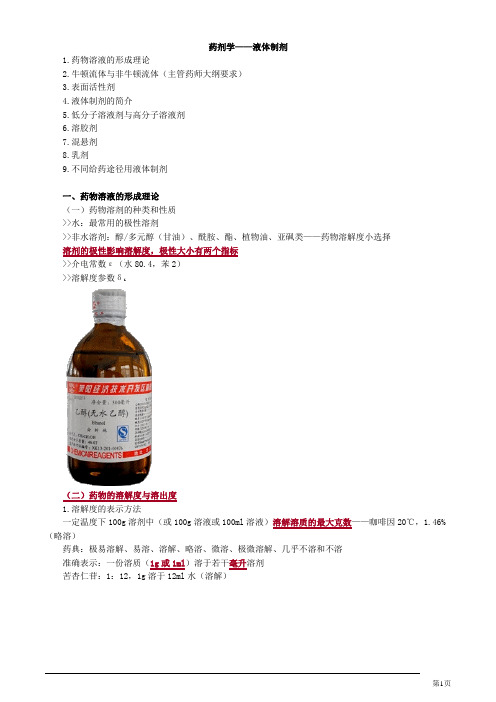
药剂学——液体制剂1.药物溶液的形成理论2.牛顿流体与非牛顿流体(主管药师大纲要求)3.表面活性剂4.液体制剂的简介5.低分子溶液剂与高分子溶液剂6.溶胶剂7.混悬剂8.乳剂9.不同给药途径用液体制剂一、药物溶液的形成理论(一)药物溶剂的种类和性质>>水:最常用的极性溶剂>>非水溶剂:醇/多元醇(甘油)、酰胺、酯、植物油、亚砜类——药物溶解度小选择溶剂的极性影响溶解度,极性大小有两个指标>>介电常数ε(水80.4,苯2)>>溶解度参数δi(二)药物的溶解度与溶出度1.溶解度的表示方法一定温度下100g溶剂中(或100g溶液或100ml溶液)溶解溶质的最大克数——咖啡因20℃,1.46%(略溶)药典:极易溶解、易溶、溶解、略溶、微溶、极微溶解、几乎不溶和不溶准确表示:一份溶质(1g或1ml)溶于若干毫升溶剂苦杏仁苷:1:12,1g溶于12ml水(溶解)溶解度是反映药物溶解性的重要指标前方高能预警!2.溶解度的测定方法(1)新药的特性溶解度药物不含任何杂质,在溶剂中不发生解离或缔合,也不发生相互作用时所形成的饱和溶液的浓度。
假设某药物在0.1mol/ml的NaOH溶解度约为1mg/ml。
实测时配制四种浓度的溶液,即分别将3、6、12、24mg药物溶于3ml溶剂中,装入容器,计算药物质量(mg)与溶剂用量(ml)之比,即药物质量-溶剂体积的比率分别为1、2、4、8。
将配制好的溶液恒温持续振荡达到溶解平衡,测定药物在饱和溶液中的浓度。
以测得药物溶液浓度为纵坐标,药物质量-溶剂体积的比率为横坐标作图,直线外推到比率为零处S0即得药物的特性溶解度。
(2)药物的平衡溶解度取数份药物,配制从不饱和溶液到饱和溶液的系列溶液,置恒温条件下振荡至平衡,经滤膜过滤,取滤液分析。
测定药物在溶液中的实际浓度S,并对配制溶液浓度C作图,曲线的转折点A即为该药物的平衡溶解度。
3.影响药物溶解度的因素药物,溶剂,温度,pH,同离子效应,助溶剂,增溶剂①药物a.极性大小:对溶解度影响很大,相似相溶b.药物晶格:排列紧密,引力大,溶解度小c.药物晶型:无定形>亚稳定型>稳定型d.粒子大小:难溶(0.1-100nm)粒径减小增溶②溶剂:降低药物分子或离子间引力使之溶剂化而溶解;水合作用,潜溶③温度:溶解过程吸热,T↑溶解度↑,反之下降④pH:有机弱酸、弱碱及其盐类⑤第三种物质同离子效应:NaCl可致盐酸小檗碱溶液析出结晶助溶剂:I2+KI——1:2950→1:20增溶剂:表面活性剂4.增加药物溶解度的方法(注意实例)①加入增溶剂:表面活性剂②使用助溶剂:I2+KI、咖啡因+苯甲酸钠,茶碱+乙二胺③应用混合溶剂(潜溶剂):洋地黄毒苷-水+乙醇苯巴比妥-90%乙醇④改变部分化学结构√制成盐类:弱酸、弱碱,如乙酰水杨酸-钙盐√引进与溶剂有较强亲和力的基团:维生素K3-亚硫酸氢钠增溶剂——表面活性剂(请注意,我很重要!)增溶原因:表面活性剂在水中形成“胶束”影响增溶的因素①增溶剂的种类②增溶剂的用量③药物的性质④加入顺序(药物和增溶剂混合后,再加水稀释)5.药物溶出速度的表示方法①单位时间:药物溶解进入溶液主体的量②两个阶段:表面溶解、扩散对流③固体药物:溶出受扩散控制Noyes-Whitney方程dC/dt:溶出速度C:t时间溶液中溶质的浓度K:溶出速度常数 S:固体的表面积C S:溶质在溶出介质中的溶解度6.影响药物溶出速度的因素(增加溶出速度的方法)①固体的表面积:粒径小,孔隙率高,表面积大;加润湿剂——增加溶出界面②温度(T)③溶出介质的体积(V)④扩散系数(D)⑤扩散层的厚度(h):加强搅拌QIAN溶出速度影响因素蔗糖粉细孔又多温度升高多加水考虑系数勤搅拌溶出速度能加快随堂练习A1型题:苯巴比妥在90%的乙醇溶液中溶解度最大,则90%的乙醇溶液是A.非极性溶剂B.潜溶剂C.助溶剂D.消毒剂E.增溶剂『正确答案』B『答案解析』90%的乙醇溶液为混合溶剂做潜溶剂。
最新药剂学-第二章药物溶液形成理论资料

第二章药物溶液形成理论习题部分一、概念与名词解释1.介电常数:2.助溶剂:3.增溶剂:二、判断题(正确的填A,错误的填B)1.药物的介电常数和溶剂的介电常数越接近,药物在该溶剂中溶解性越好。
( ) 2.正辛醇的溶解度参数与生物膜脂质接近,因此常用作模拟生物膜测定分配系数。
( )3.通常所测定的溶解度是药物的特性溶解度。
( )6.将维生素K3制备成维生素K3,亚硫酸氢钠的目的是改变维生素K3的药理作用。
( ) 7.在多数情况下,药物的溶解度和溶解速度的顺序为无水物<水合物<有机化物。
( ) 8.粒子大小对药物溶解度的影响的规律是:药物粒子越小,药物的溶解度越大。
( ) 9.温度升高,药物的溶解度增大。
( )10.许多盐酸盐类药物在生理盐水中溶解度减小的原因是由于同离子效应。
( )11.苯巴比妥在20%乙醇中的溶解度为0.22g/100ml,在40%乙醇中的溶解度为0.88g/100ml,在90%乙醇中溶解度达最大值,这种现象称为潜溶。
( )12.碘溶解时加入碘化钾的目的是增溶。
( )13.灰黄霉素溶解时加人胆酸钠的目的是增溶。
( )14.药物溶液的pH值的调节主要考虑机体的耐受性、药物的稳定性及药物的溶解度。
( )15.药物的pK a越大,碱性越强。
( )16.同一药物的多晶型中,亚稳定型比稳定型的溶出速率与溶解度均大。
( )17.药物溶解度参数与生物膜的溶解度参数越接近,越易吸收,吸收也越快。
( ) 18.药物分子间的作用力大于药物分子与溶剂分子间的作用力则药物溶解度小。
( ) 19.介电常数大的药物其极性小,介电常数小的药物极性大。
( )20.对于可溶性药物,粒子大小对溶解度影响不大。
( )三、填空题1.药物分子间的作用力大于药物分子与溶剂分子间作用力时药物在该溶剂中的溶解度,反之,则。
2.药物分子形成分子内氢键,则在极性溶剂中的溶解度;而在非极性溶剂中的溶解度。
3.当药物的△H S>0,溶解度随温度升高而,当药物的△H S<0,溶解度随温度升高而。
药剂学习题及答案

药剂学习题及答案第一章绪论1.剂型、制剂、药剂学的概念是什么?2. 什么是处药与非处药(OTC)3. 什么是GMP 、GLP与GCP?第二章液体制剂1.液体制剂的按分散系统如分类?2.液体制剂的定义和特点是什么?3.液体制剂的质量要求有哪些?4.液体制剂常用附加剂有哪些?为潜溶剂?5.为絮凝,加入絮凝剂的意义在?6.乳剂和混悬剂的特点是什么?7.用Stokes公式描述影响沉降的因素,并说明加入高分子助悬剂具有哪些作用?8.乳化剂的作用如?如选择乳化剂?9.乳剂的稳定性及其影响因素?10.简述增加药物溶解度的法有哪些?11.简述助溶和增溶的区别?12.什么是胶束?形成胶束有意义?13.表面活性剂分哪几类,在药剂中主要有哪几个作用?第三章灭菌制剂与无菌制剂1.影响湿热灭菌的因素有哪些?2.常用的除菌过滤器有哪些?3.灭菌参数F和F0值的意义和适用围?4.洁净室的净化标准怎样?5.注射剂的定义和特点是什么?6.注射剂的质量要求有哪些?7.纯化水、注射用水、灭菌注射用水的区别?8.热原的定义及组成是什么?9.热原的性质有哪些?各国药典检查热原的法定法是什么?10.简述污染热原的途径及去除热原的法。
11.注射剂等渗的调节法及调节等的意义。
12.制备安瓶的玻璃有几种?各适合于什么性质的药液?13.输液按规定的灭菌条件灭菌后,为什么还会出现染菌现象?14.输液常出现澄明度问题,简述微粒产生的原因及解决的法。
第四~五章固体制剂1.散剂的概念、制备法与质量要求。
2.用什么程来描述药物的溶出速度?改善药物溶出速度的法有哪些?3.什么是功指数?4.影响物料均匀混合的因素有哪些?如达到均匀混合?5.片剂的概念和特点是什么?6.片剂的可分哪几类?各自的特点?7.片剂常用的辅料有哪些?可用于粉末直接压片的辅料有哪些?8.湿法制粒的法有哪些?各自的特点?9.片剂产生裂片的主要原因及解决的法。
10.片剂的包衣的目的在?11.片剂的成形及其影响因素。
药剂2 22章

药剂2 22章药剂2-22章------第二章药物溶液的形成理论――1,水:最常用极性溶剂化学性质平衡存有较好的生理相容性稀释慢。
――2,非水溶剂:药物在水中容易水溶性或不平衡时用。
――3,常用的非水溶剂主要有:1醇与多元醇类―能与水混溶2醚类―能与乙醇、丙二醇和甘油混溶3酰胺类―能与水和乙醇混溶4酯类5植物油类6烃类7亚砜类―能与水和乙醇混溶。
――4,药用溶剂的性质:溶剂的极性大小常以介电常数和溶解度参数的大小来衡量――5,介电常数:指将恰好相反电荷在溶液中分离的能力,充分反映溶剂分子的极性大小。
介电常数小溶剂极性小。
――6,物质的溶解性与溶剂介电常数:水80―无机盐有机盐、二醇类50―糖鞣质、甲醇乙醇―蓖麻油蜡、醇酮氧化物高级醇20―树脂挥发油弱电解质、乙烷苯四氯化碳乙醚5―脂肪石蜡烃类汽油、矿物油植物油0(极性递减)(水溶性递减)。
――7,溶解度参数:系指同种分子间的内聚力,也就是则表示分子极性大小的一种量度。
溶解度参数越大,极性越大。
――8,正辛醇模拟生物膜相测定分配系数的溶剂:药物在体内转运过程中,药物分子能溶于生物膜极为重要,但生物膜不是简单的溶剂。
因此,简单的溶液理论并不适用于体内。
生物膜脂层的溶解度参数的平均值为17.80+-2.11与正丁烷的和环己烷的溶解度参数接近。
整个膜的平均值为21.07+-0.82,很接近正辛醇的因此正辛醇常作为模拟生物膜相测定分配系数的溶剂――9,溶解度;系指在一定温度(气体在一定压力)下,在一定量溶剂中超过饱和状态时熔化的最小药量,就是充分反映药物溶解性的关键指标。
常用一定温度之下100g溶剂中或100ml溶液中熔化溶质的最小克数去则表示。
――10,药物的特性溶解度;药物不含任何杂质,在溶剂中不发生解离和缔合,也不发生相互作用时所形成的饱和溶液的浓度。
(在测定数份不同程度过饱和溶液,测定药物在饱和溶液中的浓度)------11,药物的均衡溶解度(又称表观溶解度)测药物实际浓度s,对溶液浓度c作图,图中曲线转折点a,即为为均衡溶解度)――12,影响药物溶解度的因素:1.药物的分子结构:相似相溶、药物分子与溶剂分子间氢键―极性溶剂中的溶解度增大;药物分子形成分子内氢键―极性溶剂中溶解度减小,非极性溶剂中溶解度增大;有机弱酸弱碱药物制成可溶性盐,难溶性药物分子中引入亲水集团溶解度增加2,溶剂化作用与水合作用;药物离子的水合作用与药物离子性质有关,阳离子和水之间的作用力强以至于阳离子周围保持有一层水。
药剂学重点总结

第一章绪论1. 药剂学的概念: 是将原料药制备成用于治疗,诊断,预防疾病所需的制剂的一门学科2.药物剂型(Dosage form)(简称“剂型” )适合于疾病的诊断、治疗或预防的需要而制备的不同给药形式。
第二章药物溶液的形成理论1. 影响药物溶解度的因素药物极性溶剂:药物分子的溶剂化作用与水合作用,有机溶剂化物>无水物>水合物药物的多晶型:无定型>亚稳型>稳定型,温度,pH,同离子效应粒子大小(公式:因此我们减小粒径来增大难容性药物溶解度,如微粉化),混合溶剂a 助溶剂hydrotropy :难溶性药物与加入的第三种物质在溶剂中形成可溶性分子间的络合物、复盐或缔合物等,以增加药物在溶剂中的溶解度。
这第三种物质称为助溶剂。
①有机酸及其钠盐:苯甲酸钠、水杨酸钠等②酰胺类化合物:乌拉坦、尿素、乙酰胺等。
b 增溶剂solubilization: 难溶性药物在表面活性剂的作用下,在溶剂中溶解度增大并形成澄清溶液的过程。
具有增溶能力的表面活性剂称增溶剂, 被增溶的物质称为增溶质。
c 潜溶剂cosolvent: 在混合溶剂中各溶剂在某一比例时,药物的溶解度比在各单纯溶剂中的溶解度大,而且出现极大值,这种现象称为潜溶,这种溶剂称为潜溶剂。
如乙醇、丙二醇。
3. 等张溶液istonic solution :是指溶液的张力与红细胞的张力相等,也就是药物溶液与细胞接触时使细胞功能和结构保持正常,红细胞在该溶液中不发生溶血。
4. 等渗溶液:系指渗透压与血浆渗透压相等的溶液。
5. 增加难溶性药物溶解度的方法:制成可溶性盐、引入亲水基团、加入潜溶剂、加入助溶剂、加入增溶剂6 药物溶出速度方程Noyes-Wh 方程:dC/dt= KS(CS-C)=DS/Vh(CS-C)dC/dt ——溶出速度;K ——溶出速度常数; S ——固体的表面积;Cs——溶质在溶出介质中的溶解度;C——t 时间溶液中溶质的浓度。
D——溶质在溶出介质中扩散系数;V——溶出介质体积;h——扩散层的厚度。
药物溶液的形成理论

2020/11/18
药物溶液的形成理论
Contents
•1 •药用溶剂的性质 •2 •药物的溶解度
•目录 •3 •药物的溶出速度 •4 •药物溶液的pH与pKa值测
•5 •药物定溶液的表面张力
药物溶液的形成理论
药用溶剂的性质
l 药用溶剂与药物的性质均影响到药物在溶剂中的溶解 性能,溶剂的极性直接影响药物的溶解度。溶剂极性 的大小常用介电常数和溶解度参数来表示.
•式中,Ksp——盐的溶度积。
药物溶液的形成理论
• 如果与解离型浓度相比,非解离型的浓度小到 可以忽略不计,则该药物的溶解度St随着[Cl-]的增 加而减少,此时表观溶度积为:
• 除以上因素外,尚与离子强度、温度及水性介质 的组成有关。 • 一般向难溶性盐类饱和溶液中,加入含有相同离 子化合物时,其溶解度降低,这是由于同离子效应的影 响。如许多盐酸盐类药物在0.9%氯化钠溶液中的溶解度 比在水中低。
药物溶液的形成理论
l 特性溶解度的测定是根据相溶原理图来确定的.在 测定数份不同程度过饱和溶液的情况下,将配制好 的溶液恒温持续振荡达到溶解平衡,离心或过滤后, 取上清夜并做适当稀释,测定药物在饱和溶液中的 浓度.
l 以测得药物溶液浓度为纵坐标,药物质量-容积体积 比率为横坐标作图,直线外推到比率为零处即得药 物的特性溶解度,
•
• 计算结果表明,输液的pH值不得低于8.59,若低 于此pH值则磺胺嘧啶将从输液中析出。
药物溶液的形成理论
• 对于弱碱性药物,若已知pKa和S0,由下式即可计 算弱碱在任何pH值的溶解度。此时也表明溶液的pH值高 于计算值时弱碱即游离析出,即为弱碱溶解时的最高pH 值。
•或
药物溶液的形成理论
药剂学6版

注射用水
无菌注射用水
●性质稳定 ●生理相容性 ●使用安全 ●成本低
水能溶解大多数无机盐类和极性大的有机药物及药材中
的有效成分;有些药物水中不稳定,降解、霉变等。
▢氨基酸口服液
▢氨基酸注射液
★利巴韦林口服溶液
★利巴韦林滴眼液
★ 利巴韦林滴鼻液
复方氨基酸注射液
羟喜树碱注射液
非水溶剂
▤ 醇及多元醇类
内就地查封、扣押。
▤广东省药检所反复检验和验证 ●齐二药生产的亮菌甲素注射液含有了该药中不应该含
有的二甘醇
▤含有“二甘醇”的亮菌甲素注射液--直接导致病人肾功
能急性衰竭
●二甘醇在体内氧化成草酸而引起肾脏损害
▢江苏省泰兴市不法商人王桂平以中国地质矿业总公司泰兴化工总厂的名义, 伪造药品生产许可证等证件,于2005年10月将工业原料二甘醇假冒药用辅 料丙二醇,出售给齐二药。 ▢齐二药采购员钮忠仁违规购入假冒丙二醇 ▢化验室主任陈桂芬等人严重违反操作规程,未将检测图谱与“药用标准丙二 醇图谱”进行对比鉴别,并在发现检验样品“相对密度值”与标准严重不符 的情况下,将其改为正常值,签发合格证。 ▢假药用辅料投入生产,制造出假药“亮菌甲素注射液”并投放市场。 ▢广州中山三院和广东龙川县中医院使用此假药后,11名患者出现急性肾功能 衰竭并死亡。
处货值金额5倍罚款1682万元,罚没款合计1920万元; 吊销其《药品生产许可证》,撤销其129个药品批准文
号。收回GMP认证证书。
▤齐二药原总经理等10人被公安机关立案侦查
一批药品监管及工商行政管理部门负责人受到行政处分
二.药用溶剂的性质 溶剂的极性直接影响药物的溶解度。 溶剂极性的大小以介电常数和溶解度参数衡量。 (一)介电常数 溶剂介电常数表示将相反电荷在溶液中分开的能力
药剂学名词解释

Good manufacturing practice(GMP) 药品生产质量管理规范Standard operating procedure(SOP) 标准操作规范Good laboratory practice(GLP) 药物非临床研究质量管理规范Good clinical practice(GCP) 药物临床试验管理规范Glycerin 甘油Dimethyl sulfoxide(DMSO) 二甲亚砜Polyethylene glycol(PEG) 聚乙二醇Liquid paraffin 液状石蜡Flavouring agents 矫味剂Coloring agents 着色剂Phase volume ratio 相容积比:油水两相的容积之比。
High pressure homogenizer 乳匀机Colloid mill 胶体磨Ultrasonic homogenizer 超声波乳化器Sterility assurance level(SAL) 无菌保证水平(≤10-6)Heat sterilization 热力灭菌法Medium filtration 介质过滤Cake filtration 滤饼过滤Ray sterilization 射线灭菌法Intracutaneous injection 皮内注射Subcutaneous injection 皮下注射Intramuscular injection 肌内注射Intravenous injection 静脉注射Additives for injection 注射剂的附加剂Rabbit test 家兔法(热原检测)Limulus lysate test 鲎试剂法(热原检测)Electrolyte infusions 电解质输液Nutrition infusions 营养输液Colloid infusions 胶体Drug-containing infusions 含药输液Sterile powder for injection 注射用无菌粉末Ophthalmic preparation 眼用制剂Dry granulation 干法制粒Solid bridge 固体桥Mechanical interlocking bonds 机械镶嵌Pregelatinized starch 预胶化淀粉Microcrystalline cellulose(MCC)微晶纤维素Carboxymethylcellulose sodium(CMC-Na) 羧甲基纤维素钠Sodium carboxymethyl starch(CMS-Na) 羧甲基淀粉钠Low-subsituted hydroxypropylcellulose(L-HPC) 低取代羟丙基纤维素Croscarmellose sodium(CCMC-Na) 交联羧甲基纤维素钠Polyvinylpolypyrrolidone(PVPP) 交联聚维酮Effervescent disintegrants 泡腾崩解剂:碳酸氢钠与枸橼酸混合物Magnesium stearate 硬脂酸镁Silica gel 微粉硅胶T alc 滑石粉Hydrogenated vegetable oil 氢化植物油Sodium lauryl sulfate 十二烷基硫酸钠Laminating tablets 裂片Enteric capsules 肠溶胶囊Dimethyl ether(DME) 二甲醚Foaming agents 起泡剂Foam stabilizer 稳泡剂Antifoaming agents 消泡剂Stress testing 强化试验:即影响因素试验Accelerated testing 加速试验Long-term testing 长期试验Lead optimization 先导化合物的优化Candidate selection 确定候选化合物Current Good Manufacture Practice(cGMP)Life cycle management 药品的生命周期管理Therapeutic index 治疗指数T arget product profile(TPP)目标产品特征T arget product quality profile(TPQP)目标产品质量特征Fraction of absorption(F a)口服吸收分数Physiologically based gastrointestinal model 胃肠道生理模型Bioavailability classification system(BCS)生物药剂学分类系统Decoction 煎煮法Maceration 浸渍法Percolation 渗漉法Vapor distillation 水蒸气蒸馏法Ultrasound-assisted extraction(UAE)超声波提取法Medicinal liquor 酒剂Separation by sedimentation 沉降分离法Separation by centrifuge 离心分离法Separation by filtering 过滤分离法Cyclodextrin(CD)环糊精Nanoemulsion 纳米乳Submicroemulsion 亚微乳Spray drying 喷雾干燥法Spray congealing 喷雾凝结法Fluidized bed coating 流化床包衣法Multiorfice-centrifugal process 多孔离心法Spinning disk atomization 转碟法Unilamellar vesicles 单层脂质体Multilamellar vesicles(MLVs) 多层脂质体Endocytosis/phagocytosis 内吞Encapsulation efficiency(EE) 包封率Loading efficiency(LE) 载药率Erodible matrix tablets 溶蚀性骨架片Osmotic pressure active ingredients 渗透压活性物质Gastric floating retention 胃内漂浮滞留Gastric adhesives retention 胃壁黏附滞留1 绪论1.Pharmaceutics (Pharmacy) 药剂学:是研究药物制剂的基本理论,处方设计,制备工艺,质量控制,合理使用等内容的综合性应用技术科学。
初级执业药师药剂学——液体制剂知识点总结

初级执业药师药剂学——液体制剂知识点总结要点:1.药物溶液的形成理论2.表面活性剂3.液体制剂的简介4.低分子溶液剂与高分子溶液剂5.溶胶剂6.混悬剂7.乳剂8.不同给药途径用液体制剂一、药物溶液的形成理论(一)药物溶剂的种类和性质水:最常用的极性溶剂非水溶剂:醇/多元醇(甘油)、酰胺、酯、植物油、亚砜类——药物溶解度小选择溶剂的极性影响溶解度,极性大小有两个指标>>介电常数ε:表示将相反电荷在溶液中分开的能力,反映溶剂分子的极性大小(水80.4,苯2)>>溶解度参数δi:表示同种分子间的内聚力,也是表示分子极性大小的一种量度。
(水47.86,苯18.61)(二)药物的溶解度与溶出度1.溶解度的表示方法一定温度下100g溶剂中(或100g溶液或100ml溶液)溶解溶质的最大克数——咖啡因20℃,1.46%(略溶)药典:极易溶解、易溶、溶解、略溶、微溶、极微溶解、几乎不溶和不溶准确表示:一份溶质(1g或1ml)溶于若干毫升溶剂苦杏仁苷:1:12,1g溶于12ml水(溶解)溶解度是反映药物溶解性的重要指标拓展:2015版药典关于溶解度的描述极易溶解溶质1g(ml)能在溶剂不到1ml中溶解易溶溶质1g(ml)能在溶剂1~不到10ml中溶解溶解溶质1g(ml)能在溶剂10~不到30ml中溶解略溶溶质1g(ml)能在溶剂30~不到100ml中溶解微溶溶质1g(ml)能在溶剂100~不到1000ml中溶解极微溶溶质1g(ml)能在溶剂1000~不到10000ml中溶解几乎不溶或不溶溶质1g(ml)在溶剂10000ml中不能完全溶解前方高能预警!2.溶解度的测定方法◆药物的特性溶解度:药物不含任何杂质,在溶剂中不发生解离或缔合,也不发生相互作用时所形成的饱和溶液的浓度。
◆药物的平衡溶解度:药物的溶解度数值多是平衡溶解度(又称表观溶解度)特性溶解度直线1:药物发生解离,或杂质成分或溶剂对药物有复合及增溶作用直线2:药物纯度高,无解离与缔合无相互作用直线3:存在盐析或同离子效应,抑制溶解平衡溶解度3.影响药物溶解度的因素药物分子结构、晶型、粒子大小水合作用与溶剂化作用溶解温度溶液pH与同离子效应混合溶剂(潜溶剂)添加物:助溶剂、增溶剂①药物的影响极性大小:对溶解度影响很大,相似相溶晶格:排列紧密,引力大,溶解度小多晶型:无定形>亚稳定型>稳定型粒子大小:难溶粒径减小增溶(0.1-100nm)②水合作用与溶剂化作用◆药物离子的水合作用与离子性质有关,阳离子和水之间的作用力很强,阳离子周围保持有一层水。
药剂学课件9第九章:药物溶液的形成理论

特性溶解度测定曲线
红线表明药物解离或缔合,含杂质或增溶; 黄线表明药物纯度高,无解离与缔合,无相互作用; 蓝线表明存在盐析或同离子效应。
S
0 0 2 4 6 8 10 药物/溶液/mg/ml 12
2.药物的平衡溶解度测定法
药物的溶解度数值多是平衡溶解度 (又称表观溶解度) 测量的具体方法是:取数份药物,配 制从不饱和溶液到饱和溶液的系列溶液, 置恒温条件下振荡至平衡,经滤膜过滤, 取滤液分析,测定药物在溶液中的实际浓 度S并对配制溶液浓度C作图,如下图,图 中曲线的转折点A,即为该药物的平衡溶 解度。
7.同离子效应
一般向难溶性盐类饱和溶液中,加入含 有相同离子化合物时,其溶解度降低,这是 由于同离子效应的影响。·
[ BH Cl ]( s) [ BH ] [Cl ]
K SP
K SP [ BH ][Cl ]
8. 混合溶剂
为提高不溶或难溶于水的药物的溶解 度,常常使用两种或多种混合溶剂。在混 合溶剂中各溶剂达到一定比例时,可使药 物溶解度出现极大值,这种现象称为潜溶 (cosolvency),这种混合溶剂称潜溶剂 (cosolvent) 。 常与水组成潜溶剂的有:乙醇、丙二 醇、甘油、聚乙二醇、山梨醇等。
一些溶剂的介电常数(20℃)
溶剂 H2SO4 HCONH2 H2 O HCOOH H2NNH2 HCON(CH3)
2 CH3OH
介电常数 110 109 80.4 57.9 53.0 37.6 33.6
溶剂 C4H9OH C 5 H5 N ClCH2CH2Cl CH3COOH C6H5Cl CHCl3 C 6 H6
表8-5 药物溶剂化对药物熔点和溶解度的影响
药物 氨苄青霉素 溶剂① (无水物) 水(3:1) 苯乙派啶酮 (无水物) 水(1:1)
药剂学 简答题

Chapter 2 药物溶液的形成理论1、影响药物溶解度的因素及增加药物溶解度的方法?①影响因素:药用溶剂种类和混合溶剂,溶剂和药物极性大小,Ph值的影响,药物多晶型,药物粒子大小,添加物的影响,温度的影响,药物分子结构的影响,溶剂化作用和水合作用②方法:混合溶剂法,助溶剂助溶法,增溶剂增溶法,制成可溶性盐法,制成固体分散体或包合物法2、分析影响固体药物在液体中溶出速度的因素有哪些?①药物粒径②药物溶解度③溶出介质体积④扩散系数⑤扩散层厚度⑥温度3、助溶剂机制及分类?①机制:形成可溶性盐,有机复合物,复分解后形成可溶性盐②例如制含碘5%的水溶液时加入碘化钾,形成分子间络合物KI3,增加溶解度4、增溶剂的作用及影响增溶的因素?①作用:增加难溶性药物的溶解度,提高稳定性;防止药物被氧化;防止药物水解②因素:增溶剂的种类,药物的性质,加入顺序,增溶剂的用量5、潜溶剂提高药物溶解度的原因及如何去选择?①原因:两种溶剂间发生氢键缔合,有利于药物溶解;介电常数改变,增加了非解离药物的溶解度②一个好的潜溶剂的介电常数一般在25-80。
Chapter 3 表面活性剂1、简述表面活性剂的分类及其安全性?分类:根据分子组成特点及极性基团的解离性质可分为离子性和非离子性①根据离子表面活性剂所带电荷,可分为阳离子,阴离子和两性离子。
阴离子表面活性剂主要有高级脂肪酸盐(肥皂类),硫酸化物,磺酸化物等阳离子表面活性剂主要有苯扎氯铵和苯扎溴铵等,又称阳性皂两性离子表面活性剂中同时具有正,负电荷,有卵磷脂,氨基酸型和甜菜碱型两性离子表面活性剂碱性水溶液呈阴离子表面活性剂性质,有起泡,去污作用两性离子表面活性剂酸性水溶液呈阳离子表面活性剂性质,有很强的杀菌作用②非离子表面活性剂在水中不解离,分子中构成亲水基团的是甘油,聚乙二醇和山梨醇等多元醇,构成亲油基团的是长链脂肪酸或长链脂肪醇以及烷基或芳基等,它们以酯键或醚键与亲水基团结合。
药剂学第二章药物溶液形成理论

第二章药物溶液形成理论习题部分一、概念与名词解释1.介电常数:2.助溶剂:3.增溶剂:二、判断题(正确的填A,错误的填B)1.药物的介电常数和溶剂的介电常数越接近,药物在该溶剂中溶解性越好。
( ) 2.正辛醇的溶解度参数与生物膜脂质接近,因此常用作模拟生物膜测定分配系数。
( )3.通常所测定的溶解度是药物的特性溶解度。
( )6.将维生素K3制备成维生素K3,亚硫酸氢钠的目的是改变维生素K3的药理作用。
( ) 7.在多数情况下,药物的溶解度和溶解速度的顺序为无水物<水合物<有机化物。
( ) 8.粒子大小对药物溶解度的影响的规律是:药物粒子越小,药物的溶解度越大。
( ) 9.温度升高,药物的溶解度增大。
( )10.许多盐酸盐类药物在生理盐水中溶解度减小的原因是由于同离子效应。
( )11.苯巴比妥在20%乙醇中的溶解度为0.22g/100ml,在40%乙醇中的溶解度为0.88g/100ml,在90%乙醇中溶解度达最大值,这种现象称为潜溶。
( )12.碘溶解时加入碘化钾的目的是增溶。
( )13.灰黄霉素溶解时加人胆酸钠的目的是增溶。
( )14.药物溶液的pH值的调节主要考虑机体的耐受性、药物的稳定性及药物的溶解度。
( )15.药物的pK a越大,碱性越强。
( )16.同一药物的多晶型中,亚稳定型比稳定型的溶出速率与溶解度均大。
( )17.药物溶解度参数与生物膜的溶解度参数越接近,越易吸收,吸收也越快。
( ) 18.药物分子间的作用力大于药物分子与溶剂分子间的作用力则药物溶解度小。
( ) 19.介电常数大的药物其极性小,介电常数小的药物极性大。
( )20.对于可溶性药物,粒子大小对溶解度影响不大。
( )三、填空题1.药物分子间的作用力大于药物分子与溶剂分子间作用力时药物在该溶剂中的溶解度,反之,则。
2.药物分子形成分子内氢键,则在极性溶剂中的溶解度;而在非极性溶剂中的溶解度。
3.当药物的△H S>0,溶解度随温度升高而,当药物的△H S<0,溶解度随温度升高而。
药剂学知识点整理

第一章绪论一、药剂学的概念与任务药剂学:是研究药物制剂的基本理论、处方设计、制备工艺和合理应用的综合性技术科学.药物:能够用于诊断、缓解、治愈或预防疾病的化学物质.药品:药品是用于诊断、缓解、治愈或预防疾病的药物产品.药物剂型:为适应临床应用而制备的不同给药形式;是药剂学的核心药物制剂:为适应治疗或预防的需要而制备的不同给药形式的具体品种.制剂学:研究制剂制备工艺及其基本理论的科学.二、药剂学任务与主要研究内容1、药剂学基本理论:药物溶液的形成理论、表面活性剂、药物微粒分散系的基础理论、药物制剂的稳定性、粉体学基础、流变学基础、药物制剂的设计2、新剂型3、制剂新技术4、辅料:制剂必不可少的组成,没有辅料就没有制剂5、研发中药制剂6、生物技术药物特点:药理活性强,剂量小,药物本身毒副作用小;分子量大、稳定性差、吸收性差、半衰期短;提取、纯化工艺复杂,极易染菌、腐败,而失活,并产生热原或致敏物质,生产过程要求低温、无菌操作。
7、新机械和新设备三、药物剂型与药物传递系统1、药物剂型的重要性:是药物的传递体,是临床使用的最终形式。
不同的剂型产生不同治疗作用、作用速度、毒副作用,剂型可产生靶向作用2、药物剂型的分类(1)按给药途径:①经胃肠道给药剂型②经非胃肠道给药剂型(2)按分散系统:溶液型、胶体溶液型、乳剂型、混悬型、气体分散型、微粒分散型、固体分散型(3)按形态分类:液体制剂、气体制剂、固体制剂、半固体制剂(4)按制法分类:浸出制剂、无菌制剂3、药物传递系统(DDS)是能够改变药物动力学特征或/且能够起到储库作用的药物载体.DDS设计理念:把药物在必要的时间、以必要的量、输送到必要的部位,以达到最大疗效和最小毒副作用.四、辅料在药物制剂中的应用1、辅料的作用:①有利于制剂形态的形成;②使制备过程顺利进行;③提高药物的稳定性;④调节有效成分作用或改善生理要求药物辅料将继续向安全性、功能性、适应性、高效性等方向发展,并在实践中不断得到广泛应用。
执业药师考试《药剂学》考点练习题

执业药师考试《药剂学》考点练习题2017执业药师考试《药剂学》考点练习题考生们在备考执业药师考试《药剂学》科目过程中,要熟悉重要知识点,有针对性地进行备考,以下是店铺搜索整理的一份执业药师考试《药剂学》考点练习题,供参考练习,希望对大家有所帮助!想了解更多相关信息请持续关注我们店铺!药物溶液的形成理论1、将含非离子表面活性剂的水溶液加热至某一特定温度时,溶液会产生沉淀而浑浊,此温度称为A.熔点B.昙点C.冰点D.凝点E.闪点2、关于HLB值,下列叙述何者是错误的A.HLB值是代表乳化剂的亲水亲油平衡值B.HLB值是代表乳化剂亲水性和亲油性的比值C.HLB数值是表示乳化剂的亲水性质D.不同乳化剂混用时其HLB数值没有相加性E.常用的HLB值为1~203、最适于作疏水性药物润湿剂的HLB值是A.HLB值为15~18B.HLB值为7~9C.HLB值为1.5~3D.HLB值为3~6E.HLB值为13~154、属阴离子型表面活性剂的是A.吐温-80B.苯扎溴铵C.有机胺皂D.司盘-80E.卵磷脂5、具有Krafft点的表面活性剂是A.单硬脂酸甘油酯B.司盘C.肥皂类D.聚氧乙烯脂肪酸酯E.吐温6、有关表面活性剂的正确表述是A.表面活性剂的浓度要在I隐界胶束浓度(CMC)以下,才有增溶作用B.表面活性剂用作乳化剂时,其浓度必须达到临界胶团浓度C.非离子表面活性剂的HLB值越小,亲水性越大D.表面活性剂均有很大毒性E.阳离子表面活性剂具有很强的杀菌作用,故常用作杀菌和防腐剂7、以下表面活性剂毒性最强的是A.吐温80B.肥皂C.司盘20D.平平加0E.苯扎氯铵8、用吐温40(HLB值15.6)和司盘80(HLB值4.3)配制HLB值为9.2的混合乳化剂100g,两者各需A.43.4g 56.6gB.9.9g 9.9gC.50g 50gD.20g 80gE.60g 40g9、具有起昙现象的表面活性剂是A.卵磷脂B.肥皂C.吐温80D.司盘80E.泊洛沙姆18810、以下缩写中表示亲水亲油平衡值的是A.HLBB.GCPC.CMCD.MCCE.CMC-Na11、与表面活性剂乳化作用有关的性质是A.表面活性B.在溶液中形成胶束C.具有昙点D.在溶液表面做定向排列E.HLB值12、关于浊点的叙述正确的是A.浊点又称Krafft点B.是离子型表面活性剂的特征值C.是含聚氧乙烯基非离子型表面活性剂的特征值D.普朗尼克F-68有明显浊点E.温度达浊点时,表面活性剂的溶解度急剧增加13、表面活性剂由于能在油水界面定向排列而起A.乳化作用B.助溶作用C.增溶作用D.潜溶作用E.絮凝作用14、PluronicF68A.有起昙现象B.有起浊现象C.有Krafft点D.是非离子型表面活性剂E.是两性离子型表面活性剂15、吐温类表面活性剂溶血作用的顺序为A.吐温20>吐温60>吐温40>吐温80B.吐温80>吐温60>吐温40>吐温20C.吐温80>吐温40>吐温60>吐温20D.吐温40>吐温20>吐温60>吐温80E.吐温40>吐温80>吐温60>吐温2016、表面活性剂能够使溶液表面张力A.降低B.显著降低C.升高D.不变E.不规则变化17、具有临界胶团浓度是A.溶液的特性B.胶体溶液的特性C.表面活性剂的一个特性D.高分子溶液的特性E.亲水胶体的特性18、以下表面活性剂中,可作去污洗涤作用的是A.普朗尼克B.卖泽C.苄泽D.苯扎溴铵E.十二烷基硫酸钠19、氯化苯甲烃铵是一种杀菌的表面活性剂,在与下列何种药物相遇时可失效A.阳离子表面活性剂B.无机盐C.苷类D.皂类E.有机酸20、以下缩写中表示亲水亲油平衡值的是A.HLBB.GCPC.CMCD.MCCE.CMC-Na21、与表面活性剂乳化作用有关的性质是A.表面活性B.在溶液中形成胶束C.具有昙点D.在溶液表面作定向排列E.HLB值22、具有Krafft点的表面活性剂是A.单硬脂酸甘油酯B.司盘C.肥皂类D.聚氧乙烯脂肪酸酯E.吐温23、有关表面活性剂的正确表述是A.表面活性剂的浓度要在临界胶束浓度(CMC)以下,才有增溶作用B.表面活性剂用作乳化剂时,其浓度必须达到临界胶团浓度C.非离子表面活性剂的HLB值越小,亲水性越大D.表面活性剂均有很大毒性E.阳离子表面活性剂具有很强的杀菌作用,故常用作杀菌和防腐剂24、以下表面活性剂毒性最强的是A.吐温80B.肥皂C.司盘20D.平平加OE.苯扎氯铵25、用吐温40(HLB值15.6)和司盘80(HLB值4.3)配制HLB值为9.2的混合乳化剂100g,两者各需A.43.4g 56.6gB.9.9g 9.9gC.50g 50gD.20g 80gE.60g 40g26、表面活性剂能够使溶液表面张力A.降低B.显著降低C.升高D.不变E.不规则变化27、以下缩写中表示临界胶束浓度的是A.HLBB.GMPC.CMCD.MCE.CMS-Na28、具有起昙现象的.表面活性剂是A.卵磷脂B.肥皂C.吐温-80D.司盘-80E.泊洛沙姆188。
药剂学-第二章药物溶液形成理论

第二章药物溶液形成理论习题部分一、概念与名词解释1.介电常数:2.助溶剂:3.增溶剂:二、判断题(正确的填A,错误的填B)1.药物的介电常数和溶剂的介电常数越接近,药物在该溶剂中溶解性越好。
( ) 2.正辛醇的溶解度参数与生物膜脂质接近,因此常用作模拟生物膜测定分配系数。
( )3.通常所测定的溶解度是药物的特性溶解度。
( )6.将维生素K3制备成维生素K3,亚硫酸氢钠的目的是改变维生素K3的药理作用。
( ) 7.在多数情况下,药物的溶解度和溶解速度的顺序为无水物<水合物<有机化物。
( ) 8.粒子大小对药物溶解度的影响的规律是:药物粒子越小,药物的溶解度越大。
( ) 9.温度升高,药物的溶解度增大。
( )10.许多盐酸盐类药物在生理盐水中溶解度减小的原因是由于同离子效应。
( )11.苯巴比妥在20%乙醇中的溶解度为0.22g/100ml,在40%乙醇中的溶解度为0.88g/100ml,在90%乙醇中溶解度达最大值,这种现象称为潜溶。
( )12.碘溶解时加入碘化钾的目的是增溶。
( )13.灰黄霉素溶解时加人胆酸钠的目的是增溶。
( )14.药物溶液的pH值的调节主要考虑机体的耐受性、药物的稳定性及药物的溶解度。
( )15.药物的pK a越大,碱性越强。
( )16.同一药物的多晶型中,亚稳定型比稳定型的溶出速率与溶解度均大。
( )17.药物溶解度参数与生物膜的溶解度参数越接近,越易吸收,吸收也越快。
( ) 18.药物分子间的作用力大于药物分子与溶剂分子间的作用力则药物溶解度小。
( ) 19.介电常数大的药物其极性小,介电常数小的药物极性大。
( )20.对于可溶性药物,粒子大小对溶解度影响不大。
( )三、填空题1.药物分子间的作用力大于药物分子与溶剂分子间作用力时药物在该溶剂中的溶解度,反之,则。
2.药物分子形成分子内氢键,则在极性溶剂中的溶解度;而在非极性溶剂中的溶解度。
3.当药物的△H S>0,溶解度随温度升高而,当药物的△H S<0,溶解度随温度升高而。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第九章药物溶液的形成理论第一节药用溶剂的种类与性质一、药用溶剂的种类●极性溶剂●非极性溶剂●半极性溶剂(一) 极性溶剂●水是最常用的极性溶剂理化性质稳定,能与身体组织在生理上相适应,吸收快;水溶性药物多制备成水溶液。
极性溶剂二、药用溶剂的性质● 介电常数 (Dielectric constant)● 溶解度参数 (Solubility parameter) (一)介电常数● 在溶液中将相反电荷分开的能力,反映溶剂分子的极性大小。
● 介电常数大的溶剂极性大,介电常数小的溶剂极性小。
C0:在电容器中以空气为介质时的电容值,通常测得空气的介电常数接近1。
一些溶剂的介电常数 (20℃)C C =ε(一)介电常数● 溶质的溶解能力主要与溶质与溶剂间的相互作用力有关; ● 溶质与溶剂间的相互作用力主要表现在溶质与溶剂的极性、介电常数、溶剂化作用、缔合、形成氢键等,其中溶剂的介电常数大小顺序可预测某些物质的溶解性能。
(二) 溶解度参数● 表示同种分子间的内聚能,也是表示分子极性大小的一种量度; ● 溶解度参数越大,极性越大;● 溶剂或溶质的溶解度参数δi 式中,ΔUi :分子间的内聚能;Vi :物质在液态时的摩尔体积。
在一定温度下,分子间内聚能可从物质的摩尔气化热求得Vi :物质在液态时 T 温度下的摩尔体积; ΔHv :摩尔气化热; R :摩尔气体常数; T :热力学温度。
⏹ 由于溶解度参数δ表示同种分子间的内聚力,所以两种组分的δ值越接近,他们越溶剂 介电常数 溶剂 介电常数 H 2SO 4 110 C 4H 9OH 17.8 HCONH 2 109 C 5H 5N 12.5 H 2O 80.4 ClCH 2CH 2Cl 10.65 HCOOH 57.9 CH 3COOH 6.15 H 2NNH 2 53.0 C 6H 5Cl 5.71 HCON(CH 3 37.6 CHCl 3 5.00 CH 3OH 33.6 C 6H 6 2.28 C 2H 5OH 25.1 CCl 4 2.24 CH 3COCH 3 21.2 n-C 6H 141.89 (CH 3CO)2O20.021⎪⎪⎭⎫ ⎝⎛∆=i i i V U δRT H U v i -∆=∆21⎪⎪⎭⎫ ⎝⎛-∆=i v i V RT H δ⏹生物膜脂层的δ平均值为17.80 ±2.11,整个膜的δ平均值为21.07 ±0.82,很接近正辛醇的δ= 21.07;⏹正辛醇常用于求分配系数时模拟生物膜相的一种溶剂;⏹由于溶解度参数表示同种分子间的内聚力,所以两组分的δ值越接近,它们越易互溶。
第二节药物溶解度与溶出速度一、药物的溶解度(Solubility)●药物溶解度的表示方法溶解度:一定温度下药物溶解在溶剂中达饱和时的浓度,反映药物溶解性的重要指标;常用一定温度下100 g 溶剂中(或100 g 溶液,或100 ml 溶液)溶解溶质的最大克数表示,亦可用质量摩尔浓度mol/kg 或物质的量浓度mol/L 表示。
(二) 溶解度的测定方法●药物的特性溶解度测定法药物的特性溶解度:指药物不含任何杂质,在溶剂中不发生解离或缔合,也不发生相互作用时所形成饱和溶液的浓度,是药物的重要物理参数之一。
特性溶解度的测定方法●某药物溶解度约为1 mg/ml,测定其特性溶解度配制四种浓度的溶液,即分别将3、6、12、24 mg 药物溶于3 ml 溶剂中,装入安瓿,计算药物质量(mg)与溶剂用量(ml)之比,即药物质量-溶剂体积的比率分别为1、2、4、8;将配制好的溶液恒温持续振荡达到溶解平衡,测定药物在饱和溶液中的浓度;以测得药物溶液浓度为纵坐标,药物质量-溶剂体积的比率为横坐标作图,直线外推到比率为零处即得药物的特性溶解度。
特性溶解度测定曲线药物的平衡溶解度测定法●药物的溶解度数值多是平衡溶解度,测量的具体方法是:取数份药物,配制从不饱和溶液到饱和溶液的系列溶液,置恒温条件下振荡至平衡,经滤膜过滤,取滤液分析,测定药物在溶液中的实际浓度S 并对配制溶液浓度 C 作图平衡溶解度测定曲线(三) 影响药物溶解度的因素●药物溶解度与分子结构●药物分子的溶剂化作用与水合作用●药物的多晶型与粒子的大小●温度的影响●pH 与同离子效应●混合溶剂的影响●填加物的影响1. 药物溶解度与分子结构●药物分子在溶剂中的溶解度是药物分子与溶剂分子间的分子间作用力相互作用的结果;●若药物分子间的作用力大于药物分子与溶剂分子间作用力则药物溶解度小;反之,溶解度大●结构相似物质易互溶●氢键对药物溶解度影响较大,在极性溶剂中,如果药物分子与溶剂分子之间可以形成氢键,则溶解度增大;●药物分子形成分子内氢键,则在极性溶剂中溶解度减小,而在非极性溶剂中溶解度增大。
2. 药物分子的溶剂化作用与水合作用●药物离子的水合作用与离子性质有关, 阳离子和水分子之间的作用力很强,以至于阳离子周围保持有一层水。
●水分子极化决定因素:离子大小、离子表面积。
●离子的水合数目随离子半径增大而降低,是由于半径增加,离子场削弱,水分子容易从中心离子脱离的缘故。
●一般单价阳离子结合4 个水分子。
● 药物溶剂化影响药物在溶剂中的溶解度。
3. 药物的多晶型与粒子的大小● 多晶型的影响同一化学结构的药物,由于结晶条件(如溶剂、温度、冷却速度等)不同,形成结晶时分子排列/晶格结构不同,因而形成不同的晶型,产生多晶型。
晶型不同,导致晶格能不同,药物的熔点、溶解速度、溶解度等也不同。
例如:维生素 B2 有三种晶型,在水中溶解度分别为Ⅰ型 60 mg/L ;Ⅱ型 80 mg/L ;Ⅲ 型 120 mg/L 。
无定型 (Amorphous forms)● 无结晶结构的药物,无晶格束缚,自由能大,溶解度和溶解速度较结晶型大。
一般溶解度:无定型>亚稳定型>稳定型例如:新生霉素在酸性水溶液中形成无定型,其溶解度比结晶型大10倍,溶出速度也快,吸收也快。
假多晶型 (Pseudopolymorphism)● 药物结晶过程中,溶剂分子进入晶格使结晶型改变,形成药物的溶剂化物,如溶剂为水即为水合物。
● 溶剂化物与非溶剂化物的熔点、溶解度和溶解速度等物理性质不同,是因为结晶结构的改变影响晶格能所致。
● 在多数情况下,溶解度和溶解速度按 水合物<无水物<有机化物的顺序排列。
粒子大小的影响● Ostwald-Freundlich 方程:S1 和 S2:粒子半径为 r1 和 r2 时的溶解度; ρ:固体药物的密度;T :热力学温度; σ:固体药物与液态溶剂之间的界面张力; M :药物的分子量;R :摩尔气体常数。
4. 温度的影响● 温度对溶解度影响取决于溶解过程是吸热ΔHs>0,还是放热ΔHs<0 当ΔHs>0时溶解度随温度升高而升高; 如果ΔHs<0时溶解度随温度升高而降低。
溶解度与温度的关系S1、S2:分别在温度T1和T2下的溶解度; ΔHs :溶解焓,J/mol ; R :摩尔气体常数;若已知溶解焓ΔHs 与某一温度下的溶解度 S1,则可求得 T2 下的溶解度 S2。
5. pH 与同离子效应● pH 影响对于弱酸性药物,若已知 pKa 和 S0⎪⎪⎭⎫⎝⎛-=1212112lg r r RT M S S ρδ⎪⎪⎭⎫ ⎝⎛-∆=211211ln T T R H S Ss对于弱碱性药物,若已知 pKa 和 S0(2) 同离子效应● 若药物的解离型或盐型是限制溶解的组分,则其在溶液中的相对离子的浓度是影响该药物溶解度大小的决定因素。
● 一般向难溶性盐类饱和溶液中,加入含有相同离子化合物时,其溶解度降低,这是由于同离子效应的影响。
● 如许多盐酸盐类药物在0.9%氯化钠溶液中的溶解度比在水中低。
6. 混合溶剂的影响● 当混合溶剂中各溶剂在某一比例时,药物的溶解度与在各单纯溶剂中的溶解度相比,出现极大值,该现象称为潜溶 (cosolvency),该溶剂称为潜溶剂。
● 潜溶剂提高药物溶解度的原因两种溶剂间发生氢键缔合,有利于药物溶解; 潜溶剂改变了原来溶剂的介电常数。
⏹ 如乙醇和水或丙二醇和水组成的潜溶剂均降低了水的介电常数,增加对非解离药物的溶解度⏹ 一个好的潜溶剂其介电常数一般为25~80。
7. 填加物的影响● 加入助溶剂 ● 加入增溶剂 (1) 加入助溶剂● 助溶或助溶剂(hydrotropy):难溶性药物与加入的第三种物质在溶剂中形成可溶性分子间的络合物、复盐或缔合物等,以增加药物在溶剂(主要是水)中的溶解度。
● 助溶剂可溶于水,多为低分子化合物(不是表面活性剂),与药物形成的络合物。
(2) 加入增溶剂● 增溶 (solubilization):某些难溶性药物在表面活性剂的作用下,在溶剂中溶解度增大并形成澄清溶液的过程。
● 增溶剂 (solubilizer) :具有增溶能力的表面活性剂。
● 增溶质(solubilizates):被增溶的物质。
● 表面活性剂之所以能增加难溶性药物在水中的溶解度,是由于表面活性剂在水中形成“胶团” (micelles) 的结果。
增溶机理示意图0lgS S S pK pH a m -+=00lgS S S pK pH a m -+=━:增溶质; 1、2、3:离子型表面活性剂;4:含聚氧乙烯基的非离子表面活性剂胶团 二、溶出速度及影响溶出速度的因素 (一) 药物的溶出速度单位时间单位面积上药物溶解进入溶液主体的量。
固体溶解示意图Noyes-Whitney 方程()C C KA dtdCS -=dC/dt :溶出速度; A :固体的表面积;C s :溶质在溶出介质中的溶解度;D :溶质在溶出介质中的扩散系数; V :溶出介质的体积;VhD K =(二) 影响溶出速度的因素● 固体的表面积(充分粉碎减小A) ● 温度(提高温度) ● 溶出介质的体积 ● 扩散系数 (提高温度)● 扩散层的厚度(搅拌,减小h) 第三节 药物溶液的性质与测定方法● 药物溶液的渗透压● 药物溶液的 pH 与 pKa 测定 ● 药物溶液的表面张力 ● 药物溶液的粘度 ● 药物溶液的澄清度 一、药物溶液的渗透压(一)渗透压(Osmotic pressure)药物溶液中溶剂分子可自由通过半透膜,药物分子不通过,膜的一侧为溶液,另一侧为溶剂,溶剂进入膜内溶液中达到渗透平衡,此时两侧温度相等,两侧产生压力差,此压力差,即为溶液的渗透压Van’t Hoff 公式● 非电解质稀溶液的渗透压可用Van’t Hoff 公式计算:π= mRT m :药物溶液的质量摩尔浓度(mol/kg);R :摩尔气体常数; T :热力学温度。
● 渗透压是溶液的依数性质;溶液渗透压的大小取决于溶液中的质点数目。
