抗体纯化大全资料
抗体纯化工艺

抗体纯化工艺一、概述抗体纯化工艺是制备高纯度、高活性抗体的关键步骤之一。
该工艺包括多个步骤,如细胞培养、抗体捕获、杂质去除和抗体纯化等,旨在获得纯度高、活性好的抗体产品。
本文将详细介绍抗体纯化工艺的各个步骤及相关技术方法。
二、细胞培养1.细胞株选择–选择适合抗体生产的细胞株,如CHO细胞、HEK293细胞等。
–考虑细胞株的稳定性、表达水平和生长特性等因素。
2.培养基配方优化–根据细胞株要求,优化培养基的成分,如碳源、氮源、生长因子等。
–添加适量的抗生素保持培养的无菌状态。
3.培养条件控制–控制培养室的温度、湿度和二氧化碳浓度等参数。
–定期检测培养液的pH值和溶氧含量,并进行适当调整。
三、抗体捕获1.细胞收获–选择最佳的细胞收获时间点,通常在细胞进入衰老期前进行。
–使用适当的方法(如离心、超滤等)将培养液中的细胞分离出来。
2.细胞破碎–使用机械方法或化学方法将细胞破碎,释放抗体和细胞内组分。
–注意选择合适的破碎条件,以保持抗体的完整性和活性。
四、杂质去除1.固体杂质的去除–使用离心、滤膜等方法去除细胞碎片、沉淀和残留的细胞碎片等固体杂质。
–选择合适的离心速度和滤膜孔径,以避免抗体的损失。
2.溶液杂质的去除–使用离子交换、凝胶过滤、亲和层析等方法去除溶液中的蛋白质、DNA、RNA等杂质。
–根据目标抗体的特性选择合适的去除方法。
五、抗体纯化1.亲和层析–使用亲和介质(如蛋白A、蛋白G、蛋白L等)将目标抗体从其他成分中分离出来。
–根据目标抗体的种类选择合适的亲和介质。
2.离子交换层析–利用抗体与离子交换介质之间的电荷相互作用进行分离。
–通过调整pH值、盐浓度等参数来实现对抗体的选择性吸附和洗脱。
3.凝胶过滤层析–利用凝胶过滤介质的孔径大小选择性地分离抗体。
–根据抗体的分子量和亲和性选择合适的凝胶过滤介质。
4.逆流色谱–利用逆流色谱技术实现对抗体的纯化和富集。
–通过改变流动相和温度等条件来调节抗体与逆流色谱介质之间的相互作用。
抗体纯化

一、抗体纯化部分1、腹水/血清的亚型测定完成后,IgG亚型的腹水/血清使用Protein G 抗体纯化柱纯化;IgM亚型的腹水/血清则使用饱和硫酸铵沉淀法沉淀。
1.1 Protein G 抗体纯化步骤:(1)新柱子先用DDW 5ml过柱;(2)10倍柱体积的Binding Buffer (pH 7.0) 平衡纯化小柱;(3)抗体过柱,过程中要求缓慢过柱,以求抗体蛋白更好的结合在结合位点上;(4)继续10倍柱体积的Binding Buffer (pH 7.0) 平衡纯化小柱;(5)5倍柱体积甘氨酸-盐酸缓冲液(pH 2.7)洗脱结合位点上的抗体,并加入Tris-HCI(pH9.0)中和甘氨酸,使pH保持为适合抗体保存的中性;(6)10倍柱体积的Binding Buffer (pH 7.0) 平衡纯化小柱;(7)5倍柱体积20%乙醇溶液过柱,于4℃条件下保存纯化小柱;(8)将洗脱的抗体用聚乙二醇浓缩并透析,以彻底去除不相干离子。
其中所用试剂配方:DDW:超纯水Binding Buffer(100ml):A液,0.2M磷酸氢二钠61mlB液,0.2M磷酸二氢钠39ml磷酸氢二钠4.37g 磷酸二氢钠1.22g甘氨酸-盐酸缓冲液:0.1M甘氨酸溶液加浓盐酸调pH 2.7Tris-HCL缓冲液:1M Tris溶液加浓盐酸调pH 9.01.2 饱和硫酸铵沉淀法步骤:(1)配制饱和硫酸铵溶液,再用氨水调节pH至8.5(2)沉淀:a、腹水/血清离心去除细胞碎片,保留上清液并测定体积;b、边搅拌边逐滴滴入等体积的饱和硫酸铵溶液,搅拌均匀使蛋白充分沉淀;c、上述蛋白质溶液经过离心弃上清取沉淀,并用PBS溶液(pH 7.0)溶解;d、继续向上一步蛋白溶液中滴入1/2体积的饱和硫酸铵溶液,搅拌均匀使蛋白充分沉淀;e、继续离心沉淀弃上清去沉淀,用PBS溶液(pH 7.0)溶解;(3)透析:每隔3-6小时换一次透析液,以彻底去除硫酸铵。
抗体纯化方法

抗体纯化方法1. 引言抗体是一类免疫蛋白,具有识别和结合特定抗原的能力。
在生物医学研究和临床应用中,纯化高质量的抗体是非常重要的。
抗体纯化方法可以去除杂质,提高抗体的纯度和活性,从而提高其应用效果。
本文将介绍几种常见的抗体纯化方法。
2. 凝胶过滤层析法凝胶过滤层析法是一种基于分子大小的纯化方法。
该方法利用不同孔径的凝胶过滤介质,将目标分子(如抗体)与较大分子(如蛋白质杂质)分离开来。
具体操作步骤如下:1.将含有目标抗体的混合物加入到预先平衡好的凝胶柱中。
2.使用缓冲液进行洗脱,使较大分子无法通过凝胶柱而流出。
3.目标抗体由于分子大小适中,能够通过凝胶柱被保留下来。
4.最后使用洗脱缓冲液将目标抗体从凝胶柱中洗脱出来,得到纯化的抗体。
凝胶过滤层析法的优点是简单易行,不需要特殊设备,且适用于各种规模的实验室。
但其缺点是分离效率较低,只能实现较为粗略的纯化。
3. 亲和层析法亲和层析法是一种基于生物分子之间特异性相互作用的纯化方法。
该方法利用抗体与抗原之间的特异性结合来实现目标抗体的纯化。
具体操作步骤如下:1.将含有目标抗体的混合物加入到预先包含特异性结合配体(如蛋白A、蛋白G等)的亲和层析柱中。
2.目标抗体与配体之间发生特异性结合。
3.使用洗脱缓冲液将非特异结合的组分洗脱掉。
4.最后使用洗脱缓冲液将目标抗体从亲和层析柱中洗脱出来,得到纯化的抗体。
亲和层析法具有高选择性和高效率的优点,能够得到高纯度的抗体。
但其缺点是需要特定的亲和剂和配体,成本较高。
4. 离子交换层析法离子交换层析法是一种基于生物分子表面电荷的纯化方法。
该方法利用目标抗体与离子交换柱中固定的离子之间的相互作用来实现纯化。
具体操作步骤如下:1.将含有目标抗体的混合物加入到预先平衡好的离子交换柱中。
2.使用缓冲液进行洗脱,使与固定离子相同电荷的分子无法通过离子交换柱而流出。
3.目标抗体由于表面电荷不同,能够通过离子交换柱被保留下来。
4.最后使用洗脱缓冲液改变pH或盐浓度等条件,将目标抗体从离子交换柱中洗脱出来,得到纯化的抗体。
抗体纯化技术

抗体纯化技术抗体纯化技术是生物技术领域中应用最广泛的技术之一。
它是利用分子特异性相互作用,将杂质分离排除,从而获得纯度高、活性好、病原体清除率高的抗体制备过程的一种技术。
抗体纯化技术广泛应用于药物研发、分子诊断、分子生物学实验、生物检测等领域。
本文将从抗体的制备、分离、纯化三个角度,分别介绍抗体纯化技术的原理及其常用的纯化方法。
一、抗体的制备抗体的制备可以通过两种方式:1、动物免疫法;2、体外合成法。
动物免疫法是指通过注射一定量的抗原,在动物身上诱导其产生抗体,并从动物的血清中提取抗体。
体外合成法是利用原位合成策略,在细胞话表达体系或酵母菌上表达人工合成的抗体,再通过对产物的纯化和反应性测定,获得抗体制备。
二、抗体的分离抗体的分离需要依托一些特异性官能团与抗体的结合作用,如离子交换、亲和层流、凝胶过滤、凝胶电泳、超滤等。
其中,离子交换和亲和层流是目前用的最广泛的方法之一,可快速、高效地达到抗体分离的目的。
1、离子交换:离子交换是指利用固定在某种阵列上的一种或多种离子交换基团,以官能基团与抗体的分子手性的作用进行分离。
该方法分为阳离子交换和阴离子交换,它利用离子交换层的低份子量来固定和选择性地分离抗体及其杂质。
2、亲和层流:层流法是根据不同抗体的特异性分离的一种方法,抗体与特定抗原结合后,可采用层流法对其进行分离。
该方法分为亲和层流和亲合层流两种类型,前者是指利用抗体与其特定抗原之间的特异性,通过抗原固定在材料上,进行互补反应,以分离有治疗功效或有用的抗体;后者则是指利用抗体与其一些非特定抗原结合的作用,来对所有的抗体进行纯化,比如利用蛋白A的亲和性提取IgG。
三、抗体的纯化抗体的纯化主要包括离子交换、亲和层流、凝胶过滤、凝胶电泳、超滤等。
在这些纯化方法中,离子交换、亲和层流、凝胶过滤被广泛应用于抗体纯化中。
1、离子交换:融合相对较低的离子浓度和相对较强的取向共价键作用,利用离子交换基团将抗体和杂质分离。
抗体纯化工艺

抗体纯化工艺一、引言抗体是一种重要的生物大分子,具有广泛的应用前景。
在许多领域中,如医学、生物技术和生命科学等方面都有着重要的应用。
抗体的纯化是研究和应用这些分子的基础,因此抗体纯化工艺显得尤为重要。
二、抗体纯化工艺流程1. 细胞培养及收获细胞培养是抗体制备的第一步,通常使用哺乳动物细胞系来表达目标蛋白。
细胞培养条件包括温度、CO2浓度、营养成分和培养基等。
当细胞达到最大密度时,可以进行收获。
收获后将细胞离心并取下上清液。
2. 亲和层析亲和层析是最常用的抗体纯化方法之一。
它利用特定配体与目标分子之间的亲和作用,将目标分子从混合物中选择性地吸附到固相材料上。
例如,使用含有蛋白A或蛋白G的树脂来选择性地捕捉IgG类别的抗体。
3. 尺寸排除层析尺寸排除层析是一种基于分子大小的分离方法。
它利用不同分子大小的抗体在树脂中的渗透性差异,从而实现对目标分子的纯化。
尺寸排除层析通常用于去除杂质,如细胞碎片、DNA和RNA等。
4. 离子交换层析离子交换层析是一种利用不同离子性质进行分离的方法。
在这种方法中,树脂表面上带有正负电荷的功能团能够与目标抗体中带有相反电荷的部位结合。
通过调节pH或盐浓度,可以实现目标抗体与树脂之间的选择性结合和解离。
5. 亲水性交换层析亲水性交换层析是一种基于溶液中物质亲水/疏水特性进行分离的方法。
它利用具有不同亲水性质的树脂来选择性地捕捉和纯化目标抗体。
6. 逆流色谱逆流色谱是一种高效液相色谱技术,在抗体制备中也有广泛应用。
它可以快速地分离和纯化目标抗体,并且可以在大量样品中进行高通量分析。
7. 超滤超滤是一种利用膜过滤器进行分离和纯化的方法。
它可以去除大分子杂质,如细胞碎片、DNA和RNA等,从而提高目标抗体的纯度。
三、结论抗体纯化工艺是抗体制备中不可或缺的一部分。
通过合理地设计和选择不同的纯化方法,可以实现高效、快速和经济地纯化目标抗体。
在实际应用中,需要根据具体情况选择合适的工艺流程,并进行优化和改进,以提高抗体的产量和质量。
4种常用抗体分离纯化工艺介绍

4种常用抗体分离纯化工艺介绍抗体分离纯化的主要目的是将抗体与工艺相关杂质和产品相关杂质分离,最终获得高纯度、低潜在危害的抗体药物。
纯化过程中需要去除的工艺相关杂质包括细胞、细胞碎片、宿主细胞蛋白、宿主细胞核酸及培养基与加料液成分,需去除的产品相关杂质主要包括抗体片段和聚集体。
纯化过程还需具备足够的病毒灭活去除能力,以去除宿主细胞自身表达的内源病毒样颗粒和未及时发现的外源病毒。
大多数工艺利用ProteinA来捕获抗体,并利用了至少1个离子交换层析作为精纯步骤,仅少数工艺使用了疏水、羟基磷灰石和分子筛层析等步骤。
下图中显示了一个常见的抗体纯化工艺。
反应器收获液首先经过离心和过滤,去除细胞和细胞碎片,然后经过ProteinA层析捕获抗体,捕获后的抗体经低pH孵育后,通过两个离子交换层析进行精纯,然后进行病毒过滤,最后换液并调整抗体浓度,得到抗体原液。
工艺中的低pH孵育和病毒过滤是两个正交的专属病毒去除灭活步骤。
这两个专属步骤与层析步骤一起,可大大降低原液中可能存在的病毒数目。
工艺中的低pH孵育和病毒过滤是两个正交的专属病毒去除灭活步骤。
这两个专属步骤与层析步骤一起,可大大降低原液中可能存在的病毒数目。
抗体分离纯化工艺其中最常用的四种纯化方法,也就是今天的主角“四大名捕”。
我们接着往下看吧。
1、Protein A从原核金黄色葡萄球菌细胞壁分离的结合受体Protein A(~56kDa)与不同免疫球蛋白同型的Fc区以及人VH3家族的Fab区具有高度的亲缘关系。
进一步研究表明,Protein A仅限于与IgG亚类IgG1、IgG2和IgG4结合,与IgG3的反应性很低,约占总IgG的8%。
天然的Protein A有5个IgG结合结构域和未知功能的非Fc结合域,结构示意图如下:Protein A的结构域示意图此结构的Protein A大量结合IgG的同时,其非Fc结合域能结合部分杂蛋白,导致洗脱下来的IgG纯度不够,因此科学家利用基因工程的方法克隆Protein A 的基因并进行改造,得到重组型Protein A,其非特异性结合明显降低。
抗体纯化的方法有哪些

抗体纯化的方法有哪些抗体纯化是一种将杂质和其他成分从混合物中分离出抗体的过程。
采用不同的方法可以实现抗体的纯化,具体方法取决于纯化过程中抗体与其他成分之间的特定相互作用。
以下是常见的抗体纯化方法:1. 亲和层析(Affinity chromatography):基于抗体与目标抗原之间的高特异性结合作用。
可以使用结合在固定支持介质上的目标抗原来精确地捕获抗体。
2.蛋白A、蛋白G和蛋白L亲和层析:这些层析方法基于蛋白质和抗体之间的亲和性。
蛋白A、蛋白G和蛋白L是一类结合在细菌细胞壁上的蛋白质,它们与抗体Fc区域的不同部位结合,因此可以用于从混合物中富集抗体。
3. 离子交换层析(Ion exchange chromatography):基于抗体与离子交换基质之间的相互作用来实现分离纯化。
通过调节溶液的pH值,可以控制离子交换基质上的电荷,从而实现对抗体的选择性捕获。
4. 尺寸排阻层析(Size exclusion chromatography):通过根据抗体与其他分子的大小差异来实现分离纯化。
大分子如抗体会快速通过填充在柱内的孔隙,而较小分子则会被孔隙所限制,因此可以通过尺寸选择性地捕获和纯化抗体。
5. 亲和吸附(Affinity adsorption):用于捕获抗体的固定介质上表面共价或非共价地固定目标抗原,然后将混合物通过固定介质,使抗体与目标抗原相互作用,并通过洗涤和再生步骤来清除杂质。
6.电泳分离:电泳是基于分子在电场中迁移速率的差异来实现纯化的方法。
通过电泳可以将抗体与其他成分分离开来。
7.沉淀和沉降:使用盐类、有机溶剂或其他物质来促使抗体的沉淀或沉降,然后可以通过离心等方法将其与上清液分离开。
8. 磷酸铵沉淀(Ammonium sulfate precipitation):将逐渐增加浓度的磷酸铵加入混合物中,使抗体产生沉淀,在沉淀过程中可以通过离心等方法将其分离出来。
9. 过滤法(Filtration):通过使用滤膜和适当的压力或真空来分离大分子(如抗体)和小分子。
抗体的纯化与检测详细版

注意事项:选择 合适的荧光标记 抗体避免非特异 性结合
抗体纯化与检测的应 用
疾病诊断
抗体检测:通过检测抗体水平判断疾病状态 抗体纯化:提高抗体检测的准确性和灵敏度 抗体检测的应用:用于诊断多种疾病如传染病、肿瘤等 抗体纯化的应用:提高抗体检测的特异性和灵敏度降低假阳性和假阴性率
药物研发
抗体纯化与检测在药物研发中的作用:提高药物的疗效和安全性 抗体纯化与检测在药物研发中的具体应用:抗体筛选、抗体工程、抗体药物研发等 抗体纯化与检测在药物研发中的技术难点:抗体的纯化、抗体的检测、抗体的稳定性等 抗体纯化与检测在药物研发中的发展趋势:抗体药物的个性化治疗、抗体药物的靶向治疗等
步骤:样品制备、 电泳分离、转膜、 封闭、抗体孵育、 显色、结果分析
优点:灵敏度高、 特异性强、操作 简便、结果直观
应用:广泛应用 于蛋白质表达分 析、疾病诊断、 药物研发等领域
流式细胞术
原理:利用荧光 标记抗体通过流 式细胞仪检测细 胞表面抗原
优点:快速、灵 敏、准确
应用:免疫学、 肿瘤学、血液学 等领域
根据实验目的选 择检测方法:如 定量检测、定性 检测等
实验数据的分析和解读
数据的完整性:确保实验数 据的完整性避免遗漏和缺失
数据的时效性:确保实验数 据的时效性避免过时和失效
实验数据的准确性:确保实 验数据的准确性避免误差和 偏差
数据的解读:根据实验数据 进行合理的分析和解读得出
结论和结论
感谢您的耐心观看
生物科学研究
抗体纯化与检测在 生物科学研究中的 重要性
抗体纯化与检测在 生物科学研究中的 应用实例
抗体纯化与检测在 生物科学研究中的 发展趋势
抗体纯化与检测在 生物科学研究中的 挑战与机遇
抗体纯化手册-
单抗表达量可达 1-2g/L。 类等等。Protein A Protein A 亲和层析如 MabSelect 做快速初纯,再配合疏水层析、分子筛
亲和层析脱落集团。 等多步纯化。
利用基因工程技术表达人源 宿主杂蛋白、核酸、 若以 E.coli 包涵体形式表达,可考虑用 Sepharose 4FF 先纯化包涵体,再
2. 癌症、心血管等疾病的导向治疗:以单抗荷载同位素、 毒素蛋白、抗生素等药物制成生物导弹。
3. 应用抗体 T 细胞、抗 IL-2R 的单抗防治器官移植排斥反 应等。
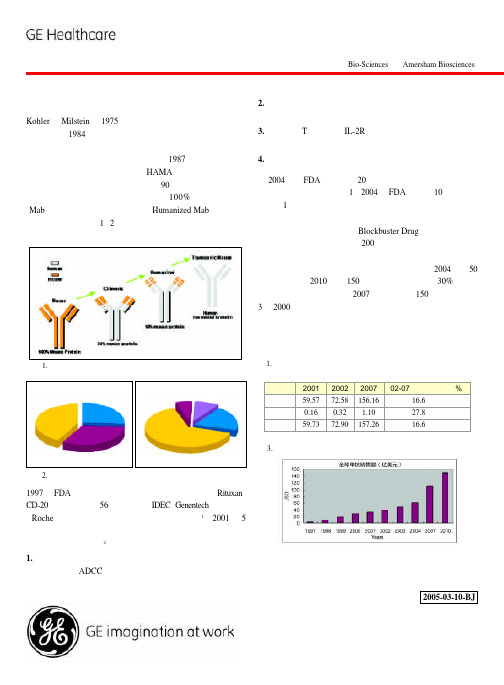
的结构域可以识别和结合特异性抗原。1987 年单抗技术被成 4. 以单抗制成避孕、传染病的预防药物。
功应用到诊断试剂当中,但由于 HAMA (人抗鼠抗体) 反应, 没能有效应用在人类疾病的治疗上。90 年代,随着基因工程 技术的迅速发展,治疗性单抗从早期 100% 的鼠源性单抗 (Mab),到嵌合抗体,人源化抗体(Humanized Mab),到近年 的全人源性抗体 (图1、2),逐步消除了抗体的免疫源性问题, 在保持对抗原高亲和力的同时,改善了抗体的药动力学。
大多数 IgG 等电点高于一般血清蛋白,建议用阳离子交换层析 3 捕获浓缩抗体或分离纯化
大部分超过 pH6
除去大部分杂蛋白 (图 5)。注意:CHO 细胞表达的基因工程抗体 (Gab) 由于细胞培养过程
带来的糖基化的不均一,等电点往往较分散 (图 5),选择离子交换层析条件时须注意。
疏水性
大多数 IgG 疏水性较强
抗体纯化手册
孙文改 陈昕·通用电气(中国)医疗集团 Bio-Sciences (原 Amersham Biosciences)
一、单抗技术的发展、应用和市场前景
Kohler 和 Milstein 于 1975 年发明了被称之为“魔弹”的单抗 技术,并在1984 年获得了诺贝尔奖。单抗是B淋巴细胞和骨 髓瘤细胞杂交形成的杂交瘤细胞产生,其重链和轻链所形成
单克隆抗体纯化方法

单克隆抗体纯化方法
以下是几种常见的单克隆抗体纯化方法:
1. 亲和层析:利用抗体与特定配体的亲和力进行纯化,例如使用Protein A 或 Protein G 亲和层析来捕获抗体。
2. 凝胶过滤层析:根据抗体分子大小进行分离,可以去除较小的杂质。
3. 离子交换层析:基于抗体的电荷性质进行分离,适用于去除带电荷的杂质。
4. 疏水相互作用层析:利用抗体的疏水性进行纯化,可有效去除亲水性杂质。
5. 亲和洗脱层析:通过改变洗脱条件,如离子强度或 pH 值,从亲和层析柱上洗脱目标抗体。
6. 盐析和透析:通过在高盐浓度下沉淀杂质,然后通过透析去除盐分,实现抗体的纯化。
7. 超速离心:利用离心力将抗体与其他杂质分离开来,适用于大规模制备。
这些方法可以单独或联合使用,以获得高纯度的单克隆抗体。
选择合适的纯化方法取决于抗体的特性和所需的纯度水平。
需要注意的是,在进行单克隆抗体纯化时,应严格遵循实验操作规程,并在适当的条件下进行质量控制和检测,以确保获得高质量的抗体产品。
抗体纯化方式

抗体纯化方式抗体纯化是从混合物中分离出单一抗体的过程。
该过程包括多个步骤,其中一些步骤是特定于某种抗体的,而其他步骤是适用于各种不同的抗体。
下面将介绍几种常用的抗体纯化方式。
1.亲和层析:亲和层析是最常用的抗体纯化技术之一。
该技术涉及使用特定的亲和剂来吸附目标抗体。
通常使用亲和剂与目标抗体分子之间的相互作用来实现吸附。
最常用的亲和剂是具有与抗体结合特异性的抗原。
在亲和层析中,杂质成分会快速流过树脂,而目标抗体会与聚合物中的相应亲和剂结合并保留在材料中。
接下来,可以使用洗脱剂从树脂上洗出目标抗体。
2.离子交换层析:离子交换层析可用于强制目标抗体通过含有逆离子的树脂以进行附着。
该技术将目标抗体与树脂上的离子交换树脂相互作用,从而实现抗体的分离和纯化。
离子交换层析可分为阳离子交换和阴离子交换两种类型。
在该过程中,目标抗体在树脂上强附着,而非目标抗体则流经树脂,因为它们与树脂的亲和力较低。
3.凝胶过滤:凝胶过滤是一种基于分子量的方法,可用于将目标抗体与其他高分子化合物分离。
在这种方法中,最初的混合物通过一种聚合物凝胶柱,分子量较大的组分无法通过凝胶,因此被分离并保留在柱中。
目标抗体分子量较小,因此可以通过凝胶流出。
4.透析:透析是一种渐进性的纯化技术,可以用于除去小分子化合物和无用的杂质,包括离子、杂质蛋白质和难溶杂质。
该过程包括使用透析袋和具有特定分子截止率的孔径尺寸的膜,并将混合物与缓冲溶液混合。
由于混合物中小分子量的组分比大分子量分子经透析膜逃逸的速度快,因此它们会在膜表面生成梯度,并被移除。
目标抗体粘附在透析袋内仍然存在。
总之,每个纯化步骤都有其优缺点,在选择纯化过程时,必须考虑到抗体的理化性质以及最终的应用目的。
一个成功的抗体纯化过程需要高纯度、高产量和快速操作的平衡。
抗体分离纯化实验报告

一、实验目的1. 学习抗体分离纯化的原理和方法。
2. 掌握蛋白A亲和层析、离子交换层析等常用分离纯化技术。
3. 提高实验操作技能,提高抗体纯度。
二、实验原理抗体分离纯化是指从复杂的生物样品中提取、分离和纯化目标抗体。
常用的分离纯化方法有蛋白A亲和层析、离子交换层析、凝胶过滤层析等。
本实验采用蛋白A亲和层析和离子交换层析相结合的方法,以提高抗体的纯度。
三、实验材料1. 抗体样品:经培养的杂交瘤细胞上清液。
2. 蛋白A亲和层析柱:Protein A Chromatography Column。
3. 离子交换层析柱:Sephadex G-25。
4. 离心机、冰箱、超声波破碎仪、移液器、滤纸等。
四、实验方法1. 蛋白A亲和层析(1)将抗体样品经0.02M PBS(pH 7.4)平衡蛋白A亲和层析柱。
(2)将抗体样品上柱,流速控制在1ml/min。
(3)用0.02M PBS(pH 7.4)洗涤柱,去除非特异性结合的蛋白。
(4)用含有0.1M甘氨酸-HCl(pH 3.0)的溶液洗脱结合的抗体,流速控制在1ml/min。
(5)收集洗脱峰,得到纯化的抗体。
2. 离子交换层析(1)将纯化的抗体样品经0.02M PBS(pH 7.4)平衡Sephadex G-25层析柱。
(2)将抗体样品上柱,流速控制在1ml/min。
(3)用0.02M PBS(pH 7.4)洗涤柱,去除小分子物质。
(4)用0.1M NaCl溶液洗脱结合的抗体,流速控制在1ml/min。
(5)收集洗脱峰,得到高纯度的抗体。
五、实验结果1. 蛋白A亲和层析:洗脱峰中抗体浓度明显升高,纯度提高。
2. 离子交换层析:洗脱峰中抗体浓度进一步升高,纯度达到95%以上。
六、实验讨论1. 本实验采用蛋白A亲和层析和离子交换层析相结合的方法,提高了抗体的纯度。
2. 在实验过程中,注意控制流速、pH值等条件,以获得最佳分离效果。
3. 本实验结果可为抗体分离纯化提供参考,有助于提高抗体质量。
单克隆抗体纯化

单克隆抗体的纯化一、简介抗体或免疫球蛋白(Ig)是B 淋巴细胞针对暴露于外源抗原后产生的独特的可溶性糖蛋白。
通常可从血浆(占总蛋白20%),血清,腹水,细胞培养基,蛋黄,植物提取物或细菌和酵母培养物中分离得到抗体。
常用于纯化的材料主要以腹水和细胞培养上清为主。
单抗纯化方式常用的技术:DEAE 离子交换层析柱,凝胶过滤法和亲和层析。
二、技术方法及原理(一)单抗粗提1.硫酸铵沉淀法(1)原理:高浓度的盐离子在蛋白质溶液中可与蛋白质竞争水分子,从而破坏蛋白质表面的水化膜,降低其溶解度,使之从溶液中沉淀出来。
各种蛋白质的溶解度不同,故可利用不同盐浓度来沉淀不同蛋白质,硫酸铵因其溶解度大,温度系数小,不易使蛋白质变性而应用广泛。
(2)方法:①若样本体积较小,可配置100%饱和硫酸铵(375 g 硫酸铵加入500 mL 的蒸馏水中,加热至完全溶解,室温过夜,析出晶体任其留在瓶中,用氨水或者硫酸调节pH 至7.0);若体积较大直接使用固体硫酸铵,根据表格(1)称取所需质量。
②盐析:缓慢向腹水中加入一定量的饱和硫酸铵溶液(或者缓慢加入固体硫酸铵,0.277 mg/mL 终浓度为45%),缓慢搅拌30 min ,室温静置2 h ,再5000 rpm 离心25 min ,去上清,沉淀用PBS 溶解。
③脱盐:主要有柱层析和透析法a)柱层析:将上述样品过Sephadex G-25 层析柱,以PBS 或Tris-HCl 缓冲液为平衡液和洗脱液,第一个蛋白峰即为脱盐后的抗体溶液;b)透析法:将样品装入处理后的透析袋(2% NaHCO3,1mM EDTA 煮沸10 min,蒸馏水洗净)中,置换缓冲溶液为PBS 或Tris-HCl 缓冲液,期间更换4-5 次透析液;2.辛酸-硫酸铵沉淀法(1)适用范围:该法简单易行,适用于提纯IgG1 和IgG2b ,但对IgG3 和IgA 的回收率及纯化效果差。
(2)试剂:0.06M 醋酸缓冲溶液(pH5.0),1M HCl,辛酸,1xPBS ,1M NaOH;(3)方法:在预处理后的腹水中加入2 倍体积的0.06M 醋酸缓冲溶液(pH5.0),按比例加入辛酸(11uL 辛酸/mL 腹水),室温搅拌下逐滴加入,30min 内加完,4℃静置2 h ,10000 rpm 离心30 min ,弃沉淀,上清过滤(经尼龙筛125uM),加入1/10 的1xPBS,再用1M NaOH 调节pH 至7.2;4℃下加入饱和硫酸铵至45% 饱和度,静置1h ,10000 rpm 离心30 min ,弃上清;沉淀用PBS 溶解;3.优球蛋白沉淀法(1)适用范围:适用于提纯IgG3 和IgM 的提取,不会影响抗体活性;复溶缓冲溶液(1M NaCl ,0. 1M Tris-HCl ,pH8.0)(2)试剂:NaCl ,CaCl2,(3)方法:取一定量的预处理后腹水,先后加入NaCl(终浓度0.2M)和CaCl2 (终浓度25mM),可看到纤维蛋白的产生;经滤纸过滤后,透析或层析过滤,缓冲体系为去离子水,超高速离心30min;弃上清,沉淀用1M NaCl,0. 1M Tris-HCl,pH8.0 溶液复溶,再经过透析或层析过滤更换缓冲体系;(二)亲和层析法1.基本原理:基因工程改造的protein A 和protein G 能特异性结合哺乳动物IgG 的Fc 区段,将protein A 和protein G 结合到柱料上,通过亲和层析的方式,可将IgG 及其亚类与片段纯化出来。
常用抗体纯化方法

常用抗体纯化方法抗体纯化是分离和纯化单克隆或多克隆抗体的方法,以获得高纯度和高活性的抗体样品。
常用的抗体纯化方法包括亲和层析法、离子交换层析法、凝胶过滤法、亲和电泳法、硫酸铵沉淀法等等。
下面将对常用的抗体纯化方法进行详细介绍。
1.亲和层析法:亲和层析法是一种基于抗原-抗体互作原理的分离纯化方法。
先制备含有抗原的固相材料,如亲和树脂或亲和膜,然后将抗体样品与这些固相材料接触,使抗体与抗原结合,其他非特异性蛋白质被洗脱,最后用适当的溶液洗脱目标抗体。
这种方法可以用于多克隆或单克隆抗体的纯化。
2.离子交换层析法:离子交换层析法是利用样品中的离子性蛋白质与离子交换树脂(正离子交换或负离子交换)之间的相互作用进行分离的方法。
通过改变洗脱缓冲液的离子强度和pH值,可以将目标抗体从离子交换树脂上洗脱下来。
这种方法适用于广泛的抗体样品,可以快速纯化大量的抗体。
3.凝胶过滤法:凝胶过滤法是一种分子大小分离纯化方法,适用于分离分子量较大的抗体。
基本原理是通过调节凝胶孔隙大小,使大分子如抗体可以滞留在凝胶中,而小分子如低分子量杂质则可以通过凝胶孔隙逸出。
这种方法操作简单,纯化速度快,适合于大量抗体的纯化。
4.亲和电泳法:亲和电泳法是利用抗体在电场中迁移速度与分子特性有关的原理进行纯化的方法。
可以通过改变电场强度、溶液pH值和溶液离子浓度等参数来调节抗体的迁移速度,从而实现抗体的纯化。
亲和电泳法适用于纯化低丰度目标抗体和快速分离纯化。
5.硫酸铵沉淀法:硫酸铵沉淀法是利用硫酸铵的沉淀作用将目标抗体从混合物中分离出来的方法。
通过调节溶液的硫酸铵饱和度和沉淀时间,可以得到纯度较高的抗体样品。
该方法简单、快速,适用于大量抗体的纯化。
总的来说,抗体纯化方法有很多种,每种方法都有其特点和适用范围。
在实际应用中,可以根据具体的实验要求和抗体性质选择最适合的纯化方法。
同时,也可以结合两种或多种方法进行联合纯化,以获得更高纯度和活性的抗体。
抗体纯化大全

抗体的纯化第一节硫酸铵沉淀法基本原理硫酸铵沉淀法可用于从大量粗制剂中浓缩和部分纯化蛋白质.用此方法可以将主要的免疫球蛋白从样品中分离,是免疫球蛋白分离的常用方法。
高浓度的盐离子在蛋白质溶液中可与蛋白质竞争水分子,从而破坏蛋白质表面的水化膜,降低其溶解度,使之从溶液中沉淀出来.各种蛋白质的溶解度不同,因而可利用不同浓度的盐溶液来沉淀不同的蛋白质。
这种方法称之为盐析。
盐浓度通常用饱和度来表示。
硫酸铵因其溶解度大,温度系数小和不易使蛋白质变性而应用最广。
试剂及仪器·组织培养上清液、血清样品或腹水等·硫酸铵(NH4)SO4·饱和硫酸铵溶液(SAS)·蒸馏水· PBS(含0。
2g/L叠氮钠) (见附录一)·透析袋·超速离心机· pH计·磁力搅拌器实验步骤以腹水或组织培养上清液为例来介绍抗体的硫酸铵沉淀.各种不同的免疫球蛋白盐析所需硫酸铵的饱和度也不完全相同。
通常用来分离抗体的硫酸铵饱和度为33%—50%。
一、配制饱和硫酸铵溶液(SAS)将767g(NH4)2SO4 边搅拌边慢慢加到1升蒸馏水中。
用氨水或硫酸调到pH7。
0.此即饱和度为100%的硫酸铵溶液(4。
1 mol/L,25°C);其它不同饱和度硫酸铵溶液的配制见表1;二、沉淀1、样品(如腹水)20 000´g 离心30 min,除去细胞碎片;2、保留上清液并测量体积;3、边搅拌边慢慢加入等体积的SAS到上清液中,终浓度为1:1(v/v);4、将溶液放在磁力搅拌器上搅拌6小时或搅拌过夜(4°C),使蛋白质充分沉淀。
三、透析1、蛋白质溶液10 000´g 离心30 min(4°C)。
弃上清保留沉淀;2、将沉淀溶于少量(10-20ml)PBS—0.2g/L叠氮钠中。
沉淀溶解后放入透析袋对PBS—0.2g/L 叠氮钠透析24—48小时(4°C),每隔3—6 小时换透析缓冲液一次,以彻底除去硫酸氨;3、透析液离心,测定上清液中蛋白质含量。
抗体的纯化

一、原理在酸性条件下( pH4.5),非1gG的蛋白成份(包括白蛋白,部分Ig),能被辛酸等短链脂肪酸沉淀,上清中剩余的蛋白主要为IgG,再用硫酸铵沉淀上清,即可获得纯度较高的IgG。
辛酸/硫酸铵法比硫酸铵法能够获得更高纯度的IgG。
二、材料与方法1、材料(1)动物腹水(2)辛酸(caprylic acid,CA),化学纯(3)硫酸铵,分析纯(4)SPA Sepharose 4FF亲合层析柱2、操作方法(1)蛋白含量测定紫外分光光度法测样品在波长260nm,280nm处的I及收光度(A 260, A 280),蛋白含量按以下公式计算蛋白量(g/L)=(1.45* A 280- 0.74* A 260)*稀释倍数(2)主要步骤①腹水滤纸过滤去沉淀和脂质,滤液用4倍体积60mmo1/ L醋酸缓冲液(pH4.0)稀释后,用Na0H调,PH值至4.5。
②逐滴加入辛酸(终浓度25u1/ml),室温h搅拌30分钟后,以6000-8000r/min.离心30分钟,收集上清液。
③上清液经滤纸过滤2次,将滤液与10*PBS(0.lmol/L,pH7.4按10:1比例混合,调pH至7.4,置冰浴冷至40度。
④每毫升上述混合液加0.2778固体硫酸钱,40度搅拌30分钟,以4000-6000r/min离心巧一20分钟,将沉淀溶于少量YBS,透析,测蛋白含量,冻存。
(3)硫酸铵沉淀法按常规方法将腹水分别经50%,33%饱和度硫酸铵沉淀。
(4)亲合层析取提取的样品,用0.01lmol/ L Na2HPO4 (pH7.4)透析,洗脱使样品中IgG结合于层析柱上,再用0. lmol/ L柠檬酸(pH4.0)洗脱,收集洗脱液即获纯化IgG。
(5)SDS—PAGE电泳鉴定抗体纯度(6)间接ELISA法测定抗体效价用sIgA包被酶标板,按常规方法测抗体效价。
处理细胞,包被酶标板,测定抗体效价。
(7)得率和回收率的计算每毫升原腹水中提取的抗体量即为得率(Y field,g/ L );提取所得抗体量与原腹水中抗体量之百分比即为回收率(Recovery,%)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
抗体的纯化第一节硫酸铵沉淀法基本原理硫酸铵沉淀法可用于从大量粗制剂中浓缩和部分纯化蛋白质。
用此方法可以将主要的免疫球蛋白从样品中分离,是免疫球蛋白分离的常用方法。
高浓度的盐离子在蛋白质溶液中可与蛋白质竞争水分子,从而破坏蛋白质表面的水化膜,降低其溶解度,使之从溶液中沉淀出来。
各种蛋白质的溶解度不同,因而可利用不同浓度的盐溶液来沉淀不同的蛋白质。
这种方法称之为盐析。
盐浓度通常用饱和度来表示。
硫酸铵因其溶解度大,温度系数小和不易使蛋白质变性而应用最广。
试剂及仪器·组织培养上清液、血清样品或腹水等·硫酸铵(NH4)SO4·饱和硫酸铵溶液(SAS)·蒸馏水· PBS(含0.2g/L叠氮钠) (见附录一)·透析袋·超速离心机· pH计·磁力搅拌器实验步骤以腹水或组织培养上清液为例来介绍抗体的硫酸铵沉淀。
各种不同的免疫球蛋白盐析所需硫酸铵的饱和度也不完全相同。
通常用来分离抗体的硫酸铵饱和度为33%—50%。
一、配制饱和硫酸铵溶液(SAS)将767g(NH4)2SO4 边搅拌边慢慢加到1升蒸馏水中。
用氨水或硫酸调到pH7.0。
此即饱和度为100%的硫酸铵溶液(4.1 mol/L, 25°C);其它不同饱和度硫酸铵溶液的配制见表1;二、沉淀1、样品(如腹水)20 000´g 离心30 min,除去细胞碎片;2、保留上清液并测量体积;3、边搅拌边慢慢加入等体积的SAS到上清液中,终浓度为1:1(v/v);4、将溶液放在磁力搅拌器上搅拌6小时或搅拌过夜(4°C),使蛋白质充分沉淀。
三、透析1、蛋白质溶液10 000´g 离心30 min(4°C)。
弃上清保留沉淀;2、将沉淀溶于少量(10-20ml)PBS-0.2g/L叠氮钠中。
沉淀溶解后放入透析袋对PBS-0.2g/L 叠氮钠透析24-48小时(4°C),每隔3-6 小时换透析缓冲液一次,以彻底除去硫酸氨;3、透析液离心,测定上清液中蛋白质含量。
应用提示一、先用较低浓度的硫酸氨预沉淀,除去样品中的杂蛋白。
1、边搅拌边慢慢加SAS到样品溶液中,使浓度为0.5:1 (v/v);2、将溶液放在磁力搅拌器上搅拌6小时或过夜(4°C);3、3000´g 离心30 min(4°C),保留上清液;4、上清液再加SAS到0.5:1 (v/v),再次离心得到沉淀。
将沉淀溶于PBS,同前透析,除去硫酸氨;5、杂蛋白与欲纯化蛋白在硫酸氨溶液中溶解度差别很大时,用预沉淀除杂蛋白是非常有效的;二、为避免体积过大,可用固体硫酸氨进行盐析(硫酸氨用量参考表1);三、硫酸氨沉淀法与层析技术结合使用,可得到更进一步纯化的抗体。
参考文献1、Burd, R.S., Raymond, C.S., Ratz, C. A and Dunn, D.L (1993) A rapid procedure for purifying IgM monoclonal antibodies from murine ascites using a DEAE – disk. Hybridoma12, 135.2、T.G.库珀着,徐晓利主译《生物化学工具》人民卫生出版社出版(1980),353。
(夏泉)表1.室温下硫酸氨饱和度由起始浓度(S1)提高到终浓度(S2)时需加硫酸氨的量(g/L)0%10%20%25%30%33%35%40%45%50%55%60%65%70%75%80%90%56 114 144 176 196 209 243 277 313 351 390 430 472 516 561 662 76757 86 118 137 150 183 216 251 288 326 365 406 449 494 592 64929 59 78 91 123 155 189 225 262 300 340 382 424 520 61930 49 61 93 125 158 193 230 267 307 348 390 485 58319 30 62 94 127 162 198 235 273 314 356 449 54612 43 74 107 142 177 214 252 292 333 426 52231 63 94 129 164 200 238 278 319 411 50631 63 97 132 168 205 245 285 375 46932 65 99 134 171 210 250 339 43133 66 101 137 176 214 302 39233 67 103 141 179 264 35334 69 105 143 227 31434 70 107 190 27535 72 153 23736 115 19877 15779第二节DEAE离子交换层析法基本原理离子交换层析是蛋白质纯化的常规方法,与硫酸氨沈淀法联合使用可以非常有效地纯化抗体。
DEAE是一种阴离子交换剂,当蛋白质溶液通过DEAE柱时,带负电荷的蛋白质可以被DEAE 吸附,带正电荷的蛋白质则不被吸附而随溶液流出。
纯化抗体时可选择pH值大于待纯化抗体等电点的缓冲液,此时抗体带负电荷可以通过电价键吸附于DEAE离子交换剂上,然后用增加盐浓度的方法将抗体洗脱。
可以用连续梯度法洗脱,也可以用不连续梯度(分段洗脱)法洗脱。
本文以腹水中mAb的纯化为例来介绍此方法。
试剂及仪器·抗体样品(小鼠腹水或经硫酸氨沉淀的抗体)· DEAE离子交换剂(阴离子交换剂)·层析柱(2.5cmÆ ´ 20 cm)·缓冲液A:25mmol/L Tris-HCl pH 8.8 +35 mmol /L NaCl·缓冲液B:25mmol/L Tris-HCl pH 8.8 +70mmol /L NaCl·缓冲液C:25mmol/L Tris-HCl pH 8.8 +500 mmol /L NaCl·缓冲液D:25mmol/L Tris-HCl pH 8.8· PBS (见附录一)·透析袋(MW CO 10 000)·磁力搅拌器·蠕动泵和部分收集器·紫外检测仪·梯度发生器·电导仪· pH计·离心机实验步骤整个层析过程最好在4°C 进行,可在冷室操作;1、抗体样品对缓冲液B 透析过夜(4°C);2、按说明处理DEAE离子交换剂。
然后用缓冲液A 平衡。
用20倍体积缓冲液A洗交换剂,可用过滤或离心法反复洗到流出液的电导率等于缓冲液A;3、将处理好的DEAE离子交换剂悬浮在缓冲液A 中,装入层析柱。
4、用等体积的缓冲液D 稀释透析过的抗体样品,使之与缓冲液A 的离子强度一致;5、稀释后的样品10 000´g 离心10 min(4°C),除去沉淀变性的蛋白质;6、层析柱与蠕动泵、部分收集器及紫外检测仪连接;7、抗体样品以1ml/min 流速上柱,然后用缓冲液A 洗柱1ml/min,将未吸附的蛋白质洗出。
直到流出液在280 nm 的吸光度小于0.05;8、吸附的蛋白质,用连续增加NaCl的浓度来洗脱。
用线性梯度缓冲液(35-500 mmol/L NaCl)或分段缓冲液(35、70、140、280、500 mmol/L NaCl)洗脱。
流速1ml/min ,分部收集洗脱液2ml / 管(图2-4-1);9、椐紫外检测结果,将抗体峰部分合并。
装入透析袋对PBS(含0.2g/L叠氮钠)4°C 透析或冷冻(视抗体的稳定性而定);10、DEAE离子交换剂可按照商品说明再生使用。
图2-4-1 DEAE离子交换柱层析纯化小鼠IgG流速:1ml/min 样品:0.5ml腹水检测方法1、大部分小鼠的单克隆抗体IgG可在50—200mmol/L NaCl浓度之间洗脱。
2、可用SDS-PAGE 或定量免疫学方法(RIA、ELISA)检测各部分洗脱液的抗体存在及效价。
实验要点及说明1、要得到满意的分离结果,每ml DEAE 离子交换剂所加样品中蛋白质总量最好不超过10mg。
2、用经硫酸铵沉淀初步纯化的抗体代替小鼠腹水作为样品,可得到更好的纯化结果。
3、如抗体与DEAE离子交换剂不能有效的结合,可将起始缓冲液的pH提高0.1个单位,直到可以有效结合为止。
4、如果没有合用的蠕动泵和部分收集器,可用手工上样和收集。
洗脱液每管收集0.5-2ml ,然后用分光光度计测定各管280nm波长的吸光度值。
5、该方法可按比例扩大。
用适合于高流速的大柱和相应的交换剂来纯化大量的蛋白质样品。
参考文献1. Corthier, G., Boschetti, E. and Charley-Poulain, J. (1984) Improved method for IgG purification from various animal species by ion exchange chromatography J. Immunol. Meth . 66, 75-79.2、张保真编译西安医科大学出版(1986)《免疫组织化学理论与技术》69-71。
(夏泉)第三节羟磷灰石层析纯化抗体基本原理羟磷灰石[Ca10(PO4)6(OH)2]吸附蛋白质的机理,通常认为与其晶体表面的Ca2+ 和PO43- 两种基团相关。
因为带电基团紧密排列于晶体表面,可能通过偶极子之间的相互作用来吸附蛋白质。
样品被吸附剂吸附后,用适当的洗脱液(较高浓度的盐溶液)冲洗,可使之解析。
解析下来的物质在流经层析柱的过程中向前移动,遇到前面新的吸附剂可再被吸附。
在反复的吸附—解析—再吸附—再解析的过程中,由于待分离物质与吸附剂之间的吸附能力不同,它们沿洗脱液流动方向移动的速度也不相同,所以在洗脱过程中各组分便会由于移动速度不同而被分离。
抗体与其它蛋白质一样可以用羟磷灰石吸附柱层析进行纯化。
试剂及仪器·抗体样品(腹水或培养上清液)·羟磷灰石(Hydroxylapatite 有售)·层析柱(2.5cmÆ ´ 20 cm)·吸附缓冲液:20mmol/L 磷酸钾缓冲液pH6.8 含30mmol /L NaCl·洗脱缓冲液:500mmol/L 磷酸钾缓冲液pH6.8 含30mmol /L NaCl· PBS (见附录1)·透析袋(MW CO 10 000)·磁力搅拌器·蠕动泵和部分收集器·紫外检测仪·梯度发生器·离心机实验步骤1、羟磷灰石柱的准备:将羟磷灰石悬浮于吸附缓冲液中,使之充分水合后装柱。
