抗体纯化大全
抗体纯化

一、抗体纯化部分1、腹水/血清的亚型测定完成后,IgG亚型的腹水/血清使用Protein G 抗体纯化柱纯化;IgM亚型的腹水/血清则使用饱和硫酸铵沉淀法沉淀。
1.1 Protein G 抗体纯化步骤:(1)新柱子先用DDW 5ml过柱;(2)10倍柱体积的Binding Buffer (pH 7.0) 平衡纯化小柱;(3)抗体过柱,过程中要求缓慢过柱,以求抗体蛋白更好的结合在结合位点上;(4)继续10倍柱体积的Binding Buffer (pH 7.0) 平衡纯化小柱;(5)5倍柱体积甘氨酸-盐酸缓冲液(pH 2.7)洗脱结合位点上的抗体,并加入Tris-HCI(pH9.0)中和甘氨酸,使pH保持为适合抗体保存的中性;(6)10倍柱体积的Binding Buffer (pH 7.0) 平衡纯化小柱;(7)5倍柱体积20%乙醇溶液过柱,于4℃条件下保存纯化小柱;(8)将洗脱的抗体用聚乙二醇浓缩并透析,以彻底去除不相干离子。
其中所用试剂配方:DDW:超纯水Binding Buffer(100ml):A液,0.2M磷酸氢二钠61mlB液,0.2M磷酸二氢钠39ml磷酸氢二钠4.37g 磷酸二氢钠1.22g甘氨酸-盐酸缓冲液:0.1M甘氨酸溶液加浓盐酸调pH 2.7Tris-HCL缓冲液:1M Tris溶液加浓盐酸调pH 9.01.2 饱和硫酸铵沉淀法步骤:(1)配制饱和硫酸铵溶液,再用氨水调节pH至8.5(2)沉淀:a、腹水/血清离心去除细胞碎片,保留上清液并测定体积;b、边搅拌边逐滴滴入等体积的饱和硫酸铵溶液,搅拌均匀使蛋白充分沉淀;c、上述蛋白质溶液经过离心弃上清取沉淀,并用PBS溶液(pH 7.0)溶解;d、继续向上一步蛋白溶液中滴入1/2体积的饱和硫酸铵溶液,搅拌均匀使蛋白充分沉淀;e、继续离心沉淀弃上清去沉淀,用PBS溶液(pH 7.0)溶解;(3)透析:每隔3-6小时换一次透析液,以彻底去除硫酸铵。
抗体纯化的方法有哪些

抗体纯化的方法有哪些抗体制备出来之后,需要进一步纯化得到纯的多抗或单抗,既有利于保存也有利于排除杂蛋白对结果的影响。
常规用于纯化的材料是腹水和细胞培养上清,而通常经过免疫制备的抗体非还原型PAGE/kDa 还原型PAGE/kDaIgG 150 50,25IgM 900 65,25IgM单体180 65,25硫酸铵沉淀法:基本原理:高浓度的硫酸铵通过与球蛋白竞争水分子破坏蛋白表明的水化膜,降低球蛋白的溶解性,是分离免疫球蛋白的常用方法,而且不同的免疫球蛋白适宜的硫酸铵浓度也稍有差别,一般用来分离抗体的硫酸铵饱和度在33~50%。
适用于:鼠抗所有亚类、其他种属抗体、任何种属的IgM、IgG、IgA基本操作:1.过滤、离心腹水或者培养上清得上清;2.加入饱和硫酸铵至终浓度45%,静置沉淀蛋白;3.沉淀蛋白用最小体积PBS或硼酸盐缓冲液溶解,用PBS或硼酸盐缓冲液透析除盐;4.过聚丙烯酰胺葡聚糖凝胶柱,PBS或硼酸盐(含%叠氮钠)缓冲液洗脱;5.电泳检测分子量大小,分光光度法测定抗体浓度;6.抗体保存浓度在mg/mL适宜,-20 ℃保存不超过一个月,避免反复冻融。
亲和层析法基本原理:基因工程改造的protein A和protein G能特异性结合哺乳动物IgG的Fc区段,将protein A和protein G结合到柱料上,通过亲和层析的方式,可将IgG及其亚类与片段纯化出来。
成员介绍:protein A分离自Staphylococcus aureus的细胞壁,分子量42 kDa,由spa基因编码,具有五个同型的免疫球蛋白结合结构域,每个结构域由三个α螺旋构成。
protein A的B结构域protein A的各个结构域protein A可结合多数免疫球蛋白的Fc段(尤其是人的IgG1、IgG2、IgG4,豚鼠,猕猴,鼠类IgG2a、兔)以及人VH3家族的Fab段。
基因工程改造的protein A通常使用大肠杆菌作为表达宿主,表达产物仍含有五个Fc结合结构域。
抗体纯化方法

抗体纯化方法1. 引言抗体是一类免疫蛋白,具有识别和结合特定抗原的能力。
在生物医学研究和临床应用中,纯化高质量的抗体是非常重要的。
抗体纯化方法可以去除杂质,提高抗体的纯度和活性,从而提高其应用效果。
本文将介绍几种常见的抗体纯化方法。
2. 凝胶过滤层析法凝胶过滤层析法是一种基于分子大小的纯化方法。
该方法利用不同孔径的凝胶过滤介质,将目标分子(如抗体)与较大分子(如蛋白质杂质)分离开来。
具体操作步骤如下:1.将含有目标抗体的混合物加入到预先平衡好的凝胶柱中。
2.使用缓冲液进行洗脱,使较大分子无法通过凝胶柱而流出。
3.目标抗体由于分子大小适中,能够通过凝胶柱被保留下来。
4.最后使用洗脱缓冲液将目标抗体从凝胶柱中洗脱出来,得到纯化的抗体。
凝胶过滤层析法的优点是简单易行,不需要特殊设备,且适用于各种规模的实验室。
但其缺点是分离效率较低,只能实现较为粗略的纯化。
3. 亲和层析法亲和层析法是一种基于生物分子之间特异性相互作用的纯化方法。
该方法利用抗体与抗原之间的特异性结合来实现目标抗体的纯化。
具体操作步骤如下:1.将含有目标抗体的混合物加入到预先包含特异性结合配体(如蛋白A、蛋白G等)的亲和层析柱中。
2.目标抗体与配体之间发生特异性结合。
3.使用洗脱缓冲液将非特异结合的组分洗脱掉。
4.最后使用洗脱缓冲液将目标抗体从亲和层析柱中洗脱出来,得到纯化的抗体。
亲和层析法具有高选择性和高效率的优点,能够得到高纯度的抗体。
但其缺点是需要特定的亲和剂和配体,成本较高。
4. 离子交换层析法离子交换层析法是一种基于生物分子表面电荷的纯化方法。
该方法利用目标抗体与离子交换柱中固定的离子之间的相互作用来实现纯化。
具体操作步骤如下:1.将含有目标抗体的混合物加入到预先平衡好的离子交换柱中。
2.使用缓冲液进行洗脱,使与固定离子相同电荷的分子无法通过离子交换柱而流出。
3.目标抗体由于表面电荷不同,能够通过离子交换柱被保留下来。
4.最后使用洗脱缓冲液改变pH或盐浓度等条件,将目标抗体从离子交换柱中洗脱出来,得到纯化的抗体。
抗体的提取与纯化

(关键词:抗体;抗体的提取与纯化;盐析法;冷酒精沉淀法;DEAE-SephadexA-50柱层析纯化免疫球蛋白;SPA-SepharoseCL-4B 亲合层析纯化IgG;离子交换层析)精制免疫球蛋白的方法很多。
一般采用综合技术,避免蛋白变性。
如分离IgG时,多结合使用盐析法与离子交换法,以求纯化。
提取IgM的方法也很多,如应用凝胶过滤与制备电泳法,或离子交换与凝胶过滤等。
一、盐析法取x ml血清加x ml生理盐水,于搅拌下逐滴加入2xml饱和硫酸铵,硫酸铵的终饱和度为50%。
↓4℃,3h以上,使其充分沉淀离心(3000rpm),20min,充上清,以xml生理盐水溶解沉淀,再逐滴加饱和硫酸铵x/2ml。
↓置4℃3h以上,[此时,(NH4)2SO4的饱和度为33%]重复上述第二步过程1~2次。
末次离心后所得沉淀物为γ-球蛋白,以0.02%mol/L pH7.4PBS溶解至xml装入透析袋。
↓对PBS充分透析、换液3次,至萘氏试剂测透析外液无黄色,即无NH4+为止。
取透析袋内样品少许作适当倍数稀释后,以751型紫外分光光度计测定蛋白含量。
影响盐析的因素很多,如蛋白质的浓度,盐的浓度,饱和度和pH,温度等都可影响盐析的结果,操作时要充分注意(参阅本章第二节)。
二、冷酒精沉淀法分离过程如下。
血清加3倍体积的蒸馏水,调节pH至7.7(±)冷却到0℃。
在激烈搅拌的条件下,加预冷的酒精(-20℃)到最终浓度为20%,保持在-5℃。
产生的沉淀(A),含有大多数种类的免疫球蛋白。
沉淀A悬浮于25倍体积的0.15~20mol/L NaCl溶液(冷)中,加有0.05mol/L醋酸调节pH到5.1,产生的沉淀(B),包括大部分的IgA 和IgM,IgG留在上清液内。
调节上清液的pH到7.4,加冷酒精(-20℃~-30℃)到最终浓度为25%,维持在-5℃。
所得到的沉淀(C)含有90%~98%IgG。
不同动物,IgG分离的条件和产量略有不同。
常用抗体纯化方法

常用抗体纯化方法抗体经制备后需要进一步纯化,纯的抗体有利于保存以及排除杂蛋白对结果的影响。
抗体纯化方法的选择一般取决于抗体的来源、时间的需求、成本的预算以及抗体的最终用途等。
根据纯化方式可分为以下几类:1、亲和层析法亲和层析主要适用于从成分复杂且杂质含量远大于目标物的混合物中提纯目标物。
如图所示,琼脂糖首先与介质偶联,结合成具有特异亲和性的分离介质,再加入成分复杂的混合物即样品后,配体选择性吸附生物活性物质(高亲和力抗体),加入平衡液,洗脱去除杂质,最终获得目标物。
protein A/protein G亲和层析通过基因工程改造的protein A和protein G能特异性结合哺乳动物IgG的Fc区段,将protein A和protein G结合到柱料上,通过亲和层析的方式,可将IgG及其亚类与片段纯化出来。
● protein A:分子量为42kDa,由spa基因编码,具有5个同型的免疫球蛋白结合结构域,每个结构域由3个α螺旋构成。
Protein A的各个结构域● protein G:分子量为65kDa,由spg基因编码,可结合抗体的Fc段、Fab段以及血清中的白蛋白。
基因工程改造的protein G去掉了与白蛋白的结合位点,仅保留Fc结合结构域,其结合力较protein A更强。
Protein G的各个结构域● protein A/protein G:是一种基因工程结合蛋白。
它由4个protein A和2个protein G免疫球蛋白结合域组成,比单独的protein A或protein G结合范围更加广泛,并将其优点融为一体,几乎可以应用于所有种属的IgG纯化。
2、抗原亲和纯化法利用抗原为配体的亲和纯化称之为抗原亲和纯化,是一种高度纯化蛋白类生物大分子的有效手段。
此种方法中,抗原替代亲和配体,被化学偶联在凝胶介质上,目的抗体与抗原特异性结合,最终洗脱得到目的抗体。
与protein A纯化法的区别在于,抗原亲和纯化是与抗体的Fv区特异性结合,protein A纯化则与抗体的Fc 区特异性结合。
抗体纯化工艺

抗体纯化工艺一、引言抗体是一种重要的生物大分子,具有广泛的应用前景。
在许多领域中,如医学、生物技术和生命科学等方面都有着重要的应用。
抗体的纯化是研究和应用这些分子的基础,因此抗体纯化工艺显得尤为重要。
二、抗体纯化工艺流程1. 细胞培养及收获细胞培养是抗体制备的第一步,通常使用哺乳动物细胞系来表达目标蛋白。
细胞培养条件包括温度、CO2浓度、营养成分和培养基等。
当细胞达到最大密度时,可以进行收获。
收获后将细胞离心并取下上清液。
2. 亲和层析亲和层析是最常用的抗体纯化方法之一。
它利用特定配体与目标分子之间的亲和作用,将目标分子从混合物中选择性地吸附到固相材料上。
例如,使用含有蛋白A或蛋白G的树脂来选择性地捕捉IgG类别的抗体。
3. 尺寸排除层析尺寸排除层析是一种基于分子大小的分离方法。
它利用不同分子大小的抗体在树脂中的渗透性差异,从而实现对目标分子的纯化。
尺寸排除层析通常用于去除杂质,如细胞碎片、DNA和RNA等。
4. 离子交换层析离子交换层析是一种利用不同离子性质进行分离的方法。
在这种方法中,树脂表面上带有正负电荷的功能团能够与目标抗体中带有相反电荷的部位结合。
通过调节pH或盐浓度,可以实现目标抗体与树脂之间的选择性结合和解离。
5. 亲水性交换层析亲水性交换层析是一种基于溶液中物质亲水/疏水特性进行分离的方法。
它利用具有不同亲水性质的树脂来选择性地捕捉和纯化目标抗体。
6. 逆流色谱逆流色谱是一种高效液相色谱技术,在抗体制备中也有广泛应用。
它可以快速地分离和纯化目标抗体,并且可以在大量样品中进行高通量分析。
7. 超滤超滤是一种利用膜过滤器进行分离和纯化的方法。
它可以去除大分子杂质,如细胞碎片、DNA和RNA等,从而提高目标抗体的纯度。
三、结论抗体纯化工艺是抗体制备中不可或缺的一部分。
通过合理地设计和选择不同的纯化方法,可以实现高效、快速和经济地纯化目标抗体。
在实际应用中,需要根据具体情况选择合适的工艺流程,并进行优化和改进,以提高抗体的产量和质量。
4种常用抗体分离纯化工艺介绍

4种常用抗体分离纯化工艺介绍抗体分离纯化的主要目的是将抗体与工艺相关杂质和产品相关杂质分离,最终获得高纯度、低潜在危害的抗体药物。
纯化过程中需要去除的工艺相关杂质包括细胞、细胞碎片、宿主细胞蛋白、宿主细胞核酸及培养基与加料液成分,需去除的产品相关杂质主要包括抗体片段和聚集体。
纯化过程还需具备足够的病毒灭活去除能力,以去除宿主细胞自身表达的内源病毒样颗粒和未及时发现的外源病毒。
大多数工艺利用ProteinA来捕获抗体,并利用了至少1个离子交换层析作为精纯步骤,仅少数工艺使用了疏水、羟基磷灰石和分子筛层析等步骤。
下图中显示了一个常见的抗体纯化工艺。
反应器收获液首先经过离心和过滤,去除细胞和细胞碎片,然后经过ProteinA层析捕获抗体,捕获后的抗体经低pH孵育后,通过两个离子交换层析进行精纯,然后进行病毒过滤,最后换液并调整抗体浓度,得到抗体原液。
工艺中的低pH孵育和病毒过滤是两个正交的专属病毒去除灭活步骤。
这两个专属步骤与层析步骤一起,可大大降低原液中可能存在的病毒数目。
工艺中的低pH孵育和病毒过滤是两个正交的专属病毒去除灭活步骤。
这两个专属步骤与层析步骤一起,可大大降低原液中可能存在的病毒数目。
抗体分离纯化工艺其中最常用的四种纯化方法,也就是今天的主角“四大名捕”。
我们接着往下看吧。
1、Protein A从原核金黄色葡萄球菌细胞壁分离的结合受体Protein A(~56kDa)与不同免疫球蛋白同型的Fc区以及人VH3家族的Fab区具有高度的亲缘关系。
进一步研究表明,Protein A仅限于与IgG亚类IgG1、IgG2和IgG4结合,与IgG3的反应性很低,约占总IgG的8%。
天然的Protein A有5个IgG结合结构域和未知功能的非Fc结合域,结构示意图如下:Protein A的结构域示意图此结构的Protein A大量结合IgG的同时,其非Fc结合域能结合部分杂蛋白,导致洗脱下来的IgG纯度不够,因此科学家利用基因工程的方法克隆Protein A 的基因并进行改造,得到重组型Protein A,其非特异性结合明显降低。
抗体纯化的方法有哪些

抗体纯化的方法有哪些抗体纯化是一种将杂质和其他成分从混合物中分离出抗体的过程。
采用不同的方法可以实现抗体的纯化,具体方法取决于纯化过程中抗体与其他成分之间的特定相互作用。
以下是常见的抗体纯化方法:1. 亲和层析(Affinity chromatography):基于抗体与目标抗原之间的高特异性结合作用。
可以使用结合在固定支持介质上的目标抗原来精确地捕获抗体。
2.蛋白A、蛋白G和蛋白L亲和层析:这些层析方法基于蛋白质和抗体之间的亲和性。
蛋白A、蛋白G和蛋白L是一类结合在细菌细胞壁上的蛋白质,它们与抗体Fc区域的不同部位结合,因此可以用于从混合物中富集抗体。
3. 离子交换层析(Ion exchange chromatography):基于抗体与离子交换基质之间的相互作用来实现分离纯化。
通过调节溶液的pH值,可以控制离子交换基质上的电荷,从而实现对抗体的选择性捕获。
4. 尺寸排阻层析(Size exclusion chromatography):通过根据抗体与其他分子的大小差异来实现分离纯化。
大分子如抗体会快速通过填充在柱内的孔隙,而较小分子则会被孔隙所限制,因此可以通过尺寸选择性地捕获和纯化抗体。
5. 亲和吸附(Affinity adsorption):用于捕获抗体的固定介质上表面共价或非共价地固定目标抗原,然后将混合物通过固定介质,使抗体与目标抗原相互作用,并通过洗涤和再生步骤来清除杂质。
6.电泳分离:电泳是基于分子在电场中迁移速率的差异来实现纯化的方法。
通过电泳可以将抗体与其他成分分离开来。
7.沉淀和沉降:使用盐类、有机溶剂或其他物质来促使抗体的沉淀或沉降,然后可以通过离心等方法将其与上清液分离开。
8. 磷酸铵沉淀(Ammonium sulfate precipitation):将逐渐增加浓度的磷酸铵加入混合物中,使抗体产生沉淀,在沉淀过程中可以通过离心等方法将其分离出来。
9. 过滤法(Filtration):通过使用滤膜和适当的压力或真空来分离大分子(如抗体)和小分子。
抗体纯化手册-
单抗表达量可达 1-2g/L。 类等等。Protein A Protein A 亲和层析如 MabSelect 做快速初纯,再配合疏水层析、分子筛
亲和层析脱落集团。 等多步纯化。
利用基因工程技术表达人源 宿主杂蛋白、核酸、 若以 E.coli 包涵体形式表达,可考虑用 Sepharose 4FF 先纯化包涵体,再
2. 癌症、心血管等疾病的导向治疗:以单抗荷载同位素、 毒素蛋白、抗生素等药物制成生物导弹。
3. 应用抗体 T 细胞、抗 IL-2R 的单抗防治器官移植排斥反 应等。
的结构域可以识别和结合特异性抗原。1987 年单抗技术被成 4. 以单抗制成避孕、传染病的预防药物。
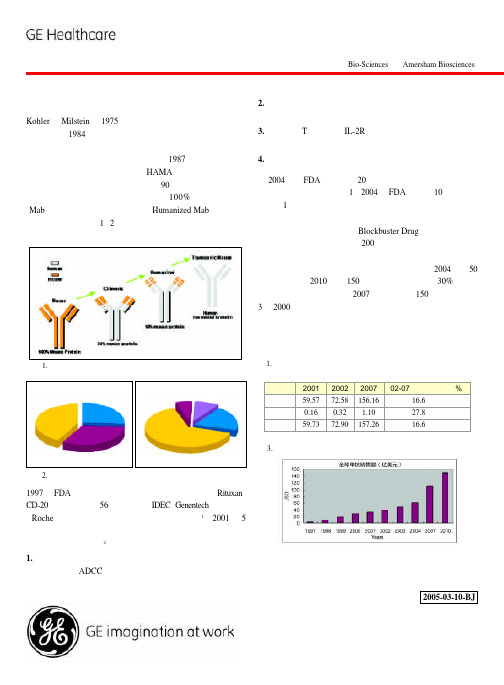
功应用到诊断试剂当中,但由于 HAMA (人抗鼠抗体) 反应, 没能有效应用在人类疾病的治疗上。90 年代,随着基因工程 技术的迅速发展,治疗性单抗从早期 100% 的鼠源性单抗 (Mab),到嵌合抗体,人源化抗体(Humanized Mab),到近年 的全人源性抗体 (图1、2),逐步消除了抗体的免疫源性问题, 在保持对抗原高亲和力的同时,改善了抗体的药动力学。
大多数 IgG 等电点高于一般血清蛋白,建议用阳离子交换层析 3 捕获浓缩抗体或分离纯化
大部分超过 pH6
除去大部分杂蛋白 (图 5)。注意:CHO 细胞表达的基因工程抗体 (Gab) 由于细胞培养过程
带来的糖基化的不均一,等电点往往较分散 (图 5),选择离子交换层析条件时须注意。
疏水性
大多数 IgG 疏水性较强
抗体纯化手册
孙文改 陈昕·通用电气(中国)医疗集团 Bio-Sciences (原 Amersham Biosciences)
一、单抗技术的发展、应用和市场前景
Kohler 和 Milstein 于 1975 年发明了被称之为“魔弹”的单抗 技术,并在1984 年获得了诺贝尔奖。单抗是B淋巴细胞和骨 髓瘤细胞杂交形成的杂交瘤细胞产生,其重链和轻链所形成
抗体纯化大全

抗体的纯化第一节硫酸铵沉淀法基本原理硫酸铵沉淀法可用于从大量粗制剂中浓缩和部分纯化蛋白质.用此方法可以将主要的免疫球蛋白从样品中分离,是免疫球蛋白分离的常用方法。
高浓度的盐离子在蛋白质溶液中可与蛋白质竞争水分子,从而破坏蛋白质表面的水化膜,降低其溶解度,使之从溶液中沉淀出来.各种蛋白质的溶解度不同,因而可利用不同浓度的盐溶液来沉淀不同的蛋白质。
这种方法称之为盐析。
盐浓度通常用饱和度来表示。
硫酸铵因其溶解度大,温度系数小和不易使蛋白质变性而应用最广。
试剂及仪器·组织培养上清液、血清样品或腹水等·硫酸铵(NH4)SO4·饱和硫酸铵溶液(SAS)·蒸馏水· PBS(含0。
2g/L叠氮钠) (见附录一)·透析袋·超速离心机· pH计·磁力搅拌器实验步骤以腹水或组织培养上清液为例来介绍抗体的硫酸铵沉淀.各种不同的免疫球蛋白盐析所需硫酸铵的饱和度也不完全相同。
通常用来分离抗体的硫酸铵饱和度为33%—50%。
一、配制饱和硫酸铵溶液(SAS)将767g(NH4)2SO4 边搅拌边慢慢加到1升蒸馏水中。
用氨水或硫酸调到pH7。
0.此即饱和度为100%的硫酸铵溶液(4。
1 mol/L,25°C);其它不同饱和度硫酸铵溶液的配制见表1;二、沉淀1、样品(如腹水)20 000´g 离心30 min,除去细胞碎片;2、保留上清液并测量体积;3、边搅拌边慢慢加入等体积的SAS到上清液中,终浓度为1:1(v/v);4、将溶液放在磁力搅拌器上搅拌6小时或搅拌过夜(4°C),使蛋白质充分沉淀。
三、透析1、蛋白质溶液10 000´g 离心30 min(4°C)。
弃上清保留沉淀;2、将沉淀溶于少量(10-20ml)PBS—0.2g/L叠氮钠中。
沉淀溶解后放入透析袋对PBS—0.2g/L 叠氮钠透析24—48小时(4°C),每隔3—6 小时换透析缓冲液一次,以彻底除去硫酸氨;3、透析液离心,测定上清液中蛋白质含量。
单克隆抗体纯化方法

单克隆抗体纯化方法
以下是几种常见的单克隆抗体纯化方法:
1. 亲和层析:利用抗体与特定配体的亲和力进行纯化,例如使用Protein A 或 Protein G 亲和层析来捕获抗体。
2. 凝胶过滤层析:根据抗体分子大小进行分离,可以去除较小的杂质。
3. 离子交换层析:基于抗体的电荷性质进行分离,适用于去除带电荷的杂质。
4. 疏水相互作用层析:利用抗体的疏水性进行纯化,可有效去除亲水性杂质。
5. 亲和洗脱层析:通过改变洗脱条件,如离子强度或 pH 值,从亲和层析柱上洗脱目标抗体。
6. 盐析和透析:通过在高盐浓度下沉淀杂质,然后通过透析去除盐分,实现抗体的纯化。
7. 超速离心:利用离心力将抗体与其他杂质分离开来,适用于大规模制备。
这些方法可以单独或联合使用,以获得高纯度的单克隆抗体。
选择合适的纯化方法取决于抗体的特性和所需的纯度水平。
需要注意的是,在进行单克隆抗体纯化时,应严格遵循实验操作规程,并在适当的条件下进行质量控制和检测,以确保获得高质量的抗体产品。
抗体纯化方式

抗体纯化方式抗体纯化是从混合物中分离出单一抗体的过程。
该过程包括多个步骤,其中一些步骤是特定于某种抗体的,而其他步骤是适用于各种不同的抗体。
下面将介绍几种常用的抗体纯化方式。
1.亲和层析:亲和层析是最常用的抗体纯化技术之一。
该技术涉及使用特定的亲和剂来吸附目标抗体。
通常使用亲和剂与目标抗体分子之间的相互作用来实现吸附。
最常用的亲和剂是具有与抗体结合特异性的抗原。
在亲和层析中,杂质成分会快速流过树脂,而目标抗体会与聚合物中的相应亲和剂结合并保留在材料中。
接下来,可以使用洗脱剂从树脂上洗出目标抗体。
2.离子交换层析:离子交换层析可用于强制目标抗体通过含有逆离子的树脂以进行附着。
该技术将目标抗体与树脂上的离子交换树脂相互作用,从而实现抗体的分离和纯化。
离子交换层析可分为阳离子交换和阴离子交换两种类型。
在该过程中,目标抗体在树脂上强附着,而非目标抗体则流经树脂,因为它们与树脂的亲和力较低。
3.凝胶过滤:凝胶过滤是一种基于分子量的方法,可用于将目标抗体与其他高分子化合物分离。
在这种方法中,最初的混合物通过一种聚合物凝胶柱,分子量较大的组分无法通过凝胶,因此被分离并保留在柱中。
目标抗体分子量较小,因此可以通过凝胶流出。
4.透析:透析是一种渐进性的纯化技术,可以用于除去小分子化合物和无用的杂质,包括离子、杂质蛋白质和难溶杂质。
该过程包括使用透析袋和具有特定分子截止率的孔径尺寸的膜,并将混合物与缓冲溶液混合。
由于混合物中小分子量的组分比大分子量分子经透析膜逃逸的速度快,因此它们会在膜表面生成梯度,并被移除。
目标抗体粘附在透析袋内仍然存在。
总之,每个纯化步骤都有其优缺点,在选择纯化过程时,必须考虑到抗体的理化性质以及最终的应用目的。
一个成功的抗体纯化过程需要高纯度、高产量和快速操作的平衡。
详细介绍抗体的分离纯化

(一蛋)白盐质在析水的溶基液本中原的理溶解度是由蛋白质亲水基团、与水形成
水化膜的程度、以及所带有电荷的情况决定的。
当中性盐加入蛋白质溶液中,盐离子对水分子的亲和力大于
蛋白质,于是减弱甚至消除蛋白质分子周围的水化膜。同时, 盐离子所带的电荷中和部分蛋白质分子表面电荷,更加导致 其溶解度降低,使蛋白质分子之间聚集而沉淀。
CaCl2 /ml混匀 15 min并10 000 ×g离心
沉淀脂蛋白
乙烯聚合物
加入3% (w/v)后搅拌4 小时,并17000×g离心 可用于高脂蛋白的 样品,例如腹水 可以选择右旋硫糖苷
PEG(Mr > 4000) 最多到20%
血浆蛋白
丙酮(冷的)
聚乙烯亚胺 硫化精蛋白 硫酸链霉素
在0摄氏度最多到 80%,在最高转速离 心后收集 小球
这些列在下表中。
选择滤孔大小
滤膜通常的孔径大小 1um 0.45um 0.22um
色谱层析柱中柱材的颗粒大小 90um或者更大 30或者40um 3,10,15um,或者需要更加干净的样品时采用
注意:
• 用一个预跑来检测目标蛋白的收率,因为有时候样品可能被滤膜 表面非特异性吸附。
• 过滤器可能会饱和——就是滤膜有一个特定的载量,因此在建立一 个纯化步骤时,需要考虑这些。
优点: ①重现性好,简单易行; ②分辨力强,回收率高; ③具有多孔性,表面积大、交换容量大; ④具有亲水性,对大分子的吸附不牢固,层析条件温和,不致引起
21
物质变性或失活。
12/12/2016
一、 基本原理
离子交换法的固定相是离子 交换剂; 若担体带有正电荷,可吸附 着负电荷分子,则为阴离子 交换法;不带净电荷的分子 ,以及阳离子则直接流出, 不会被吸附上去。 这些被固相单体所吸附的离 子,统称为 counter ion(抗 衡离子),因为其电荷与担 体上的电荷相反 (counter 是 "相反" 的意思)
抗体分离纯化技术

蓝色琼脂糖亲和纯化腹水中抗体 样品:腹水1.5ml,蛋白量4.6mg 填料:蓝色琼脂糖凝胶6B FF,1ml BufferA:50mM KH2PO4, pH7.0 BufferB:50mM KH2PO4, 1.5M KCl, pH7.0 结果:穿透6.2ml,蛋白量2.4mg 洗脱3.7ml,蛋白量1.9mg
苯基琼脂糖纯化SDS-PAGE图
1.marker 2. 培养液上清 3.苯基柱 穿透 4.和5 .苯基柱洗脱
4.疏水色谱纯化蛋黄中的抗体
400 300 200 100 0 0 50 100 150 200 250 300 350
A280(mAu)
volume(ml)
吡啶琼脂糖凝胶分离抗体
填料:吡啶琼脂糖凝胶 FF 20ml Buffer A: 20mM PBS,0.8M Na2SO4,pH7.5 Buffer B: 20mM PBS, pH7.5 Buffer C: 20mM PBS, pH7.5,30%异丙醇
3.疏水色谱纯化细胞培养样品中的抗体
1800 1500
A280(mAu)
1200 900 600 300 0 0 50 100 150 200 250 300
volume(ml)
苯基琼脂糖凝Байду номын сангаас分离抗体
填料:苯基琼脂糖凝胶 FF 5ml Buffer A:50mM PBS,0.6M 硫酸铵,pH7.0 Buffer B: 50mM PBS,pH7.0 结果:洗脱蛋白量4.5mg/ml×20ml=90mg
SDS-PAGE图 1.marker 2. 腹水上样 3.腹水blue柱穿透 4. 腹水blue柱洗脱 5.腹水PrA柱穿透 6. 腹水PrA柱洗脱
2.亲和纯化血浆中的抗体
抗体纯化方法汇总与比较

抗体纯化方法汇总与比较
1. 概论
制备出效价高,特异性强,稳定性好的抗体是免疫学实验取得成功的基础,抗体质量的好坏直接影响着研究者研究的成败,不同的免疫学实验方法(如ELISA,IHC,IP,ICC,SDS-PAGE, WB等)对抗体的效价,浓度和纯度有不同的要求。
我们知道,一般免疫血清中含有特异性抗体和非特异性抗体,血清蛋白以及其他各种杂蛋白等,在制备特异性抗体过程中当抗体的效价达到实验预期之后,我们所制备的抗体的纯度关键取决于所选择的纯化方法。
下面就一一介绍常用抗体纯化方法及其相关原理。
免疫球蛋白主要有5种,轻链和重链的组成也有较大差异。
其结构如下图所示:
各类免疫球蛋白有不同的亚型,下图展示人免疫球蛋白各亚型的理化性质:
2. 沉淀法
硫酸铵/辛酸沉淀法是纯化抗体最传统的方法之一,被广泛用于血清和腹水抗体的浓缩和粗纯,此方法可大规模粗纯抗体,但纯化后纯度不高,还需配合其它方法继续纯化。
通常是将饱和硫酸加入血清或腹水中,将抗体沉淀下来,然后在溶解沉淀继续下一步的纯化。
辛酸沉淀抗体通常要先将腹水或血清的pH调至4.8,然后缓慢的滴加辛酸,是蛋白沉淀,抗体在上清中,上清继续下一步的纯化。
3. 离子交换层析
离子交换层析也常用于抗体的纯化,通量大,工业上用离子交换层析成本低,主要用于除去非抗体蛋白,及用亲和层析纯化时混入的Protein A/G等亲和填料脱离的配基,内毒素的去除等。
离子交换纯化时,根据抗体的pI选择合适的离子交换类型,在pI未知时可以分别用阴阳离子交换填料去试验。
27抗体的纯化——沉淀法

抗体的纯化方法很多,最为常用的为以下四种方法,基于工业化生产工艺开发的规模化生产方法要比这些复杂得多,甚至多个纯化策略联合使用,有兴趣的科研工作者可以查阅相关的文献。
1)沉淀法:利用抗体蛋白疏水性不同,提高盐离子浓度蛋白沉淀,常用的沉淀方法有硫酸铵沉淀法、辛酸沉淀法、辛酸-硫酸铵沉淀法、优球蛋白沉淀法和聚乙二醇沉淀法;这类纯化各有各的优缺点,往往对某些亚型抗体有偏爱性。
2)广谱亲和纯化:这类纯化主要是利用金黄色葡萄球菌ProteinA /G蛋白可以特异性与抗体的Fc结合的原理进行的。
3)抗原特异性纯化:将特异性的抗原偶联到琼脂糖凝胶等固相载体上,纯化方法与ProteinA /G纯化方法相同。
4)离子交换法:DEAE-Sephadex A-50(二乙氨基—乙基-葡萄糖凝胶A-50)为弱碱性阳离子交换剂。
用NaOH 将Cl-型转变为OH-型后,可吸附酸性蛋白。
血清中的γ球蛋白属于中性蛋白(等电点为pH6.85~7.5),其余均属酸性蛋白。
pH7.2~7.4的环境中,酸性蛋白均被DEAE- Sephadex A-50吸附,只有γ球蛋白不被吸附。
因此,通过柱层析,γ球蛋白便可在洗脱中先流出,而其他蛋白则被吸附在柱上,从而便可分离获得纯化的IgG。
1. (NH4)2SO4沉淀法纯化抗体1.1 饱和硫酸铵配制:无菌去离子水加入足量硫酸铵之后,加热到65℃以上,在磁力搅拌器上搅拌溶解至底部仍有未溶解的硫酸铵,待冷却后,取上清滤纸过滤。
1.2 样品(血清或腹水),12,000rpm离心30min(4℃),除去细胞碎片,保留上清液并测量体积。
1.3 边搅拌边缓慢加入等体积的饱和硫酸铵溶液到上清液中,溶液放在磁力搅拌器上室温搅拌6h或搅拌过夜(4℃),使蛋白质充分沉淀。
1.4 蛋白溶液12,000rpm离心30min(4℃),沉淀用原样品体积的PBS溶液重悬,重悬后12,000rpm离心10min(4℃),上清转移到一个新离心管。
抗体纯化原理

抗体纯化原理
抗体纯化是指将含有目标抗体的样品与其他成分分离开来,以得到纯净的抗体溶液。
抗体纯化的原理依赖于抗体与其他成分之间的物理和化学性质的差异。
下面介绍几种常见的抗体纯化原理:
1. 亲和层析:利用抗原与其相应的抗体之间的非共价结合,将抗体固定在由该抗原构建的亲和纯化树脂上。
样品通过亲和层析柱时,抗体会与亲和树脂上的抗原结合,其他成分则流经柱子。
之后再通过改变条件(如pH值、盐浓度等),使抗体与
抗原解离,从而得到纯化的抗体溶液。
2. 离子交换层析:利用抗体与离子交换纯化材料上的相互作用进行分离。
离子交换纯化材料通常带有电荷(正或负),根据抗体与其表面电荷之间的相互作用,可以实现抗体的吸附和洗脱。
3. 尺寸排除层析(凝胶过滤):根据分子的尺寸差异进行分离,较大的抗体分子无法穿过较小的孔隙,而小分子溶质则可以通过。
通过选择合适的孔隙大小,可以将抗体与其他成分分离开来。
4. 逆向相色谱:利用抗体与逆向相色谱树脂上的静电作用力进行分离。
逆向相色谱树脂是具有亲水性的固相,样品中的抗体在树脂表面形成亲水层,而其他成分则更容易与树脂发生亲和作用,因而被保留在树脂上。
以上所述的抗体纯化原理只是其中的几种常见方法,实际纯化过程中可以根据实验要求和目标抗体的特性选择合适的纯化方法。
纯化抗体的方法

纯化抗体的方法
抗体纯化可是个超级有趣的过程呢!就好像是在一个复杂的大迷宫里寻找那最珍贵的宝藏。
先来说说亲和层析吧,这就像是给抗体准备了一个专属的舒适小窝,只有抗体能舒舒服服地待在里面,其他杂质都只能眼巴巴地看着进不去。
通过特定的配体,精准地把抗体给“抓”出来,这手段,厉害吧!
还有离子交换层析呢,就像是个聪明的分拣员,根据抗体和杂质所带电荷的不同,把它们区分开来。
抗体带着合适的电荷,就能顺利地被留下来,而那些不合适的杂质就只能被淘汰啦。
凝胶过滤层析也不能小瞧呀!它就像是个神奇的筛子,根据分子大小的不同来进行筛选。
抗体在里面就像是找到了属于自己的通道,一路畅通无阻地通过,而那些大个头的或者小不点的杂质就被挡在外面啦。
沉淀法也挺有意思的,就好像是一场特殊的聚会,在特定的条件下,让抗体聚集在一起,形成沉淀,然后和其他杂质分离开来。
你想想看,要从那么多乱七八糟的东西里面把抗体准确地挑出来,这得多不容易啊!但科学家们就是有这样的本事,他们就像超级英雄一样,用各种神奇的方法把抗体纯化出来。
这难道不是很令人惊叹吗?
抗体纯化的这些方法,每一种都有自己独特的魅力和作用。
它们相互配合,就像是一支默契十足的团队,共同为了纯化出高质量的抗体而努力。
这不就和我们在生活中一样吗,大家各自发挥自己的优势,团结协作,才能取得更好的成果呀!
总之,纯化抗体的方法真的是太神奇、太重要啦!它们为医学研究、疾病诊断和治疗等提供了坚实的基础。
让我们对科学家们的智慧和努力表示由衷的敬佩吧!。
常用抗体纯化方法

常用抗体纯化方法抗体纯化是分离和纯化单克隆或多克隆抗体的方法,以获得高纯度和高活性的抗体样品。
常用的抗体纯化方法包括亲和层析法、离子交换层析法、凝胶过滤法、亲和电泳法、硫酸铵沉淀法等等。
下面将对常用的抗体纯化方法进行详细介绍。
1.亲和层析法:亲和层析法是一种基于抗原-抗体互作原理的分离纯化方法。
先制备含有抗原的固相材料,如亲和树脂或亲和膜,然后将抗体样品与这些固相材料接触,使抗体与抗原结合,其他非特异性蛋白质被洗脱,最后用适当的溶液洗脱目标抗体。
这种方法可以用于多克隆或单克隆抗体的纯化。
2.离子交换层析法:离子交换层析法是利用样品中的离子性蛋白质与离子交换树脂(正离子交换或负离子交换)之间的相互作用进行分离的方法。
通过改变洗脱缓冲液的离子强度和pH值,可以将目标抗体从离子交换树脂上洗脱下来。
这种方法适用于广泛的抗体样品,可以快速纯化大量的抗体。
3.凝胶过滤法:凝胶过滤法是一种分子大小分离纯化方法,适用于分离分子量较大的抗体。
基本原理是通过调节凝胶孔隙大小,使大分子如抗体可以滞留在凝胶中,而小分子如低分子量杂质则可以通过凝胶孔隙逸出。
这种方法操作简单,纯化速度快,适合于大量抗体的纯化。
4.亲和电泳法:亲和电泳法是利用抗体在电场中迁移速度与分子特性有关的原理进行纯化的方法。
可以通过改变电场强度、溶液pH值和溶液离子浓度等参数来调节抗体的迁移速度,从而实现抗体的纯化。
亲和电泳法适用于纯化低丰度目标抗体和快速分离纯化。
5.硫酸铵沉淀法:硫酸铵沉淀法是利用硫酸铵的沉淀作用将目标抗体从混合物中分离出来的方法。
通过调节溶液的硫酸铵饱和度和沉淀时间,可以得到纯度较高的抗体样品。
该方法简单、快速,适用于大量抗体的纯化。
总的来说,抗体纯化方法有很多种,每种方法都有其特点和适用范围。
在实际应用中,可以根据具体的实验要求和抗体性质选择最适合的纯化方法。
同时,也可以结合两种或多种方法进行联合纯化,以获得更高纯度和活性的抗体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
抗体的纯化第一节硫酸铵沉淀法基本原理硫酸铵沉淀法可用于从大量粗制剂中浓缩和部分纯化蛋白质。
用此方法可以将主要的免疫球蛋白从样品中分离,是免疫球蛋白分离的常用方法。
高浓度的盐离子在蛋白质溶液中可与蛋白质竞争水分子,从而破坏蛋白质表面的水化膜,降低其溶解度,使之从溶液中沉淀出来。
各种蛋白质的溶解度不同,因而可利用不同浓度的盐溶液来沉淀不同的蛋白质。
这种方法称之为盐析。
盐浓度通常用饱和度来表示。
硫酸铵因其溶解度大,温度系数小和不易使蛋白质变性而应用最广。
试剂及仪器·组织培养上清液、血清样品或腹水等·硫酸铵(NH4)SO4·饱和硫酸铵溶液(SAS)·蒸馏水· PBS(含0.2g/L叠氮钠) (见附录一)·透析袋·超速离心机· pH计·磁力搅拌器实验步骤以腹水或组织培养上清液为例来介绍抗体的硫酸铵沉淀。
各种不同的免疫球蛋白盐析所需硫酸铵的饱和度也不完全相同。
通常用来分离抗体的硫酸铵饱和度为33%—50%。
一、配制饱和硫酸铵溶液(SAS)将767g(NH4)2SO4 边搅拌边慢慢加到1升蒸馏水中。
用氨水或硫酸调到pH7.0。
此即饱和度为100%的硫酸铵溶液(4.1 mol/L, 25°C);其它不同饱和度硫酸铵溶液的配制见表1;二、沉淀1、样品(如腹水)20 000´g 离心30 min,除去细胞碎片;2、保留上清液并测量体积;3、边搅拌边慢慢加入等体积的SAS到上清液中,终浓度为1:1(v/v);4、将溶液放在磁力搅拌器上搅拌6小时或搅拌过夜(4°C),使蛋白质充分沉淀。
三、透析1、蛋白质溶液10 000´g 离心30 min(4°C)。
弃上清保留沉淀;2、将沉淀溶于少量(10-20ml)PBS-0.2g/L叠氮钠中。
沉淀溶解后放入透析袋对PBS-0.2g/L 叠氮钠透析24-48小时(4°C),每隔3-6 小时换透析缓冲液一次,以彻底除去硫酸氨;3、透析液离心,测定上清液中蛋白质含量。
应用提示一、先用较低浓度的硫酸氨预沉淀,除去样品中的杂蛋白。
1、边搅拌边慢慢加SAS到样品溶液中,使浓度为0.5:1 (v/v);2、将溶液放在磁力搅拌器上搅拌6小时或过夜(4°C);3、3000´g 离心30 min(4°C),保留上清液;4、上清液再加SAS到0.5:1 (v/v),再次离心得到沉淀。
将沉淀溶于PBS,同前透析,除去硫酸氨;5、杂蛋白与欲纯化蛋白在硫酸氨溶液中溶解度差别很大时,用预沉淀除杂蛋白是非常有效的;二、为避免体积过大,可用固体硫酸氨进行盐析(硫酸氨用量参考表1);三、硫酸氨沉淀法与层析技术结合使用,可得到更进一步纯化的抗体。
参考文献1、Burd, R.S., Raymond, C.S., Ratz, C. A and Dunn, D.L (1993) A rapid procedure for purifying IgM monoclonal antibodies from murine ascites using a DEAE – disk. Hybridoma12, 135.2、T.G.库珀着,徐晓利主译《生物化学工具》人民卫生出版社出版(1980),353。
(夏泉)表1.室温下硫酸氨饱和度由起始浓度(S1)提高到终浓度(S2)时需加硫酸氨的量(g/L)0%10%20%25%30%33%35%40%45%50%55%60%65%70%75%80%90%56 114 144 176 196 209 243 277 313 351 390 430 472 516 561 662 76757 86 118 137 150 183 216 251 288 326 365 406 449 494 592 64929 59 78 91 123 155 189 225 262 300 340 382 424 520 61930 49 61 93 125 158 193 230 267 307 348 390 485 58319 30 62 94 127 162 198 235 273 314 356 449 54612 43 74 107 142 177 214 252 292 333 426 52231 63 94 129 164 200 238 278 319 411 50631 63 97 132 168 205 245 285 375 46932 65 99 134 171 210 250 339 43133 66 101 137 176 214 302 39233 67 103 141 179 264 35334 69 105 143 227 31434 70 107 190 27535 72 153 23736 115 19877 15779第二节DEAE离子交换层析法基本原理离子交换层析是蛋白质纯化的常规方法,与硫酸氨沈淀法联合使用可以非常有效地纯化抗体。
DEAE是一种阴离子交换剂,当蛋白质溶液通过DEAE柱时,带负电荷的蛋白质可以被DEAE 吸附,带正电荷的蛋白质则不被吸附而随溶液流出。
纯化抗体时可选择pH值大于待纯化抗体等电点的缓冲液,此时抗体带负电荷可以通过电价键吸附于DEAE离子交换剂上,然后用增加盐浓度的方法将抗体洗脱。
可以用连续梯度法洗脱,也可以用不连续梯度(分段洗脱)法洗脱。
本文以腹水中mAb的纯化为例来介绍此方法。
试剂及仪器·抗体样品(小鼠腹水或经硫酸氨沉淀的抗体)· DEAE离子交换剂(阴离子交换剂)·层析柱(2.5cmÆ ´ 20 cm)·缓冲液A:25mmol/L Tris-HCl pH 8.8 +35 mmol /L NaCl·缓冲液B:25mmol/L Tris-HCl pH 8.8 +70mmol /L NaCl·缓冲液C:25mmol/L Tris-HCl pH 8.8 +500 mmol /L NaCl·缓冲液D:25mmol/L Tris-HCl pH 8.8· PBS (见附录一)·透析袋(MW CO 10 000)·磁力搅拌器·蠕动泵和部分收集器·紫外检测仪·梯度发生器·电导仪· pH计·离心机实验步骤整个层析过程最好在4°C 进行,可在冷室操作;1、抗体样品对缓冲液B 透析过夜(4°C);2、按说明处理DEAE离子交换剂。
然后用缓冲液A 平衡。
用20倍体积缓冲液A洗交换剂,可用过滤或离心法反复洗到流出液的电导率等于缓冲液A;3、将处理好的DEAE离子交换剂悬浮在缓冲液A 中,装入层析柱。
4、用等体积的缓冲液D 稀释透析过的抗体样品,使之与缓冲液A 的离子强度一致;5、稀释后的样品10 000´g 离心10 min(4°C),除去沉淀变性的蛋白质;6、层析柱与蠕动泵、部分收集器及紫外检测仪连接;7、抗体样品以1ml/min 流速上柱,然后用缓冲液A 洗柱1ml/min,将未吸附的蛋白质洗出。
直到流出液在280 nm 的吸光度小于0.05;8、吸附的蛋白质,用连续增加NaCl的浓度来洗脱。
用线性梯度缓冲液(35-500 mmol/L NaCl)或分段缓冲液(35、70、140、280、500 mmol/L NaCl)洗脱。
流速1ml/min ,分部收集洗脱液2ml / 管(图2-4-1);9、椐紫外检测结果,将抗体峰部分合并。
装入透析袋对PBS(含0.2g/L叠氮钠)4°C 透析或冷冻(视抗体的稳定性而定);10、DEAE离子交换剂可按照商品说明再生使用。
图2-4-1 DEAE离子交换柱层析纯化小鼠IgG流速:1ml/min 样品:0.5ml腹水检测方法1、大部分小鼠的单克隆抗体IgG可在50—200mmol/L NaCl浓度之间洗脱。
2、可用SDS-PAGE 或定量免疫学方法(RIA、ELISA)检测各部分洗脱液的抗体存在及效价。
实验要点及说明1、要得到满意的分离结果,每ml DEAE 离子交换剂所加样品中蛋白质总量最好不超过10mg。
2、用经硫酸铵沉淀初步纯化的抗体代替小鼠腹水作为样品,可得到更好的纯化结果。
3、如抗体与DEAE离子交换剂不能有效的结合,可将起始缓冲液的pH提高0.1个单位,直到可以有效结合为止。
4、如果没有合用的蠕动泵和部分收集器,可用手工上样和收集。
洗脱液每管收集0.5-2ml ,然后用分光光度计测定各管280nm波长的吸光度值。
5、该方法可按比例扩大。
用适合于高流速的大柱和相应的交换剂来纯化大量的蛋白质样品。
参考文献1. Corthier, G., Boschetti, E. and Charley-Poulain, J. (1984) Improved method for IgG purification from various animal species by ion exchange chromatography J. Immunol. Meth . 66, 75-79.2、张保真编译西安医科大学出版(1986)《免疫组织化学理论与技术》69-71。
(夏泉)第三节羟磷灰石层析纯化抗体基本原理羟磷灰石[Ca10(PO4)6(OH)2]吸附蛋白质的机理,通常认为与其晶体表面的Ca2+ 和PO43- 两种基团相关。
因为带电基团紧密排列于晶体表面,可能通过偶极子之间的相互作用来吸附蛋白质。
样品被吸附剂吸附后,用适当的洗脱液(较高浓度的盐溶液)冲洗,可使之解析。
解析下来的物质在流经层析柱的过程中向前移动,遇到前面新的吸附剂可再被吸附。
在反复的吸附—解析—再吸附—再解析的过程中,由于待分离物质与吸附剂之间的吸附能力不同,它们沿洗脱液流动方向移动的速度也不相同,所以在洗脱过程中各组分便会由于移动速度不同而被分离。
抗体与其它蛋白质一样可以用羟磷灰石吸附柱层析进行纯化。
试剂及仪器·抗体样品(腹水或培养上清液)·羟磷灰石(Hydroxylapatite 有售)·层析柱(2.5cmÆ ´ 20 cm)·吸附缓冲液:20mmol/L 磷酸钾缓冲液pH6.8 含30mmol /L NaCl·洗脱缓冲液:500mmol/L 磷酸钾缓冲液pH6.8 含30mmol /L NaCl· PBS (见附录1)·透析袋(MW CO 10 000)·磁力搅拌器·蠕动泵和部分收集器·紫外检测仪·梯度发生器·离心机实验步骤1、羟磷灰石柱的准备:将羟磷灰石悬浮于吸附缓冲液中,使之充分水合后装柱。
