磷酸烯醇式丙酮酸羧激酶(PEPCK)试剂盒说明书
丙酮酸激酶检测试剂盒测定原理

丙酮酸激酶检测试剂盒测定原理一、概述在生命科学研究中,分子生物学领域的检测试剂盒广泛应用于疾病诊断、基因表达分析和药物筛选等方面。
丙酮酸激酶检测试剂盒是一种用来测定丙酮酸激酶(Pyruvate Kinase,简称PK)活性的试剂盒。
本文将从以下几个方面介绍丙酮酸激酶检测试剂盒的测定原理:•丙酮酸激酶简介•丙酮酸激酶检测试剂盒组成•丙酮酸激酶检测试剂盒测定原理二、丙酮酸激酶简介丙酮酸激酶是一种在糖酵解过程中起关键作用的酶,它能够催化丙酮酸与磷酸化物(如ADP)反应生成磷酸丙酮酸和ATP。
丙酮酸激酶广泛存在于真核生物和原核生物的细胞质中,是细胞能量代谢的重要调控因子。
三、丙酮酸激酶检测试剂盒组成一般来说,丙酮酸激酶检测试剂盒由以下几个组分组成: 1. 丙酮酸激酶底物:一种特定的丙酮酸底物。
2. 辅酶:用于促进丙酮酸激酶的催化活性。
3. PK反应缓冲液:用于维持反应环境的稳定性。
4. 酶标试剂:用于测定反应终点的标记试剂。
5. 正样品:已知浓度的丙酮酸激酶样品,用于构建标准曲线。
四、丙酮酸激酶检测试剂盒测定原理丙酮酸激酶检测试剂盒测定原理基于丙酮酸激酶催化丙酮酸与磷酸化物反应的特性。
具体步骤如下:1. 样品制备将需要测定丙酮酸激酶活性的样品收集,并通过离心等方法,将样品从细胞或组织中提取出来,得到纯化的丙酮酸激酶。
2. 反应体系配置按照试剂盒说明书中的配方,将丙酮酸底物、辅酶和PK反应缓冲液按一定比例混合,制备反应底物液。
3. 样品处理将制备好的样品与反应底物液按照一定比例混合,使得反应体系达到相应的浓度。
4. 反应过程将混合好的反应物置于适当的温度下孵育一段时间,使丙酮酸激酶催化底物发生反应,生成磷酸丙酮酸和ATP。
5. 酶标反应将反应终止或稀释后的样品取出,加入酶标试剂,进行酶标反应。
酶标试剂中的特定物质与ATP反应,产生荧光或颜色信号。
6. 信号测定使用合适的光谱仪或读板仪器,测定酶标反应后的荧光或颜色信号的强度。
大鼠神经元特异性烯醇化酶酶联免疫分析(NSE-ELISA)试剂盒使用

大鼠神经元特异性烯醇化酶酶联免疫分析(NSE-ELISA)试剂盒使用说明书本试剂盒仅供研究使用产品编号:E0537r预期应用ELISA法定量测定大鼠血清中NSE含量,有助于诊断小细胞肺癌及相关性疾病。
概述烯醇化酶(Enolase)是参与糖酵解的酶,催化2-磷酸甘油酸向磷酸烯醇丙酮酸的转化,由三种亚基(α、β、γ)组成的二聚体同功酶。
其中αγ和γγ烯醇化酶同功酶存在于神经元及神经来源的细胞中,也称为神经元特异性烯醇化酶(Neurone specific enolase ,NSE)。
在正常大鼠群中NSE含量较低,但在某些神经内皮细胞增生的恶性疾病,如神经母细胞瘤(Neuroblastoma),其含量往往上升。
由于小细胞肺癌(Small cell lung carcinoma,SCLC)是最常表现有神经内分泌性质的肿瘤,目前NSE也是SCLC最敏感最特异的肿瘤标志物。
肺癌是近年来发病率日趋增高的癌种,在种种肺癌中小细胞肺癌占大约20%,因此正确诊断肺癌的类型,特别是确定小细胞肺癌的诊断很重要。
小细胞肺癌患者的αγ和γγ同功酶含量均有不同比例的增高,因些必须在同一敏感度下同时检测NSE的αγ和γγ同功酶含量。
本试剂盒所用单抗只针对NSE的γ亚基,而与α或β亚基无交差反应。
据文献报道,NSE含量测定可作为肺癌、成神经细胞瘤、黑素瘤、精原细胞瘤以及中枢精神系统损伤的诊断指标。
同时,也可用于SCLC治疗前后疗效的监测与预后,以及SCLC 与其它型肺癌的鉴别诊断。
实验原理本试剂盒应用双抗体夹心酶标免疫分析法测定血清中NSE水平。
用纯化的抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入NSE抗原、生物素化的抗大鼠NSE抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的NSE呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
神经元特异性烯醇化酶(NSE)测定试剂盒(化学发光免疫分析法)产品技术要求参考版
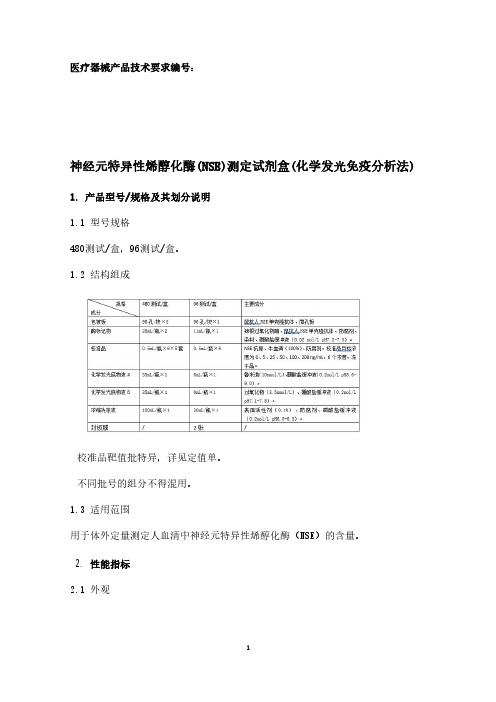
医疗器械产品技术要求编号:
神经元特异性烯醇化酶(NSE)测定试剂盒(化学发光免疫分析法) 1.产品型号/规格及其划分说明
1.1型号规格
480测试/盒,96测试/盒。
1.2结构组成
校准品靶值批特异,详见定值单。
不同批号的组分不得混用。
1.3适用范围
用于体外定量测定人血清中神经元特异性烯醇化酶(NSE)的含量。
2.性能指标
2.1外观
组分齐全、完整;溶液无混浊,无沉淀或絮状物;微孔板包装袋无破损、漏气现象。
2.2准确度
回收率应在90%~110%范围内。
2.3线性
在[0.5,200]ng/mL范围内,r应不小于0.9900。
2.4空白限
应不大于0.50ng/mL。
2.5精密度
2.5.1批内精密度
手工操作应不大于10.0%,全自动操作应不大于8%。
2.5.2批间精密度
应不大于15.0%。
2.6特异性
根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》规定了校准品的来源、赋值以及不确定度等内容,溯源至企业工作校准品。
2.8稳定性
2.8.1效期末稳定性
NSE试剂盒在2~8℃保存,有效期12个月。
在NSE试剂盒有效期满后2个月内,分别检测2.1~2.4,2.5.1项,结果应符合各项要求。
2.8.2校准品复溶后稳定性
复溶后的校准品在2~8℃条件下保存7天后检测2.2~2.4,2.5.1项,结果应符合各项要求。
002植物磷酸烯醇式丙酮酸羧激酶及其编码基因研究进展

植物磷酸烯醇式丙酮酸羧激酶及其编码基因研究进展杨玲玲(化学与生命科学学院2009级食品质量与安全监测专业学号091004024)指导教师:蔡英卿副教授摘要:本文主要介绍了C4植物中磷酸烯醇丙酮酸羧激酶(PEPCK)及其编码基因在近年来的研究进展,以及对PEPCK的结构,功能,影响其活性的因素等方面进行讨论。
关键词:C4植物磷酸烯醇丙酮酸羧激酶编码基因光合速率磷酸烯醇式丙酮酸羧激酶(PEPCK,EC4.1.1.49)催化如下的反应:OAA +ATP →PFP+ADP+CO2。
PEPCK主要作用是参与C4代谢途径的CO2固定作用。
其主要分布在C4植物的叶肉细胞的叶绿体内,形成CO2的浓缩机制为维管束鞘细胞的C3途径提供CO2。
近些年来利用生物技术已将编码该酶的基因(ppc)转移到C3作物中并得到了超量表达,因此,PEPCK成为改善C3作物光合作用重点关注的酶。
对PEPCK有两种形式:一种是存在于哺乳类、鸟类和昆虫等动物内的PEPCK.它利用GTP为底物,Mt 为70000 ;另一种存在于植物、细菌、酵母和藻类中,利用ATP作底物,这种PEPCK的蛋白质分子序列与动物中的不同。
植物的PEPCK与细菌、酵母和藻类的氨基酸序列比较接近,都有一个与ATP结合的保守序列,但来自植物的PEPCK 相对分子质量较太。
本文主要简述近年来对C4植物PEPCK的研究进展。
1 PEPCK的分布与定位1.1 PEPCK的分布1.2 PEPCK的定位2 PEPCK的蛋白结构和生理功能2.1 PEPCK的蛋白结构2.1.1相对分子质量2.1.2活化中心2.2 PEPCK的生理功能2.2.1 生糖作用2.2.2 浓缩CO22.2.3 细胞内的PH平衡2.2.4 其他作用3 PEPCK酶的调节3.1磷酸化调节3.2产物调节4 PEPCK的分子生物学4.1 PEPCK基因的结构特征4.2 PEPCK基因的克隆5 结语。
植物磷酸烯醇式丙酮酸羧化酶的研究进展

2021年 2月 Journal of Science of Teachers′ College and University Feb. 2021文章编号:1007-9831(2021)02-0054-07植物磷酸烯醇式丙酮酸羧化酶的研究进展于济1,2,沙伟1,2,张梅娟1,2,马天意1,2(齐齐哈尔大学 1. 生命科学与农林学院,2. 抗性基因工程与寒地生物多样性保护黑龙江重点实验室,黑龙江 齐齐哈尔 161006)摘要:磷酸烯醇式丙酮酸羧化酶(Phosphoenolpyruvate carboxylase,PEPC,EC 4.1.1.31)是广泛存在的一种细胞质酶,催化磷酸烯醇式丙酮酸和HCO3-生成草酰乙酸.PEPC作用的产物在植物的生长发育过程和植物应对环境胁迫反应中起到调控的作用,因而被广泛关注.介绍了植物PEPC的种类、结构特征、不同物种中PEPC基因的克隆与分离、在植物逆境反应中的应用、植物PEPC 的活性调节,为深入研究PEPC基因提供理论依据.关键词:磷酸烯醇式丙酮酸羧化酶;植物;植物逆境胁迫中图分类号:Q945 文献标识码:A doi:10.3969/j.issn.1007-9831.2021.02.011Research progress of plant phosphoenolpyruvate carboxylaseYU Ji1,2,SHA Wei1,2,ZHANG Meijuan1,2,MA Tianyi1,2(1. School of Life Sciences,Agriculture and Forestry,2. Heilongjiang Provincial Key Laboratory of Resistance Gene Engineering andProtection of Biodiversity in Cold Areas,Qiqihar University,Qiqihar 161006,China)Abstract:Plant phosphoenolpyruvate carboxylase(PEPC,EC 4.1.1.31)is a ubiquitous cytoplasmic enzyme that catalyzes the production of Oxaloacetate by phosphoenolpyruvate and HCO3-.The products of PEPC play important roles in the growth and development of plants and the responses of plants to environmental stresses,so that the PEPC is widely concerned.Introduced the types,structural characteristics,the cloning and isolation of PEPC genes in different species,the applications in plant stress responses,and the researches of plant PEPC activity regulation,which provides a theoretical basis for further studiesof PEPC genes.Key words:phosphoenolpyruvate carboxylase;plant;plant stress responses磷酸烯醇式丙酮酸羧化酶(Phosphoenolpyruvate carboxylase,PEPC,EC 4.1.1.31)是一种胞质酶,在HCO3-存在的情况下,可以催化磷酸烯醇式丙酮酸(Phosphoenolpyruvate,PEP)的β-羧化反应,以Mg2+为辅因子生成草酰乙酸(Oxobutanedioic acid,OAA)和无机磷酸[1]70,此反应为不可逆反应.PEPC存在于所有植物中,如绿藻、蓝细菌、大多数古细菌、非光合细菌中,但在动物和真菌中不存在[2]15. PEPC以其在C4和景天酸代谢(Crassulacean acid metabolism,CAM)光合作用中的作用而闻名,在此过程中,其初步固定了大气中的CO2[3]274.然而,PEPC在C3植物的非光合和光合组织中也发挥着广泛的作用,它可以通过补充C4-二羧酸进行能量和生物合成代谢,主要起抗衰老作用[4-5].在C3植物叶片和非光合收稿日期:2020-11-15基金项目:齐齐哈尔大学大学生创新创业训练计划项目(202010232817);黑龙江省省属高等学校基本科研业务费青年创新人才项目(135309364);黑龙江省省属高等学校基本科研业务费科研项目植物性食品加工技术特色学科专项(YSTSXK201876);黑龙江省人力资源和社会保障厅2018年省级留学回国人员择优资助项目作者简介:于济(1997-),女,吉林松原人,在读硕士研究生,从事植物逆境分子遗传学研究.E-mail:*****************通信作者:马天意(1989-),男,黑龙江齐齐哈尔人,讲师,博士,从事植物逆境分子遗传学研究.E-mail:********************组织中,PEPC的主要作用是在三羧酸循环中补充中间体,以及后面的氮同化和各种生物合成途径[3]274.此外,PEPC还参与了广泛的生理和发育过程,包括种子萌发和发育、果实成熟、豆科植物根瘤固氮等,在气孔保卫细胞中提供苹果酸以及增强了对渗透压和生物胁迫的耐受性[2,6-9].正是因为PEPC在植物中发挥着非常重要的作用,因此被人们广泛关注.为了更好地了解植物体中的磷酸烯醇式丙酮酸羧化酶基因的作用机制,本文概括分析了植物磷酸烯醇式丙酮酸羧化酶基因的分类、功能、分离与克隆、活性调节以及在植物抵抗逆境过程中的作用等方面的研究结果,介绍了磷酸烯醇式丙酮酸羧化酶基因在基因工程方面的应用,也为进一步研究磷酸烯醇式丙酮酸羧化酶基因提供了理论基础.1 PEPC的基本结构1984年,首先从大肠杆菌(Escherichia coli)克隆的PEPC基因推导了PEPC的一级结构[10].目前,已经分别在植物和细菌中发现了许多PEPC序列,包括同一生物体中的同工型,并且大约500个部分序列已经记录在GenBank中,主要用于系统发育重建[11-12].系统进化树显示,这些PEPC是从相同的祖先进化而来的[3,13].PEPC多肽的大小随生物体的种类而异:细菌、维管束植物、蓝细菌、原生动物(如疟疾病原体)的氨基酸残基数量大约为870(100 kDa),970(110 kDa),1010(116 kDa)或1150(134 kDa)[1]71.尽管已知古细菌的亚基大小非常小(约60 kDa),并且没有常见的变构调节子,但尚无来自古细菌的PEPC 序列数据[14-15].此外,还寻找了藻类PEPC的序列数据,因为硒的纯化亚型之一是由3种不同的亚基组成的[16],这种新的PEPC类型也在发育中的蓖麻(Ricinus communis)种子中被发现[17].在拟南芥(Arabidopsis thaliana)基因组序列中确定了另一种新的进入高等植物PEPC的第4种亚型[18],在分子大小上与蓝细菌的PEPC相似,并且缺少N端磷酸化位点,这是植物PEPC的标志.在植物和微生物界的多样性和广泛分布使得PEPC成为系统发育分析中最有趣的目标之一.对PEPC序列的比对表明,大约100个残基始终是保守的(相同的),另外100个残基是保守的具有相似的氨基酸残基的,对于成对的陆地植物酶,其识别率超过71%,因为C末端是高度保守的,所以长度的任何差异似乎是由于在N末端或内部区域(大约10个基因位点)处添加或插入了额外的序列而引起的.所制备的重组PEPCs的数量和特征仍是有限的,所涉及的物种目前不超过15个[1]71,因此有必要做进一步的工作.2 植物PEPC的分类及生理生化功能PEPC基因已大致分为2个亚家族,分为植物型PEPC(PTPC)和细菌型PEPC(BTPC)[19]11.PTPC表现出高度的遗传保守性,并在其100~110 kDa蛋白质中包含高度保守的N末端丝氨酸磷酸化基序和关键的C末端四肽QNTG[1,20].相比较而言,116~118 kDa的BTPC蛋白质显示低序列相似性并包含1个类似原核的C端(R/K)NTG四肽基序[17,21].PTPC典型地存在于同型四聚体-1类PEPCs中,而BTPCs作为调节和催化亚基存在于超常的异质配合物中(2类PEPCs)[2]26.PTPC又可以分为C4,C3和根特异亚型[21-22],它们在植物细胞中发挥着不同的功能.植物中PEPC的C3,C4类型至少在3个关键方面不同[23]:(1)C4型的PEPC通过吸收C4和CAM物种中的大气CO2参与了CO2浓缩机制的第1步,C3型PEPC存在于所有植物中,它参与多种生理功能,如三羧酸循环中中间体的补给,OAA的合成以及随后的苹果酸及其衍生物的合成[2]15.(2)C4型PEPC存在于叶肉细胞中,其表达方式对实现C4光合循环具有重要意义[24],而C3型的PEPC分布在C3和/或C4植物的不同组织中,起到管家的作用[22]865.(3)C4型PEPC的底物(PEP)饱和常数(Km)高于C3型,并且显示更多对苹果酸的耐受性,但是在一些植物物种中(如南美白菊科(Chenopodiaceae)植物和异子蓬(Suaedaaralocaspica))尚未将不同的PEPC区分为C3或C4类型,仅命名为ppc-1,ppc-2[25],它们的功能需要进一步验证.3 植物PEPC基因的分离与克隆1953年,植物的磷酸烯醇式丙酮酸羧化酶从菠菜(Spinacia oleracea)叶中首次被分离出来.目前,PEPC基因已在多种植物中被鉴定和研究,拟南芥和水稻(Oryzasativa)中分别报道4,6个PEPC家族成员[18,26],在大豆(Glycine max)中共鉴定到10个PEPC基因(GmPEPC1~10),其中GmPEPC6,GmPEPC8,GmPEPC9被铝毒、寒害、盐害等非生物胁迫诱导表达[27].花生(Arachis hypogaea)基因组报道5个PEPC 基因(AhPEPC1~5)[28],涂嘉琦[29]等从蔓花生(Arachis duranensis)基因组中鉴定到9个PEPC基因.马海洋[30]等从菠萝(Ananas comosus)基因组中鉴定出3个PEPC基因.邵姁[31]等从蓝莓(Vaccinium corymbosum)果实中克隆到磷酸烯醇式丙酮酸羧化酶编码基因VcPEPC,该基因开放阅读框全长为2 907 bp,可编码968个氨基酸,分子量为110.59 kD.赵晋锋[32]等从谷子(Setariaitalica)基因组中鉴定出1个SiPEPC基因,进一步研究表明,SiPEPC基因在拔节期和抽穗期正常光照强度下参与了对干旱胁迫的响应,推测SiPEPC基因参与了谷子对非生物逆境的应答,可能在干旱和其它逆境胁迫信号途径中起关键作用.4 植物PEPC基因在植物逆境反应中的作用非生物胁迫(如盐度、干旱、高温)通常会对植物的光合作用产生负面影响[33]901.PEPC已被建议用于支持主要的生理代谢途径(即三羧酸循环中中间体的补给等),以帮助植物和微生物避免和/或耐受极端的环境胁迫[7,34].在水分胁迫下,PEPC介导PEP的羧基化为OAA,随后合成苹果酸和渗透活性化合物(糖、氨基酸、糖醇)以帮助植物耐受水分胁迫[34-35].铝的积累、磷和铁的缺乏导致PEPC的上调,从而增加了包括苹果酸和柠檬酸在内的有机酸合成[36-38].有机酸向土壤中的排泄不仅可以增加磷和铁的可溶性形态并为植物所利用,还可以与Al3+形成稳定的配合物,从而降低毒性[39].生物应激(如病毒感染)也可以诱导PEPC的高活性,推测PEPC可以在防御作用中增强植物抗毒素、氨基酸、蛋白质的合成[40-41].也有研究表明,番茄(Lycopersicon esculentum)PEPC基因在盐、冷、植物激素胁迫下均有不同表达[19]15.可以推测PEPC 对植物的生长发育和抗逆性起一定作用.5 PEPC基因的应用目前,已经在多种植物物种中使用了不同PEPC基因作为改善作物的手段.如在水稻中,C4-PEPC使转基因水稻具有耐旱性,但叶绿体定位的PEPC对铵同化至关重要[42].玉米(Zea mays)C4型PEPC基因在小麦(Triticum aestivum)受体内实现了正确的转录和准确的剪接,也证明了玉米C4型PEPC基因在小麦中表现了一定的光合生理效应[43].以转甘蔗(Saccharum officinarum)PEPC基因的籼稻植株和非转基因的植株为研究材料,发现在光合效率和产量相关性状方面,转甘蔗PEPC基因植株都有较大提高,可以实现增产目的[44].张桂芳[45]等首次将含有稗草(Echinochloacrusgalli)根型的PEPC基因对水稻进行遗传转化,研究结果表明,转基因水稻的PEPC活性最高,为对照的5.85倍,植株叶片的净光合速率(Pn)较对照相比提高了20.0%.尹吴[46]等发现,与对照相比,转玉米PEPC基因的杨树表现出较强的光利用能力,其羧化能力和酶活性与对照相比最高可分别增加62.3%,38.6%.最近有研究表明,许多PEPC基因在增强对各种非生物和生物胁迫的耐受性中起调节作用.在干旱和盐胁迫下,PEPC的过度表达增强了耐受性[8]1513,但抑制导致转基因植物对渗透胁迫的敏感性增加[47].同样,拟南芥AtPPC4也可能在干旱胁迫中发挥作用[33]906.然而,表达PEPC的马铃薯(Solanum tuberosum)转基因植株表现出整体有机氮含量的增加,但淀粉和可溶性糖含量有所损失[48].6 植物组织中PEPC的活性调节PEPC通常由4个相同的亚基组成,相对分子质量约为95~110 kDa.大多数PEPC是变构酶,具有多种变构效应物,具体取决于生物的种类[1]70.此外,维管植物PEPCs通过位于N末端附近的保守丝氨酸处的可逆磷酸化来调节[49].目前解析了来自大肠杆菌和玉米的PEPC三维结构[50-51],这种结构信息以及通过定点诱变获得的信息为长期以来一直深入研究的催化和变构调节的分子机理提供了启示. 大多数PEPC都受变构调节,维管植物的效应仅限于一组效应类型,双子叶植物的PEPCs被葡萄糖6-磷酸(G6P)激活,并被L-苹果酸或天冬氨酸抑制,而单子叶植物的PEPC被甘氨酸或丙氨酸进一步激活[52]154.相反,大肠杆菌PEPC受更复杂的方式调节,被乙酰辅酶A、果糖1,6-双磷酸、长链脂肪酸、鸟苷3′-二磷酸5′-二磷酸激活,并被天冬氨酸或L-苹果酸抑制[53].此外,细菌PEPC中不存在的调节性磷酸化是植物PEPC中固有的[1]73.调节性磷酸化后,PEP的半饱和浓度略有降低,而抑制剂的半饱和浓度在包含底物和Mg2+生理浓度的反应混合物中增加了约2.7倍[52]155.Tovar-Mendez[52,54-55]等采用目前可用的最明确的玉米C4-PEPC制剂进行了全面的动力学分析,从生理条件下的动力学测量清楚地表明了变构效应子和磷酸化的重要性.S形PEP饱和度曲线归因于附加的PEP与G6P位点的结合[1]73,这些研究成功地应用了变构调控的协调过渡模型来描述玉米C4-PEPC的动力学行为,并且通过快速动力学分析观察到伴随变构过渡的构象变化[56].PEPC的活性在多个层次上受到调节.变构控制由调节PEPC活性(尤其是在细胞质pH值下)的正(葡萄糖6-P,甘氨酸)、负(L-苹果酸,天冬氨酸)效应子施加[3]280.此外,C4-PEPC通过光依赖性磷酸烯醇丙酮酸羧化酶激酶(Phosphoenolpyruvate carboxylase kinase,PEPCK)进行调节性磷酸化[57].PEPC的磷酸化形式与去磷酸化形式的动力学性质不同,如更高的最大反应速率对PEP的亲和力更高,对变构效应子的敏感性有所改变,从而减轻了苹果酸对其抑制作用,并增强了其对葡萄糖-6-P和甘氨酸的活化作用[58-59].高粱(Sorghum bicolor)中所有PTPC(SbPPC1-5)均含有带有保守丝氨酸的N末端磷酸化结构域,BTPC (SbPPC6)中不存在此域,PEPCK基因家族包括3个基因(SbPPCK1~3)[60],在叶肉细胞中,SbPPCK1的表达是由光触发的,其转录本在叶肉中比束鞘细胞更为丰富,由于这些原因,它被认为是光合异构体,其中SbPPCK2和SbPPCK3的功能未知[61].另一种可能调控PEPC活性的翻译后修饰(Post-translational modification,PTM)是保守的赖氨酸残基的单泛素化作用,使该酶对苹果酸和天冬氨酸更加敏感[62-64].据报道,该PTM(仅针对C3型PEPCs)存在于蓖麻种子[62]、Hakea prostata种子[63]、高粱种子[64-65]、拟南芥叶片[65-66]中.此外,在不同的植物组织(叶片、保卫细胞、根、果实)[67-70]以及大麦(Hordeum vulgare)、小麦、高粱种子[71-74]中还报道了2条免疫反应性PTPC条带,表明上部条带是下部条带的单泛素化形式.PEPC改变了该酶的动力学特性,从而干扰了其与PEP结合的能力,并增强了其对大多数代谢物效应子的敏感性[62]29656.7 展望植物磷酸烯醇式丙酮酸羧化酶作为C4型光合途径的关键酶,对其结构特点、代谢途径已有较为深入的研究[75].现在PEPC基因已经在越来越多的植物中被发现,并对其功能进行研究探索.在C4和CAM植物中,PEPC的作用以及其基因表征信息比较详细,但在C3植物中PEPC表达的细节报道很少,仍需进一步探索.转PEPC基因植物也在不同方面表达出PEPC基因对植物的调控功能,PEPC作为植物中广泛存在的酶,其在植物应对环境胁迫过程中的作用逐渐被发现,尤其是CAM植物中的大多数物种具有较高抗逆性,而这之中PEPC的相关功能机制还有待进一步挖掘,因此有必要进一步对PEPC基因在植物抗逆性研究中的作用进行详细探索.参考文献:[1] Izui K,Matsumura H,Furumoto T,et al.Phosphoenolpyruvate carboxylase:a new era of structural biology[J].Annual reviewof plant biology,2004,55:69-84[2] O′Leary B,Park J,Plaxton W C.The remarkable diversity of plant PEPC(phosphoenolpyruvate carboxylase):recent insightsinto the physiological functions and post-translational controls of non-photosynthetic PEPCs[J].The biochemical journal,2011(1):15-34[3] Chollet R,Vidal J,O'Leary M H.PHOSPHOENOLPYRUVATE CARBOXYLASE:A Ubiquitous,Highly Regulated Enzyme inPlants[J].Annual review of plant physiology and plant molecular biology,1996,47:273-298[4] Driever S M,Kromdijk J.Will C3crops enhanced with the C4CO2-concentrating mechanism live up to their full potential(yield)?[J].Journal of experimental botany,2013,64(13):3925-3935[5] Masumoto C,Miyazawa S,Ohkawa H.Phosphoenolpyruvate carboxylase intrinsically located in the chloroplast of rice plays acrucial role in ammonium assimilation[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(11):5226-5231[6] Cousins A B,Baroli I,Badger M R,et al.The role of phosphoenolpyruvate carboxylase during C4 photosynthetic isotope exchangeand stomatal conductance[J].Plant physiology,2007,145(3):1006-1017[7] O′Leary B,Fedosejevs E T,Hill A T,et al.Tissue-specific expression and post-translational modifications of plant-andbacterial-type phosphoenolpyruvate carboxylase isozymes of the castor oil plant,Ricinus communis L[J].Journal of experimental botany,2011,62(15):5485-5495[8] Qin N,Xu W,Hu L,et al.Erratum to:Drought tolerance and proteomics studies of transgenic wheat containing the maize C4phosphoenolpyruvate carboxylase(PEPC)gene[J].Protoplasma,2016,253(6):1513[9] 蔡小宁,陈茜,杨平,等.磷酸烯醇式丙酮酸羧化酶的生物信息学分析[J].安徽农业科学,2008(3):914-916[10] Fujita N,Miwa T,Ishijima S,et al.The primary structure of phosphoenolpyruvate carboxylase of Escherichia coli.Nucleotidesequence of the PPC gene and deduced amino acid sequence[J].Journal of biochemistry,1984(4):909-916[11] BesnardG,Offmann B,Robert C,et al.Assessment of the C4 phosphoenolpyruvate carboxylase gene diversity in grasses(Poaceae)[J].Theor Appl Genet,2002,105(2-3):404-412[12] Gehrig H,Heute V,Kluge M.New partial sequences of phosphoenolpyruvate carboxylase as molecular phylogeneticmarkers[J].Molecular phylogenetics and evolution,2001,20(2):262-274[13] Svensson P,Blasing O,Westhoff P,et al.Evolution of C4 phosphoenolpyruvate carboxylase[J].Archives of Biochemistry andBiophysics,2003,414(2):180-188[14] Sako Y,Takai K,Nishizaka T,et al.Biochemical relationship of phosphoenolpyruvate carboxylases(PEPCs)from thermophilicarchaea[J].Fems Microbiology Letters,1997,153(1):159-165[15] Sako Y,Takai K,Uchida A,et al.Purification and characterization of phosphoenolpyruvate carboxylase from the hyperthermophilicarchaeon Methanothermussociabilis[J].FEBS Letters,1996,392(2):148-152[16] Rivoal J,Trzos S,Gage D A,et al.Two unrelated phosphoenolpyruvate carboxylase polypeptides physically interact in the highmolecular mass isoforms of this enzyme in the unicellular green alga Selenastrumminutum[J].The journal of biological chemistry,2001,276(16):12588-12597[17] Blonde J D,Plaxton W C.Structural and kinetic properties of high and low molecular mass phosphoenolpyruvate carboxylaseisoforms from the endosperm of developing castor oilseeds[J].The journal of biological chemistry,2003,278(14):11867-11873 [18] Sánchez R,Cejudo F J.Identification and expression analysis of a gene encoding a bacterial-type phosphoenolpyruvate carboxylasefrom Arabidopsis and rice[J].Plant physiology,2003(2):949-957[19] Waseem M,Ahmad F.The phosphoenolpyruvate carboxylase gene family identification and expression analysis under abiotic andphytohormone stresses in Solanum lycopersicum L[J].Gene,2019,690:11-20[20] Xu W,Ahmed S,Moriyama H,et al.The importance of the strictly conserved,C-terminal glycine residue in phosphoenolpyruvatecarboxylase for overall catalysis:mutagenesis and truncation of GLY-961 in the sorghum C4leaf isoform[J].The journal of biological chemistry,2006,281(25):17238-17245[21] Gennidakis S,Rao S,Greenham K,et al.Bacterial-and plant-type phosphoenolpyruvate carboxylase polypeptides interact in thehetero-oligomeric Class-2 PEPC complex of developing castor oil seeds[J].The plant journal:for cell and molecular biology,2007(5):839-849[22] Dong L Y,Masuda T,Kawamura T,et al.Cloning,expression,and characterization of a root-form phosphoenolpyruvate carboxylasefrom Zea mays:comparison with the C4-form enzyme[J].Plant & cell physiology,1998,39(8):865-873[23] Gehrig H,Faist K,Kluge M.Identification of phosphoenolpyruvate carboxylase isoforms in leaf,stem and roots of the obligate CAMplant Vanilla planifolia Salib.(Orchidaceae):a physiological and molecular approach[J].Plant molecular biology,1998,38(6):1215-1223[24] Stockhaus J,Schlue U,Koczor M,et al.The promoter of the gene encoding the C4 Form of phosphoenolpyruvate carboxylase directsmesophyll-specific expression in transgenic C4Flaveriaspp[J].The plant cell,1997,9(4):479-489[25] Rosnow J J,Edwards G E,Roalson E H.Positive selection of Kranz and non-Kranz C4 phosphoenolpyruvate carboxylase aminoacids in Suaedoideae(Chenopodiaceae)[J].Journal of experimental botany,2014,65(13):3595-3607[26] Muramatsu M,Suzuki R,Yamazaki T,et al.Comparison of plant-type phosphoenolpyruvate carboxylases from rice:identificationof two plant-specific regulatory regions of the allosteric enzyme[J].Plant & cell physiology,2015,56(3):468-480[27] Wang N,Zhong X,Cong Y,et al.Genome-wide Analysis of Phosphoenolpyruvate Carboxylase Gene Family and Their Responseto Abiotic Stresses in Soybean[J].Sci Rep,2016(6):38448[28] Shanlin Y U,Pan L,Yang Q,et al.Identification and expression analysis of the phosphoenolpyruvate carboxylase gene family inpeanut(Arachis hypogaea L.)[J].Agricultural Sciences in China,2010,9(4):477-487[29] 涂嘉琦,甘璐,冯兰兰,等.蔓花生PEPC基因家族的生物信息学分析[J].热带亚热带植物学报,2018,26(2):107-115[30] 马海洋,赵秋芳,陈曙,等.菠萝PEPC基因家族的生物信息学分析[J].热带作物学报,2020,41(1):97-103[31] 邵姁,王月,应炎标,等.蓝莓磷酸烯醇式丙酮酸羧化酶基因cDNA克隆及表达分析[J].基因组学与应用生物学,2016,35(1):166-171[32] 赵晋锋,王高鸿,杜艳伟,等.谷子磷酸烯醇式丙酮酸羧化酶基因(PEPC)对逆境胁迫的响应[J].华北农学报,2019,34(4):67-74[33] Sánchez R,Flores A,Cejudo F J.Arabidopsis phosphoenolpyruvate carboxylase genes encode immunologically unrelatedpolypeptides and are differentially expressed in response to drought and salt stress[J].Planta,2006,223(5):901-909 [34] Doubnerová V,Rylavá H.What can enzymes of C4 photosynthesis do for C3 plants under stress?[J].Plant science:an internationaljournal of experimental plant biology,2011,180(4):575-583[35] Seki M,Umezawa T,Urano K,et al.Regulatory metabolic networks in drought stress responses[J].Current opinion in plantbiology,2007,10(3):296-302[36] Ma J F,Furukawa J.Recent progress in the research of external Al detoxification in higher plants:a minireview[J].Journal ofinorganic biochemistry,2003,97(1):46-51[37] Gregory A L,Hurley B A,Tran H T,et al.In vivo regulatory phosphorylation of the phosphoenolpyruvate carboxylase AtPPC1 inphosphate-starved Arabidopsis thaliana[J].The biochemical journal,2009(1):57-65[38] López-Millán A F,Morales F,Andaluz S,et al.Responses of sugar beet roots to iron deficiency.Changes in carbon assimilationand oxygen use[J].Plant physiology,2000(2):885-898[39] Rangel A F,Rao I M,Braun H P,et al.Aluminum resistance in common bean(Phaseolus vulgaris)involves induction andmaintenance of citrate exudation from root apices[J].Physiologia plantarum,2010(2):176-190[40] Ryslava H,Muller K,Semoradova S,et al.Photosynthesis and activity of phosphoenolpyruvate carboxylase in Nicotiana tabacum L.Leaves infected by potato virus A and potato virus Y[J].Photosynthetica,2003,41(3):357-363[41] Müller K,Doubnerová V,Synková H,et al.Regulation of phosphoenolpyruvate carboxylase in PVY(NTN)-infected tobaccoplants[J].Biological chemistry,2009,390(3):245-251[42] Liu X,Li X,Zhang C,et al.Phosphoenolpyruvate carboxylase regulation in C4-PEPC-expressing transgenic rice during earlyresponses to drought stress[J].Physiologia plantarum,2017(2):178-200[43] 陈绪清,张晓东,梁荣奇,等.玉米C4型PEPC基因的分子克隆及其在小麦的转基因研究[J].科学通报,2004(19):1976-1982[44] 马宏敏.转PEPC基因籼稻恢复系“N175”产量相关性状分析[J].福建农业科技,2014(8):1-2[45] 张桂芳,丁在松,赵明.稗草(Echinochloacrusgalli)根型PPC基因对水稻的遗传转化及其对光合速率的调节效应[J].作物学报,2015,41(3):507-513[46] 尹吴,李丽莎,王立科,等.转玉米PEPC基因杨树的光合生理特性分析[J].林业科学,2012,48(6):63-71[47] Chen M,Tang Y,Zhang J,et al.RNA interference-based suppression of phosphoenolpyruvate carboxylase results in susceptibilityof rapeseed to osmotic stress[J].Journal of integrative plant biology,2010,52(6):585-592[48] Rademacher T,Häusler R E,Hirsch H J,et al.An engineered phosphoenolpyruvate carboxylase redirects carbon and nitrogenflow in transgenic potato plants[J].The plant journal:for cell and molecular biology,2002(1):25-39[49] Vidal J,Chollet R.Regulatory phosphorylation of C4 PEP carboxylase[J].Trends in Plant Science,1997,2(6):230-237[50] Kai Y,Matsumura H,Inoue T,et al.Three-dimensional structure of phosphoenolpyruvate carboxylase:a proposed mechanismfor allosteric inhibition[J].Proceedings of the National Academy of Sciences of the United States of America,1999,96(3):823-828[51] Matsumura H,Xie Y,Shirakata S,et al.Crystal structures of C4 form maize and quaternary complex of E.coli phosphoenolpyruvatecarboxylases[J].Structure,2002,10(12):1721-1730[52] Tovar-Méndez A,Mújica-Jiménez C,Muñoz-Clares R A.Physiological implications of the kinetics of maize leafphosphoenolpyruvate carboxylase[J].Plant Physiology,2000(1):149-160[53] Izui K,Taguchi M,Morikawa M,et al.Regulation of Escherichia coli phosphoenolpyruvate carboxylase by multiple effectors invivo. II. Kinetic studies with a reaction system containing physiological concentrations of ligands[J].Journal of biochemistry,1981(5):1321-1331[54] Tovar-Méndez A,Muñoz-Clares R A.Kinetics of phosphoenolpyruvate carboxylase from Zeamays leaves at high concentration ofsubstrates[J].Biochimica et Biophysica Acta,2001,1546(1):242-252[55] Tovar-Méndez A,Rodríguez-Sotres R,López-Valentín D M,et al.Re-examination of the roles of PEP and Mg2+ in the reactioncatalysed by the phosphorylated and non-phosphorylated forms of phosphoenolpyruvate carboxylase from leaves of Zeamays.Effects of the activators glucose 6-phosphate and glycine[J].Biochemical Journal,1998(3):633-642[56] Frank J,Clarke R J,Vater J,et al.Influence of allosteric effectors on the kinetics and equilibrium binding of phosphoenolpyruvate(PEP)to phosphoenolpyruvate carboxylase(PEPC)from Zea mays[J].Biophysical Chemistry,2001,92(1-2):53-64 [57] Echevarria C,Vidal J.The unique phosphoenolpyruvate carboxylase kinase[J].Plant Physiology and Biochemistry,2003,41(6):541-547[58] Echevarria C,Pacquit V,Bakrim N,et al.The effect of pH on the covalent and metabolic control of C4 phosphoenolpyruvatecarboxylase from Sorghum leaf[J].Archives of Biochemistry and Biophysics,1994,315(2):425-430[59] Takahashi-Terada A,Kotera M,Ohshima K,et al.Maize phosphoenolpyruvate carboxylase.Mutations at the putative bindings ite for glucose 6-phosphate caused desensitization and abolished responsiveness to regulatory phosphorylation[J].The journal of biological chemistry,2005,280(12):11798-11806[60] Wang X,Gowik U,Tang H,et al.Comparative genomic analysis of C4 photosynthetic pathway evolution in grasses[J].GenomeBiology,2009,10(6):447-477[61] Shenton M,Fontaine V,Hartwell J,et al.Distinct patterns of control and expression amongst members of the PEP carboxylasekinase gene family in C4 plants[J].Plant Journal,2006,48(1):45-53[62] Uhrig R G,She Y M,Leach C A,et al.Regulatory monoubiquitination of phosphoenolpyruvate carboxylase in germinating castoroil seeds[J].Journal of Biological Chemistry,2008,283(44):29650-29657[63] Shane M W,Fedosejevs E T,Plaxton W C.Reciprocal control of anaplerotic phosphoenolpyruvate carboxylase by invivo monoubiquitination and phosphorylation in developing proteoid roots of phosphate-deficient harsh hakea[J].Plant Physiology,2013(4):1634-1644[64] Ruiz-Ballesta I,Feria A B,Ni H,et al.In vivomonoubiquitination of anaplerotic phosphoenolpyruvate carboxylase occurs atLys624 in germinating sorghum seeds[J].Journal of Experimental Botany,2014,65(2):443-451[65] Ruiz-Ballesta I,Baena G,Gandullo J,et al.New insights into the post-translational modification of multiple phosphoenolpyruvatecarboxylase isoenzymes by phosphorylation and monoubiquitination during sorghum seed development and germination[J].Journal of experimental botany,2016,67(11):3523-3536[66] Figueroa C M,Feil R,Ishihara H,et al.Trehalose 6-phosphate coordinates organic and amino acid metabolism with carbonavailability[J].The plant journal:for cell and molecular biology,2016(3):410-423[67] Denecke M,Schulz M,Fischer C,et al.Partial purification and characterization of stomatal phosphoenolpyruvate carboxylase fromVicia faba[J].Physiologia Plantarum,1993(1):96-102[68] Law R D,Plaxton W C.Purification and characterization of a novel phosphoenolpyruvate carboxylase from bananafruit[J].Biochemical Journal,1995(3):807-816[69] Nisi P D,Zocchi G.Phosphoenolpyruvate carboxylase in cucumber(Cucumis sativus L.)roots under iron deficiency:activity andkinetic characterization[J].Journal of Experimental Botany,2000,51(352):1903-1909[70] Rao S,Reiskind J,Bowes G.Light regulation of the photosynthetic phosphoenolpyruvate carboxylase(PEPC)in Hydrillaverticillata[J].Plant and Cell Physiology,2006,47(9):1206-1216[71] González M C,Osuna L,Echevarría C,et al.Expression and localization of phosphoenolpyruvate carboxylase in developing andgerminating wheat grains[J].Plant Physiology,1998(4):1249-1258[72] Osuna L,Pierre J N,Gonzalez M C,et al.Evidence for a slow-turnover form of the Ca2+-independent phosphoenolpyruvatecarboxylase kinase in the aleurone-endosperm tissue of germinating barley seeds[J].Plant Physiology,1999(2):511-520 [73] Nhiri M,Bakrim N,Bakrim N,et al.Posttranslational regulation of phosphoenolpyruvate carboxylase during germination ofSorghum seeds:influence of NaCl and l-malate[J].Plant Science,2000,151(1):29-37[74] Feria A B,Alvarez R,Cochereau L,et al.Regulation of phosphoenolpyruvate carboxylase phosphorylation by metabolites andabscisic acid during the development and germination of barley seeds[J].Plant Physiology,2008(2):761-774[75] 王丽媛,张玉,徐明怡,等.植物磷酸烯醇式丙酮酸羧化酶的研究进展[J].国土与自然资源研究,2017(5):86-89。
牛磷酸烯醇式丙酮酸羧激酶(PCK)酶联免疫分析(ELISA)

牛磷酸烯醇式丙酮酸羧激酶(PCK)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定牛血清,血浆及相关液体样本中肿瘤坏死因子相关凋亡诱导配体1(TRAIL-R1)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中牛磷酸烯醇式丙酮酸羧激酶(PCK)水平。
用纯化的牛磷酸烯醇式丙酮酸羧激酶(PCK)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤坏死因子相关凋亡诱导配体1(TRAIL-R1),再与HRP标记的肿瘤坏死因子相关凋亡诱导配体1(TRAIL-R1)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的肿瘤坏死因子相关凋亡诱导配体1(TRAIL-R1)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中牛磷酸烯醇式丙酮酸羧激酶(PCK)浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×48 1×96 2-8℃保存标准品:2700ng/L0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂 3 ml×1瓶 6 ml×1瓶2-8℃保存样品稀释液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂A液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂B液 3 ml×1瓶 6 ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
二氧化碳(CO2)测定试剂盒(PEP-C法)技术要求利德曼

二氧化碳(CO2)测定试剂盒(PEP-C法)适用范围:本产品用于体外定量测定人血清或血浆中总二氧化碳含量。
1.1包装规格试剂(R):2×80mL;试剂(R): 3×60mL;试剂(R) :2×40mL;试剂(R):2×100 mL;试剂(R):1×20mL;试剂(R):3×61mL;360测试/盒:【试剂(R):2×41mL】;校准品(选配):单水平1×3mL;质控品(选配):单水平1×3mL。
1.2主要组成成分1.2.1 试剂组成见表1:表1 试剂(R)组成1.2.2 校准品组成单水平液体校准品,在50mmol/L,pH=9.0 的Tris缓冲液中添加碳酸氢钠,定值范围:(20~40)mmol/L。
稳定剂<0.1%。
1.2.3 质控品组成:单水平的液体质控品,在50mmol/L,pH=9.0 的Tris缓冲液中添加碳酸氢钠,目标浓度范围在(20~40)mmol/L之间。
稳定剂<0.1%。
注:校准品和质控品浓度具有批特异性,具体浓度见标签。
2.1 外观R试剂:液体单试剂,浅黄色澄清液体。
校准品:无色透明液体。
质控品:无色透明液体。
2.2 净含量液体试剂净含量不得低于标示体积。
2.3 空白吸光度在37℃、405nm波长、1cm光径条件下,试剂空白吸光度应大于0.7ABS。
2.4 分析灵敏度浓度为25mmol/L时,吸光度差值的绝对值范围在(0.03~0.25)ABS之间。
2.5 线性在(0,50]mmol/L线性范围内,线性相关系数r应不小于0.995;在[15,50]mmol/L范围内的相对偏差应不超过±10%;测定浓度小于15 mmol/L时,绝对偏差应不超过±2 mmol/L。
2.6 重复性变异系数CV应小于5%。
2.7 批间差不同批号之间测定结果的相对极差应小于6%。
2.8 准确度用参考物质(GBW06101c)作为样本进行检测,其测量结果的相对偏差应不超过±10%。
磷酸烯醇式丙酮酸磷酸酶

磷酸烯醇式丙酮酸磷酸酶1 磷酸烯醇式丙酮酸磷酸酶介绍磷酸烯醇式丙酮酸磷酸酶(Phosphoenolpyruvate carboxykinase,PEPCK)是一种广泛存在于细胞和组织中的酶,可以将磷酸烯醇式丙酮酸(PEP)与三磷酸腺苷(ATP)或二磷酸腺苷(ADP)反应生成磷酸丙酮酸(2-PGA)和二磷酸或三磷酸腺苷。
PEPCK在糖异生、脂肪代谢和酸碱平衡等生物过程中起着重要作用。
2 物种和结构PEPCK非常普遍,存在于植物、真菌、细菌和动物中。
目前已经发现了许多物种的PEPCK,其中包括大肠杆菌、酵母菌、果蝇、小鼠和人类等。
这些物种的PEPCK的结构和功能略有不同,但基本上都具有相似的酶学特性。
PEPCK是一种多聚体酶,由4个亚基组成。
每个亚单位具有一个或两个核心结构域,其中一个是PEPCK的保守结构域,称为PEPCK-C区,另一个是变异结构域,称为PEPCK-M区。
PEPCK的C区结构域是关键的催化功能区,包含了活性位点。
3 酶学特性PEPCK在生物过程中起着重要作用。
在糖异生过程中,PEPCK将异丙酰辅酶A(Acetyl-coA)和柠檬酸转化为PEP和CO2,并在某些组织中促进葡萄糖分解产生糖原,同时可通过酯化反应促进脂肪酸合成。
PEPCK还参与调节酸碱平衡,调节胰岛素和葡萄糖等耐量激素的水平,以及参与代谢性疾病的发生发展等生理过程。
除了其功能之外,PEPCK还具有一些独特的酶学特性。
PEPCK是一种高度调节的酶,可通过多种方式调节其活性,包括基因表达、翻译后修饰、核酸修饰和底物浓度等。
其中,最广泛研究的是PEPCK基因的表达和受体调节机制。
4 基因表达和调节在基因表达和调节方面,PEPCK的表达主要受到许多激素和环境因素的调节。
例如,皮质醇、葡萄糖和胰岛素等激素都可以调节PEPCK的表达,而且表达峰值时间和水平也不同。
PEPCK的基因表达受到转录因子的调节。
多个转录因子参与调控PEPCK的表达,包括核因子Y(NF-Y)、脂肪酸转录因子(SREBP)和前列腺素受体(PR)等。
二氧化碳(CO2)测定试剂盒(PEPC酶法)产品技术要求sainuopu

二氧化碳(CO2)测定试剂盒(PEPC酶法)适用范围:用于体外定量测定人体血清中二氧化碳的含量。
1.1 试剂盒包装规格试剂:1×20ml;2×60ml;3×40ml;4×60ml;4×400ml;1×8L;2×30ml。
校准品(选配):1×1ml;1×3ml。
质控品(选配):1×1ml;1×3ml;2×3ml(单水平)。
1.2 试剂盒主要组成成分2.1 外观液体单试剂:浅黄色澄清液体。
校准品:无色至淡黄色澄清液体。
质控品:无色至浅黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、405 nm波长、1cm光径条件下,试剂空白吸光度应不小于0.7。
2.4 分析灵敏度测定浓度为25mmol/L样本时,吸光度变化值(ΔA)应在(0.03,0.25)范围内。
2.5 线性范围在(5,50)mmol/L线性范围内,r不小于0.995。
在(20,50)mmol/L范围内线性相对偏差不大于±10%;在(5,20]mmol/L范围内线性绝对偏差不大于±2mmol/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于5%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于6%。
2.8 准确度相对偏差:相对偏差应不超过±10%。
2.9 质控品赋值有效性测定结果在靶值范围内。
2.10校准品溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至中国计量科学研究院生产的国家标准物质碳酸钠(GBW(E)060023c)。
2.10稳定性效期稳定性:试剂盒在2℃~8℃下有效期为12个月,取失效期的试剂盒进行检测,试验结果满足2.3、2.4、2.5、2.6、2.8、2.9的要求。
磷酸烯醇式丙酮酸羧化酶(PEPCase)提取液

磷酸烯醇式丙酮酸羧化酶(PEPC)提取液简介:磷酸烯醇式丙酮酸羧化酶(Phosphoenolpyruvate carboxylase,PEPC)是C4植物和CAM 植物固定CO 2的关键酶,为催化磷酸烯醇式丙酮酸与二氧化碳反应生成草酰乙酸呈不可逆反应的酶,在植物和细菌中广泛存在,在动物及丝状霉菌中缺乏此酶。
大肠杆菌中的酶分子量约36万的四聚体,可受很多因素的影响,例如可为乙酰辅酶A 活化,可受天门冬氨酸抑制。
此酶是变构酶,主要功能为供给三羧酸循环以草酰乙酸,另外也与C4植物光合二氧化碳固定反应(C4二羧酸循环)及景天科植物的苹果酸形成(景天酸代谢)等有关。
Leagene 磷酸烯醇式丙酮酸羧化酶(PEPC)提取液主要用于裂解植物组织,提取样品中的磷酸烯醇式丙酮酸羧化酶。
该试剂仅用于科研领域,不宜用于临床诊断或其他用途。
组成:自备材料:1、蒸馏水2、离心管或试管3、匀浆器或研钵4、低温离心机操作步骤(仅供参考):1、取植物组织清洗干净,切碎。
2、加入预冷的磷酸烯醇式丙酮酸羧化酶提取液,冰浴情况下充分匀浆或研磨。
3、经纱布或滤纸过滤,留取滤液待用。
3、离心,留取上清液。
4、冻存,用于磷酸烯醇式丙酮酸羧化酶的检测或其他用途。
计算:组织或植物粗酶液获得率(ml)=上清液体积(ml)/组织或植物质量×100%注意事项:编号名称CS0421Storage 磷酸烯醇式丙酮酸羧化酶提取液500ml 4℃使用说明书1份1、待测样品中不能含有磷酸酶抑制剂,同时需避免反复冻融。
2、所测样本的值高于标准曲线的上限,应用磷酸烯醇式丙酮酸羧化酶提取液稀释样品后重新测定。
3、为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期:6个月有效。
相关:编号名称CC0007磷酸缓冲盐溶液(10×PBS,无钙镁)CS0001ACK红细胞裂解液(ACK Lysis Buffer)DC0032Masson三色染色液DF0135多聚甲醛溶液(4%PFA)NR0001DEPC处理水(0.1%)PS0013RIPA裂解液(强)TC1167尿素(Urea)检测试剂盒(脲酶波氏比色法)。
丙酮酸激酶测定试剂盒使用说明

丙酮酸激酶测定试剂盒使用说明分光光度法货号:BC0540规格:50管/48样产品内容:提取液:60mL×1瓶,4℃保存;试剂一:液体45mL×1瓶,4℃保存;试剂二:粉剂×1支,-20℃保存;试剂三:粉剂×1支,-20℃保存;临用前每支加入 1.5mL双蒸水充分溶解备用,用不完的试剂仍4℃保存一周;试剂四:液体×1支,4℃保存;临用前每支加入900µL双蒸水充分溶解备用,用不完的试剂仍4℃保存一周。
产品说明:PK(EC2.7.1.40)广泛存在于动物、植物、微生物和培养细胞中,催化糖酵解过程中的最后一步反应,是糖酵解过程中的主要限速酶之一,也是产生ATP的关键酶之一,因此测定PK 活性具有重要意义。
PK催化磷酸烯醇式丙酮酸和ADP生成ATP和丙酮酸,乳酸脱氢酶进一步催化NADH和丙酮酸生成乳酸和NAD+,在340nm下测定NADH下降速率,即可反映PK活性。
需自备的仪器和用品:紫外分光光度计、台式离心机、水浴锅、可调式移液器、1mL石英比色皿、研钵、冰和蒸馏水。
操作步骤:一、样本的前处理1、细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500-1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或者200W,超声3s,间隔10s,重复30次);8000g4℃离心10min,取上清,置冰上待测。
2、组织:按照组织质量(g):提取液体积(mL)为1:5-10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆;8000g4℃离心10min,取上清,置冰上待测。
3、血清(浆)样品:直接检测。
二、测定步骤及加样表:1.分光光度计预热30min以上,调节波长至340nm,蒸馏水调零。
2.工作液的配置:临用前将试剂二转移至试剂一中,充分溶解待用;现配现用。
磷酸烯醇式丙酮酸羧化酶综述

文献综述磷酸烯醇式丙酮酸羧化酶综述[摘要]磷酸烯醇式丙酮酸羧化酶( PEPC)广泛存在于高等植物、藻类及大多数细菌中, 催化C4光合作用固定CO2的第一步反应。
在过去的10年中关于 PEPC分子的一级结构研究已取得显著的进展, 最近, 通过X- 射线衍射分析阐明了大肠杆菌和米C4型PEPC分子的三维结构, 就这些研究进展进行总结。
关键词: 磷酸烯醇式丙酮酸羧化酶大肠杆菌 PEPC 玉米 C4型 PEPC 分子结构一、磷酸烯醇式丙酮酸羧化酶的分子结构[1]PEPC (EC4.1.1.31)以 Mg2+或 Mn2+为辅助因子,催化磷酸烯醇式丙酮酸(PEP)和HCO3-生成草酰乙酸( OAA)和无机磷酸的不可逆性反应。
PEPC广泛存在于光合生物, 如植物、藻类、蓝细菌和光合细菌中, 还存在于很多非光合细菌和原生动物中。
PEPC催化的反应为细胞各种组分的生物合成提供四碳二羧酸, 参与维持柠檬酸循环, 在初级代谢中有重要的补给作用, 在C4植物和CAM 植物的光合作用中催化大气中CO2固定的第一步反应, 是C4光合作用途径中最重要的酶之一。
所有已知的PEPC均是四聚体,四个相同亚基的分子量大约为95~110k Da。
大多数 PEPC是变构酶, 其活性调控方式为变构作用。
不同种类生物的PEPC有多种变构效应物。
把C4光合作用特异性的PEPC基因导入C3植物中,以期提高C3光合作用效率, 是目前植物基因工程的一个研究热点。
研究结果发现在转基因植物中PEPC的活性也如同在C4植物中一样, 受代谢产物如苹果酸, 6-磷酸葡萄糖(Gluc6-P)和可逆性磷酸化的共价修饰调控。
由于PEPC的变构调控方式和机理很复杂,使PEPC的转基因操作得不到预期的结果, 为此PEPC的分子特性需要通过基因工程改造使之更适合转基因操作的要求。
对PEPC分子结构的研究可以为基因工程改造PEPC的分子特性提供理论依据、为提高C3光合作用固定CO2的效率和作物的产量提供有益的启示。
丙酮酸羧化酶(PC)试剂盒使用说明

丙酮酸羧化酶(PC)试剂盒使用说明货号:BC0730规格:50管/48样产品内容:提取液:100mL×1瓶,4℃保存;试剂一:液体47mL×1瓶,4℃保存;试剂二:液体×1支,4℃保存;试剂三:粉剂×1支,-20℃保存;试剂四:粉剂×1支,-20℃保存;产品说明:丙酮酸羧化酶(pyruvate carboxylase,PC,EC6.4.1.1)广泛存在于动物、霉菌和酵母的线粒体中,催化丙酮酸、ATP、CO2和水生成草酰乙酸、ADP和Pi,是糖异生过程的第一个限速酶,在保证血糖的动态平衡方面起着重要的作用。
PC催化丙酮酸、ATP、CO2和水生成草酰乙酸、ADP和Pi,苹果酸脱氢酶进一步催化草酰乙酸和NADH生成苹果酸和NAD+,在340nm下测定NADH氧化速率,即可反映PC活性。
需自备的仪器和用品:分光光度计、台式离心机、可调式移液器、1mL石英比色皿、研钵、冰和蒸馏水。
操作步骤:一、样本的前处理组织、细菌或细胞中胞浆蛋白与线粒体蛋白的分离:1、称取约0.1g组织或收集500万细菌或细胞,加入1mL提取液,用冰浴匀浆器或研钵匀浆。
2、将匀浆600g,4℃离心5min。
3、弃沉淀,将上清液移至另一离心管中,11000g,4℃离心10min。
4、上清液即胞浆提取物,可用于测定从线粒体泄漏的PC(此步可选做)。
5、在步骤④的沉淀中加入1mL提取液,超声波破碎(冰浴,功率20%或200W,超声3秒,间隔10秒,重复30次),用于线粒体PC活性测定。
二、测定步骤1、分光光度计预热30min以上,调节波长至340nm,蒸馏水调零。
2、工作液的配制:临用前将试剂二和试剂三转移到试剂一中混合溶解待用;置于37℃(哺乳动物)或25℃(其它物种)预热5分钟;用不完的试剂4℃保存一周;试剂四的配制:在试剂四瓶中加入2.5mL蒸馏水充分溶解待用;用不完的试剂4℃保存一周;3、在1mL石英比色皿中加入50μL样本、50μL试剂四和900μL工作液,立即混匀,记录340nm处初始吸光值A1和2min后的吸光值A2,计算A=A1-A2。
细胞凋亡试剂盒使用说明书 - 专业提供基因,重组蛋白,抗体

细胞凋亡试剂盒使用说明书目录号:CSB-AP11921h本试剂盒仅供研究使用概述细胞凋亡是细胞的基本特征之一,在机体的胚胎发育、组织修复、内环境的稳定等方面都起到十分重要的作用。
在正常细胞中磷脂酰丝氨酸(PS)分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中的磷脂酰丝氨酸(PS)由脂膜内侧翻向外侧。
此磷脂酰丝氨酸可与Annexin V, 一种分子量为35~36kD的Ca2+依赖性磷脂结合蛋白以高度亲和力相结合。
凋亡后期死亡的细胞与其它因素死亡的细胞,虽都可与A nnexin V结合,但死亡的细胞其细胞膜通透,也可被碘化丙啶(Propidium Iodide, PI),一种核酸染料染成红色。
如将Annexin V标以荧光素(RPE、FITC等)作为荧光探针,结合PI, 利用荧光显微镜或流式细胞仪检测,就可以将处于不同凋亡时期的细胞区分开来。
试剂盒组成及试剂配制1.Annexin V-FITC:保存在Tris-HCl (20mM), NaCl(50mM) 缓冲液中,含1mg/ml BSA和0.09% NaN3。
2.Binding Buffer:Hepes(10 mM) /NaOH (pH 7.4), NaCl (140 mM),CaCl2(2.5 mM). 经0.2μm孔径过滤器除菌。
2–8℃保存。
3.Propidium Iodida(PI):50 ug/ml 溶于PBS (pH7.4)中。
操作步骤实验开始前,请提前配置好所有试剂,试剂或样品稀释时,均需混匀,混匀时尽量避免起泡。
1.悬浮细胞离心(350g, 3 min)收集;贴壁细胞用不含EDTA的胰酶消化收集(胰酶消化时间不易过长,以防引起假阳性);2.用PBS洗涤细胞二次(350g, 3 min),计数细胞,每样0.1ml 含1~5×105细胞;3.用400μL Binding Buffer悬浮细胞;4.加入5μL Annexin V-FITC, 混匀,加入5 μL Propidium Iodide,混匀;5.室温避光反应10 min;6.荧光显微镜下观察或用流式细胞仪检测。
磷酸烯醇式丙酮酸羧化酶在c4途径中的作用

磷酸烯醇式丙酮酸羧化酶在c4途径中的作用
磷酸烯醇式丙酮酸羧化酶(PEPCK)是C4途径中非常重要的酶之一。
C4途径是一种植物的光合作用运作方式,主要用于增加CO2浓度,提高光合作用效率。
PEPCK与此过程密
切相关,它可先将光合作用的产物三羧酸循环酸(TCA)循环中的草酰乙酰辅酶A(CoA)转化成磷酸烯醇式丙酮酸(PEP), 然后PEP进入C4途径之后,就能在小细胞光合体中被羧
化为草酸(OAA),以便在大细胞中再次被羧化为PEP, 从而为二氧化碳固定和尤其是碳同化提供“CO2泵”的作用。
PEPCK作用机理的主要是利用PEPCK磷酸酯化活力。
磷酸酯化是将能否转移磷酸的基
团特定加入到分子中的化学反应。
PEPCK能够通过将磷酸基元从ATP中转移,并将其与磷
酸烯醇式丙酮酸结合,从而生成草酸的过程中,驱动C4途径的整个过程,该过程还需要羧化酶以及其他辅助分子的帮助。
PEPCK的代谢途径非常复杂,但是其核心思想是将PEPCK磷酸酯化活力和其能够转化
在不同代谢途径中的小分子相结合,从而从代谢中提取能源和/或产生新的代谢中间产物。
PEPCK所涉及的代谢途径包括糖原分解,葡萄糖合成,乳酸脱氢酶活性,磷酸肌酸途径和
碳酸酐途径等等,它们在代谢途径中的平衡状态受到一系列内外部信号的调节。
总体来说,PEPCK在C4途径中的作用就是促进了草酸的产生,草酸在C4途径中的后续轮回中可以不断的进行反复羧化和去羧化反应,将CO2转移至大细胞进行碳同化反应,提
高植物的光合作用效率,增加CO2利用效率。
同时,PEPCK也参与了很多其他的代谢途径,其作用机理在以上所述的途径中有所不同,但它的作用对于整个代谢系统非常重要。
磷酸烯醇丙酮酸羧化酶

磷酸烯醇丙酮酸羧化酶磷酸烯醇丙酮酸羧化酶(Fructoneoxidase,简称FOXO)是一类非常重要的蛋白质,它可以将磷酸烯醇丙酮(fructone)氧化到羧酸(formate),为细胞提供能量。
磷酸烯醇丙酮酸羧化酶具有重要的生理学功能,比如调节细胞内葡萄糖代谢、影响衰老和促进细胞凋亡等。
磷酸烯醇丙酮酸羧化酶主要在细胞内部发挥作用,是建立和维持正常的细胞代谢的重要组成部分。
在细胞在高糖水平下,FOXO启动磷酸烯醇丙酮酸羧化过程,将其氧化到羧酸,提供细胞有利的热能量。
其过程可以自动由FOXO来控制,也可以被外界刺激因素如亚硝酸、钙离子和谷胱甘肽等信号调节。
FOXO也可以调节细胞内葡萄糖代谢,当糖水平过高时,FOXO可以抑制糖异构酶糖原合成酶,启动糖酵解反应,并促进肝细胞内糖的代谢,从而降低体内的血糖水平。
FOXO也可以影响衰老,当FOXO水平低时,细胞可能更容易衰老,而FOXO水平高时,细胞可以抵抗衰老。
此外,FOXO还可以促进细胞凋亡,它可以抑制一些凋亡抑制蛋白,从而有效地促进细胞凋亡。
磷酸烯醇丙酮酸羧化酶在很多生理活动中发挥着重要的作用,它参与细胞内的热能生成,影响细胞的衰老和凋亡,调节葡萄糖代谢,从而支持细胞正常的生长和运转。
由于FOXO的多功能性和作用深远,它在抗衰老、抗癌、肥胖和代谢性疾病等领域得到了广泛的研究和应用。
研究表明,FOXO介导的磷酸烯醇丙酮酸羧化反应是细胞内非常重要的代谢途径,有助于细胞内机能的平衡调节,保证细胞正常的运转。
最近,FOXO被用来设计药物治疗肥胖,糖尿病,动脉硬化,癌症等疾病,在这些疾病之中发挥着重要的作用。
综上所述,磷酸烯醇丙酮酸羧化酶(FOXO)可以将磷酸烯醇丙酮(fructone)氧化到羧酸(formate),为细胞提供能量,参与细胞内热能生成、影响细胞衰老、凋亡以及调节葡萄糖代谢等等,是建立和维持正常细胞代谢的重要组成部分。
FOXO还可以用来治疗肥胖,糖尿病,动脉硬化,癌症等疾病,具有重要的治疗意义。
磷酸烯醇丙酮酸盐单钾盐 -回复

磷酸烯醇丙酮酸盐单钾盐-回复磷酸烯醇丙酮酸盐单钾盐(Potassium salt of Phosphoenolpyruvic Acid, abbreviated as PEP-K)是一种重要的生物化学物质。
它在生物体内扮演着关键的角色,参与多种生物过程和代谢途径。
本文将深入探讨PEP-K的结构与性质、生理功能以及在生物技术领域的应用。
一、结构与性质磷酸烯醇丙酮酸盐单钾盐是一种盐类化合物,由磷酸烯醇丙酮酸和钾离子组成。
其化学式为C3H3O6PK,相对分子质量为246.12。
PEP-K为无色结晶或粉末状固体,在水中易溶解。
二、生理功能1.能量代谢:PEP-K参与三磷酸腺苷(ATP)的合成过程中的磷酸转移反应。
在糖酵解和柠檬酸循环中,PEP-K催化磷酸烯醇丙酮酸与ADP的反应,形成一个高能物质-磷酸肌酸和ATP,从而为细胞提供能量。
2.二氧化碳固定:PEP-K参与植物光合作用中的C4途径,在植物叶片中将二氧化碳转化为4-碳化合物——麦饭石酸。
PEP-K催化磷酸烯醇丙酮酸与CO2的反应,生成麦饭石酸,并最终转化为葡萄糖。
3.生物合成:磷酸烯醇丙酮酸是许多重要生物分子合成的起始物质,包括氨基酸、核苷酸、脂肪酸等。
PEP-K参与这些重要化合物的合成途径中,提供必要的底物和反应催化。
三、在生物技术领域的应用由于PEP-K在生物代谢过程中的重要作用,它在生物技术领域具有广泛的应用价值。
1.生物燃料生产:PEP-K参与生物质发酵产生乙醇和乙酸的代谢途径中,是生物燃料生产的重要催化酶。
利用PEP-K的催化活性,可以改良发酵过程,提高生物燃料的产量和质量。
2.抗生素生产:PEP-K在微生物代谢途径中的作用,对抗生素的产生具有重要意义。
通过调控PEP-K的表达和活性,可以增加微生物合成抗生素的效率和产量。
3.药物研发:PEP-K作为生物化学反应中的催化剂,其抑制剂的发展具有广阔的前景。
将针对PEP-K的抑制剂应用于药物研发,有望开发出新型的抗菌药物、抗肿瘤药物等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
货号:MS3500 规格:100管/96样磷酸烯醇式丙酮酸羧激酶(PEPCK)试剂盒说明书
微量法
正式测定前务必取2-3个预期差异较大的样本做预测定
测定意义:
PEPCK(EC 4.1.1.32)广泛存在于动物、植物、微生物和细胞中,催化草酰乙酸转化为磷酸烯醇式丙酮酸,是调节糖异生途径的关键酶。
测定原理:
,丙酮酸激酶和乳酸脱氢酶进一步依次催化PEPCK催化草酰乙酸生成磷酸烯醇式丙酮酸和CO
2
NADH氧化生成NAD+,在340nm下测定NADH下降速率,即可反映PEPCK活性。
自备实验用品及仪器:
分光光度计/酶标仪、台式离心机、可调式移液器、微量石英比色皿/96孔板、研钵、冰和蒸馏水。
试剂的组成和配制:
提取液:液体100mL×1瓶,4℃保存;
试剂一:液体18 mL×1瓶,4℃保存;
试剂二:液体16.5uL×1支,4℃保存;
试剂三:粉剂×1支, -20℃保存;
试剂四:粉剂×1支,-20℃保存;
样本的前处理:
1、细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);8000g 4℃离心10min,取上清,置冰上待测。
2、组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。
8000g 4℃离心10min,取上清,置冰上待测。
3、血清(浆)样品:直接检测。
测定步骤:
1、分光光度计或酶标仪预热30min以上,调节波长至340nm,蒸馏水调零。
2、工作液的配制:临用前将试剂二和试剂三转移到试剂一中混合溶解待用;用不完的试剂分装后-20℃保存,禁止反复冻融。
3、试剂四的配制:临用前加入1mL蒸馏水充分溶解待用;用不完的试剂分装后-20℃保存,禁止反复冻融。
4、将工作液和试剂四置于37℃(哺乳动物)或25℃(其它物种)预热5分钟。
5、在微量石英比色皿或96孔板中加入10μL样本、10μL试剂四和180μL工作液,立即混匀,记录340nm处初始吸光值A1和 1min后的吸光值A2,计算ΔA=A1-A2。
注意:在该试剂盒中,若ΔA大于0.1,需将样本用提取液稀释适当倍数后测定,使ΔA小于0.1可提高检测灵敏度。
计算公式中乘以相应稀释倍数。
第1页,共2页
PEPCK活性计算:
a.用微量石英比色皿测定的计算公式如下
1、血清(浆)PEPCK活力计算
单位定义:每毫升血清(浆)每分钟消耗1 nmol NADH定义为一个酶活力单位。
PEPCK(nmol/min/mL))=[ΔA×V反总÷(ε×d)×109]÷V样÷T=3215×ΔA
2、组织、细菌或细胞中PEPCK活力计算
(1)按样本蛋白浓度计算
单位定义:每mg组织蛋白每分钟消耗1nmol NADH定义为一个酶活力单位。
PEPCK(nmol/min/mg prot)=[ΔA×V反总÷(ε×d)×109]÷(V样×Cpr) ÷T=3215×ΔA÷Cpr (2)按样本鲜重计算
单位定义:每g组织每分钟消耗1 nmol NADH定义为一个酶活力单位。
PEPCK(nmol/min/g 鲜重)=[ΔA×V反总÷(ε×d)×109]÷(W ×V样÷V样总)÷T=3215×ΔA÷W
(3)按细菌或细胞密度计算:
单位定义:每1万个细胞每分钟消耗1 nmol NADH定义为一个酶活力单位。
PEPCK(nmol/min/104cell)=[ΔA×V反总÷(ε×d)×109]÷(500×V样÷V样总)÷T=6.43×ΔA
V反总:反应体系总体积,2×10-4 L;ε:NADH摩尔消光系数,6.22×103 L / mol /cm;d:比色皿光径,1cm;V样:加入样本体积,0.01 mL;V样总:加入提取液体积,1 mL;T:反应时间,1 min;Cpr:样本蛋白质浓度,mg/mL;W:样本质量,g;500:细菌或细胞总数,500万。
b.用96孔板测定的计算公式如下
1、血清(浆)PEPCK活力计算
单位定义:每毫升血清(浆)每分钟消耗1 nmol NADH定义为一个酶活力单位。
PEPCK(nmol/min/mL))=[ΔA×V反总÷(ε×d)×109]÷V样÷T=6430×ΔA
2、组织、细菌或细胞中PEPCK活力计算
(1)按样本蛋白浓度计算
单位定义:每mg组织蛋白每分钟消耗1nmol NADH定义为一个酶活力单位。
PEPCK(nmol/min/mg prot)=[ΔA×V反总÷(ε×d)×109]÷(V样×Cpr) ÷T=6430×ΔA÷Cpr (2)按样本鲜重计算
单位定义:每g组织每分钟消耗1 nmol NADH定义为一个酶活力单位。
PEPCK(nmol/min/g 鲜重)=[ΔA×V反总÷(ε×d)×109]÷(W ×V样÷V样总)÷T=6430×ΔA÷W
(3)按细菌或细胞密度计算:
单位定义:每1万个细胞每分钟消耗1 nmol NADH定义为一个酶活力单位。
PEPCK(nmol/min/104cell)=[ΔA×V反总÷(ε×d)×109]÷(500×V样÷V样总)÷T=12.86×ΔA
V反总:反应体系总体积,2×10-4 L;ε:NADH摩尔消光系数,6.22×103 L / mol /cm;d:96孔板光径,0.5cm;V样:加入样本体积,0.01 mL;V样总:加入提取液体积,1 mL;T:反应时间,1 min;Cpr:样本蛋白质浓度,mg/mL;W:样本质量,g;500:细菌或细胞总数,500万。
第2页,共2页。
