元素周期律作业(无答案)
高中化学元素周期律练习题 附答案

高中化学元素周期律练习题(附答案)1. 元素周期表中,下列元素中原子半径最小的是:A. 碳B. 氮C. 氧D. 氟答案:D2. 下列元素中,最容易失去两个电子的是:A. 钠B. 铝C. 硅D. 磷答案:B3. 下列元素中,电子亲和能最小的是:A. 氧B. 氮C. 氖D. 氟答案:C4. 下列元素中,最容易形成+3价离子的是:A. 铝B. 硅C. 磷D. 硫答案:A5. 下列元素中,最容易形成-3价离子的是:A. 氮B. 磷C. 硫D. 氧答案:B6. 下列元素中,原子序数最小的是:A. 锂B. 钠C. 钾D. 铷答案:A7. 下列元素中,原子序数最大的是:A. 钒B. 铜C. 铁D. 锌答案:B8. 下列元素中,最容易形成+2价离子的是:A. 镁B. 钙C. 锶D. 钡答案:A9. 下列元素中,最容易形成-2价离子的是:A. 氮B. 氧C. 硫D. 磷答案:B10. 下列元素中,电子亲和能最大的是:A. 氧B. 氖C. 氟D. 氮答案:C1. 以下元素中,哪个元素的原子半径最小?C. 钾D. 铁答案:A2. 在元素周期表中,元素的原子半径随着原子序数的增大而:A. 呈周期性增加B. 呈周期性减小C. 不发生变化D. 先增加后减小答案:B3. 以下元素中,哪个元素的电子亲和能最大?A. 锂B. 钠C. 钾D. 氖答案:D4. 在元素周期表中,元素的电子亲和能随着原子序数的增大而:A. 呈周期性增加B. 呈周期性减小C. 不发生变化D. 先增加后减小答案:B5. 以下元素中,哪个元素的电离能最小?A. 氢B. 铁C. 氧D. 锌答案:A6. 在元素周期表中,元素的电离能随着原子序数的增大而:A. 呈周期性增加B. 呈周期性减小C. 不发生变化D. 先增加后减小答案:A7. 以下元素中,哪个元素的电子亲和能最小?A. 氖B. 氧答案:D8. 在元素周期表中,元素的电子亲和能随着原子序数的增大而:A. 呈周期性增加B. 呈周期性减小C. 不发生变化D. 先增加后减小答案:D9. 以下元素中,哪个元素的电离能最大?A. 钠B. 铝C. 铁D. 锌答案:C10. 在元素周期表中,元素的电离能随着原子序数的增大而:A. 呈周期性增加B. 呈周期性减小C. 不发生变化D. 先增加后减小答案:A11. 以下元素中,哪个元素的化合价最小?A. 钠B. 铝C. 铁D. 锌答案:A12. 在元素周期表中,元素的化合价随着原子序数的增大而:A. 呈周期性增加B. 呈周期性减小C. 不发生变化D. 先增加后减小答案:D13. 以下元素中,哪个元素的电负性最大?A. 锂B. 钠C. 铁D. 氟14. 在元素周期表中,元素的电负性随着原子序数的增大而:A. 呈周期性增加B. 呈周期性减小C. 不发生变化D. 先增加后减小答案:B15. 以下元素中,哪个元素的原子半径最大?A. 锂B. 钠C. 钾D. 铁答案:C16. 在元素周期表中,元素的原子半径随着原子序数的增大而:A. 呈周期性增加B. 呈周期性减小C. 不发生变化D. 先增加后减小答案:A17. 以下元素中,哪个元素的电子亲和能最大?A. 锂B. 钠C. 钾D. 氖答案:D18. 在元素周期表中,元素的电子亲和能随着原子序数的增大而:A. 呈周期性增加B. 呈周期性减小C. 不发生变化D. 先增加后减小答案:B19. 以下元素中,哪个元素的电离能最小?A. 钙B. 镁C. 锌D. 铁答案:B20.A. 呈周期性增加B. 呈周期性减小C. 不发生变化D. 先增加后减小答案:B21. 以下元素中,哪个元素的化合价最大?A. 钠B. 铝C. 铁D. 锌答案:B22. 在元素周期表中,元素的化合价随着原子序数的增大而:A. 呈周期性增加B. 呈周期性减小C. 不发生变化D. 先增加后减小答案:D23. 以下元素中,哪个元素的电负性最小?A. 锂B. 钠C. 铁D. 氟答案:A24. 在元素周期表中,元素的电负性随着原子序数的增大而:A. 呈周期性增加B. 呈周期性减小C. 不发生变化D. 先增加后减小答案:B25. 以下元素中,哪个元素的原子半径最小?A. 钠B. 铝C. 铁D. 锌答案:D26. 在元素周期表中,元素的原子半径随着原子序数的增大而:A. 呈周期性增加C. 不发生变化D. 先增加后减小答案:B27. 以下元素中,哪个元素的电子亲和能最小?A. 钠B. 铝C. 铁D. 锌答案:D28. 在元素周期表中,元素的电子亲和能随着原子序数的增大而:A. 呈周期性增加B. 呈周期性减小C. 不发生变化D. 先增加后减小答案:A29. 以下元素中,哪个元素的电离能最大?A. 钙B. 镁C. 锌D. 铁答案:A30. 在元素周期表中,元素的电离能随着原子序数的增大而:A. 呈周期性增加B. 呈周期性减小C. 不发生变化D. 先增加后减小答案:A。
高三化学选择题【元素周期律】

01化学选择题元素周期律1.短周期主族元素X、Y、Z、W原子序数依次增大,X的原子半径小于Y的原子半径,Z的单质是空气中含量最高的气体,W原子最外层比Y原子最外层少1个电子,W的单质制得的金属容器常温下可盛装浓硫酸。
下列说法正确的是()A.原子半径:r(Y)Vr(Z)Vr(W)B.X、Y形成的化合物只含有极性键C.Z、w的简单离子具有相同的电子层结构D.Y的最高价氧化物的水化物酸性比Z的强2.现有短周期元素R、X、Y、Z、T,R与T原子最外层电子数均是电子层数的2倍,Y元素能与大多数金属和非金属元素形成化合物;Z+与Y2-电子层结构相同。
五种元素的原子半径如图所示,下列推断正确的是A.Y、Z组成的化合物只含离子键B.氢化物的沸点:R〈X〈YC.最高价氧化物的水化物酸性:T的比R的强D.Y和Z分别与T、X组成的二元化合物的水溶液一定呈中性3•四种短周期主族元素W、X、Y、Z的原子序数依次增大,W元素的最外层电子数是其电子层数的二倍;X的原子半径是短周期主族元素原子中最大的;Y是地壳中含量最多的金属元素;X与Z形成的离子化合物的水溶液呈中性。
下列实验操作对应的实验现象中,不正确的是选项实验操作实验现象A 将X单质投入到CuSO溶液中4生成大量红色固体B 向Y的氯化物溶液中滴加氨水生成白色沉淀C 将Z的单质通入到NaBr溶液中溶液变为黄色D 将W的最高价氧化物通入到Na2SiO3溶液中生成白色沉淀4•下列有关性质的比较,不能用元素周期律解释的是A.金属性:Na>MgB.酸性:HSO>HClO2 4C.碱性:KOH>NaOHD.热稳定性:HC1>HBr5.下列说法正确的是A.Si、P、S、Cl原子半径依次增大B.HF、HCl、HBr、HI稳定性依次减弱C.C、N、0、F元素的最高正化合价依次升高D.NaOH、Mg(OH)、Al(OH)碱性依次增强6.根据元素周期律,由下列事实进行归纳推测,推测不合理的是选项事实推测A Mg与冷水较难反应,Ca与冷水较易反应Be(铍)与冷水更难反应B Na与Cl形成离子键,Al与Cl形成共价键Si与Cl形成共价键C HCl在1500°C时分解,HI在230°C时分解HBr的分解温度介于二者之间D Si是半导体材料,同族的Ge是半导体材料WA族兀素的单质都是半导体材料7.下表为元素周期表的一部分。
元素周期表及周期律试题答案及解析

元素周期表及周期律试题答案及解析本页仅作为文档封面,使用时可以删除This document is for reference only-rar21year.March高中化学组卷元素周期表及周期律练习题答案及解析一.选择题(共6小题)1.地壳中含量最多的元素在周期表中的位置是()A.第二周期VIA族B.第二周期VA族C.第三周期VIA族D.第三周期VA族2.Q、W、X、Y、Z都是短周期元素.X、Y、Q在周期表中的位置关系如图.W、Z的最外层电子数相同,Z的核电荷数是W的2倍.则下列说法不正确的是()ⅠAⅡAⅢAⅣAQX YA.非金属性:W>ZB.原子半径:X>Y>ZC.最高价氧化物对应水化物的碱性:X>YD.氢化物稳定性:Q>W3.下列叙述正确的有()A.第四周期元素中,锰原子价电子层中未成对电子数最多B.第二周期主族元素的原子半径随核电荷数增大依次减小C.卤素氢化物中,HCl的沸点最低的原因是其分子间的范德华力最小D.价层电子对相斥理论中,π键电子对数不计入中心原子的价层电子对数4.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是()A.简单离子半径:W<X<ZB.W与X形成的化合物溶于水后溶液呈碱性C.气态氢化物的热稳定性:W<YD.最高价氧化物的水化物的酸性:Y>Z5.根据元素周期表和元素周期律分析下面的推断,其中错误的是()A.酸性由强到弱的顺序:HClO4>H2SO4>H3PO4B.氢氧化钙比氢氧化镁碱性强C.气态氢化物的稳定性X>Y,说明X的非金属性比Y强D.最外层电子数X>Y,说明X的非金属性比Y强6.已知Cl、S、P为三种原子序数相连的元素,则下列说法正确的是()A.气态氢化物的稳定性:HCl>H2S>PH3B.非金属活泼性:S<Cl<PC.原子半径:Cl>S>PD.原子序数:S<P<Cl二.填空题(共3小题)7.针对下面10种元素,完成以下各小题.回答下列间题.ⅠAⅡAⅢAⅣAⅤAⅥAⅤⅡA0 2C N F Ne3Na Mg Al Si S Cl(1)非金属性最强的元素是(填名称).化学性质最不活泼的元素是(填元素符号).(2)S 原子结构示意图为;(3)Mg和Al中,原子半径较小的是;(4)N的氢化物的分子式,该物质中N元素与H元素的质量比为,(相对原子质量:N﹣14 H﹣1),其水溶液呈性.(5)元素硅的氧化物常用于制造(填一种高性能的现代通讯材料的名称);(6)元素最高价氧化物对应的水化物中,碱性最强的是(填化学式),呈两性的是(填化学式);两者反应的化学方程式.8.X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:(1)Y在元素周期表中的位置为.(2)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式),非金属气态氢化物还原性最强的是(写化学式).(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有(写出其中两种物质的化学式).(4)ZX的电子式为;ZX与水反应放出气体的化学方程式为.9.下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题.IAⅡAⅢAⅣAⅤAⅥAⅦA0族周期二①②③④三⑤⑥⑦⑧⑨⑩(1)非金属性最强的元素是(填元素符号,下同),形成化合物种类最多的元素是.(2)第三周期元素除⑩外原子半径最小的是(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是(填化学式,下同),具有两性的是.(3)⑤⑥⑦单质的活泼性顺序为>>(填元素符号),判断的实验依据是(写出一种).三.多选题(共1小题)10.X、Y、Z、W 四种短周期元素在周期表中位于连续的四个主族,相对位置如图所示.Z 元素原子核外K层与M层电子数相等.下列说法正确的是()X YWZA.原子半径由小到大的顺序为Y<X<W<ZB.Y的单质和Z的单质能够发生反应C.X的单质都是熔点高、硬度大的物质D.工业上利用电解Z、W的熔融氯化物的方法制备对应的单质四.推断题(共1小题)11.如表为元素周期表短周期的一部分,请用化学用语(元素符号或化学式)回答相关问题:①②③④⑤⑥⑦⑧⑨(1)⑥元素在周期表中的位置为.(2)表中序号元素中半径最大的常见离子是.(3)表中最高价氧化物对应水化物的碱性最强的物质的电子式为,酸性最强的物质的化学式是,气态氢化物最稳定的物质的化学式是.(4)元素非金属性强弱比较有很多方法,其中③和⑧的非金属性强弱的探究方案中不可行的是(填序号)A.比较两种氢化物的熔沸点高低 B.比较氢化物的稳定性C.通过和铁反应,比较得电子能力 D.通过置换反应(5)由①和②两种元素组成的化合物,同条件下与氧气密度相当,请写出该分子的电子式.(6)⑦与⑨两元素的单质反应生成1mol⑦的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为﹣69℃和58℃,写出该反应的热化学方程式.高中化学组卷参考答案与试题解析一.选择题(共6小题)1.(2017•嘉兴模拟)地壳中含量最多的元素在周期表中的位置是()A.第二周期VIA族B.第二周期VA族C.第三周期VIA族D.第三周期VA族【分析】地壳中含量最多的元素为O元素,其原子序数为8,核外含有2个电子层,最外层含有6个电子,据此判断氧元素在周期表中的位置.【解答】解:地壳中含量最多的元素为O元素,其原子序数为8,核外含有2个电子层,最外层含有6个电子,则氧元素位于周期表中第二周期VIA族,故选A.【点评】本题考查了元素周期表的结构及应用,题目难度不大,明确地壳中元素含量为解答关键,注意掌握原子结构与元素周期表的关系,试题侧重考查学生的灵活应用能力.2.(2017•湛江校级模拟)Q、W、X、Y、Z都是短周期元素.X、Y、Q在周期表中的位置关系如图.W、Z的最外层电子数相同,Z的核电荷数是W的2倍.则下列说法不正确的是()ⅠAⅡAⅢAⅣAQX YA.非金属性:W>ZB.原子半径:X>Y>ZC.最高价氧化物对应水化物的碱性:X>YD.氢化物稳定性:Q>W【分析】Q、W、X、Y、Z都是短周期元素.由X、Y、Q在周期表中的位置关系可知:X为Na元素、Y为Al元素、Q为碳元素元素.W、Z的最外层电子数相同,二者处于同族,Z 的核电荷数是W的2倍,令W的核电荷数为a,则Z的核电荷数为2a,故a+8=2a,解得a=8,故W为O元素、Z为S元素,据此解答.【解答】解:Q、W、X、Y、Z都是短周期元素.由X、Y、Q在周期表中的位置关系可知:X为Na元素、Y为Al元素、Q为碳元素元素.W、Z的最外层电子数相同,二者处于同族,Z的核电荷数是W的2倍,令W的核电荷数为a,则Z的核电荷数为2a,故a+8=2a,解得a=8,故W为O元素、Z为S元素,A.同主族自上而下非金属性减弱,故非金属性O>S,即W>Z,故A正确;B.同周期自左而右原子半径减小,故原子半径Na>Al>S,即X>Y>Z,故B正确;C.同周期自左而右金属性减弱,金属性越弱,最高价氧化物对应水化物的碱性越弱,故碱性:X>Y,故C正确;D.非金属性越强,氢化物越稳定,故稳定性H2O>CH4,故D错误;故选D.【点评】本题考查结构性质位置关系、元素周期律等,难度不大,注意整体把握元素周期表的结构,掌握元素周期律.3.(2016•海南)下列叙述正确的有()A.第四周期元素中,锰原子价电子层中未成对电子数最多B.第二周期主族元素的原子半径随核电荷数增大依次减小C.卤素氢化物中,HCl的沸点最低的原因是其分子间的范德华力最小D.价层电子对相斥理论中,π键电子对数不计入中心原子的价层电子对数【分析】A、第四周期元素中,外围电子排布为nd x ns y,且能级处于半满稳定状态时,含有的未成对电子数最多;B、同周期核电荷数越多半径越小;C、HF分子间存在氢键;D、价层电子对相斥理论中,σ键和孤对电子对计入中心原子的价层电子对数,而π不计入.【解答】解:A、第四周期元素中,外围电子排布为nd x ns y,且能级处于半满稳定状态时,含有的未成对电子数最多,即外围电子排布为3d54s1,此元素为铬,故A错误;B、同周期核电荷数越多半径越小,所以第二周期主族元素的原子半径随核电荷数增大依次减小,故B正确;C、HF分子间存在氢键,HCl分子内没有氢键,故C错误;D、价层电子对相斥理论中,σ键和孤对电子对计入中心原子的价层电子对数,而π不计入,故D正确;故选BD.【点评】本题考查核外电子排布规律、元素周期律、氢键和价层电子对理论等,难度不大,注意选A在理解核外电子排布规律,注意能级处于全满、半满、全空时的稳定状态.4.(2016春•南宁校级期末)四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W 与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是()A.简单离子半径:W<X<ZB.W与X形成的化合物溶于水后溶液呈碱性C.气态氢化物的热稳定性:W<YD.最高价氧化物的水化物的酸性:Y>Z【分析】四种短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X是钠;Z与X形成的离子化合物的水溶液呈中性,说明这种盐不水解,Z只能是第三周期的非金属元素,且Z的氢化物的水溶液属于强酸,则Z是氯;W、X的简单离子具有相同电子层结构,则W在第二周期且是非金属元素,可能是氮和氧;W与Y同族,Y在X与Z之间,位置关系如图:,据此解答.【解答】解:四种短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X是钠;Z与X形成的离子化合物的水溶液呈中性,说明这种盐不水解,Z只能是第三周期的非金属元素,且Z的氢化物的水溶液属于强酸,则Z 是氯;W、X的简单离子具有相同电子层结构,则W在第二周期且是非金属元素,可能是氮和氧;W与Y同族,Y在X与Z之间,位置关系如图:,A.X、W离子的电子层为2层,Z离子即氯离子电子层为3层,电子层多半径大,电子层结构相同时,序小半径反而大,则简单离子半径大小顺序是:X<W<Z,故A错误;B.W在第二周期且是非金属元素,可能是氮和氧,与钠形成的化合物可能是氮化钠,氧化钠,过氧化钠,它们与水反应都能生成氢氧化钠使溶液呈碱性,故B正确;C.W与Y处于同于主族,从上到下,非金属性逐渐减弱,气态氢化物的热稳定性逐渐减弱,则W>Y,故C错误;D.Y与Z处于同同期,从左到右,非金属性逐渐增强,最高价氧化物的水化物的酸性逐渐增强,则Z>Y,故D错误;故选:B.【点评】本题考查了原子结构与元素周期表的关系,正确推断各元素为解答关键,在答题时,画出各元素的位置关系使解题更快也更准确,试题培养了学生的分析能力及灵活应用能力.5.(2016•淄博校级模拟)根据元素周期表和元素周期律分析下面的推断,其中错误的是()A.酸性由强到弱的顺序:HClO4>H2SO4>H3PO4B.氢氧化钙比氢氧化镁碱性强C.气态氢化物的稳定性X>Y,说明X的非金属性比Y强D.最外层电子数X>Y,说明X的非金属性比Y强【分析】A.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;B.同主族元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;C.元素的非金属性越强,对应的氢化物越稳定;D.元素的非金属性的大小取决于得电子能力.【解答】解:A.非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故A正确;B.金属性Ca>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故B 正确;C.元素的非金属性越强,对应的氢化物越稳定,故C正确;D.元素的非金属性的大小取决于得电子能力,与原子最外层电子数的多少无关,故D错误.故选D.【点评】本题考查元素周期律知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握元素周期律的递变规律以及对应单质、化合物的性质的相似性和递变性的判断,把握比较角度,难度不大.6.(2016•吴忠校级模拟)已知Cl、S、P为三种原子序数相连的元素,则下列说法正确的是()A.气态氢化物的稳定性:HCl>H2S>PH3B.非金属活泼性:S<Cl<PC.原子半径:Cl>S>PD.原子序数:S<P<Cl【分析】同周期从左向右随原子序数的增大,非金属性增强、原子半径减小,非金属性越强,对应氢化物越稳定,以此来解答.【解答】解:A.非金属性Cl>S>P,气态氢化物的稳定性为HCl>H2S>PH3,故A正确;B.非金属性Cl>S>P,非金属活泼性为Cl>S>P,故B错误;C.同周期从左向右原子半径减小,则原子半径为P>S>Cl,故C错误;D.同周期从左向右原子序数增大,则原子序数为P<S<Cl,故D错误;故选A.【点评】本题考查非金属元素的性质,为高频考点,把握元素在周期表的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.二.填空题(共3小题)7.(2016•晋江市校级模拟)针对下面10种元素,完成以下各小题.回答下列间题.ⅠAⅡAⅢAⅣAⅤAⅥAⅤⅡA0 2C N F Ne 3Na Mg Al Si S Cl(1)非金属性最强的元素是氟(填名称).化学性质最不活泼的元素是Ne(填元素符号).(2)S 原子结构示意图为;(3)Mg和Al中,原子半径较小的是Al;(4)N的氢化物的分子式NH3,该物质中N元素与H元素的质量比为14:3,(相对原子质量:N﹣14 H﹣1),其水溶液呈碱性性.(5)元素硅的氧化物常用于制造光导纤维(填一种高性能的现代通讯材料的名称);(6)元素最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式),呈两性的是Al(OH)3(填化学式);两者反应的化学方程式NaOH+Al(OH)3=NaAlO2+2H2O.【分析】(1)同周期自左而右非金属性增强,同主族自上而下非金属性减弱;稀有气体原子最外层为稳定结构,化学性质最不活泼;(2)S原子质子数为16,核外电子数为16,有3个电子层,各层电子数为2、8、6;(3)同周期自左而右原子半径减小;(4)N的氢化物的分子式为NH3,其水溶液呈碱性;(5)二氧化硅可以制造光导纤维;(6)同周期自左而右金属性减弱,金属性越强,最高价氧化物对应水化物的碱性越强;氢氧化铝属于两性氢氧化物.【解答】解:(1)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,上述元素中F元素非金属性最强;稀有气体Ne原子最外层为稳定结构,化学性质最不活泼,故答案为:氟;Ne;(2)S原子质子数为16,核外电子数为16,有3个电子层,各层电子数为2、8、6,原子结构示意图为,故答案为:;(3)同周期自左而右原子半径减小,故原子半径Mg>Al,故答案为:Al;(4)N的氢化物的分子式为NH3,分子中N、H元素质量之比为14:3 其水溶液呈碱性,故答案为:NH3;14:3;碱;(6)二氧化硅可以制造光导纤维,故答案为:光导纤维;(6)上述元素中Na的金属性最强,故NaOH的碱性最强,Al(OH)3属于两性氢氧化物,二者反应生成偏铝酸钠与水,反应方程式为:NaOH+Al(OH)3=NaAlO2+2H2O,故答案为:NaOH;Al(OH)3;NaOH+Al(OH)3=NaAlO2+2H2O.【点评】本题考查元素周期表与元素周期律综合应用,侧重对元素周期律的考查,注意掌握元素化合物性质,比较基础.8.(2016春•龙海市校级期末)X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:(1)Y在元素周期表中的位置为第二周期第ⅥA族.(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式).(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有O3、ClO2(写出其中两种物质的化学式).(4)ZX的电子式为;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.【分析】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Y原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素(不考虑稀有气体),据此解答,【解答】解:X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Y原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G 是短周期主族元素,所以G是Cl元素(不考虑稀有气体),(1)Y是O元素,O原子有2个电子层,最外层电子数为6,处于第二周期第ⅥA族,故答案为:第二周期第ⅥA族;(2)非金属元素的非金属性越强,其相应的最高价含氧酸的酸性越强,这几种元素非金属性最强的是Cl元素,所以其最高价含氧酸的酸性最强的是高氯酸HClO4,非金属性越弱,气态氢化物还原性越强,还原性最强的气态氢化物是硫化物 H2S,故答案为:HClO4;H2S;(3)Y的单质O3、G的单质Cl2、二者形成的ClO2可作消毒剂,故答案为:O3、ClO2等;(4)ZX为NaH,属于离子化合物,由钠离子与氢负离子构成,电子式为,Na 与水反应是氢氧化钠与氢气,反应化学方程式为为:NaH+H2O=NaOH+H2↑,故答案为:;NaH+H2O=NaOH+H2↑.【点评】本题以元素推断为载体考查了元素化合物的性质,能正确判断元素是解本题的关键,注意(4)中NaH电子式书写氢负离子的电子式2个电子成对,不能分开.9.(2016春•伊犁州校级期末)下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题.IAⅡAⅢAⅣAⅤAⅥAⅦA0族周期二①②③④三⑤⑥⑦⑧⑨⑩(1)非金属性最强的元素是F(填元素符号,下同),形成化合物种类最多的元素是C.(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式,下同),具有两性的是Al (OH)3.(3)⑤⑥⑦单质的活泼性顺序为Na>Mg>Al(填元素符号),判断的实验依据是单质与水或酸反应的剧烈程度(写出一种).【分析】由元素在周期表中的位置可知,①为C,②为N,③为O,④为F,⑤为Na,⑥为Mg,⑦为Al,⑧为S,⑨为Cl,⑩为Ar,然后利用元素及其单质、化合物的性质来解答.【解答】解:由元素在周期表中的位置可知,①为C,②为N,③为O,④为F,⑤为Na,⑥为Mg,⑦为Al,⑧为S,⑨为Cl,⑩为Ar,(1)以上元素中第二周期中F的非金属性最强,在第ⅦA中F的非金属性最强,则F的非金属性最强,碳元素形成的有机物种类最多,故答案为:F;C;(2)同周期,从左向右原子半径在减小,则Cl的原子半径在第三周期最小,以上元素中Na的金属性最强,则最高价氧化物对应水化物NaOH的碱性最强,Al元素的最高价氧化物对应水化物Al(OH)3的具有两性,故答案为:Cl;NaOH;Al(OH)3;(3)同周期,从左向右金属性在减弱,则Na、Mg、Al单质的活泼性为Na>Mg>Al,可利用单质分别与水(或酸)反应的剧烈程度来验证,故答案为:Na;Mg;Al;单质与水或酸反应的剧烈程度.【点评】本题考查元素周期表和元素周期律,熟悉元素在元素周期表中的位置是解答本题的关键,并利用元素及其单质、化合物的性质来解答即可,难度不大.三.多选题(共1小题)10.(2016•海南校级模拟)X、Y、Z、W 四种短周期元素在周期表中位于连续的四个主族,相对位置如图所示.Z元素原子核外K层与M层电子数相等.下列说法正确的是()X YWZA.原子半径由小到大的顺序为Y<X<W<ZB.Y的单质和Z的单质能够发生反应C.X的单质都是熔点高、硬度大的物质D.工业上利用电解Z、W的熔融氯化物的方法制备对应的单质【分析】X、Y、Z、W为四种短周期主族元素,Z元素原子核外K层与M层电子数相等,则Z原子M层电子数为2,故Z为Mg元素;由元素周期表中的相对位置可知,W为Al元素、X为C元素、Y为N元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.【解答】解:X、Y、Z、W为四种短周期主族元素,Z元素原子核外K层与M层电子数相等,则Z原子M层电子数为2,故Z为Mg元素,由元素周期表中的相对位置可知,W为Al元素、X为C元素、Y为N元素,A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径大小为:N <C<Al<Mg,即Y<X<W<Z,故A正确;B.Y的单质和Z的单质分别是氮气、镁,它们点燃生成氮化镁,故B正确;C.X是碳,它的单质有金刚石,金刚石的熔点高、硬度大,其他单质石墨质软,足球烯是分子晶体,熔点低,硬度小,故C错误;D.工业上利用电解Z(镁)的熔融氯化物的方法制备对应的单质镁,而铝不能用三氯化铝,因为三氯化铝是共价化合物,熔融态不能导电,故D错误;故选AB.【点评】本题考查结构位置性质关系应用,为高频考点,题目难度中等,试题侧重于学生的分析能力的考查,注意把握元素周期表的结构、元素周期律的递变规律.四.推断题(共1小题)11.(2016春•西安校级期末)如表为元素周期表短周期的一部分,请用化学用语(元素符号或化学式)回答相关问题:①②③④⑤⑥⑦⑧⑨(1)⑥元素在周期表中的位置为第三周期第ⅢA族.(2)表中序号元素中半径最大的常见离子是S2﹣.(3)表中最高价氧化物对应水化物的碱性最强的物质的电子式为,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF.(4)元素非金属性强弱比较有很多方法,其中③和⑧的非金属性强弱的探究方案中不可行的是A(填序号)A.比较两种氢化物的熔沸点高低 B.比较氢化物的稳定性C.通过和铁反应,比较得电子能力 D.通过置换反应(5)由①和②两种元素组成的化合物,同条件下与氧气密度相当,请写出该分子的电子式.(6)⑦与⑨两元素的单质反应生成1mol⑦的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为﹣69℃和58℃,写出该反应的热化学方程式Si(s)+2Cl2(g)=SiCl4(l)△H=﹣687kJ/mol.【分析】由元素在周期表中的位置可知,①为H,②为N,③为O,④为F,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl,(1)⑥元素为Al;(2)第三周期中阴离子大于阳离子半径,且具有相同排布的离子中原子序数大的离子半径小;(3)NaOH的碱性最强,高氯酸的酸性在所有含氧酸中酸性最强,HF在氢化物中最稳定;(4)利用氢化物的稳定性、与氢气化合的难易、最高价含氧酸的酸性、得电子能力比较非金属性;(5)由①和②两种元素组成的化合物,同条件下与氧气密度相当,则化合物为N2H4;(6)Si与Cl两元素的单质反应生成1molCl4,恢复至室温,放热687kJ,由于该化合物的熔、沸点分别为﹣69℃和58℃,则常温下SiCl4为液态,据此结合热化学方程式的书写原则解答.【解答】解:由元素在周期表中的位置可知,①为H,②为N,③为O,④为F,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl,(1)⑥元素为Al,位于第三周期第ⅢA族,故答案为:第三周期第ⅢA族;(2)第三周期中阴离子大于阳离子半径,且具有相同排布的离子中原子序数大的离子半径小,则表中序号元素中半径最大的常见离子是S2﹣,故答案为:S2﹣;(3)表中最高价氧化物对应水化物的碱性最强的物质为NaOH,其电子式为;高氯酸的酸性在所有含氧酸中酸性最强,其化学式为HClO4,气态氢化物最稳定的物质的化学式是HF,故答案为:;HClO4;HF;(4)A.比较两种氢化物的熔沸点高低,水中含氢键沸点高,但一般不能利用熔沸点比较非金属性,角度不合理,故A选;B.比较氢化物的稳定性,可知非金属性,故B不选;C.通过和铁反应,比较得电子能力,则O得到电子能力强,可比较非金属性,故C不选;D.通过置换反应,如氧气与硫化氢反应生成S,可比较非金属性,故D不选;故答案为:A;(5)由①和②两种元素组成的化合物,同条件下与氧气密度相当,则化合物为N2H4,电子式为,故答案为:;(6)Si与Cl两元素的单质反应生成1molSi的最高价化合物SiCl4,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为﹣69℃和58℃,则常温下SiCl4为液态,该反应的热化学方程式为Si(s)+2Cl2(g)=SiCl4(l)△H=﹣687kJ/mol,故答案为:Si(s)+2Cl2(g)=SiCl4(l)△H=﹣687kJ/mol.【点评】本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意元素周期律、元素化合物知识的应用,题目难度不大.。
(完整版)元素周期律测试题

《物质结构元素周期律》自测题可能用到的相对原子质量:Na 23 Cu 64 Cl 35.5 O 16 S 32 H 1 N 14 一、单选题(每题4分,共48分)1.元素X、Y、Z的原子序数依次增大,且序数之和为36。
Y、Z在同一周期,X、Z在同一主族,X原子最外层电子数是Y原子最外层电子数的3倍。
下列说法正确的是() A.Y的单质不与水反应B.由X、Y、Z三种元素形成的化合物里含有离子键C.简单离子的半径由大到小为Y>Z>X D.Z的最高价氧化物对应的水化物不稳定2.短周期主族元素X、Y、Z、W的原子序数依次递减,四种元素中没有同族元素,其原子的最外层电子数之和为15, W与X、Y、Z位于相邻周期,X原子的最外层电子数是W原子内层电子总数的3倍,单质Z可与水剧烈反应,Y、Z均为金属元素。
下列叙述正确的是() A.原子半径:Y>Z B.X、Y的氧化物均能与Z的氧化物对应的水化物反应C.单质熔点:W>X D.X、W的最简单氢化物的水溶液均显酸性3.短周期元素W、X、Y、Z的原子序数依次增大,W、Z同主族。
X2-与Y+离子的电子层结构相同,Z的单质可用作太阳能电池的光电转换材料。
下列说法错误的是() A.原子半径:X<W<Z<Y B.简单氢化物的稳定性:X>W>Z C.氢元素与W、X形成的相对分子质量最小的酸的分子式为H2WX3D.X与Y形成的两种二元化合物中,阴、阳离子数之比均为1∶24.X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素。
X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“—”相连的两种物质能发生反应)。
下列判断一定正确的是()A.X是元素周期表中非金属性最强的元素B.Z位于元素周期表第3周期ⅠA族C.4种原子中,Y原子半径最大D.W的最高化合价为+7价5.短周期元素X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子数之和为21,下列说法一定正确的是()A.X、Y、Z、W中至少有一种是金属元素B.元素的最高化合价:W>Z>YC.简单离子半径由大到小的顺序:W>Z>Y>XD.一定条件下,W的单质可以置换出Z的单质6.W、X、Y、Z是原子序数依次增大的短周期元素,W的原子半径最小,W、Y同主族,X、Z同主族,且X、Z的原子序数之和是W、Y原子序数之和的2倍,下列说法中不正确的是()A.由W和X两种元素形成的化合物可能含有非极性共价键B.由X、Y、Z三种元素形成的化合物只能为Y2ZX3或Y2ZX4C.由W、X、Y、Z四种元素形成的化合物水溶液可能呈强酸性D.W、X、Y、Z四种元素两两之间都能形成二元化合物7.短周期主族元素X、Y、Z、W的原子序数依次增大,Y、Z原子的电子数之比为3∶4;X、Z、W三种元素可组成化合物甲,25℃时,0.1mol/L甲溶液的c(OH-)=0.1mol/L,下列说法正确的是()A.简单离子半径:W>Z B.X和W形成的化合物属于离子化合物C.由X、Y、Z三种元素组成化合物的水溶液一定显酸性D.Z最简单氢化物分子间存在氢键,故其稳定性强于Y最简单氢化物8.X、Y、Z、M、W为五种短周期元素。
高考化学元素周期律综合经典题及答案
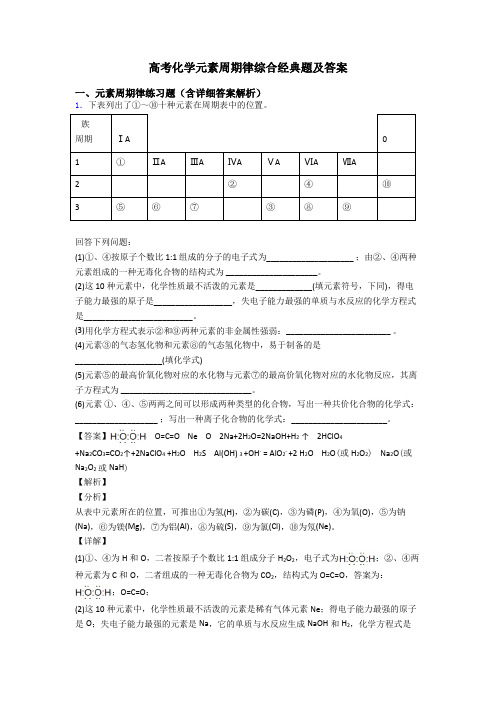
高考化学元素周期律综合经典题及答案一、元素周期律练习题(含详细答案解析)1.下表列出了①~⑩十种元素在周期表中的位置。
族周期ⅠA01①ⅡAⅢAⅣAⅤAⅥAⅦA2②④⑩3⑤⑥⑦③⑧⑨回答下列问题:(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是____________________(填化学式)(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
【答案】 O=C=O Ne O 2Na+2H2O=2NaOH+H2↑ 2HClO4+Na2CO3=CO2↑+2NaClO4 +H2O H2S Al(OH) 3 +OH- = AlO2- +2 H2O H2O(或H2O2) Na2O(或Na2O2或NaH)【解析】【分析】从表中元素所在的位置,可推出①为氢(H),②为碳(C),③为磷(P),④为氧(O),⑤为钠(Na),⑥为镁(Mg),⑦为铝(Al),⑧为硫(S),⑨为氯(Cl),⑩为氖(Ne)。
元素周期律(习题及答案)

①Cl<S
②F<Mg2<Al3
③Na<Na
④F<Cl<Br
A.①②④
B.①③④ C.②④ D.③④
4. 下列各组微粒,半径由小到大的顺序是( )
A.I、Br、Cl、F C.S2、O2、F
B.Al、Si、P D.Mg2、Na、K
5. 第 3 周期元素从左到右,下列叙述错误的是( )
A.最外层电子数逐渐增多
A.原子半径:丙<丁<戊 B.金属性:甲>丙 C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙
2
【参考答案】
1. B 2. A 3. B 4. D 5. B 6. D 7. A 8. D 9. C 10. C 11. C
3
径及元素主要化合价的周期性变化
2. 已知下列元素的原子半径:
原子
N
S
O
Si
半径 r/×1010 m 0.75
1.02
0.73
1.11
根据以上数据判断,磷原子的半径可能是( )
A.1.06×1010 m C.0.70×1010 m
B.0.80×1010 m D.1.20×1010 m
3. 比较下列各组微粒的半径,正确的是( )
C.酸性:HClO4>H2SO4>H3PO4 D.稳定性:HF>HCl>HBr 8. 下列结论正确的是( )
①微粒半径:S2>Cl ②还原性:S2>Cl>Br>I
③氧化性:S>Se>Te
④非金属性:F>Cl>S
A.①②③④ B.仅①③ C.仅①④ D.①③④ 9. 已知短周期元素的离子 A2、B、C3、D都具有相同的电子
高中化学第一章物质结构元素周期律第一节第1课时元素周期表作业(含解析)新人教版必修2

高中化学第一章物质结构元素周期律第一节第1课时元素周期表作业(含解析)新人教版必修21.下列说法中错误的是( )A.元素周期表中有7个主族、7个副族、1个0族和1个Ⅷ族B.稀有气体元素原子的最外层电子数均为8C.氢是原子序数最小的元素D.氧元素位于第二周期第ⅥA族解析:稀有气体中氦的最外层电子数是2而不是8。
答案:B2.原子序数为15的元素磷,在周期表中的位置为( )A.第二周期第ⅤA族B.第三周期第ⅣA族C.第三周期第ⅥA族D.第三周期第ⅤA族解析:15号元素磷位于元素周期表中第三周期,第ⅤA族。
答案:D3.现行元素周期表中已列出112种元素,其中元素种类最多的周期是( )A.第四周期B.第五周期C.第六周期D.第七周期解析:第一~六周期分别含有2、8、8、18、18、32种元素,第七周期未排满,排满后含有32种,故选C。
答案:C4.以下关于元素周期表结构的叙述正确的是( )A.元素周期表有7个主族,8个副族B.元素周期表有3个长周期和3个短周期C.第ⅢA族位于元素周期表的第三列(从左往右)D.0族位于元素周期表的第18列(从左往右)解析:周期表中有7个主族、7个副族、1个0族、1个Ⅷ族,A项错;周期表中的第一、二、三周期为短周期,其他四个周期均为长周期,B项错;第ⅢA族位于周期表中的第13列,C项错。
答案:D5.原子序数为x的元素位于周期表中的ⅡA族,则原子序数为x+1的元素不可能为( ) A.第ⅢA族B.第ⅠA族C.镧系元素D.第ⅢB族解析:原子序数为x+1的元素应位于第ⅡA族右侧相邻的族,在短周期中与第ⅡA族相邻的为第ⅢA族,在长周期中与第ⅡA族相邻的为第ⅢB族,镧系元素属于第ⅢB族。
答案:B6.元素周期表中前七周期的元素种数规律如下:( ) A.18 B.32C.50 D.64解析:结合周期数与元素种数的关系知,第八周期最后一种元素的原子序数和第七周期最后一种元素的原子序数之差即为第八周期元素种数,原子核外8个电子层,按排布规律各层电子数为2、8、18、32、50、32、18、8,故有50种元素。
元素周期律练习题

元素周期律1.有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,A和B 分别是(C)A.硅原子和钠原子B.硼原子和氢原子C.碳原子和铝原子D.氮原子和氧原子解析:A原子的M层比B原于的M层少3个电子,B原子的L 层电子数恰为A原子L层电子数的2倍,说明A、B为第2、第3周期元素;L层最多排8个电子,B原子的L层电子数恰为A原子L 层电子数的2倍,说明B元素L层有8个电子,A元素的L层有4个电子,故A是碳;A原子的M层比B原子的M层少3个电子,故B为铝。
2.已知X、Y、Z、W是短周期主族元素,X原子最外层有6个电子,且单质在常温下为气体,Y是至今发现的非金属性最强的元素,Z、W同周期,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。
下列叙述正确的是(A)A.原子最外层电子数由多到少的顺序:Y、X、W、ZB.原子序数由大到小的顺序:W、Y、Z、XC.元素非金属性由强到弱的顺序:Y、W、XD.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W解析:X、Y、Z、W是短周期主族元素,X原子最外层有6个电子,且单质是气体,则X为O;Y为至今发现的非金属性最强的元素,则Y为F,W的单质广泛用于半导体材料,则W为Si,Z元素周期序数等于族序数,且与W同周期,则Z为Al。
进而依据元素周期律知识和原子结构特点判断叙述正确与否。
最外层电子数依次为6、7、3、4,则由多到少顺序为Y 、X 、W 、Z ,A 项正确;依据原子序数,可知B 项错误;非金属性:F>O>S ,C 项错误;气态氢化物的稳定性:HF>H 2O>SiH 4,D 项错误。
3.下列排列顺序错误的是 ( D )A .原子半径:钠>硫>氯B .最高价氧化物对应的水化物的酸性:HClO 4>H 2SO 4>H 3PO 4C .最高正化合价:氯>硫>磷D .热稳定性:碘化氢>溴化氢>氯化氢解析:钠、磷、硫、氯是具有相同电子层数的元素,随着原予序数的递增,原子半径逐渐减小,最外层电子数逐渐增多,最高正化合价逐渐增大,最高价氧化物对应的水化物的酸性逐渐增强,碱性逐渐减弱。
完整版元素周期律和元素周期表练习题

随堂模拟测试第二节元素周期律和元素周期表1. “神舟七号”的燃料是氢化锂三兄弟物质的下列说法正确的是 ( )LiH、LiD、LiT。
其中Li的质量数为7,对这三种2.3. A .质子数之比为1 : 2 : 3C .摩尔质量之比为 8 : 9: 10B .中子数之比为D.化学性质不相同解析:A项,质子数之比为(3 + 1):+ 1) : (4+ 2) = 4 : 5 : 6; C 项摩尔质量之比为:(7 + 1) : (7+ 2) : (7 + 3) =8 : 9 : 三种物质的化学性质相同。
(3+ 1) : (3 + 1) = 1 : 1 :1 ; B项,中子数之比为(4+ 0) :(410; D 项,答案:C(2009山东理综,11)元素在周期表中的位置,反映了元素的原子结构和元素的性质。
法正确的是( )A .同一元素不可能既表现金属性,又表现非金属性B .第三周期元素的最高正化合价等于它所处的主族序数C•短周期元素形成离子后,最外层都达到8电子稳定结构D .同一主族的元素的原子,最外层电子数相同,化学性质完全相同解析:Al元素既表现金属性又表现非金属性,故A项错误;氢元素失去 1最外层没有电子,得到 1个电子为H-,为2电子稳定结构,故 C项错误; 与钠元素最外层电子数相同,但化学性质不同。
答案:B(2009 •东单科,11)元素X、Y、Z原子序数之和为 36 , X、Y在同一周期, 相同的核外电子层结构。
下列推测不正确的是( )A•同周期元素中X的金属性最强B .原子半径 X>Y,离子半径 X + >Z2「C •同族元素中Z的氢化物稳定性最高D•同周期元素中丫的最高价含氧酸的酸性最强下列说个电子为H + ,I A族中氢元素X +与Z2-具有解析:分析题给条件可推知:X是钠(Na)、Y是氯(CI)、Z 是氧(O)。
原子半径X>Y,但X +(Na + )与Z2—(02—)电子层结构相同,离子半径X + >Z2—。
元素周期表,元素周期律练习题

元素周期表,元素周期律练习题【知识框架】【基础回顾】一、元素周期表1、元素周期表的编排原则(1)横行:把电子层数相同的元素按原子序数递增的顺序从左至右排成横行。
(2)纵行:把不同横行中最外层电子数相等的元素,按电子层数递增的顺序,由上而下排成纵行。
2、元素周期表的结构(1)周期(七个横行,七个周期)(2)族(18个纵行,16个族)3.元素周期表的分区(★选修)按构造原理最后填入电子的能级的符号可把周期表里的元素划分为5个区,分别为s区、d区、ds、p区、f区,各区分别包括ⅠA、Ⅱ族元素、ⅢB~Ⅷ族元素、ⅠB、ⅡB族元素、ⅢA~ⅦA族和0族元素、镧系和锕系元素,其中s区(H除外)d 区、ds区和f区的元素都为金属。
二、元素周期律1、概念元素的性质随核电荷数递增发生周期性的递变。
2、实质元素周期律的实质是元素原子结构的周期性变化必然引起元素性质的周期性变化。
3、对角线规则在元素周期表中,某些主族元素与右下方的主族元素的某些性质相似,如Li和Mg,Be和Al。
4、元素周期表中同周期、同主族元素性质的递变规律5、电离能(★选修)(1)第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量。
(2)元素第一电离能的意义:元素的第一电离能可以衡量元素的原子失去一个电子的难易程度。
第一电离能数值越小,原子越易失去一个电子,该元素的金属性越强;反之,第一电离能数值越大,原子越难失去一个电子。
(3)变化规律:①同一周期从左到右元素的第一电离能呈增大的趋势,但某些地方出现曲折变化,如Be>B,N>O, Mg>Al,P>S。
②同一族从上到下元素的第一电离能变小。
6.电负性(★选修)(1)键合电子:原子中用于形成化学键的电子。
(2)电负性:用来描述不同元素的原子对键合电子吸引力的大小。
(3)意义:电负性越大的原子,对键合电子的吸引力越大,非金属性越强。
故电负性的大小可用来衡量元素非金属性和金属性的大小。
高中化学元素周期律练习题(附答案)

高中化学元素周期律练习题(附答案)高中化学元素周期律练题一、单选题1.下列关于元素周期表的说法不正确的是()A.编制第一张元素周期表的是俄国化学家门XXXB.门捷列夫编制元素周期表的排序依据是原子的核电荷数C.门捷列夫编制元素周期表的排序依据是相对原子质量D.元素周期表揭示了化学元素间的内在规律2、下列关于元素周期表的说法正确的是A.在元素周期表中,每一列就是一个族B.主族元素都是短周期元素C.副族元素都是金属元素D.元素周期表每个长周期包含32种元素3.下列关于元素周期表的说法正确的是( )A.元素周期表共有七个周期B.元素周期表共有18个族D.原子核外最外层电子数为2的元素都是第ⅡA元C.所含元素种数最多的族是Ⅷ族素4、元素在周期表中的位置,能反映原子结构和元素的化学性质,下列有关说法正确的是A.由长、短周期元素共同组成的元素族称为主族(除零族外)B.同一元素不可能既表现金属性,又表现非金属性C.短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构D.互为同位素的不同核素,物理性质和化学性质都不同5.下列说法正确的是()A.卤族元素都有正化合价B.卤族元素的单质都只具有氧化性C.卤族元素的最低化合价都是-1价D.卤族元素氢化物都是强酸6、下列叙述中正确的是A.卤族元素是典范的非金属元素,因此不能与其他非金属元素回响反映B.碱金属元素单质越活泼,其熔点和沸点就越高C.卤族元素单质都能与水猛烈回响反映D.卤族元素单质都能和氢气反应,且气态氢化物的稳定性随单质氧化性的增强而增强7、下列有关卤族元素的叙述不正确的是A.卤素单质从F2到I2,颜色加深,熔沸点升高B.卤族元素从Cl到I,最高价氧化物对应水化物的酸性减弱C.卤族元素从F到I, HX水溶液酸性增强D.卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质可将排在后面的卤素从它的盐溶液中置换出来8.下列有关卤族元素的说法中,正确的是()A.密度:Cl2>Br2B.HFO4>HClO4D.最外层电子数:Br>IC.热稳定性:HBr>HI9.依据同主族元素性质的递变规律判断,随着原子核电荷数的递增,下列说法正确的是(不考虑第七周期元素)( )A.碱金属和卤素单质的熔点逐渐升高B.碱金属元素的金属性逐渐增强,对应离子的氧化性也逐渐增强C.卤族元素的单质与氢气反应越来越难,生成的氢化物越来越稳定D.碱金属元素的单质与水反应的程度越来越剧烈10.下列关于碱金属元素和卤素的说法中,错误的是()A.钾与水的回响反映比钠与水的回响反映更猛烈B.随核电荷数的增加,碱金属单质的密度逐渐变大C.随核电荷数的增加,碱金属元素和卤素的原半径都逐渐增大D.碱金属元素中,锂原子落空最外层电子的能力最弱11.下列关于碱金属的叙述中,正确的是()A.碱金属都可以保存在煤油中B.碱金属与水回响反映均漂泊在水面上C.碱金属在空气中加热均可生成多种氧化物D.碱金属元素的单质硬度小、密度小、熔点低12、下列有关碱金属元素的叙述正确的是()A.碱金属单质均为银白色,密度均小于水B.碱金属单质从Li到Cs,熔点依次升高C.氢氧化铯碱性强于氢氧化钠D.碱金属元素构成的阳离子,从Li到Cs氧化性依次增强13.关于碱金属元素的表述正确的是()A.碱金属是对应周期中金属性最强的元素B.从上至下单质氧化性逐渐减弱C.Li、Na、K单质均应保存在火油中D.Li、Na、K燃烧均生成过氧化物14.下列叙述中错误的是()A.碱金属具有强还原性,它们的离子具有强氧化性B.随着电子层数的增多,碱金属的原子半径逐渐增大C.碱金属单质的熔、沸点随着核电荷数的增大而降低D.碱金属元素在自然界中都是以化合态的形式存在的15.下列关于碱金属元素和卤素的说法中,错误的是()A.随核电荷数的增加,碱金属单质和卤素单质的熔、沸点都逐渐降低B.碱金属元素中,锂原子落空最外层电子的能力最弱;卤素中,氟原子得电子的能力最强C.钾与水的回响反映比钠与水的回响反映更猛烈D.溴单质与H2的反应比碘单质与H2的回响反映更猛烈二、填空题++16.下表是元素周期表的一局部,回答下列题目:1.B在周期表中的位置是__________;写出A、B的单质之间发生反应的化学方程式:__________。
元素及周期律答案及解析

元素及周期律参考答案与试题解析一.选择题(共30小题)1.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是(A)A.原子半径:W>Z>Y>XB.最高价氧化物对应水化物的酸性:X>W>ZC.最简单气态氢化物的热稳定性:Y>X>W>ZD.元素X、Z、W的最高化合价分别与其主族序数相等【解答】解:A、同一周期的元素,原子序数越大,原子半径越小,不同周期的元素,原子核外电子层数越多,原子半径就越大,所以原子半径大小关系是:Z>W>X>Y,故A错误;B、元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,元素的非金属性:X >W>Z,所以它们的最高价氧化物对应水化物的酸性:X>W>Z,故B正确;C、元素的非金属性越强,其相应的氢化物的稳定性就越强,元素的非金属性:Y>X>W >Z,所以元素的氢化物的稳定性:Y>X>W>Z,故C正确;D、主族元素除了O和F之外,最高化合价等于主族序数,所以X、Z、W的最高化合价分别与其主族序数相等,故D正确;2.短周期非金属元素甲~戊在元素周期表中的相对位置如表所示,下面判断正确的是(C)甲乙丙丁戊A.原子半径:甲<乙B.非金属性:乙<丁C.最高价氧化物的水化物的酸性:丙<丁D.最外层电子数:丙>丁>戊【解答】解:A.同周期自左而右原子半径减小,则原子半径为甲>乙,故A错误;B.同主族从上到下元素的非金属性减弱,则非金属性为乙>丁,故B错误;C.同周期从左向右非金属性增强,对应的最高价氧化物的水化物的酸性越强,高价氧化物的水化物的酸性:丙<丁,故C正确;D.同周期从左向右最外层电子数增大,则最外层电子数为丙<丁<戊,故D错误;3.已知33As、35Br位于同一周期.下列关系正确的是(C)A.原子半径:As>Cl>P B.热稳定性:HCl>AsH3>HBrC.还原性:As3﹣>S2﹣>Cl﹣D.酸性:H3AsO4>H2SO4>H3PO4【解答】解:A.原子半径大小顺序是As>P>Cl,故A错误;B.热稳定性:HCl>HBr>AsH3,故B错误;C.单质的氧化性Cl2>S>As,所以阴离子的还原性:As3﹣>S2﹣>Cl﹣,故C正确;D.酸性H2SO4>H3PO4>H3AsO4,故D错误;4.下列说法中,正确的是(D)A.原子最外层电子数为2的元素一定是金属元素B.HF、HCl、HBr、HI的热稳定性和还原性都依次增强C.同主族元素形成的氧化物晶体类型相同D.化合物XY3中,X可能呈﹣3价,Y可能呈+1价【解答】解:A、氦原子只有2个电子,不是金属元素,故A错误;B、同主族自上而下,非金属性增强,所以非金属性F>Cl>Br>I,所以稳定性HF>HCl >HBr>HI,还原性HF<HCl<HBr<HI,故B错误;C、碳元素与硅元素同族,二氧化碳是分子晶体,二氧化硅是原子晶体,故C错误;D、化合物XY3为NH3,N呈﹣3价,H呈+1价,符合,故D正确.5.下列大小顺序排列不正确的组合是(B)A.气态氢化物的稳定性:HCl>HBr>HI B.离子半径:S2﹣>Na+>O2﹣C.酸性:HClO4>H2SO4>H3PO4 D.熔点:SiO2>NaCl>干冰【解答】解:A、非金属性:Cl>Br>I,因此氢化物的稳定性:HCl>HBr>HI,故A正确;B、相同电子层结构的微粒,核电核数大的半径小,O2﹣>Na+,即S2﹣>O2﹣>Na+,故B错误;C、非金属性:Cl>S>P,则最高价含氧酸酸性:HClO4>H2SO4>H3PO4,故C正确;D、SiO2是原子晶体,NaCl是离子晶体,干冰是分子晶体,一般有熔点:原子晶体>离子晶体>分子晶体,故D正确;6.X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20.下列判断正确的是(C)W X YZA.四种元素的原子半径:r Z>r X>r Y>r W B.四种元素形成的单质最多有6种C.四种元素均可与氢元素形成电子总数为18的分子D.四种元素中,Z的最高价氧化物对应的水化物酸性最强【解答】解:X、Y、Z、W四种属于短周期元素,根据元素在周期表中的位置知,W、X、Y属于第二周期元素,Z属于第三周期元素,设X的原子最外层电子数是a,则W的最外层电子数是a﹣1,Y的最外层电子数是a+1,Z最外层电子数是a,这四种元素原子的最外层电子数之和为20,则a﹣1+a+a+1+a=20,a=5,所以X是N元素、W是C元素、Y是O 元素、Z是P元素,A.原子的电子层数越多,其原子半径越大,同一周期中,原子半径随着原子序数的增大而减小,所以四种元素的原子半径:r Z>r w>r x>r y,故A错误;B.形成单质最多的元素是C元素,碳元素的单质有:金刚石、石墨、木炭、焦炭、活性炭、炭黑、C60等,故B错误;C.这四种元素形成的18电子的分子为:C2H6、N2H4、H2O2、PH3,故C正确;D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,这几种元素中,虽然O元素的非金属性最强,但O元素没有最高价含氧酸,所以X的最高价氧化物的水化物酸性最强,故D错误;7.如图为元素周期表中前四周期的一部分,下列判断正确的是(AD)A.气态氢化物的还原性:X>Y、M>RB.原子半径:Z>M>R、M<X<YC.M与Z的原子核外电子数相差16D.Q的最高价氧化物一定能溶于强碱D、Q可以是Al、硅或P,最高价氧化物能溶于强碱.【解答】解:A、非金属性X<Y、M<R,所以氢化物的还原性为X>Y、M>R,故A正确;B、同主族从上往下电子层数增多,半径增大,所以原子半径:Z>M>R,同周期从左到右半径减小,所以原子半径为M>X>Y,故B错误;C、同主族元素,第三周期和第四周期相差18,故C错误;D、Q可以是Al、硅或P,最高价氧化物能溶于强碱,故D正确;8.下列叙述中,不正确的是(D )A.含金属元素的离子不一定都是阳离子B.阴阳离子间的反应不一定生成离子化合物C.金属元素从游离态变为化合态一定被氧化D.非金属元素从化合态变为游离态一定被还原【解答】解:A.含金属元素的离子不一定是阳离子,可能是阴离子,如AlO2﹣,故A正确;B.阴阳离子之间的反应不一定生成离子化合物,可能生成共价化合物,如氢离子和氢氧根离子反应生成水,故B正确;C.金属元素从游离态变为化合态时,金属失电子作还原剂而被氧化,故C正确;D.非金属元素从化合态变为游离态不一定被还原,可能被氧化,如HCl→Cl2,故D错误;9.第三周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是(D)A.气态氢化物的稳定性:N>RB.Z的最高价氧化物对应的水化物能溶于稀氨水C.Y和R形成的化合物既含离子键又含共价键D.X和M两者最高价氧化物对应的水化物反应后溶液的pH>7【解答】解:元素的金属性越强,其对应最高价氧化物的水化物碱性越强则该溶液的pH越大,元素的非金属性越强,其最高价氧化物的水化物酸性越强则该溶液的pH越小,根据图象知,从R到X,最高价氧化物的水化物碱性逐渐增强、酸性逐渐减弱,X、Y、Z、M、N、W、R分别为Na、Mg、Al、Si、P、S、Cl元素.A.元素的非金属性越强,其氢化物越稳定,R的非金属性大于N,则气态氢化物的稳定性:N<R,故A错误;B.Z的最高价氧化物对应的水化物是氢氧化铝,氢氧化铝能溶于强碱但不能溶于弱碱,所以不能溶于稀氨水,故B错误;C.Y和R形成的化合物是MgCl2,氯化镁中氯离子和镁离子之间只存在离子键,故C错误;D.X和M两者最高价氧化物对应的水化物反应后的物质是Na2SiO3和H2O,硅酸钠是强碱弱酸盐,硅酸根离子水解导致溶液呈碱性,所以硅酸钠溶液的pH>7,故D正确;10.下列说法不正确的有几个(C)①C12H8分子中既含极性键又含非极性键②若R2﹣和M+的电子层结构相同,则原子序数:R>M③F2,Cl2,Br2,I2熔点随相对分子质量增大而升高④NCl3,PCl5,CO2,CS2分子中各原子均达到8e稳定结构⑤若X的质子数为a,中子数为b,则原子可表示为b a X⑥由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI⑦两种微粒含有相同质子数和电子数,这两种微粒可能是两种不同阴离子或阳离子⑧原子序数为34号的元素属于长周期的副族元素.A.3 B.4 C.5 D.6【解答】解:①C12H8分子中碳元素和碳元素之间形成非极性共价键,碳元素和氢元素之间形成极性共价键,故①正确;②R2﹣和M+的电子层结构相同,则离子的核外电子数相等,且M处于R相邻的下一周期;所以原子序数:M>R,故②错误;③F2、Cl2、Br2、I2是组成和结构相似的分子,熔点随相对分子质量增大而升高,故③正确;④NCl3、CO2、CS2分子中各原子均达到8e﹣稳定结构,但PCl5中P原子最外层不是8电子,故④错误;⑤若X的质子数为a,中子数为b,则原子可表示为a a+b X,故⑤错误;⑥不能利用非金属性来比较氢化物的水溶液酸性,故⑥错误;⑦钠离子和铵根离子具有相同的质子数和电子数、氢氧根和氟离子具有具有相同的质子数和电子数,故⑦正确;⑧原子序数为34号的元素为Se,属于长周期的主族元素,不是副族元素,故⑧错误;根据分析可知,错误的有5个,11.下列关于化学键的叙述正确的是(D)A.非金属元素组成的化合物中只含共价键B.C、N、O、H四种元素形成的化合物一定既有离子键,又有共价键C.不同元素的原子构成的分子只含极性共价键D.CH4中所有的价电子都参与形成共价键【解答】解:A.非金属元素组成的化合物中可能含有离子键,如铵盐,故A错误;B.C、N、O、H四种元素形成的化合物一定含有共价键,可能含有离子键,如氨基酸中只含共价键,铵盐中既含共价键也含离子键,故B错误;C.不同元素的原子构成的分子可能含有非极性共价键,如HC≡CH中含有非金属性共价键,故C错误;D.碳原子最外层含有4个电子,甲烷分子中碳原子的最外层4个电子和氢原子形成4个共价键,所以CH4中所有的价电子都参与形成共价键,故D正确;12.如图为元素周期表中短周期的一部分,下列说法正确的是(C)A.非金属性:Y>Z>M B.离子半径:M﹣>Z2﹣>Y﹣C.ZM2分子中各原子的最外层均满足8电子稳定结构D.三种元素中,Y的最高价氧化物对应的水化物酸性最强【解答】解:根据元素在周期表中的相对位置可知,X为He元素、Y为F元素、M为Cl 元素、Z为S元素,A.Y、M铜主族,原子序数:Y<M,则非金属性:Y>M;Z、M同周期,原子序数:Z <M,则非金属性:Z<M,所以非金属性大小为:M>Z>Y,故A错误;B.Z、M位于第三周期,其阴离子比Y多1个电子层,且原子序数:Z<M,则离子半径大小为:Z2﹣>M﹣>Y﹣,故B错误;C.Z为S、M为Cl元素,则ZM2为SCl2,SCl2分子中S和Cl都达到8电子稳定结构,故C正确;D.Y为F元素,F没有正化合价,三种元素中,最高价氧化物对应的水化物酸性最强的为Cl,故D错误;13.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y 处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是(C)A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大B.元素X不能与元素Y形成化合物X2Y2C.元素Y、R分别与元素X形成的化合物的热稳定性:X m Y>X m RD.元素W、R的最高价氧化物的水化物都是强酸【解答】解:A、从题目所给的条件可以看出X是H元素,Y是O元素,Z是Na元素,W 是Al元素,R是S元素.Y、Z、W具有相同电子层结构的离子(O2﹣、Na+、Al3+),根据核外电子排布相同的微粒,半径随着核电荷数的增加而减小,其半径依次减小,故A错误;B、X和Y元素能形成2种化合物,X2Y(H2O)和X2Y2(H2O2),故B错误;C、元素Y、R分别与元素X形成的化合物是氢化物,因为Y(O元素)和R(S元素)的非金属性强弱:Y>R,所以对应的氢化物的稳定性:X m Y>X m R,故C正确;D、W元素最高价氧化物的水化物是Al(OH)3,是弱碱,而R元素最高价氧化物的水化物是H2SO4,是强酸,故D错误.14.已知a、b分别为同周期的ⅠA和ⅦA族的两种元素,它们的原子序数分别为m和n,则下列关系不可能成立的是(D)A.n=m+16 B.n=m+6 C.n=m+30 D.n=m+10【解答】解:周期表中第一、二、三、四、五、六、七周期元素的种数分别为2、8、8、18、18、32、26,若元素在二、三周期,则原子序数n=m+6,若元素在四、五周期,由于副族和ⅥⅡ族出现在ⅠA和ⅦA族之间共10种元素,则原子序数n=m+6+10=m+16,若元素在第六周期,又多了镧系的出现,有15种元素,则原子序数n=m+16+14=m+30.15.A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示.A 是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是(B)A.简单离子的半径大小关系:B>C>EB.C元素的气态氢化物比D元素的气态氢化物稳定是氢键的缘故C.由A、B两种元素组成的离子化合物NH5中,阴、阳离子个数比为1:1D.由C、D、E三种元素组成的某种化合物,其水溶液能与盐酸反应产生沉淀【解答】解:A、B、C、D、E均为短周期主族元素,原子序数均小于18,A是短周期中原子半径最小的元素,A是氢元素,E是短周期中最活泼的金属元素,所以E为钠元素,由B 与C、D在周期表中的位置关系可知,B、C位于第二周期,原子序数:C>B,且C与D 处于同主族,A、B、C三种元素的原子序数之和等于D元素的原子序数,令C的原子序数为x,则B为x﹣1、D为x+8,则1+x﹣1+x=x+8,解得x=8,故A为H、B为N、C为O、D为S,E为Na,A.B为N、C为O、E为Na,电子层结构相同核电荷数越大离子半径越小,则离子半径N3﹣>O2﹣>Na+,故A正确;B.氢键与氢化物的稳定性无关,与氢化物的沸点有关.同一主族元素中,元素的非金属性随着原子序数的增大而减小,元素的非金属性越强,其氢化物的稳定性越强,所以非金属性O>S,氢化物稳定性H2O>H2S,故B错误;C.NH5是由铵根离子和氢离子,一个铵根离子带一个单位的正电荷,一个氢离子带一个单位的负电荷,所以阴、阳离子H﹣、NH4+个数比为1:1,故C正确;D.由C、D、E三种元素组成的某种化合物可能为硫酸钠、亚硫酸钠、硫代硫酸钠,Na2S2O3+2HCl═2NaCl+S↓+SO2↑+H2O,故D正确;16.短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13.X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素.下列说法正确的是(D)A.原子半径的大小顺序:r(Y)>r(Z)>r(W)B.元素Z、W 的简单离子的电子层结构不同C.元素Y 的简单气态氢化物的热稳定性比Z 的强D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物【解答】解:短周期元素X、Y、Z、W 的原子序数依次增大,Z 是地壳中含量最高的元素,Z为氧元素,X 的原子半径比Y 的小,则X不可能与Y处于同一周期,Y的原子序数小于氧元素,故Y处于第二周期,X处于第一周期,则X为氢元素,X与W同主族,故W为Na元素,四原子最外层电子数之和为13,则Y原子的最外层电子数为13﹣1﹣1﹣6=5,故Y为氮元素,A、同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>N>O,即r(W)>r(Y)>r(Z),故A错误;B、O2﹣、Na+离子的核外电子数都是10个电子,核外电子层结构相同,故B错误;C、同周期自左而右非金属性增强,故非金属性O>N,非金属性越强气态氢化物越稳定,故氢化物稳定性H2O>NH3,故C错误;D、由H、N、O三元素组成的化合物中,若硝酸为共价化合物,硝酸铵为离子化合物,故D正确;17.短周期主族元素A、B、C、D的原子序数依次增大,A、B、C原子的最外层电子数之和为12,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍.下列说法正确的是(B)A.元素A、C的最高价氧化物对应的水化物都是弱酸B.元素B能与A的最高价氧化物发生置换反应C.元素B和D能形成BD2型的共价化合物D.D的单质有毒,且有漂白性【解答】解:由题中信息可知A为C,B为Mg,C为S,D为Cl,则A.A为C,对应的最高价氧化物的水化物为碳酸,属于弱酸,故A错误;B.根据反应:2Mg+CO22MgO+C,该反应为置换反应,故B正确;C.B为Mg,D为Cl,二者形成的化合物为离子化合物,故C错误;D.D为Cl,干燥的氯气没有漂白性,故D错误.18.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知(A)A.X、Y、Z中最简单氢化物稳定性最弱的是YB.Z元素氧化物对应水化物的酸性一定强于YC.X元素形成的单核阴离子还原性大于YD.Z元素单质在化学反应中只表现氧化性【解答】解:W、X、Y、Z四种短周期元素,W的气态氢化物可与其最高价含氧酸生成离子化合物,这指的是铵盐,W是N元素;由元素在周期表中的位置可知,X为氧元素、Y 为硫元素、Z为氯元素,A.非金属O>S,Cl>S,则其氢化物中H2S最不稳定,故A正确;B.只有氯元素的最高价含氧酸才一定比Y的含氧酸酸性强,故B错误;C.非金属O>S,则阴离子还原性S2﹣>O2﹣,故C错误;D.Cl2与水的反应中既表现氧化性,也表现了还原性,故D错误;19.已知磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换.又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换.由此可推断出H3PO2的分子结构是(B)A. B.C.D.【解答】解:由题意可知,次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换,则H3PO2中只有一个羟基氢,A、有2个羟基氢,则不符合题意,故A错误;B、有1个羟基氢,则符合题意,故B正确;C、有2个羟基氢,则不符合题意,故C错误;D、不含有羟基氢,则不符合题意,故D错误;20.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是(A)A.元素X与元素Z的最高正化合价之和的数值等于8B.原子半径的大小顺序为:r X>r Y>r Z>r W>r QC.离子Y2﹣和Z3+的核外电子数和电子层数都不相同D.元素W的最高价氧化物对应的水化物的酸性比Q的强【解答】解:由元素所在周期表中的位置可知,X为N元素,Y为O元素,Z为Al元素,W为S元素,Q为Cl元素.A、X为N元素,最高正价为+5价,Z为Al元素,最高正价为+3价,则元素X与元素Z 的最高正化合价之和的数值等于8,故A正确;B、原子核外电子层数越多,半径越大,同一周期元素原子半径从左到右逐渐减小,则有:r Z>r W>r Q>r X>r Y,故B错误;C、离子Y2﹣和Z3+的核外电子数都为10,离子核外有2个电子层,电子层数相同,故C错误;D、同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性逐渐增强,故D错误.21.A、B、C、D、E为原子序数相邻且依次递增的同一短周期元素,下列说法正确的是(m、n均为正整数)(C)A.若H n EO m为强酸,则D是位于V A族以后的非金属元素B.若C的最低化合价为﹣3,则E的气态氢化物的分子式为H2EC.A、B的最高价氧化物水化物均为碱,则碱性A(OH)n强于B(OH)n+1D.若B为金属,则C一定为金属元素【解答】解:A、若H n EO m为强酸,如果E是第二周期元素,E应该是N元素,D位于第IV A族,如果E是第三周期,E为S元素或Cl元素,D为第V A族或第VIA族元素,故A 错误;B、若C的最低化合价为﹣3,则E的最低化合价为﹣1,E的气态氢化物的分子式为HE,故B错误;C、同一周期从左到右最高价氧化物对应水化物的碱性减弱,A在B的左端,所以碱性A(OH)n强于B(OH)n+1,故C正确;D、如果是第二周期元素的原子,则B是金属铍时,C可以是非金属硼,故D错误.22.下列有关化学用语表示正确的是(C)A.明矾的化学式:KAl(SO4)2B.氯离子的结构示意图:C.2﹣丙醇的结构简式:(CH3)2CHOHD.溴化铵的电子式:【解答】解:A.明矾中含有结晶水,明矾正确的化学式为:KAl(SO4)2•12H2O,故A错误;B.氯离子的核电荷数为17,最外层为8个电子,氯离子的结构简式为:,故B错误;C.2﹣丙醇中,羟基位于2号C,主链含有3个C原则,其结构简式为:(CH3)2CHOH,故C正确;D.溴化铵为离子化合物,铵根离子和溴离子都需要标出所带电荷及原子的最外层电子,溴化铵正确的电子式为:,故D错误;23.X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是(D)A.X的原子半径一定大于Y的原子半径B.X与Y的简单离子不可能具有相同的电子层结构C.两元素形成的化合物中,原子个数比不可能为1:1D.X2Y可能是离子化合物,也可能是共价化合物【解答】解:X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,则Y为第ⅥA 族元素,则X可能为H、Li、Na等元素,Y可能为O、S等元素:A、当X为H、Li等元素,Y为S元素时,X的原子半径小于Y的原子半径,故A错误;B、X为Na时,其对应离子为Na+,离子有10个电子,Y为O元素时,其对应的离子为O2﹣,离子有10个电子,二者具有相同的电子层结构,故B错误;C、两元素形成的化合物中,原子个数为1:1的有H2O2或Na2O2,故C错误;D、化学式为X2Y的有H2O或Na2O或Li2O,可能是离子化合物,也可能是共价化合物,故D正确.24.中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝.关于Lv的叙述错误的是(D)A.原子序数116 B.中子数177C.核外电子数116 D.相对原子质量293【解答】解:A.第116号元素Lv的原子序数为116,故A正确;B.中子数=质量数﹣质子数=293﹣116=177,故B正确;C.原子序数=质子数=核外电子数=核电荷数,可知核外电子数为116,故C正确;D.293代表该原子的质量数,一种元素有多种核素,质量数指的是质子与中子质量的和,不同核素的质量数不同,即一种元素可以有多个质量数,相对原子质量为各核素的平均相对质量,所以同种元素的相对原子质量只有一个数值,两者近似相等,故D错误.25.如表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍.下列说法正确的是(D)XY Z WTA.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增C.YX2晶体熔化、液态WX3气化均需克服分子间作用力D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性【解答】解:X、Y、Z、W为短周期元素,由元素周期表可知:X应位于第二周期,且应处于周期表中右半部分,W与X处于同一主族,且W元素原子的核电荷数为X元素的2倍,那么X为O,W为S,那么Z为P,T为As,Y为Si,A、元素的非金属性越强,其气态氢化物越稳定,由于非金属性O>S>P,故H2O>H2S>H3P,故A错误;B、S元素在自然界中存在游离态单质,常在火山口附近,故B错误;C、YX2为SiO2,属于原子晶体,该固体熔化克服的是共价键,没有分子间作用力,故C错误;D、As处于元素周期表的金属与非金属分界线上,具有半导体的性能,T2X3为As2O3,As 的化合价为+3,处于中间价,故既有氧化性也有还原性,故D正确,26.“玉兔”号月球车用Pu作为热源材料.下列关于Pu的说法正确的是(D)A.Pu与U互为同位素B.Pu与Pu互为同素异形体C.Pu与U具有完全相同的化学性质D.Pu与Pu具有相同的最外层电子数【解答】解:A.有相同质子数,不同中子数的原子或同一元素的不同核素互为同位素,Pu与U质子数不同,不是同位素,故A错误;B.同种元素形成的不同单质互称同素异形体,Pu与Pu均为原子,不是同素异形体,故B错误;C.Pu与U质子数不同属于不同的元素,其化学性质不同,故C错误;D.Pu与Pu具有相同的质子数,所以其核外电子数相同,则具有相同的最外层电子数,故D正确;27.X、Y是同主族的非金属元素,如果X原子半径比Y原子大,则下列说法错误的是(BC )A.X的非金属性比Y弱B.X的原子序数比Y的小C.X的气态氢化物比Y的气态氢化物稳定D.X的最高价氧化物对应的水化物的酸性比Y的最高价氧化物对应的水化物的酸性弱【解答】解:X、Y是同主族的非金属元素,同主族元素从上到下原子半径逐渐增大,如果X原子半径比Y原子半径大,则原子序数X>Y,则A.同主族元素从下到上非金属性逐渐增强,则非金属性X<Y,故A正确;B.原子序数X>Y,故B错误;C、非金属性X<Y,元素的非金属性越强,对应的氢化物越稳定,所以Y的氢化物更稳定,故C错误;D、非金属性X<Y,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,故X最高价氧化物对应水化物的酸性比Y最高价氧化物对应水化物的酸性弱,故D正确.28.元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是(BD)。
元素周期律经典练习题

《元素周期律》习题精选1一、选择题1.元素性质呈周期性变化的原因是A .相对原子质量逐渐增大B .核电荷数逐渐增大C .核外电子排布呈周期性变化D .元素的化合价呈周期性变化2.某电子层当它作为最外层时,最多只能容纳8个电子,当它作为次外层时,最多只能容纳18个电子,该电子层可能是A.M 层B.K 层C.L 层D.P 层3.下列各组元素中,按最高正价递增顺序排列的是A .F 、Cl 、Br 、IB .K 、Mg 、C 、S C .C 、N 、O 、FD .Li 、Na 、K 、Rb4.按Be 、Mg 、Ca 、Sr 、Ba 的顺序而递增的性质是A .氧化性B .还原性C .熔点D .化合价5.1~18号元素的离子中,原子核电荷数和离子最外层电子数相同的是A .Cl —B .Na +C .O 2—D .S2— 6.1~18号元素中,原子的核外电子数与电子层数相同的是A .氢B .铍C .铝D .氯7.下列元素中,原子半径最大的是( )A.锂B.钠C.氟D.氯8.下列各组微粒半径之比大于1的是A .Na Na r /r +B .NaMg /r r C .Cl P /r r D .p N /r r 9、某元素R 的阳离子是R n+,核外共有x 个电子,其质量数为A 则R 核内中子数为( )A 、A-x+nB 、A-x-nC 、A+x+nD 、A-n+x10、某元素的原子,核外有3个电子层;最外电子层与最内电子层的电子数相等,则该元素的核电荷数是( )A 、12B 、16C 、18D 、2011.元素X 的原子核外M 电子层上有3个电子,元素-2Y 的离子核外有18个电子则这两种元素可形成的化合物为A .XY 2B .X 2Y 3C .X 3Y 2D .X 2Y12.A 、B 均为原子序数1~20的元素,已知A 的原子序数为n ,+2A 离子比-2B 离子少8个电子,则B 的原子序数为A .n +4B .n +6C .n +8D .n +1013 X 和Y 两元素的阳离子具有相同的电子层结构,X 元素的阳离子半径大于Y 元素的阳离子半径;Z 和Y 两元素的原子核外电子层次相同,Z 元素的原子半径小于Y 元素的原子半径。
高中化学 第05天 元素周期律暑假作业 新人教版选修1(2021年整理)

高中化学第05天元素周期律暑假作业新人教版选修1编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学第05天元素周期律暑假作业新人教版选修1)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学第05天元素周期律暑假作业新人教版选修1的全部内容。
第05天元素周期律高考频度:★★★★☆难易程度:★★★☆☆下列有关碱金属单质的化学性质的说法中正确的是A.K与H2O反应最剧烈B.Rb比Na活泼,故Rb可以从Na盐溶液中置换出NaC.碱金属的阳离子没有还原性,所以有强氧化性D.从Li到Cs都易失去最外层1个电子,且失电子能力逐渐增强【参考答案】D1.元素周期律的实质元素原子核外电子排布的周期性变化。
2.元素周期表中主族元素性质的递变规律内容同周期(从左到右)同主族(从上到下)原子半径逐渐减小逐渐增大电子层结构电子层数相同,最外层电子数逐渐增多电子层数逐渐增多,最外层电子数相同得电子能力逐渐增强逐渐减弱失电子能力逐渐减弱逐渐增强金属性逐渐减弱逐渐增强非金属性逐渐增强逐渐减弱最高价氧化物对应水化物的酸碱性酸性逐渐增强,碱性逐渐减弱酸性逐渐减弱,碱性逐渐增强非金属元素气态氢化物的形成及稳定性气态氢化物的形成越来越容易,其稳定性逐渐增强气态氢化物的形成越来越困难,其稳定性逐渐减弱1.A、B、C、D四种元素在元素周期表中的位置如图所示。
则下列说法正确的是A.原子半径:A>B>C〉D B.最外层电子数:A>B>C〉DC.单质氧化性:C〉D D.非金属性:A>B〉C〉D2.X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。
高考化学元素周期律(大题培优)附答案

高考化学元素周期律(大题培优)附答案一、元素周期律练习题(含详细答案解析)1.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。
下列叙述不正确的是()A.最高正价由低到高的顺序:Z、W、X、YB.原子半径由大到小的顺序:Z、W、X、YC.Z、W分别与X形成的化合物:均既能与酸又能与碱反应D.简单气态氢化物的稳定性由强到弱的顺序:Y、X、W【答案】A【解析】【分析】X、Y、Z、W原子序数依次增大,Y是至今发现的非金属性最强的元素,Y是F元素;X原子最外层有6个电子,X是O元素;Z在周期表中处于周期序数等于族序数的位置,Z位于第三周期、ⅢA族,Z是Al元素;W的单质广泛用作半导体材料,W是Si元素。
【详解】A.主族元素最高正价等于族序数(O、F除外),F没有正价,故A错误;B.电子层数越多半径越大,电子层数相同,质子数越多半径越小,原子半径由大到小的顺序:Al>Si>O>F,故B正确;C.Al2O3是两性氢氧化物既能与酸又能与碱反应,SiO2是酸性氧化物,能与碱反应生成硅酸盐,SiO2也能与氢氟酸反应生成SiF4气体和水,故C正确;D.非金属性越强,气态氢化物越稳定,简单气态氢化物的稳定性由强到弱的顺序:HF>H2O> SiH4,故D正确;故选A。
【点睛】本题考查元素周期表和元素周期律,熟记元素及其化合物特殊的性质是解题关键,明确氟是至今非金属性最强的元素,无正价,SiO2是酸性氧化物,但能与氢氟酸反应。
2.已知A、B、C、D、E、F均为短周期主族元素,且它们的原子序数依次增大.B和E同主族,A、B在元素周期表中处于相邻的位置,C元素原子在同周期主族元素中原子半径最大,D是地壳中含量最多的金属元素,E元素原子的最外层电子数是电子层数的2倍.请回答下列问题:(1)画出F的原子结构示意图_____。
(完整版)元素周期律习题(附答案)

元素周期律练习1. 短周期元素A、B、C在周期表中的位置如右图所示。
已知B、C两元素所在族数之和是A元素族数的2倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C是( )A.Be、Na、AlB.B、Mg、SiC.O、P、ClD.C、Al、P2.如下图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等。
下列叙述中不正确的是( )A.三种元素的原子半径的大小顺序是W<Y<XB.W最高价氧化物对应水化物具有强酸性,气态氢化物的水溶液具有弱碱性C.X元素的氧化物、氢化物的水溶液都呈酸性D.Y元素的单质是非金属单质中唯一能跟水发生激烈反应的单质3.X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z分别是( )A.Mg、Al、Si B.Li、Be、Mg C.N、O、S D.P、S、O4.已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4。
则下列说法不正确的是( )A.气态氢化物的稳定性:HX>H2Y>ZH3B.非金属活泼性:Y<X<ZC.单质的氧化性:X2>Y>ZD.原子最外电子层上电子数相等5.下列各组微粒具有相同质子数和电子数的是( )A.CH4,NH3,H2O,Ar B.OH-,NH4+,H3O+,NeC.H3O+,NH4+,Na+,HF D.OH-,F-,Mg2+,Na+6.下列叙述中正确的是( )A.40K和40Ca原子中的质子数和中子数都不相等B.金刚石和石墨的性质相同C.H2和D2互为同位素D.某物质中只含一种元素,该物质一定是纯净物7.氧化性由弱到强,原子或离子半径由大到小的一组微粒是( )A .O ,Cl ,S ,PB .K +,Al 3+,Ca 2+,Ba 2+C .Rb ,K ,Na ,LiD .K +,Mg 2+,Al 3+,H +8.下列属于同位素的是()9.按C ,N ,O ,F 的顺序,下列递变规律正确的是[ C ]A .原子半径逐渐增大B .非金属性逐渐减弱C .气态氢化物的稳定性逐渐增强D .单质的氧化性逐渐减弱10.A 、B 、C 、D 、E 是同一周期的五种主族元素,A 和B 的最高价氧化物对应的水化物均呈 碱性,且碱性B >A ,C 和D 的气态氢化物的稳定性C >D ;E 是这五种元素中原子半径 最小的元素,则它们的原子序数由小到大的顺序是( )A . A 、B 、C 、D 、E B . E 、C 、D 、B 、AC . B 、A 、D 、C 、E D . C 、D 、A 、B 、E15表是周期表中的一部分,根据A ~I 在周期表中的位置,用元素符号或化学式回答下列问题:ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA0 1 A 2 D E G 3BCJFHI(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 , 可用于制半导体材料的元素是_______。
备战高考化学元素周期律综合题

备战高考化学元素周期律综合题一、元素周期律练习题(含详细答案解析)1.已知元素X 、Y 均为短周期元素,X 元素的一种核素常用于测文物的年代,Y 元素原子半径是所有原子中最小的,元素X 、Y 可形成两种常见化合物M 和N ,已知M 可以使高锰酸钾酸性溶液褪色,M 分子中所含X 元素的质量是Y 元素质量的6倍,且M 的相对分子质量为56。
N 是一种常用溶剂,它的实验式XY 。
回答下列问题:(1)符合条件的M 的有 ______种。
(2)任意写一种不带支链的M 的结构简式__________。
(3)若在N 与液溴的混合液中加入铁粉可以发生反应(在如图装置a 容器中反应),则:①写出a 容器中发生的所有反应的化学方程式:_____________。
②d 容器中NaOH 溶液的作用是_____________。
(4)在碘水中加入N 振荡静置后的现象是__________。
(5)等质量M 、N 完全燃烧时消耗O 2的物质的量较多的是________(填“M ”或“N ”)。
【答案】3 CH 2=CH -CH 2-CH 3 2Fe +3Br 2=2FeBr 3、+Br 23FeBr −−−→+HBr 吸收HBr 和Br 2,防止污染环境 溶液分层,下层无色,上层紫红色 M【解析】【分析】短周期元素X 元素的一种核素常用于测文物的年代,则X 为碳(C );Y 元素原子半径是所有原子中最小的,则Y 为氢(H )。
元素X 、Y 可形成两种常见化合物M 和N ,已知M 可以使高锰酸钾酸性溶液褪色,M 分子中所含X 元素的质量是Y 元素质量的6倍,且M 的相对分子质量为56,则M 为分子式C 4H 8的烯烃;N 是一种常用溶剂,它的实验式XY ,则N 为苯(C 6H 6)。
【详解】由以上分析可知,M 是分子式为C 4H 8的烯烃,N 是分子式为C 6H 6的苯。
(1)符合条件的M 有CH 2=CHCH 2CH 3、CH 3CH =CHCH 3、(CH 3)2C =CH 2,共3种。
元素周期律 作业

作业2 元素周期律姓名:1.短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是()A.钠与W可能形成Na2W2化合物B.由Z与Y组成的物质在熔融时能导电C.W得电子能力比Q强D.X有多种同素异形体,而Y不存在同素异形体2.四种短周期元素在周期表中的位置如图,其中只有M为金属元素。
下列说法不正确的是()A.原子半径Z<MB.Y的最高价氧化物对应水化物的酸性比X的弱C.X的最简单气态氢化物的热稳定性比Z的小D.Z位于元素周期表中第二周期、第ⅥA族3.元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸,则下列判断正确的是()A.非金属性:Z<T<XB.R与Q的电子数相差26C.气态氢化物稳定性:R<T<QD.最高价氧化物的水化物的酸性:T<Q4.下列各组中的性质比较,不正确的是()A.稳定性:NH3<PH3<SiH4B.酸性:HClO4>H2SO4>H3PO4C.碱性:KOH>NaOH>Mg(OH)2D.还原性:F-<Cl-<Br-5.如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是()。
A.原子半径:Z>Y>XB.气态氢化物的稳定性:R<WC.WX3和水反应形成的化合物是离子化合物D.Y和Z两者最高价氧化物对应的水化物能相互反应6.X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。
若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是()。
A.X的最常见气态氢化物的水溶液显酸性B.最高价氧化物对应水化物的酸性W比Z强C.Z的单质与氢气反应比Y单质与氢气反应剧烈D.X的原子半径小于Y7.某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个弧线上的“·”代表一种元素,其中O点代表氢元素。
化学元素周期律的专项培优练习题附详细答案

化学元素周期律的专项培优练习题附详细答案一、元素周期律练习题(含详细答案解析)1.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答问题:族ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期1①2②③④3⑤⑥⑦⑧⑨(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号....回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式...回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式...回答)。
(5)②和③按原子数1:2形成的化合物的电子式...为____________,该晶体气化的过程中克服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
【答案】第3周期IVA族 F NaOH H-F 分子间作用力共价化合物原子 Al(OH)3+NaOH=NaAlO2+2H2O【解析】【分析】根据元素①~⑨在表中的位置可知分别是H、C、O、F、Na、Mg、Al、Si、Cl。
据此解答。
【详解】(1)半导体材料应在金属与非金属交界处寻找,根据上述元素周期表的部分结构,半导体材料是晶体硅,位于第三周期第IVA族;(2)同周期从左向右原子半径减小,同主族从上到下原子半径增大,因此原子半径大小顺序是Mg>O>F,即原子半径最小的是F;(3)同周期从左向右金属性减弱,金属性越强,其最高价氧化物的水化物的碱性越强,即NaOH>Mg(OH)2>Al(OH)3,碱性最强的是NaOH;(4)同周期从左向右非金属性增强,其氢化物的稳定性增强,因此氢化物的稳定性:HF>H2O>CH4,最稳定的氢化物是HF,其结构式为H-F;(5)②和③按原子数1:2形成的化合物是CO2,其电子式为:,CO2属于分子晶体,熔化时克服分子间作用力;(6)③和⑧构成的化合物是SiO2,属于共价化合物,其晶体为原子晶体;(7)⑤是钠元素,其最高价氧化物的水化物是NaOH,⑦是Al,其最高价氧化物的水化物是Al(OH)3,Al(OH)3表现两性,与碱反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、下列关于元素周期律的叙述正确的()
A. 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现
B. 随着元素原子序数的递增,同周期从左到右原子半径从小到大(稀有气体除外)发生周期性变化
C. 随着元素原子序数的递增,元素最高正价从+1到+7、负价从−7到−1重复出现
D. 元素原子核外电子排布的周期性变化是导致原子半径、元素主要化合价和元素性质周期性变化的主要原因
2、下列各组元素性质递变情况错误的()
A.N、O、F最高正价依次升高
B.Li、Be、B原子最外层电子数逐渐增多
C.P、S、Cl原子半径依次减小
D.Li、Na、K的半径依次增大
3、下列有关结构和性质的说法中正确的()
A. 主族金属元素化合价均不会超过+4
B. 同周期的元素按照原子序数递增,原子半径逐渐减小
C. 元素原子的最外层电子数越多,越容易得电子,非金属性越强
D. 核外电子排布的相同的简单离子,核电荷数越多,离子半径越小
4、对于元素周期表中第3周期的元素来说,按原子序数递增的顺序(稀有气体除外),以下说法正确的()
A.原子半径和离子半径均减小
B.元素金属性减弱,非金属性增强
C.氧化物对应的水化物碱性减弱,酸性增强
D.单质的熔点降低
5、已知33As、35Br位于同一周期。
下列关系正确的()
A. 原子半径:As>Cl>P
B. 热稳定性:HCl>AsH3>HBr
C. 还原性:As3−>S2−>Cl−
D. 酸性H2AsO4>H2SO4>H3PO4
6、下列事实不能用元素周期律解释的只有()
A. 碱性:KOH>NaOH
B. 酸性:HClO4>H2SO4
C. 相对原子质量:Ar>K
D. 元素的金属性:Mg>Al
7、下列关于元素周期表和元素周期律的说法错误的()
A. 因为Na比K易失电子,所以Na比K还原性强
B. 第二周期元素从Li到F,非金属性逐渐增强
C. IA族元素Li、Na、K原子核外电子层数随核电荷数增加而增多
D. VIA族元素O、S、Se位置从上至下,故H2O、H2S、H2Se稳性依次减弱
8、X、Y、Z为原子核外电子层数相同的三种元素,已知最高价氧化物对应水化物的酸性是:HXO4>H2XO4>H3XO4,则下列判断错误的()
A. 原子半径:X<Y<Z
B. 气态氢化物稳定性:HX>H2Y>ZH3
C. 非金属性:Z>Y>X
D. 阴离子还原性:X—<Y2—<Z3—
9、根据元素周期表和周期律相关知识判断,下列说法正确的()
A. 硒元素非金属性比硫强
B.Cl—、K+、Ca2+的离子半径最大的是Ca2+
C.Sr(OH)2碱性比Ca(OH)2弱
D.Be与Al化学性质相似,BeO是两性氧化物
A.元素④比④形成的氢化物稳定
B. 元素④比④的非金属强,所以氢化物的沸点高
C. 元素④④形成的化合物是共价化合物
D. 元素④的最高价氧化物对应水化物的碱性最强
11、元素的性质随着原子序数的递增呈现周期性变化的根本原因()
A. 元素相对原子质量的递增而引起的变化
B. 元素化合价呈周期性的变化
C. 元素原子核外电子排布呈周期性的变化
D. 元素金属性和非金属性呈周期性变化
12、下列递变规律正确的()
A.HClO4、H2SO4、H3PO4酸性依次增强
B. 钠、镁、铝还原性依次减弱
C.HCl、HBr、HI稳定性依次增强
D. 由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI
13、下列关于物质性质的比较,不正确的()
A. 稳定性:SiH4>P H3>NH3
B. 原子半径大小:Na>S>O
C. 碱性强弱:KOH>NaOH>LiOH
D. 金属性强弱:Na>Mg>Al
14、已知X2+、Y+、Z—、W2—四种离子均具有相同的电子层结构。
下列关于X、Y、Z、W四种元素的描述,不正确的()
A. 原子半径:X>Y>W>Z
B. 原子序数:Y>X>Z>W
C. 原子最外层电子数:Y>X>Z>W
D. 金属性:X>Y,还原性:W2—>Z—
15、下列叙述及推理正确的()
④金属性Sn>Ge,故碱性Sn(OH)4>Ge(OH)4;④非金属性O>N,故O2比N2更容易与H2化合;④非金属性S>As,故后者气态氢化物稳定性更强;
④非金属性F>Cl,故将F2通入NaCl溶液中发生反应为F2+2Cl—=2F—+Cl2
A.④④
B.④④
C.④④
D.④④
16、四种主族元素离子aX m+、bY n+、cZ n−和dR m−(a、b、c、d为元素原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述判断正确的()
④a−b=m−n;④元素的原子序数a>b>c>d;④元素非金属性Z>R;④最高价氧化物对应水化物的碱性X>Y
A. ④④④
B. ④④
C. ④
D. ④④④④
17、X、Y、Z、W为四种短周期主族元素,且原子序数依次增大。
已知X原子的最外层电子数是其电子层数的2倍,Y是地壳中含量最高的元素,Y原子的
最层电子数是W原子最外层电子数的2倍,Z原子的最外层上只有一个电子。
下列说法正确的()
A. 原子半径:r(Z)>r(W)>r(X)>r(Y)
B.Y与Z两种元素只能形成一种化合物
C. 最高价氧化物对应水化物的碱性:Z<W
D.X的简单气态氢化物的热稳定性比Y的强
A.L2+与R2—核外电子数相等
B. M与T形成的化合物既能与强酸反应又能与强碱反应
C. 氢化物稳定性H2T<H2R
D. 单质与浓度相等的稀盐酸反应的速率为Q>L
19、Na+、Mg2+、F−、O2−四种离子具有相同的电子层结构。
则四种元素原子半径由大到小的顺序分别()
A.Mg>Na>F>O
B.O>F>Na>Mg
C.Na>Mg>O>F
D.O>F>Na>Mg
20、下列微粒半径大小比较正确的() A. Na<Mg<Al<S B. I<Br<Cl<F C. Na+<Mg2+<Al3+<O2− D. S2−>Cl−>Na+>Al3+
21、有关短周期元素原子的说法正确的()
A. 当原子形成简单离子后,其最外层上电子数可超过8个
B. 原子最外层上电子数少于4个时,电子数越多,还原性越强
C. 原子核外电子中,最外层上电子能量最高
D. 当最外层上电子数变为4个时即达稳定结构
22、下列说法中正确的()
A.次外层电子数是2或8或18的原子一定是主族元素B.短周期元素中最外层电子数等于电子层数的元素有2种
C.L层上的电子数为奇数的原子一定是主族元素的原子D.核外电子排布相同的微粒,一定具有相同的化性。
