第3章紫外光谱
仪器分析课件 第3章 紫外分光光度法
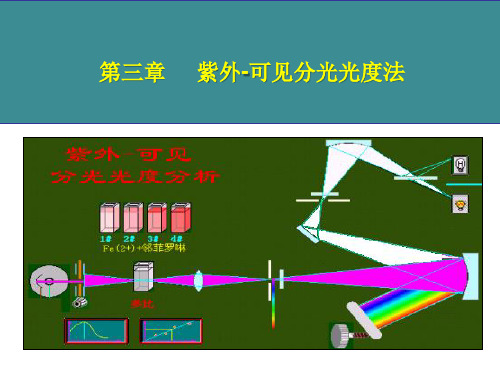
检流计、数字显示、微机进行仪器自动控制
和结果处理
记录装置
二、分光光度计的类型
(一)单光束分光光度计
光源 单色器
参比 样品
检测器
显示器
• 只有一条光路,通过变换参比池和样品池的位 置,使它们分别置于光路来进行测定
国产751型、752型、721型、722型、UV-1100 型、英国SP-500型
E2a ca E2b
(3) 图计算法----两组分吸收光谱完全重叠--混合样品测定 (3)图中,a,b 吸收光谱双向重迭,互相干扰,在最大波长处互相
吸收。处理方法如下:
解线性方程组 过程:
(三)示差分光光度法(示差法)
普通分光光度法一般只适于测定微量组分,当待测组分含量 较高时,将产生较大的误差。需采用示差法。
第三节 紫外-可见分光光度计
依据朗伯-比尔定律,测定待测液吸光度A的仪器。(选择不同波
长单色光λ、浓度) 分光光度计外观 分光光度原理图:
0.575
光源
单色器
吸收池
检测器 信号处理及显示
信号处理 显示器
单色器
分光光度计外观
吸收池 检测器
光源
721型可见分光光度计
一、主要部件
1. 光源 在整个紫外光区或可见光谱区可以发射连续光
浓度C及液层厚度L的乘积成正比。
注意! 适用范围
①入射光为单色光,适用于可见、红外、紫外光。 ②均匀、无散射溶液、固体、气体。 ③吸光度A具有加和性。Aa+b+c= Aa &光系数
A=k c L
k = A /c L
1、摩尔吸光系数或Em: 在一定λ下,c=1mol/L,L=1cm时的吸光度。单位:L/(mol.cm)
第三章 紫外-可见吸收光谱分析

2.不饱和脂肪烃 .
在不饱和烃类分子中,除含有σ键外,还含有π 键,它们可以产生 σ→σ*和π→π* 两种跃迁。 如果存在共轭体系,则随共轭系统的延长, 吸收带将明显向长波方 向移动,吸收强度也随之增强 在共轭体系中, π→π*跃迁产生的吸收带又称为K(Konjugation) 带。其特点是:强度大,εmax›104;位置一般在217~280nm λmax和εmax的大小与共轭链的长短及取代基的位置有关 根据K带是否出现,可判断分子中共轭体系的存在的情况。在紫外光 根据 带是否出现,可判断分子中共轭体系的存在的情况 带是否出现 谱分析中有重要应用。
紫外- §3-3 紫外-可见分光光度法的应用 一、 定性分析 二、纯度检查 三、结构推测 四、定量分析 单组分样品的定量分析 多组分样品的定量分析
一、 定性分析
1、依据:吸收光谱的特征——形状、波长、峰数目、强度、 吸光系数。 、依据:吸收光谱的特征 形状、 形状 波长、峰数目、强度、 吸光系数。 2、方法:对比法 、方法: (1) 对比吸收光谱特征数据 (2) 对比吸光度或吸光系数的比值
3.芳香烃 .
苯有三个吸收带 E1带180∼184nm ε=47000 E 2带200∼204 nm ε=7000 苯环上三个共扼双键的 π → π*跃迁特征吸收带 B带 230-270 nm
ε=200
π → π*与苯环振动引起; 含取代基时, B带简化,红移 当苯环上有取代基时,苯的三个特征谱带都会发生显著的变化, 其中影响较大的是E2带和B谱带。
化合物 H2O CH3OH CH3CL CH3I CH3NH2
λmax(nm) 167 184 173 258 215
εmax 1480 150 200 365 600
第三章紫外可见分光光度法

23
3.双波长
将不同波长的两束单色光(λ 1、λ 2) 快束交替通 过同一吸收池而后到达检测器。产生交替信号。无需 参比池。△=1~2nm。两波长同时扫描即可获得导数 光谱。
max也作为定性的依据。不同物质
的λmax有时可能相同,但ε
定量分析的依据。
max不一定相同。
(6)吸收谱带强度与该物质分子吸收的光子数成正比,
10
3.紫外-可见吸收光谱的产生
由于分子吸收紫外-可见光区的电磁辐射,分 子中价电子(或外层电子)的能级跃迁而产生紫 外-可见吸收光谱。 电子能级间跃迁的同时总伴随有振动和转动
紫外分光光度计检测;可作为溶剂使用。
39
2、n→ζ*跃迁
所需能量较大。 吸收波长为150~250 nm,大部分在远紫外区 ,近紫外区仍不易观察到。
含非键电子的饱和烃衍生物(含N、O、S和卤
素等杂原子)均呈现n →ζ*跃迁。 如一氯甲烷、甲醇、三甲基胺n →ζ*跃迁的λ分 别为173 nm、183 nm和227 nm。
38
1、σ →σ *跃迁
所需能量最大,ζ电子只有吸收远紫外光的能量 才能发生跃迁。
饱和烷烃的分子吸收光谱出现在远紫外区。
吸收波长λ< 200 nm。 例:甲烷λmax为125 nm , 乙烷λmax为135 nm, 环丙烷(饱和烃中最长) λmax为190 nm。 在近紫外没有饱和碳氢化合物的光谱,需真空
8
2.能级跃迁的讨论
(1)转动能级间的能量差Δ Er:0.005~0.050 eV, 跃迁产生吸收光谱位于远红外区,称为远红外 光谱或分子转动光谱; (2)振动能级的能量差Δ Ev约为:0.05~1eV,跃
第3章-紫外-可见分光光度法

第3章 紫外-可见分光光度法一、内容提要1、电子跃迁类型 σ→σ*跃迁、π→π*跃迁、n →π*跃迁、n →σ*跃迁、电荷迁移跃迁、配位场跃迁。
2、常用术语1)最大吸收波长:曲线上的峰(吸收峰)所对应的波长,以m ax λ表示。
2)最小吸收波长:曲线上的谷(吸收谷)所对应的波长,以m in λ表示。
3)肩峰:在吸收峰旁边存在一个曲折,对应的波长以sh λ表示。
4)末端吸收:在200nm 附近,吸收曲线呈现强吸收却不成峰形的部分。
5)生色团:分子中可以吸收光子而产生电子跃迁的原子基团。
有机化合物的生色团主要是含有π→π*或n →π*跃迁的基团(>C =C <、>C =O 、>C =S 、—N =N —、—N =O 等)。
6)助色团:含有非键电子的杂原子饱和基团(如—OH 、—SH 、—OR 、—SR 、—NH 2、—Cl 、—Br 、—I 等),它们本身不能吸收波长大于200nm 的光,但当它们与生色团相连时,能使该生色团的吸收峰向长波长方向移动,并使吸收强度增强。
7)红移和蓝移:化合物常因结构的变化(发生共轭作用、引入助色团等)或溶剂的改变而导致吸收峰的最大吸收波长m ax λ发生移动。
m ax λ向长波长方向移动称为红移;m ax λ向短波长方向移动称为蓝移。
8)增色效应和减色效应:因化合物的结构改变或其他原因而导致吸收强度增强的现象称为增色效应,有时也称为浓色效应;反之,导致吸收强度减弱的现象称为减色效应,有时也称为淡色效应。
9)吸收带:不同类型的电子跃迁在紫外-可见光谱中呈现的不同特征的吸收峰。
10)强带和弱带:摩尔吸收系数大于104的吸收带为强带;摩尔吸收系数小于102的吸收带为弱带。
3、吸收带1)R 带:跃迁类型为n →π*,波长范围为250~500nm ,吸收强度ε<102。
溶剂极性增大时蓝移。
R 带是杂原子的不饱和基团(>C =O 、-NO 、-NO 2、-N =N -等)的特征。
有机波谱分析--紫外-可见光谱法

②呈一宽峰,且有精细结构。 ③当苯环被烷基以外的基团取代或溶剂极性增大时,精细
结构将会减弱甚至消失。
(4)E 带:芳香族化合物的特征谱带。
Ethylene
●E1带:苯环中“乙烯键”的π→π*跃迁产生的吸收带。 λmax=180~200nm,远紫外区; εmax=5×104L·mol-1·cm-1,强吸收。(不常用)
3.互变异构
4.氢键效应 1)溶质分子间氢键
使n→*共轭受限,轨道能差增大,波长蓝移。
2)分子内氢键:能差减小,波长红移。
例如:邻硝基苯酚和间硝基苯酚
分子内氢键
max=278nm =6.6103
无分子内氢键
max=273nm =6.6103
邻硝基苯酚, 由于分子内氢键的形成,红移了5nm。
3)溶质与溶剂间形成的氢键(属于溶剂效应)
波谱范围:10~800nm
(1)远紫外光区10~200nm (2)近紫外光区200~400nm (3)可见区400~800nm.
一般的紫外光谱是指近紫外区。
1、紫外光谱产生的条件
2、有机分子的化学键类型
★构成分子的化学键主要有 键、 键,还 有未成键孤
对电子构成的非键(n 键)。
★ 5种轨道分别是:
54
2)单环共轭烯烃(乙醇溶剂) ◆母体值: ①共轭二烯不在同一环内
217nm
②共轭二烯在同一环内
◆扩展共轭: ◆取代基增加值: 烷基 卤素 ◆环外双键
253nm
+30nm
+5nm +17nm +5nm
55
●注意: (1)母体值只是指共轭二烯母体本身的λ值,不包括C=C-C=C
仪器分析 第三章 紫外可见吸收光谱法

第三章紫外可见吸收光谱法1.定义2.紫外吸收光谱的产生3.物质对光的选择性吸收4.电子跃迁与分子吸收光谱第一节概述11. 定义根据溶液中物质的分子或离子对紫外、可见光谱区辐射能的吸收来研究物质的组成和结构的方法,包括比色分析法与分光光度法。
◆比色分析法:比较有色溶液颜色深浅来确定物质含量的方法。
◆分光光度法:使用分光光度计进行吸收光谱分析测量的方法。
2/紫外-可见波长范围:(真空紫外区)◆远紫外光区:10-200 nm;◆近紫外光区:200-400 nm;◆可见光区:400-780 nm。
◆O2、N2、CO2、H2O等可吸收远紫外区(60-200 nm)电磁辐射。
◆测定远紫外区光谱时,须将光学系统抽真空,并充入惰性气体。
◆准确:近紫外-可见分光光度法(200-780 nm)。
3/方法特点:◆仪器较简单,价格较便宜;◆分析操作简单;◆分析速度较快。
4/紫外可见吸收光谱:分子中价电子能级跃迁(伴随着振动能级和转动能级跃迁)。
2. 紫外可见吸收光谱的产生价电子的定义?AB 电磁辐射5/◆分子内部三种运动形式:电子相对于原子核的运动;原子核在其平衡位置附近的相对振动;分子本身绕其重心的转动。
◆分子具有三种不同能级:电子能级、振动能级和转动能级(量子化,具有确定能量值)。
◆分子内能:包括电子能量E e、振动能量E v、转动能量Er 。
2.1 电子跃迁与分子吸收光谱6/分子的各能级:◆转动能级能量差:0.005~0.05 eV,跃迁产生吸收光谱位于远红外区(远红外光谱或分子转动光谱)。
◆振动能级能量差:0.05~1 eV,跃迁产生吸收光谱位于红外区(红外光谱或分子振动光谱)。
◆电子能级能量差:1~20 eV。
电子跃迁产生的吸收光谱在紫外-可见光区(紫外-可见光谱或分子的电子光谱)。
7/8/◆电子能级间跃迁的同时,总伴随有振动和转动能级间的跃迁。
◆电子光谱中总包含有振动/转动能级间跃迁产生的若干谱线而呈现宽谱带(带状光谱)。
第三章 紫外-可见吸收光谱法

3-1 概述
3-1 概述
紫外光
波长为10-400nm的电磁辐射,分为远紫外光 的电磁辐射, 波长为 的电磁辐射 (10-200nm)和近紫外光(200-400nm)。 )和近紫外光( )。 远紫外光可被大气中的水气、 远紫外光可被大气中的水气、氮、氧和二氧化 碳所吸收,只能在真空中研究, 碳所吸收,只能在真空中研究,故又称真空紫 外光。我们讨论近紫外光谱。 外光。我们讨论近紫外光谱。
紫外-可见吸收光谱法 第三章 紫外 可见吸收光谱法
UltravioletUltraviolet-Visible Absorption Spectrometry UV-Vis UV-
章节内容
第一节 概述 紫外-可见吸收光谱 第二节 紫外 可见吸收光谱 第三节 紫外-可见分光光度计 紫外 可见分光光度计 紫外-可见吸收光谱法的应用 第四节 紫外 可见吸收光谱法的应用
(5)出射狭缝 紫外-可见分光光度计使用石英棱镜。 棱镜单色器的缺点在于色散率随波长变 化,得到的光谱呈非均匀排列,而且传递 光的效率较低。 光栅单色器在整个光学光谱区具有良好 的几乎相同的色散能力。因此现代紫外-可 见分光光度计 多采用光栅单色器。 (三)吸收池 (四)检测器 (五)信号显示器
二、分光光度计的构造类型
的配位体强度小于NH 如:H2O的配位体强度小于 3的, 的配位体强度小于 所以, ( 所以,Cu(H2O)6呈浅蓝色,吸收峰 ) 呈浅蓝色, 794nm;Cu(NH3)6深蓝色,吸收峰 深蓝色, ; ( 663nm。 。 一些常见配位体配位场强弱顺序: 一些常见配位体配位场强弱顺序: I-<Br-<Cl-<F-<OH-<C2O4-=H2O<SCN-< 吡啶=NH3<乙二胺 联吡啶 邻二氮菲 乙二胺<联吡啶 吡啶 乙二胺 联吡啶<邻二氮菲 <NO2-<CN-
紫外~可见光谱分析

出射狭缝:使分析所需波长的单色光通过。
准光镜 光源
棱镜
成像物镜
入射狭缝
出射狭缝
光
电
管
棱镜单色器的结构原理示意
狭缝大小的影响
紫外-可见分光光度计
单色器中入射狭缝越窄,则光谱带上任 意一点的波长成分越纯,光谱的质量就越高; 出射狭缝越小,则产生单色光的带宽小、单色 性好、但能量小,影响仪器的信噪比。
第三章
第三章 紫外—可见吸收光谱分析(分子)
第一节 概述:
第二节 紫外-可见吸收光谱 与分子结构的关系
第三节 紫外-可见分光光度计的 基本组成与结
构
第四节 紫外-可见分光光度计的 性能
第五节 紫外-可见吸收光谱法的
第一节 概 述:
紫外~可见吸收光谱分析,简称UV-V IS。
利用分光光度计测量物质对紫外~可 见光的吸光度和通过物质的紫外~可见吸收光 谱来确定物质的组成、含量,推断物质结构的 分析方法,称紫外~可见吸收光谱分析,又称 为紫外~可见分光光度法。
(1)单色器的组成:
紫外-可见分光光度计
入射狭缝:只许光源分一束光进入。
准光镜:将光源产生的光转变为平行光束, 使其照射在色散元件上的入射角均相等。
色散元件:为棱镜或光栅,将复合光色散成 按一定波长顺序排列的单色光。
成像物镜:将色散原件产生的单色平行光, 在其焦平面的不同位置聚焦,成为出射狭缝对应波长 的单色光。
紫外可见吸收光谱法

2021/4/9
16
常见生色团的吸收光谱
生色团
烯
C6H13CH=CH2
炔
C5H11C≡C-CH3
羧基 CH3COOH 酰胺基 CH3CONH2 羰基 CH3COCH3
偶氮基 CH3N=NCH3 硝基 CH3NO2 亚硝基 C4H9NO 硝酸酯 C2H5ONO2
溶剂 正庚烷 正庚烷 乙醇 水 正己烷
σ→σ*、π→π*、
n→σ*、n→ π*
跃迁能量:
* n * * n *
<20
11
2、跃迁类型
1) * 跃迁
分子成键轨道中的一个电子通过吸收辐射而被激 发到相应的反键轨道。
化合物种类:饱和烃 特点:需要的能量较高 位置:远紫外光区 <200nm
乙醇 异辛酯 乙醚 二氧杂环己烷
/nm 177 178 204 214 186 280 339,665 280 300,665 270
max 13000 10000 41 60 1000 16 150000 22 100 12
跃迁类型
* * n* n*
n* n*
n* n* n* n*
2021/4/9
例:1,3-丁二烯(己烷)
217nm, 21,000
2021/4/9
14
4)n* 跃迁 孤对电子向反键轨道跃迁 化合物种类:含有杂原子的不饱和基团 特点:谱带强度弱,ε<100 位置:近紫外光区
2021/4/9
【例】:
λmax
carbanyls
186
Carboxylic acids 204
2021/4/9
4
末
最大吸收峰
端
吸
收 肩峰
分析化学(仪器分析)第三章-仪器分析(UV)

1
第一节
概述
一、紫外-可见吸收光谱法
根据溶液中物质的分子或离子对紫外和可见光谱
区辐射能的吸收来研究物质的组成和结构的方法。
包括比色分析法和紫外-可见分光光度法。 紫外-可见吸收光谱的产生:分子价电子能级跃迁。 波长范围:10-800 nm.
(1) 远紫外光区: 10-200nm
(2) 近紫外光区: 200-400nm (3) 可见光区:400-800nm
结束结束结束25一基本部件二分光光度计的构造原理26紫外可见分光光27光源单色器样品室检测器显示光源在整个紫外光区或可见光谱区可以发射连续光谱具有足够的辐射强度较好的稳定性较长的使用寿命
第三章 紫外-可见吸收光谱法
第一节 概述
第二节 紫外-可见吸收光谱
第三节 紫外-可见分光光度计
第四节 紫外-可见吸收光谱法的应用
金属离子的影响,将引起配位体 吸收波长和强度的变化。变化与成键 性质有关,若共价键和配位键结合, 则变化非常明显。
23
3.电荷转移吸收光谱
电荷转移跃迁:辐射下,分子中原定域在金属
M轨道上的电荷转移到配位体L的轨道,或按相反
方向转移,所产生的吸收光谱称为荷移光谱。
Mn+—Lbh M(n-1) +—L(b-1) h [Fe2+SCN]2+ [Fe3+SCN-]2+ 电子接受体
34
2. 定量分析
依据:朗伯-比耳定律—分子吸收光谱定量分析 的基本定律,它指出:当一束单色光穿过透明介质 时,光强度的降低同入射光的强度、吸收介质的厚 度以及光路中吸光微粒的数目成正比。
吸光度: A= e b c 透光度:-lgT = e b c
35
第三章紫外光谱2016答辩

6、电荷转移吸收谱带
在配合物的中心离子和配位体中,当一个电子由配位体的某一轨道跃迁 到与中心离子相关的轨道上或中心离子的某一轨道跃迁到配位体某一轨 道,可产生电荷转移吸收光谱。
Mn+—Lb-
h h
M(n-1) +—L(b-1) [Fe2+CNS]2+
[Fe3+CNS-]2+
电子接受体
特征
2、n*跃迁
电子光谱在远紫外区,10-200nm。
含杂原子(O、N、S、P、卤素)的饱和有机化合物 非成键电子被激发到 *轨道所产生的跃迁。 它需要的能量低于*跃迁,在150-250 nm左右,其吸收 光谱大部分落入远紫外光区,一部分在近紫外光区。
2019/1/5
特征 要求
吸收波长为150-250 nm光子;其吸收峰的吸 收系数ε较低 含有未共用电子对杂原子(O、N、S)和 卤素等杂原子的饱和烃衍生物可发生此类 跃迁。
2019/1/5
苯和甲苯在环己烷 溶液中的B吸收带 精细结构在230270nm。
2019/1/5
苯酚在非极性溶 剂庚烷中的B吸收 带呈现精细结构, 而在极性溶剂中 乙醇中则观察不 到精细结构。
2019/1/5
4、E吸收带(取自德文:ethylenic band,乙烯 型谱带)。
苯环内三个乙烯基共轭发生的π-π*跃迁所发生 。 E带可分为E1和E2二个吸收带。二者可以分别看成是 苯环中的乙烯键和共轭乙烯键所引起的。E1带的吸收 峰大约在180nm(ε>104);E2带约在200nm(ε<7000),
要求
2019/1/5
电子跃迁类型不同,实际跃迁需要的能量不同, σ→σ* ~150nm n→σ* ~200nm π→π* ~200nm n→π* ~300nm 吸收能量的次序为: σ→σ*>n→σ*≥π→π*>n→π*
第三章紫外光谱和质谱

③ π-π*跃迁
是π电子从π成键向反键π*轨道的跃迁,含有π电子基团的不饱和有 机化合物,都会发生π-π*跃迁,如有 、 等的有机化合
物。π-π*跃迁所需的能量比σ-σ*跃迁小,也一般比n-σ*跃迁小,吸收 峰一般在200nm附近。
π-π*还具有以下特点:
吸收波长一般受组成不饱和键的原子影响不大,如 及 的λmax 都是 175 nm;摩尔吸光系数都比较大,通常在104以上,为强吸收带;
特点:光谱原理简单,识谱容易,信息量较少, 应用仍较广泛。
一、基本原理
1.紫外光谱的产生 E = E0 + E平动 + E转动 + E振动 + E电子 图中A、B表示不同能量的两个电 子能级,在每个电子能级中还分 布着若干振动能量不同的振动能 级,它们的振动量子数V=0、1、 2、3…表示,而在同一电子能级 和同一电子能级和同一振动能级 中,还分布着若干能量不同的转 动能量,它们的转动能级数J=0、 1、2、3……表示。 在分子能级跃迁所产生的能级变化ΔE中,电子能级跃 迁的能量变化ΔEe是最大的,一般在1~20eV之间, 它对应的电磁辐射能量主要在紫外-可见光区。
3.某些常见化合物的吸收光谱 ① 饱和烃及其取代衍生物 饱和烃中只有σ键,即只有σ电子,因此只能产生σ-σ*跃 迁,饱和烃的取代衍生物引入具有未成键n电子的杂原子, 可以产生n -σ*跃迁,吸收波长变大 。 如CH4的吸收波长为125 nm,而CH3Cl、CH3Br和CH3I的 吸收波长分别为173、204 和258 nm。 饱和烃是测定紫外-可见光谱时的良好溶剂。 ② 不饱和烃及共轭烯烃 可以产生σ-σ*跃迁和π-π*跃迁,一般在近紫外光区,为强吸收带在 分析上较有实用价值。 不饱和烃中,如果存在着共轭体系,共轭使电子离域大,-*能 量降低,跃迁几率增加,吸收波长变长,吸收变大。共轭程度越大, 则λmax越大,εmax也越大。 如:乙烯(193 nm),1,3-丁二烯(217 nm),己三烯(258 nm),辛四 烯(300 nm) 在共轭体系下,π-π*跃迁所产生的吸收带,又称为K带。
仪器分析第三章(含练习题)

C
C
p
极性
非极性
n → p*跃迁:兰移; ;
p → p*跃迁:红移;
N-亚硝基二甲胺在不同溶剂中的紫外吸收光谱图
由于溶剂对电子光谱图影响很大,因此,在吸收 光谱图上或数据表中必须注明所用的溶剂。在进行紫 外光谱法分析时,必须正确选择溶剂。选择溶剂时注 意下列几点:
3.2 光吸收的基本定律
如:异丙叉丙酮
吸收带
max(正己烷)
max(氯仿)
max(甲醇)
max(水)
p→p *p n→
*
230nm
329nm
238nm
315nm
237nm
309nm
243nm
305nm
溶剂极性增加,n→π *跃迁吸收带蓝移是因为:
C
O ‥ n轨道
· C
· O
p * 轨道
从上面C=O(羰基)键的电子云分布可以知道,相 对于激发态π*轨道来说,基态时氧原子上的n电子处于定 域状态,更为集中,使得羰基的极性较为明显,因此,在 n→π*跃迁中,基态的极性比激发态更强一些。
3.1.4 常用术语
吸收峰、谷、肩峰、末端吸收
3.1.4 常用术语
☺吸收曲线
同一种物质对不同波长光 的吸光度不同。吸光度最大 处对应的波长称为最大吸收 波长(λmax)
λmax
不同浓度的同一种物质, 其吸收曲线形状相似, λmax不变。而对于不同物 质,它们的吸收曲线形状 和λmax则不相同。 ——定性分析依据
第3章 紫外-可见分光光度法法
Ultraviolet and visible Spectrometry (UV-Vis)
• 紫外-可见吸收光谱
• 朗伯-比尔定律
第三章 紫外可见吸收光谱法

3.金属离子影响下配体的 p → p* 跃迁 显色剂大多含有生色团和助色团,与金属离子 配位时,其共轭结构发生变化导致吸收光谱发生红 移或蓝移。 例:茜素磺酸钠 弱酸性-黄色- λmax=420nm 弱碱性-紫红色- λmax=560nm
pH为4~5时与Al3+配位后,为红色,λmax=475nm,相对于 酸性茜素磺酸钠吸收峰红移,相对于碱性茜素磺酸钠吸收峰 蓝移。
480-490
490-500 500-560 560-580 580-610 610-650 650-780
绿蓝
蓝绿 绿 黄绿 黄
橙
红 红紫 紫 蓝
橙
红
绿蓝
蓝绿
3.特点:
(1) 灵敏度较高,可达10-4~10-7g/mL; (2) 准确度较高,一般为1% ~5%; (3) 仪器价格较低,操作简便、快速; (4)应用范围广。既能进行定量分析,又可进行 定性分析和结构分析;既可用于无机物化合 物分析,也可用于有机物化合物分析;还可 用于络合物组成、酸碱解离常数的测定等。
标准谱图库:46000种化合物紫外光谱的标准谱图 有一定局限性,需与红外、核磁、质谱等法相结合 进行准确鉴定。
(二)结构分析
紫外—可见吸收光谱中有机物发色体系信息分析的一般规律: (1)若在220~280nm内无吸收峰,可推断化合物不含苯环、共轭 双键、醛基、酮基、溴和碘(饱和脂肪族溴化物在200-210nm有 吸收)。
必须在配体的配位场作用下才可能产生;
一般的规律:轨道分裂能随场强增加而增加,吸 收峰波长则发生紫移。 例如:水合铜离子(Ⅱ)是浅蓝色的λmax=794nm ,而 它的氨络合物却是深蓝色的λmax=663nm 。
摩尔吸收系数ε很小,对定量分析意义不大。但可 用于络合物的结构及无机络合物的键合理论研究。
紫外-可见吸收光谱.

3.有机化合物的吸收光谱与分子结构
(2)不饱和烃及共轭烯烃
在不饱和烃类分子中,除含有键外,还含有 键,它们可以产生*和*两种跃迁。 *跃迁的能量小于 *跃迁。例如,在 乙烯分子中, *跃迁最大吸收波长为180nm。
第一节 紫外-可见吸收光谱 一、分子吸收光谱的产生
过程:
运动的分子外层电子---吸收外来辐射--产生电子能级跃迁----分子吸收光谱。
M h I0 M * It
一、分子吸收光谱的产生
在分子中,除了电子 相对于原子核的运动 外,还有核间相对位 移引起的振动和转动。 这三种运动能量都是 量子化的,并对应有 一定能级。左图为分 子的能级示意图。
丙酮
例:KMnO4紫红色,吸收的是绿光,λmax=525nm。它 对其它颜色的光吸收极小。吸收曲线形状是物质特有 的。当KMnO4的量不同,只使曲线沿纵座标上下移动, 但曲线形状不变。
图 KMnO----4的吸收光谱图 浓度:5、10、20、40μg/ml,1cm厚比色杯
四、分子跃迁类型及吸收光谱
max 较大 (104以上),可用于定量分析。
2.几个概念
生色团(Chromogenesis group)
有机化合物分子中含有非键或键的电子体系,
能吸收外来辐射时并引起n-* 和-*跃迁,可产生 此类跃迁或吸收的结构单元,称为生色团。
是一些具有不饱和健和含有孤对电子的基团。
如-C=C-、-C ≡ C-、—CH=O、—N=N—、-N=O 、—C≡N、—NO2等
紫外-可见吸收光谱分析

• 分子、原子或离子具有不连续的量子化能级,仅当
照射光光子的能量(hυ)与被照射物质粒子的基态和 激发态能量之差相当时才能发生吸收。不同的物质微粒 由于结构不同而具有不同的量子化能级,其能量差也不 相同。所以物质对光的吸收具有选择性。
三、吸收曲线(吸收光谱)
• 吸光度(A)--波长(λ)曲线称--。 • 光吸收程度最大处的波长叫 • 最大吸收波长,用λmax表示。 • 高锰酸钾的λmax=525nm。 • 浓度不同时,光吸收曲线形状不同,最大吸收波长
1852年,比耳(Beer)发现:
• 当单色光通过液层厚度b一
• 定的有色溶液时,溶液的吸
• 光度A与溶液浓度C成正比:
•
A= lg(I0/I)= k2 C
• --- 比耳定律
•
( C--有色溶液的浓度 k2--比例常数 )
• 将朗白定律与比耳定律合并起来:
•
A = lg(I0/I) = K b c
物质颜色
黄绿 黄 橙 红
紫红 紫 蓝
绿蓝 蓝绿
吸收光
颜色
波长范围
紫
40/0n-m450
蓝
450-480
绿蓝
480-490
蓝绿
490-500
绿
500-560
黄绿
560-580
黄
580-600
橙
600-650
红
650-700
二、物质对光的选择性吸收
当一束光照射到某物质或其溶液时,组成该物质的 分子、原子或离子与光子发生“碰撞”,光子的能量就 转移到分子、原子上,使这些粒子由最低能态(基态) 跃迁到较高能态(激发态):M + hυ → M* 这个作用叫物质对光的吸收。
紫外-可见吸收光谱

第二节 紫外—可见吸收光谱
一、有机化合物的紫外-可见吸收光谱 二、无机化合物的紫外-可见吸收光谱
一、有机化合物的紫外-可见吸收光谱
(一)电子跃迁类型 分子轨道理论:一个成键轨道必定有一 个相应的反键轨道。通常外层电子均处 于分子轨道的基态,即成键轨道或非键 轨道上。
当外层电子吸收紫外或可见辐射后,就 从基态向激发态(反键轨道)跃迁。主要有四 种跃迁所需能量ΔΕ大小顺序为:n→π* < π→π* < n→σ* < σ→σ*
羧酸及羧酸的衍生物虽然也有n*吸 收带,但是, 羧酸及羧酸的衍生物的羰基 上的碳原子直接连结含有未共用电子对的 助色团,如-OH、-Cl、-OR等,由于这些助 色团上的n电子与羰基双键的电子产生 n共轭,导致*轨道的能级有所提高, 但这种共轭作用并不能改变n轨道的能级, 因此实现n* 跃迁所需的能量变大,使 n*吸收带蓝移至210nm左右。
2. 配位场跃迁 配位场跃迁包括d - d 跃迁和f - f 跃迁。元素周期表中第四、五周期的过度金 属元素分别含有3d和4d轨道,镧系和锕系元 素分别含有4f和5f轨道。在配体的存在下, 过度元素五 个能量相等的d轨道和镧系元素 七个能量相等的f轨道分别分裂成几组能量 不等的d轨道和f轨道。
当它们的离子吸收光能后,低能态的 d电子或f电子可以分别跃迁至高能态的d 或f轨道,这两类跃迁分别称为d - d 跃 迁和f - f 跃迁。由于这两类跃迁必须 在配体的配位场作用下才可能发生,因 此又称为配位场跃迁。
⑶ π→π*跃迁
所需能量较小,吸收波长处于远紫外 区的近紫外端或近紫外区,摩尔吸光系数 εmax一般在104L·mol-1·cm-1以上,属于 强吸收。不饱和烃、共轭烯烃和芳香烃类均 可发生该类跃迁。如乙烯π→π*跃迁的 λmax为162nm,εmax为1×104L·mol-1·cm -1。
第三章紫外吸收光谱

溶剂的影响
C
∆Εn<∆Εp
O
C
C
π∗
∆Ε n > ∆Ε p π∗
∆Ε n n C
π∗ ∆Ε p
π∗ ∆Ε n π ∆Ε p
O 非极性
C
极性
C
π 极性
非极性
n → π*跃迁:兰移; λ↓ ;ε↑ 兰移; 兰移
λmax(正己烷) λmax(氯仿)
π → π*跃迁:红移; λ↑;ε↓ λ↑;
λmax(甲醇) λmax(水)
C H3 C O
n π∗ ; R带
π
π∗ ; K带
生色团与助色团
生色团: 生色团: 最有用的紫外—可见光谱是由π→π*和n→π*跃迁产生的 。这两种跃迁均要求有机物分子中含有不饱和基团。这类含 有π键的不饱和基团称为生色团。简单的生色团由双键或叁键 体系组成,如乙烯基、羰基、亚硝基、偶氮基—N=N—、乙 炔基、腈基—C㆔N等。 助色团: 助色团: 有一些含有n电子的基团(如—OH、—OR、—NH2、— NHR、—X等),它们本身没有生色功能(不能吸收λ>200nm的 光),但当它们与生色团相连时,就会发生n—π共轭作用,增 强生色团的生色能力(吸收波长向长波方向移动,且吸收强度 增加),这样的基团称为助色团。
基本值 217 基本值 253 增加值 +30 +5 +5 0 +6 +30 +5 +60
解析示例
有一化合物C10H16由红外光谱证明有双键和异丙基存在, 其紫外光谱λ max=231 nm(ε 9000),此化合物加氢只能吸收2 克分子H2,,确定其结构。 解:①计算不饱和度Ω = 3;两个双键;共轭?加一分子氢 ②λmax=231 nm, ③可能的结构 ④计算λ max
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第3章紫外光谱
2.5 小结
紫外光谱一般指近紫外区,即 200~400nm,那么就 只能观察 p p *和 n p *跃迁。也就是说紫外光谱 只适用于分析分子中具有不饱和结构的化合物。
第3章紫外光谱
三、 影响紫外吸收波长的因素
共轭效应 超共轭效应 溶剂效应 立体效应 pH对紫外光谱的影响
Absorbance
0.5
0.4
0.3
0.2
0.1
0.0
-0.1 400 450 500 550 600 650 700
(nm)
0.8
0.6
罗丹明B
0.4
亚甲基蓝
0.2
0.0
第3章紫外光谱
400 450 500 550 600 650 700
(nm)
不同波长的光具有不同能量,因此可引发不同能级上的电子跃迁。
外层价电子跃迁
分子转动和振动跃迁
核自旋取向跃迁
第3章紫外光谱
1.3 小结
紫外和可见光谱是由分子吸收能量引发价电子 或外层电子跃迁而产生的,不同的物质有不同的 紫外光谱响应,不同的光子可引发不同能级上电 子的跃迁。
第3章紫外光谱
二、电子跃迁类型
有机化合物的紫外—可见吸收光谱是三种电子跃迁的结果:
当烷基与共轭体系相连时, σ电子与共轭体系的 p电子云产生一定程度的重叠,扩大了共轭范围,使 跃迁能量降低,吸收红移。
苯 甲苯 间二甲苯 1,3,5-三甲 苯六甲苯
max(nm) 254 261 263 266 272
max 200 300 300 305 300
第3章紫外光谱
3.3 溶剂效应
极性溶剂导致p p *跃迁能量减小,吸收红移,非极性溶剂: 吸收蓝移。 非极性溶剂n → π*跃迁能量减小,吸收红移,极性溶剂: 吸收 蓝移。
eg. 甲烷的λmax为125nm , 乙烷λmax为135nm。 只能被真空紫外分光光度计检测到; 作为溶剂小,吸收波长处于远紫外区的近紫外端或近紫外 区,εmax一般在104以上,属于强吸收。 不饱和烃π→π*跃迁 乙烯π→π*跃迁的λmax为171nm,εmax为: 1× 104 。 共轭体系中的π→π*跃迁 共轭体系中的p 键与p 键可相互作用,生成大p 键。由于大p 键 各能级的距离较近电子容易激发,所以吸收峰的波长就增加。
λmax=292 ε= 292
O
λmax=280 ε~ 150
第3章紫外光谱
O
eg. 苯环上邻位取代基基越多,使得共平面性越差, 共轭性越差,导致吸收蓝移。
第3章紫外光谱
3.5 pH对光谱的影响
pH的改变可能引起共轭体系的延长或缩短,从 而引起吸收峰位置的改变。
OH
NH2
吸
吸
光
光
度
度
中性
碱性
酸性
第3章紫外光谱
3.1 共轭效应
共轭体系使分子的最高已占轨道能级升高,最低空轨 道能级降低,使p p *跃迁能量降低,共轭体系越 长,紫外光谱的最大吸收越向长波方向移动(红移), 并且强度也增大。
n=4
p* 吸
光 n=3
n=5
p
系
数
34 5 波长 H(CH=CH)n H 第3章紫外光谱
3.2 超共轭效应
第三章 紫外-可见光谱 Ultraviolet-Visible absorption
spectra;UV
第3章紫外光谱
一、紫外光谱基本原理
1.1 定义:分子中价电子经紫外光(或可见光)照射时,电子
从低能级跃迁到高能级,此时电子就吸收了相应波长的光,这
样产生的吸收光谱叫紫外光谱。
紫外吸收光谱的波长范围是10-400nm(纳米), 其中10200nm 为远紫外区,200-400nm为近紫外区, 一般的紫外光 谱是指近紫外区。
σ电子、π电子、n电子。
s*
HC O
s
n
E
p*
n
Hp
p
s
当外层电子吸收紫外或可见辐射后,就从基态向激发态(反键
轨道)跃迁。主要有四种跃迁所需能量ΔΕ大小顺序为:
n→π* < π→π* < n→σ* < σ→σ*
第3章紫外光谱
2.1 σ→σ*跃迁
所需能量最大,σ电子只有吸收远紫外光的能量才能发生跃迁。 饱和烷烃的分子吸收光谱出现在远紫外区; 吸收波长λ<200 nm;
区域 γ射线 X射线 远紫外 紫外 可见 红外 远红外 微波 无线电波
波长 10-3~0.1nm 0.1~10nm 10~200nm 200~400nm 400~800nm 0.8~50μm 50~100μm 0.1~100cm
1~100m
第3章紫外光谱
原子或分子跃迁 核跃迁
内层电子跃迁 中层电子跃迁
第3章紫外光谱
1.2 紫外光谱产生原理
当一定波长的光照射到物质表面时,物质会吸收特定波长的光。
M + h → M *
基态
激发态
E1
(△E)
E2
E = E2 - E1 = h
e-
e-
激发态
E
基态
不同的物质,电子跃迁所需能量不同,因此不同的 物质有不同的紫外响应特性。
第3章紫外光谱
Absorbance
K带:共轭非封闭体系的π →π* 跃迁产生的吸收带。(210~250nm)
CH2=CH-CH第3=章紫C外光H谱 2
2.3 n→σ*跃迁
所需能量较大。吸收波长为150~250nm,大部分在远紫 外区,近紫外区仍不易观察到。
含非键电子的饱和烃衍生物(含N、O、S和卤素等杂原
子)均呈现n→σ* 跃迁(生色团、助色团、红移、蓝移)。
非极性溶剂 极性溶剂
非极性溶剂 极性溶剂
pp*
n → π* 第3章紫外光谱
3.4 立体效应
空间位阻:影响共平面性,从而影响共轭效应。
OO HC C CH3λmax=466
O CO
C
λmax=300
邻位效应:苯环邻位取代影响共轭。
跨环效应:两个基团虽不共轭,但由于空间的排列,它们 的电子云仍能相互影响,使最大吸收波长和吸光系数改变.
中性
波长(nm)
波长(nm)
苯酚、苯胺在酸碱性溶液中的吸收光谱
化合物 H2O
CH3OH CH3CL
CH3I CH3NH2
max(nm) 167 184 173 258 215
第3章紫外光谱
max 1480 150 200 365 600
2.4 n → π*跃迁
n → π*跃迁是指分子中处于非键轨道上的n电子获得能 量后向π*反键轨道的跃迁,这种跃迁称为R跃迁,一般 在近紫外或可见光区有吸收,其特点是在270~350nm,吸 光系数较小在100以内,为弱带,该跃迁为禁阻跃迁。
