化合物及化合价
九年级化学化合价

注意事项和易错点提示
注意元素化合价的符号
注意化合物中元素的比例关系
化合价有正负之分,计算时要注意元素化 合价的符号,避免出现错误。
在列出求解未知数的方程时,要确保化合 物中各元素的比例关系正确。
注意验证结果
注意多解情况
求得元素化合价后,一定要代入原化合物 中进行验证,确保结果符合实际情况。
有些复杂化合物可能存在多种元素化合价的 组合方式,计算时要注意考虑多种可能性。
药品准备
待测化合物、已知化合价的化合物、还原剂 、氧化剂等。
实验步骤和操作注意事项
实验步骤 1. 准确称量待测化合物和已知化合价的化合物。
2. 将两种化合物混合,并加入适量的还原剂或氧化剂。
实验步骤和操作注意事项
01
3. 观察并记录反应现象,如颜色 变化、沉淀生成等。
02
4. 对反应后的混合物进行定量分 析,测定各元素化合价的变化情 况。
在电子式中,通常用“·”或“×”表示原子最外层的电子,用元素符号 表示原子核和内层电子。例如,氢原子的电子式为H·,氯原子的电子式 为·Cl:。
通过电子式可以方便地表示出共价化合物的形成过程,如HCl的形成过程 可以表示为H·+·Cl:→H-Cl。
04 氧化还原反应与化合价变 化
氧化还原反应定义及判断依据
在氧化还原反应中,失去电子的物 质称作还原剂。
注意
氧化剂、还原剂都是反应物,不是 产物;氧化剂被还原、还原剂被氧 化。
常见氧化还原反应类型归纳
四大基本反应类型中,置换反应一定是 氧化还原反应;复分解反应一定不是氧 化还原反应;化合反应与分解反应可能 是氧化还原反应,也可能不是氧化还原
反应。
有单质参加的化合反应和有单质生成的 没有单质参加的化合反应和没有单质生 分解反应,一定是氧化还原反应。因为 成的分解反应,可能是氧化还原反应, 单质中元素的化合价为0,而化合物中 也可能不是氧化还原反应。这类反应前 元素的化合价不为0,反应前后元素化 后,元素化合价可能变化,也可能不变。
化合价

2+
HgS
HgCl2。
需要十分熟悉。较不常见的有 Al4C3,C 爲-4 价,水解生成 Al(OH)3 和 CH4。 镓分族不必了解。
ⅣA C Si Ge Sn Pb
C:[-4 ,+4] ,常见的 CO 碳爲+2 价, CO2
+1 −1+ 3 −3
2− − H2CO3 碳爲+4 价,氰根 CN-碳 CO3 HCO3
+1 −1−1 +1+ 3 −3
Cu3P。
CrCl 3,+6 价如 CrO 4 Cr2O 7 。
2−
2−
Mn: +2 价+4 价+6 价+7 价, +2 价如 MnSO4, +4 价如 MnO2, +6 价如 K2MnO4, +7 价如 KMnO4。 其他的 Hg:+1 价+2 价,+1 价如 Hg 2 (双聚) ,+2 价如 HgO Au:+3 价,+3 价如 Au2Cl6(双聚) AuCl 4 。
ⅤA N P As Sb Bi
N:[-3,+5]所有整数化合价均有且均较常见,
NH 3 + N 2H 4 NH 4 , -2 价 ,-1 价 NH2OH,+1 价 N2O, 如-3 价 + − N H ( 肼合氫離子 ) NH ( 氨基離子 ) 2 5 2 氮化物(如Mg N ) 3 2
硒分族不必了解。
ⅦA F Cl Br I At
F:化合态只有-1 价,无正价。 卤素互化物通式 XX n ,n∈{1,3,5,7} ,其中 X 显正价,爲+n 价,X’显负价,爲-1 价。
化合价与化学式及有关的计算

化合价与化学式以及有关的计算(化学用语)班级 姓名 座号(11福州) 1.三氧化二铋(Bi 2O 3)俗称铋黄,是制作防火纸的材料之一。
三氧化二铋中铋元素的化合价是 ( )A.+6B. +3C. +2D. -2(11福州) 2. 下列化学用语与含义不相符的是 ( )A.AlCl 3—氯化铝B. 钙离子—Ca 2+C. 2个氧元素—2OD. 2个水分子—2H 2O(11莆田)3.下列化学符号中,表示2个氢分子的是 ( )A H 2B 2HC 2H 2D 2H +(09娄底)4.掌握化学用语是学好化学的关键。
下列化学用语与所表述的意义相符合的是A.H 2O ——1个水分子B.Na +1——1个钠离子C.3Fe 3+ ——3个铁原子D.2H ——2个氢元素 (10龙岩)5.冲洗照片时,需将底片浸泡在大苏打(Na 2S 2O 3)溶液中,使影像固定下来,这一过程叫“定影”。
大苏打中硫元素的化合价为 ( )A .0B .+2C .+4D .+6(11泉州)6.下列化学用语表示正确的是 ( )A .两个氯原2Cl 2B .镁离子C .二氧化硫分子SO 2D .碳酸钠 NaCO 3(13泸州市)7.下列化学用语书写正确的是 ( )A. 2个镁原子:2MgB.钙离子:Ca +2C.五氧化二磷:05P 2D.氯化铝:A1C1(09苏州)8.下列物质的化学式的读法和写法都正确的是 ( )A .碳酸钠NaCO 3B .硫酸H 2SO 4C .氧化铁O 3Fe 2D .氢氧化钾K(OH)2(09福州)9.下列化学用语与含义相符的是 ( )A .2O —2个氧元素B .P 2O 5 — 五氧化二磷C .H 2—2个氢原子D .Ca —钙离子(09青岛)10.化学用语是国际通用的化学语言,下列有关说法正确的是 ( )A .2O 表示两个氧分子B .钠离子的符号为Na +C .一氧化碳的化学式是CoD .H 2O 中含有氧分子(11广西)11. 2011年3月11日日本因9.0级大地震引发了核泄漏事故。
如何判断化合物中化合价的大小

如何判断化合物中化合价的大小
书写化学式以及氧化还原反应的配平都会用到化合价。
单质的元素化合价为零。
中学阶段,化合物的化合价的判断方法如下(有先后顺序):
1、金属的化合价都是正价,主族金属元素的主要化合价就是最外层电子数,
如锂钠钾铷铯钫+1价,铍镁钙锶钡镭+2价,铝+3价。
主族金属元素随着电子层数和最外层电子数增多,元素的化合价呈现变价,最高价仍然等于最外层电子数,并且遵循价奇序奇,价偶序偶的原则。
如金属铊(读ta)+1 、+3价,锡铅+2 、+4价。
副族元素通常有变价,常见的有铜+1 +2价,铁+2 +3价,锰+2 +4 +6 +7价,铬+3 +6价,
有些也无变价,如锌+2价。
2、氢元素与金属结合(或者硼元素如NaBH4)显示-1价,如NaH,其余显+1价。
3、氟元素仅显示-1价。
4、氧元素,正常显-2价,有些时候显-1价,不好计算的时候前面的判断根据化合价的代数和等于0计算可得。
如OF2中氧显+2价。
5、氮元素的化合价很多,常见的有-3,+1,+2,+3,+4,+5 。
6、硫元素的化合价也很多,常见的有-2,+2,+4,+6。
7、非金属元素的最高正价一般等于最外层电子数,并且最高正价与最低负价的绝对值之和为8。
8、有些物质同一元素有多种化合价如Fe3O4,NH4NO3等。
9、有机物以及化合价不好判断的如Fe3C,在氧化还原反应配平中,可以认为所有元素均为零价。
化学物质构成之化合价整理

化学物质构成之化合价整理昨日撒下勤奋种,今朝一搏必成功。
鲤鱼一跃便成龙,大鹏展翅震长空。
前程似锦圆美梦,锦衣凯旋沐春风。
寒窗不负苦心人,金榜有你祝高中。
中考顺利,愿你成功!下面是小编给大家带来的化学物质构成之化合价,欢迎大家阅读参考,我们一起来看看吧!化学物质构成之化合价1、O通常显-2价,氢通常显+1价;金属元素通常显正价;化合价有变价。
2、化合价的应用:依据化合物中各元素化合价的代数和为0。
3、书写化学式时注意根据化合价的正负,按左正右负氨特殊来书写。
4、记住常见元素的化合价七、1、元素符号前的数字:表示原子个数 2N2、化学式前面的数字:表示分子个数 2H2O3、离子符号前面的数字:表示离子个数4、元素符号右上角的数字:表示该离子所带的电荷数 Mg2+5、元素符号正上方的数字:表示该元素的化合价6、化学式中元素符号右下角的数字:表示该分子所含有的某原子个数 H2O初三化学知识点:初三化学化合价详细讲解一、什么是化合价化合价是由一定元素的原子构成的化学键的数量。
一个原子是由原子核和外围的电子组成的,电子在原子核外围是分层运动的,化合物的各个原子是以和化合价同样多的化合键互相连接在一起的。
化合键有两种:因为惰性气体最外层电子数已经达到了2个或8个,所以惰性气体(现统称稀有气体)一般不能和其他物质化合。
各元素的化合价参考元素氧化态列表。
化合价的概念就由此而来,那么元素的核外电子相互化合的数目,就决定了这种元素的化合价,便表示原子相互化合的数目而设置的。
学习化合价时你应该了解化合物中元素化合价的规定。
化合价是化合物物质中的原子得失的电子数或共用电子对偏移的数目。
化合价表示原子之间互相化合时原子的得失电子的数目。
化合价也是元素或根在形成化合物时表现出的一种性质。
注意:元素的“化合价”是元素的一种重要性质,这种性质只有跟其他元素相化合时才表现出来。
就是说,当元素以游离态存在时,即没有跟其他元素相互结合成化合物时,该元素是不表现其化合价的,因此单质元素的化合价为“0”。
初中常见化合价、化学式及化学方程式
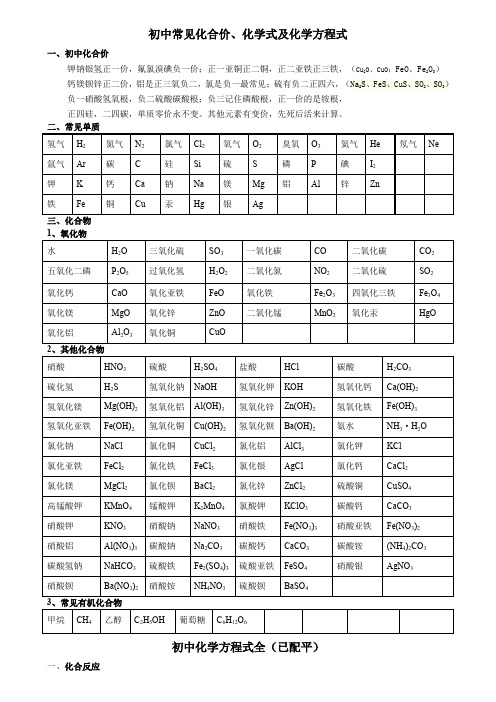
初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu2O、CuO;FeO、Fe2O3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na2S、FeS、CuS、SO2、SO3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根,正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
三、化合物初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O点燃2MgO2、铁在氧气中燃烧:3Fe+2O点燃Fe3O43、铝在空气中燃烧:4Al+3O点燃2Al2O34、氢气在空气中燃烧:2H2+O点燃2H2O5、红磷在空气中燃烧:4P+5O点燃2P2O56、硫粉在空气中燃烧:S+O2点燃SO27、碳在氧气中充分燃烧:C+O点燃 CO28、碳在氧气中不充分燃烧:2C+O2点燃2CO9、二氧化碳通过灼热碳层:C+CO高温2CO10、一氧化碳在氧气中燃烧:2CO+O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO312、生石灰溶于水:CaO+H2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑16、加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑18、碳酸化学性质不稳定而分解:H2CO3=H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO高温CaO+CO2↑20、加热氯酸钾分解:2KClO3=2KCl+3O2↑21、氧化汞加热分解:2HgO△2Hg+O2↑三、置换反应(单质+化合物→新的单质+新的合化物)22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl2+H2↑锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑23、镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑镁和稀硫酸反应:Mg+H2SO4=MgSO4+H2↑24、铁和稀盐酸反应:Fe+2HCl=FeCl2+H2↑铁和稀硫酸反应:Fe+H2SO4=FeSO4+H2↑25、铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑铝和稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑26、铁和硫酸铜溶液反应:Fe+CuSO4 =FeSO4+Cu铝和硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3+3Cu27、铜和硝酸银反应:Cu+2AgNO3=Cu(NO3)2+2Ag28、氢气还原氧化铜:H2+CuO△Cu+H2O29、木炭还原氧化铜:C+2CuO高温 2Cu+CO2↑30、焦炭还原氧化铁:3C+2Fe2O高温 4Fe+3CO2↑31、水蒸气通过灼热碳层:H2O+C高温 H2+CO四、复分解反应复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应。
初中化学元素及化合价

初中化学元素及化合价1、氢化合物:
(1)氢:质子1,化合价+1
(2)氧化物:质子2,化合价-2
(3)氯化物:质子1,化合价-1
(4)硫酸盐:质子2,化合价-2
2、碱金属:
(1)钠:质子1,化合价+1
(2)钙:质子2,化合价+2
(3)铝:质子3,化合价+3
(4)锂:质子1,化合价+1
3、非金属:
(1)氟:质子1,化合价-1
(2)氖:质子0,化合价0
(3)氮:质子3,化合价-3
(4)磷:质子3,化合价-3
(5)硫:质子2,化合价-2
4、有机元素:
(1)甲烷:质子4,化合价-4
(2)乙烷:质子2,化合价-2
(3)丙烷:质子6,化合价-6
(4)烯烃:质子2,化合价-2
(5)芳香烃:质子4,化合价-4
二、常见元素的定义
1、氢:氢是一种无色、无臭、无味的无机元素,其在自然界中最多,但是在地壳中只占质量的0.14%,其原子量为1,处于无机元素周期表的
最左边。
2、氧:氧是一种常见的元素,它是地球上最常见的元素,其原子量
为16,是一种有机物,它可以与其他元素如氢、碳等进行化学反应,形
成氧化物。
3、氯:氯是一种常见的元素,原子量为35.5。
常用化学元素的化合价

常用化学元素的化合价
以下是常见化学元素的化合价和相应的解释:
1.氢(H)的化合价通常为+1,因为它倾向于失去一个电子,形成带正电荷的单价阳离子H+。
2.氧(O)的化合价通常为-2,在大多数化合物中氧原子会接受两个电子,形成带负电荷的氧化物阴离子O2-,例如水分子(H2O)中氧的化合价为-2
3.氮(N)的化合价通常为-3,它往往会接受三个电子,形成带负电荷的氮化阴离子N3-。
4.碳(C)的化合价可以是+4或-4,取决于化合物的性质。
在有机化合物中,碳通常与其他元素共享电子,形成化合价为+4的带正电荷的阳离子。
5.铁(Fe)的化合价可以是+2或+3,这取决于它所处的化合物和溶液环境。
例如,Fe2+和Fe3+是两种常见的氧化态,如Fe2+在血红蛋白中的还原型。
6.铜(Cu)的化合价可以是+1或+2,在大多数情况下,它的化合价为+2,但在一些特定的化合物中,它的化合价为+1,例如CuO和Cu2O。
7.氯(Cl)的化合价通常为-1,因为它倾向于获得一个电子,形成带负电荷的氯化物阴离子Cl-。
8.锂(Li)的化合价通常为+1,因为它倾向于失去一个电子,形成带正电荷的单价阳离子Li+。
9.钠(Na)的化合价通常为+1,因为它也倾向于失去一个电子,形成带正电荷的单价阳离子Na+。
10.氟(F)的化合价通常为-1,因为它倾向于获得一个电子,形成带负电荷的氟化物阴离子F-。
这些只是常见化学元素的一些化合价,还有许多其他元素的化合价需要具体根据元素的性质、电子结构和化合物的类型来确定。
化合价是化学反应和物质变化的重要参数,它决定了元素能够与其他元素形成化学键,并决定了化合物的稳定性和性质。
初中常见化合价化学式及化学方程式

初中常见化合价化学式及化学方程式集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu 2O 、CuO ;FeO 、Fe 2O 3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na 2S 、FeS 、CuS 、SO 2、SO 3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根, 正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
二、常见单质三、化合物 1、氧化物2、其他化合物3、常见有机化合物 初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O 点燃2MgO2、铁在氧气中燃烧:3Fe+2O 点燃Fe 3O 43、铝在空气中燃烧:4Al+3O 点燃2Al 2O 34、氢气在空气中燃烧:2H 2+O 点燃2H 2O5、红磷在空气中燃烧:4P+5O 点燃2P 2O 56、硫粉在空气中燃烧:S+O 点燃SO 27、碳在氧气中充分燃烧:C+O 点燃 CO 28、碳在氧气中不充分燃烧:2C+O 2 点燃2CO9、二氧化碳通过灼热碳层:C+CO 高温2CO10、一氧化碳在氧气中燃烧:2CO+O 2 点燃2CO 211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO 2+H 2O=H 2CO 3 12、生石灰溶于水:CaO+H 2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO 4+5H 2O=CuSO 4·5H 2O 14、钠在氯气中燃烧:2Na+Cl 2点燃2NaCl 二、分解反应15、实验室用双氧水制氧气:2H 2O 2MnO 22H 2O+O 2↑ 16、加热高锰酸钾:2KMnO 4△K 2MnO4+MnO 2+O 2↑ 17、水在直流电的作用下分解:2H 2O 通电2H 2↑+O 2↑ 18、碳酸化学性质不稳定而分解:H 2CO 3=H 2O+CO 2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO 3高温CaO+CO 2↑ 20、加热氯酸钾分解:2KClO 3=2KCl+3O 2↑21、氧化汞加热分解:2HgO △2Hg+O 2↑三、置换反应(单质+化合物→新的单质+新的合化物) 22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl 2+ H 2↑ 锌和稀硫酸反应(实验室制氢气):Zn+H 2SO 4=ZnSO 4+ H 2↑ 23、镁和稀盐酸反应:Mg+2HCl=MgCl 2+H 2↑ 镁和稀硫酸反应:Mg+H 2SO 4=MgSO 4+ H 2↑ 24、铁和稀盐酸反应:Fe+2HCl=FeCl 2+ H 2↑ 铁和稀硫酸反应:Fe+H 2SO 4=FeSO 4+ H 2↑ 25、铝和稀盐酸反应:2Al+6HCl=2AlCl 3+3H 2↑ 铝和稀硫酸反应:2Al+3H 2SO 4=Al 2(SO 4)3+3 H 2↑ 26、铁和硫酸铜溶液反应:Fe+CuSO 4 =FeSO 4+Cu 铝和硫酸铜溶液反应:2Al+3CuSO 4=Al 2(SO 4)3+3Cu 27、铜和硝酸银反应:Cu+2AgNO 3=Cu(NO 3)2+2Ag28、氢气还原氧化铜:H 2+CuO △Cu+H 2O29、木炭还原氧化铜:C+2CuO 高温 2Cu+CO 2↑ 30、焦炭还原氧化铁:3C+2Fe 2O 高温 4Fe+3CO 2↑ 31、水蒸气通过灼热碳层:H 2O+C 高温 H 2+CO 四、复分解反应复分解反应是由两种互相交换成分,生成另外两种化合物的反应。
化合价

一、化合价掌握元素的化合价,请注意以下几点:(1)记住常见元素的化合价,掌握元素化合价的一些规律,如:①在化合物中,通常氢显+1价;氧显-2价;②单质里元素的化合价为零;③一些元素有变价,其化合价的确定,可以通过不变价元素按化合价规则求得。
(2)使用化合价的规则是:在化合物里,元素正负化合价的代数和为零。
(3)掌握常见原子团的化合价。
原子团是在化学反应中相对稳定的原子集团,又叫做根。
(4)常见的化合价:一价钾钠氯氢银,二价氧钙钡镁锌.三铝四硅五价磷,二三铁,二四碳.二四六硫都齐全,铜汞二价最常见.氢一氧二为标准,看见单质即为零!负一硝酸氢氧根,负二硫酸碳酸根。
负三只有磷酸根,正一价的是铵根。
下表是一些常见原子团的化合价:根的名称根的符号化合价根的名称根的符号化合价氢氧根OH -1碳酸根CO3-2硝酸根NO3-1硫酸根SO4-2碳酸氢根HCO3-1铵根NH4+1氯酸根ClO3-1二、化学式的意义和书写1.化学式的意义①表示一种物质;②表示该物质的组成元素;③由分子构成的物质的化学式可以表示该物质的一个分子及该分子的构成。
2.化学式的书写①单质化学式书写一般用元素符号表示,但像氢气、氧气、氮气、氯气等非金属单质是双原子分子,要在其元素符号的右下角加2;②化合物化学式书写时,正价元素写在左边,负价元素写在右边;正负价总数的代数和为0;③含有原子团的物质,可将原子团看成是一个原子来书写化学式,如氢氧化镁〔Mg(OH)2〕。
三、关于化学式的计算1、利用化学式可进行下列各种计算:①相对分子质量(化学式中各原子的相对原子质量的总和)②物质组成元素的质量比(化学式中个院子的相对原子质量之比)③物质中某元素的质量分数。
公式为例:1.写出下列物质的化学式或名称:高锰酸钾;硫酸钾;碳酸钠;氯化钾;氯气;铁;氢气;氧化铜;水;二氧化碳;氩;四氧化三铁;氢氧化钙;硝酸铵;氯化镁;碳酸氢铵。
2.写出下列物质的名称Cu H2O Ne SiO2P2O5K2O AgCl ZnO NaCl K2MnO4Al2O3SO2NH4Cl CaCO3Mg(NO3)23.用化学符号表示:两个碳原子三个水分子四个氮分子一个二氧化硫分子三个氢原子一个钠原子两个铁原子两个氖分子四、根据化合价写化学式正价在左,负价在右1、交叉法:在元素上方标上化合价,先化简再交叉,如P为+5价,氧为-2价,交叉后为P2O52、最小公倍数法,选求出几种元素化合价的最小公倍数,再根据最小公倍数求各元素的原子数。
高一化学化合价知识点总结

高一化学化合价知识点总结化合价是指元素在化合物中所具有的价态或化合能力,它是研究化学反应和化学式的重要概念。
下面是对高一化学中常见的化合价知识点进行总结。
一、单质的化合价单质指的是由同种原子组成的物质。
一般情况下,单质的化合价等于它的氧化数,而氧的化合价通常为-2。
但有几个例外情况,如氧化银(Ag2O)中银的化合价为+1,过氧化物中氧的化合价为-1。
二、自由基的化合价自由基由原子或分子通过解离、键断裂等反应形成的离子或分子,它们通常具有未成对的电子。
自由基的化合价是指其中带正电的原子的电荷数减去带负电的原子的电荷数。
例如,羟基自由基(·OH)中氧的化合价为-1。
三、离子化合物的化合价离子化合物是由正离子和负离子通过电荷平衡而结合形成的物质。
在离子化合物中,正离子的化合价等于它的电荷数,而负离子的化合价等于它的电荷数的绝对值。
四、共价化合物的化合价共价化合物是由原子通过共享电子而形成的物质。
在共价化合物中,元素的化合价等于它在分子中共享电子的数目。
对于氧族元素(如氧、硫、硒等),它们通常的化合价是-2。
对于氮族元素(如氮、磷、砷等),它们的化合价通常是-3。
但这只是一般情况,根据具体化合物的结构和化学键的性质,这些元素的化合价也可能有变化。
五、化合价的确定确定化合价的方法主要有化合物离子法和电子配对法。
化合物离子法是指根据离子化合物中元素的电荷数确定其化合价。
电子配对法是指根据共价化合物中元素形成化学键时的电子配对数确定其化合价。
在使用这些方法时,我们还需要考虑元素的电负性,以及氧的化合价通常为-2等规律。
六、化合价的意义化合价的正确确定有助于我们理解化学反应的机理和推算化学式的写法,进而加深对化学原理的理解。
化合价还有助于我们预测元素的化学性质和反应活性,方便进行实验设计和化学实践。
综上所述,化合价是化学中重要的概念之一,在高一化学学习中占有重要地位。
通过对单质的化合价、自由基的化合价、离子化合物的化合价、共价化合物的化合价以及化合价的确定方法的总结,我们可以更好地理解化学反应和化学式的构成。
化合价口诀离子符号

化合价口诀离子符号一、化合价口诀化学中的化合价是指元素在化合物中的电价,用于描述元素与其他元素之间的化学结合方式。
化合价口诀是一种记忆化合价的方式,通过一句口诀可以快速记忆元素的化合价规律。
化合价口诀如下:1.对于单负离子,其化合价即为其电荷数,如Cl-的化合价为-1。
2.对于单正离子,其化合价即为其电荷数,如Na+的化合价为+1。
3.第一族元素的化合价为+1。
4.第二族元素的化合价为+2。
5.第三族元素的化合价为+3。
6.第十六族非金属元素的化合价为-2。
7.第十五族非金属元素的化合价为-3。
8.铝和银的化合价为+3。
9.锌的化合价为+2。
根据以上口诀,我们可以快速推导出元素的化合价,从而预测元素在与其他元素反应时的结合方式。
二、离子符号离子符号用于表示化合物中各种离子的符号组合,是化学化合物描述的一种重要方式。
通过离子符号,我们可以简洁明了地表示化合物中的不同元素及其化合价。
离子符号的表示方式遵循以下规律:1.对于带正电荷的离子,以元素符号开头,后跟电荷的绝对值,如Na+表示正一价的钠离子。
2.对于带负电荷的离子,同样以元素符号开头,后跟电荷的绝对值,如Cl-表示负一价的氯离子。
3.当含有多个离子时,可以用括号将多个离子括起来,括号外再写上对应的电荷数,如NaCl表示氯化钠。
4.当化合物中含有多个不同的离子时,根据离子的化合价和数量,通过交换离子组成离子符号。
同时,需要注意离子的电荷数要平衡,以保持电中性。
通过离子符号的表示,我们可以直观地了解化合物中的离子组成,进而理解化合物的性质和化学反应。
三、示例以下是一些化学化合物的化合价口诀离子符号示例:1.氯化钠:Na+ Cl-(+1和-1离子)2.水:H+ OH-(+1和-1离子)3.硫酸:H+ SO4^2-(+1和-2离子)4.水合铜(II)硫酸:Cu(H2O)4^2+ SO4^-2(+2和-2离子)5.硫酸铵: NH4+ SO4^2-(+1和-2离子)通过以上示例,我们可以看到如何根据化合价口诀和离子符号推导出化学化合物的组成。
初三化学 常见物质的化学式及元素化合价

2பைடு நூலகம்化合物
(1) 氧化物
水(H2O)
过氧化氢(H2O2)
一氧化碳(CO) 二氧化碳(CO2)
二氧化硫(SO2) 五氧化二磷(P2O5) 一氧化氮(NO) 二氧化氮(NO2)
氧化亚铁(FeO) 氧化铁(Fe2O3) 四氧化三铁(Fe3O4) 二氧化锰(MnO2)
氧化汞(HgO)
(2) 其他化合物
高锰酸钾(KMnO4) 锰酸钾(K2MnO4) 氯酸钾(KClO3) 氯化钾(KCl)
硫酸铜(CuSO4) 氯化钠(NaCl)
氯化钙(CaCl2) 氯化氢(HCl)
氢氧化钠(NaOH) 氢氧化钙 [Ca(OH)2] 碳酸钙(CaCO3)
元素化合价口诀
一价钾钠氯氢银, 二价氧钙钡镁锌, 三铝四硅五氮磷, 二三铁,二四碳, 二四六硫都齐全, 铜汞二价最常见, 单质为零永不变。
原子团化合价口诀
常见物质的化学式
1、单质
(1) 稀有气体单质
氦气(He) 氖气(Ne) 氩气(Ar)
(2) 金属单质
铁(Fe) 铜(Cu) 钠(Na) 镁(Mg) 铝(Al) 汞(Hg)
(3) 非金属固体单质
碳(C) 硅(Si) 磷(P) 硫(S)
(4) 非金属气体单质
氧气(O2) 臭氧(O3) 氢气(H2) 氮气(N2) 氯气(Cl2)
化合价的定义及计算规律是什么

化合价的定义及计算规律是什么化合价的定义及计算规律是什么化合价是一种元素的一个原子与其他元素的原子化合{即构成化合物}时表现出来的性质。
下面是店铺给大家整理的化合价的定义及计算规律是什么,希望能帮到大家!化合价的定义中学是物质中的原子得失的电子数或共用电子对偏移的。
化合价表示原子之间互相化合时原子得失电子的数目。
化合价也是元素在形成化合物时表现出的一种性质。
元素在相互化合时,反应物原子的个数比并不是一定的,而是根据原子的最外层电子数决定的。
比如,一个钠离子(化合价为+1,失去一个电子)一定是和一个氯离子(化合价为-1,得到一个电子)结合。
而一个镁离子(化合价为+2,失去两个电子)一定是和2个氯离子结合。
如果形成的化合物的离子的化合价代数和不为零,就不能使构成离子化合物的阴阳离子和构成共价化合物分子的原子的最外电子层成为稳定结构。
也就不能形成稳定的化合物。
化合价的概念就由此而来,那么元素的核外电子相互化合的数目,就决定了这种元素的化合价,化合价就是为了方便表示原子相互化合的数目而设置的。
学习化合价时你应该了解化合物中元素化合价的规定。
另外,规定单质分子里,元素的化合价为零,不论离子化合物还是共价化合物,其组成的正、负离子的化合价的代数和均为零。
离子化合物,例:NaOH(钠化合价是正1价,氢氧根离子化合价是负1价,相互抵消为零价这样的化合物写法就成立)化合价——原子形成化学键的能力。
是形成稳定化合物中的彼此元素的化学性质。
(即达成各元素形成稳定结构的一种能力性质) 注意:元素的“化合价”是元素的'一种重要性质,这种性质只有跟其他元素相化合时才表现出来。
就是说,当元素以游离态存在时,即没有跟其他元素相互结合成化合物时,因此单质元素的化合价为“0”。
比如铁等金属单质、碳等非金属单质、氦等稀有气体。
大学<大学里化合价和中学的化合价定义不一样,中学的化合价在大学被定义为氧化数>定义:某元素一个原子的表观电荷数,这个电荷数是假设把每一个化学键中的电子指定给电负性更大的原子而求得的。
单质和化合物的化合价

单质和化合物的化合价咱们得认识一下单质。
单质就是由同一种元素构成的物质。
比如说,氧气(O₂)、氢气(H₂)等等。
它们在这儿就像是一帮兄弟,心里都明白,自己就是自己,没啥需要担心的。
单质的化合价一般是零。
咋回事呢?你想啊,单质就像是一个人在自己家里,没必要表现得太特别,平平淡淡就是了。
所以说,单质的化合价,就是“零分”啊!这可真没什么压力。
咱们得聊聊化合物了。
化合物就像是把不同性格的元素集合在一起,搞个“大联欢”。
比如水(H₂O)这位老友,里面有两个氢和一个氧,大家一起搭伙过日子。
氢在这里的化合价是+1,氧是2。
咋说呢?氢就像是那个爱出风头的家伙,想要让大家都听他的;而氧则有点沉稳,喜欢把事情搞得有条不紊。
每个元素都有自己的化合价,就像角色扮演游戏里,大家各自都有自己的任务。
说到这里,很多小伙伴可能会问,化合价是怎么来的?其实嘛,元素的化合价主要跟它们的电子结构有关。
就像是每个人都有自己的背景和经历,元素也不例外。
比如,钠(Na)这个家伙,它在化学反应中总是喜欢失去一个电子,表现得像个大方的朋友,所以它的化合价是+1。
而氯(Cl)则喜欢吸引电子,想要达到“八卦”状态,化合价是1。
这种互补的关系就像一对情侣,互相吸引,互相依赖,嘿嘿,真是甜蜜得让人想哭。
还有一件有趣的事情,化合价有时候会变。
比如说,铁(Fe)可以有+2和+3的化合价,这就好比是它今天心情不错,想当个二当家,明天心情不好,变成了大老板,真是让人捉摸不透。
化合价的变化让化学反应变得更加多姿多彩,仿佛每一次反应都是一场精彩的表演。
说到反应,不得不提的就是酸碱反应。
酸和碱在化学反应中就像是两位热情的舞者,酸通常有个负的化合价,而碱则是正的化合价,它们一碰头,化学反应立马就开始了。
形成盐的时候,它们就像是一对甜蜜的情侣,牵手走进了婚姻的殿堂,真是浪漫得不要不要的。
化合价的应用可不止于此。
生活中,我们常常接触到各种化学物质,比如在厨房做饭的时候,盐的化合价是+1和1,这让它能与其他元素进行各种各样的化合,给我们的菜肴增添了无穷的风味。
共价化合物化合价数值

共价化合物化合价数值【引言】在化学领域中,共价化合物是指由原子通过共享电子来形成的化合物。
在化合物的化学式中,每个原子的化合价数值决定了其在共价键中的电子数目。
化合价数值的理解对于分子的结构、化学性质以及反应机制的解释至关重要。
本文将全面评估共价化合物的化合价数值,并对其进行深入探讨。
【主体】1. 什么是共价化合物?共价化合物是由两个或多个原子通过共享电子来形成化学键的化合物。
在共价键中,原子通过共享电子对来实现电子配置的稳定。
这种共享使原子围绕中心原子形成稳定的分子构型。
2. 什么是化合价数值?化合价数值指的是一个原子通过共享电子参与共价键时的电子数目。
化合价数值决定了原子在共价键中的电荷分布和化学键的属性。
氧气分子(O₂)中的每个氧原子的化合价数值为2,表示每个氧原子共享了2个电子对。
3. 如何确定化合价数值?化合价数值的确定涉及到电子亲和性、电子亲合力以及共享电子对的数量。
一般来说,元素的化合价数值等于其单个原子所能形成的共价键的数量。
然而,也有一些特殊情况需要考虑,例如键长、离子性等因素。
4. 化合价数值对化合物的特性的影响化合价数值的改变会导致化合物的性质发生变化。
氮气(N₂)和一氧化氮(NO)都是氮的共价化合物,但它们的化合价数值不同。
氮气中氮的化合价数值为3,而一氧化氮中氮的化合价数值为2。
由于化合价数值的差异,氮气具有稳定性,而一氧化氮则具有较强的活性。
5. 共价化合物化合价数值的应用共价化合物的化合价数值对于预测和解释化学反应具有重要意义。
它可以用来确定反应物和产物之间的电子转移、电荷分布以及电子密度的变化。
通过了解化合价数值,我们可以更好地理解和解释化学反应的速率、选择性以及产物的稳定性。
6. 我对共价化合物化合价数值的理解在我的理解中,共价化合物化合价数值不仅是描述化学键性质的一种方式,也是解释化学反应的基础。
化合价数值的变化会影响原子之间电荷的分布和电子共享的程度,从而影响分子的结构和性质。
化合物及化合价

化合物及化合价化合物及化合价⼀: 酸: 电离时得到的阳离⼦全都是H+的化合物。
分类1:(1)含氧酸:如:H2SO4,H2CO3(2)⽆氧酸:如:HCl,H2S2:(1)⼀元酸:如:HCl,HF(2)⼆元酸:如H2SO4,H2CO3(3)三元酸:如H3PO4⼆.碱电离时得到的阴离⼦全都是OH-的化合物。
分类:(1)可溶性碱:如:NaOH,Ba(OH)2,KOH(2)不溶性碱:如:Fe(OH)3,Cu(OH)2三..盐就是电离时得到⾦属阳离⼦或铵根离⼦和酸根阴离⼦的化合物。
分类:1:可溶性盐:如:NaCl,MgSO4 不溶性盐:如:BaSO4,CaCO3,AgCl2:正盐:如NaCl,MgSO4,BaSO4,CaCO3,AgCl酸式盐:如:NaHCO3, KHCO3,NaHS碱式盐:如:Mg(OH)Cl,Cu2(OH)2CO3四..氧化物:由两种元素组成的,且其中⼀种元素为氧元素的化合物. 分类: 酸性氧化物:如:CO2,SO2,SO3,P2O5.碱性氧化物:如:CaO,Na2O,K2O两性氧化物:如:Al2O3不成盐氧化物:如:CO⼀、元素化合价的规律(1)化合价原则:在化合物⾥,元素正负化合价的代数和为0. (2)在化合物⾥,H 通常显+1价,O通常显-2价。
(3)⾦属元素通常是正价,⾮⾦属元素通常是负价,(但在⾮⾦属氧化物⾥,氧显负价,另⼀⾮⾦属元素显正价)。
(4)单质分⼦⾥,元素的化合价为零。
(5)许多元素具有可变化合价。
例如:Fe有+2、+3价;Cl有-1、+1、+3、+5、+7价。
(6)原⼦团的化合价由构成元素原⼦的正负化合价的代数和算出,“根”的化合价⼀定不为0.例如:常见元素(原⼦团)的化合价⼆、化合价规律的应⽤在化合物⾥,各元素正负化合价的代数和为零。
这⼀原则是计算化学式⾥元素化合价的根据,也是判断化学式是否正确的依据。
化合价规律的应⽤如下:(1)根据化合价原则,书写化学式。
例如:书写硫酸铝的化学式。
有机化合物的化合价代数和

有机化合物的化合价代数和共有机化合物的化合价代数和。
1. 前言有机化合物是由碳和氢组成的化合物,同时也可能包含其他元素,如氧、氮、硫等。
在有机化学中,了解有机化合物的化合价代数和是非常重要的,因为它决定了化合物的结构、性质和反应方式。
本文将深入探讨有机化合物的化合价代数和的概念和应用。
2. 什么是化合价代数和?化合价代数和表示化合物中所有原子的化合价之和。
化合价是指元素与其他元素形成化合物时所表现出的电荷状态。
它反映了原子中的电子数目以及与其他原子之间的电荷转移和共享情况。
化合价代数和可以通过化学式的分子式来计算,其中每个原子的化合价乘以其个数,然后求和。
3. 如何计算化合价代数和?计算化合价代数和需要了解化合物中各个原子的化合价。
化合价的确定可以根据元素的电子构型和化合物的共价键的形成来进行。
对于大部分有机化合物而言,碳的化合价为4,氢的化合价为1,氧的化合价为2,氮的化合价为3,硫的化合价为2。
其他元素的化合价需要通过参考化合物或进一步的化学性质确定。
4. 化合价代数和的应用化合价代数和在有机化学中有着广泛的应用。
它可以用来确定化合物的分子式、结构和式量。
通过计算化合价代数和,我们可以快速确定一个未知有机化合物的分子式,进而推测它可能的结构。
化合价代数和也与化合物的性质和反应有关。
化合物的化合价代数和较高,往往表示较高的化学活性和反应性。
化合价代数和对于有机化合物的命名和分类也起着重要的作用。
根据化合价代数和的大小,我们可以将有机化合物分为饱和化合物和不饱和化合物,进一步细分为醇、酮、醛、酸等不同类别。
5. 个人观点和理解对我而言,化合价代数和代表着有机化合物的基本特征和特性。
通过计算和比较化合价代数和,我们可以获得有关化合物结构、性质和反应的有用信息。
而且,化合价代数和的概念也为我理解和学习有机化学提供了框架和指导。
通过深入了解和应用化合价代数和,我能更好地解决和分析有机化学问题,进而提高我的实验和研究水平。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化合物及化合价
一: 酸: 电离时得到的阳离子全都是H+的化合物。
分类1:(1)含氧酸:如:H2SO4,H2CO3
(2)无氧酸:如:HCl,H2S
2:(1)一元酸:如:HCl,HF
(2)二元酸:如H2SO4,H2CO3
(3)三元酸:如H3PO4
二.碱电离时得到的阴离子全都是OH-的化合物。
分类:(1)可溶性碱:如:NaOH,Ba(OH)2,KOH
(2)不溶性碱:如:Fe(OH)3,Cu(OH)2
三..盐就是电离时得到金属阳离子或铵根离子和酸根阴离子的
化合物。
分类:
1:可溶性盐:如:NaCl,MgSO4 不溶性盐:如:BaSO4,CaCO3,AgCl
2:正盐:如NaCl,MgSO4,BaSO4,CaCO3,AgCl
酸式盐:如:NaHCO3, KHCO3,NaHS
碱式盐:如:Mg(OH)Cl,Cu2(OH)2CO3
四..氧化物:由两种元素组成的,且其中一种元素为氧元素的化合物. 分类: 酸性氧化物:如:CO2,SO2,SO3,P2O5
.碱性氧化物:如:CaO,Na2O,K2O
两性氧化物:如:Al2O3不成盐氧化物:如:CO
一、元素化合价的规律
(1)化合价原则:在化合物里,元素正负化合价的代数和为0. (2)在化合物里,H 通常显+1价,O通常显-2价。
(3)金属元素通常是正价,非金属元素通常是负价,(但在非金属氧化物里,氧显负价,另一非金属元素显正价)。
(4)单质分子里,元素的化合价为零。
(5)许多元素具有可变化合价。
例如:Fe有+2、+3价;Cl有-1、+1、+3、+5、+7价。
(6)原子团的化合价由构成元素原子的正负化合价的代数和算出,“根”的化合价一定不为0.例如:
常见元素(原子团)的化合价
二、化合价规律的应用
在化合物里,各元素正负化合价的代数和为零。
这一原则是计算化学式里元素化合价的根据,也是判断化学式是否正确的依据。
化合价规律的应用如下:
(1)根据化合价原则,书写化学式。
例如:书写硫酸铝的化学式。
①正价左,负价右:
②交叉约简定个数:
③写右下,验正误:Al2(SO4)3(+3)×2+(-2)×3=0
(2)根据化合价原则,计算未知元素的化合价。
例如:计算H2RO3中R元素的化合价。
②列出式子求解:
(3)根据化合价原则,判断化学式的正误。
例如:判断碳酸钾(KCO3)的化学式是否正确。
②计算正负化合价代数和是否为零:
所以给出的化学式是错误的,正确的化学式应为:
怎样确定化合价
化合价由正、负和数值的两个方面来表示。
1.元素的化合价是元素的一种性质。
2.这种性质是不同元素的原子在相互化合时表现出来的。
3.什么性质呢?它就是一种元素一定数目的原子和其他元素一定数目的原子相化合即化合的各元素的原子个数比是确定的。
4.元素的这种性质是由其原子结构决定的。
还记得离子化合物和共价化合物是怎样形成的?离子化合物是由阴、阳离子相互作用而构成的。
共价化合物是以共用电子形成分子的。
由于形成方式不同,所以在离子化合物或共价化合物中元素化合价的实质是不同的。
1.离子化合物中,元素化合价的数值,就是这种元素的一个原子得失电子的数目。
失为正价,得为负价。
2.共价化合物中,元素化合物的数值就是这种元素的一个原子和其它元素的原子形成的共用电子对的数目。
电子对偏离哪种原子,那种元素为正价,偏向哪种原子,那种元素为负价。
3.单质中元素的化合价为零。
4.在化合物中正、负化合价代数和为零。
化合价和化学式之间有密切的联系,我们如何根据物质的化学式标出元素的化合价呢?
5.化合价和化学式的关系
例题1:标出氢氧化钠中各元素的化合价。
解:(1)写出氢氧化钠的化学式:
(2)元素符号的正上方标出化合价:
(3)检查正、负化合价的代数和是否为零:
例题2:试确定氯酸钾中氯元素的化合价。
解:(1)写出氯酸钾的化学式:KclO3
(2)查表得出钾元素为+1价,氧元素为-2价,氯元素有-1价、+1价、+5价、+7价等。
(3)根据化合物中各元素正、负化合价的代数和为零求出氯元素的化合价。
设氯元素的化合价为x。
1+x+(-2)×3=0 则
x=6-1=+5
(4)标出各元素的化合价
【注意】标化合价的方式与离子表示方式的不同。
我们已经学习了根据物质的化学式求元素的化合价,现在我们来研究如何根据化合价写出物质的化学式。
根据化合价写出化学式
例题:试写出+4价氮的的氧化物的化学式。
解:①按正价元素在左、负价元素在右的原则写出组成化合物的元素符号,并标出化合价:
②求出两种元素化合价绝对值的最小公倍数:4
③求各元素的原子数:N:4/4=1 O:4/2=2
④把原子数标在相应元素符号的右下角,即得化学式:
⑤检查各元素正、负化合价的代数和是否为零。
【说明】只有确实知道有某种化合物存在,才能根据元素的化合价写出它的化学式。
确定元素化合价的方法
一定数目的一种元素的原子跟一定数目的其他元素的原子化合的性质,叫元素的化合价。
它是元素的一个重要性质,确定元素的化合价是初中生应掌握的一种基本技能。
一、根据与其他元素组成的化合物化学式确定
二、根据元素的原子电子层结构特征确定
三、根据相对原子质量及该元素在化合物中的质量分数或各元素间质量比确定
四、根据质量守恒定律确定
五、根据元素所形成的不同化合物相对分子质量确定
六、根据反应中的质量关系,计算确定
七、根据相关因素,讨论确定
习题精选
一、选择题
1、下列说法正确的是:
A.水中的氢元素化合价为零
B.不同条件下,铁元素可显+2价和+3价
C.在MgCl2中,镁原子得到了2个电子成为+2价
D.化合物中元素化合价的数值,即该元素的原子得失电子的数目。
2、某元素+3价阳离子的核外电子数与氖原子相同,这种元素的元素符号是()
A.O B.Na C.Mg D.Al
3、下列化学式中不正确的是()
A.MgCl2 B.Na2S C.FeCl3D.Na2CO3
4、某含硫元素的氧化物中,硫元素与氧元素的质量比1:1,该氧化物中硫元素的化合价为:()
A.+2 B.+3 C.+4 D.+1
5、Ca(ClO)2中氯元素的化合价是()
A.-1 B.+1 C.+2 D.+3
6、某元素R无变价,其氧化物的化学式为R2O3,下列有关R形成的化合物化学式可能正确的是()
A.NaRO2B.R(OH)2C.RPO4 D.R2NO3
7、下列化合物中,锰元素的化合价最高的是()
A.KMnO4 B.MnO2C.K2MnO4 D.MnCl2
8、一种元素R的相对原子质量为56,它的氧化物中R元素和氧元素的质量比为7:3,则R的化合价是()
A.+1 B.+2 C.+3 D.+4
9、A和B两种元素,其原子量分别是14和16,化合价分别是+4和+2,则A和B形成化合物C的式量为()
A.30 B.46 C.44 D.60
10、某元素的相对原子质量为24,化合价为+2价,则它的氧化物中含该元素的质量分数为()
A.40% B.24% C.60% D.16%
11、某+2价金属元素的氯化物中含氯元素55.9%,则该金属元素是()
A.Fe B.Mg C.Cu D.Ca
12、已知A元素的第三电子层有3个电子,B元素的第二电子层有6个电子,A和B形成的化合物的化学式为()
A.AB B.A2B C.AB3 D.A2B3
13、原子失去最外层电子和在最外层得到电子后,一定不会引起改变的是:()
(1)元素种类(2)化学性质(3)相对原子质量(4)微粒的电性(5)原子核(6)电子层数(7)最外层电子数(8)核外电子总数
A.(1)(3)(5) B.(2)(4)(6)(8) C.(2)(5) D.(1)(5)
14、X和Y两种元素间可以形成多种化合物。
在X2Y中X和Y 的质量比为7:4,那么在X2Y3中X和Y的质量比是()A.B.C.D.
15、某元素R的化合价是奇数(无变价),已知某氧化物的式量为m,某氯化物的式量为n,则R的化合价为()
A.2(m-n)/55 B.2(n-m)/55 C.2m-n/55 D.2n-m/55
二、填空题
1、写出下列符号中“2”的意义
(1)2Mg ________ (2)Mg2+ _____
(3)____ (4)2Na+_ ___ _
2、写出下列物质的化学式:
(1)氧化铁______ (2)硫酸钠______(3)氧化钠___________ (4)碳酸钾_____(5)氢氧化钠______ (6)氯化钡__________
三、计算题
某+6价元素R的氧化物中,氧元素的质量分数为60%,计算
(1)R元素的相对原子质量(2)该氧化物的式量。
