2020年高考二轮复习非金属元素及其重要化合物
第11讲 常见非金属及其重要化合物(课件)-2023届高考化学二轮复习(全国通用)

化学
2023
二轮精准复习45讲
第11讲
常见非金属及其重要化合物
有关非金属元素单质及其化合物的性质和用途的思维途径
1.硅及其化合物
(1)硅及其化合物的“价类二维”转化。
理清知识主线:
-
H4
-
H4
+
O
+
+
O2
+
O2(H2 O3)
(2)重要反应的方程式。
ClO-+Cl-+2H+═Cl2↑+H2O
⑦将SO2和Cl2混合,漂白性减弱的原因(用离子方程式表示)。
SO2+Cl2+2H2O
+
4H +S +2Cl
(3)扫除易忘知识盲点。
①液氯密封在钢瓶中,而氯水、次氯酸应保存在棕色试剂瓶中。
②酸性KMnO4溶液应用硫酸酸化。
酸化KMnO4溶液不能用盐酸,也不能用硝酸
③ClO-不论在酸性环境中还是在碱性环境中均能体现强氧化性,如ClO-与
-、Fe2+均不能大量共存。
、I
SO23
④当Fe与Cl2在加热条件下反应时,不论Fe过量还是不足,由于Cl2的强氧化
性,产物一定是FeCl3。
⑤“84”消毒液的有效成分为NaClO,漂粉精的有效成分为Ca(ClO)2。“84”消
3S↓+3H2O
④书写下列反应的化学方程式。
a.将 SO2 通入 H2S 溶液中。
2H2S+SO2
3S↓+2H2O
b.Cu 与浓硫酸混合加热。
Cu+2H2SO4(浓)
高考化学二轮复习专题4常见元素及其重要化合物学案新人教版
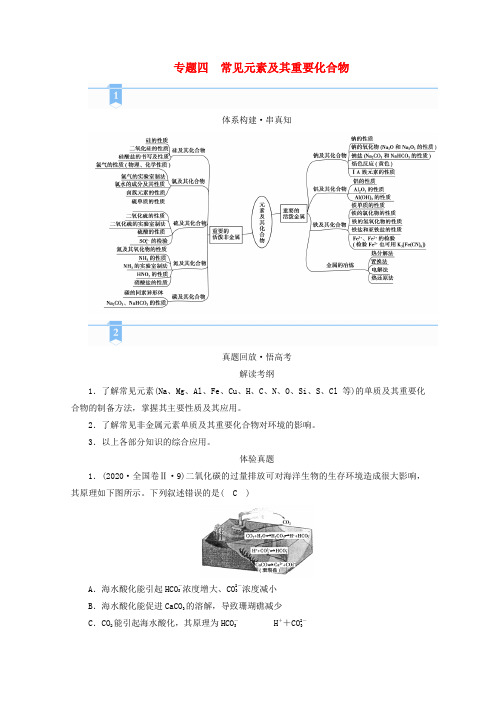
专题四常见元素及其重要化合物体系构建·串真知真题回放·悟高考解读考纲1.了解常见元素(Na、Mg、Al、Fe、Cu、H、C、N、O、Si、S、Cl等)的单质及其重要化合物的制备方法,掌握其主要性质及其应用。
2.了解常见非金属元素单质及其重要化合物对环境的影响。
3.以上各部分知识的综合应用。
体验真题1.(2020·全国卷Ⅱ·9)二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。
下列叙述错误的是( C )A.海水酸化能引起HCO-3浓度增大、CO2-3浓度减小B.海水酸化能促进CaCO3的溶解,导致珊瑚礁减少C.CO2能引起海水酸化,其原理为HCO-3H++CO2-3D.使用太阳能、氢能等新能源可改善珊瑚的生存环境【解析】海水酸化,H+浓度增大,平衡H++CO2-3HCO-3正向移动,CO2-3浓度减小,HCO-3浓度增大,A正确;海水酸化,CO2-3浓度减小,导致CaCO3溶解平衡正向移动,促进了CaCO3溶解,导致珊瑚礁减少,B正确;CO2引起海水酸化的原理为:CO2+H2O H2CO3H +浓度增大,C错误;使用太阳能、氢能等新能源,可以减少化石能源的燃烧,++HCO-3,导致H从而减少CO2的排放,减弱海水酸化,从而改善珊瑚礁的生存环境,D正确。
2.(2018·全国卷Ⅰ·7)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。
采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是( D )A.合理处理废旧电池有利于保护环境和资源再利用B.从“正极片”中可回收的金属元素有Al、Fe、 LiC.“沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠【解析】由于废旧电池中含有一些重金属离子等,所以合理的处理废旧电池有利于保护环境和资源再利用,A正确;根据流程可知,正极片中的金属元素主要有Al、Fe、 Li三种金属,所以从“正极片”中可回收的金属元素有Al、Fe、 Li三种金属,B正确;由于含磷酸亚铁锂滤渣被混酸溶解,而混酸具有强氧化性,所以溶解后铁元素以Fe3+的形式存在,故“沉淀”反应的金属离子为Fe3+,C正确;由于硫酸锂是可溶性盐,所以用硫酸钠代替碳酸钠无法沉淀锂离子,D错误。
高考化学第二轮复习专题非金属及其化合物PPT课件

1.了解硫的物理性质及硫的可燃性。
5
硫及其氧化 物
2.了解二氧化硫与氧气、与水的反应及二氧化硫的 实验室制法。 3.认识二氧化硫的漂白作用与次氯酸的漂白作用
的区别。
1.了解浓硫酸的强氧化性。
6
硫酸及硫酸 2.了解 SO42- 检验方法。 工业 3.了解硫酸的工业制法。
4.初步学会多步反应的计算方法。
下与之缓慢反应
化学性 质
与 H2O 反 应
与碱反应
与酸反应
与有机物 反应
Cl2、Br2、I2 与水反应,既作氧化剂, 又作还原剂;C 与水高温下反应,其
余不反应
Cl2、Br2、I2 与碱反应;Si 与强碱反应; S 与热碱液反应,其余不反应
Cl2、Br2、I2、O2 与还原性酸如 H2SO3、 H2S 反应;S、C 与强氧化性酸如浓 HNO3、浓 H2SO4 反应 O2 与有机物发生氧化反应; 卤素单质与有机物可发生取代反应和
3
卤素的性质 与溴、碘的
提取
1.以氯为例,了解卤素的物理性质和化学性质。 2.从原子的核外电子排布,了解卤素(单质、化合物) 性质的递变性与原子结构的关系。 3.了解海水中提取溴、海带中提取碘。
4
氯及其化合 物的主要性 质及其应用
1.掌握氯气、氯水的化学性质。 2.了解几种重要的含卤素化合物的性质和用途。 3.掌握 Cl-的检验方法。 4.掌握 Cl2 的实验室制法。
实验二:三次滴定中平均每次消耗的 KMnO4 溶液体积
V=20.00
mL+19.98 3
mL+20.02
mL=20.00
mL。
5.00 mL H2O2 溶液中,n(H2O2)=
0.1000
高考第二轮复习——无机非金属元素及其化合物(学案含答案)

年级高三学科化学版本苏教版内容标题无机非金属元素及其化合物【本讲教化信息】一. 教学内容:无机非金属元素及其化合物二. 教学目标驾驭氯、氧、硫、氮、磷、碳、硅所在主族元素性质的相像性、递变规律和特别性;重点驾驭几种常见典型物质的物理性质和化学性质;驾驭硫酸、硝酸的化学性质;驾驭氯气、二氧化硫、一氧化氮、二氧化氮、二氧化碳、氨气、氢气的试验室制法和气体的收集与尾气的汲取。
三. 教学重点、难点常见非金属元素的性质及相互关系四. 教学过程:元素化合物是中学化学的主体,这部分内容与基本概念、基本理论相互渗透,与化学试验、化学计算联系紧密。
复习元素化合物,要运用规律、把握关键、抓住重点、联系实际、编织元素化合物的科学体系。
元素化合物学问复习中要留意相像、相近内容的总结归纳。
如SO2、CO2、SO3、P2O5、SiO2等都是酸性氧化物,它们的性质有相像之处也有相异点。
高考命题时常会把这种关系编入试题中。
近几年的高考试题中这种趋向比较明显,值得大家重视。
说明:1. 氯元素的学问网络2. 次氯酸、漂白粉的性质HClO分子的结构式为H-O-Cl(氧处于中心),所以电子式为。
次氯酸、次氯酸钙等有多方面的性质,常常用到以下几方面性质:(1)HClO是一种弱酸,与碳酸比较电离实力有如下关系:H2CO3>HClO>HCO3-,请分析下列反应:少量二氧化碳通入NaClO溶液中:NaClO + CO2+H2O=NaHCO3+HClO氯气通入碳酸氢钠溶液中:Cl2+NaHCO3=NaCl+CO2↑+HClO(2)ClO-是一种弱酸的酸根离子,能发生水解反应:ClO-+H2O HClO+OH-,所以次氯酸钙溶液显碱性。
若遇到铁盐、铝盐易发生双水解:3ClO-+Fe3++3H2O=Fe(OH)3↓+3HClO(3)HClO和ClO-都具有强氧化性,无论酸性、碱性条件下都可以跟亚铁盐、碘化物、硫化物等发生氧化还原反应,但不能使品红溶液褪色。
(新课标)2020高考化学二轮复习第Ⅱ(四)物质结构与性质(选考)[含答案]
![(新课标)2020高考化学二轮复习第Ⅱ(四)物质结构与性质(选考)[含答案]](https://img.taocdn.com/s3/m/4bb0060c51e79b896902265e.png)
四羰基镍的晶体类型是________,写出一种与其配体互为等电子体的分子的化学式:
________。
(4)血红素铁是血液的重要组成部分,其结构如下图。
其中 C 原子的杂化方式为____________,N 与 Fe 之间存在的相互作用是
____________。在人体内合成血红素铁的基本原料之一为甘氨酸(
啶配体中 C 原子的杂化方式有__________。
(4)从电负性角度解释 CF3COOH 的酸性强于 CH3COOH 的原因:____________________。 (5)C60 与金刚石互为同素异形体,从结构与性质之间的关系解释 C60 的熔点远低于金刚 石的原因是
____________________________________________________________________。
),甘氨酸分子
中的 σ 键和 π 键的个数比为______。
(5)Ni2+和 Fe2+的半径分别为 69 pm 和 78 pm,则熔点 NiO______FeO(填“<”或“>”)
。
(6)嫦娥三号卫星上的 PTC 元件(热敏电阻)的主要成分钡钛矿的晶体结构如图所示,边
长为 a cm。顶点位置被 Ti4+所占据,体心位置被 Ba2+所占据,所以棱心位置被 O2-所占据。
非选择题规范练(四) 物质结构与性质(选考)
(建议用时:40 分钟) 1.B、C、N、Si 是常见的几种重要非金属元素,其形成的各种化合物在自然界中广泛 存在。 (1)基态硅原子的核外电子排布式为____________。B、C、N 元素原子的第一电离能由 大到小的顺序为________________。 (2)BF3 与一定量的水可形成如图甲所示晶体 R。
高考化学二轮专题复习课件第11讲常见非金属元素及其化合物

答案:(3)吸收尾气(Cl2)
AC
(4)过滤 少量(冷)水洗涤
(5)紫 小于
【变式 2】溴化锂是一种高效的水汽吸收剂和空气湿度调节剂。工业上以 碳酸锂为原料制备 LiBr·H2O 的流程如下:
已知: ①Br2+H2O===HBr+HBrO; 3Br2+3H2O===5HBr+HBrO3。 ②HBrO、HBrO3 具有强氧化性。
答案:C
4.(2019·全国卷Ⅲ)下列实验不能达到目的的是( )
选项
目的
实验
A 制取较高浓度的次氯酸溶液
将 Cl2 通入碳酸钠溶液中
B
加快氧气的生成速率 在过氧化氢溶液中加入少量 MnO2
C 除去乙酸乙酯中的少量乙酸 加入饱和碳酸钠溶液洗涤、分液
D 制备少量二氧化硫气体 向饱和亚硫酸钠溶液中滴加浓硫酸
答案:B
3.(2020·山东卷)下列关于 C、Si 及其化合物结构与性质的论述错误的是
() A.键能 C—C>Si—Si、C—H>Si—H,因此 C2H6 稳定性大于 Si2H6 B.立方型 SiC 是与金刚石成键、结构均相似的共价晶体,因此具有很高
的硬度 C.SiH4 中 Si 的化合价为+4,CH4 中 C 的化合价为-4,因此 SiH 还原性
答案:(1)圆底烧瓶饱和食盐水 (2)水浴加热 Cl2+2OH-===ClO-+Cl-+H2O 避免生成 NaClO3
(3)d 的作用是____________,可选用试剂________(填字母)。
A.Na2S
B.NaCl
C.Ca(OH)2
D.H2SO4
(4) 反 应 结 束 后 , 取 出 b 中 试 管 。 经 冷 却 结 晶 ,
解析:(3)Cl2 有毒,故装置 d 中可选用 Na2S 还原或用 Ca(OH)2 溶液吸收, 进行尾气处理;
高三化学二轮复习 专题四 学案12 常见无机物及应用

③ Cu 在潮湿的空气中被腐蚀的化学方程式: 2Cu+CO2+H2O+O2===Cu2(OH)2CO3 。 ④与氧气反应条件不同,反应产物不同的是 Na、Fe 。
基础知识回扣
(2)上述四种金属的氧化物中:
学案12
①能用作供氧剂的是 Na2O2 ,写出一个化学方程式: 2Na2O2+2CO2===2Na2CO3+O2 。
基础知识回扣
学案12
1.金属单质及其化合物 (1)Na、 Al、Fe、 Cu 四种元素的单质中:
本 学 案 栏 目 开 关
①能与水剧烈反应的是 Na ,反应的离子方程式: + - 2Na+2H2O===2Na +2OH +H2↑ 。 ②能与 NaOH 溶液反应的是 Al ,反应的离子方程式:
2Al+2OH-+2H2O===2AlO- 2 +3H2↑;其中作氧化剂的是
本 学 案 栏 目 开 关
②既能溶于酸溶液又能溶于强碱溶液的是 Al2O3 , 离子方程式 + 3+ - Al O + 6H ===2Al + 3H O Al O + 2OH === 2 3 2 分别为 , 2 3
2AlO- 2 +H2O 。
③常温下为黑色固体的是 FeO、Fe3O4、CuO 。 (3)上述四种金属的氢氧化物中: ①易在空气中被氧化的是 Fe(OH)2,现象白色沉淀迅速变为灰
+
2+
化性最强的是 Fe3+ ,它腐蚀金属铜的离子方程式为 2Fe3++Cu===2Fe2++Cu2+ 。
基础知识回扣
学案12
2.非金属单质及其化合物 (1)C、 N、 O、 Si、 S、 Cl 等元素形成的单质中: ①属于空气主要成分的是 N2、O2 ,它们相互反应的化学方
本 学 案 栏 目 开 关
非金属元素及其化合物

非金属元素及其化合物最常见的非金属元素包括氧、碳、氮、硫、磷、氯、氢和硅等。
以下分别介绍一些常见的非金属元素及其化合物。
氧(O)是地球上最丰富的元素之一,占地壳质量的49.2%。
在化合物中,氧通常以氧分子(O2)的形式存在,是支持生命的必需气体。
氧气是我们呼吸过程中吸入的气体,同时还参与燃烧反应。
氧与许多元素的化合物被称为氧化物。
碳(C)是生命中最重要的元素之一、它是有机化合物的基础,包括脂肪、蛋白质和碳水化合物等。
除了形成分子间键,碳还能形成与其他元素共价的键,形成无限多的化合物。
例如,二氧化碳(CO2)是一种重要的气体,它参与光合作用和呼吸过程。
氮(N)是氨基酸和核酸等生物分子的关键组成部分。
氮既形成氨分子(NH3)也形成亚硝酸(NO2)和亚硝酸盐等含氮化合物。
氮气(N2)是大气中的主要成分之一,氮气通过闪电、固氮细菌和工业生产过程等途径转化成可用的氮化合物。
硫(S)是一种黄色固体,在天然界中以硫矿石的形式存在。
硫通常以硫化物形式存在,如硫化氢(H2S)和二硫化碳(CS2)。
硫还参与形成许多其他化合物,如硫酸和亚硫酸。
磷(P)是DNA、RNA和ATP等核酸分子的重要组成部分。
磷与氧形成的磷酸盐在能量传递和储存的过程中起着重要作用。
在自然界中,磷主要以磷酸盐的形式存在,并广泛应用于农业肥料。
氯(Cl)是一种非金属卤素,在自然界中以氯化物的形式广泛存在。
氯被广泛应用于水处理、消毒和生产塑料等工业过程中。
氯还是盐酸(HCl)的组成部分。
氢(H)是宇宙中最丰富的元素,几乎在所有化合物中都有出现。
氢气(H2)是一种清洁的能源,并被广泛应用于燃料电池技术。
硅(Si)是地壳中的第二大成分,占地壳质量的27.7%。
硅是生命体中最常见的非金属元素之一,也是硅酸盐矿物的重要成分。
硅在电子行业中广泛应用于制造半导体材料。
2020年高考化学二轮专题复习测试《金属及其化合物》含答案

绝密★启用前2020年高考化学二轮专题复习测试《金属及其化合物》本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间90分钟。
第Ⅰ卷一、单选题(共10小题,每小题4.0分,共40分)1.下列叙述正确的是()A.用锡焊接的铁质器件,焊接处易生锈B.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClOC.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体D.将钝化后的铝条放入CuSO4溶液中无现象,说明铝的金属性弱于铜2.设阿伏加德罗常数的值为N A,下列说法正确的是 ()A. 1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为N AB. 1 mol Na2O2与足量CO2反应时,转移2N A个电子C. 1 mol·L-1的NaOH溶液中含Na+数目为N AD. 1 mol Na2O2晶体中含有的阴离子数目为2N A3.氧化亚铁溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述白色沉淀和残渣分别是()A. Fe(OH)3Fe2O3B. Fe(OH)2Fe2O3C. Fe(OH)2Fe(OH)3D. Fe(OH)2Fe3O44.下列关于钠、钾的说法正确的是()①钠的熔点比钾的熔点高②钠和钾在空气中燃烧的产物都是过氧化物③钠和钾性质活泼且都是短周期元素④钠和钾的合金常用作原子反应堆的导热剂A.①②B.②③C.③④D.①④5.向分别盛有100 mL水、100 mL 0.1 mol·L-1盐酸、100 mL 0.01 mol·L-1NaOH溶液的X、Y、Z三个烧杯中各投入0.05 mol Na。
下列有关说法正确的是()A.三个烧杯中均会发生的离子反应为2Na+2H2O===2Na++2OH-+H2↑B.三个烧杯中钠均在液面上剧烈反应,且X烧杯中反应最剧烈C.三个烧杯反应后,溶质的物质的量浓度相同D.三个烧杯反应后,生成的气体的质量一定相同6.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:方案Ⅰ:铜铝混合物测定生成气体的体积方案Ⅱ:铜铝混合物测定剩余固体的质量下列有关判断中不正确的是()A.溶液A和B均可以是盐酸或NaOH溶液B.溶液A和B均可以选用稀硝酸C.若溶液B选用浓硝酸,则测得铜的质量分数偏小D.实验方案Ⅱ更便于实施7.A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。
高考化学二轮冲刺复习精讲第一部分必考部分第10讲非金属及其化合物课件

[分点突破] 角度:非金属单质及其化合物的性质与应用 1.(2018·四川成都实验外国语学校检测)下列变化的实质相 似的是( ) ①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小 ②二氧化硫和氯气均能使品红溶液褪色 ③二氧化硫能使品红溶液、溴水褪色 ④氨气和碘化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸用铁制容器盛放、加热条件下浓硫酸能与木 炭反应
(2)氯及其化合物之间的转化关系
图中标号的化学方程式: ①Cl2+SO2+2H2O===H2SO4+2HCl ②2Fe+3Cl2=点==燃==2FeCl3 或 Cu+Cl2=点==燃==CuCl2 ③Cl2+2NaOH===NaCl+NaClO+H2O ④2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O ⑤MnO2+4HCl(浓)==△===MnCl2+Cl2↑+2H2O ⑥2NaCl+2H2O=电==解==2NaOH+Cl2↑+H2↑
发展,可以说“硅是信息技术革命的催化剂”。⑤碳酸钡可做 X
光透视肠胃的药剂。⑥有机物可B.③④⑥
C.①④⑦
D.②③⑤
[解析] ①铅笔芯的原料是石墨,错误;②一氧化碳难溶于 水,放置数盆水不能吸收一氧化碳,错误;③“汽水”浇灌植物 有一定道理,其中二氧化碳的缓释,有利于作物的光合作用,正 确;④硅的提纯与应用,促进了半导体元件与集成芯业的发展, 可以说“硅是信息技术革命的催化剂”,正确;⑤碳酸钡溶于胃 酸(主要成分为盐酸)产生有毒的氯化钡,不能做 X 光透视肠胃的 药剂,错误;⑥有机物可用无机物合成,正确;⑦氯化钠中含有 氯元素,无毒,是常用的调味品,错误;故选 B。
③浓硫酸与金属活动顺序表中排在氢后面的金属反应时,不 论金属是否足量,酸均不可能消耗完,还原产物只有 SO2。
高考化学二轮复习 第三单元 专题11 常见非金属元素单质及其化合物课件

b.用酸化的 AgNO3溶液检验白雾,产生白色沉淀。 ①实验 a 目的是__________。 ②由实验 a、b 不能判断白雾中含有 HCl,理由是 ____________________________________________。
(4)现象Ⅱ中溶液变为黄绿色的可能原因:随溶液 酸性的增强,漂粉精的有效成分和 Cl-发生反应。通
【解析】Cl2 通入一定浓度的苛性钾溶液中,可发 生如下两个反应:低温时 Cl2+2KOH===KCl+KClO +H2O,较高温度时 3Cl2+6KOH===5KCl+KClO3
+3H2O,当生成 0.06 mol KClO、0.03 mol KClO3 时,
分别对应生成 0.06 mol KCl、0.15 mol KCl,所以苛性 钾 溶 液 中 KOH 的 质 量 是 (0.06 + 0.03 + 0.06 + 0.15)mol×56 g·mol-1=16.8 g;转移电子的物质的量 为(0.06+0.03×5)=0.21 mol;反应后溶液中 Cl-的物质 的量为(0.06+0.03×5)=0.21 mol;由于反应过程放 热,随着反应的进行,溶液的温度逐渐升高,生成
过进一步实验确认了这种可能性,其实验方案是 _____________________________________________。
(5)将 A 瓶中混合物过滤、洗涤,得到沉淀 X。
①向沉淀 X 中加入稀 HCl,无明显变化。取上层
清液,加入 BaCl2 溶液,产生白色沉淀。则沉淀 X 中 含有的物质是________。
3.以上各部分知识的综合应用。 (1)能根据所提供的信息或资料,获取并归纳元素 化合物的性质。
高考化学第二轮专题复习课周期表非金属元素

练习
VIIA 还原性
HF HCl HBr HI
氢化物还原性逐渐减弱
氢 化 物 还 原 性 逐 渐 增 强
氢 化即 物非 还金 原属 性性 愈愈 强弱 则 其
气态氢化物性质的递变规律
IVA VA 元素 CH4 NH3 氢化 SiH4 PH3 物化 ASH3 学式 VIIA 水溶液酸性 HF 氢 化 HCl 物 HBr 水 溶 H2S<HCl 2Te HI H 液 酸 性 氢化物水溶液酸性逐渐增强 增 强 VIA H2O H2S H2Se
气态氢化物性质的递变规律
IVA VA 元素 CH4 NH3 氢化 SiH PH 4 3 物化 ASH3 学式 VIA VIIA 性质递变 H2O HF H2S HCl H2Se HBr H2Te HI
直线 形
分子 正四 三角 空间 面体 锥形 形状
V形
RH4的空间形状
RH3的空间形状
H2R的空间形状
氢化物可燃性大小的变化规律
一个零族
周期表和原子结构的联系
IA IIA IIIA VIA VA VIA VIIA 0
主族序数=最外层电子数 =最高正价
1 2 3 +1 +2 +3
4 5 6 7 8 +4 +5 +6 +7
周期表和原子结构的联系
IA IIA IIIA VIA VA VIA VIIA 0
非金属负价=主族序数-8 =最外层电子数-8
H2Se HBr Br
H2Te HI I
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
√ (6)硅酸钠水溶液常用作木材防火剂和粘合剂。 ( )
× (7)可用磨口玻璃瓶保存NaOH溶液。 ( )
× (8)SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物。 ( ) × (9)因为晶体硅熔点高、硬度大,所以可用于制作半导体材料。 ( ) × (10)玻璃容器可长期盛放各种酸。 ( )
__滤__、___洗__涤__、__干___燥__、__称__量___,__质__量__为___m__g________________________________。
m ②α=_2_3_.3_c_0___×100%(用实验方案中的物理量表示)。
1.知识归纳
考点四 氮及其重要化合物
(1)知识主线
①氨气的发生装置可以选择上图中的__A__,反应的化学方程式为 ___________2_N_H_4_C_l_+__C_a_(O__H_)_2=_=_△=_=_=_C__a_C_l_2+__2_H_2。O+2NH3↑
(或 B NH3·H2O==△===NH3↑+H2O)
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为发
√ (11)某硅酸盐的化学式为KAlSi3O8,可用K2O·Al2O3·6SiO2表示。 ( )
(12)硅酸胶体的制备:人教版课本P76
硅胶和硅橡胶的区别
考点四 碳、硅及其重要化合物
1 核心精讲
1.树立物质转化思想 (1)理清知识主线
-4
0
+2
+4
CH4←― C ←― CO ―→ CO2
-4
0
+4
)
2. (2017·广东广州 3 月综合测试)SO2 的防治与利用对于环境保护意义重大。某小 组在实验室中对 SO2 的性质及回收利用等相关问题进行探究。
(1) 用下图装置制备纯净的 SO2,发生装置中反应的化学方程式为____________ _H__2_S_O__4_+__2__N__a_H__S_O__3_=_=_2__S_O__2_↑__+___2_H__2_O__+___N_a__2_S_O__4_______________________ ______________,装置的连接顺序:a→_b_→___c_→__g__→__f_→__d___(按气流方向,用小写字 母表示)。
× (2015·全国卷Ⅱ,13B)( )
(3)利用下图,根据①浓硝酸、②Na2CO3,③Na2SiO3溶液,可证明酸性:硝酸
>碳酸>硅酸
× (2014·新课标全国卷Ⅰ,13D)( )
(4)NH3的发生装置
(2012·上海,16B)( √ )
(5) NH3的收集、检验装置 如图
× (2012·上海,16D)( )
-3
0
+1
+2
+4
+5
N H3―→ N2―→ N 2O―→ N O―→ N O2―→ H N O3
(2)网络构建
N2O3、N2O4、N2O5
【基础回顾1】正误判断,正确的划“√”,错误的划“×”。
× (1)NH4HCO3受热易分解,可用作氮肥。(2016·江苏,3B)( )
(2)将浓硝酸溶液滴入用砂纸打磨过的铝条中,则产生红棕色气体
× (6) NH3易溶于水,可用作制冷剂(
(7)氮气的化学性质稳定可作保护气(
)
√)
× (8)浓氨水具有挥发性和还原性,可用浓氨水检验输送氯气的管道是否漏气(√)
(9)汽车尾气中含有NO,是由于汽油燃烧不完全造成的。( )
× (10)正常雨水的PH为5.6,酸雨的PH小于5.6,是由于溶解了二氧化碳的缘故。
4.二氧化硅与氢氟酸反应
5.制玻璃过程中纯碱参与的反应
①硅酸盐比碳酸盐稳定;②从化学平衡角度,由高沸点 难挥发固体SiO2制得低沸点易挥发的CO2气体。
2 题组集训
题组一 重要反应规范书写 1.用方程式回答下列问题。
(1)Mg在CO2中燃烧。2Mg+CO2=点==燃==2MgO+C
(2)“水滴石穿”的反应原理(用离子方程式表示)。 CaCO3+CO2+H2O===Ca2++。2HCO- 3 (3)“钟乳石”的形成过程(用化学方程式表示)。 CaCO3+CO2+H2O===Ca(H,CO3)2 Ca(HCO3)2==△===CaCO3↓+CO2↑+。H2O (4)向饱和Na2CO3溶液中通入过量CO2的离子方程式。
(1)利用
,根据①浓硫酸、②蔗糖、③溴水,证明浓硫酸具有脱水性、
氧化性
√ (20性和强氧化性
(2)利用
,根据①稀盐酸、②Na2SO3、③Ba(NO3)2溶液,证明SO2
× 与可溶性钡盐均可生成白色沉淀 (2014·新课标全国卷Ⅰ,13C)( )
× (3)SO2具有漂白性,所以可用于漂白纸浆和食品,还可用于杀菌消毒。( ) × (4)可用酒精或热的NaOH溶液除去附着在试管内壁上的硫。( )
2.三氯化硼(BCl3)是一种重要的化工原料。某兴趣小组拟选用下 列装置,用氯气和硼制备BCl3(已知BCl3的沸点为12.5 ℃,熔点 为-107.3 ℃;遇水剧烈反应生成硼酸和盐酸)。
(1)上述装置连接顺序为 a→ edjkbcfgh
。
(2)装置A中a管的作用是__导__气__。
装置C中饱和食盐水的作用是__除__去__C_l_2中__的__H__C_l_。 装置E的作用是?
√ (5) SO2和Cl2等体积混合通入溶液中,溶液无漂白性。( )
× (6)把SO2气体通入BaCl2溶液中,没有沉淀生成,再通入NH3仍没有沉淀产生( )
× (7)二氧化硫能使石蕊溶液先变红后褪色,体现了二氧化硫的漂白性( )
× (8)浓硫酸不能干燥碱性气体NH3和还原性气体H2S、SO2等。(
生装置→ d→c→f→e→i (按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应 将上述收集到的NH3充入注射器 X中,硬质玻璃管Y中加入少量催 化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下进行实验。
操作步骤
实验现象
解释原因
打开K1,推动注射器活塞,①Y管中_红__棕__色__气_ 使 X中的气体缓慢通入Y
C.新制氯水中含有的强氧化性的微粒有ClO-、HClO
D.常温下,用PH试纸分别测定相同浓度的NaClO溶液和NaHCO3溶 液的PH,可比较HClO和H2CO3的酸性大小 E.1molMnO2与足量的浓盐酸共热反应生成22.4LCl2 F.可将氯水保存在带有橡胶塞的棕色试剂瓶中
G.1molCl2参加反应,转移电子数一定为2NA
CHa.2向++C3aC(lCOl-O+)2S溶O2液+中H2O通=入==SCOa2S气O4体↓+,C其l-离+2子H方ClO程(少式量为SO:2) Ca2+C+a22+C+lO2-C+lO2S-O+2+S2OH2O+=H==2OCa=S=O=4C↓a+SO2C3↓l-++S2OH42C-+lO4H+(过量SO2)
1.知识归纳
考点二 硫及其重要化合物
(1)知识主线
-2
0
+4
+6
+6
H2 S ―→ S―→ S O2 (H2SO3)―→ S O3(H2 S O4)
-2
0
+4
+6
Na2 S ―→ S―→ Na2 S O3―→ Na2 S O4
(2)知识网络
H2O2
【基础回顾1】正误判断,正确的划“√”,错误的划“×”。
②α=__8_c_08-_c_0c_V_×100%(用实验方案中的物理量表示)。
方案 2:
①为该小组设计实验方案(不必描述操作过程的细节,物理量的数值用字母表 示):__向__反__应___后__的__溶__液___中__加__入__过___量__盐__酸__,___再__加__入__足___量__B_a_C_l_2_溶__液__,__将___沉__淀__过____
+4
SiH4 ←― Si ―→ SiO2(H2S i O3)
(2)形成网络构建
自然界中无游离态的硅,硅是制作光电池的材料。 SiO2不导电,是制作光导纤维的材料。
制硅胶、木材防火剂、黏合剂。
(3)重要化学反应书写
1.粗硅的制备 该反应必须在隔绝空气的条件下进行
2.硅与氢氟酸
3.硅与氢氧化钠溶液
二氧化硅的特性,不是两性氧化物。
考点五 碳、硅及其重要化合物
1.知识主线 -C4H4―→C0 ―→+C2O―→+C4O2 S-4iH4―→S0i ―→S+i4O2(H2S+4iO3) 2.知识网络
【(1基3)础N知H4识F水回溶顾液】中含判有断H正F误,,因正此确NH的4F画溶“√液”,不错能误存的放画于“玻×璃”。试剂瓶中。
_体__颜__色__慢__慢__变__浅__
②反应的化学方程式 __6_N_O__2+__8_N__H_3__催=_=_化△=__=剂_=
管中
___7_N_2_+__1_2_H_2_O
将注射器活塞退回原处并 Y管中有少量水珠
固定,待装置恢复到室温
生成的气态水凝聚
打开K2
③__Z_中__N_a_O__H_溶__液_ ④_反__应__后__气__体__分__子__数__减__少_, _发__生__倒__吸__现__象_ _Y__管__中_压__强__小__于__外__界__压__强_
该小组在实验室探究步骤Ⅱ时,一定条件下向 100 mL c0 mol·L-1(NH4)2SO3 溶液
通入空气后,欲测定溶液中(NH4)3SO3 的氧化率(α)。
方案 1:
①为该小组设计实验方案(不必描述操作过程的细节,物理量的数值用字母表
示):___取__2_0_._0_0_m__L_反__应___后__的__溶__液___于__锥__形__瓶___中__,__用__浓___度__为__c__m_o__l·_L_-_1_的__K_M__n__O_4_标__ ___准__溶__液___滴__定__,__重___复__滴__定__三___次__,__平__均__消___耗__K_M__n_O__4_溶__液__的__体___积__是__V__m__L___。
