酵母表达系统使用心得
酵母表达(1)

酵母表达引言酵母是一类单细胞真核生物,被广泛应用于生物学研究中。
酵母表达系统是指利用酵母细胞表达外源基因的技术,被广泛应用于蛋白质的高效表达和产量大规模生产。
本文将介绍酵母表达系统的原理、优势和应用。
原理酵母表达系统的核心原理是将外源基因导入酵母细胞,并通过酵母细胞的转录、翻译和修饰机制,使外源基因在酵母细胞中得到表达和功能发挥。
通常情况下,酵母表达系统主要采用酵母菌属的酿酒酵母(Saccharomyces cerevisiae)或毕赤酵母(Pichia pastoris)作为宿主细胞。
1.酵母转录机制:酵母细胞的基因表达主要通过RNA聚合酶Ⅱ进行转录,产生mRNA分子。
2.酵母翻译机制:酵母细胞通过核糖体进行翻译,将mRNA翻译成蛋白质。
3.酵母修饰机制:酵母细胞具有多种修饰酶,可以对蛋白质进行翻译后修饰,如糖基化、磷酸化等。
优势相比其他常用的表达系统,酵母表达系统具有一系列的优势:1.高效表达能力:酵母表达系统能够实现高水平的外源基因表达,产量可达到克级。
2.翻译后修饰:酵母细胞具有多种修饰酶,可以对蛋白质进行翻译后修饰,使蛋白质得到正确的糖基化等修饰。
3.生长条件简单:酵母菌生长条件相对简单,可以在常规培养基中进行培养,对培养条件的要求相对较低。
4.可溶性蛋白质表达:酵母细胞具有较强的蛋白质折叠和修饰能力,能够高效地表达可溶性蛋白质。
应用酵母表达系统广泛应用于以下领域:1.蛋白质研究:酵母表达系统可用于大规模蛋白质表达和纯化,为蛋白质的结构、功能和相互作用研究提供了高效的工具。
2.药物筛选:酵母表达系统可用于药物靶点鉴定和药物分子筛选,加速药物研发过程。
3.疫苗研究:酵母表达系统可用于疫苗候选抗原的高效表达和产量大规模生产。
4.代谢工程:酵母表达系统可用于代谢工程领域,利用酵母细胞对外源代谢产物的高效合成能力,实现产生复杂化合物的目标。
5.生物制药:酵母表达系统已经被广泛应用于生物制药领域,用于生产重组蛋白和抗体等生物药物。
酵母表达系统在植物功能基因组学研究中应用的局限性

植物生理学通讯 第42卷 第6期,2006年12月1168酵母表达系统在植物功能基因组学研究中应用的局限性潘维锋 李师鹏*山东师范大学生命科学学院,济南250014Yeast, a Model System to Elucidate Plant Gene Function: Application and Limi-tationPAN Wei-Feng, LI Shi-Peng *College of Life Sciences, Shandong Normal University, Jinan 250014, China提要 介绍了酵母表达体系在植物的功能基因组学研究中的应用,并对这一实验手段应用的局限性进行了分析,以期提醒研究者应全面理解采用这一体系所获得的实验数据,确保据此而作出的结论全面、可靠。
关键词 酵母;拟南芥;基因组学;酵母功能互补;功能基因组学随着DNA测序技术的不断完善,基因测序变得越来越经济、有效、可靠。
到2006年6月为止已经完成包括酵母、人类、拟南芥在内的21个真核生物基因组测序,另外还有126个真核生物基因组计划正在进行中(数据来源于NCBI数据库)。
这些前沿性工作导致了大量新基因的发现,为人们在基因组水平上研究生物的生长和发育等生命现象打下了基础。
单倍体啤酒酵母(Saccharomycescerevisiae)是1997年完成全基因组测序的,这是第一个完成的全基因组测序的真核生物。
整个酵母基因组包括约6 200个不含内含子的基因。
其中很多基因的功能已得到较为深入的研究,有关信息可以通过互联网在酵母基因组数据库中查到,如斯坦福大学的SGD (Saccharomyces GenomeDatabase)数据库。
迄今,整个酵母的95%以上的基因序列被系统敲除,不同的单基因敲除突变体可以从Invitrogen公司ATCC (American TypeCulture Collection)或EUROSCARF (European Sac-charomyces cerevisiae Archives for Functional Analysis)获得。
毕赤酵母表达系统在外源蛋白表达中的研究及应用

写一篇毕赤酵母表达系统在外源蛋白表达中的研究及应用的报
告,800字
毕赤酵母表达系统是一种高效、灵活的工具,可用于外源蛋白表达研究和应用。
它是一种重要的生物工程技术,可以实现外来基因的大规模表达,分子量可达到200 KD 以上。
目前,毕
赤酵母表达系统已成功地用于各类重要蛋白质的表达,并发挥了重要作用。
毕赤酵母表达系统的优势在于它能够表达复杂的蛋白质,而且不受细胞因子的限制,能够有效提高蛋白表达的效率。
此外,该系统还具有良好的原核性、容易稳定表达、灵活的改造等特点。
因此,毕赤酵母表达系统被广泛应用于外源蛋白表达和重组蛋白的研究中。
例如,已成功利用该系统彻底破解人工合成水稻Hsp70基因编码蛋白的结构,它同时也是人类在蛋白研
究中的有力工具。
毕赤酵母表达系统在医学研究中也得到了很大的发展。
比如,可以用毕赤酵母表达系统来研究和表达病毒血管瘤病毒(HPV)-695E5蛋白,而这种蛋白可能会加速病毒复制和细胞侵入,因
此有助于治疗HPV相关的癌症。
利用毕赤酵母表达系统还可
以大规模表达多肽,如α-肌动蛋白及其相关蛋白,从而探索
肌钙蛋白的生物学功能。
总的来说,毕赤酵母表达系统是一种重要的生物工程技术,它能够实现外来基因的大规模表达,受益于它的灵活性和稳定性,可以成功用于外源蛋白表达及其相关研究与应用中,是一项具有重大意义的研究。
酵母菌的遗传工程和表达系统

酵母菌的遗传工程和表达系统酵母菌是一种常见的单细胞真菌,广泛存在于自然界中。
由于其易于培养、生长速度快、基因组较小、剪接机制类似于哺乳动物细胞等优点,酵母菌成为了功能基因组学、代谢工程学、蛋白质工程学等领域中的重要模型生物。
而酵母菌的遗传工程和表达系统则为这些研究提供了基础和保障。
酵母菌的遗传工程主要包括基因克隆、拷贝数调控、基因敲除、基因组编辑、基因表达调控、代谢通路调控等方面。
其中,基因克隆是构建目的基因载体的重要步骤,一般通过 PCR 扩增或基于荧光报告基因的克隆方法来实现。
而拷贝数调控则指通过操纵载体的拷贝数,达到目的蛋白在酵母细胞中表达量的控制。
酵母菌具有高度重组能力以及泛素降解酶机制,因此基因敲除和基因组编辑等操作在酵母菌中较为容易实现。
基因表达调控则是酵母细胞酿酒业中的重要应用,通过调节转录、翻译后修饰等环节来实现产品的调控。
代谢通路调控则是通过调节酵母菌内一系列代谢酶的表达量或活性来增加特定产物的产量。
酵母菌的表达系统则包括基于质粒的表达和基于基因组的表达两种方式。
质粒表达是将目的基因克隆至质粒中,然后将质粒转化至酵母细胞中,通过调控拷贝数和选择适当的启动子及终止子等措施实现表达。
而基因组表达则是将基因克隆至某一位点上,在酵母菌表达生命周期较长的时期内带来更稳定的表达效果,尤其适用于连续表达大规模生物分子的场合。
同时,可以采用多个方面的策略来处理表达过程中可能出现的问题,从而进一步优化表达效率和表达质量。
例如在 translational initiation 上加入特定元件、利用内质网信号肽将蛋白定向到内质网,从而利用内质网发生的翻译后修饰增加表达质量等等。
总之,酵母菌的遗传工程和表达系统为现代生物技术研究和产业化提供了重要的平台,无论从理论研究还是实践应用的角度来看,都具有广泛的前景和应用价值。
我们期待,基于酵母菌的遗传工程和表达系统将吸引更多的生物学家、遗传学家、代谢工程师、蛋白质化学家等多个领域的专家和研究人员的关注,一起推进这一新兴领域的发展和进步。
酵母表达系统在药物研发中的应用研究

酵母表达系统在药物研发中的应用研究酵母表达系统是一种利用酵母菌将外源基因表达的技术。
它广泛应用于药物研发中,是一种重要的基础研究方法。
下面就来探讨一下酵母表达系统在药物研发中的应用研究。
一、酵母表达系统的基本原理酵母表达系统是利用酿酒酵母菌,将外来基因导入到酵母菌中,使其表达外源蛋白质。
外源基因通常以质粒的形式封装进入酵母细胞中,而通常采用的质粒是pYES2、pESC、pGADT等。
这些质粒都具备不同的特定序列,这些序列可以使酵母表达系统实现不同的功能。
在酵母菌表达外源蛋白的过程中,其主要遵循四个步骤:转录、翻译、修饰和定位。
其中,转录和翻译过程非常类似于真核细胞的情况,最终将形成蛋白质。
但是,由于酿酒酵母是一种真核细胞,因此它的蛋白质修饰和定位过程与真核细胞的过程也非常接近。
二、酵母表达系统在药物研发中的应用1. 基因筛选酵母表达系统是基因筛选的一种常用方法。
基因筛选是通过对外源基因随机插入到酵母细胞中,然后判断是否会导致生长缺陷或特定表型的改变。
这种方法常用于寻找与信号转导、代谢途径和基因调控等过程相关的基因。
2. 蛋白结构研究人类的某些蛋白在体内的折叠会受到转录后修饰的影响,出现拓扑结构的变化会对其功能产生很大影响。
利用酵母表达系统就能够在短时间内对蛋白质结构进行研究。
通过酵母菌表达外源蛋白的方法,可以使加入原蛋白质的一段序列在折叠时进行彻底的探究,便于寻找相应的结构域。
3. 药物筛选在药物研发中,酵母表达系统也常被用于药物筛选。
通过酵母表达外源蛋白的方法,可以筛选出一种或多种能够调控目标蛋白的物质,从而对药物进行优化。
例如,先在酵母菌中表达目标蛋白,在检测其功能后,针对它的活性位点进行筛选最优化的化合物。
这就是所谓的基于蛋白的药物发现。
三、酵母表达系统的优势和局限酵母表达系统在药物研发中有着广泛的应用,这是因为它具有许多优点。
首先,酵母表达系统简单、成本低。
其次,酵母表达系统样品预备时间短,能够快速得到高度纯净的蛋白质。
毕赤酵母表达系统原理

毕赤酵母表达系统原理《毕赤酵母表达系统那点事儿》嘿,朋友们!今天咱来唠唠毕赤酵母表达系统。
这玩意儿可有意思啦!你看啊,毕赤酵母就像是一个神奇的小工厂。
它呀,能把我们想要的东西给生产出来。
想象一下,它就像一个勤劳的小工匠,在自己的小天地里忙忙碌碌。
这个小工厂有自己的一套工作流程呢。
首先,我们得把我们需要表达的基因送进去,就好像给小工匠下达一个任务订单。
毕赤酵母接收到这个基因后,就开始开动啦。
它会利用自己身体里的各种零部件和原材料,一点一点地把这个基因表达出来,变成我们想要的蛋白质。
它可厉害了,能生产出各种各样的蛋白质。
就像一个万能的大厨,不管你要做什么菜,它都能给你做出来。
而且啊,它做出来的东西质量还挺高。
毕赤酵母还有个优点,就是它比较好养活。
不需要特别复杂的条件,给它点吃的喝的,它就能茁壮成长。
这就像咱家里养的小宠物,只要你稍微照顾一下它,它就能给你带来很多欢乐。
不过呢,毕赤酵母也不是完美的啦。
有时候它也会出点小差错,就像人一样,偶尔也会犯点小迷糊。
但这并不影响它的可爱和实用呀。
在实际应用中,毕赤酵母表达系统可是帮了大忙呢。
比如说在生物医药领域,很多药物的生产都离不开它。
它就像一个幕后英雄,默默地为我们的健康贡献着力量。
我记得有一次,我在实验室里研究一个项目,就是用毕赤酵母表达系统来生产一种蛋白质。
那时候真是费了不少心思,不断地调整各种条件,就盼着能得到高质量的产物。
经过一番努力,终于看到了成果,那一刻的心情真是无法用言语来形容。
总之呢,毕赤酵母表达系统是个很有趣也很有用的东西。
它虽然小小的,但却有着大大的能量。
它就像一颗闪亮的星星,在科学的天空中绽放着自己的光芒。
我们要好好利用它,让它为我们创造更多的价值呀!。
酵母表达系统在蛋白质工程中的应用

酵母表达系统在蛋白质工程中的应用在现代生物技术领域中,蛋白质工程无疑是一个越来越重要的领域。
蛋白质工程的目的就是为了通过合成、改造、再造蛋白质,让它们发挥更好的作用。
但要想顺利实现这个目标,首先需要一个强大的工具——酵母表达系统。
本文将着重讨论酵母表达系统在蛋白质工程中的应用。
一、酵母表达系统的概述酵母表达系统指的是用酵母作为外源基因表达的宿主系统。
通常我们所使用的酵母表达系统分为两大类:酵母菌株(氨基酸合成型酵母、酵母菌、诺霉菌等)和酵母质粒。
酵母表达系统具有诸多优点:(1)表达效率高,含量可达30%以上;(2)修饰完备,可形成天然蛋白质的完整结构;(3)简单方便,培养条件简单,易于大规模生产。
二、酵母表达系统在蛋白质工程中的应用1. 蛋白质的可合成性: 酵母表达系统不仅适用于表达人类基因,而且还可以表达来自其他生物体的蛋白质基因。
例如,酵母表达系统可以用来合成的大肠杆菌中无法表达的大分子蛋白质,如人源性因子VIII和因子IX。
2. 蛋白质的结构保护: 酵母表达系统在表达可溶性蛋白质时,可以避免因过量表达而引起的蛋白质不正确折叠、表达时段不对,以及蛋白质酶解等问题。
此外,酵母表达系统还可以进行多肽连接和修饰,从而提高蛋白质稳定性和活性。
3. 蛋白质结构改造: 酵母表达系统不仅适用于合成蛋白质,还可以将已知结构的蛋白质进行改造,如改变蛋白质的区域,添加、改变或缩短结构域等,使其得到改进。
例如,可以通过酵母表达系统制备出抗体、酶及酶替代剂等以及多个域之间衔接的蛋白质,这些蛋白质具有与天然蛋白质相同的生物活性,且更加稳定。
4. 蛋白质的特定细胞定位: 酵母表达系统的另一个重要优点在于可以针对性地调控蛋白的表达定位。
例如,可以将表达在酵母中的蛋白转运到特定的亚细胞区域中,从而实现细胞定位和功能分化。
此外,通过改变酵母中的蛋白质结构、质量和量,可以增加细胞发酵性能、生物转化过程和蛋白质反应的有效性。
三、酵母表达系统面临的挑战与以上的优点相对应,酵母表达系统也存在着一些挑战:(1)构建表达载体;(2)寻找适宜的宿主菌株;(3)了解基因调控和宿主代谢途径;(4)选择适合的培养条件等。
酿酒酵母表面展示表达系统及应用

。G P I 锚定区域与细胞蛋白的 C 端共价相 ?
连, 为蛋白与细胞膜提供稳定的连接。G P I 锚定蛋白的 C 端包含疏水多肽, 当细胞蛋白被合成, 前体蛋白通过 ? 羧基末端的疏水序列锚定在内质网膜上, 其余蛋白则 位于内质网的内腔中。在极短的时间内, 疏水序列在 P I 锚置换, 转酰氨基酶作用下 ω位点裂开并同时被 G 然后蛋白被运输到高尔基体再通过分泌途径分泌至细 胞膜外。在蛋白水解酶作用下, 分泌信号序列被切除, I P L C从细胞膜上释放以 G P I 锚定形式与 细胞蛋白被 P ?
2 ] 葡聚糖共价相连并被转运至细胞壁外 [ 。可在许多真 [ 3 ] 核生物的质膜蛋白中发现 G P I , 其结构高度保守。酵
生物活性的复杂蛋白。
1 酵母细胞表面展示表达系统构成
1 . 1 载 体 一个成功的表达载体应满足 4个条件: ( 1 ) 具有信 号肽序列, 使已经表达的融合蛋白能够被分泌至细胞 外; ( 2 ) 具有较强的定位结构使融合蛋白固定于细胞表 3 ) 与外源蛋白融合后, 载体蛋白的定 面而不能脱落; ( 位特性和外源蛋白的生物活性不会改变; ( 4 ) 在宿主菌 株中能稳定存在, 不会被细胞壁膜之间和培养基中的
中国生物工程杂志 C h i n aB i o t e c h n o l o g y , 2 0 0 8 , 2 8 ( 1 2 ) : 1 1 6~ 1 2 2
酿酒酵母表面展示表达系统及应用
郭 钦1 张 伟2 阮 晖1 何国庆1 ( 1浙江大学生物系统工程与食品科学学院 杭州 3 1 0 0 2 9 2温州医学院 温州 3 2 5 0 3 5 )
3 酿酒酵母细胞表面展示表达系统的应用
酵母表达系统

酵母表达系统基因表达是分子生物学领域的重要内容之一,人们利用基因表达技术制备各种目的基因的重组蛋白质,在分析基因的表达与调控、基因的结构与功能、基因治疗以及生物制药等领域均取得了令人振奋的成果。
其中,酵母表达系统拥有转录后加工修饰功能,操作简便,成本低廉,适合于稳定表达有功能的外源蛋白质,而且可大规模发酵,是最理想的重组真核蛋白质生产制备用工具。
1、酵母表达系统的特点酵母是一种单细胞低等真核生物,培养条件普通,生长繁殖速度迅速,能够耐受较高的流体静压,用于表达基因工程产品时,可以大规模生产,有效降低了生产成本。
酵母表达外源基因具有一定的翻译后加工能力,收获的外源蛋白质具有一定程度上的折叠加工和糖基化修饰,性质较原核表达的蛋白质更加稳定,特别适合于表达真核生物基因和制备有功能的表达蛋白质。
某些酵母表达系统具有外分泌信号序列,能够将所表达的外源蛋白质分泌到细胞外,因此很容易纯化。
应用酵母表达系统生产外源基因的蛋白质产物时也有不足之处,如产物蛋白质的不均一、信号肽加工不完全、内部降解、多聚体形成等,造成表达蛋白质在结构上的不一致。
解决内部降解的方法有三:一是在培养基中加入富含氨基酸和多肽的蛋白胨或酪蛋白水解物,通过增加酶作用底物来缓解蛋白水解作用;二是将培养基的pH值调成酸性(酵母可在pH3.0~8.0的范围内生长),以抑制中性蛋白酶的活性;三是利用蛋白酶缺失酵母突变体进行外源基因的表达。
另外,还时常遇到表达产物的过度糖基化情况。
因此,表达系统应根据具体情况作适当的改进。
2、常用酵母表达系统(宿主-载体系统)(1)酿酒酵母(Saccharomyces cerevisiae)表达系统酿酒酵母难于高密度培养,分泌效率低,几乎不分泌分子量大于30 kD的外源蛋白质,也不能使所表达的外源蛋白质正确糖基化,而且表达蛋白质的C端往往被截短。
因此,一般不用酿酒酵母做重组蛋白质表达的宿主菌。
酿酒酵母本身含有质粒,其表达载体可以有自主复制型和整合型两种。
毕赤酵母表达系统使用心得

毕赤酵母表达系统使用心得PichiaPichiaPichiaPichia酵母表达系统使用心得甲醇酵母表达系统有不少优点其中以Invitrogen公司的Pichia酵母表达系统最为人熟知并广泛应用于外源蛋白的表达。
虽然说酵母表达操作简单表达量高但是在实际操作中并不是每个外源基因都能顺利得到高表达的。
不少人在操作中会遇到这样那样的问题收集了部分用户在使用EasySelectPichiaExpressionSystem这个被誉为最简单的毕赤酵母表达的经典试剂盒过程中的心得体会。
其中XiangYang是来自美国乔治城大学GeorgetownUniversityLombardi癌症中心LombardiCancerCenter部分用户来自国内。
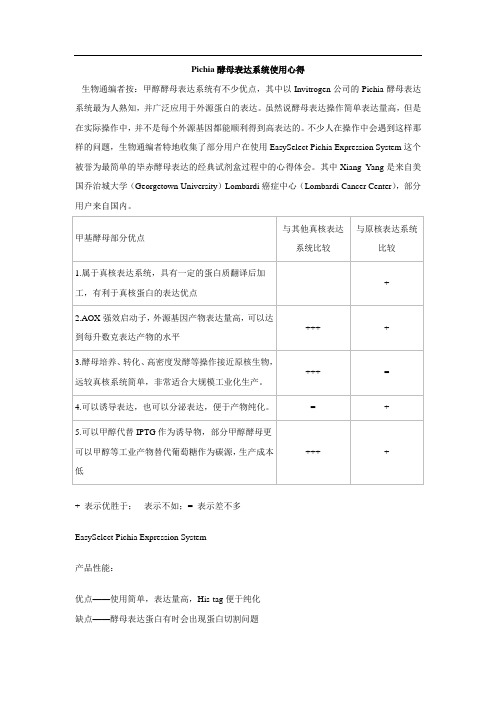
甲基酵母部分优点与其他真核表达系统比较与原核表达系统比较1.属于真核表达系统具有一定的蛋白质翻译后加工有利于真核蛋白的表达优点-2.AOX强效启动子外源基因产物表达量高可以达到每升数克表达产物的水平3.酵母培养、转化、高密度发酵等操作接近原核生物远较真核系统简单非常适合大规模工业化生产。
4.可以诱导表达也可以分泌表达便于产物纯化。
5.可以甲醇代替IPTG作为诱导物部分甲醇酵母更可以甲醇等工业产物替代葡萄糖作为碳源生产成本低表示优胜于-表示不如表示差不多EasySelectPichiaExpressionSystem产品性能优点——使用简单表达量高His-tag便于纯化缺点——酵母表达蛋白有时会出现蛋白切割问题全面产品报告及心得体会巴斯德毕赤酵母Pichiapastoris是一种能高效表达重组蛋白的酵母品种一方面由于其是属于真核生物因此表达出来的蛋白可以进行糖基化修饰另一方面毕赤酵母生长速度快可以将表达的蛋白分泌到培养基中方便蛋白纯化。
毕赤酵母表达载体pPICZ在多克隆位点MCR3端带有his-tag和c-mycepitopes这些tag有利于常规检测和纯化而且在MCR5端引入了alphafactorα-factor用以增加表达并且在表达后α-factor可以自动被切除。
Pichia酵母表达系统使用心得资料

Pichia酵母表达系统使用心得摘要:Pichia酵母表达系统广泛应用于外源基因表达。
生物通编者按:甲醇酵母表达系统有不少优点,其中以Invitrogen公司的Pichia酵母表达系统最为人熟知,并广泛应用于外源蛋白的表达。
虽然说酵母表达操作简单表达量高,但是在实际操作中,并不是每个外源基因都能顺利得到高表达的。
不少人在操作中会遇到这样那样的问题,生物通编者特地收集了部分用户在使用EasySelect Pichia Expression System这个被誉为最简单的毕赤酵母表达的经典试剂盒过程中的心得体会。
其中Xiang Yang是来自美国乔治城大学(Georgetown University)Lombardi癌症中心(Lombardi Cancer Center),部分用户来自国内。
+ 表示优胜于;- 表示不如;= 表示差不多EasySelect Pichia Expression System产品性能:优点——使用简单,表达量高,His-tag便于纯化缺点——酵母表达蛋白有时会出现蛋白切割问题全面产品报告及心得体会:巴斯德毕赤酵母(Pichia pastoris)是一种能高效表达重组蛋白的酵母品种,一方面由于其是属于真核生物,因此表达出来的蛋白可以进行糖基化修饰,另一方面毕赤酵母生长速度快,可以将表达的蛋白分泌到培养基中,方便蛋白纯化。
毕赤酵母表达载体pPICZ在多克隆位点(MCR)3'端带有his-tag和c-myc epitopes,这些tag有利于常规检测和纯化,而且在MCR5'端引入了alpha factor(α-factor)用以增加表达,并且在表达后α-factor可以自动被切除。
在进行克隆的时候,如果你选择的是EcoRI,那么只需在目标蛋白中增加两个氨基酸序列即可完成。
另外pPICZ系列选用的是Zeocin抗生素作为筛选标记,而诱导表达的载体需要甲醇——甲醇比一般用于大肠杆菌表达诱导使用的IPTG便宜。
酵母表达的注意事项

1、菌株用GS115表达不出蛋白,换KM71H后,大部分克隆能表达。
2、温度:在28度和室温下诱导表达,表达水平可能都不低。
3、pH手册上用6.0,pH提高到6.8,不表达的蛋白可能就表达出来。
BMMY的pH7.0-7.5比较合适。
国内外做的最好的rHSA,最适pH大概5-6左右。
pH3的时候yeast和peptone好像会沉淀的,可以用磷酸和磷酸二氢钾调,具体比例自己去试试。
4、偏爱密码子codonbias一般不是主要的问题,你要表达的蛋白特性才是主要问题,酵母对分子量大(30KD 以上),结构复杂(如一些蛋白酶),二硫键含量多的蛋白往往不能有效表达,尤其是分泌表达。
密码子改造对一些较小的而且结构简单的蛋白表达量的提高可能有一些作用。
比如一位战友用Pichia酵母表达一个单链抗体,29KD,含有2对二硫键,表达量约几毫克每升,选用酵母偏好密码子全基因合成后,表达量没有什么提高。
5、表达时间与空质粒转化对照诱导时间长了以后,是会有很多蛋白分泌出来的,时间越长杂蛋白就越多,且分子量都比较大。
最好做一个空质粒转化的对照,这样就会比较肯定到底是不是自身的蛋白分泌的结果。
6、污染每个样品从G418板上挑10个左右单克隆于2ml BMGY摇菌(30ml玻璃管,比LB管大一点),纱布一般用8层,一天左右看着比较浑离心,留样1ml,余1ml换2ml BMMY诱导表达,3,4层纱布足够了。
污染一般都是跟瓶口覆盖有关的原因造成的,只盖纱布肯定会污染。
加盖报纸后,就再没遇到过污染。
如果只用6层纱布,污染的可能当然很大,100ml三角瓶,装量10ml培养液,用橡筋把8层纱布和2层报纸拴紧封口,空气浴摇床。
7、不表达蛋白有没有表达就要看你的运气了,一般重复2-3次实验都没有表达菌株,这个蛋白就放弃表达了。
8、表达量30KD,10mg/L表达量已经很高,最直接的方法是发酵,一般提高5-10倍。
大肠杆菌一样出现大团的超表达蛋白。
重组酵母表达系统中的蛋白质结构与功能研究

重组酵母表达系统中的蛋白质结构与功能研究一、引言目前,重组蛋白质的生产已成为现代生物技术和制药工业的关键技术之一。
重组酵母表达系统是广泛使用的一种蛋白质表达和生产平台。
与其他表达系统相比,酵母表达系统有许多优点,如基因组稳定,高表达水平,细胞培养简单等。
然而,酵母表达系统也存在一些挑战,如蛋白质折叠不正常,产生糖基化偏移等问题。
因此,为了提高酵母表达系统的蛋白质表达效率和质量,本文就酵母表达系统中蛋白质结构与功能研究进行探讨。
二、酵母表达系统中蛋白质折叠与结构蛋白质折叠是蛋白质从链状多肽到最终三维立体结构的转变过程。
在酵母表达系统中,蛋白质折叠可能受到细胞外部环境和酵母细胞内部变异的影响。
酵母表达系统中,蛋白质折叠状态受到多种因素影响,其中包括宿主细胞成长环境、表达蛋白质的特性、构建载体的类型等。
此外,由于蛋白质复杂的折叠模式和折叠过程,酵母表达系统中蛋白质可能出现失配折叠或意外折叠的情况。
为了解决这些问题,科学家们通过构建更多的折叠监测工具和通过生物物理化学方法进行折叠结构分析来探索酵母表达系统中蛋白质折叠机理和结构特点。
三、酵母表达系统中蛋白质糖基化问题酵母细胞表面几乎不存在N- 糖基化酶切位点,因此酵母表达系统中的蛋白质可能会产生糖基化偏移。
糖基化是一种重要的蛋白质修饰方式,在某些情况下,它对蛋白质结构和功能都有显著的影响。
糖基化从生化学角度来看是一种复杂的反应,它的条件、速率和位置独立于蛋白质的折叠和表达情况。
目前,为了解决酵母表达系统中的糖基化问题,科学家们通过构建新的酵母表达载体、优化酵母细胞培养设施和生产过程等方法来降低糖基化偏移的概率。
四、酵母表达系统中蛋白质功能研究酵母表达系统的成功应用强调了其在制药和其他生物技术领域的重要性。
在酵母表达系统中,蛋白质的结构和功能研究事关其在医学和工业制造中的应用。
近年来,酵母表达系统中的蛋白质结构和功能研究获得了许多进展。
科学家们通过组合和修饰蛋白质结构,从而形成新的功能和特性,这有望向医药工业和食品产业提供更可控性的解决方案。
Pichia酵母表达系统使用心得及蛋白酶控制
Pichia酵母表达系统使用心得生物通编者按:甲醇酵母表达系统有不少优点,其中以Invitrogen公司的Pichia酵母表达系统最为人熟知,并广泛应用于外源蛋白的表达。
虽然说酵母表达操作简单表达量高,但是在实际操作中,并不是每个外源基因都能顺利得到高表达的。
不少人在操作中会遇到这样那样的问题,生物通编者特地收集了部分用户在使用EasySelect Pichia Expression System这个被誉为最简单的毕赤酵母表达的经典试剂盒过程中的心得体会。
其中Xiang Yang是来自美国乔治城大学(Georgetown University)Lombardi癌症中心(Lombardi Cancer Center),部分用户来自国内。
+ 表示优胜于;- 表示不如;= 表示差不多EasySelect Pichia Expression System产品性能:优点——使用简单,表达量高,His-tag便于纯化缺点——酵母表达蛋白有时会出现蛋白切割问题全面产品报告及心得体会:巴斯德毕赤酵母(Pichia pastoris)是一种能高效表达重组蛋白的酵母品种,一方面由于其是属于真核生物,因此表达出来的蛋白可以进行糖基化修饰,另一方面毕赤酵母生长速度快,可以将表达的蛋白分泌到培养基中,方便蛋白纯化。
毕赤酵母表达载体pPICZ在多克隆位点(MCR)3'端带有his-tag和c-myc epitopes,这些tag有利于常规检测和纯化,而且在MCR5'端引入了alpha factor(α-factor)用以增加表达,并且在表达后α-factor可以自动被切除。
在进行克隆的时候,如果你选择的是EcoRI,那么只需在目标蛋白中增加两个氨基酸序列即可完成。
另外pPICZ系列选用的是Zeocin抗生素作为筛选标记,而诱导表达的载体需要甲醇——甲醇比一般用于大肠杆菌表达诱导使用的IPTG便宜。
第一步——构建载体Xiang Yang:pPICZ系列有许多克隆位点可供选择,同时也有三种读码框以便不用的用户需要。
生物酵母高效表达系统的研究及优化

生物酵母高效表达系统的研究及优化绪论生物酵母高效表达系统在生物技术领域中扮演着重要的角色。
酵母是一种简单而又易于培养的真核生物,具有许多优点,比如高表达水平,易于扩大生产以及可调控的代谢途径。
然而,在使用酵母进行表达时,有一些因素需要考虑,以确保高效表达和最大化产量。
本文将探讨生物酵母高效表达系统的研究和优化。
一、研究生物酵母高效表达系统的原因1.1 酵母的生物学特性酵母是一种单细胞真核生物,其基因组具有高度保守性。
酵母细胞有类似于人类细胞的机制,这使得酵母可用作人类蛋白质的表达系统。
此外,酵母细胞的代谢通路与人类细胞有许多共同之处,因此可以通过酵母细胞进行药物筛选和代谢途径的研究。
1.2 酵母高效表达系统的优势相对于其他表达系统,酵母高效表达系统有以下优势:a) 高表达水平:酵母细胞拥有高度活跃的转录和转译机制,使其能够实现高水平的蛋白表达。
b) 易于扩大生产:酵母细胞的培养工艺相对简单,同时可以进行批量培养和连续培养。
c) 可调控的代谢途径:酵母细胞常用来研究特定代谢途径,并通过基因工程进行调控。
二、生物酵母高效表达系统的优化2.1 基因工程基因工程是生物酵母高效表达系统优化的关键。
通过选择适当的启动子、增强子和终止子以及优化启动子-转录因子相互作用,可以实现蛋白质表达水平的提高。
此外,通过插入调节元件,在表达过程中控制蛋白质的稳态水平,从而实现高产量表达。
2.2 优化培养条件培养条件对于酵母高效表达系统的优化至关重要。
适当的培养温度、pH值、培养基成分和添加剂选择可以提高酵母细胞的生存率和表达效率。
还可以通过调节培养基的营养物质浓度和培养过程中的氧气供应,进一步提高表达效果。
2.3 蛋白质稳定性的提高蛋白质在酵母细胞中的稳定性是影响高效表达的因素之一。
通过添加相关蛋白质降解途径的抑制剂,可以延长目标蛋白质的半衰期,从而提高其表达水平。
此外,在目标蛋白质的N-端或C-端添加稳定性标签,也能有效提高蛋白质的稳定性。
毕赤酵母表达系统

毕赤酵母表达系统毕赤酵母表达系统前言:所用表达质粒有pPIC3.5K,pAO815用于胞内表达,而pPIC9K用于分泌表达,所有载体均利用AOX1启动子来诱导高水平表达。
抗性选择:最有效的筛选遗传霉素抗性及高抗性克隆的程序需要先对HIS+转化子进行选择,再进行不同水平遗传霉素抗性筛选。
毕赤菌株表型:毕赤酵母菌GS115 及KM71 在组氨酸脱氢酶位点(His4)有突变,因而不能合成组氨酸,所有表达质粒都有HIS4 基因可与宿主进行互补,通过不含组氨酸的培养基来选择转化子。
GS115 及KM71都可在复合培养基如YPD(YEPD)及含组氨酸的最小培养基中生长。
转化之前,GS115 及KM71 都不能在最小培养基中生长,因为它们是His-。
培养温度:毕赤酵母生长温度为28-30度(液体、平板、斜面)。
在32 度以上诱导生长时,对蛋白表达有害,甚至会导致细胞死亡。
贮存:贮存细胞几周或几月,用YPD培养基或YPD 琼脂斜面1 挑取所需菌株单克隆在YPD 平板上划线生长;2 挑取单克隆转移至YPD进行穿刺培养,30 度2 天;3 细胞在4 度可放几周几月或几年,存于-80度1 挑取所需菌株单克隆在YPD 中过夜培养;2 收集细胞,在含15%甘油的YPD 中悬浮至终OD600 为50-100(大约2.5-5.0×109细胞/ml);3 细胞先用液氮或干冰/酒精浴中冰冻再贮存于-80 度。
注意:在4 度或-80 度长期保存后,用之前建议在MM、MD 或MGY 平板上划线培养以检测His+转化子的表型是否正确及其活力。
以质粒pPIC9K,酵母Pichia pastoris GS115为例说明做法。
载体pPIC9K酶切为点线性化质粒DNA:建议使用下列方法线性化载体以获得Mut+及Muts重组子,可能其中一个会比另一个更利于表达多拷贝重组子。
如果只想得到Muts 重组子,使用KM71 菌株。
单个十字交换事件可比双重十字交换更容易、更有效地获得Muts 重组菌(例如:插入AOX1或his4 而不是取代AOX1)。
酵母分泌表达

酵母分泌表达酵母分泌表达作为一种重要的蛋白质表达技术,已经在生物科学、生物技术和医药研究领域得到了广泛应用。
本文将从酵母分泌表达的概述、优势、应用、实验流程、提高策略以及未来发展趋势等方面进行详细阐述。
一、酵母分泌表达的概述酵母分泌表达是指将外源基因在酵母细胞中表达,并使其分泌到细胞外的过程。
与其他表达体系相比,酵母分泌表达具有许多优点,使得它成为了研究者们的首选。
二、酵母分泌表达的优势1.酵母细胞易于培养和繁殖,成本较低;2.酵母分泌的蛋白质具有较高的纯度和活性;3.分泌蛋白具有天然的空间结构和功能;4.可以实现高密度发酵,提高产量。
三、酵母分泌表达的应用酵母分泌表达技术在生物制药、生物材料、生物能源等领域具有广泛的应用。
例如,利用酵母分泌表达制备单克隆抗体、酶、激素等生物制品。
四、酵母分泌表达的实验流程1.构建表达载体:将外源基因与酵母分泌表达载体连接;2.转化酵母细胞:将构建好的表达载体转化到酵母细胞中;3.筛选与鉴定转化子:通过筛选含有目的基因的酵母转化子,并进行鉴定;4.发酵培养:对转化子进行发酵培养,实现外源蛋白的分泌表达;5.分离与纯化:对外分泌的蛋白质进行分离、纯化及活性检测。
五、提高酵母分泌表达的策略1.选择合适的酵母菌株:根据目标蛋白的特性和需求,选择具有较高分泌能力的酵母菌株;2.优化表达载体:改进表达载体的结构和组成,提高外源基因的表达水平;3.调整发酵条件:优化发酵过程中的温度、pH、营养元素等条件,以提高分泌蛋白的产量;4.蛋白后翻译修饰:对分泌蛋白进行适当的翻译后修饰,以提高其稳定性和活性。
六、未来发展趋势与展望随着科学技术的不断发展,酵母分泌表达技术在医药、食品和生物工程等领域具有巨大的应用潜力。
未来,酵母分泌表达技术将继续向高效、可控和个性化方向发展,为人类创造更多的价值。
总之,酵母分泌表达作为一种重要的蛋白质表达手段,已经在各个领域取得了显著的成果。
酵母表达的注意事项

酵母表达的注意事项1、菌株用GS115表达不出蛋白,换KM71H后,大部分克隆能表达。
2、温度:在28度和室温下诱导表达,表达水平可能都不低。
3、pH手册上用6.0,pH提高到6.8,不表达的蛋白可能就表达出来。
BMMY的pH7.0-7.5比较合适。
国内外做的最好的rHSA,最适pH 大概5-6左右。
pH3的时候yeast和peptone好像会沉淀的,可以用磷酸和磷酸二氢钾调,具体比例自己去试试。
4、偏爱密码子codonbias一般不是主要的问题,你要表达的蛋白特性才是主要问题,酵母对分子量大(30KD以上),结构复杂(如一些蛋白酶),二硫键含量多的蛋白往往不能有效表达,尤其是分泌表达。
密码子改造对一些较小的而且结构简单的蛋白表达量的提高可能有一些作用。
比如一位战友用Pichia酵母表达一个单链抗体,29KD,含有2对二硫键,表达量约几毫克每升,选用酵母偏好密码子全基因合成后,表达量没有什么提高。
5、表达时间与空质粒转化对照诱导时间长了以后,是会有很多蛋白分泌出来的,时间越长杂蛋白就越多,且分子量都比较大。
最好做一个空质粒转化的对照,这样就会比较肯定到底是不是自身的蛋白分泌的结果。
6、污染每个样品从G418板上挑10个左右单克隆于2ml BMGY摇菌(30ml玻璃管,比LB管大一点),纱布一般用8层,一天左右看着比较浑离心,留样1ml,余1ml换2ml BMMY诱导表达,3,4层纱布足够了。
污染一般都是跟瓶口覆盖有关的原因造成的,只盖纱布肯定会污染。
加盖报纸后,就再没遇到过污染。
如果只用6层纱布,污染的可能当然很大,100ml 三角瓶,装量10ml培养液,用橡筋把8层纱布和2层报纸拴紧封口,空气浴摇床。
7、不表达蛋白有没有表达就要看你的运气了,一般重复2-3次实验都没有表达菌株,这个蛋白就放弃表达了。
8、表达量30KD,10mg/L表达量已经很高,最直接的方法是发酵,一般提高5-10倍。
大肠杆菌一样出现大团的超表达蛋白。
酵母表达系统使用心得

酵母表达系统使用心得第一篇:酵母表达系统使用心得Pichia酵母表达系统使用心得甲醇酵母表达系统有不少优点,其中以Invitrogen公司的Pichia 酵母表达系统最为人熟知,并广泛应用于外源蛋白的表达。
虽然说酵母表达操作简单表达量高,但是在实际操作中,并不是每个外源基因都能顺利得到高表达的。
不少人在操作中会遇到这样那样的问题,收集了部分用户在使用EasySelect Pichia Expression System这个被誉为最简单的毕赤酵母表达的经典试剂盒过程中的心得体会。
其中Xiang Yang是来自美国乔治城大学(Georgetown University)Lombardi癌症中心(Lombardi Cancer Center),部分用户来自国内。
甲醇酵母部分优点:1.属于真核表达系统,具有一定的蛋白质翻译后加工,有利于真核蛋白的表达;2.AOX强效启动子,外源基因产物表达量高,表达产物可以达到每升数克的水平;3.酵母培养、转化、高密度发酵等操作接近原核生物,远较真核系统简单,非常适合大规模工业化生产;4.可以诱导表达,也可以分泌表达,便于产物纯化;5.可以甲醇代替IPTG作为诱导物,部分甲醇酵母更可以用工业甲醇替代葡萄糖作为碳源,生产成本低。
产品性能:优点——使用简单,表达量高,His-tag便于纯化;缺点——酵母表达蛋白有时会出现蛋白切割问题。
巴斯德毕赤酵母(Pichia pastoris)是一种能高效表达重组蛋白的酵母品种,一方面由于其是属于真核生物,因此表达出来的蛋白可以进行糖基化修饰,另一方面毕赤酵母生长速度快,可以将表达的蛋白分泌到培养基中,方便蛋白纯化。
毕赤酵母表达载体pPICZ在多克隆位点(MCR)3'端带有his-tag 和c-myc epitopes,这些tag有利于常规检测和纯化,而且在MCR5'端引入了alpha factor(α-factor)用以分泌表达,并且在表达后α-factor可以自动被切除。
酵母蛋白质表达系统的研究

酵母蛋白质表达系统的研究酵母蛋白质表达系统是一种被广泛应用于分子生物学实验室中的工具,它能够有效地合成大量的蛋白质,为研究者们在酵母细胞中进行蛋白质功能、结构和相互作用等研究提供了重要的手段。
本文将探讨酵母蛋白质表达系统的原理、应用以及最新的研究进展。
一、酵母蛋白质表达系统的原理酵母蛋白质表达系统的原理基于酵母细胞对外源蛋白质的合成和折叠机制。
在酵母细胞中,蛋白质的合成和折叠是通过核糖体、转录和翻译等复杂的细胞机制完成的。
酵母细胞中存在丰富的酵母菌细胞器,它们能够提供良好的蛋白质折叠环境,同时酵母细胞的细胞壁结构也能够有效地保护外源蛋白质。
因此,利用酵母蛋白质表达系统可以实现高效、稳定的蛋白质表达。
二、酵母蛋白质表达系统的应用酵母蛋白质表达系统被广泛应用于多个领域的研究中,包括基础生物学、生物医学研究和产业应用等。
首先,在基础生物学领域,酵母蛋白质表达系统被用于研究蛋白质的功能与结构,以及蛋白质与其他生物分子的相互作用等。
其次,在生物医学研究中,酵母蛋白质表达系统可以用来生产重要的蛋白质药物,如胰岛素和白细胞介素等。
此外,在产业应用方面,酵母蛋白质表达系统可以用于工业酶的生产,如纤维素酶和葡萄糖异构酶等。
三、酵母蛋白质表达系统的最新研究进展近年来,随着基因工程技术的不断发展,酵母蛋白质表达系统也得到了进一步的改进和优化。
一方面,研究者们通过优化酵母细胞的生长条件和培养介质,提高了蛋白质表达的效率和产量。
另一方面,新型的表达载体和突变体的构建也为酵母蛋白质表达系统的研究提供了更多的选择和可能性。
此外,利用基因组学和蛋白质组学等高通量技术,研究者们还在酵母蛋白质表达系统的调控和优化方面取得了重要突破。
结论酵母蛋白质表达系统作为一种重要的实验工具,为研究者们提供了可靠、高效的蛋白质表达方法。
通过对其原理和应用的探讨,我们可以看到酵母蛋白质表达系统在生物学研究和工业应用中的巨大潜力。
随着技术的不断进步和改进,相信酵母蛋白质表达系统在科研领域的地位和作用将会更加重要和广泛。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精心整理
Pichia酵母表达系统使用心得
甲醇酵母表达系统有不少优点,其中以Invitrogen公司的Pichia酵母表达系统最为人熟知,并广泛应用于外源蛋白的表达。
虽然说酵母表达操作简单表达量高,但是在实际操作中,并不是每个外源基因都能顺利得到高表达的。
不少人在操作中会
这个
是来中心(
1.
3.
4.
5.
产品性能:优点——使用简单,表达量高,His-tag便于纯化;缺点——酵母表达蛋白有时会出现蛋白切割问题。
巴斯德毕赤酵母(Pichiapastoris)是一种能高效表达重组蛋白的酵母品种,一方面由
于其是属于真核生物,因此表达出来的蛋白可以进行糖基化修饰,另一方面毕赤酵母生长速度快,可以将表达的蛋白分泌到培养基中,方便蛋白纯化。
毕赤酵母表达载体pPICZ在多克隆位点(MCR)3'端带有his-tag和c-mycepitopes,这些tag有利于常规检测和纯化,而且在MCR5'端引入了alphafactor(α-factor)用以
的是系
PIC9K G418无
leslie:要做毕赤酵母表达实验,首先当然就要了解这个可爱的酵母了(椭圆形,肥嘟嘟的,十分可爱),她和大肠杆菌长得有较大区别(大肠杆菌是杆状的),因此在培养的过程中要区别这两种菌体,除了气味,浓度,颜色以外,也可以取样到显微
镜中观测。
大家做毕赤表达的时候应该都遇过这种情况吧,表达过程中染菌(我们实验室曾经污染过各种颜色形状的细菌,那真是一段可怕的经历),如果在不知情的情况下继续做下去,那可以就是浪费大把的时间了。
基本熟悉了毕赤酵母,了解了她生长的喜好(多糖偏酸环境),生长的周期等等
有
的
余的
(起始密码子),有人认为酵母启动子与外源基因的ATG之间的距离越短对于表达的该基因越有利;
⑤如果不希望有c-myc和His-tag,可以在基因片段末尾加入终止密码子;
⑥Pichia的密码子与酿酒酵母的相似,有关基因表达偏好密码子的问题有人认为没有必要更换,有人认为一定要换,个人认为以产量为主要目的的可以考虑更换基因密码子,而如果片段过长就比较麻烦,不过有许多真核保守蛋白其实是和酵母密码子相似的;
XiangYang:EasySelect试剂盒准备了三种菌株:X33,GS115和KM71H。
我倾向于选择X33,因为这个菌株转化率和表达量相对而言较高,如果你有电转仪(electroporator),可以尝试一下。
如果没有的话,EasySelect也准备了化学转化试剂
——EasyCompTransformation,但是由于转化率的缘故,我建议使用电转仪。
leslie:在得到了正确的序列之后就可以准备转化毕赤酵母了,试剂盒携带有的是X-33,GS115和KM71H这三种毕赤酵母(另外常用的还有SMD1168),每种酵母的特点有些不尽相同(Manual上写的很清楚),其中X-33由于是野生型,因此耐受性
MUT
基酯酶
不同的酵母菌中可能表达量截然不同,因此在最开始的时候建议多用几种酵母菌实验。
另外有个保存问题,原始酵母菌一定要保存好,因为酵母在传代多次后会影响其转化率和表达量,所以一方面分多管分装保存于-80℃,另一方面如果出现了转化或者
表达的问题,在其它方面都没有出错的前提下可以考虑重新取出新菌液(每次都要涂平板挑菌)。
在准备酵母菌的同时也需要准备质粒,由于酵母菌转化对转化质粒的要求较高,量也较大(5-10ug),因此许多时候都会用PEG大提质粒,或者用大提试剂盒,总而言
达)。
80%的
接下来就是酵母转化了,这是令许多人头疼的一步,也是影响实验决定表达的关键步骤。
转化方法有不少,例如电转,化学转化,原生质体转化,其方法的难易程度和转化率高低呈反向递减的,也就是说电转最容易,转化率较高(但要求有电转
仪),而原生质体最麻烦,而且效果不好(比较传统),因此不建议使用,EasySelect 说明书上这么建议,并且也详细说明了电转,化学转化(EasyComp和LiCl)方法的过程,可以按部就班。
需要注意的是(电转过程):
①最好每次都从平板上挑酵母菌,用培养过的酵母放置时间不要超过一个星期;
②扩大培养的浓度一定要控制好,个人认为不需要OD600达到1.3-1.5,1.0-1.3的就
(4)就
(
如果没有电转仪,LiCl转化是一种可供选择的方法,转化率是102到103cfu/ug。
主要过程为:取过夜活化培养的菌液按1:1000接种于15ml新鲜的YPD液体培养基,30℃培养至OD600达到0.8-1.0;4℃,4500rpm离心5分钟,用8ml冰预冷的无菌水洗涤菌体,倾除洗涤液,用1mL,4℃,4500rpm离心5分钟,沉淀用50μl冰预
冷的100mmol/LLiCl悬浮,最后定容至80-90ml。
LiCl转化取适量单链鲑精DNA(2mg/mL)煮沸5min,立即置于冰上备用,取上述制备好的感受态细胞12000rpm,离心15s,吸弃LiCl溶液,按顺序依次加入50%PEG240ml1mmol/LLiCl36ml单链鲑精DNA25ml
线性化质粒DNA10ml(约10mg)
30℃YPDS
4 leslie
也挺让人头痛的,第一就是破壁的问题,许多人用PCR方法进行鉴定都无法得到结果,甚至在表达出了以后还是无法得到这张鉴定图片,主要原因之一就是无法正常释放酵母基因组,一般通过培养菌然后进行沸水和-20℃冷冻循环过程裂解细胞在目的蛋白片段比较合适的范围以内是可以得到好的结果的,但是有时候片段过长,模
壁就会阻碍扩增,所以我们实验室会用蜗牛酶(很便宜的酶来的)来帮助溶菌,我看许多实验室也会这么做,不过加入的时间不同而已,其次也有奢侈的用试剂盒的。
第二就是是模板量,个人建议模板真的不要加太多了,按照说明书的上的5ul我觉得还是多了,而且建议总体积不用这么大,当然加入模板的量也与自己培养菌的浓度
5'AOX
区位
GS115
和
色体上,在加入甲醇作为唯一碳源的培养基中,外源基因在5’AOX1启动子的控制下表达.在载体中引入Tn903Kanr基因(抗G418)有助于筛选高拷贝转化子,转化子的拷贝数与抗G418的能力有关,通过筛选抗G418能力强的酵母即可获得高拷贝转化子.外源基因是以同源重组的方式插入到酵母菌的染色体中,因此不易丢失,多次传代后酵母
仍能稳定表达外源蛋白,具有良好的遗传稳定性.
第四步——表达
XiangYang:将你的克隆在YPD培养基中培育到OD600值达到6.0,就可以离心收菌。
用表达培养基(比如BMMY)重悬沉淀,在30oC培育过夜。
leslie
(空
隆,
,转入
母)
所以可以适当补充一些,以及在摇床里放置盛有无菌水的深口瓶,来保持摇床里湿度。
诱导物甲醇注意要在超净台中打开,可以分装到灭过菌的瓶子中——当然甲醇是不能灭菌的,而且也要注意在用酒精灯过甲醇瓶口的时候要小心,如果真的引起爆炸
那可就损失大了。
另外如果觉得每天添加甲醇麻烦,也有人用一次性注射器透过纱布添加甲醇,这个方法可能会造成染菌,慎选。
说到纱布就想到了通气性问题,酵母在无氧和有氧的情况下都可以存活,但是在甲醇诱导的情况下毕赤酵母用的是醇氧化酶,自然氧气量对于这一基因的表达影响重大,但是由于害怕感染大肠杆菌,纱布裹的也不能太少,最好专辟出一个摇床进行三十度酵母表达,这样可以考虑将
pH
的浓度的对应性,如果小到20kD以下,可以考虑用tricine胶,不过是个需要全盘重新准备的过程,要考虑清楚。
如果选用的载体是带有信号肽的,虽说是分泌表达好纯化,但实际上毕赤酵母本身还是有本底表达的,而且有时候会造成假阳性,所以最后表达过程需要用Westernblot或者Elasa,通常都是用WB,具体的细节可见
WesternBlotting前传:想成为高手吗?系列文章,另外要提一句的是,如果本身蛋白没有合适抗体(如果是利用从大肠表达出来的蛋白做出的抗体也有可能与用真核系统表达出来的蛋白无法发生免疫作用),可以选用anti-myc或者anti-his的,前提当然是你的蛋白没有提前终止。
,
得到
向平行二聚体(antiparallelhomodimer)的糖蛋白,经过纯化,我通过一个细胞增殖实验(cellproliferationassay)检测了其活性,结果表明表达出来的蛋白在体外有完全的活性。
并且我也在体外利用受体分析了蛋白结合活性,与对照(通过大肠杆菌和Bacular细胞未带tag的蛋白)相比,his-tag有一点副作用。
伊可丽:由于在摇瓶培养中巴斯德毕赤酵母表达外源蛋白的水平往往不能准确地反映罐发酵中的表达情况,使之成为令人头痛的问题。
主要原因是在摇瓶培养中,培养液的pH值无法控制,培养物通气不充分及无法控制添加碳源的最适速率。
但是为了避免对每一个表达菌株进行繁琐的发酵罐培养条件的实验,仍需摸索表达菌株的摇瓶培养条件,使其产物的表达量与预期的发酵罐培养结果相近。
达过。
