高中知识点规律大全《氮族元素》
氮族元素知识点总结

氮族元素知识点总结一、氮族元素的性质1. 氮(N)氮是氮族元素中最常见的元素,占据地壳中78%的成分。
氮气是一种无色、无味、无臭的气体,化学性质相对稳定。
在常温下,氮气是不活泼的。
但是,当氮气与氢气或氧气等其他元素发生反应时,就会变得非常活泼。
2. 磷(P)磷是一种具有五种同素异形体的元素,分别是白磷、红磷、黑磷、紫磷和蓝磷。
其中,白磷是最常见的形态,具有毒性并且在空气中易燃。
磷在自然界中主要以磷酸盐的形式存在,例如磷灰石和磷灰石。
磷在工业生产中主要用于制造化肥、杀虫剂、药物和清洁剂。
3. 砷(As)砷是一种具有金属和非金属特性的元素,化学性质较活泼。
砷的化合物在环境和生物体中具有毒性。
然而,砷化合物在医药和半导体工业中具有一定的应用价值。
4. 锑(Sb)锑是一种银白色的金属元素,具有良好的导电性和导热性。
锑主要用于制造半导体材料、合金和防火材料。
5. 铋(Bi)铋是一种银白色的金属元素,具有较低的熔点和高的电阻率。
铋主要用于制造合金、化妆品和医药。
二、氮族元素的应用1. 化肥氮族元素主要用于制造化肥,如尿素、磷酸二铵和钾肥等。
这些化肥在农业生产中起着至关重要的作用,能够促进植物生长,增加作物产量。
2. 基础材料氮族元素还用于制备一些重要的基础材料,如硫化磷、磷酸盐、氟硼酸盐等,这些材料在工业生产中具有广泛的应用价值。
3. 医药氮族元素在制药工业中也有重要的应用,例如磷酸二氢钾、砷酸钠、氯化铋等化合物都是一些重要的药物原料。
4. 电子材料磷化镓、砷化镓、硒化锗等化合物是一些重要的半导体材料,用于制造太阳能电池、激光器和传感器等电子产品。
5. 生活用品氮族元素在生活用品中也发挥着重要作用,例如在防火材料、合金材料、玻璃染料等方面都有应用。
三、氮族元素在环境和生物中的作用1. 生物体中的氮族元素氮族元素在生物体内起着至关重要的作用,如氨基酸、核酸、蛋白质和维生素都离不开氮族元素。
磷还是DNA和RNA的主要组成部分,铋在人类体内也具有一定的生理功能。
氮族元素

氮族元素【复习要点】一.氮族元素(上→下)1.氮族元素:原子结构:最外层,族。
电子层数逐渐,原子半径逐渐;元素性质:主要化合价:、(N:+1,+2,+3,+4,+5)金属性逐渐,非金属性逐渐;单质性质:密度逐渐,熔沸点逐渐;与氢气化合越来越,(Sb、Bi不化合)化合物性质:RH3稳定性逐渐,还原性逐渐;R2O5(HRO3、H3RO4等)酸性,碱性;2.氮气和磷1)氮元素的存在与氮气的性质⑴氮元素的存在化合态:无机物与有机物,是构成蛋白质和核酸的主要成分;游离态:氮气,空气中含量78%(体积)。
⑵氮气的物理性质:色味气体,熔点与沸点比氧气低,色液体,固体。
溶解度较。
⑶氮气的化学性质结构:N≡N,性质非常。
①与氮气反应:N2+3H22NH3 ,工业②与氧气反应:N2+O2 2 NO ,NO→NO2→HNO3氮的固定:N2转化为氮的的过程,分为人工固氮和自然固氮⑷氮气的用途:合成氨的原料,保护气,医学上冷冻剂等。
⑸氮气的制备工业上:空气→液态空气→氮气实验室:空气N22)磷元素的存在及磷的性质⑴磷元素的存在仅以化合态存在,主要以磷酸盐的形式存在,蛋白质的构成成份之一。
动物的骨骼、牙齿和神经组织,植物的果实和幼芽,生物的细胞里。
⑵磷的同素异形体磷有多种同素异形体白磷(P4)红磷结构:面体(°)/物性:色状固体,毒色粉末,毒易溶于、不溶于不溶于着火点℃,水中切割与保存着火点高℃用途:高纯度磷酸、燃烧与烟幕弹农药、安全火柴化学性质:PCl5(PCl3)←p →P2O5(P4O10)转化:白磷红磷⑶磷酸(元酸)P2O5,与水反生成磷酸:P2O5+3H2O(水)=2H3PO4用途:磷肥、食品纺织。
3)氮氧化物五种价态,六种氧化物:、、、()、。
⑴一氧化氮物理性质:色味气体,毒,溶于水化学性质:2NO+O2=NO2()制法:与反应。
⑵二氧化氮物理性质:色气体,溶于水化学性质:3NO2+H2O=2HNO3+NO制法:与反应。
高考化学:氮族元素基础知识

第八章氮族元素一、氮族元素:1、氮族元素在周期表中,位于(碳)族元素和(氧)族元素之间的第(ⅤA)族元素,也是(主)族元素,包括(N、P、As、Sb、Bi)等(五)种元素。
随着核电和数的递增,原子的电子层数(增加),原子半径逐渐增大,在化学反应中得电子能力逐渐(减小),失电子能力逐渐(增强),非金属性逐渐(减弱),金属性逐渐(增强),其中(N、P)表现出较明显的非金属性,(As)虽为非金属,但已具有一些金属性,而(铋)已具有明显的金属性。
2、下列各项比较中由强到弱的顺序是:NH3、PH3、AsH3的稳定性(减弱),还原性(增强);HNO3、H3PO4、H3AsO4的酸性(依次减弱)3、氮气的分子式(N2),电子式(),结构式(),键能()(填大或小),大气中氮气占体积百分比为(78%)。
因为氮气的(化学性质不活泼),因此可用作保护气,如(焊接2NH3)金属、充入灯泡、保鲜粮食水果)等,人工固氮的化学方程式为(N2+3H2 催化剂加热这一反应的那些方面说明了氮气的稳定性(加热、催化剂、反应为可逆的)。
自然界什么现象可起氮的固定作用(雷雨),方程式为(N2+O2=2NO),什么植物有固氮能力(豆科植物)4、磷元素常见的单质有(白磷)和(红磷),其中不溶于水可溶于CS2的是(白磷),分子式为(P4),分子空间构型是(正四面体),键角是(60°),颜色和状态是(白色蜡状固体),晶型是(分子晶体),毒性(剧毒),着火点是(40°),少量保存在(水)中,大量(密封)保存,它与另一种单质之间的转化条件是(白磷红磷)5、完成下列方程式:N2+O2=2NO 4P+5O2=2P2O5N2+3H2=2NH3N2+3Mg=Mg3N22P+3Cl2 (不足) =2PCl32P+5Cl2(足量)=2PCl52NO+O2=2NO3NO2+H2O=2HNO3+NO P2O5+H2O(冷)=2HPO3(偏磷酸有剧毒)P2O5+3H2O(热)=2H3PO4P+5HNO3(浓)△H3PO4+5NO2+H2O2P+5H2SO4(浓)=2H3PO4+5SO2+2H2O 4NO2+O2+2H2O=4HNO34NO+3O2+2H2O=4HNO3NO+NO2+H2O+O2=2HNO3Ag++NH3·H2O=AgOH↓+NH4+AgOH+2NH3·H2O=〔Ag(NH3)2〕+ +OH-+2H2O二、氨、铵盐:1、氨的分子式:(NH3),电子式(),结构式(),N与H之间是(极性)键,分子空间构型是(三角锥)型,分子(有)极性,氨分子之间可形成(氢)键,这使分子间作用力增强而(易)液化,液化后叫(液)氨,它属于(纯净)物。
高中化学氮族元素知识点

高中化学氮族元素知识点氮族元素是元素周期表中的第15族元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)和锇(Bi)。
这些元素在化学性质上具有一些共同的特征,例如它们的价态多变,敏感度较高,容易形成各种化合物等。
1.化学特性氮族元素的价态多变,氮的电子结构为1s²2s²2p³,其价态通常为-3、+3、0和+5、氮和磷的成键性质更加明显而形成更多的化合物,而砷、锑和锇则形成较少的化合物。
在化合物中,氮族元素通常以共价键形式存在。
2.氮族元素的重要化合物(1)氮化物:氮族元素与金属形成氮化物,例如氮化钙(Ca3N2)、氮化铍(Be3N2)等。
这些化合物通常具有很高的热稳定性和硬度,可用作耐磨材料和催化剂。
(2)卤化物:氮族元素与卤素形成卤化物,例如五氯化磷(PCl5)、五溴化磷(PBr5)等。
这些化合物在有机合成和分析化学中具有重要的应用,例如五氯化磷可用于酰氯的制备,五溴化磷可用于酰溴的制备。
(3)氮氧化物:氮氧化物是氮族元素中最重要的化合物之一,其中最常见的是一氧化氮(NO)、二氧化氮(NO2)和氧化氮(N2O)。
氮氧化物在大气中起着重要的化学作用,例如一氧化氮对臭氧层的破坏、二氧化氮和空气中的水蒸气反应形成酸雨等。
3.氮族元素的生物化学作用氮族元素在生物体内具有重要的生物化学作用。
例如,氨基酸中的氮以氨的形式存在,氨是合成蛋白质和核酸的关键物质。
此外,生物体内的ATP(三磷酸腺苷)也包含氮元素,ATP是细胞内能量转化的重要媒介物。
4.氮族元素的应用(1)氮化物的应用:氮化物具有耐磨、高熔点和高硬度的特点,因此被广泛应用于耐磨涂层、陶瓷材料和切削工具等领域。
(2)磷适用性广泛:磷广泛应用于农业和化学工业。
作为肥料,磷是作物生长所需的关键元素之一;作为化学品,磷广泛应用于合成有机化合物、制备药品和消防材料等。
(3)磷化氢的用途:磷化氢(PH3)可用作溴化和碘化的脱溴和脱碘试剂,也可用于制备金属磷化物,例如氢磷化镉和氢磷化铜等。
2023年氮族元素知识点归纳

氮族元素【知识归纳】一.氮族元素概况名称氮磷砷锑铋原子符号N P As Sb Bi 原子序数715335183氮族组员在周期表中旳位置第二周期第ⅤA 族第三周期第ⅤA 族第四面期第ⅤA 族第五周期第ⅤA 族第六周期第ⅤA 族相似点最外层电子数相似,都是5个原子构造不一样点电子层数不一样,随核电荷数增大依次递增,原子半径逐渐增大重要化合价-3,0,+3,+5(其中N 尚有+1,+2,+4等价态)相似性能形成氢化物RH 3,最高价氧化物旳水化物为HRO 3或H 3RO 4元素性质递变性随核电荷数增大,非金属性逐渐减弱,金属性逐渐增强氢化物NH 3,PH 3,A S H 3稳定性依次减弱,还原性依次增强化合物旳性质含氧酸酸性按H 3BiO 4< H 3SbO 4<H 3PO 4<HNO 3次序递增二.氮气(空气中体积80%旳构成成分)1.概况:N 2是一种无色无味旳气体,密度比空气略小,不溶于水。
分子构造式为__ N ≡N ,该化学键很牢固,键以破坏,因此一般状况下氮气性质__很稳定 。
2.化学性质:(1)工业合成氨旳反应方程式:(2)高温或闪电时与O 2旳反应旳反应方程式:________________________N 2+3H 22NH 3N 2+O 22NO或或或或或3Mg +N 2Mg 3N 2或或(3)点燃时与金属Mg(或Ca, Sr, Ba) 旳反应方程式:___________________以上反应均为__氮旳固定,即将空气中_游离_态旳氮气转化为化合态旳氮。
三.氮旳氧化物:N2O、(笑气麻醉剂)NO、N2O3、NO2、N2O4、N2O5注意:N2O3是HNO2酸酐;N2O5是HNO3酸酐。
其他旳氧化物都不是酸酐。
1.NO和NO2旳性质NO NO2物理性质无色,有毒,难溶于水红棕色有刺激性气味旳气体,有毒还原性2NO+ O2=2 NO2(NO与O2不共存)-----------------------氧化性6NO+4NH3 催化剂5N2+6H2O6NO2+8NH3催化剂7N2+12H2O强氧化性(相称于硝酸)化学性质与(碱)反应3NO2+H2O=2HNO3+NONO+NO2+2NaOH=2NaNO2+H2O∴2NO2+2NaOH=NaNO2+NaNO3+H2O(尾气处理)试验室制法3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2OCu+4HNO3 (浓)Cu(NO3)2+2NO2↑+2H2O搜集措施排水法(绝对不用排空法)向上排空气法(绝对不用排水法)注意:2NO2N2O4(一般状况下NO2气体不是纯净物)2.怎样鉴别一瓶红棕色气体是二氧化氮或溴蒸气?(找出尽量多旳措施)①AgNO3 :加入少许硝酸银溶液振荡,若有浅黄色沉淀生成,是溴蒸气,若无浅黄色沉淀生成,是二氧化氮。
高三化学氮族元素

学习目标: 1、掌握氮族元素的相似性和递变规律 2、掌握氮气的性质
一、氮族元素的相似性和递变规律 N
1、主要化合价: -3、+3、+5 最外 2、氢化物的通式: RH3 层电相似性: 3、氧化物的通式: R2O5、R2O3 子数 4、最高价氧化物对应的水 相同 化物的通式: HRO3、H3RO4 1、金属性 增强 ,非金属性 减弱 电子 2、氢化物的稳定性 减弱 , 层数递变性: 还原性 增强 不同 3、最高价氧化物对应的水 化物的酸性 减弱 , 碱性增强 4、密度逐渐 增大 5、熔沸点 先升高后降 低
二、氮气的性质
1、物理性质: 无色、无味、难溶于水的气体(1:0.02), 密度略小于空气 2、化学性质
结构 ( N N) 决定 性质 (不活泼) 决定
(用作保护气) 用途
①与氢气反应 高温、高压 N2+3H2 催化剂 2NH3 (工业合成氨) ②与镁的反应 N2+3Mg 点燃 Mg3N2 Mg N +6H O=3Mg(OH) +2NH ↑ 3 2 2 2 3 ③与氧气的反应 2NO(无色、有毒、难溶于水的气体,易被O2氧化) (有毒、有刺激性气味的红棕色气体、易 溶于水的气体,以氧化性为主,能使湿 2NO+O2 = 2NO2 润的淀粉碘化钾试纸变蓝) 3NO2+H2O=2HNO3+NO N2+O2
相 同 P 结点
As Sb Bi
构
不 同 点
下列说法错误的是:(AD ) A、随着原子序数的递增熔沸点逐渐升高 B、酸性:HNO3>H3PO4>H3AsO4 C、氢化物的稳定性:NH3>PH3>AsH3 D、 氢化物 的还原性:NH3>PH3>AsH3
高三化学复习氮族元素

专题十三 氮族元素氮和磷氮气的性质(1)氮气的物理性质:无色无味,不溶于水比空气略轻的气体。
(2)氮气的化学性质:分子中N≡N 非常牢固,通常情况下不易与其他物质反应。
N2 与氢气反应生成NH 3(高温高压铁触媒)与氧气在放电条件下生成NO 与活泼金属反应 3Mg+N 2 Mg 3N 2(3)氮气的用途:工业上合成氨制硝酸;用作保护气,用于:焊接金属、填充灯泡、保鲜食品;医学上用于冷冻麻醉;高科技中用液氮制造低温环境等。
4.磷及其化合物的性质(1)磷单质的化学性质和用途4P+5O 2 2P 2O 5 2P +3Cl 2 2PCl 3(l ) 2P +3Cl 2 2PCl 5(s ) 用途:制高纯度磷酸、红磷用于制农药、安全火柴、白磷制造燃烧弹和烟幕弹。
(2)磷的化合物①P 2O 5:极易溶于水,是较好的干燥剂(吸湿性很强)能与水作用:P 2O 5+H 2O (冷)=2HPO 3(剧毒) P 2O 5+3H 2O (热)=2H 3PO 4(无毒)②H 3PO 4:无色晶体,与水任意比例互溶,有吸湿性,可作干燥剂,属非氧化性酸,沸点高。
化学性质:具有酸的通性,是三元中强酸,是一种高沸点酸。
能与碱中和、与NaBr 、NaI 作用。
③磷酸盐:溶解性:磷酸二氢盐均易溶于水,溶液呈酸性;磷酸盐和磷酸一氢盐除钾、钠、铵盐外不溶于水。
相互转化:磷酸盐 磷酸一氢盐 磷酸二氢盐1.氮族元素最外层电子都是5个,主要显+5、+3、-3价。
本族元素形成的+3、-3价化合物中其原子已达到稳定结构,如NH 3、PCl 3、BiCl 3、Mg 3N 2。
点燃2.在氮族元素中氮和其它元素比较,有很大的特殊性,它的主要化合价有-3、+1、+2、+3、+4、+5等多种氮元素能以不同的价态与氧结合,可以形成多种氧化物:N2O、NO、N2O3、N2O4、NO2、N2O5。
在这些氧化物中NO2和N2O4可以通过非氧化还原反应相互转化:2NO2N2O4。
高中知识点规律大全《氮族元素》

高中知识点规律大全《氮族元素》氮族元素是元素周期表中第15族的元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)和铋(Bi)。
氮族元素具有共同的电子配置ns2np3,其中n 代表主量子数。
1.氮(N):-原子序数:7- 原子半径:65 pm- 密度:1.25 g/cm³-熔点:-210.1°C-沸点:-195.8°C氮是一种无色、无味、无毒的气体,在常温下存在于大气中。
它是空气中的主要成分,占据了78%的体积比例。
氮具有高度的化学稳定性,因此在自然界中很少以单质形式存在。
氮气可以通过固体氨的热分解或通过空气经过液氮的冷却得到。
氮与氢可以形成氨气(NH3),它是一种无色气体,具有强烈的刺激性气味。
氨气是一种重要的化学试剂,广泛用于农业和工业生产中。
氮还可以与氧形成氮氧化物(NOx),它们是空气污染的主要成分之一2.磷(P):-原子序数:15- 原子半径:100 pm- 密度:1.82 g/cm³-熔点:44.1°C-沸点:280.5°C磷是一种多态元素,有黑磷、红磷和白磷等多种形式。
白磷是最常见和最活泼的形式,它是一种蜡状固体,具有强烈的气味。
白磷在空气中容易燃烧,产生白烟和脱氧酸气。
红磷是一种比较稳定的形态,它不易燃烧。
磷是生物体中的关键元素之一,它在骨骼和牙齿的形成中起着重要作用。
磷还是DNA、RNA和ATP等核酸和能量储存分子的组成成分。
3.砷(As):-原子序数:33- 原子半径:119 pm- 密度:5.776 g/cm³-熔点:817.0°C-沸点:613.0°C砷是一种灰色金属,常形成硫化物矿物,如砷矿。
纯砷以三价形式存在,它具有金属和非金属两类性质。
砷的化合物有毒,并且对人体和环境有害。
砷化氢是一种无色气体,具有强烈的臭酸味。
4.锑(Sb):-原子序数:51-原子质量:121.760- 原子半径:140 pm- 密度:6.687 g/cm³-熔点:630.63°C-沸点:1587°C锑是一种蓝白色的金属,具有良好的导电性和导热性。
高中化学知识点规律大全——《氮族元素》

氮族元素1.氮和磷[氮族元素]包括氮(7N)、磷、(15P)、砷(33As)、锑(51Sb)、铋(83Bi)五种元素.氮族元素位于元素周期表中第VA族,其代表元素为氮和磷.[氮族元素的原子结构](1)相似性:①最外层电子数均为5个;②主要化合价:氮有-3、+1、+2、+3、+4、+5价;磷和砷有-3、+3、+5价;锑、铋有+3、+5价.(2)递变规律:按氮、磷、砷、锑、铋的顺序,随着核电荷数的增加,电子层数增多,原子半径增大,失电子能力增强,得电子能力减弱,非金属性减弱,金属性增强.在氮族元素的单质中,氮、磷具有较明显的非金属性;砷虽然是非金属,但有一些金属性;锑、铋为金属.[氮族元素单质的物理性质][氮气](1)氮元素在自然界中的存在形式:既有游离态又有化合态.空气中含N2 78%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素.(2)氮气的物理性质:纯净的氮气是无色气体,密度比空气略小.氮气在水中的溶解度很小.在常压下,经降温后,氮气变成无色液体,再变成雪花状固体.(3)氮气的分子结构:氮分子(N2)的电子式为,结构式为N≡N.由于N2分子中的N≡N 键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼.(4)氮气的化学性质:①N2与H2化合生成NH3N2 +3H22NH3说明该反应是一个可逆反应,是工业合成氨的原理.②N2与O2化合生成NO:N2 + O22NO说明在闪电或行驶的汽车引擎中会发生以上反应.(5)氮气的用途:①合成氨,制硝酸;②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑧在灯泡中填充氮气以防止钨丝被氧化或挥发; ④保存粮食、水果等食品,以防止腐烂;⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术; ⑥利用液氮制造低温环境,使某些超导材料获得超导性能. [NO 、NO 2性质的比较][自然界中硝酸盐的形成过程] (1)电闪雷鸣时:N 2+O 22NO(2) 2NO + O 2= 2NO 2(3)下雨时:3NO 2 + H 2O =2HNO 3 + NO(4)生成的硝酸随雨水淋洒到土壤中,并与土壤中的矿物作用生成能被植物吸收的硝酸盐.[光化学烟雾] NO 、NO 2有毒,是大气的污染物.空气中的NO 、NO 2污染物主要来自于石油产品和煤燃烧的产物、汽车尾气以及制硝酸工厂的废气.NO 2在紫外线照射下,发生一系列光化学反应,产生一种有毒的烟雾——光化学烟雾.因此,NO 2是造成光化学烟雾的主要因素.光化学烟雾刺激呼吸器官,使人生病甚至死亡. [磷](1)磷元素在自然界中的存在形式:自然界中无游离态的磷.化合态的磷主要以磷酸盐的形式存在于矿石中.动物的骨骼、牙齿和神经组织,植物的果实和幼芽,生物的细胞里都含有磷. (2)单质磷的化学性质: ①与O 2反应: 4P+5O 22P 2O 5②磷在C12中燃烧: 2P+3C12(不足量) 2PCl 3 2P+5Cl 2(足量)2PCl 5240℃白磷、红磷在空气中燃烧,都生成白色的白磷与红磷燃烧都生成P2O5,证明它们都是由磷元素形成的单质白磷红磷证明白磷与红磷所含元素相同——互为同素异[五氧化二磷、磷酸](1)五氧化二磷的性质:五氧化二磷是白色粉末状固体,极易吸水(因此可作酸性气体的干燥剂).P2O5是酸性氧化物,与水反应:P 2O5+3H2O2H3PO4(2)磷酸的性质、用途:磷酸(H3PO4)是一种中等强度的三元酸,具有酸的通性.磷酸主要用于制造磷肥,也用于食品、纺织等工业.222P222.铵盐[氨](1)氨的物理性质:①氨是无色、有刺激性气味的气体,比空气轻;②氨易液化.在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热.液态氨气化时要吸收大量的热,使周围的温度急剧下降;③氨气极易溶于水.在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);④氨对人的眼、鼻、喉等粘膜有刺激作用.若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛.(2)氨分子的结构:NH3的电子式为,结构式为,氨分子的结构为三角锥形,N 原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子.(3)氨的化学性质:①跟水反应.氨气溶于水时(氨气的水溶液叫氨水),大部分的NH3分子与H2O分子结合成NH3·H2O(叫一水合氨).NH3·H NH4+和OH-:NH3 + H23·H2NH4++ OH-a.氨水的性质:氨水具有弱碱性,使无色酚酞试液变为浅红色,使红色石蕊试液变为蓝色.氨水的浓度越大,密度反而越小(是一种特殊情况).NH3·H2O不稳定,故加热氨水时有氨气逸出:NH4++ OH-NH3↑+ H2Ob.氨水的组成:氨水是混合物(液氨是纯净物),其中含有3种分子(NH3、NH3·H2O、H2O)和3种离子(NH4+和OH-、极少量的H+).c.氨水的保存方法:氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水.通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里.d.有关氨水浓度的计算:氨水虽然大部分以NH3·H2O形式存在,但计算时仍以NH3作溶质.②跟氯化氢气体的反应:NH3 + HCl =NH4C1说明a.当蘸有浓氨水的玻璃棒与蘸有浓盐酸的玻璃棒靠近时,产生大量白烟.这种白烟是氨水中挥发出来的NH3与盐酸挥发出来的HCl化合生成的NH4C1晶体小颗粒.b.氨气与挥发性酸(浓盐酸、浓硝酸等)相遇,因反应生成微小的铵盐晶体而冒白烟,这是检验氨气的方法之—.c.氨气与不挥发性酸(如H2SO4、H3PO4等)反应时,无白烟生成.③跟氧气反应:4NH3 + 5O24NO + 6H2O说明这一反应叫做氨的催化氧化(或叫接触氧化),是工业上制硝酸的反应原理之一.(4)氨气的用途:①是氮肥工业及制造硝酸、铵盐、纯碱的原料;②是有机合成工业如合成纤维、塑料、染料、尿素等的常用原料;③用作冰机中的致冷剂.[铵盐]铵盐是由铵离子(NH4+)和酸根阴离子组成的化合物.铵盐都是白色晶体,都易溶于水.(1)铵盐的化学性质:①受热分解.固态铵盐受热都易分解.根据组成铵盐的酸根阴离子对应的酸的性质的不同,铵盐分解时有以下三种情况:a.组成铵盐的酸根阴离子对应的酸是非氧化性的挥发性酸时,则加热时酸与氨气同时挥发,冷却时又重新化合生成铵盐。
氮族元素知识点归纳

氮族元素知识点归纳氮族元素是周期表中的第15族元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)和钋(Bi)。
以下是氮族元素的一些重要知识点的归纳:1.原子性质:-原子结构:氮族元素的原子核外层电子数为5个,包括3个p电子和2个s电子。
氮族元素的原子半径随着周期数的增加而增加,同时电子层数也增加。
-电离能:氮族元素的电离能随着周期数的增加而增加,原子核对外层电子的吸引力增强。
-电负性:氮族元素的电负性随着周期数的增加而增加,原子核向外层电子施加的吸引力增强。
-氧化态:氮族元素通常呈-3氧化态,但也能呈现其他氧化态,如氮的氧化态为-1到+5,磷的氧化态为-3到+5-化合价:氮族元素的化合价通常为3、52.物理性质:-氮:无色、无臭、味道也基本无味,为一个非金属气体。
它是空气中的主要成分之一,占据了输配器中的78%。
-磷:红色或白色固体,存在多种同素异形体,包括白磷、红磷和黑磷。
白磷具有毒性,易自燃,红磷为不活泼的固体,黑磷则为金属光泽的固体。
-砷:银灰色金属外观,有毒。
它有多个形态,包括黄砷(三角形晶体)、白砷(金属光泽)、黑砷和金砷(金属光泽)。
-锑:银白色,有金属光泽,是一种脆性材料。
它在空气中稳定,在酸中溶解度较高。
-钋:银白色金属外观,有较高毒性。
它是地壳中最不多见的元素之一3.化学性质:-反应活性:氮族元素的反应活性随周期数的增加而增加。
氮气稳定且不易反应,磷在空气中燃烧,而砷、锑和钋则会与氧反应。
-氮与氢气反应生成氨气(NH3),这是合成肥料和化学品的主要工艺。
-磷可与氧气反应生成五氧化二磷(P2O5),用作化学品和肥料的原料。
-砷常与卤素形成盐类,如三氯化砷(AsCl3)和五氯化砷(AsCl5)。
-锑的化合物通常具有还原性,可以与氯气反应生成三氯化锑(SbCl3)。
-钋具有高放射性,其化合物主要用于放射疗法和核科学研究。
4.应用:-氮:氮气广泛用于制造氨气,用作农业肥料和化学品的原料。
高考化学氮族

高考化学——氮族元素考点阐释1.了解氮气的分子结构和化学性质,了解氮的氧化物(NO 、NO 2)的性质及其对大气的污染与防止方法,掌握硝酸的物理性质和化学性质。
2.掌握氨的分子结构、物理性质、化学性质、实验室制法等,掌握氨水的成分及主要性质(弱碱性),了解铵盐的性质与用途。
3.了解磷的同素异形体(白磷、红磷),单质磷的化学性质,磷酸盐和磷肥的性质、用途。
命题趋向与应试策略(一)重视基础 形成知识规律1.氮及其化合物间的转化关系2.分析理解元素化合物性质的方法规律(1)氮元素的化学活动性与氮分子的稳定性元素的性质取决于元素的原子结构。
氮的原子半径小,吸引电子的能力较强,故表现出较强的化学活动性,所以说氮元素是一种较为活泼的非金属元素。
氮气的稳定性则取决于氮分子的结构。
氮分子是由两个氮原子共用三对电子结合而成的,氮分子中有共价三键(N ≡N),它的键能很大(946 kJ ·mol -1),当氮气参加化学反应时,必须打开(破坏)分子中的三键,这就需要吸收很高的能量。
因此,在通常情况下,氮气的性质很不活泼,很难跟其他物质发生化学反应。
只有在高温或放电条件下,氮分子获得了足够的能量,使氮分子中的共价键断裂而形成活动性较强的氮原子,才能跟氢气、氧气、金属等物质发生化学反应。
(2)由氨的分子结构分析理解氨的性质:NH 3分子为三角锥形,N —H 键具有极性,决定了NH 3为极性分子,因而氨易液化(易液化的还有SO 2、Cl 2等);氨极易溶于水,其水溶液的密度小于1;NH 3分子也极易与酸反应生成铵盐。
NH 3分子中氮元素呈-3价,为氮元素的最低价态,具有还原性,能在一定条件下与O 2、Cl 2、CuO 等反应,被它们氧化:4NH3+5O 2催化剂∆======4NO +6H 2O 2NH 3+3Cl 2===N 2+6HCl 2NH3+3CuO ∆====3Cu +N 2+3H 2O(3)关于硝酸性质的分析理解方法①从属类去分析HNO 3具有酸的通性。
氮族元素知识点整理

氮族元素,第V主族:元素符号核电荷数电子层结构原子半径pm 主要化合价氮N 7 2 5 70 -3、+1、+2、+3、+4、+5 磷P 15 2 8 5 110 -3、+3、+5砷As 33 2 8 18 5 121 -3、+3、+5锑Sb 51 2 8 18 18 5 141 +3、+5铋Bi 83 2 8 18 32 18 5 152 +3、+5【最外层电子排布、元素化合价共同点】∵最外层电子都有5个,∴最高价+5,最低价-3∴最高价氧化物R2O5,气态氢化物RH3【原子半径、金属性、非金属性的递变规律】∵原子半径随着电子层数的增加而增大,得电子能力减弱→非金属性减弱失电子能力增强→金属性增强氮、磷:较显著的非金属性砷:较弱的金属性和非金属性锑、铋:较显著的金属性氮族元素的非金属性比同周期的氧族和卤族元素弱氮气N2一、氮元素的存在:单质:氮气,占大气体积的78%,总质量的75%化合物:无机物(硝酸盐、铵盐、氮的氧化物)有机物(蛋白质、核酸)二、物理性质:无色、无味、气体标况下,密度=1.25g/L(比空气略小,但相近,只能用排水法收集)沸点:-195.8℃无色液体(液氮)难液化熔点:-209.86℃雪状固体难溶于水(1:0.02)三、氮分子的结构:分子式:N2电子式:结构式:用元素符号和短线来表示分子中原子结合的式子(一根短线表示一对共用电子,即共价键)氮分子的结构很稳定,破坏分子中的共价键需要很大的能量通常情况下,N 2的化学性质很不活泼,很难跟其他物质发生化学反应一定条件下(高温、放电),获得足够能量,能跟H 2、O 2、金属等反应四、化学性质:1、与H 2反应:N 2+ 3H 2 2NH 3 + Q (工业合成氨)【注】反应要加热,不一定是吸热反应2、与O 2反应:NO 2O N 22−−→−+放电 (无色、有毒、不溶于水)3、与金属反应:高温时,N 2能跟钾、钠、镁、钙、锶、钡等金属化合 -3232N Mg N Mg 3−−→−+高温 (式量100:CaCO 3、KHCO 3)氮化镁、灰色【镁在空气中燃烧】232N Mg N Mg 3−−→−+高温 (微量)MgO 2O Mg 22−−→−+点燃 (主要产物,因O 2比N 2活泼)C MgO 2CO Mg 22+−→−+△【氮化镁遇水】↑+↓−→−+32223NH 2OH Mg 3O H 6N Mg )((非氧化还原)五、用途1、 利亚N 2的稳定性(化学性质不活泼):代替稀有气体作焊接金属时的保护气充填灯泡,防止钨丝氧化,减慢钨丝的挥发 充氮包装,食品保鲜高温高压 催化剂2、 利用液氮的低温:深度冷冻物质提供超导材料的工作环境 保存待移植的活性器官 冷冻麻醉开刀3、 利用一定条件下的反应:合成氨、制硝酸、氮肥、炸药、塑料、药品、染料等六、氮的固定(固氮)【定义】把大气中游离态的氮转化为氮的化合物的过程1、生物固氮豆科植物根部的根瘤菌中存在固氮酶,能把空气中游离的氨变成氨(铵态氮肥)2、大气固氮——“雷电发庄稼”闪电时,大气中的氮转化为氮的氧化物,经降水生成极稀的硝酸(硝态氮肥)NO 2O N 22−−→−+放电 22NO 2O NO 2−→−+NO HNO 2O H NO 3322+−→−+3、工业固氮——“先合成氨,再生产各种化肥”N 2 + 3H 22NH 3固氮途径自然固氮 人工固氮 生物固氮 大气固氮 化学模拟生物固氮 工业固氮 高温高压 催化剂氨NH 3一、氨分子的结构:氮的气态氢化物 分子式:NH 3电子式:N HH H结构式:N HH H分子空间构型:三角锥形氮原子位于锥顶,3个氢原子位于锥底,键角107°18′,极性分子二、物理性质:1、无色、刺激性气味、气体2、比空气轻,标况下,密度=0.771g/L3、极易溶于水(1:700),形成氨水难溶 不易溶 能(可)溶 易溶 极易溶 H 2、CON 2<O 2CO 2 1:1Cl 2 1:2 H 2S 1:2.6SO 2 1:40HCl 1:500 NH 3 1:700【喷泉实验】视频现象:气体体积迅速减小,烧杯里的酚酞溶液由玻璃管喷入烧瓶,形成红色喷泉 结论:① 氨气极易溶于水 ② 氨水溶液呈碱性原理:气体能被胶头滴管中挤出的少量液体快速吸收,使烧瓶内气体压强远远低于外界大气压关键:① 烧瓶、预先吸液的滴管、长直玻璃管外部都要干燥 ② 气体要充满圆底烧瓶③ 装置气密性好,不漏气,止水夹要夹紧 烧瓶中气体 Cl 2 CO 2 H 2S NO 2+NO HCl 滴管中液体浓NaOH浓NaOH浓NaOH浓NaOHH 2O4、易液化,成无色液体,放出大量的热(常温冷却到-33.5℃、常温加压到700-800kPa ) (易液化的气体还有:Cl 2、SO 2、HF )液氨气化时要吸收大量热,能使周围温度剧降——制冷剂三、化学性质: 1、与水反应:NH 3 + H 2O NH 3·H 2O NH 4+ + OH -化学平衡 电离平衡【氨水中有6种微粒,3分3离】NH 3、H 2O 、NH 3·H 2ONH 4+、OH -、H +(极少量)【氨水与液氨的区别】液氨是纯净物,只有NH 3分子氨水是混合物,含6种微粒【氨水的性质】弱碱性:氨气本身不显碱性弱电解质溶液:电解质是NH 3·H 2O不稳定性:O H NH O H NH 2323+↑−→−⋅△刺激性气味:游离的氨分子挥发性:NH 3易挥发(浓氨水瓶口有白雾) 保存:密封、阴暗处密度小于纯水,越浓密度越小(28%,密度=0.91g/cm 3) 同酒精 计算氨水的浓度,以NH 3计算沉淀性:很好的沉淀剂,制取Al(OH)3、Fe(OH)3弱还原性:O H 8N Cl NH 6O H NH 8Cl 3224232++−→−⋅+ 离子方程式书写:① 反应物, 写化学式② 生成物:浓溶液+加热——NH 3↑+H 2O 稀溶液+不加热——化学式 2、与酸反应:视频Cl NH HCl NH 43−→−+ 白烟(挥发出的氨跟氯化氢化合生成的微小的氯化铵晶体)3433NO NH HNO NH −→−+ 硝铵 白烟424423S O NH S O H 2NH )(−→−+ 硫胺 无白烟 34223HCO NH O H CO NH −→−++ 碳铵 无白烟【注】NH 3与挥发性酸反应生成铵盐,有白烟 【氨跟强酸溶液反应的本质】++−→−+43NH H NH3、与氧气反应:(最低价,具有还原性)(Pt 、Cr 2O 3)Q O H 6NO 4O 5NH 4223++→+催化剂△ 氨的催化氧化(接触氧化),工业制硝酸的基础【现象】 ① 虽然停止加热,催化剂仍能保持红热② 圆底烧瓶内出现红棕色气体 22NO 2O NO 2−→−+ ③ 紫色石蕊溶液变红 NO HNO 2O H NO 3322+−→−+ ④ 烧瓶内有时会看到白色烟雾 3433NO NH HNO NH −→−+ ⑤ 圆底烧瓶内红棕色不明显 322HNO 4O H 2O 3NO 4−→−++4、与其他氧化剂反应:Cl NH 6N NH 8Cl 34232+−→−+ 氨气过量 ——工厂检验氯气 HCl 6N NH 2Cl 3232+−→−+ 氯气过量O H 3N Cu 3NH 2CuO 3223++−→−+△H 2O 2、KMnO 4 均可氧化NH 3四、制法1、自然界:动植物体内的蛋白质腐败产生2、工业制法: 原理: N 2 + 3H 2 2NH 3 【注】可逆反应,得到的产品是3者的混合物,利用NH 3易液化的特点将其分离后,N 2和H 2可循环使用N 2:蒸馏液态空气H 2:焦炭与高温水蒸气反应 22H CO O H C +−−→−+高温222H CO O H CO +−−→−+高温3、实验室制法:、1) 固态铵盐与固体强碱加热【原料】常用消石灰,不用烧碱:① 在加热条件下烧碱对玻璃的腐蚀作用更强,试管易碎裂 ② 烧碱价格昂贵【原理】 O H 2NH 2CaCl OH Ca Cl NH 223224+↑+−→−+△)( 强碱制弱碱【装置】固固加热,同O 2【干燥】碱石灰——干燥管、U 型管(不能用浓硫酸、无水氯化钙 CaCl 2·8NH 3)【收集】只能用向下排空气(集气试管口棉花作用:防止气体对流,有利于集满) 【检验】① 湿润的红色石蕊试纸,变蓝高温高压 催化剂② 把气体通入酚酞试液,试液变红氨气是中学化学唯一的碱性气体③ 蘸有浓盐酸的玻璃棒,白烟【验满】① 湿润的红色石蕊试纸放在集气瓶口,变蓝 ② 蘸有浓盐酸的玻璃棒接近瓶口,白烟 【尾气】用水浸湿的棉花团2)在生石灰(或固体烧碱)中加入浓氨水生石灰(或固体烧碱)遇到浓氨水放出大量热,使一水合氨分解。
高中化学氮族元素知识点
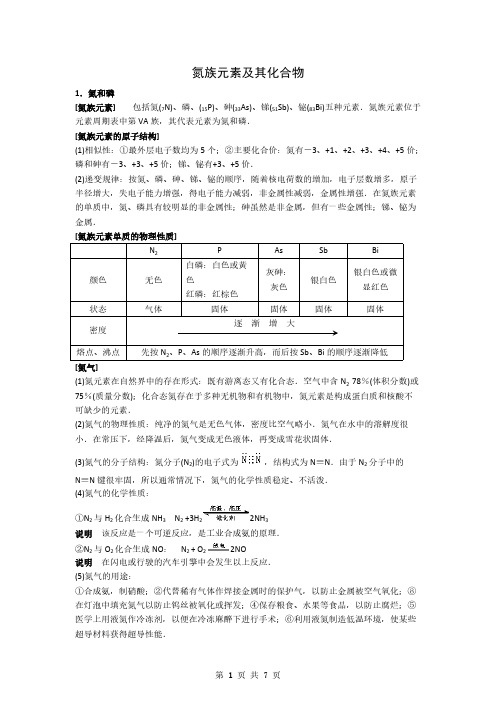
2NO + O2= 2NO2
②NO 中的氮为+2 价,处于中间价态,(工业制 HNO3 原理.在此反应中,
既有氧化性又有还原性
二氧化氮(NO2) 为红棕色、有刺激性气味、有毒的 气体,易溶于水
与 H2O 反应:
3NO2 + H2O=2HNO3 + NO
NO2 同时作氧化剂和还原剂)
2NO (2) 2NO + O2= 2NO2(3)下雨时:3NO2 + H2O=2HNO3 + NO
可缺少的元素.
(2)氮气的物理性质:纯净的氮气是无色气体,密度比空气略小.氮气在水中的溶解度很
小.在常压下,经降温后,氮气变成无色液体,再变成雪花状固体.
(3)氮气的分子结构:氮分子(N2)的电子式为
N≡N 键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼. (4)氮气的化学性质:
①N2 与 H2 化合生成 NH3 N2 +3H2
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,系电,通力根1保过据护管生高线产中敷工资设艺料技高试术中卷0资不配料仅置试可技卷以术要解是求决指,吊机对顶组电层在气配进设置行备不继进规电行范保空高护载中高与资中带料资负试料荷卷试下问卷高题总中2体2资,配料而置试且时卷可,调保需控障要试各在验类最;管大对路限设习度备题内进到来行位确调。保整在机使管组其路高在敷中正设资常过料工程试况1卷中下安,与全要过,加度并强工且看作尽护下可1都关能可于地以管缩正路小常高故工中障作资高;料中对试资于卷料继连试电接卷保管破护口坏进处范行理围整高,核中或对资者定料对值试某,卷些审弯异核扁常与度高校固中对定资图盒料纸位试,置卷编.工保写况护复进层杂行防设自腐备动跨与处接装理地置,线高尤弯中其曲资要半料避径试免标卷错高调误等试高,方中要案资求,料技编试术写5、卷交重电保底要气护。设设装管备备置线4高、调动敷中电试作设资气高,技料课中并3术试、件资且中卷管中料拒包试路调试绝含验敷试卷动线方设技作槽案技术,、以术来管及避架系免等统不多启必项动要方高式案中,;资为对料解整试决套卷高启突中动然语过停文程机电中。气高因课中此件资,中料电管试力壁卷高薄电中、气资接设料口备试不进卷严行保等调护问试装题工置,作调合并试理且技利进术用行,管过要线关求敷运电设行力技高保术中护。资装线料置缆试做敷卷到设技准原术确则指灵:导活在。。分对对线于于盒调差处试动,过保当程护不中装同高置电中高压资中回料资路试料交卷试叉技卷时术调,问试应题技采,术用作是金为指属调发隔试电板人机进员一行,变隔需压开要器处在组理事在;前发同掌生一握内线图部槽 纸故内资障,料时强、,电设需回备要路制进须造行同厂外时家部切出电断具源习高高题中中电资资源料料,试试线卷卷缆试切敷验除设报从完告而毕与采,相用要关高进技中行术资检资料查料试和,卷检并主测且要处了保理解护。现装场置设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
高中化学知识点详解大全——《氮及氮的化合物氮族元素》

高中化学知识点详解大全——《氮及氮的化合物氮族元素》氮及氮的化合物是高中化学中的重要知识点之一,下面将详细介绍氮的性质、氮的化合物以及氮族元素的一些特点。
1.氮的性质:氮是化学元素周期表中的第七元素,原子序数为7,原子符号为N。
氮气是大气的主要成分之一,占约78%。
氮气是一种无色、无味、不可燃的气体,密度较空气略大。
在高温和高压条件下,氮气可以与氢反应生成氨气。
2.氮的化合物:氮主要以N2分子形式存在于大气中,但在化学反应中,氮通常以离子形式存在。
氮的最常见的化合物是氨(NH3)和氧化亚氮(NO)。
氨是一种气体,有强烈的刺激性气味;氧化亚氮是一种无色气体,对人体有毒。
此外,氮还可以与氧形成一系列的氮氧化物,如二氧化氮(NO2)和三氧化二氮(N2O3)等。
3.氮的化合物的制备和应用:氨的制备通常是通过哈伯–博帕法制取,即将氮气与氢气通过催化剂(通常是铁)的作用下,在高温和高压条件下反应生成氨气。
氨被广泛用于制造化肥、合成纤维和塑料等工业生产中。
氧化亚氮通常是通过氧化铵制备,氧化亚氮可以用作氧化剂、爆炸药以及用于治疗心血管疾病的药物。
4.氮族元素的特点:氮族元素是位于元素周期表第15族的元素,包括氮、磷、砷、锑和铋。
这些元素的原子结构具有相似的电子排布,因此它们有一些共同的化学特性。
例如,氮族元素通常形成负电荷的离子,因为它们的原子有5个价电子。
这些元素的化合物通常具有共有键和离子键的性质。
总结:本文介绍了高中化学中关于氮及氮的化合物和氮族元素的知识点。
氮是一种常见的元素,主要以氮气的形式存在于大气中。
氮的化合物包括氨、氧化亚氮等,这些化合物有广泛的应用。
氮族元素具有一些共同的特点,包括原子结构和化学性质的相似性。
对于理解氮及氮化合物和氮族元素的特性,有助于学生进一步学习高中化学相关知识。
高中化学基础知识滚动记忆08氮族元素

非金属及其化合物第二节氮族元素一、N21.N为7号元素,其常见的化合价有-3、+1、+2、+3、+4、+5,共有六种氧化物N2O、NO、N 2O3、NO2、N2O4、N2O5. N2的结构式为N≡N,电子式为。
2.为无色无味的气体,难溶于水,化学性质稳定,是大气的主要成分之一,无毒。
常用作保护气,沸点为零下160多度,可做冷冻剂。
3.一定条件下可发生一些化学反应:①3Mg+ N2Mg3N2,②N2+ 3H22NH3,③N2+ O2 2NO。
①、②中N2做氧化剂,③中N2做还原剂。
反应③是汽车尾气中含有氮的氧化物的原因,也是“雷雨发庄稼”的原理的第一步反应的方程式。
4. N2在实验室可由下列反应制备:NH4Cl+ NaNO2△NaCl+ N2↑+2H2O,工业上通过液化空气的办法来制取N2。
二、NH31.结构式为:,电子式为:,空间结构为三角锥形。
2.无色有刺激性气味的气体,极易溶于水(通常条件下为1︰700),沸点为-33.3℃,易液化,液氨挥发时吸收大量的热,因此可做致冷剂。
3.化学性质:①和H2O反应:NH3+H2O NH3·H2O NH4++ OH-,NH3·H2O为一元弱碱,氨水可使指示剂变色,氨水中共有六种微粒:NH3、H2O、NH3·H2O、NH4+、OH-、H+;②和H+反应:NH3+ H+= NH4+,蘸有浓氨水的玻璃棒和蘸有浓盐酸或浓硝酸的玻璃棒靠近时,在两个玻璃棒之间会有白烟生成,而和蘸有浓硫酸的玻璃棒靠近时无白烟生成;③和盐溶液反应:Al3++3NH3·H2O = Al(OH)3↓+ 3NH4+,Ag++NH3·H2O(少量) =AgOH+NH4+,Ag++2NH3·H2O(过量) =[Ag(NH3)2] ++2H2O,Cu2++2NH3·H2O(少量) =Cu(OH)2+2NH4+,Cu2++4NH3·H2O(过量) =[Cu(NH3)4] 2++ 2H2O。
氮族元素高三总复习(整理)

3、强氧化性:
与还原性物质反应:如金属单质、非金属单质
Fe2+、I-、S2-、SO2等。
1)、与金属反应 不产生氢气,N元素被还原 反应规律: 金属
稀硝酸
浓硝酸
高价金属 + NO2
高价金属 + NO
分析Cu、Fe分别与浓、稀硝酸反应 常温时,Fe、Al遇浓硝酸也被钝化
a.几乎和所有金属(除金、铂等少数 金属外) b.与任何金属反应均不生成H2 ,说明 呈现氧化性的不是H+而是HNO3,但由于 H+的量决定HNO3的量,所以硝酸发生化 学反应时要特别关注H+的浓度 c.与金属反应硝酸既起氧化剂的作用, 又起酸的作用。 d.铁、铝遇冷浓HNO3发生钝化,其原 因是在铁、铝表面氧化生成一层致密 的氧化膜,阻止反应进一步发生。
(冒白烟)
(
点燃
白 (2)与氯气的反应:点燃 2P + 3Cl2 (不足) = 2PCl3 (液体) 色
2P + 5Cl2 (足量)
烟 = 2PCl5(固体)雾
)
磷的化合物
1、五氧化二磷(P2O5) 物性: 白色固体 ,有强烈的吸水性 、脱水性。作干燥剂 化性:P2O5 + H2O(冷水) = 2HPO3 (剧毒) P2O5 + 3H2O(热水)= 2H3PO4(无毒) 2、磷酸(H3PO4) 无色透明晶体,有吸湿性,与水以任意比互溶。 物性: 化性:①是一种三元中强酸 ( 电离不完全 )
②高沸点非氧化性酸 (制HI HBr H2S 还原性挥发性酸). ③磷酸比硝酸稳定,不易分解 。 点燃 制法: 高纯度磷酸制法: 4P(白磷) + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4 △ 工业制法: Ca3(PO4)2 + 3H2SO4 = 2H3PO4 + 3CaSO4↓
高中化学氮族元素知识点
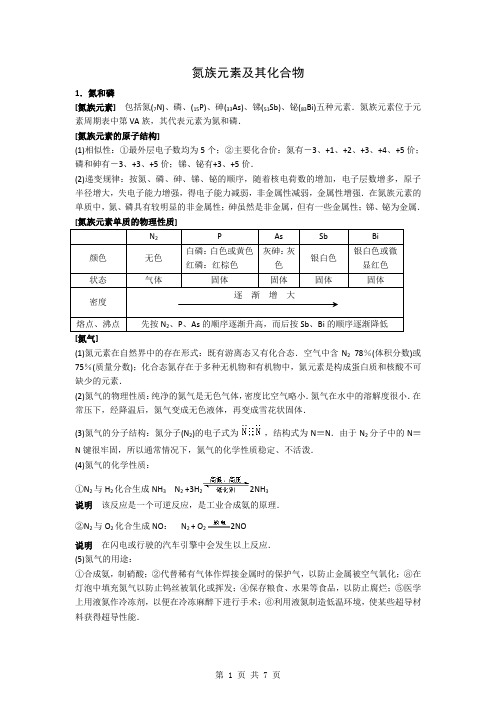
氮族元素及其化合物1.氮和磷[氮族元素]包括氮(7N)、磷、(15P)、砷(33As)、锑(51Sb)、铋(83Bi)五种元素.氮族元素位于元素周期表中第VA族,其代表元素为氮和磷.[氮族元素的原子结构](1)相似性:①最外层电子数均为5个;②主要化合价:氮有-3、+1、+2、+3、+4、+5价;磷和砷有-3、+3、+5价;锑、铋有+3、+5价.(2)递变规律:按氮、磷、砷、锑、铋的顺序,随着核电荷数的增加,电子层数增多,原子半径增大,失电子能力增强,得电子能力减弱,非金属性减弱,金属性增强.在氮族元素的单质中,氮、磷具有较明显的非金属性;砷虽然是非金属,但有一些金属性;锑、铋为金属.[氮族元素单质的物理性质]N2P As Sb Bi颜色无色白磷:白色或黄色红磷:红棕色灰砷:灰色银白色银白色或微显红色状态气体固体固体固体固体密度逐渐增大熔点、沸点先按N2、P、As的顺序逐渐升高,而后按Sb、Bi的顺序逐渐降低[氮气](1)氮元素在自然界中的存在形式:既有游离态又有化合态.空气中含N278%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素.(2)氮气的物理性质:纯净的氮气是无色气体,密度比空气略小.氮气在水中的溶解度很小.在常压下,经降温后,氮气变成无色液体,再变成雪花状固体.(3)氮气的分子结构:氮分子(N2)的电子式为,结构式为N≡N.由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼.(4)氮气的化学性质:①N2与H2化合生成NH3N2 +3H22NH3说明该反应是一个可逆反应,是工业合成氨的原理.②N2与O2化合生成NO:N2 + O22NO说明在闪电或行驶的汽车引擎中会发生以上反应.(5)氮气的用途:①合成氨,制硝酸;②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑧在灯泡中填充氮气以防止钨丝被氧化或挥发;④保存粮食、水果等食品,以防止腐烂;⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⑥利用液氮制造低温环境,使某些超导材料获得超导性能.[NO、NO2性质的比较]氮的氧化物一氧化氮(NO) 二氧化氮(NO2)物理性质为无色、不溶于水、有毒的气体为红棕色、有刺激性气味、有毒的气体,易溶于水化学性质①极易被空气中的O2氧化:2NO + O2= 2NO2②NO中的氮为+2价,处于中间价态,既有氧化性又有还原性与H2O反应:3NO2 + H2O=2HNO3 + NO(工业制HNO 3原理.在此反应中,NO2同时作氧化剂和还原剂)[自然界中硝酸盐的形成过程](1)电闪雷鸣时:N2+O22NO (2) 2NO + O2= 2NO2(3)下雨时:3NO2 + H2O=2HNO3 + NO(4)生成的硝酸随雨水淋洒到土壤中,并与土壤中的矿物作用生成能被植物吸收的硝酸盐.[光化学烟雾]NO、NO2有毒,是大气的污染物.空气中的NO、NO2污染物主要来自于石油产品和煤燃烧的产物、汽车尾气以及制硝酸工厂的废气.NO2在紫外线照射下,发生一系列光化学反应,产生一种有毒的烟雾——光化学烟雾.因此,NO2是造成光化学烟雾的主要因素.光化学烟雾刺激呼吸器官,使人生病甚至死亡.[磷](1)磷元素在自然界中的存在形式:自然界中无游离态的磷.化合态的磷主要以磷酸盐的形式存在于矿石中.动物的骨骼、牙齿和神经组织,植物的果实和幼芽,生物的细胞里都含有磷.(2)单质磷的化学性质:①与O2反应:4P+5O22P2O5②磷在C12中燃烧:2P+3C12(不足量) 2PCl32P+5Cl2(足量) 2PCl5[磷的同素异形体——白磷与红磷]磷的同素异形体白磷红磷说明物理性质颜色、状态无色蜡状固体红棕色粉末①白磷与红磷的结构不同是物理性质存在差别的原因②由两者物理性质的不同,证明了白磷与红磷是不同的单质密度(g·cm-3)1.822.34溶解性不溶于水,溶于CS2不溶于水,也不溶于CS2毒性剧毒无毒着火点40℃(白磷受到轻微的摩擦就会燃烧;常温时,白磷可被氧化而发光)240℃化学性质白磷、红磷在空气中燃烧,都生成白色的P2O5白磷与红磷燃烧都生成P2O5,证明它们都是由磷元素形成的单质相互转化白磷红磷证明白磷与红磷所含元素相同——互为同素异形体保存方法密封保存,少量白磷保存在水中密封保存,防止吸湿切削白磷应在水中进行用途制造高纯度磷酸;制造燃烧弹、烟幕弹制造高纯度磷酸;制农药、安全火柴[五氧化二磷、磷酸](1)五氧化二磷的性质:五氧化二磷是白色粉末状固体,极易吸水(因此可作酸性气体的干燥剂).P2O5是酸性氧化物,与水反应:P2O5+3H2O2H3PO4(2)磷酸的性质、用途:磷酸(H3PO4)是一种中等强度的三元酸,具有酸的通性.磷酸主要用于制造磷肥,也用于食品、纺织等工业.[氮、磷元素及其单质、化合物性质的比较]元素氮(N)磷(P)自然界中存在的形式游离态和化合态只有化合态单质与O2化合的情况N2+O22NO(易)4P+5O22P2O5(难)单质与H2化合的情况N2 +3H22NH32P(蒸汽) + 3H22PH3单质的化学活泼性及原因单质活泼性:N2<P原因:N2分子中N≡N键很牢固,故N2性质稳定、不活泼氢化物的稳定性NH3>PH3最高价氧化物对应水化物的酸性HNO3>H3PO4非金属性N>P2.铵盐[氨](1)氨的物理性质:①氨是无色、有刺激性气味的气体,比空气轻;②氨易液化.在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热.液态氨气化时要吸收大量的热,使周围的温度急剧下降;③氨气极易溶于水.在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);④氨对人的眼、鼻、喉等粘膜有刺激作用.若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛.(2)氨分子的结构:NH3的电子式为,结构式为,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子.(3)氨的化学性质:①跟水反应.氨气溶于水时(氨气的水溶液叫氨水),大部分的NH3分子与H2O分子结合成NH3·H2O(叫一水合氨).NH3·H2O为弱电解质,只能部分电离成NH4+和OH-:NH3 + H2O NH3·H2O NH4++ OH-a.氨水的性质:氨水具有弱碱性,使无色酚酞试液变为浅红色,使红色石蕊试液变为蓝色.氨水的浓度越大,密度反而越小(是一种特殊情况).NH3·H2O不稳定,故加热氨水时有氨气逸出:NH4++ OH-NH3↑+ H2Ob.氨水的组成:氨水是混合物(液氨是纯净物),其中含有3种分子(NH3、NH3·H2O、H2O)和3种离子(NH4+和OH-、极少量的H+).c.氨水的保存方法:氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水.通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里.d.有关氨水浓度的计算:氨水虽然大部分以NH3·H2O形式存在,但计算时仍以NH3作溶质.②跟氯化氢气体的反应:NH3 + HCl =NH4C1说明a.当蘸有浓氨水的玻璃棒与蘸有浓盐酸的玻璃棒靠近时,产生大量白烟.这种白烟是氨水中挥发出来的NH3与盐酸挥发出来的HCl化合生成的NH4C1晶体小颗粒.b.氨气与挥发性酸(浓盐酸、浓硝酸等)相遇,因反应生成微小的铵盐晶体而冒白烟,这是检验氨气的方法之—.c.氨气与不挥发性酸(如H2SO4、H3PO4等)反应时,无白烟生成.③跟氧气反应:4NH3 + 5O24NO + 6H2O说明 这一反应叫做氨的催化氧化(或叫接触氧化),是工业上制硝酸的反应原理之一. (4)氨气的用途:①是氮肥工业及制造硝酸、铵盐、纯碱的原料;②是有机合成工业如合成纤维、塑料、染料、尿素等的常用原料;③用作冰机中的致冷剂. [铵盐]铵盐是由铵离子(NH 4+)和酸根阴离子组成的化合物.铵盐都是白色晶体,都易溶于水. (1)铵盐的化学性质:①受热分解.固态铵盐受热都易分解.根据组成铵盐的酸根阴离子对应的酸的性质的不同,铵盐分解时有以下三种情况:a .组成铵盐的酸根阴离子对应的酸是非氧化性的挥发性酸时,则加热时酸与氨气同时挥发,冷却时又重新化合生成铵盐。
氮族元素知识归纳

一、N
2
的化学性质
1.与H
2
的反应——氧化性
N
2(g)+3H
2
(g) =2NH
3
(g) (条件是催化剂,加热加压)
(1)该反应为可逆反应,而且反应速率慢,所以需要高温、高压和催化剂。
该感应是工业上合成氨的原理。
(2)反应类型为化合反应、可逆反应、放热反应、氧化还原反应等多种类型。
(3)氮、氧、氟非金属性的比较:F
2与H
2
在暗处就能爆炸生成HF;
H
2与O
2
点燃时反应生成H
2
O;
N
2与H
2
在高温、高压和催化剂条件下反应生成NH
3。
所以单质的氧化性:F
2
>
O
2>N
2
;元素的非金属性:F>O>N。
2.与O
2
反应——还原性
N+O
2
=2NO (条件是放电)
(1)反应条件是放电或高温,而不是点燃或加热。
(2)汽车、摩托车等尾气中的NO也是在气缸中的电火花作用下面发生上述反应生成的。
(3)N
2与O2不能一步生成NO
2
,类似的还有S和O
2
不能一步生成SO
2。
3.与Mg反应——氧化性
3Mg+N
2=Mg
3
N
2
(条件是点燃)
二、利用氮族元素性质的相似性和递变性预测元素的性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学知识点规律大全——氮族元素.氮和磷[氮族元素]包括氮(7N)、磷、(15P)、砷(33As)、锑(51Sb)、铋(83Bi)五种元素.氮族元素位于元素周期表中第VA族,其代表元素为氮和磷.[氮族元素的原子结构](1)相似性:①最外层电子数均为5个;②主要化合价:氮有-3、+1、+2、+3、+4、+5价;磷和砷有-3、+3、+5价;锑、铋有+3、+5价.(2)递变规律:按氮、磷、砷、锑、铋的顺序,随着核电荷数的增加,电子层数增多,原子半径增大,失电子能力增强,得电子能力减弱,非金属性减弱,金属性增强.在氮族元素的单质中,氮、磷具有较明显的非金属性;砷虽然是非金属,但有一些金属性;锑、铋为金属.[氮族元素单质的物理性质]N2P As Sb Bi颜色无色白磷:白色或黄色红磷:红棕色灰砷:灰色银白色银白色或微显红色状态气体固体固体固体固体密度逐渐增大熔点、沸点先按N2、P、As的顺序逐渐升高,而后按Sb、Bi的顺序逐渐降低[氮气](1)氮元素在自然界中的存在形式:既有游离态又有化合态.空气中含N278%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素.(2)氮气的物理性质:纯净的氮气是无色气体,密度比空气略小.氮气在水中的溶解度很小.在常压下,经降温后,氮气变成无色液体,再变成雪花状固体.(3)氮气的分子结构:氮分子(N2)的电子式为,结构式为N≡N.由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼.(4)氮气的化学性质:①N2与H2化合生成NH3N2 +3H22NH3说明该反应是一个可逆反应,是工业合成氨的原理.②N2与O2化合生成NO:N2 + O22NO说明在闪电或行驶的汽车引擎中会发生以上反应.(5)氮气的用途:①合成氨,制硝酸;②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑧在灯泡中填充氮气以防止钨丝被氧化或挥发;④保存粮食、水果等食品,以防止腐烂;⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⑥利用液氮制造低温环境,使某些超导材料获得超导性能.[NO、NO2性质的比较]氮的氧化物一氧化氮(NO) 二氧化氮(NO2)物理性质为无色、不溶于水、有毒的气体为红棕色、有刺激性气味、有毒的气体,易溶于水化学性质①极易被空气中的O2氧化:2NO + O2= 2NO2②NO中的氮为+2价,处于中间价态,既有氧化性又有还原性与H2O 反应:3NO2 + H2O=2HNO3 + NO(工业制HNO3原理.在此反应中,NO2同时作氧化剂和还原剂)[自然界中硝酸盐的形成过程](1)电闪雷鸣时:N2+O22NO(2) 2NO + O2= 2NO2(3)下雨时:3NO2 + H2O=2HNO3 + NO(4)生成的硝酸随雨水淋洒到土壤中,并与土壤中的矿物作用生成能被植物吸收的硝酸盐.[光化学烟雾]NO、NO2有毒,是大气的污染物.空气中的NO、NO2污染物主要来自于石油产品和煤燃烧的产物、汽车尾气以及制硝酸工厂的废气.NO2在紫外线照射下,发生一系列光化学反应,产生一种有毒的烟雾——光化学烟雾.因此,NO2是造成光化学烟雾的主要因素.光化学烟雾刺激呼吸器官,使人生病甚至死亡.[磷](1)磷元素在自然界中的存在形式:自然界中无游离态的磷.化合态的磷主要以磷酸盐的形式存在于矿石中.动物的骨骼、牙齿和神经组织,植物的果实和幼芽,生物的细胞里都含有磷.(2)单质磷的化学性质:①与O2反应:4P+5O22P2O5②磷在C12中燃烧:2P+3C12(不足量) 2PCl32P+5Cl2(足量) 2PCl5磷的同素异形体白磷红磷说明物颜色、状态无色蜡状固体红棕色粉末①白磷与红磷的结构不理性质密度(g·cm-3)1.822.34同是物理性质存在差别的原因②由两者物理性质的不同,证明了白磷与红磷是不同的单质溶解性不溶于水,溶于CS2不溶于水,也不溶于CS2毒性剧毒无毒着火点40℃(白磷受到轻微的摩擦就会燃烧;常温时,白磷可被氧化而发光)240℃化学性质白磷、红磷在空气中燃烧,都生成白色的P2O5白磷与红磷燃烧都生成P2O5,证明它们都是由磷元素形成的单质相互转化白磷红磷证明白磷与红磷所含元素相同——互为同素异形体保存方法密封保存,少量白磷保存在水中密封保存,防止吸湿切削白磷应在水中进行用途制造高纯度磷酸;制造燃烧弹、烟幕弹制造高纯度磷酸;制农药、安全火柴[五氧化二磷、磷酸](1)五氧化二磷的性质:五氧化二磷是白色粉末状固体,极易吸水(因此可作酸性气体的干燥剂).P2O5是酸性氧化物,与水反应:P2O5+3H2O2H3PO4(2)磷酸的性质、用途:磷酸(H3PO4)是一种中等强度的三元酸,具有酸的通性.磷酸主要用于制造磷肥,也用于食品、纺织等工业.元素氮(N)磷(P)自然界中存在的形式游离态和化合态只有化合态单质与O2化合的情况N2+O22NO(易)4P+5O22P2O5(难)单质与H2化合的情况N2 +3H22NH32P(蒸汽) + 3H22PH3单质的化学活泼性及原因单质活泼性:N2<P原因:N2分子中N≡N键很牢固,故N2性质稳定、不活泼氢化物的稳定性NH3>PH3最高价氧化物对应水化物的HNO3>H3PO4酸性非金属性N>P2.铵盐[氨](1)氨的物理性质:①氨是无色、有刺激性气味的气体,比空气轻;②氨易液化.在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热.液态氨气化时要吸收大量的热,使周围的温度急剧下降;③氨气极易溶于水.在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);④氨对人的眼、鼻、喉等粘膜有刺激作用.若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛.(2)氨分子的结构:NH3的电子式为,结构式为,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子.(3)氨的化学性质:①跟水反应.氨气溶于水时(氨气的水溶液叫氨水),大部分的NH3分子与H2O分子结合成NH3·H2O(叫一水合氨).NH3·NH4+和OH-:NH3 + H2O NH3·H2O NH4++ OH-a.氨水的性质:氨水具有弱碱性,使无色酚酞试液变为浅红色,使红色石蕊试液变为蓝色.氨水的浓度越大,密度反而越小(是一种特殊情况).NH3·H2O不稳定,故加热氨水时有氨气逸出:NH4++ OH-NH3↑+ H2Ob.氨水的组成:氨水是混合物(液氨是纯净物),其中含有3种分子(NH3、NH3·H2O、H2O)和3种离子(NH4+和OH-、极少量的H+).c.氨水的保存方法:氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水.通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里.d.有关氨水浓度的计算:氨水虽然大部分以NH3·H2O形式存在,但计算时仍以NH3作溶质.②跟氯化氢气体的反应:NH3 + HCl =NH4C1说明a.当蘸有浓氨水的玻璃棒与蘸有浓盐酸的玻璃棒靠近时,产生大量白烟.这种白烟是氨水中挥发出来的NH3与盐酸挥发出来的HCl化合生成的NH4C1晶体小颗粒.b.氨气与挥发性酸(浓盐酸、浓硝酸等)相遇,因反应生成微小的铵盐晶体而冒白烟,这是检验氨气的方法之—.c.氨气与不挥发性酸(如H2SO4、H3PO4等)反应时,无白烟生成.③跟氧气反应:4NH3 + 5O24NO + 6H2O说明这一反应叫做氨的催化氧化(或叫接触氧化),是工业上制硝酸的反应原理之一.(4)氨气的用途:①是氮肥工业及制造硝酸、铵盐、纯碱的原料;②是有机合成工业如合成纤维、塑料、染料、尿素等的常用原料;③用作冰机中的致冷剂.[铵盐]铵盐是由铵离子(NH4+)和酸根阴离子组成的化合物.铵盐都是白色晶体,都易溶于水.(1)铵盐的化学性质: ①受热分解.固态铵盐受热都易分解.根据组成铵盐的酸根阴离子对应的酸的性质的不同,铵盐分解时有以下三种情况:a .组成铵盐的酸根阴离子对应的酸是非氧化性的挥发性酸时,则加热时酸与氨气同时挥发,冷却时又重新化合生成铵盐。
例如: NH 4Cl(固) NH 3↑+ HCl ↑ NH 3 + HCl =NH 4Cl (试管上端又有白色固体附着) 又如: (NH 4)2CO 32NH 3↑+ H 2O + CO 2↑ NH 4HCO 3NH 3↑+ H 2O + CO 2↑b .组成铵盐的酸根阴离子对应的酸是难挥发性酸,加热时则只有氨气逸出,酸或酸式盐仍残留在容器中.如: (NH 4)2SO 4NH 4HSO 4 + NH 3↑ (NH 4)3PO 4H 3PO 4 + 3NH 3↑c .组成铵盐的酸根阴离子对应的酸是氧化性酸,加热时则发生氧化还原反应,无氨气逸出.例如: NH 4NO 3N 2O ↑+ 2H 2O②跟碱反应——铵盐的通性.固态铵盐 + 强碱(NaOH 、KOH)−→−∆无色、有刺激性气味的气体−−−−−−→−湿润的红色石蕊试纸试纸变蓝色.例如:(NH 4)2SO 4+2NaOH Na 2SO 4 + 2NH 3↑+ 2H 2O NH 4NO 3+NaOH NaNO 3 + NH 3↑+ H 2O说明:a .若是铵盐溶液与烧碱溶液共热,则可用离子方程式表示为:NH 4++ OH -NH 3↑+ H 2Ob .若反应物为稀溶液且不加热时,则无氨气逸出,用离子方程式表示为:NH 4++ OH -=NH 3· H 2Oc .若反应物都是固体时,则只能用化学方程式表示.(2)氮肥的存放和施用.铵盐可用作氮肥.由于铵盐受热易分解,因此在贮存时应密封包装并存放在阴凉通风处;施用氮肥时应埋在土下并及时灌水,以保证肥效.[铵盐(NH 4+)的检验] 将待检物取出少量置于试管中,加入NaOH 溶液后,加热,用湿润的红色石蕊试纸在管口检验,若试纸变蓝色,则证明待检物中含铵盐(NH 4+). [氨气的实验室制法](1)反应原理:固态铵盐[如NH 4Cl 、(NH 4)2SO 4等]与消石灰混合共热: 2NH 4Cl+Ca(OH)2 CaCl 2 + 2NH 3↑+ 2H 2O(2)发生装置类型:固体+固体−→−∆气体型装置(与制O 2相同). (3)干燥方法:常用碱石灰(CaO 和NaOH 的混合物)作干燥剂.不能用浓H 2SO 4、P 2O 5等酸性干燥剂和CaCl 2干燥氨气,因为它们都能与氨气发生反应(CaCl 2与NH 3反应生成CaCl 2·8NH 3). (4)收集方法:只能用向下排气法,并在收集氨气的试管口放一团棉花,以防止氨气与空气形成对流而造成制得的氨气不纯.(5)验满方法;①将湿润的红色石蕊试纸接近集气瓶口,若试纸变蓝色,则说明氨气已充满集气瓶;②将蘸有浓盐酸的玻璃棒接近集气瓶口,有白烟产生,说明氨气已充满集气瓶. 注意 ①制氨气所用的铵盐不能用NH 4NO 3、NH 4HCO 3、(NH 4)2CO 3等代替,因为NH 4NO 3在加热时易发生爆炸,而NH 4HCO 3、(NH 4)2CO 3极易分解产生CO 2气体使制得的NH 3不纯. ②消石灰不能用NaOH 、KOH 等强碱代替,因为NaOH 、KOH 具有吸湿性,易潮解结块,不利于生成的氨气逸出,而且NaOH 、KOH 对玻璃有强烈的腐蚀作用.③NH3极易溶于水,制取和收集的容器必须干燥.④实验室制取氨气的另一种常用方法:将生石灰或烧碱加入浓氨水中并加热.有关反应的化学方程式为:CaO + NH3·H2O Ca(OH)2 + NH3↑加烧碱的作用是增大溶液中的OH-浓度,促使NH3·H2O转化为NH3,这种制氨气的发生装置与实验室制Cl2、HCl气体的装置相同.3.硝酸[硝酸](1)物理性质:①纯硝酸是无色、易挥发(沸点为83℃)、有刺激性气味的液体.打开盛浓硝酸的试剂瓶盖,有白雾产生.(与盐酸相同)②质量分数为98%以上的浓硝酸挥发出来的HNO3蒸气遇空气中的水蒸气形成的极微小的硝酸液滴而产生“发烟现象”.因此,质量分数为98%以上的浓硝酸通常叫做发烟硝酸.(2)化学性质:①具有酸的一些通性.例如:CaCO3 + 2HNO3(稀)=Ca(NO3)2 + CO2↑+ H2O(实验室制CO2气体时,若无稀盐酸可用稀硝酸代替)②不稳定性.HNO3见光或受热发生分解,HNO3越浓,越易分解.硝酸分解放出的NO2溶于其中而使硝酸呈黄色.有关反应的化学方程式为:4HNO32H2O + 4NO2↑+O2↑③强氧化性:不论是稀HNO3还是浓HNO3,都具有极强的氧化性.HNO3浓度越大,氧化性越强.其氧化性表现在以下几方面:a.几乎能与所有金属(除Hg、Au外)反应.当HNO3与金属反应时,HNO3被还原的程度(即氮元素化合价降低的程度)取决于硝酸的浓度和金属单质还原性的强弱.对于同一金属单质而言,HNO3的浓度越小,HNO3被还原的程度越大,氮元素的化合价降低越多.一般反应规律为:金属+ HNO3(浓) →硝酸盐+ NO2↑+ H2O金属+ HNO3(稀) →硝酸盐+ NO↑+ H2O较活泼的金属(如Mg、Zn等) + HNO3(极稀) →硝酸盐+ H2O + N2O↑(或NH3等)金属与硝酸反应的重要实例为:3Cu + 8HNO3(稀) =3Cu(NO3)2 + 2NO↑+ 4H2O该反应较缓慢,反应后溶液显蓝色,反应产生的无色气体遇到空气后变为红棕色(无色的NO 被空气氧化为红棕色的NO2)。
