热力学第零定律
热力学第零定律、温度
热力学第零定律、温度1. 热力学第零定律热力学第零定律是有关热平衡的基本公理。
根据这条定律可以引出温度的概念。
现在,我们从考察热平衡现象入手来说明这个问题。
当一个单相系统与环境之间只有一种形式的功作用〈这样假定纯粹是为了讨论的方便〉,例如只有体积变化功、电功或磁功等之一时,经验表明,只要两个独立的热力学参数便可以完全地确定它的状态。
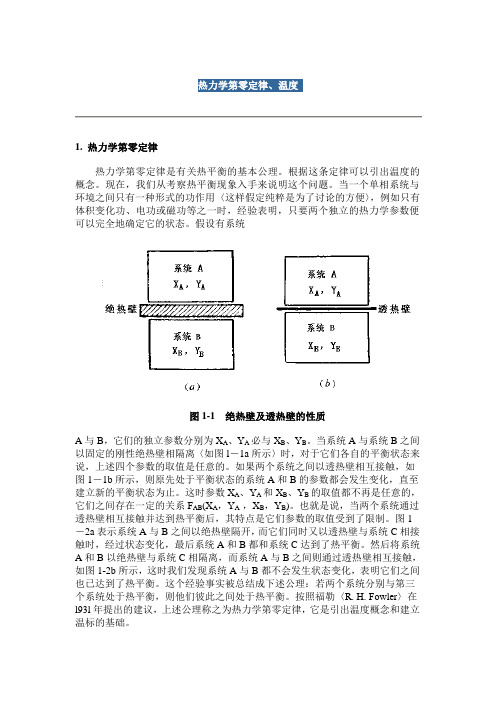
假设有系统图1-1 绝热壁及透热壁的性质A与B,它们的独立参数分别为X A、Y A必与X B、Y B。
当系统A与系统B之间以固定的刚性绝热壁相隔离〈如图l-1a所示〉时,对于它们各自的平衡状态来说,上述四个参数的取值是任意的。
如果两个系统之间以透热壁相互接触,如图1-1b所示,则原先处于平衡状态的系统A和B的参数都会发生变化,直至建立新的平衡状态为止。
这时参数X A、Y A和X B、Y B的取值都不再是任意的,它们之间存在一定的关系F AB(X A,Y A ,X B,Y B)。
也就是说,当两个系统通过透热壁相互接触并达到热平衡后,其特点是它们参数的取值受到了限制。
图1-2a表示系统A与B之间以绝热壁隔开,而它们同时又以透热壁与系统C相接触时,经过状态变化,最后系统A和B都和系统C达到了热平衡。
然后将系统A和B以绝热壁与系统C相隔离,而系统A与B之间则通过透热壁相互接触,如图1-2b所示,这时我们发现系统A与B都不会发生状态变化,表明它们之间也已达到了热平衡。
这个经验事实被总结成下述公理:若两个系统分别与第三个系统处于热平衡,则他们彼此之间处于热平衡。
按照福勒〈R. H. Fowler〉在l93l年提出的建议,上述公理称之为热力学第零定律,它是引出温度概念和建立温标的基础。
图1-2 热力学第零定律示意图2. 温度当系统A与C处于热平衡时,它们参数间的限制关系为F AC(X A,Y A,X C,Y C)=0(1-1)同样,若系统B与系统C也处于热平衡,则有F BC(X B,Y B,X C,Y C)=0 (1-2)将这两个关系写成Y C的显式,可得Y C=f AC(X A,,X C) (1-3)及Y C=f BC(X B,X B,X C) (1-4)将式(1-3)与式(1-4)合并,消去变量Y C,得f AC(X A,X B,X C)= f BC(X B,Y B,X C)(1-5)根据热力学第零定律,当系统A和系统B分别与系统C处于热平衡时,它们之间也处于热平衡,因此有F AB(X A,Y A,X B,Y B)=0 (1-6)方程(1-5)与(l-6)描述的是同一个现象,因而应该是等同的,但后者没有包含参数只能取以下形式:X C。
热力学第零定律内容

热力学第零定律内容热力学是研究热现象和热能转化规律的学科,它是现代物理学的重要分支之一。
热力学第零定律是热力学中的一个基本定律,它是指当两个物体分别与第三个物体达到热平衡时,这两个物体之间也必然达到热平衡。
本文将详细介绍热力学第零定律的内容及其应用。
一、热力学第零定律的内容热力学第零定律是热力学中的基本定律之一,它是指当两个物体分别与第三个物体达到热平衡时,这两个物体之间也必然达到热平衡。
这个定律的表述可以简单地理解为:如果物体A和物体B分别与物体C达到热平衡,那么物体A和物体B之间也一定达到了热平衡。
热平衡是指在相同温度下的物体之间,不存在热量的传递,也就是说,在热平衡状态下,两个物体之间不存在温度差。
热力学第零定律告诉我们,当两个物体达到热平衡时,它们之间的温度是相等的,这个定律为热力学的研究提供了基础。
二、热力学第零定律的应用热力学第零定律是热力学中的基本定律之一,它的应用非常广泛。
下面我们将从几个方面介绍热力学第零定律的应用。
1、温度计的原理温度计是一种测量温度的仪器,温度计的原理就是基于热力学第零定律。
常见的温度计有水银温度计、酒精温度计、电子温度计等。
水银温度计是温度计中最常见的一种,它的原理是利用热力学第零定律来测量温度。
水银温度计中,温度计的底部与被测物体接触,当温度计达到热平衡时,温度计中的水银液柱就会上升到一个固定的高度,这个高度与温度有关。
通过测量水银液柱的高度,就可以确定被测物体的温度。
2、热力学中的状态方程热力学中的状态方程是用来描述物质状态的方程,它是热力学中的基本方程之一。
热力学第零定律对状态方程的建立有着重要的作用。
状态方程描述了物质在不同温度、压力下的物态,它是热力学中的基本方程之一。
热力学第零定律告诉我们,当两个物体达到热平衡时,它们的温度相等。
这个定律为建立状态方程提供了基础,使得我们可以通过测量物体的温度、压力等参数来确定物质的状态。
3、热力学中的热力学平衡热力学平衡是指在相同温度下的物体之间,不存在热量的传递,也就是说,在热平衡状态下,两个物体之间不存在温度差。
热力学中的热平衡与热力学第零定律

热力学是研究能量传递和转化的科学,研究物质的宏观运动和微观结构相关的物理性质。
热力学中的热平衡是一个重要概念,它与热力学第零定律密切相关。
本文将从热平衡的概念入手,进而讨论热力学第零定律的作用和意义。
热平衡指的是系统与其周围环境之间没有温度差异,也就是两者达到了相同的温度。
在热平衡状态下,系统内各部分的宏观参数和微观状态均保持不变。
具体来说,热平衡要求系统内的热能以一种均匀的方式传播,而不是部分区域温度过高或过低。
这种均匀传播的过程称为热传导。
热平衡的存在对于研究热力学体系的平衡状态和物质之间的热交换过程具有重要意义。
热力学第零定律则是描述热平衡的基本原理。
热力学第零定律指出,如果两个独立的系统与第三个系统都处于热平衡状态,那么这两个系统之间也处于热平衡状态。
热力学第零定律之所以被称为“第零定律”是因为它对热平衡的概念进行了定义,而不是基于其他定律。
它的提出使得热平衡的概念更加形式化和系统化。
热力学第零定律的作用和意义在于,通过它我们可以建立一个热平衡状态的参照系。
当我们想要研究一个系统是否处于热平衡状态时,可以利用第零定律将其与已知处于热平衡状态的系统进行比较。
如果两者之间不存在温度差异,则可以断定该系统也处于热平衡状态。
热力学第零定律对于热力学体系的研究有着重要的实际应用。
在实际生活中,我们经常需要测量温度。
利用热力学第零定律,我们可以通过将一个温度计与已知处于热平衡状态的系统接触,来确定其他物体的温度,从而实现温度的测量。
此外,热力学第零定律也为热力学体系的研究提供了一种通过观察一系统与其他系统的热交换过程来判断系统是否处于热平衡状态的方法。
通过分析系统与外界的热交换是否达到平衡,我们可以判断系统是否处于热平衡状态,并进一步推断系统内部的能量转化和宏观行为。
综上所述,热平衡是热力学研究的重要概念,它要求系统与周围环境之间达到不同温度的状态,而热力学第零定律则为研究热平衡状态提供了基本原理和方法。
热力学四大定律第零定律热平衡Thezerolawofthermodynamics

第零定律:熱平衡The zero law of thermodynamics T1=T2=T3=T4第一定律:The first Law of thermodynamics能量守恆定律(The Law of conservation of energy)△E=Q-WQ=-W= Pdv = -nRTln v2/v1Q=+nRT ln V2/V1代入S= dnRT ln V2/V1T第二定律:每一自發性的變化均伴隨著熵的增加宇宙趨向最大亂度S>0熵entropy S :熱力學函數(thermodynamic function),熵可解釋為一種物系「亂度」或不規律的一種量度。
熵可視為一機率函數S宇宙= S系統+ S週邊>0判斷自發的方法:S>0(不可逆)S= 0(可逆),S<0(不發生)S 表示熵的改變。
宇宙上能量傳遞有方向性的,總是由高能量傳到低能量。
第三定律:在OK時,一完全結晶物體之熵會等於零,S=0所有物體都呈現靜止狀態。
海水轉變成淡水化工程要生產出1噸淡水,需要抽取2.5噸海水作為“原水”。
海水被抽出後,首先通過加藥-混凝沉澱環節除去海水大顆粒懸浮物,然後進入氣浮池進行預處理,後經過超濾、反滲透兩個主要環節,充分去除海水中的鹽分、懸浮物、有機物和藻類物質等,最後進入後礦化環節調節水的硬度和pH值,苦澀的海水就變成能夠直飲的淡水了自然科學:1543年─哥白尼:(天體運行論)以太陽為中心(日心論)1.伽利略:望遠鏡→h=1/2gt22.刻卜勒:行星三大運動定律第一定律:「軌道定律」─所有的行星繞著太陽運行第二定律:等面積定律─T=T2-T1=T4-T3第三定律:週期定律R13= R23=KT12T22第一定律:慣性定律─靜者恒靜,動者恒動。
第二定律:加速度定律速度= s/t =V 公尺/秒F一定:m與a成反比mx1/aF=mxa m一定:Fxa成正比a一定:Fxm成正比第三定律:作用力與反作用力定律複色光分解為單色光的現象叫光的色散.牛顿在1666年最先利用三棱鏡觀察到光的色散,把白光分解為彩色光帶(光譜).色散現象説明光在媒質中的''速度''溯因法的推理步驟:觀察現象形成假設(猜測原因)- -解釋假設-- 最佳解釋-- 檢驗強調;猜測與假設的區別。
热力学第零定律

§1 热力学系统概述 §2 热力学第零定律 §3 物态方程
§1 热力学系统概述
一、热力学系统
由大量微观粒子组成的、有明确界面的连续介质系统。
(界面可以是真实的,也可以是虚拟的,即认为划定的。)
系统 外 界
孤立系统: 无能量、物质交换。
封闭系统: 有能量交换、无物质交换
开放系统: 能量、物质交换。
p 0 V m 0/xR T
xm 0 R T 0
p 0 V
m R p V Tm p 0 R 0 V T 0p p 0 T T 0m 0
由题意, T T0
m p p 0 m 0 1 .0 5 1 .3 0 2 5 1 0 1 4 0 5 1 .0 g 0 .4 9 3 g
三、实际气体的物态方程 1、范德瓦耳斯方程 考虑到分子间的引力和斥力作用,把理想气体方程 进行了修正。
3、 热力学温标 与具体的测温物质的属性无关,是一种理论温标。 在理想气体温标适用的温度范围内,理想气体温 标是热力学温标的具体实现方式。(第三章介绍)
4、国际温标
1927年开始建立国际实用温标.几经修改,现在国际 上采用的是1990年国际温标(ITS--90)。
1K定义为水的三相点温度的1/273.16。
T = t+273.15(k)
§3 物态方程之间满足一定的函 数关系。
处于热平衡的热力学系统具有确定的温度,而且温 度是状态参量的函数:
T = T(x、y) 上式可改写为: f(T、x、y)= 0
系统的物态方程
一、气体定律(实验定律)
1.玻意耳定律(1662) PVC
3、各向同性固体与液体的物态方程
各向同性固体和液体同气体一样,也可以用p,V作 状态参量描述一定质量的系统状态。
热力学四大定律

热力学四大定律:第零定律——若A与B热平衡,B与C热平衡时,A与C也同时热平衡第一定律——能量守恒定律(包含了热能)第二定律——机械能可全部转换成热能,但是热能却不能以有限次的试验操作全部转换成功(热能不能完全转化为功)第三定律——绝对零度不可达成性热力学定律的发现及理论化学反应不是一个孤立的变化过程,温度、压力、质量及催化剂都直接影响反应的方向和速度。
1901年,范霍夫因发现化学动力学定律和渗透压,提出了化学反应热力学动态平衡原理,获第一个化学奖。
1906年能斯特提出了热力学第三定律,认为通过任何有限个步骤都不可能达到绝对零度。
这个理论在生产实践中得到广泛应用,因此获1920年化学奖。
1931年翁萨格发表论文“不可逆过程的倒数关系”,阐明了关于不可逆反应过程中电压与热量之间的关系。
对热力学理论作出了突破性贡献。
这一重要发现放置了20年,后又重新被认识。
1968年获化学奖。
1950年代,普利戈金提出了著名的耗散结构理论。
1977年,他因此获化学奖。
这一理论是当代热力学理论发展上具有重要意义的大事。
它的影响涉及化学、物理、生物学等广泛领域,为我们理解生命过程等复杂现象提供了新的启示。
热力学第零定律如果两个热力学系统中的每一个都与第三个热力学系统处于热平衡(温度相同),则它们彼此也必定处于热平衡。
这一结论称做“热力学第零定律”。
热力学第零定律的重要性在于它给出了温度的定义和温度的测量方法。
定律中所说的热力学系统是指由大量分子、原子组成的物体或物体系。
它为建立温度概念提供了实验基础。
这个定律反映出:处在同一热平衡状态的所有的热力学系统都具有一个共同的宏观特征,这一特征是由这些互为热平衡系统的状态所决定的一个数值相等的状态函数,这个状态函数被定义为温度。
而温度相等是热平衡之必要的条件。
热力学中以热平衡概念为基础对温度作出定义的定律。
通常表述为:与第三个系统处于热平衡状态的两个系统之间,必定处于热平衡状态。
热力学四大定律

热力学共有四大定律第零定律:热平衡定律(zeroth law of thermodynamics )第一定律:能量守恒定律,“热”是一种能量。
第二定律:熵函数的引出及过程变化方向的熵判据在一个封闭系统(closed system)里操作,总熵量有增无减:只能不变或增加,不能减少。
第三定律:决对零度达不到,在绝对温度0K(相当于-273.15摄氏度)下,所有物质的熵都等于0。
热力学第零定律如果两个热力系的每一个都与第三个热力系处于热平衡,则它们彼此也处于热平衡。
热力学第零定律于1930年由福勒(R.H.Fowler)正式提出,比热力学第一定律和热力学第二定律晚了80余年。
虽然这么晚才建立热力学第零定律,但实际上之前人们已经开始应用它了。
因为它是后面几个定律的基础,在逻辑上应该排在最前面,所以叫做热力学第零定律。
如果两个热力学系统中的每一个都与第三个热力学系统处于热平衡(温度相同),则它们彼此也必定处于热平衡。
这一结论称做“热力学第零定律”。
热力学第零定律的重要性在于它给出了温度的定义和温度的测量方法。
定律中所说的热力学系统是指由大量分子、原子组成的物体或物体系。
它为建立温度概念提供了实验基础。
这个定律反映出:处在同一热平衡状态的所有的热力学系统都具有一个共同的宏观特征,这一特征是由这些互为热平衡系统的状态所决定的一个数值相等的状态函数,这个状态函数被定义为温度。
而温度相等是热平衡之必要的条件。
热力学中以热平衡概念为基础对温度作出定义的定律。
通常表述为:与第三个系统处于热平衡状态的两个系统之间,必定处于热平衡状态。
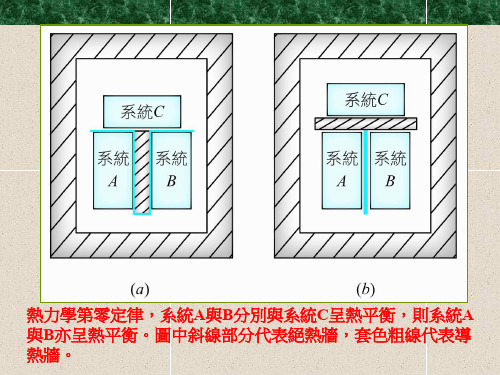
图中A热力学第零定律示意图、B热力学第零定律示意图、C 热力学第零定律示意图为3个质量和组成固定,且与外界完全隔绝的热力系统。
将其中的B、C用绝热壁隔开,同时使它们分别与A发生热接触。
待A与B和A与C都达到热平衡时,再使B与C发生热接触。
这时B和C的热力状态不再变化,这表明它们之间在热性质方面也已达到平衡。
热力学第零定律的证明

热力学第零定律的证明
热力学第零定律:在可能的任意物理状态下,一个系统的总熵增加不超过所接受的外部热量的熵之和($\Delta S \leq \Sigma Q_{rev}/T$)。
证明:考虑一个宏观系统,在封闭状态下,随着它接受外部热量 $Q$,温度上升$\Delta T$,它的熵增加
$\Delta S$ 。
可以将这个过程分成两步:
1、先是由低温$T_0$ 升高到 $T_{0} + \Delta T$ 的过程,在这个过程中,它吸收了反应热量 $Q_{rev}$,且
它的熵增加 $\Delta S_{rev}$;
2、然后再从 $T_{0} + \Delta T$ 降低到 $T_0$ ,在这个过程中,它放出的反应热量 $Q_{irr}$,且它的熵
减少为$-\Delta S_{irr}$;
因此,由于热力学第二定律,有: $$Q_{irr} = -
Q_{rev}$$ $$\Delta S_{irr} = - \Delta S_{rev}$$由上式可得:$\Delta S = \Delta S_{rev} + \Delta S_{irr} = \Delta S_{rev} - \Delta S_{rev}= 0$因此,$\Delta S \leq \Sigma Q_{rev}/T$ 成立。
热力学基础知识

二、压力 垂直作用在单位面积上的力称为压力,以符号P表示,这就 是物理学上所称的压强.按分子运动论的观点,压力是气体的 大量分子向容器壁面撞击所产生的平均结果。若气体作用在 器壁面积A上的垂直作用力为F,那么该壁上的压力为: P=F/A 压力通常用各种压力计来测定。这些压力计的测量原理部是 建立在力的平衡的基础上。由于压力计本身处于大气压力Pb 作用下,因此压力计上测得的压力是工质的真实压力和大气 压力Pb的差值,是一个相对压力,称为表压力或工作压力, 用符号Pg表示,而工质的实际压力称绝对压力,用P表示。 P, Pg 和Pb之间的关系是: P=Pb+Pg
热力学基础识
樟洋电厂 运行部
第一节
热力学定律
一、热力学第零定律 定义:与第三个系统处于热平衡的两个系统,彼此也处于 热平衡。 热力学第零定律是进行体系测量的基本依据。1)、 可以通过使两个体系相接触,并观察这两个体系的性质是 否发生变化而判断这两个体系是否已经达到平衡。2)、 当外界条件不发生变化时,已经达成热平衡状态的体系, 其内部的温度是均匀分布的,并具有确定不变的温度值。 3)、一切互为平衡的体系具有相同的温度,所以,一个 体系的温度可以通过另一个与之平衡的体系的温度来表达; 或者也可以通过第三个体系的温度来表达。
t,c
w0 q2 T2 1 1 q1 q1 T1
即:
q2 q1 T2 T1
对于任意的可逆循环, 如图所示循环1A2B1。假 如用一组可逆绝热线将它分 割成无数个微元循环,当绝 热线间隔极小时,例如绝热 线ad与 bc 间隔极小,ab 段温度差极小,接近于定温 过程,同理cd段也是定温 过程,那么微元循环abcda。 就是由两个可逆绝热过程与 两个可逆定温过程组成的微 小卡诺循环。
热力学第零定律

在工程中,热力学第零定律是传热设计和分析的基础,可以 帮助工程师理解和优化传热过程,提高设备的效率和安全性 。
05
CATALOGUE
热力学第零定律的实验验证
实验验证的方法
01
02
03
热量测量
通过测量热量交换量来验 证热力学第零定律,确保 热量交换过程中温度保持 不变。
温度测量
使用温度计或其他测量仪 器,准确测量系统内各部 分的温度,以验证温度的 一致性。
这个温度可以作为它们各自的热力学温度。
03
这意味着我们可以使用热平衡状态下的物体来测量和
标定温度,从而为温度提供了一个客观的物理标准。
02
CATALOGUE
热平衡和温度
热平衡的定义
热平衡定义总结
热平衡是指两个或多个物体在没 有外界热交换的情况下,通过内 部热量交换达到的热状态平衡。
热平衡条件
当两个物体在没有外界热交换的 情况下,如果它们的温度相同, 则它们处于热平衡状态。
等温过程
等压过程
等容过程
04
CATALOGUE
热力学第零定律的应用
在热力学第一定律和第二定律中的应用
热力学第一定律
热力学第零定律为热量传递的方向和 大小提供了基础,是热力学第一定律 中能量守恒和转换的基础。
热力学第二定律
热力学第零定律对于判断系统状态变 化的方向和可能性非常重要,是热力 学第二定律中熵增加原理的基础。
简单来说,如果两个物体温度相同, 则它们之间没有热交换。
定律的数学表述
热力学第零定律的数学表述涉及到温 度的标定和热平衡状态下的热容。
VS
在数学上,如果两个热力学系统在某 个温度下达到热平衡,则它们的热容 相等。
热力学第零定律内容

热力学第零定律内容
热力学是研究热量与能量转化的学科,是自然科学中的一个重要分支。
热力学第零定律是热力学中的基本定律之一,它对研究热力学问题具有重要意义。
本文将从以下几个方面介绍热力学第零定律的内容。
一、热力学第零定律的基本概念
热力学第零定律是指如果两个物体分别与第三个物体接触并达到热平衡,那么前两个物体也必定处于热平衡状态。
简单来说,就是如果物体A与物体B分别与物体C达到热平衡,那么物体A与物体B也必定处于热平衡状态。
二、热力学第零定律的实际应用
热力学第零定律在实际生活中有着广泛的应用。
例如,在温度计中,通过测量不同物体的温度,就可以判断它们是否处于热平衡状态。
此外,在工业生产中,热力学第零定律也被广泛应用于热处理、制冷等领域。
三、热力学第零定律的证明
热力学第零定律的证明可以通过实验进行。
例如,将两个温度不同的物体分别与一个第三个物体接触,然后测量它们的温度变化,如果它们最终达到了相同的温度,那么就可以证明它们处于热平衡状态。
此外,还可以通过理论推导来证明热力学第零定律的正确性。
四、热力学第零定律的意义
热力学第零定律对热力学的研究具有重要意义。
它为热力学的其他定律提供了基础,例如热力学第一定律、第二定律等。
同时,热力学第零定律也为温度的测量提供了依据,为热力学在实际应用中提供了指导。
总之,热力学第零定律是热力学中的基本定律之一,它对研究热力学问题具有重要意义。
通过了解热力学第零定律的基本概念、实际应用、证明方法和意义,我们可以更好地理解热力学的基本原理,为热力学在实际应用中提供指导。
热力学第零定律
dW=PdV
氣體以壓力P對外作功,熱
量可由底部流入或流出。
功的大小等於PV曲線下之面積,可由鋸齒狀線下之面積求得 近似值。
目錄 第十一章 熱力學
CH.1 CH.2
CH.3 CH.4
CH.5 CH.6 CH.7 CH.8 CH.9 CH.10 CH.11 CH.12 CH.13 CH.14
W= W=P1V1+P2V2+
nCpT=U+PV (等壓過程)
等壓過程
等容過程
當系統之狀態發生變化時,整個系統之體積若保 持一定不變,則此變化過程稱為等容過程(constant volume或isovolume或isochoric process)。
右圖為等容過程之 P-V圖。因體積保持一 不變之常數V,故為一 垂直線。線下之面積為 零,故在等容過程中, 所作之功W=0。
系統原有之內能為U0,若周遭加Q之熱量於系 統,系統對外圍作W之功。故系統最終之內能U為:
U=U0+Q-W 或 Q=U-U0+W=U+W
目錄 第十一章 熱力學
CH.1 CH.2
CH.3 CH.4 CH.5 CH.6 CH.7 CH.8 CH.9 CH.10 CH.11 CH.12 CH.13 CH.14 CH.15 CH.16 CH.17 CH.18
CH.1 CH.2
CH.3 CH.4 CH.5 CH.6 CH.7 CH.8 CH.9 CH.10
所謂節流過程,是高壓的流體, 經過一多孔的壁或一細縫(節流活門) 而摻入一低壓的區域,其間無熱的轉 移現象。
CH.11 CH.12
CH.13 CH.14
自由膨脹(free expansion)
如果在一個絕熱過程之中,系統 並未對外作功,而外界亦未對此系統
热力学第零定律

以p-V 简单系统为例:
S S p,V
S S dS dp dV V p p V
系统由初态 i 变到未态 f 时
S dS S p f ,V f S pi ,Vi
f i
dS 0
态函数的基本性质
二、热力学平衡态
定义:不随时间变化并具有确定值的系统状态。
(平衡态是在实验观察结果总结的基础上引入的理想概念)
热 力 学 平 衡 态
力学平衡
热平衡 相平衡
几何参量 态参量 力学参量
化学参量 电磁参量 态函数 ( T、 U 、 S )
化学平衡
由状态参量描述的系统状态确定后,系统的态函数也 就确定下来。态函数的函数值与系统状态一一对应, 与达到该状态的过程无关. 热力学平衡是一种动态平衡,也称为热动平衡。
即互为热平衡的系统具有一个数值相等的态函数 , 这个函数就定义为温度,若用符号 T 表示, 则
TA A ( x A, y )
ATB B ( x B, Nhomakorabea )B
TC C ( x C , y )
C
温度是强度量,不具有可加性。
三、温标 —— 温度的数值表示法
温标要素: 测温物质、测温属性、定标方程及固定标准点
A B
要使 ( 3 ) 式与 ( 4 ) 式同时成立 , 必须要求( 3 ) 式中的 参量xc 以消去, 即 ( 3 ) 式可以简化为
A ( x A, y ) B ( x B, y )
A B
( 5 )
因系统 A、B、C 互为热平衡 , 运用同样的结论 , 可得
A xA,yA B xB,yB c xc,yc
热力学第零定律

热力学第零定律引言热力学是研究热量和能量转化的科学,它起源于18世纪末的工业革命时期。
在热力学中,有一个基本原理被称为热力学第零定律。
这个定律为我们提供了一个基本的基准,用于测量物体之间的温度差异。
在本文中,我们将详细介绍热力学第零定律的定义、原理和应用。
一、热力学第零定律的定义热力学第零定律是用来定义物体的热平衡的一个基本定律。
它表明,如果两个物体分别与第三个物体处于热平衡状态,那么这两个物体之间也将处于热平衡状态。
具体来说,当两个物体通过导热或者其他方式接触时,它们将会达到相同的温度,从而实现热平衡。
二、热力学第零定律的原理热力学第零定律的原理可以通过一个简单的实验来解释。
假设我们有三个热水壶,分别标记为A、B和C。
我们将A和B分别与C进行接触,并观察它们之间的温度变化。
首先,我们将A和C放在一起接触一段时间后,然后分别测量它们的温度。
接着,我们将B和C放在一起接触一段时间后,再次测量它们的温度。
如果A和B之间的温度差异很小,而A和C以及B和C之间的温度差异也很小,那么可以得出结论,A和B之间也处于热平衡状态。
这个实验可以推广到更多的物体之间,只要它们通过导热或者其他方式相互接触,它们就有可能达到热平衡状态。
这是因为热量会自由地从一个物体传递到另一个物体,直到它们达到相同的温度。
这个过程被称为热传导。
三、热力学第零定律的应用热力学第零定律在实际应用中有着广泛的应用。
首先,它为测量物体的温度提供了一个基准。
例如,在实验室中,我们可以使用温度计来测量物体的温度,而这个温度计是根据热力学第零定律设计的。
此外,热力学第零定律还可以帮助我们理解和解释一些热学现象。
例如,我们知道热量是从高温物体流向低温物体的。
根据热力学第零定律,当两个物体接触时,它们将交换热量,直到它们达到热平衡。
这个现象被广泛应用于热工学和能源转换等领域。
热力学第零定律还有助于我们理解热学平衡的概念。
在热平衡状态下,物体之间没有净热量传递,即它们的温度保持不变。
热学基本概念 热力学第0定律 温度

热力学是研究物质热运动的宏观理论。从基本 实验定律出发,通过逻辑推理和数学演绎,找 出物质各种宏观性质的关系,得出宏观过程进 行的方向及过程的性质等方面的结论。具有高 度的普适性与可靠性。但因不涉及物质的微观 结构,而将物质视为连续体,故不能解释物质 宏观性质的涨落。
3
统计物理学是研究物质热运动的微观理论。 从物质由大量微观粒子组成这一基本事实 出发,运用统计方法,把物质的宏观性质 作为大量微观粒子热运动的统计平均结果 ,找出宏观量与微观量的关系,进而解释 物质的宏观性质。在对物质微观模型进行 简化假设后,应用统计物理可求出具体物 质的特性;还可应用到比热力学更为广阔 的领域,如解释涨落现象。
第二部分 热学
第一章 热学基本概念 热力学第0定律 温度
§1 热学的一些基本概念
1.1 系统与外界
1.2 热力学平衡态 1.3 状态参量——平衡态的描述和态函数 1.4 摩尔、摩尔质量
§2 热力学第0定律 温度的概念
2.1 热平衡
经验温标
2.2 热力学第0定律
理论温标
2.3 温度和温标
国际温标
§3 理想气体状态方程
13
通过导热板进行热接触的两个系统组成 一复合系统当复合系统达到平衡态时, 我们就说两个系统处于热平衡。
2.2 热力学第0定律
如果两个系统分别与处于确定状态 的第三个系统达到热平衡,则这两 个系统彼此也将处于热平衡。
AB C
2.3 温度和温标
• 温度—互为热平衡的几个热力学系统,必
然具 有某种共同的宏观性质,我们将这种决 定系统热平衡宏观性质的物理量定义为温度。
18
2. 规定温度T 与测温属性X 之间的函数关系 通常假定为线性关系,如:T(x)=a.X
热力学第零定律

热力学第零定律——热平衡定律,为什么不是热力学第四定律呢?热力学第一定律提出于1850年左右。
热力学第二定律提出于1850-1851年之间。
热力学第三定律提出于1905年。
而热力写第零定律却是在1931年提出的。
如果按提出的先后顺序来讲,应该被称为第四定律才对,可为什么被定义为第零定律呢?其实主要的原因是因为第零定律是第一、二、三定律的基础,所以它排在最前面。
如果它在1850年前提出的话,它就应该是排在第一位了,其他三定律依次为二、三、四定律。
那到底第零定律讲了什么呢?“若两个热力学系统均与第三个系统处于热平衡状态,此两个系统也必互相处于热平衡。
”这好像是显而易见的。
所以虽然人们早就觉察到这种现象,但直到二十世纪三十年代前一直都未有人们想把它以定律的形式表达出来。
1931年,英国物理学家拉尔夫·福勒正式提出热力学第零定律,比热力学第一定律和热力学第二定律晚了整整80余年。
为什么说它是基础呢?因为在热力学的研究过程中,温度给出了热力学状态的定量数据,是研究的基础。
而测量的温度采用的温度计,恰恰使用了热力学第零定律。
测量液体的温度为了测量系统A的热力学状态,我们把温度计和它接触在一起,当温度计的指数不再变化时,系统A与温度计达到热力学平衡,温度计的数字也就是系统A的温度t;然后再去测量系统B,也得出温度t;那么我们就说系统A与B的温度相同。
如上,如果没有热力学第零定律的话,即使测出A、B温度都为t,我们也无法给出A、B的温度相同的结论。
拉尔夫·福勒再来说一下提出热力学第零定律的拉尔夫·福勒,他生于1889年的英国,毕业于剑桥大学。
他还是鼎鼎大名的欧内斯特·卢瑟福(原子核物理学之父)的女婿,他的学生也是极为出名,保罗·狄拉克(量子力学的奠基人)和苏布拉马尼扬·钱德拉塞卡(钱德拉塞卡极限)。
热学四大定律

热学四大定律
热力学四定律通常指的是:
1. 热力学第一定律,也就是能量守恒定律,表明在一个封闭的系统中,能量不能被创造也不能被消灭,只能从一种形式转化为另一种形式。
2. 热力学第二定律,即熵增加定律,表明在自然过程中,一个孤立系统的熵(反映混乱程度的度量)总是增加的。
3. 热力学第三定律,即绝对零度不可达到定律,表明我们无法将一个物体冷却到绝对温度的零度。
4. 热力学第零定律,该定律确定了温度的绝对零度,即两个热力学系统处于热平衡时的温度是相同的。
这一结论称做“热力学第零定律”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
主讲人:吴龙超 刘鹏展 何静远 (第二组)
热力学第零定律(zeroth law of thermodynamics)
一、 历史
1930年由英国科学家福勒(R.H.Fowler)正式提出,比热力学第一定律和热力学第 二定律晚了80余年。虽然这么晚才建立热力学第零定律,但实际上之前人们已经开始 应用它了。 因为它是后面几个定律的基础,在逻辑上应该排在最前面,所以叫做热力学第零 定律。
热力学第一定律
一、
•
பைடு நூலகம்
T T T
四、热力学第零定律与温度
热力学第零定律揭示出均相物系存在着一个新的平衡 性质,称之为温度。
概括为下述的温度定理:
“ 任一热力学的均相体系,在平衡态各自都存在一 个状态函数,称之为温度(符号为T);它们具有这样 的特性,对于一切互呈热平衡的均相系,其温度彼相 此等” 如果α、β、γ· · · 等均相系,其平衡态分别由 x1 x,2 ,x x;x,1 , x xx ; , , x m 描写,这个定理 n2 1 2 q 的数学表达式:
二、定义
如果两个热力学系统中的每一个都与第三个热力学系统处于热平 衡(温度相同),则它们彼此也必定处于热平衡。这一结论称做“热力 学第零定律”。(zeroth law of thermodynamics:The zeroth law states that if two systems are in thermal equilibrium with a third system, they are also in thermal equilibrium with each other.)
三、数学表达式
A、B、C三个物体的状态变量分别为 x1, x2,…, xn;y1, y2,…, ym;z1, z2,…, zq 若 F(x1, x2,…, xn;z1, z2,…, zq)=0 ( A、C热平衡 ) F(y1, y2,…, ym;z1, z2,…, zq)=0 ( B、C热平衡 )
则
F(x1, x2,…, xn;y1, y2,…, ym)=0 ( A、B热平衡 )
T T ( x1 , x2 , xn )
T
T ( x1 , x2 , xm )
T T ( x1 , x2 , xq )
对每一均相系、、等都存在一个各自的状态函数f、 f 、 f ;
五、重要性
热力学第零定律的重要性在于它给出了温度的定义和温度的测量 方法。定律中所说的热力学系统是指由大量分子、原子组成的物体或 物体系。它为建立温度概念提供了实验基础。这个定律反映出:处在 同一热平衡状态的所有的热力学系统都具有一个共同的宏观特征,这 一特征是由这些互为热平衡系统的状态所决定的一个数值相等的状态 函数,这个状态函数被定义为温度。而温度相等是热平衡之必要的条 件。温度计所以能够测定物体温度正是依据这个原理。
f ( x1 , x2 , xn ) f ( x1 , x2 , xm ) f ( x1 , x2 , xq )
而且当、、彼此达热平衡时,这些状态函数都相 等,将具有这种特性的状态函数称为均相系的温度,用符 号T表示。
注 一切互为平衡的体系具有相同的温度,所以一个体系的温度可以通过另一个与之平衡的体系 的温度来表示,也可以通过第三个体系的温度来表示。
