热力学第零定律、温度
热力学第零定律

温度的热力学概念
• 处于同一热平衡状态的所有物体都具有共同的宏观性质: 它们的冷热程度相等,这个宏观性质就是温度。
• 温度是决定一个物体是否与其他物体处于热平衡的宏观性质。
温度
• 温度的这种定义和我们日常对温度的理解(冷热程度)是一致 的,冷热不同的两个物体,温度是不同的,相互热接触后, 热的变冷,冷的变热,最后冷热均匀,温度成为相同,而达 到热平衡。
• A、热力学第零定律的发现先于热力学第一定律 • B、热力学第零定律定义了温度 • C、热力学第零定律指出绝对零度是不能达到的 • D、热力学第零定律是由开尔文提出的
热力学第零定律
1802-25-刘珂彤 第2组:四叶草组
目录
• 1.热力学第零定律 • 2.温度
热力学第零定律
• 无数实验证明:
A
B
Cቤተ መጻሕፍቲ ባይዱ
A,B,C三个系统 的平衡态各异
A
B
C
长时间接触后达 到新的平衡态
A
B
C
让A,C接触,可发现 A,C的状态无任何变化
热力学第零定律
• 概念: • 如果两个物体都与处于确定状态的第三物体处于热平 衡,则该两个物体彼此处于热平衡。
• 热力学第零定律,也是温度测量技术的理论基础。
热力学第零定律的历史
热力学第零定律是20世纪20年代由英国福勒( R. H. Fowler)提出的,比热力学第一定律和第二定律的提出 晚了数十年,因为温度的概念是这两条定律的基础, 出于逻辑的排序,因此称为第零定律。
练习
• 下面关于热力学第零定律的说法正确的是( B)
热力学第零定律、温度
热力学第零定律、温度1. 热力学第零定律热力学第零定律是有关热平衡的基本公理。
根据这条定律可以引出温度的概念。
现在,我们从考察热平衡现象入手来说明这个问题。
当一个单相系统与环境之间只有一种形式的功作用〈这样假定纯粹是为了讨论的方便〉,例如只有体积变化功、电功或磁功等之一时,经验表明,只要两个独立的热力学参数便可以完全地确定它的状态。
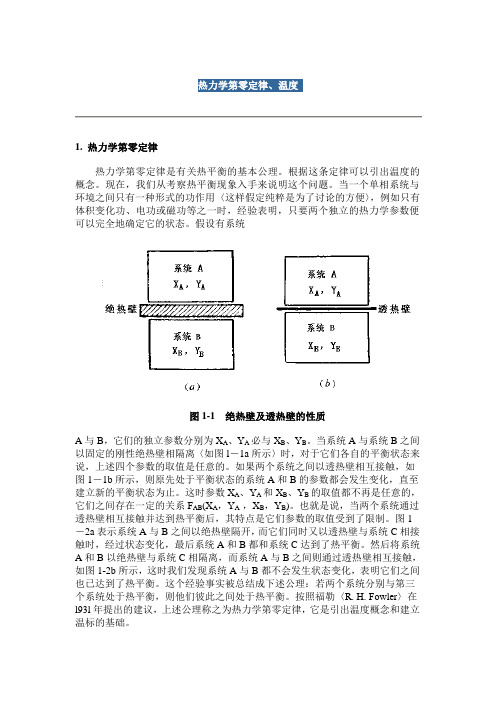
假设有系统图1-1 绝热壁及透热壁的性质A与B,它们的独立参数分别为X A、Y A必与X B、Y B。
当系统A与系统B之间以固定的刚性绝热壁相隔离〈如图l-1a所示〉时,对于它们各自的平衡状态来说,上述四个参数的取值是任意的。
如果两个系统之间以透热壁相互接触,如图1-1b所示,则原先处于平衡状态的系统A和B的参数都会发生变化,直至建立新的平衡状态为止。
这时参数X A、Y A和X B、Y B的取值都不再是任意的,它们之间存在一定的关系F AB(X A,Y A ,X B,Y B)。
也就是说,当两个系统通过透热壁相互接触并达到热平衡后,其特点是它们参数的取值受到了限制。
图1-2a表示系统A与B之间以绝热壁隔开,而它们同时又以透热壁与系统C相接触时,经过状态变化,最后系统A和B都和系统C达到了热平衡。
然后将系统A和B以绝热壁与系统C相隔离,而系统A与B之间则通过透热壁相互接触,如图1-2b所示,这时我们发现系统A与B都不会发生状态变化,表明它们之间也已达到了热平衡。
这个经验事实被总结成下述公理:若两个系统分别与第三个系统处于热平衡,则他们彼此之间处于热平衡。
按照福勒〈R. H. Fowler〉在l93l年提出的建议,上述公理称之为热力学第零定律,它是引出温度概念和建立温标的基础。
图1-2 热力学第零定律示意图2. 温度当系统A与C处于热平衡时,它们参数间的限制关系为F AC(X A,Y A,X C,Y C)=0(1-1)同样,若系统B与系统C也处于热平衡,则有F BC(X B,Y B,X C,Y C)=0 (1-2)将这两个关系写成Y C的显式,可得Y C=f AC(X A,,X C) (1-3)及Y C=f BC(X B,X B,X C) (1-4)将式(1-3)与式(1-4)合并,消去变量Y C,得f AC(X A,X B,X C)= f BC(X B,Y B,X C)(1-5)根据热力学第零定律,当系统A和系统B分别与系统C处于热平衡时,它们之间也处于热平衡,因此有F AB(X A,Y A,X B,Y B)=0 (1-6)方程(1-5)与(l-6)描述的是同一个现象,因而应该是等同的,但后者没有包含参数只能取以下形式:X C。
热力学第零定律在温度测量中的应用

热力学第零定律在温度测量中的应用热力学第零定律是热力学基本定律之一,它是热力学研究中非常重要的一条定律,不仅对热学领域的研究有着重要意义,同时也在实际应用中发挥着重要的作用。
本文将探讨热力学第零定律在温度测量中的具体应用。
首先,我们先来了解一下热力学第零定律的内容。
热力学第零定律指出,当两个物体之间没有热量传递时,它们的温度是相等的。
换句话说,如果两个物体和第三个物体分别达到了热平衡状态,那么这三个物体的温度是相等的。
这一定律为温度的测量提供了基础。
在实际生活中,我们经常需要测量物体的温度,比如测量室内温度、身体温度等等。
而热力学第零定律在温度测量中的应用就体现在这些方面。
首先,我们来看室内温度的测量。
在我们的日常生活中,我们通常使用温度计来测量室内温度。
而温度计的工作原理正是基于热力学第零定律。
温度计中的温度探头与被测物体(室内空气)接触,通过热平衡使温度计与被测物体达到相同温度。
探头中的某种物质(如酒精)随温度的变化而膨胀或收缩,进而引起指针的移动,从而读取温度值。
可见,温度计的工作原理正是基于热力学第零定律。
除了室内温度的测量,热力学第零定律在身体温度测量中也发挥着重要的作用。
身体温度是我们健康状况的重要指标,而体温计正是用来测量身体温度的。
体温计的工作原理与温度计类似,通过热平衡使体温计与人体达到相同温度,然后读取温度值。
热力学第零定律的应用使得我们能够准确测量自己的体温,从而判断自己是否患病。
此外,热力学第零定律在工业生产中也有着重要的应用。
许多工业过程需要精确控制温度,以确保产品质量和生产效率。
在这些过程中,温度传感器起着关键的作用。
温度传感器根据热力学第零定律原理,通过与被测物体接触来测量温度。
然后,它们将测得的温度值传输给控制系统,由控制系统根据设定值进行调节,从而实现温度的控制。
总结起来,热力学第零定律在温度测量中有着广泛而重要的应用。
无论是室内温度的测量,还是身体温度的测量,热力学第零定律都为我们提供了准确测量温度的基础。
《高等工程热力学》02热力学温标
,
t3
)
Q1 Q3
= ψ (t1,t3 )
Q2 T2
C
WC
Q1 = Q1 Q2 Q3 Q2 Q3
ψ (t1, t3 ) = ψ (t1, t2 ) ×ψ (t2 , t3 )
Q2
WB B Q3
Q3
因此有:ψ (t1,t2 ) =
f (t1 ) f (t2 )
ψ (t2 , t3 ) =
f (t2 ) f (t3 )
国际温标的发展
1976年0.5 K到30 K的暂行温标(EPT-76)
z 明显减小了原有定义中30 K以下温度的偏差; z 填补了5.2 K到13.8 K之间的空隙; z 设计了11个参考点和一个热力学内插仪器; z 但由于缺乏内部一致性,各复现之间可能出现
细微的含糊。
18
温度与热力学第零定律
1990年国际温标(ITS-90)
z 调整了多个固定点的取值和内插公式; z 定义了0.65 K以上全部温度范围,全量程均非常接近
于热力学温度的最佳估计值,但远比直接测量热力学 温度方便得多。
19
温度与热力学第零定律
1990年国际温标(ITS-90)
主要特点:
z 规定了多个固定点温度; z 0.65到5.0K的蒸气压测量 ; z 从3.0到24.5561K用氦气定容温度计测量 ; z 13.8033到1234.93K用按照技术规范在表中的固
2016-9-7
温度和热力学第零定律
温度与热力学第零定律
温度的定义
人们的经验:温度是表征物体冷热程度的 物理量
z 同样温度,不同人感觉不同; z 冬天相同温度下,铁比木头凉,人的感觉还和
导热系数等因素有关;
热力学温度与摄氏温度的换算

热力学温度与摄氏温度的换算摘要:热力学温度和摄氏温度是两种常见的温度单位,它们之间可以通过一定的换算关系进行转换。
本文将介绍热力学温度和摄氏温度的定义及其换算关系,并通过实例进行说明。
引言:温度是物体内部分子热运动的一种表现,是物体热状态的度量。
在热力学中,热力学温度是温度的一种单位,常用符号为T。
而摄氏温度是人们日常生活中常用的温度单位,用符号°C表示。
下面将详细介绍热力学温度和摄氏温度的定义及其换算关系。
一、热力学温度的定义及换算热力学温度是根据理想气体状态方程定义的,它与理想气体的压力和体积有关。
根据热力学第零定律,当两个物体处于热平衡状态时,它们的热力学温度是相等的。
热力学温度的单位是开尔文(K)。
摄氏温度是根据水的冰点和沸点定义的,将水的冰点定义为0°C,沸点定义为100°C。
摄氏温度的单位是摄氏度(°C)。
热力学温度和摄氏温度之间的换算关系可以通过下面的公式进行计算:T(K) = t(°C) + 273.15其中,T(K)表示热力学温度,t(°C)表示摄氏温度。
根据这个公式,我们可以将摄氏温度转换为热力学温度,或者将热力学温度转换为摄氏温度。
二、实例分析为了更好地理解热力学温度和摄氏温度之间的换算关系,我们来看一个实际的例子。
假设现在有一个物体的摄氏温度为20°C,我们要将其转换为热力学温度。
根据上述的换算公式,可以得到:T(K) = 20°C + 273.15 = 293.15K所以,该物体的热力学温度为293.15K。
同样地,如果我们已知一个物体的热力学温度为350K,我们要将其转换为摄氏温度。
根据换算公式,可以得到:t(°C) = 350K - 273.15 = 76.85°C所以,该物体的摄氏温度为76.85°C。
三、总结本文介绍了热力学温度和摄氏温度的定义及其换算关系。
物理温度的知识点总结

物理温度的知识点总结1. 温度的概念和测量温度是物体内部微观粒子的平均热运动的强弱程度的物理量。
温度的测量通常使用温度计,常用的有水银温度计和电子温度计。
温度的单位有摄氏度、华氏度和开尔文。
摄氏度和开尔文是国际单位制的温度单位,华氏度一般用于英美国家。
2. 温度和热量之间的关系温度和热量是不同的物理量,温度是物体内部微观粒子的平均热运动的强弱程度,而热量是物体内部微观粒子的总热运动能量。
在热力学中,温度是热平衡状态下物体之间热传递的驱动力,热量是热传递的真正载体。
3. 理想气体的温度理想气体的温度是指气体分子的平均动能,它与气体的压强、体积和摩尔数成正比。
理想气体的温度可以用理想气体状态方程来描述:PV=nRT,其中P是气体的压强,V是气体的体积,n是气体的摩尔数,R是气体常数,T是气体的绝对温度。
4. 热力学温度和测量热力学温度是描述物质内部微观粒子运动状态的物理量。
热力学温度的测量通常使用卡诺循环或者理想气体状态方程来实现。
5. 温度的传递方式温度的传递方式主要有热传导、对流和辐射。
热传导是固体和液体传热的主要方式,对流是液体和气体传热的主要方式,辐射是热量以电磁波的形式传递的方式。
6. 温度和热力学系统温度是热力学系统内部微观粒子平均热运动状态的物理量。
在热力学系统中,热力学温度是描述系统热平衡状态的物理量,它与系统内部微观粒子的平均热运动状态的强弱程度有关。
7. 温度和热力学过程在热力学过程中,温度是描述系统热平衡状态和热传递过程中的物理量。
在绝热过程中,系统内部的温度不变;在等温过程中,系统内部的温度恒定;在绝热过程中,系统内部的温度逐渐增大或减小。
8. 温度和理想气体在理想气体的热力学过程中,温度是描述气体内部微观粒子平均热运动状态的物理量。
在等温过程中,理想气体的温度不变;在绝热过程中,理想气体的温度逐渐增大或减小。
9. 温度和热力学第零定律热力学第零定律表明,如果两个系统分别与一个第三个系统达到热平衡,那么这两个系统之间也处于热平衡状态,它们的温度相等。
热力学第零定律温度与热平衡

热力学第零定律温度与热平衡热力学第零定律:温度与热平衡热力学是一门涉及物质和能量转换的学科,其研究的基础之一就是热平衡。
而热平衡则与温度密切相关。
它们之间的关系以及热力学第零定律的原理,构成了热力学的重要基础。
热平衡指的是在一个封闭系统中,系统的各个部分之间不存在热量的净流动,而只有热量的传递。
在热平衡状态下,系统的各个部分之间的温度是相等的。
这是一个十分重要的概念,因为从热平衡的角度出发,可以推导出热力学第零定律。
热力学第零定律是指:若A与B分别与第三个体C分别达到热平衡,则A与B之间也达到热平衡。
换句话说,如果两个系统与一个第三个系统分别达到热平衡,那么这两个系统之间也处于热平衡状态。
这个定律的重要性在于它为温度的概念提供了准确定义。
温度是一个用来衡量物体热状态的物理量。
根据热力学第零定律,我们可以用温度来衡量两个物体是否达到了热平衡。
实际上,温度的定义就是通过热平衡状态实现的。
如果两个物体达到了热平衡,那么它们的温度必然是相等的。
然而,温度是一个相对的概念。
我们无法直接测量一个物体的温度,而只能通过与其他物体进行热平衡来确定其温度。
这就是为什么温度通常是用摄氏度、华氏度或开氏度等具体数字表示的原因。
在温度尺度中,开氏温标是最常用的,也是最科学的。
它将冰点的温度定义为零度,沸点的温度定义为一百度,并将这两个固定点之间的温度分成一百等分。
与开氏温标相比,摄氏温标和华氏温标使用了不同的固定点,而且刻度之间的间隔也不相同。
温度的量纲是K(开氏度)或℃(摄氏度)或℉(华氏度),而温度本身是一个无量纲的物理量。
它只是用来描述物体或系统中分子运动状态的一个指标。
具体说,温度越高,分子的平均能量就越高,分子运动的速度就越快。
总之,热力学第零定律将温度和热平衡联系在一起,为温度的概念提供了准确定义。
温度是一种相对的概念,通过与其他物体进行热平衡来确定。
开氏温标是常用的温度尺度,用于衡量物体的热状态。
温度是一个无量纲的物理量,用来描述分子的平均能量和分子运动的速度。
热力学基础知识

二、压力 垂直作用在单位面积上的力称为压力,以符号P表示,这就 是物理学上所称的压强.按分子运动论的观点,压力是气体的 大量分子向容器壁面撞击所产生的平均结果。若气体作用在 器壁面积A上的垂直作用力为F,那么该壁上的压力为: P=F/A 压力通常用各种压力计来测定。这些压力计的测量原理部是 建立在力的平衡的基础上。由于压力计本身处于大气压力Pb 作用下,因此压力计上测得的压力是工质的真实压力和大气 压力Pb的差值,是一个相对压力,称为表压力或工作压力, 用符号Pg表示,而工质的实际压力称绝对压力,用P表示。 P, Pg 和Pb之间的关系是: P=Pb+Pg
热力学基础识
樟洋电厂 运行部
第一节
热力学定律
一、热力学第零定律 定义:与第三个系统处于热平衡的两个系统,彼此也处于 热平衡。 热力学第零定律是进行体系测量的基本依据。1)、 可以通过使两个体系相接触,并观察这两个体系的性质是 否发生变化而判断这两个体系是否已经达到平衡。2)、 当外界条件不发生变化时,已经达成热平衡状态的体系, 其内部的温度是均匀分布的,并具有确定不变的温度值。 3)、一切互为平衡的体系具有相同的温度,所以,一个 体系的温度可以通过另一个与之平衡的体系的温度来表达; 或者也可以通过第三个体系的温度来表达。
t,c
w0 q2 T2 1 1 q1 q1 T1
即:
q2 q1 T2 T1
对于任意的可逆循环, 如图所示循环1A2B1。假 如用一组可逆绝热线将它分 割成无数个微元循环,当绝 热线间隔极小时,例如绝热 线ad与 bc 间隔极小,ab 段温度差极小,接近于定温 过程,同理cd段也是定温 过程,那么微元循环abcda。 就是由两个可逆绝热过程与 两个可逆定温过程组成的微 小卡诺循环。
热力学第零定律

在工程中,热力学第零定律是传热设计和分析的基础,可以 帮助工程师理解和优化传热过程,提高设备的效率和安全性 。
05
CATALOGUE
热力学第零定律的实验验证
实验验证的方法
01
02
03
热量测量
通过测量热量交换量来验 证热力学第零定律,确保 热量交换过程中温度保持 不变。
温度测量
使用温度计或其他测量仪 器,准确测量系统内各部 分的温度,以验证温度的 一致性。
这个温度可以作为它们各自的热力学温度。
03
这意味着我们可以使用热平衡状态下的物体来测量和
标定温度,从而为温度提供了一个客观的物理标准。
02
CATALOGUE
热平衡和温度
热平衡的定义
热平衡定义总结
热平衡是指两个或多个物体在没 有外界热交换的情况下,通过内 部热量交换达到的热状态平衡。
热平衡条件
当两个物体在没有外界热交换的 情况下,如果它们的温度相同, 则它们处于热平衡状态。
等温过程
等压过程
等容过程
04
CATALOGUE
热力学第零定律的应用
在热力学第一定律和第二定律中的应用
热力学第一定律
热力学第零定律为热量传递的方向和 大小提供了基础,是热力学第一定律 中能量守恒和转换的基础。
热力学第二定律
热力学第零定律对于判断系统状态变 化的方向和可能性非常重要,是热力 学第二定律中熵增加原理的基础。
简单来说,如果两个物体温度相同, 则它们之间没有热交换。
定律的数学表述
热力学第零定律的数学表述涉及到温 度的标定和热平衡状态下的热容。
VS
在数学上,如果两个热力学系统在某 个温度下达到热平衡,则它们的热容 相等。
热力学第零定律是温度测量的依据

热力学第零定律是温度测量的依据
热力学第零定律是热力学的基本原理之一,它为温度的测量提
供了重要依据。
在热力学中,温度是一种描述物体热运动程度的物
理量,而热力学第零定律则为我们提供了一种方法来测量和比较不
同物体的温度。
热力学第零定律的表述是这样的,如果两个物体分别与第三个
物体处于热平衡状态,那么这两个物体之间也一定处于热平衡状态。
这意味着,如果两个物体具有相同的温度,它们与第三个物体的热
交换将不会引起温度的变化。
基于这个定律,我们可以利用热平衡
的原理来测量和比较物体的温度。
利用热力学第零定律进行温度测量通常采用温度计。
温度计是
一种利用物质的热膨胀性质来测量温度的仪器。
常见的温度计包括
水银温度计和电子温度计等。
通过将温度计与待测物体放置在热平
衡状态下,我们可以测量出它们之间的温度差异,从而准确地测量
出物体的温度。
除了温度计,热力学第零定律还为温度测量提供了其他方法。
例如,利用热辐射的原理,我们可以通过测量物体发出的热辐射来
推断出其温度。
这些方法都是基于热力学第零定律的基本原理,即物体在热平衡状态下的热交换规律。
总之,热力学第零定律为温度的测量提供了重要依据,它为我们提供了测量和比较物体温度的方法。
通过利用热平衡的原理和相应的测量仪器,我们可以准确地测量和比较不同物体的温度,从而更好地理解和应用热力学的基本原理。
工程热力学2 温度与热力学第零定律详解

温度通常指的是物体的冷热程度。
这一概念来源于人们对于冷热现象的经验感觉,譬如通过触觉,可以把各种
物体按冷、凉、温、热等作一排列。但感觉不能成为科学概念,感觉往往也 可能会是错觉。
常与热的概念混淆-- 物体“冷热”的热与物体间传递“热量”的热是同一个字,不
像英语中可分别用Hotness和Heat区分,但此热非彼热也。人们用手触摸物体感受其温 度时,他所感到的实际上是单位时间物体传给他的热量。诚然,热量源自于温差,即 外界物体的温度越高,势差也越大,传给我们手的热量也越多,这种感觉似乎也能指 示物体的温度。但要知道物体所传的热量不仅和温差有关,还和物体本身材料的导热 性质又称导热系数有关。触摸处于相同环境同一温度的铁与木头,冬天你会觉得铁比 木头冷,夏天又可能会觉得铁比木头热。
上述证明很易推广到任意多个系统处于热平衡且每个系统有任意独立
变量个数的情况。
这一结果表明:任何系统均有一个状态函数存在,它对于所有相互处于 热平衡的系统数值相同。我们将这个状态函数定义为温度,作为判断 一个系统与其它系统是否处于热平衡的宏观性质。一切处于热平衡的 系统,其温度均相等。
在我们的温度感觉可以信赖的范围内,所有各个物体相互接触一段足够 长的时间之后,这些物体的冷热程度都将变得相同。因此,这个温度 概念与我们日常估量系统冷热程度的温度概念是一致的。
2. 温度测量--温度计与温标
我们已得到了热力学第零定律的一个重要推论——状态参数温度存在。
现将温度这一性质定量化。若要判断两个系统温度是否相等,根据 热力学第零定律,可用第三个系统分别与它们接触,如果都是处于热平 衡的,即没有热的相互作用,则这两个系统也处于热平衡,它们的温度 相等。如果第三个系统和其中一个热平衡而和另一个有热的相互作用, 则这两系统温度不等。对于一般第三个系统和它们可能均达不成热平衡 的情况,我们进一步推想,若选的第三个系统的热容相对很小,它与其 它系统接触时,即使有热的相互作用,对它们的状态也几乎没有影响, 而自己的状态却有明显的改变,那么当其与第一个系统达成热平衡处于 某一状态后,若与第二个系统达不成热平衡,状态继续变化,则这两系 统温度不等。这里比较两个系统的温度,它们无须接触,第三个系统状 态参数的变化可指示温度的异同。因此,我们得到了热力学第零定律的 另一个重要推论--温度计存在。
热力学第零定律温度的定义

热力学第零定律温度的定义在我们探索热力学这个神秘而又实用的领域时,热力学第零定律就像一把关键的钥匙,为我们打开了理解温度本质的大门。
那么,究竟什么是热力学第零定律温度的定义呢?让我们一起来揭开它的神秘面纱。
想象一下,在一个寒冷的冬日,我们走进一间温暖的房间,很快就能感受到温暖,身体逐渐适应新的环境温度。
而在炎热的夏天,当我们从户外走进空调房,那种凉爽的感觉也会迅速传递给我们。
这其中,温度的变化是显而易见的,但温度到底是什么呢?要理解热力学第零定律中温度的定义,我们首先得明白什么是热平衡。
当两个物体相互接触时,如果它们之间没有热量的交换,也就是说它们的状态不发生改变,我们就说这两个物体处于热平衡状态。
假设我们有三个物体 A、B 和 C。
如果物体 A 和物体 B 分别与物体C 接触时,都处于热平衡状态,那么根据热力学第零定律,物体 A 和物体 B 彼此接触时也会处于热平衡状态。
这个定律看似简单,却蕴含着对温度深刻的定义。
在这种情况下,我们就可以说物体 A、B 和 C 具有相同的“某种性质”,而这个“某种性质”就是温度。
换句话说,温度是决定物体是否处于热平衡的一个物理量。
如果两个物体的温度相同,它们相互接触时就不会有热量的传递,因为它们在热的方面已经达到了一种平衡状态。
而如果两个物体的温度不同,热量就会从温度高的物体流向温度低的物体,直到它们达到相同的温度,实现热平衡。
举个例子,我们把一杯热水和一杯冷水混合在一起。
热水温度高,具有较多的内能,而冷水温度低,内能较少。
当它们混合时,热水中的热量会自动传递给冷水,直到两者的温度变得相同,达到一个共同的中间温度。
温度的概念在我们的日常生活中无处不在。
我们用温度计来测量温度,无论是测量气温、水温还是人体的体温。
温度计的工作原理,其实也是基于热力学第零定律。
常见的温度计,比如水银温度计,利用了水银的热胀冷缩性质。
当温度计接触到一个物体时,它会与该物体达到热平衡。
热学基本概念 热力学第0定律 温度

热力学是研究物质热运动的宏观理论。从基本 实验定律出发,通过逻辑推理和数学演绎,找 出物质各种宏观性质的关系,得出宏观过程进 行的方向及过程的性质等方面的结论。具有高 度的普适性与可靠性。但因不涉及物质的微观 结构,而将物质视为连续体,故不能解释物质 宏观性质的涨落。
3
统计物理学是研究物质热运动的微观理论。 从物质由大量微观粒子组成这一基本事实 出发,运用统计方法,把物质的宏观性质 作为大量微观粒子热运动的统计平均结果 ,找出宏观量与微观量的关系,进而解释 物质的宏观性质。在对物质微观模型进行 简化假设后,应用统计物理可求出具体物 质的特性;还可应用到比热力学更为广阔 的领域,如解释涨落现象。
第二部分 热学
第一章 热学基本概念 热力学第0定律 温度
§1 热学的一些基本概念
1.1 系统与外界
1.2 热力学平衡态 1.3 状态参量——平衡态的描述和态函数 1.4 摩尔、摩尔质量
§2 热力学第0定律 温度的概念
2.1 热平衡
经验温标
2.2 热力学第0定律
理论温标
2.3 温度和温标
国际温标
§3 理想气体状态方程
13
通过导热板进行热接触的两个系统组成 一复合系统当复合系统达到平衡态时, 我们就说两个系统处于热平衡。
2.2 热力学第0定律
如果两个系统分别与处于确定状态 的第三个系统达到热平衡,则这两 个系统彼此也将处于热平衡。
AB C
2.3 温度和温标
• 温度—互为热平衡的几个热力学系统,必
然具 有某种共同的宏观性质,我们将这种决 定系统热平衡宏观性质的物理量定义为温度。
18
2. 规定温度T 与测温属性X 之间的函数关系 通常假定为线性关系,如:T(x)=a.X
简述热力学第零定律的物理意义

简述热力学第零定律的物理意义热力学第零定律是热力学的基础定律之一,它描述了物体的温度状态与能量的关系。
其原理是,如果把一定的物质置于恒定的温度,它们所存在的能量状态就不会发生变化,也就是说,温度是一种平衡的状态。
热力学第零定律最早是由热力学学者Sadi Carnot1824年提出来的,他认为,只有当温度和能量完全平衡时,物质才能保持一定的温度。
他还指出,只有当温度降低到一定程度时,物质会改变状态,而当温度升高到一定程度时,物质又会改变状态。
热力学第零定律的物理意义在于,它使得物理系统的稳定性得以确定。
这个定律同时也提供了热力学所需的基本模型,并且可以帮助我们理解复杂热力学现象。
它定义了物理系统中温度与能量之间的关系,并规定了物理系统必须在一定的温度范围内保持平衡。
在热力学系统中,各种物理量,例如压力、温度和总能,可以使用热力学第零定律来表示。
热力学第零定律以温度及其与总能的关系为基础,还引入了一个重要的参数熵,用来表示热力学系统的熵变化。
与熵相关的重要概念包括热力学定律、熵定律及热力学系统的熵增加定律。
由热力学第零定律可得出热力学的定律,这些定律又可以用来计算热力学系统的熵变化。
另外,由于热力学第零定律提供了一种表征热力学系统熵变化的方法,因此可以用来解释复杂物理现象,例如气候变化,化学反应,物质变形等现象。
此外,热力学第零定律还可以用来表示一定物质中某种物理量的变化,如压力或温度,以及物质之间的相互作用。
因此,热力学第零定律是物理学中十分重要的定律之一,其物理意义在于,它为我们提供了一种表征物质的温度和能量之间关系的方法,而且可以用来解释复杂物理现象,可以作为热力学系统中稳定性的基础,从而为热力学的研究提供了基础模型。
热力学第零定律公式

热力学第零定律公式热力学第零定律听起来好像很深奥,其实它就像我们生活中的小秘密,只要揭开面纱,就会发现也没那么难理解。
先来说说什么是热力学第零定律。
它表述为:如果两个热力学系统中的每一个都与第三个热力学系统处于热平衡,那么这两个热力学系统也必定处于热平衡。
这听起来有点绕口是不是?咱们换个说法,假设你有三杯热水,A 杯和 B 杯分别与 C 杯接触后,温度变得和 C 杯一样,那么 A 杯和 B 杯相互接触,它们之间也不会发生热传递,因为它们温度相同,处于热平衡状态。
这定律有个重要的公式:T1 = T2 。
这里的 T 代表温度。
我想起之前在课堂上给学生讲这个定律的时候,有个特别有趣的事儿。
那天阳光正好,教室里有点闷热。
我正讲到热力学第零定律,有个调皮的小家伙举手问我:“老师,这和我们夏天吃冰棍儿有关系吗?”我一听,嘿,这问题问得还挺有意思。
我就跟他们说:“当然有关系啦!你们想想,冰棍儿在冰箱里的时候温度很低,当我们把它拿出来放到室温下,冰棍儿和周围的空气就存在温度差,就会发生热传递。
直到冰棍儿的温度和周围空气的温度达到热平衡,也就是差不多一样的时候,冰棍儿就开始化得更快啦。
”这时候,孩子们都瞪大了眼睛,好像突然明白了什么。
咱们再回到这个公式T1 = T2 。
它虽然简单,却包含着深刻的道理。
比如说,在一个大工厂里,有好多机器在运转,会产生大量的热。
工程师们就得根据热力学第零定律和这个公式,来计算怎么给机器散热,保证机器不会因为过热而出故障。
还有在我们的日常生活中,冬天的时候,我们从寒冷的室外走进温暖的室内,身体会逐渐和室内的温度达到热平衡,这也是热力学第零定律在起作用呢。
再比如说,我们做饭的时候,锅里的水和锅里的食物,它们的温度会逐渐变得一样,也是因为这个定律。
总之,热力学第零定律虽然看似抽象,但其实就在我们身边,影响着我们生活的方方面面。
从工厂的生产到我们日常的衣食住行,它都在默默地发挥着作用。
所以啊,同学们,别小看这个简单的公式 T1 = T2 ,它可是蕴含着大大的能量和智慧呢!。
简述热力学第零定律物理意义

简述热力学第零定律物理意义热力学第零定律是物理学中有重要的定律,它也被称为热力学绝对零定律。
热力学第零定律物理意义是指热力学系统中的温度在不同状态下,温度改变的量是相同的,并且这种温度的变化是不可逆的。
这一定律被广泛应用于物理、化学、工程和材料等许多领域。
热力学第零定律物理意义是,在不受外力影响的情况下,物体存在温度差异的情况下,这种温度差异会随着时间流逝而减少,甚至最终消失,直至两个物体的温度完全平衡。
温度的变化是不可逆的,即一个物体的温度上升时,另一个物体的温度必定会下降。
这就是热力学第零定律的物理意义。
在这里,温度改变量相等是指,无论谁升温,谁降温,温度变化量都是相同的。
热力学第零定律也可以表述为温度和熵之间的关系。
熵与温度有一定的关系,温度越高,熵越大。
熵是热力学系统中最重要的物理参数,它可以体现一个物质的热力学和逆变状态。
当物质的温度发生变化时,它的熵也会随着温度变化而发生变化,由此可见,温度和熵变化量相等,这就是热力学第零定律的物理意义。
热力学第零定律也可以实际应用到物理、化学、工程和材料等许多领域,例如电子工程和电子材料等,都是基于这一定律实现热力学系统的热平衡性。
热力学第零定律也可以应用于量子力学,以实现量子力学系统内部的能量平衡,这可以极大地提高量子计算机的处理能力。
另外,热力学第零定律也可以用来探究物质交互过程中的能量变化,从而推断物质属性变化和物理性质变化。
它还可以帮助我们理解和分析物质的性质变化,从而更好地利用热力学系统中的热能。
总之,热力学第零定律表明,物质在存在温度差异的情况下,随着不受外力干涉的情况下,温度会逐渐改变,直至完全平衡,这种温度变化是不可逆的。
热力学第零定律实际应用于物理、化学、工程和材料等许多领域,可以帮助我们更好地理解和分析物质的性质变化,从而实现更好的热力学系统管理。
热力学第零定律的物理意义

热力学第零定律的物理意义热力学第零定律是热力学的基本定律之一,它指的是在一个系统中,温度是相等的。
物理意义上,这意味着在一个系统中,没有能量传递(热传递)发生时,温度不会发生变化。
简单来说,热力学第零定律就是系统中不存在无效热。
热力学第零定律还表明,在一个系统中,两个物质如果有相同的温度,那么这两个物质在热交换上是相等的。
这个定律也被称为热平衡定律。
这意味着,在热平衡状态下,热交换量是相等的。
热力学第零定律是热力学研究的基础,它为热力学的其他定律提供了基础。
它的应用非常广泛,可以用来研究各种热力学系统,如热电器,热交换器等。
热力学第零定律的一个重要应用是在热机的工作原理和效率计算中。
它被用来研究热机的热效率,这个热效率的定义是将机器的输入热能转化为机器的输出功率的比例。
热力学第零定律还被用来研究各种热交换器的工作原理和效率,如管道式热交换器,板式热交换器等。
热力学第零定律在实际工程中也有广泛应用,如在空调系统,加热系统,冷却系统等中。
热力学第零定律还被用来研究各种热力学系统,如热电器,热交换器等。
热力学第零定律还可以用来研究热力学系统的稳定性。
如果系统是热力学稳定的,那么系统会自动达到热平衡状态,系统中的温度会趋于稳定。
如果系统是热力学不稳定的,那么系统会自动脱离热平衡状态,系统中的温度会不断变化。
另外,热力学第零定律也可以用来研究热力学系统的热流密度。
热流密度是指热流在单位面积上所产生的能量,它可以用来评估热力学系统的热效率。
另外还有一点需要提醒,热力学第零定律是热力学中的一个基本定律,是在热平衡状态下成立的。
在热平衡状态之外,热力学第零定律不再成立。
另外,在热力学系统中,有时候会出现热力学不稳定的现象,这个时候热力学第零定律不再成立。
这种情况下,需要采用其他方法来研究热力学系统。
总的来说,热力学第零定律是一个重要的热力学定律,它是热力学研究的基础,但是需要注意它只在热平衡状态下才成立。
热力学温度与摄氏度换算

热力学温度与摄氏度换算热力学温度和摄氏度是两种常用的温度单位,它们之间的换算关系让我们能够在不同的温度标度下进行测量和计算。
热力学温度是基于热力学第零定律而定义的,而摄氏度是基于水的冰点和沸点而定义的。
下面我将为大家介绍一种简单的换算方法。
我们来了解一下热力学温度的定义。
热力学温度是以绝对零度为零点的温度标度,用符号T表示。
绝对零度是理论上的最低温度,它等于摄氏零度减去273.15度。
换句话说,绝对零度就是-273.15摄氏度。
现在,我们来看看如何将热力学温度转换为摄氏度。
换算公式如下:摄氏度 = 热力学温度 - 273.15举个例子,假设有一个物体的热力学温度是300K,我们可以使用上述公式进行换算。
将300K带入公式中,计算结果为:摄氏度 = 300 - 273.15 = 26.85摄氏度因此,300K等于26.85摄氏度。
相反地,如果我们想将摄氏度转换为热力学温度,我们可以使用以下公式:热力学温度 = 摄氏度 + 273.15假设有一个物体的摄氏度为30度,我们可以将30带入公式中,计算结果为:热力学温度 = 30 + 273.15 = 303.15K因此,30摄氏度等于303.15K。
通过以上的换算公式,我们可以在热力学温度和摄氏度之间进行简单的换算。
这对于科学研究和工程应用来说非常重要,因为不同的温度单位在不同的领域中有着不同的应用。
无论是在化学实验室中还是在工业生产中,我们都需要准确地进行温度换算。
总结一下,热力学温度和摄氏度之间的换算关系可以通过简单的数学公式实现。
熟练掌握这些换算方法将有助于我们更好地理解和应用温度单位。
希望以上内容能够帮助大家更好地理解热力学温度与摄氏度的换算方法。
热力学温度和摄氏温度换算

热力学温度和摄氏温度换算热力学温度和摄氏温度是两种不同的温度标度,它们在物理学和工程学中经常被使用。
本文将介绍热力学温度和摄氏温度的定义和换算关系。
热力学温度是热力学系统的一个基本量,用符号T表示,单位是开尔文(K)。
热力学温度是根据热力学第零定律得出的,它与热平衡状态下两个系统的热交换无关。
热力学温度与物质的热运动的平均动能有关,当物质的热运动增加时,热力学温度也会增加。
摄氏温度是一种常用的温度标度,用符号°C表示。
它是由瑞典物理学家安德斯·开尔文提出的,以水的冰点和沸点作为标准。
在摄氏温度标度下,水的冰点定义为0°C,沸点定义为100°C。
摄氏温度与热力学温度之间存在着线性关系,可以通过换算公式进行转换。
换算公式如下:T(K)= t(°C)+ 273.15其中,T为热力学温度(单位为开尔文),t为摄氏温度(单位为摄氏度)。
举个例子来说明热力学温度和摄氏温度的换算。
假设现在有一个物体的摄氏温度是25°C,我们要将其换算为热力学温度。
根据上述公式,可以得到:T(K)= 25 + 273.15 = 298.15 K所以,该物体的热力学温度为298.15 K。
同样,如果我们知道一个物体的热力学温度是350 K,我们可以利用上述换算公式将其转换为摄氏温度:t(°C)= 350 - 273.15 = 76.85°C因此,该物体的摄氏温度为76.85°C。
通过以上的例子可以看出,热力学温度和摄氏温度之间的换算是非常简单的,只需要利用一个加减法运算即可完成。
在实际应用中,我们经常需要在不同的温度标度之间进行转换,这时候就可以使用这个换算公式。
需要注意的是,在一些特殊的情况下,摄氏温度和热力学温度之间的换算可能不适用。
例如,当物体的温度接近绝对零度时,摄氏温度和热力学温度之间的换算就不再准确。
在这种情况下,需要使用更加精确的温标进行换算。
热力学温度和开尔文温度

热力学温度和开尔文温度热力学温度和开尔文温度是热力学中常用的温度概念,它们在研究热力学系统中的能量转换和热平衡等方面起着重要的作用。
本文将分别介绍热力学温度和开尔文温度的概念、特点以及它们之间的转换关系。
一、热力学温度热力学温度是描述热力学系统中分子平均动能的物理量,是热平衡状态下系统的宏观性质。
热力学温度的单位通常采用开尔文(Kelvin)符号为K。
热力学温度的定义基于热力学第零定律,即当两个物体处于热平衡时,它们的热力学温度相等。
热力学温度的特点是绝对的,即零度时对应着绝对零度,无限接近于绝对零度的物体热力学温度也趋近于零。
在绝对零度下,分子的热运动几乎完全停止,系统的熵趋于零。
热力学温度的零点被称为绝对零度,对应着-273.15℃。
二、开尔文温度开尔文温度是热力学温度的另一种表达方式,它与热力学温度之间存在简单的线性关系。
开尔文温度的单位也是K,与热力学温度的单位相同。
开尔文温度的定义基于绝对温标,即绝对零度对应着0K,温度的数值与系统内部分子的平均动能成正比。
开尔文温标是热力学中常用的温度标度,它的特点是与分子热运动的平均动能成正比,数值上没有负值。
开尔文温度的零点是绝对零度,与热力学温度的零点相同。
开尔文温度与热力学温度的转换关系是简单的线性关系,即K = ℃ + 273.15。
三、热力学温度和开尔文温度的转换关系热力学温度和开尔文温度之间存在着简单的线性关系,可以通过一个简单的换算公式进行转换。
这个公式是K = ℃ + 273.15,其中K 表示开尔文温度,℃表示热力学温度。
在实际应用中,我们经常需要在不同的温度标度之间进行转换,特别是在国际科学交流中。
热力学温度和开尔文温度的转换关系提供了便利,使得科学家们能够在不同的温度标度下进行数据分析和比较。
四、热力学温度和开尔文温度的应用热力学温度和开尔文温度在热力学领域有着广泛的应用。
它们是描述热力学系统能量状态的重要物理量,可以用于研究热力学过程、能量转换以及热平衡等问题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
热力学第零定律、温度1. 热力学第零定律热力学第零定律是有关热平衡的基本公理。
根据这条定律可以引出温度的概念。
现在,我们从考察热平衡现象入手来说明这个问题。
当一个单相系统与环境之间只有一种形式的功作用〈这样假定纯粹是为了讨论的方便〉,例如只有体积变化功、电功或磁功等之一时,经验表明,只要两个独立的热力学参数便可以完全地确定它的状态。
假设有系统图1-1 绝热壁及透热壁的性质A与B,它们的独立参数分别为X A、Y A必与X B、Y B。
当系统A与系统B之间以固定的刚性绝热壁相隔离〈如图l-1a所示〉时,对于它们各自的平衡状态来说,上述四个参数的取值是任意的。
如果两个系统之间以透热壁相互接触,如图1-1b所示,则原先处于平衡状态的系统A和B的参数都会发生变化,直至建立新的平衡状态为止。
这时参数X A、Y A和X B、Y B的取值都不再是任意的,它们之间存在一定的关系F AB(X A,Y A ,X B,Y B)。
也就是说,当两个系统通过透热壁相互接触并达到热平衡后,其特点是它们参数的取值受到了限制。
图1-2a表示系统A与B之间以绝热壁隔开,而它们同时又以透热壁与系统C相接触时,经过状态变化,最后系统A和B都和系统C达到了热平衡。
然后将系统A和B以绝热壁与系统C相隔离,而系统A与B之间则通过透热壁相互接触,如图1-2b所示,这时我们发现系统A与B都不会发生状态变化,表明它们之间也已达到了热平衡。
这个经验事实被总结成下述公理:若两个系统分别与第三个系统处于热平衡,则他们彼此之间处于热平衡。
按照福勒〈R. H. Fowler〉在l93l年提出的建议,上述公理称之为热力学第零定律,它是引出温度概念和建立温标的基础。
图1-2 热力学第零定律示意图2. 温度当系统A与C处于热平衡时,它们参数间的限制关系为F AC(X A,Y A,X C,Y C)=0(1-1)同样,若系统B与系统C也处于热平衡,则有F BC(X B,Y B,X C,Y C)=0 (1-2)将这两个关系写成Y C的显式,可得Y C=f AC(X A,,X C) (1-3)及Y C=f BC(X B,X B,X C) (1-4)将式(1-3)与式(1-4)合并,消去变量Y C,得f AC(X A,X B,X C)= f BC(X B,Y B,X C)(1-5)根据热力学第零定律,当系统A和系统B分别与系统C处于热平衡时,它们之间也处于热平衡,因此有F AB(X A,Y A,X B,Y B)=0 (1-6)方程(1-5)与(l-6)描述的是同一个现象,因而应该是等同的,但后者没有包含参数只能取以下形式:X C。
为了使方程(1-5)中的X C可以消去,函数f AC 及fBCf AC=φ(X C)θA(X A,Y A)+η(X C)(1-7)f AC=φ(X C)θB(X B,Y B)+η(X C)(1-8)将上面两个式子联立,得到与式(1-5)等价的公式,θA(X A,Y A)=θB(X B,Y B)(1-9)把式(l-7)代入式(1-3),得到Y C=φ(X C)θA(X A,Y A)+η(X C)即(1-10)最后求得θA(X A,Y A) =θB(X B,Y B) =θc(X c,Y c)(1-11)上式表明:任何系统总可以找到一个函数θ(X,Y),它对于相互处于热平衡状态的所有系统都具有相同的数值。
我们把确定一个系统与其他系统是否处于热平衡的共同特性定义为温度,并令其等于温度函数θ(X,Y),即:θ(X,Y)(1-12)因为温度是系统状态的函数,所以它是一个状态参数。
处于热平衡状态的系统,其内部各部分之间必定也处于热平衡,也就是说系统内部每一部分都具有相同的温度。
由此也可以得出:温度是一个强度参数。
根据温度的定义,当两个系统具有不同的温度而通过透热壁相接触时,便有热作用产生,因此温度差是发生热量传递的根源。
3. 温标以上关于温度的讨论完全是定性的。
作为一个可使用的参数还需要解决测量方法和标度的问题,即建立温标。
温度的测量可根据热力学第零定律来解决。
首先选定一个标准系统(温度计),按方程(1-12)给定一系列θ值,从而可在X-Y坐标图上画出一簇等温线,如图1-3a所示。
这时与标准系统处于平衡的系统B(待测温度的物体),按式(1-11)可以在X B-Y B坐标图上画出相应的等温线簇,见图1-3b。
规定系统B 的等温线具有和标准图1-3 标准系统与待测系统B的等温线系统对应等温线相同的温度值,这样就解决了温度的测量问题。
具体做的时候还可以采用更简便的方式,把标准系统的一个参数Y固定,于是Y=常数的直线与各等温线交点的每一个X就对应一个温度值,θ就成为X的单值函数。
测温参数X一般应选择对温度敏感而又容易测量的物体的物性。
表1-1列出了几种常用的温度计及测温参数。
表1-1 温度计与测温参数①磁化率等于磁化强度与磁场强度之比。
任选一个线性温度函数θ(X)=αX (Y = 常数)式中α为任意常数。
于是标准系统的温度关系就可用对应参数X之比表示,即(Y=常数) (1-13)选作标准固定点d的温度值θ(X d)一经定义,就可按上式进行标度。
定义的标准固定点要求稳定并有良好的复现性。
从1954年起,以水的三相点作为定义点已为国际上所接受,其温度规定为θψ =273.16K式中,K为热力学温度单位“开尔文”(或简称“开”)的符号。
于是式(l-13)变成(Y=常数) (1-14)由于标准系统和温度函数的选择具有随意性,故按照上述程序确定的温标称为经验温标,用经验温标表示的温度叫做经验温度。
很明显,经验温标与测温参数有关,因此除定义点外,两种经验温标对同一温度的测量都不可能获得完全相同的数值。
除此之外,经验温标还使我们对绝对零度的理解发生困难。
基本的经验温标是理想气体温标。
人们发现,低压下(约105Pa或更低)利用不同气体做成的各种温标,压力恒定时的体积变化,或体积恒定时的压力变化,都几乎相同。
当压力逐渐减小时,这两种温标的差异越来越小。
这种性质的推论是,当压力无限减小时,所有的实际气体都将具有理想气体的性质,其压力、体积与温度的关系都将趋向同一极限。
因此,有可能将任何实际气体的相应参数外推到零压,并把这种参数作为标准测温参数。
接着,将泡中的气体取出一部分再次进行以上测量,读得较小的p tp与p,按上式算得新的θ(P)值。
多次重复上述操作步骤后,便可获得一系列的p tp 、p值以及计算出的相应θ(P)值。
然后将结果表示在θ(P)-p tp坐标图上〈图1-5〉,便可得到一条曲线。
图1-5 采用不同气体时,气体温度计测得的水沸点温度当温度计采用其他气体时,用类似的方法还可以得到另外的曲线。
但是,当这些曲线外推到p tp=0时,所有的曲线都与坐标交于一点。
于是得到理想气体温标的温度(K)(V=常数) (1-15)理想气体温标与测温气体的性质无关,以后我们将要证明这种温标与热力学温标是一致的,因此可作为实现热力学温标的手段。
用气体温度计测定温度值需要精密度和准确度很高的零压测温系统,使用费事而且困难,也很昂贵,故通常仅限于国家计量标准实验室和某些必要装置与经验的实验室。
为了能在科学技术中普遍应用,经过国际协商,制定了国际实用温标。
国际实用温标是在l927年采用的,目的在于提供一种容易准确地复现并且尽可能给出接近热力学温度的实用温标。
它经过几次修正,其中以1948年的修正版(IPTS一48)和现行的取代前者的1968年新版本(IPTS一68)最为重要。
IPTS 一68在1975年又经过微小的修正,根据它所测定的温度非常接近热力学温标的温度,而且两者间的差值在当今(1975年)测量误差的限度之内。
(IPTS一68)是以一些可复现的平衡态(定义的固定点)温度的给定值(用气体温度计检定过)及在这些温度上分度的标准仪器作为基础的。
各固定点温度间的插补是根据公式得到的,这些公式建立了标准仪器指示值和国际实用温标值间的关系。
国际实用温标——1968的单位为“开尔文",单位符号为K,定义一开尔文等于水的三相点温度的l/273.16K。
国际实用开尔文温度及国际实用摄氏温度分别用符号T68和t68来区别,它们之间的关系是{f68}c{T68}k-273.16考虑到IPTS一68与IPTS-48有差值,读者在使用1968年以前发表的文献时,对温度及有关数据应加以修正。
稳定平衡定律在工程热力学中,热力学第一定律、第二定律以及状态原理,一般都是分别作为经验事实来接受的。
在l965年出版的哈特索波洛斯(G. N. Hatsopoulos)和基南(J. H. Keenan)的著作中提出了“稳定平衡定律",于是上述三条定律或原理都可以作为稳定平衡定律的推论来引出。
这样,经典热力学的公理基础就变得更为简单,并使热力学第一定律、第二定律以及状态原理居于“定理”的地位。
不过由于习惯,我们在以后的阐述中仍然保留它们原先的名称在本章1-1中已经简单而笼统地对平衡状态下了定义,并进行了简单的讨论,下面我们来作比较详细的研究。
图1-6 四种不同类型的平衡状态首先,我们对热力平衡的性质进行一些考察。
为此,可用经典力学的例子来作类比,先来分析重力场中一颗刚性圆珠在不同支座上的平衡状况。
图1-6表明,支座可以有四种不同形式,从而珠子的平衡状态也相应地具有稳定、随遇、亚稳定和不稳定等四种。
所谓稳定,是指具有抗干扰的能力。
处于稳定平衡状态时,圆珠在受到瞬时扰动之后,会恢复到它原先的平衡位置,如图1-6a所示。
随遇平衡是指在受到扰动时圆珠将变到一个新的平衡位置上,如图1-6b所示。
亚稳定状态则指在微小的扰动下是稳定的,但当扰动超过一定限度后,圆珠就会失去稳定而转移到另一个新的稳定平衡位置上去,如图1-6c所示。
不稳定平衡是在轻微扰动下便会使圆珠从支座上跌落,产生有限大小的状态变化速率。
现在回到热力学上来。
不稳定平衡实际上不可能存在足够长的时间,我们无法捕捉到观察或研究它们的时机,随遇平衡在瞬时的干扰下平衡位置便发生了变化,但根据我们对热力学参数和状态所下的定义,这种变化与我们研究的目的无关。
换句话说,热力学所研究的稳定平衡状态将包括随遇平衡在内。
我们对热力学状态研究的注意力应该集中到稳定平蘅状态和亚稳定平衡状态,或简称为稳定态和亚稳态。
事实上,稳定态是我们最经常碰到的,经典热力学的各种唯象规律都是建立在对热力系统稳定平衡状态的描述的基础之上的,也只有在这个基础上,才能撇开时间这个因素。
因此,在应用这些定律及定理的时候,判断研究对象是否处于稳定态就显得非常重要,否则就不可能对这些规律的可靠性确信无疑。
一般认为,稳定态是最常见的,亚稳态相对来说比较少。
然而,有时我们往往无法辨别系统是否真正处于稳定平衡状态。
