2020届高考化学总复习课件+作业:第23讲 弱电解质的电离 (2份打包)
合集下载
人教版高中化学选修:弱电解质的电离PPT

弱电解质的电离是可逆的;书写电离方程式时
用
, 多元弱酸是分步电离的,以第一步电
离为主,多元弱碱一步完成。
人教版高中化学选修:弱电解质的电 离PPT
人教版高中化学选修:弱电解质的电 离PPT
2、弱电解质的电离平衡
CH3COOH
思考与讨论:
电离 结合
CH3COO - + H+
开始时,V电离 和 V结合怎样变化?当V电离 = V结合 时,可逆过程达到一种什么样的状态?
人教版高中化学选修:弱电解质的电 离PPT
人教版高中化学选修:弱电解质的电 离PPT
一 强弱电解质 强电解质:能够全部电离的电解质。
NaCl = Na++Cl-
(强酸、强碱、大多数盐)
弱电解质:只能部分电离的电解质。
(弱酸、弱碱、水)
人教版高中化学选修:弱电解质的电 离PPT
人教版高中化学选修:弱电解质的电 离PPT
①NaCl溶液、②NaOH 、③HCl、
④Cu、 ⑤CH3COOH、 ⑥NH3·H2O、 ⑦CO2、 ⑧乙醇、 ⑨水
讨论以下几种说法是否正确?
1.石墨能导电,所以是电解质。 2.由于BaSO4不溶于水,所以不是电解质。 3.盐酸能导电,所以盐酸是电解质。 4.SO2、NH3、Na2O溶于水可导电,所以均为 电解质。
(2)化学平衡原理也适用于电离平衡,当浓度等条件改变时, 弱电解质的电离平衡也会发生移动。
人教版高中化学选修:弱电解质的电 离PPT
人教版高中化学选修:弱电解质的电 离PPT
写出一元弱酸(HA)和一元弱碱(BOH)电离方程式并填写下表
0 不变
0 不变
最大 不变
最大
最大
高二化学《弱电解质的电离》课件
常数”比较它们的相对强弱。 酸性:草酸>磷酸>柠檬酸>碳酸
➢写出H3PO4在水溶液中的电离方程式。
H3PO4 H2PO4HPO42-
H+ + H2PO4H+ + HPO42H+ + PO43-
请推测每一步的电离程度如何变化,为什么?
• 多元弱酸是分步电离的,K1》K2》K3
• 多元弱酸的酸性主要由第一步电离决定。
BD
A.NaOH(s) B.H2O C.NH4Cl(s) D.CH3COONa (s)
3.1mol/l的盐酸、醋酸、硫酸各1L,分别加入足量的 铁开始反应时产生氢气的速率_硫__酸__>_盐__酸__>__醋_酸_, 最终 收集到的氢气的物质的量_硫__酸__>_盐__酸__=_醋__酸_ 。
4.pH都为1的盐酸、醋酸、硫酸各1L,分别加入足量的 铁.开始反应时产生氢气的速率_______三__者_相__等, 最终收集到的氢气的物质的量____醋__酸__>_硫__酸_=_盐__酸。
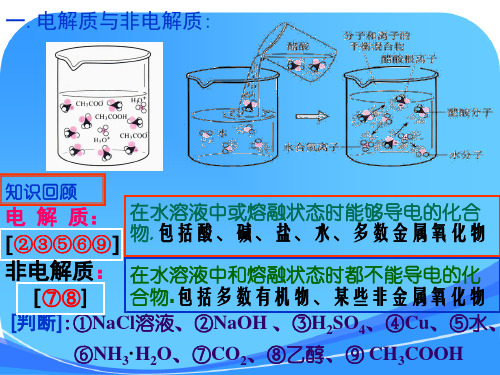
一.电解质与非电解质:
知识回顾
电 解 质:
[②③⑤⑥⑨]
在水溶液中或熔融状态时能够导电的化合 物.包括酸、碱、盐、水、多数金属氧化物
非电解质: 在水溶液中和熔融状态时都不能导电的化
[⑦⑧] 合物.包括多数有机物、某些非金属氧化物
[判断]:①NaCl溶液、②NaOH 、③H2SO4、④Cu、⑤水、
⑥NH3·H2O、⑦CO2、⑧乙醇、⑨ CH3COOH
b.弱酸的酸式盐第一步完全电离:
[训练] :请写出Na2SO4、HClO、NH3·H2O 、
H2CO3、Fe(OH)3在水溶液中的电离方程式。
Na2SO4 = 2Na+ +SO42- HClO NH3·H2O NH4++OH- H2CO3
-弱电解质的电离平衡复习ppt(共20张)

第16页,共20页。
练习(liànxí)2.某二元酸(H2A)在水中的电离方程
式是 H2A=H++HA-, HA-≒H++A2-
1.请判断H2A是强电解质还是弱电解质
理由是
2.已知0.1mol/LNaHA溶液的PH=2,则0.1mol/lH2A溶液中C(H+))应 0.11mol/L(填<,>或=)
元弱酸(HB)的比较:。4.一元强酸(HA)与一元弱酸(HB)的比较:。1)相同物质的量浓度 、相同体积时。2)相同pH、相同体积时
Image
第20页,共20页。
(guòchéng)
度 均升增高大,平衡向电离方向移动。K与
(2)浓度
弱电解质浓度越大,电离度
越小。K的大小与溶液的浓度无关.
第6页,共20页。
思考题1:
现有(xiàn yǒu)两瓶醋酸溶液,其物质的量浓
度分别为1 mol/L和0.1 mol/L,那么 这两瓶溶液的氢离子浓度的比值是大 于10、小于10、还是等于10 ?
(1)电离平衡常数:
对于一元弱酸:HA
c ( H+) .c( A-)
Ka=
c(HA)
H++A-,平衡时
对于一元弱碱:MOH M++OH-,平衡时
c ( M+).c( OH- )
Kb=
c(MOH)
第3页,共20页。
(2)电离 度α (diànlí)
已电离的弱电解质浓度
α=
×100%
弱电解质的初始浓度
n(H+) C(H+) C (Ac- ) α
减小 减小 增大
Hale Waihona Puke 减小 减小 增大增大
练习(liànxí)2.某二元酸(H2A)在水中的电离方程
式是 H2A=H++HA-, HA-≒H++A2-
1.请判断H2A是强电解质还是弱电解质
理由是
2.已知0.1mol/LNaHA溶液的PH=2,则0.1mol/lH2A溶液中C(H+))应 0.11mol/L(填<,>或=)
元弱酸(HB)的比较:。4.一元强酸(HA)与一元弱酸(HB)的比较:。1)相同物质的量浓度 、相同体积时。2)相同pH、相同体积时
Image
第20页,共20页。
(guòchéng)
度 均升增高大,平衡向电离方向移动。K与
(2)浓度
弱电解质浓度越大,电离度
越小。K的大小与溶液的浓度无关.
第6页,共20页。
思考题1:
现有(xiàn yǒu)两瓶醋酸溶液,其物质的量浓
度分别为1 mol/L和0.1 mol/L,那么 这两瓶溶液的氢离子浓度的比值是大 于10、小于10、还是等于10 ?
(1)电离平衡常数:
对于一元弱酸:HA
c ( H+) .c( A-)
Ka=
c(HA)
H++A-,平衡时
对于一元弱碱:MOH M++OH-,平衡时
c ( M+).c( OH- )
Kb=
c(MOH)
第3页,共20页。
(2)电离 度α (diànlí)
已电离的弱电解质浓度
α=
×100%
弱电解质的初始浓度
n(H+) C(H+) C (Ac- ) α
减小 减小 增大
Hale Waihona Puke 减小 减小 增大增大
高考化学一轮总复习课件弱电解质的电离平衡

特点
弱电解质的电离程度较小,存在电离 平衡,且电离过程吸热。
常见弱电解质类型
弱酸
如醋酸、碳酸等,其电离程度较小,存在电离平衡。
弱碱
如氨水、氢氧化铁等,同样存在电离平衡,且电离程 度较小。
水
作为极弱的电解质,水的电离程度非常小,但在某些 条件下可以发生电离。
弱电解质与强电解质区别
电离程度不同
强电解质在水中完全电离,而弱电解质 则部分电离。
对酸碱指示剂的反应不同
强电解质可以使酸碱指示剂发生明显 颜色变化,而弱电解质则变化不明显
。
溶液性质不同
强电解质溶液导电能力强,而弱电解 质溶液导电能力相对较弱。
受温度影响不同
弱电解质的电离过程吸热,因此升高 温度可以促进其电离;而强电解质的 电离不受温度影响。
02
电离平衡原理
电离平衡建立过程
弱电解质部分电离
影响沉淀溶解平衡因素
同离子效应
在难溶电解质的饱和溶液中,加入含有与该难溶电解质具 有相同离子的易溶强电解质,从而使难溶电解质的溶解度 降低的现象称为同离子效应。
温度
大多数难溶电解质的溶解度随温度的升高而增大,少数难 溶电解质的溶解度随温度的升高而减小。
盐效应
在难溶电解质的饱和溶液中,加入不含与该难溶电解质具 有相同离子的强电解质,使难溶电解质的溶解度略有增大 的现象称为盐效应。
正确操作、准确观察和记录数据。
误差来源及减小误差方法
误差来源
酸碱滴定法中的误差主要来源于仪器误差、操作误差 和试剂误差等方面。例如,仪器未经校准、操作不规 范、试剂不纯等都可能导致误差的产生。
减小误差方法
为了减小误差,可以采取以下措施:使用校准合格的 仪器、规范实验操作、选用优质试剂、进行空白试验 以消除试剂误差、增加平行测定次数以减小随机误差 等。
弱电解质的电离程度较小,存在电离 平衡,且电离过程吸热。
常见弱电解质类型
弱酸
如醋酸、碳酸等,其电离程度较小,存在电离平衡。
弱碱
如氨水、氢氧化铁等,同样存在电离平衡,且电离程 度较小。
水
作为极弱的电解质,水的电离程度非常小,但在某些 条件下可以发生电离。
弱电解质与强电解质区别
电离程度不同
强电解质在水中完全电离,而弱电解质 则部分电离。
对酸碱指示剂的反应不同
强电解质可以使酸碱指示剂发生明显 颜色变化,而弱电解质则变化不明显
。
溶液性质不同
强电解质溶液导电能力强,而弱电解 质溶液导电能力相对较弱。
受温度影响不同
弱电解质的电离过程吸热,因此升高 温度可以促进其电离;而强电解质的 电离不受温度影响。
02
电离平衡原理
电离平衡建立过程
弱电解质部分电离
影响沉淀溶解平衡因素
同离子效应
在难溶电解质的饱和溶液中,加入含有与该难溶电解质具 有相同离子的易溶强电解质,从而使难溶电解质的溶解度 降低的现象称为同离子效应。
温度
大多数难溶电解质的溶解度随温度的升高而增大,少数难 溶电解质的溶解度随温度的升高而减小。
盐效应
在难溶电解质的饱和溶液中,加入不含与该难溶电解质具 有相同离子的强电解质,使难溶电解质的溶解度略有增大 的现象称为盐效应。
正确操作、准确观察和记录数据。
误差来源及减小误差方法
误差来源
酸碱滴定法中的误差主要来源于仪器误差、操作误差 和试剂误差等方面。例如,仪器未经校准、操作不规 范、试剂不纯等都可能导致误差的产生。
减小误差方法
为了减小误差,可以采取以下措施:使用校准合格的 仪器、规范实验操作、选用优质试剂、进行空白试验 以消除试剂误差、增加平行测定次数以减小随机误差 等。
2020人教版化学高考复习:弱电解质的电离平衡 (共65张PPT)

减小。 • ④加入能反应的物质:电离平衡正向移动,电离程度增大。
5
考点探究
• 角度1 弱电解质的电离平衡及其影响因素
6
考点探究
• 角度1 弱电解质的电离平衡及其影响因素 A
7
考点探究 • 2.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:
CH3COOH⇌CH3COO-+H+,要使溶液中 大,可以采取的措施是( )
。 。
14
考点二 电离平衡常数及其应用 • 2.意义:相同条件下,K值越大,表示该弱电解质越易电离,所
对应的酸性或碱性相对越强。 • 3.特点:电离常数只与温度有关,与电解质的浓度、酸碱性无
关,由于电离过程是吸热的,故温度升高,K增大。多元弱酸是 分步电离的,各级电离常数的大小关系是K1≫K2……,所以其酸 性主要决定于第一步电离。
• (1)对于pH=y的强酸溶液稀释时,体积每增大10n倍,pH就增大n个单位,即pH=y+n; 对于pH=y的弱酸溶液来说,体积每增大10n倍,pH增大不足n个单位,即pH<y+n;无 论怎样稀释,酸溶液的pH不能等于或大于7,只能趋近于7。
• (2)对于pH=x的强碱溶液稀释时,体积每增大10n倍,pH就减小n个单位,即pH=x-n; 对于pH=x的弱碱溶液来说,体积每增大10n倍,pH减小不足n个单位,即pH>x-n;无 论怎样稀释,碱溶液的pH不能等于或小于7,只能趋近于7。
•
HX ⇌
H+ +
X-
• 起始/(mol·L-1): c(HX)
0
0
• 平衡/(mol·L-1): c(HX)-c(H+) c(H+)
c(H+)
• 则:K=
• 由于弱酸只有极少一部分电离,c(H+)的数值很小,可做近似处理:c(HX)-c(H+)≈c(HX)。
5
考点探究
• 角度1 弱电解质的电离平衡及其影响因素
6
考点探究
• 角度1 弱电解质的电离平衡及其影响因素 A
7
考点探究 • 2.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:
CH3COOH⇌CH3COO-+H+,要使溶液中 大,可以采取的措施是( )
。 。
14
考点二 电离平衡常数及其应用 • 2.意义:相同条件下,K值越大,表示该弱电解质越易电离,所
对应的酸性或碱性相对越强。 • 3.特点:电离常数只与温度有关,与电解质的浓度、酸碱性无
关,由于电离过程是吸热的,故温度升高,K增大。多元弱酸是 分步电离的,各级电离常数的大小关系是K1≫K2……,所以其酸 性主要决定于第一步电离。
• (1)对于pH=y的强酸溶液稀释时,体积每增大10n倍,pH就增大n个单位,即pH=y+n; 对于pH=y的弱酸溶液来说,体积每增大10n倍,pH增大不足n个单位,即pH<y+n;无 论怎样稀释,酸溶液的pH不能等于或大于7,只能趋近于7。
• (2)对于pH=x的强碱溶液稀释时,体积每增大10n倍,pH就减小n个单位,即pH=x-n; 对于pH=x的弱碱溶液来说,体积每增大10n倍,pH减小不足n个单位,即pH>x-n;无 论怎样稀释,碱溶液的pH不能等于或小于7,只能趋近于7。
•
HX ⇌
H+ +
X-
• 起始/(mol·L-1): c(HX)
0
0
• 平衡/(mol·L-1): c(HX)-c(H+) c(H+)
c(H+)
• 则:K=
• 由于弱酸只有极少一部分电离,c(H+)的数值很小,可做近似处理:c(HX)-c(H+)≈c(HX)。
高考化学一轮复习全国版精选专题弱电解质的电离PPT演示课件

(或酸性)越弱。如:利用上面中电离常数的数 值可知等浓度的CH3COONa、NaHCO3、 Na2CO3溶液的pH由大到小的顺序为 Na2CO3>NaHCO3>CH3COONa 一般符合“强酸制弱酸”规律。如:利用上面
(三二) 电离常数的4个应用
判断弱酸 (或弱碱) 的相对强 弱
判断盐溶 液的酸性 (或碱性) 强弱
判断复分 解反应能 否发生
电离常数越大,酸性(或碱性)越强。如:常温 下,CH3COOH的Ka=1.8×10-5,H2CO3的Ka1 =4.3×10-7、Ka2=5.6×10-11。 则酸性:CH3COOH>H2CO3>HCO- 3 电离常数越大,对应的盐水解程度越小,碱性
(3)相同离子:在弱电解质的溶液中,加入与弱电解质 具有相同离子的强电解质,电离平衡向逆反应方向移动, 电离程度 减小 。
(4)加入能与电离出的离子反应的物质:电离平衡向正 反应方向移动,电离程度 增大 。
(四二) 溶液的导电能力
电解质溶液导电能力取决于溶液中自由移动离子浓度 和离子所带电荷数。自由移动离子浓度越大,离子所带电 荷数越多,则导电能力越强。将冰醋酸、稀醋酸加水稀 释,其导电能力随加水的量的变化曲线如图所示。
注意:指已电离的电解质与未电 离的电解质的分子数之和。
已电离的弱电解质的浓度 2.表达式:α= 弱电解质的初始浓度 ×100%。 3.意义:衡量弱电解质的电离程度,在相同条件下 (浓度、温度相同),不同弱电解质的电离度越大,弱电解 质的电离程度越大。
4.影响因素
温度的 升高温度,电离平衡向右移动,电离度_增__大_; 影响 降低温度,电离平衡向左移动,电离度_减__小__
步(通常只写第一步电离),如H2CO3的电离方程式: H2CO3 H++HCO- 3 、 HCO- 3 H++CO23- 。
(三二) 电离常数的4个应用
判断弱酸 (或弱碱) 的相对强 弱
判断盐溶 液的酸性 (或碱性) 强弱
判断复分 解反应能 否发生
电离常数越大,酸性(或碱性)越强。如:常温 下,CH3COOH的Ka=1.8×10-5,H2CO3的Ka1 =4.3×10-7、Ka2=5.6×10-11。 则酸性:CH3COOH>H2CO3>HCO- 3 电离常数越大,对应的盐水解程度越小,碱性
(3)相同离子:在弱电解质的溶液中,加入与弱电解质 具有相同离子的强电解质,电离平衡向逆反应方向移动, 电离程度 减小 。
(4)加入能与电离出的离子反应的物质:电离平衡向正 反应方向移动,电离程度 增大 。
(四二) 溶液的导电能力
电解质溶液导电能力取决于溶液中自由移动离子浓度 和离子所带电荷数。自由移动离子浓度越大,离子所带电 荷数越多,则导电能力越强。将冰醋酸、稀醋酸加水稀 释,其导电能力随加水的量的变化曲线如图所示。
注意:指已电离的电解质与未电 离的电解质的分子数之和。
已电离的弱电解质的浓度 2.表达式:α= 弱电解质的初始浓度 ×100%。 3.意义:衡量弱电解质的电离程度,在相同条件下 (浓度、温度相同),不同弱电解质的电离度越大,弱电解 质的电离程度越大。
4.影响因素
温度的 升高温度,电离平衡向右移动,电离度_增__大_; 影响 降低温度,电离平衡向左移动,电离度_减__小__
步(通常只写第一步电离),如H2CO3的电离方程式: H2CO3 H++HCO- 3 、 HCO- 3 H++CO23- 。
弱电解质的电离平衡高三复习课堂PPT

深度思考·提升思维能力
以0.1 mol·L-1 CH3COOH溶液为例,填写外界条件对CH3CO⇌OH -+H+ ΔH>0的影响。
CH3COO
实例(稀溶液) 改变条件 加水稀释
CH3COOH ⇌ 平衡移动方向 n(H+)
向右
_增__大__
H++CH3导电能力
Ka
_减__小_ _减__弱__
_不__变__
加入少量冰醋酸
向右
_增__大__ _增__大__ _增__强__
_不__变__
通入HCl(g)
向左
_增__大__ _增__大__ _增__强__
_不__变__
加NaOH(s)
向右
_减__小__ _减__小__ _增__强__
_不__变__
加入镁粉
向右
_减__小__ _减__小__ _增__强__
忽略水的电离及H2CO3的第二级电离,则H2CO3
+ ⇌ HH+CO- 3
的电离常数K1=4_._2_×__1_0_-_7_(已知:10-5.60=2.5×10-6)。
解析 由 H2CO3 ⇌ H++HCO-3 得
K1=cHc+H·c2CHOC3O- 3 =10-15.5.6×0×1100--55.60≈4.2×10-7。
√B.升高温度,溶液的pH增大
C.此酸的电离常数约为1×10-7 D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
解析 答案
练后反思
有关电离平衡常数计算的答题模板(以弱酸HX为例)
HX
H+ + X-
起始/mol·L-1: c(HX)
0
0
平衡/mol·L-1: c(HX)-c(H+) c(H+) c(H+)
电解质的电离ppt课件

问题探究:
物质导电的本质原因是什么?
(1).物质中存在自由移动的电子;
(2).物质中存在自由移动的阴阳离子。
灯泡发光
铜 线
实验表明:金属(铜)能导电
——金属内部存在自由移动的电子。
灯泡发光
NaCl 溶液
——NaCl 溶液中存在自由移动的阴阳离子。
无明显现象
蔗糖或酒精溶液
——蔗糖或酒精溶液既无自由移动的电 子,又无自由移动的阴阳离子。
离子(包括NH4+)和酸根阴 离子的化合物叫做盐
试从电离的角度概括出盐的本质
想一想:
1、写出NaHSO4在水溶液中的电离方程式, 思考它属于酸吗?
NaHSO4 = Na+ + H+ + SO42-
2、写出Cu2(OH)2CO3在水溶液中的电离方程 式,思考它属于碱吗?
Cu2(OH)2CO3 = 2Cu2+ + 2OH- + CO32-
6.弱酸的酸式盐,用电离方程式表示其电离过程时 弱酸的酸式酸根不能拆!而强酸的酸式盐,用电离 方程式表示其电离过程时,酸式酸根一般要拆!
例如:不是:NaHCO3 = Na+ + H+ + 而是:NaHCO3 = Na+ + HCO3-
例如: 不是:NaHSO4 = Na+ + HSO4而是:NaHSO4 = Na+ + H+ +
纯 净 物
物 质
混 合 物
单
质
电
解
质
化 合 物
非 电 解 质
强电解质 弱电解质
返回
四、电离方程式的书写
1.强电解质是全部电离,用电离方程式表示其电离 过程时,连接符号用“=”;
高考总复习《化学》弱电解质的电离平衡ppt课件

D.加入少量醋酸钠固体,CH3COOH 溶液的电离程度增大 解析:醋酸的电离是吸热反应,升高温度,促进醋酸电离,A 项错误;加入少量 NaOH 固体,NaOH 和 H+反应生成水,所 以促进醋酸电离,B 项正确;盐酸中含有 H+,向醋酸中加入盐 酸,H+浓度增大,C 项错误;加入醋酸钠固体,醋酸钠中含有 CH3COO-,抑制醋酸电离,使醋酸的电离程度减小,D 项错误。 答案:B
减弱 增强 增强
减小 增强
减小 增大
增强 增强
[练题点——备考方向明起来] 1.在 0.1 mol·L-1 CH3COOH 溶液中存在电离平衡:CH3COOH
CH3COO-+H+。对于该平衡,下列叙述正确的是( ) A.温度升高,平衡向逆反应方向移动
B.加入少量 NaOH 固体,平衡向正反应方向移动 C.加入少量 0.1 mol·L-1 盐酸,溶液中 c(H+)减小
4.影响因素
温度的 升高温度,电离平衡向右移动,电离度增大; 影响 降低温度,电离平衡向左移动,电离度减小
浓度的 当弱电解质溶液浓度增大时,电离度减小; 影响 当弱电解质溶液浓度减小时,电离度增大
(二)电离常数 1.概念:在一定条件下,弱电解质在达到电离平衡时, 溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的 分子浓度的比值是一个常数,这个常数叫做电离常数。用 K(弱 酸的用 Ka,弱碱的用 Kb)表示。
比较 项目 c(H+) pH 酸 一元强酸 大 小 一元弱酸 小 大
中和 碱的 能力
相同
与足量Zn 反应产生 H2的量
相同
与金属反 应的起始
速率 大 小
(2)相同 pH、相同体积的一元强酸与一元弱酸的比较
与足量
比较
中和
酸
减弱 增强 增强
减小 增强
减小 增大
增强 增强
[练题点——备考方向明起来] 1.在 0.1 mol·L-1 CH3COOH 溶液中存在电离平衡:CH3COOH
CH3COO-+H+。对于该平衡,下列叙述正确的是( ) A.温度升高,平衡向逆反应方向移动
B.加入少量 NaOH 固体,平衡向正反应方向移动 C.加入少量 0.1 mol·L-1 盐酸,溶液中 c(H+)减小
4.影响因素
温度的 升高温度,电离平衡向右移动,电离度增大; 影响 降低温度,电离平衡向左移动,电离度减小
浓度的 当弱电解质溶液浓度增大时,电离度减小; 影响 当弱电解质溶液浓度减小时,电离度增大
(二)电离常数 1.概念:在一定条件下,弱电解质在达到电离平衡时, 溶液中电离所生成的各种离子浓度的乘积与溶液中未电离的 分子浓度的比值是一个常数,这个常数叫做电离常数。用 K(弱 酸的用 Ka,弱碱的用 Kb)表示。
比较 项目 c(H+) pH 酸 一元强酸 大 小 一元弱酸 小 大
中和 碱的 能力
相同
与足量Zn 反应产生 H2的量
相同
与金属反 应的起始
速率 大 小
(2)相同 pH、相同体积的一元强酸与一元弱酸的比较
与足量
比较
中和
酸
高考化学一轮基础查漏补缺第23讲弱电解质的电离课件

全部 部分
强酸、强 碱、大多 数盐
弱酸、弱 碱、水
12/11/2021
返回目录
第23讲 弱电解质的电离
❖考
向❖
3.电离方程式的书写
互 动❖
(1)强电解质的电离方程式用__=______号连接,如
探 硫酸的电离方程式H_2_S_O_4_=_=_=_2H__+_+_S_O_24_-______;
究❖ 弱电解质的电离方程式用________号连接,如醋酸的电
等体积、等pH的盐酸和HA溶液 分别中和碱量
现象及结论
pH=1⇨HA为强酸 pH>1⇨HA为弱酸 HA溶液的导电性弱 ⇨HA为弱酸
反应开始时HA产生 H2慢,⇨HA为弱酸
消耗碱量相同⇨HA 为强酸 HA消耗碱量大⇨HA 为弱酸
12/11/2021
返回目录
第23讲 弱电解质的电离
❖考 向 互 动 探 究
混合溶液,因CH3COO-水解,故c(Cl-)>c(CH3COO-),D项
正确;③点后为继续滴加弱电解质溶液氨水,体积增大,
其导电率会略小,但不是因为溶液中离子数目减少,C项
错误。
12/11/2021
返回目录
第23讲 弱电解质的电离
❖考 向❖
►
探究考向二
弱电解质的电离平衡
互 动
❖ —— 知 识 梳 理 ——
12/11/2021
返回目录
第23讲 弱电解质的电离
❖考 向【触摸高考】 高考选项正误判断
互
动
1.[2012·山东卷] HClO是弱酸,所以NaClO是弱电解
探 质( )
究
[解析] × NaClO属于盐,为强电解质。
2.[2012·浙江卷] 蔗糖、淀粉、油脂及其水解产物均 为非电解质( )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.强电解质和弱电解质
栏目索引
3.电离方程式的书写
教材研读 栏目索引
(1)强电解质用“ ”;弱电解质用“ ”。
(2)多元弱酸分步电离,且第一步电离程度远远大于第二步,如碳酸:H2CO3
H++HCO3 ,HCO3
H++CO32 。
(3)多元弱碱的电离一步写出,如氢氧化铁:①
(4)酸式盐的电离
Fe(OH)3
1.电离平衡的建立 在一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速率和离 子结合成弱电解质分子的速率相等时,达到了电离平衡状态。 2.电离平衡的特征
教材研读 栏目索引
3.影响电离平衡的因素 浓度、温度等因素对电离平衡有一定的影响。 (1)浓度 浓度降低(加水稀释),平衡向① 电离 方向移动。但弱电解质分子及 弱电解质电离出的离子浓度都降低。
教材研读 栏目索引
(2)温度 弱电解质的电离是一个② 吸热 的过程,升高温度,电离平衡向电离 的方向移动,弱电解质的电离程度增大。 (3)同离子效应 在弱电解质溶液中加入含有弱电解质电离产生的某种离子的物质,使离 子浓度增大,促使电离平衡逆向(即离子结合成分子的方向)移动,反之, 平衡正向(即电离方向)移动。
考点突破 栏目索引
(3)配制相同浓度的盐酸和醋酸溶液,分别测定两溶液的pH,醋酸溶液的 pH大。 (4)用已知浓度的盐酸和醋酸溶液分别配制pH=1的两种溶液,取相同体 积溶液并加入足量的锌,用排水法收集生成的氢气,醋酸产生氢气的量多。 Ⅱ.从影响弱电解质电离平衡的外界因素分析 把一定浓度的醋酸溶液分成两等份,其中一份加入醋酸钠固体,然后分别 加入形状相同质量相同的锌,未加醋酸钠固体的生成氢气的速率更快。
相等 ( √ )
教材研读 栏目索引
自测4 (1)电离平衡右移,电解质分子的浓度一定减小吗?离子的浓度 一定增大吗? (2)稀释一弱电解质溶液时,所有粒子浓度一定减小吗? 答案 (1)都不一定。如对于CH3COOH CH3COO-+H+,平衡后,加入 冰醋酸,c(CH3COOH)增大,平衡右移,根据勒夏特列原理可知,再次平衡 时,c(CH3COOH)比原平衡时大;加水稀释或加少量NaOH固体,都会引起 平衡右移,但c(CH3COOH)、c(H+)都比原平衡时要小。 (2)不是所有粒子浓度都减小。如弱酸HA溶液稀释时,c(HA)、c(H+)、c (A-)均减小,但c(OH-)会增大。
考点突破
考点突破
考点一 判断强、弱电解质的方法
栏目引
证明电解质为弱电解质的实验设计可从以下方面进行思考(以CH3 COOH为例): Ⅰ.从弱电解质的电离特点分析 (1)配制0.1 mol·L-1的醋酸溶液,测得该溶液的pH>1。 (2)配制浓度相同的盐酸和醋酸溶液,取相同体积的盐酸和醋酸分别加入烧 杯中,接通电源,观察灯泡亮度,接盐酸的灯泡更亮。
Ka= c(H ) c(CH3COO )
c(CH3COOH )
教材研读 栏目索引
(2)电离常数的意义 在一定条件下,根据电离常数数值的大小,可以估算弱电解质电离的程 度,K值越大,电离程度越大,弱酸酸性越强。如相同条件下常见弱酸的 酸性强弱:H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO。 (3)电离常数的影响因素 a.电离常数随温度的变化而变化。 b.电离常数与弱酸、弱碱的浓度无关,同一温度下,不论弱酸、弱碱的浓 度如何变化,电离常数是不会改变的。
教材研读 栏目索引
自测2 下列物质中,属于电解质的是
,属于非电解质
的是
,属于强电解质的是
,属于弱
电解质的是
。(填序号)
①H2SO4 ②盐酸 ③氯气 ④硫酸钡 ⑤酒精 ⑥铜 ⑦H2CO3
⑧氯化氢 ⑨蔗糖 ⑩氨气 CO2 NaHCO3
答案 ①④⑦⑧ ⑤⑨⑩ ①④⑧ ⑦
教材研读 栏目索引
二、弱电解质的电离平衡
Fe3++3OH- 。
强酸的酸式盐溶于水完全电离,如NaHSO4 Na++H++SO24 ;弱酸的酸
式盐中酸式酸根离子不完全电离,如NaHCO3的电离方程式:NaHCO3
Na++HCO3,② HCO3
H++CO32 。
教材研读 栏目索引
自测1 判断正误,正确的画“√”,错误的画“✕”。 (1)BaSO4难溶于水,其属于弱电解质 ( ✕ ) (2)强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 ( ✕ ) (3)强电解质溶液中不存在溶质分子,弱电解质溶液中存在溶质分子 ( √ ) (4)NH3通入水中,溶液导电性较强,故它是强电解质 ( ✕ ) (5)由0.1 mol/L一元碱BOH溶液的pH=10,可知溶液中存在BOH B++ OH- ( ✕ ) (6)冰醋酸溶于水的电离方程式为CH3COOH CH3COO-+H+ ( √ )
教材研读 栏目索引
(5)CH3COOH溶液加水稀释后,溶液中
c(CH3COOH ) c(CH3COO )
的值减小
(√)
(6)室温下,对于0.10
mol·L-1的氨水,加水稀释后,溶液中c(NH
4
)·c(OH-)变
大 (✕)
(7)稀醋酸加水稀释,醋酸的电离程度增大,溶液的pH减小 ( ✕ )
(8)中和等体积、等物质的量浓度的盐酸和醋酸溶液所消耗的n(NaOH)
教材研读 栏目索引
4.电离常数 (1)概念 在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种 离子浓度的乘积跟溶液中未电离的分子浓度的比值是一个常数,这个常 数叫做电离常数,用K来表示(一般酸的电离常数用Ka表示,碱的电离常 数用Kb表示)。 如:CH3COOH H++CH3COO-
教材研读 栏目索引
自测3 判断正误,正确的画“√”,错误的画“✕”。 (1)稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 ( ✕ ) (2)25 ℃时,等体积、等浓度的硝酸与氨水混合后,溶液pH=7 ( ✕ ) (3)25 ℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力 弱 (√) (4)25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH ( ✕ )
栏目索引
第23讲 弱电解质的电离
教 一 电解质 材 研 读 二 弱电解质的电离平衡
总纲目录 栏目索引
总纲目录 栏目索引
考 点
考点一 判断强、弱电解质的方法
突
破
考点二 弱电解质的电离问题
教材研读
教材研读
一、电解质
1.电解质与非电解质
(1)电解质:在水溶液里或熔融状态下能导电的化合物。
(2)非电解质:在水溶液里和熔融状态下都不能导电的化合物。
