弱电解质的电离平衡ppt课件全面版
合集下载
《弱电解质电离平衡》课件

《弱电解质电离平衡》ppt课件
• 弱电解质电离平衡概述 • 弱电解质的电离过程 • 弱电解质电离平衡的应用 • 弱电解质电离平衡的实验研究 • 弱电解质电离平衡的挑战与展望 • 相关资料与参考文献
01
弱电解质电离平衡概述
定义与特点
定义
弱电解质在水溶液中部分电离, 存在电离平衡。
特点
电离程度较小,离子浓度较低, 但电离平衡常数较大。
03
弱电解质电离平衡的应用
在化学反应中的应用
弱电解质电离平衡在化学反应中起着重要的调控作用,通过改变反应物和产物的浓 度,可以影响化学反应的速率和方向。
在化学反应中,弱电解质电离平衡常用于研究反应机理和反应动力学,帮助人们更 好地理解化学反应的本质和过程。
弱电解质电离平衡还可以用于指导化学反应条件的选择和优化,提高化学反应的效 率和选择性。
在环境保护中的应用
弱电解质电离平衡在环境保护中 也有着广泛的应用,例如水处理 、土壤修复和大气治理等方面。
在水处理中,利用弱电解质电离 平衡可以控制水中的离子浓度和 酸碱度,实现水质的净化和处理
。
在土壤修复中,利用弱电解质电 离平衡可以研究土壤污染物的迁 移转化规律,为土壤污染治理提
供理论依据和技术支持。
弱电解质的电离程度较小,溶液中离子浓度较低 。
影响因素
3
浓度、温度、压力等。
电离平衡的移动
影响因素
浓度、温度、压力、催化剂等。
移动方向
向电离程度增大的方向移动,即向着离子浓度增大的方向移动。
电离过程的速率
影响因素
浓度、温度、压力、催化剂等。
速率变化
随着反应物浓度的增加或温度的升高,电离速率会增大;反之,随着反应物浓度 的减小或温度的降低,电离速率会减小。
• 弱电解质电离平衡概述 • 弱电解质的电离过程 • 弱电解质电离平衡的应用 • 弱电解质电离平衡的实验研究 • 弱电解质电离平衡的挑战与展望 • 相关资料与参考文献
01
弱电解质电离平衡概述
定义与特点
定义
弱电解质在水溶液中部分电离, 存在电离平衡。
特点
电离程度较小,离子浓度较低, 但电离平衡常数较大。
03
弱电解质电离平衡的应用
在化学反应中的应用
弱电解质电离平衡在化学反应中起着重要的调控作用,通过改变反应物和产物的浓 度,可以影响化学反应的速率和方向。
在化学反应中,弱电解质电离平衡常用于研究反应机理和反应动力学,帮助人们更 好地理解化学反应的本质和过程。
弱电解质电离平衡还可以用于指导化学反应条件的选择和优化,提高化学反应的效 率和选择性。
在环境保护中的应用
弱电解质电离平衡在环境保护中 也有着广泛的应用,例如水处理 、土壤修复和大气治理等方面。
在水处理中,利用弱电解质电离 平衡可以控制水中的离子浓度和 酸碱度,实现水质的净化和处理
。
在土壤修复中,利用弱电解质电 离平衡可以研究土壤污染物的迁 移转化规律,为土壤污染治理提
供理论依据和技术支持。
弱电解质的电离程度较小,溶液中离子浓度较低 。
影响因素
3
浓度、温度、压力等。
电离平衡的移动
影响因素
浓度、温度、压力、催化剂等。
移动方向
向电离程度增大的方向移动,即向着离子浓度增大的方向移动。
电离过程的速率
影响因素
浓度、温度、压力、催化剂等。
速率变化
随着反应物浓度的增加或温度的升高,电离速率会增大;反之,随着反应物浓度 的减小或温度的降低,电离速率会减小。
弱电解质的电离平衡-完整版课件

如图所示,导线插入相同浓度的不同溶液时,灯泡的 亮度不同,为什么会出现这种现象?若将上述溶液稀 释相同倍数,亮度的变化又不同,出现这种现象又是 为什么呢?这节课我们就来学习相关内容。
1.了解弱电解质的电离平衡常数的概念和电离平衡 常数与电离程度的关系。 2.理解影响弱电解质电离平衡的因素对电离平衡移 动的影响。(重点) 3.了解常见弱酸、弱碱的电离平衡常数大小,能比 较它们的电离能力强弱。
加NaOH
增大
减小 减小 增大 减小
锌粒
增大
减小 减小 增大 减小
升温
增大
增大 增大 增大 减小
1.弱电解质的电离平衡 2.弱电解质电离程度的表示 3.影响电离平衡的因素
(1)定义
(2)特点 (1)电离度 (2)电离平衡常数
(1)温度:越高越电离
(2)浓度:越稀越电离
1.(双选)醋酸溶液加水稀释,在稀释过程中 ( BD )
阿伦尼乌斯与电离理论 阿伦尼乌斯的最大贡献是1887
年提出电离学说,它突破了当时的科 学界普遍认为离子是在电流的作用 下产生的金科玉律, 提出“电解质 在溶液中能自动电离出正、负离子 ; 溶液越稀,电离程度就越大”。
这一学说是物理化学发展初期的重大发现,对 溶液性质的解释起过重要的作用。它是物理和化学 之间的一座桥梁。
4.21×10-3
0.100 0.09866 1.34×10-3 1.34×10-3 1.82×10-5
1.34×10-2
二、弱电解质电离程度的表示
1.电离度 (1)概念:
当弱电解质在溶液中达到平衡时,溶液中已经电
离的电解质分子数占原来总分子数的百分数。 (2)适用范围:处于电离平衡状态的弱电解质。
弱电解质浓度越大,电离度越小。 电离平 衡常数的大小与溶液的浓度无关。 越稀越电离
1.了解弱电解质的电离平衡常数的概念和电离平衡 常数与电离程度的关系。 2.理解影响弱电解质电离平衡的因素对电离平衡移 动的影响。(重点) 3.了解常见弱酸、弱碱的电离平衡常数大小,能比 较它们的电离能力强弱。
加NaOH
增大
减小 减小 增大 减小
锌粒
增大
减小 减小 增大 减小
升温
增大
增大 增大 增大 减小
1.弱电解质的电离平衡 2.弱电解质电离程度的表示 3.影响电离平衡的因素
(1)定义
(2)特点 (1)电离度 (2)电离平衡常数
(1)温度:越高越电离
(2)浓度:越稀越电离
1.(双选)醋酸溶液加水稀释,在稀释过程中 ( BD )
阿伦尼乌斯与电离理论 阿伦尼乌斯的最大贡献是1887
年提出电离学说,它突破了当时的科 学界普遍认为离子是在电流的作用 下产生的金科玉律, 提出“电解质 在溶液中能自动电离出正、负离子 ; 溶液越稀,电离程度就越大”。
这一学说是物理化学发展初期的重大发现,对 溶液性质的解释起过重要的作用。它是物理和化学 之间的一座桥梁。
4.21×10-3
0.100 0.09866 1.34×10-3 1.34×10-3 1.82×10-5
1.34×10-2
二、弱电解质电离程度的表示
1.电离度 (1)概念:
当弱电解质在溶液中达到平衡时,溶液中已经电
离的电解质分子数占原来总分子数的百分数。 (2)适用范围:处于电离平衡状态的弱电解质。
弱电解质浓度越大,电离度越小。 电离平 衡常数的大小与溶液的浓度无关。 越稀越电离
(精品)弱电解质的电离平衡ppt课件全面版

弱酸、弱碱、水。 H2CO3、HClO、H2S、HF、CH3COOH NH3·H2O Fe(OH)3等
5
一、弱电解质的电离平衡
电离
CH3COOH 结合 CH3COO- + H+ v
v电离 v结合
v电离= v结合
电离平衡状态
0
t1
t2
t
6
1.定义: 在一定条件(如温度、浓度)下, 当电解质分子电离成离子和离子重新结合成分子的速率相 等时,各种微粒的浓度保持不变,电离过程就达到了平衡 状态——电离平衡。 2.特征:逆、动、等、定、变。
9
二、电离平衡常数(K)
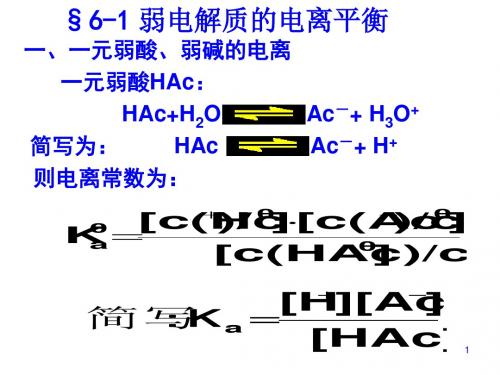
1.表示方法 一元弱酸 HA
[H+][A-] H+ +A-, Ka= [HA]
一元弱碱 MOH 2.注意事项:
[M+][OH-] M++OH-, Kb= [MOH]
(1)只有温度变,才有K变。 (2)意义:K值越大,表示弱电解质电离程度越大。
10
3.多元弱酸在水溶液中的电离
30
集腋成裘,聚沙成塔。几秒钟虽然不长, 却能构成永恒长河中的伟大时代。
31
只要我们坚持了,就没有克服不了的困难。或许,为了将来,为了自己的发展,我们会把一件事情想得非常透彻,对自己越来越严,要求越来越高,对任何机会都不曾错过,其 目的也只不过是不让自己随时陷入逆境与失去那种面对困难不曾屈服的精神。但有时,“千里之行,始于足下。”我们更需要用时间持久的用心去做一件事情,让自己其中那小 小的浅浅的进步,来击破打破突破自己那本以为可以高枕无忧十分舒适的区域,强迫逼迫自己一刻不停的马不停蹄的一直向前走,向前看,向前进。所有的未来,都是靠脚步去 丈量。没有走,怎么知道,不可能;没有去努力,又怎么知道不能实现?幸福都是奋斗出来的。那不如,生活中、工作中,就让这“幸福都是奋斗出来的”完完全全彻彻底底的 渗入我们的心灵,着心、心平气和的去体验、去察觉这一种灵魂深处的安详,侧耳聆听这仅属于我们自己生命最原始最动人的节奏。但,这种聆听,它绝不是仅限于、执着于 “我”,而是观察一种生命状态能够扩展和超脱到什么程度,也就是那“幸福都是奋斗出来的”深处又会是如何?生命不止,奋斗不息!又或者,对于很多优秀的人来说,我们 奋斗了一辈子,拼搏了一辈子,也只是人家的起点。可是,这微不足道的进步,对于我们来说,却是幸福的,也是知足的,因为我们清清楚楚的知道自己需要的是什么,隐隐约 约的感觉到自己的人生正把握在自己手中,并且这一切还是通过我们自己勤勤恳恳努力,去积极争取的!“宝剑锋从磨砺出,梅花香自苦寒来。”当我们坦然接受这人生的终局, 或许,这无所皈依的心灵就有了归宿,这生命中觅寻处那真正的幸福、真正的清香也就从此真正的灿烂了我们的人生。一生有多少属于我们的时光?陌上的花,落了又开了,开 了又落了。无数个岁月就这样在悄无声息的时光里静静的流逝。童年的玩伴,曾经的天真,只能在梦里回味,每回梦醒时分,总是多了很多伤感。不知不觉中,走过了青春年少, 走过了人世间风风雨雨。爱过了,恨过了,哭过了,笑过了,才渐渐明白,酸甜苦辣咸才是人生的真味!生老病死是自然规律。所以,面对生活中经历的一切顺境和逆境都学会 了坦然承受,面对突然而至的灾难多了一份从容和冷静。这世上没有什么不能承受的,只要你有足够的坚强!这世上没有什么不能放下的,只要你有足够的胸襟! 一生有多少 属于我们的时光?当你为今天的落日而感伤流泪的时候,你也将错过了明日的旭日东升;当你为过去的遗憾郁郁寡欢,患得患失的时候,你也将忽略了沿途美丽的风景,淡漠了 对未来美好生活的憧憬。没有十全十美的生活,没有一帆风顺的旅途。波平浪静的人生太乏味,抑郁忧伤的人生少欢乐,风雨过后的彩虹最绚丽,历经磨砺的生命才丰盈而深刻。 见过了各样的人生:有的轻浮,有的踏实;有的喧哗,有的落寞;有的激扬,有的低回。肉体凡胎的我们之所以苦恼或喜悦,大都是缘于生活里的际遇沉浮,走不出个人心里的 藩篱。也许我们能挺得过物质生活的匮乏,却不能抵挡住内心的种种纠结。其实幸福和欢乐大多时候是对人对事对生活的一种态度,一花一世界,一树一菩提,就是一粒小小的 沙子,也有自己精彩的乾坤。如果想到我们终有一天会灰飞烟灭,一切象风一样无影亦无踪,还去争个什么?还去抱怨什么?还要烦恼什么?未曾生我谁是我?生我之时我是谁? 长大成人方是我,合眼朦胧又是谁?一生真的没有多少时光,何必要和生活过不去,和自己过不去呢。你在与不在,太阳每天都会照常升起;你愁与不愁,生活都将要继续。时
5
一、弱电解质的电离平衡
电离
CH3COOH 结合 CH3COO- + H+ v
v电离 v结合
v电离= v结合
电离平衡状态
0
t1
t2
t
6
1.定义: 在一定条件(如温度、浓度)下, 当电解质分子电离成离子和离子重新结合成分子的速率相 等时,各种微粒的浓度保持不变,电离过程就达到了平衡 状态——电离平衡。 2.特征:逆、动、等、定、变。
9
二、电离平衡常数(K)
1.表示方法 一元弱酸 HA
[H+][A-] H+ +A-, Ka= [HA]
一元弱碱 MOH 2.注意事项:
[M+][OH-] M++OH-, Kb= [MOH]
(1)只有温度变,才有K变。 (2)意义:K值越大,表示弱电解质电离程度越大。
10
3.多元弱酸在水溶液中的电离
30
集腋成裘,聚沙成塔。几秒钟虽然不长, 却能构成永恒长河中的伟大时代。
31
只要我们坚持了,就没有克服不了的困难。或许,为了将来,为了自己的发展,我们会把一件事情想得非常透彻,对自己越来越严,要求越来越高,对任何机会都不曾错过,其 目的也只不过是不让自己随时陷入逆境与失去那种面对困难不曾屈服的精神。但有时,“千里之行,始于足下。”我们更需要用时间持久的用心去做一件事情,让自己其中那小 小的浅浅的进步,来击破打破突破自己那本以为可以高枕无忧十分舒适的区域,强迫逼迫自己一刻不停的马不停蹄的一直向前走,向前看,向前进。所有的未来,都是靠脚步去 丈量。没有走,怎么知道,不可能;没有去努力,又怎么知道不能实现?幸福都是奋斗出来的。那不如,生活中、工作中,就让这“幸福都是奋斗出来的”完完全全彻彻底底的 渗入我们的心灵,着心、心平气和的去体验、去察觉这一种灵魂深处的安详,侧耳聆听这仅属于我们自己生命最原始最动人的节奏。但,这种聆听,它绝不是仅限于、执着于 “我”,而是观察一种生命状态能够扩展和超脱到什么程度,也就是那“幸福都是奋斗出来的”深处又会是如何?生命不止,奋斗不息!又或者,对于很多优秀的人来说,我们 奋斗了一辈子,拼搏了一辈子,也只是人家的起点。可是,这微不足道的进步,对于我们来说,却是幸福的,也是知足的,因为我们清清楚楚的知道自己需要的是什么,隐隐约 约的感觉到自己的人生正把握在自己手中,并且这一切还是通过我们自己勤勤恳恳努力,去积极争取的!“宝剑锋从磨砺出,梅花香自苦寒来。”当我们坦然接受这人生的终局, 或许,这无所皈依的心灵就有了归宿,这生命中觅寻处那真正的幸福、真正的清香也就从此真正的灿烂了我们的人生。一生有多少属于我们的时光?陌上的花,落了又开了,开 了又落了。无数个岁月就这样在悄无声息的时光里静静的流逝。童年的玩伴,曾经的天真,只能在梦里回味,每回梦醒时分,总是多了很多伤感。不知不觉中,走过了青春年少, 走过了人世间风风雨雨。爱过了,恨过了,哭过了,笑过了,才渐渐明白,酸甜苦辣咸才是人生的真味!生老病死是自然规律。所以,面对生活中经历的一切顺境和逆境都学会 了坦然承受,面对突然而至的灾难多了一份从容和冷静。这世上没有什么不能承受的,只要你有足够的坚强!这世上没有什么不能放下的,只要你有足够的胸襟! 一生有多少 属于我们的时光?当你为今天的落日而感伤流泪的时候,你也将错过了明日的旭日东升;当你为过去的遗憾郁郁寡欢,患得患失的时候,你也将忽略了沿途美丽的风景,淡漠了 对未来美好生活的憧憬。没有十全十美的生活,没有一帆风顺的旅途。波平浪静的人生太乏味,抑郁忧伤的人生少欢乐,风雨过后的彩虹最绚丽,历经磨砺的生命才丰盈而深刻。 见过了各样的人生:有的轻浮,有的踏实;有的喧哗,有的落寞;有的激扬,有的低回。肉体凡胎的我们之所以苦恼或喜悦,大都是缘于生活里的际遇沉浮,走不出个人心里的 藩篱。也许我们能挺得过物质生活的匮乏,却不能抵挡住内心的种种纠结。其实幸福和欢乐大多时候是对人对事对生活的一种态度,一花一世界,一树一菩提,就是一粒小小的 沙子,也有自己精彩的乾坤。如果想到我们终有一天会灰飞烟灭,一切象风一样无影亦无踪,还去争个什么?还去抱怨什么?还要烦恼什么?未曾生我谁是我?生我之时我是谁? 长大成人方是我,合眼朦胧又是谁?一生真的没有多少时光,何必要和生活过不去,和自己过不去呢。你在与不在,太阳每天都会照常升起;你愁与不愁,生活都将要继续。时
弱电解质的电离平衡讲义PPT课件( 20页)
悲心,饶益众生为他人。
•
14、梦想总是跑在我的前面。努力追寻它们,为了那一瞬间的同步,这就是动人的生命奇迹。
•
15、懒惰不会让你一下子跌倒,但会在不知不觉中减少你的收获;勤奋也不会让你一夜成功,但会在不知不觉中积累你的成果。人生需要挑战,更需要坚持和勤奋!
•
16、人生在世:可以缺钱,但不能缺德;可以失言,但不能失信;可以倒下,但不能跪下;可以求名,但不能盗名;可以低落,但不能堕落;可以放松,但不能放纵;可以虚荣,
H3O + + A-
0
0
X
X =α•c
α•ca α• ca
返回1
6
代入Ka式:K
c α c α
a
a
a
c c α
a
a
展
开得: K (c c α c )2α 2
aa
a
a
近似处理,忽略X对ca的影响, ca―ca•α≈ ca
则: Ka ca ca 2 2
对于碱 :
对弱碱:
[OH ]Kb Kb24Kbcb
2
4
条件: c/Kb <500
10
• 例5-1 计算0.10mol/LHAc 溶液的pH值。
•
已 知:Ka=1.8×10-5。
解:由c/ Ka=0.10/(1.8×10-5) >500,近似计
算
[H] caKa
0.11.81 501.3 4 1 30 mL o 1
•
7、生命的美丽,永远展现在她的进取之中;就像大树的美丽,是展现在它负势向上高耸入云的蓬勃生机中;像雄鹰的美丽,是展现在它搏风击雨如苍天之魂的翱翔中;像江
河的美丽,是展现在它波涛汹涌一泻千里的奔流中。
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
弱酸、弱碱、水。 H2CO3、HClO、H2S、HF、CH3COOH NH3·H2O Fe(OH)3等
一、弱电解质的电离平衡
电离
CH3COOH 结合 CH3COO- + H+ v
v电离 v结合
v电离= v结合
电离平衡状态
0
t1
t2
t
1.定义: 在一定条件(如温度、浓度)下, 当电解质分子电离成离子和离子重新结合成分子的速率相 等时,各种微粒的浓度保持不变,电离过程就达到了平衡 状态——电离平衡。 2.特征: 逆、动、等、定、变。
第2节 弱电解质的电离 盐类的水解
第1课时 弱电解质的电离平衡
1.掌握弱电解质的电离平衡及其特征。 2.了解电离平衡常数的表示方法和含义。 3.掌握影响电离平衡的因素。
等体积、等浓度的盐酸、醋酸与镁条(用砂纸打磨)的反应。 观察、比较气球鼓起的快慢等现象。思考等浓度的盐酸、醋 酸溶液中的H+浓度的大小关系。
(1)温度:越热越电离 (2)浓度:加水稀释,越稀越电离 稀释时浓度的变化——主要微粒浓度都减小。
CH3COOH
项目
加水稀释 升高温度 加NaOH 加H2SO4 加醋酸铵固体 加冰醋酸
CH3COO- + H+ Δ H>0
平衡移 动方向 向右 向右 向右 向左 向左 向右
c(H+) H+数目
减小 增大 减小 增大 减小 增大
升温
右
加水稀释
右
加冰醋酸
右
增大 不变 不变
增大 增大 增大
增大 减小 增大
通HCl气体 左
NaOH固体
右
CH3COONa
左
Na2CO3
右
不变 不变 不变 不变
增大 减小 减小 减小
增大 减小 减小 减小
电离 程度 增大 增大 减小 减小 增大 减小 增大
1.电离常数——Ka、Kb的表达式、意义 2.多元弱酸—分步电离 3.影响电离平衡的因素
CH3COOH
CH3COO―+H+。对于该平衡,下列叙述正确
的是( A )
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,反应速率增大,平衡向逆反应方向移动
C.滴加少量0.1 mol·L-1HCl溶液,溶液中c(H+)减少
QC < KC
平衡右移
溶液中各种微粒的浓度都减小吗? c(CH3COOH)、c(H+)、c(CH3COO-) 均减小 , c(OH-)增大
归纳:加水稀释时弱电解质溶液中的主要粒子浓度都减小。
归纳: CH3COOH
CH3COO¯ + H+ Δ H>0
平衡移动的 电离平衡
方向
常数Ka
n(H+) c(H+)
1.0.1mol·L-1的盐酸和0.1mol·L-1的醋酸pH相同吗? 盐酸完全电离,酸性强,pH小。
2.pH=3的盐酸和醋酸,酸的浓度相同吗? pH=3,说明[H+]相等,都等于10-3 mol·L-1,醋酸部 分电离,说明分子更多,醋酸的浓度更大。
如何判断某电解质是弱电解质?
(1)电解质溶液中,电离出的离子与未电离的分子共存。 (2)某一元酸HA,当浓度为0.1 mol·L-1时,溶液的pH=3。 (3)根据物质的类别判断弱电解质。
二、电离平衡常数(K)
1.表示方法 一元弱酸 HA
[H+][A-] H+ +A-, Ka= [HA]
一元弱碱 MOH 2.注意事项:
[M+][OH-] M++OH-, Kb= [MOH]
(1)只有温度变,才有K变。 (2)意义:K值越大,表示弱电解质电离程度越大。
3.多元弱酸在水溶液中的电离
——分步电离,以第一步为主。
参考可逆反应的化学平衡,思考如何定量描述弱电 解质的电离程度。 一般用电离平衡常数 和 电平离衡度转。化率。
写出下列电离的电离平衡常数表达式:
① CH3COOH
H+ + CH3COO¯
Ka=
[H+][CH3COO-] [CH3COOH]
② NH3·H2O
NH4+ + OH-
Kb=
[NH4+][OH- ] [NH3·H2O]
例:H2CO3 HCO3-
H+ + HCO3H+ + CO32-
Ka1 Ka2
Ka1>>Ka2
主要原因:
一级电离出的H+抑制了二级的电离。
25℃时醋酸的Ka=1.7×10-5 mol·L-1,求0.10 mol·L-1 的醋酸溶液中H+的浓度。
【提示】 结合三段式,利用电离常数的表达式计算。
【解析】 设生成的H+ 物质的量浓度为x。
起始 转化
CH3COOH 0.10 mol·L-1
x
H+ + CH3COO -
0
0
x
x
平衡 (0.10-x)mol·L-1 x
x
Ka=
x2 (0.10-x)mol·L-1
≈
0.10
x2 mol·L-1
=1.7×10-5
mol·L-1
x= [0 .1 0 1 .7 1 0 5(m o lL 1 )2] 1 2 =1.3×10-3 mol·L-1
1.内因:电解质本身的性质。 2.外界条件 (1)温度 越热越电离。
电离过程是吸热过程,温度升高向电离方向移动。 (2)浓度 越稀越电离。 浓度越大,电离程度(转化率)越小。 (3)加入其他物质:抑制或促进。
稀醋酸溶液中, 加水稀释平衡如何移动? 【解析】加稀释一倍时,
QC = 1?/2[H+]·1/2[CH3COO-] =1/2 Kc 1/2[CH3COOH]
增多 增多 减少 增多 减少 增大
Ka
不变 增大 不变 不变 不变 不变
1.用蒸馏水稀释1 mol·L-1 醋酸时,溶液中始终保持
增大趋势的是( D )
A.c(CH3COO-) C.c(CH3COOH)
B.c(H+) D.c(OH-)
2.在0.1 mol·L-1的CH3COOH溶液中存在如下电离平衡:
1.已知25℃时,下列酸的电离常数如下,则相同浓度的
下述溶液中[H+]浓度最小的是( B )
(KHF=7.2×10-4 KHNO2=4.6×10-4 A.HF
KHCN=4.9×10-10 KCH3COOH=1.8×10-5)
B.HCN
C.HNO2
D.CH3COOH
归纳:一元酸的电离常数越大,酸性越强。
2.下列电离方程式书写正确的是(
A.H2CO3
2H++CO32-
B.NaHCO3 ==== Na+ +H++CO32-
C.CH3COOH ====CH3COO-+H+
D.BaCO3
Ba2++CO32-
E.HCO3-+H2O
CO32-+H3O+
F.Fe(OH)3
Fe3++3OH-
EF )
三、影响电离平衡的有哪些因素
一、弱电解质的电离平衡
电离
CH3COOH 结合 CH3COO- + H+ v
v电离 v结合
v电离= v结合
电离平衡状态
0
t1
t2
t
1.定义: 在一定条件(如温度、浓度)下, 当电解质分子电离成离子和离子重新结合成分子的速率相 等时,各种微粒的浓度保持不变,电离过程就达到了平衡 状态——电离平衡。 2.特征: 逆、动、等、定、变。
第2节 弱电解质的电离 盐类的水解
第1课时 弱电解质的电离平衡
1.掌握弱电解质的电离平衡及其特征。 2.了解电离平衡常数的表示方法和含义。 3.掌握影响电离平衡的因素。
等体积、等浓度的盐酸、醋酸与镁条(用砂纸打磨)的反应。 观察、比较气球鼓起的快慢等现象。思考等浓度的盐酸、醋 酸溶液中的H+浓度的大小关系。
(1)温度:越热越电离 (2)浓度:加水稀释,越稀越电离 稀释时浓度的变化——主要微粒浓度都减小。
CH3COOH
项目
加水稀释 升高温度 加NaOH 加H2SO4 加醋酸铵固体 加冰醋酸
CH3COO- + H+ Δ H>0
平衡移 动方向 向右 向右 向右 向左 向左 向右
c(H+) H+数目
减小 增大 减小 增大 减小 增大
升温
右
加水稀释
右
加冰醋酸
右
增大 不变 不变
增大 增大 增大
增大 减小 增大
通HCl气体 左
NaOH固体
右
CH3COONa
左
Na2CO3
右
不变 不变 不变 不变
增大 减小 减小 减小
增大 减小 减小 减小
电离 程度 增大 增大 减小 减小 增大 减小 增大
1.电离常数——Ka、Kb的表达式、意义 2.多元弱酸—分步电离 3.影响电离平衡的因素
CH3COOH
CH3COO―+H+。对于该平衡,下列叙述正确
的是( A )
A.加入少量NaOH固体,平衡向正反应方向移动
B.加水,反应速率增大,平衡向逆反应方向移动
C.滴加少量0.1 mol·L-1HCl溶液,溶液中c(H+)减少
QC < KC
平衡右移
溶液中各种微粒的浓度都减小吗? c(CH3COOH)、c(H+)、c(CH3COO-) 均减小 , c(OH-)增大
归纳:加水稀释时弱电解质溶液中的主要粒子浓度都减小。
归纳: CH3COOH
CH3COO¯ + H+ Δ H>0
平衡移动的 电离平衡
方向
常数Ka
n(H+) c(H+)
1.0.1mol·L-1的盐酸和0.1mol·L-1的醋酸pH相同吗? 盐酸完全电离,酸性强,pH小。
2.pH=3的盐酸和醋酸,酸的浓度相同吗? pH=3,说明[H+]相等,都等于10-3 mol·L-1,醋酸部 分电离,说明分子更多,醋酸的浓度更大。
如何判断某电解质是弱电解质?
(1)电解质溶液中,电离出的离子与未电离的分子共存。 (2)某一元酸HA,当浓度为0.1 mol·L-1时,溶液的pH=3。 (3)根据物质的类别判断弱电解质。
二、电离平衡常数(K)
1.表示方法 一元弱酸 HA
[H+][A-] H+ +A-, Ka= [HA]
一元弱碱 MOH 2.注意事项:
[M+][OH-] M++OH-, Kb= [MOH]
(1)只有温度变,才有K变。 (2)意义:K值越大,表示弱电解质电离程度越大。
3.多元弱酸在水溶液中的电离
——分步电离,以第一步为主。
参考可逆反应的化学平衡,思考如何定量描述弱电 解质的电离程度。 一般用电离平衡常数 和 电平离衡度转。化率。
写出下列电离的电离平衡常数表达式:
① CH3COOH
H+ + CH3COO¯
Ka=
[H+][CH3COO-] [CH3COOH]
② NH3·H2O
NH4+ + OH-
Kb=
[NH4+][OH- ] [NH3·H2O]
例:H2CO3 HCO3-
H+ + HCO3H+ + CO32-
Ka1 Ka2
Ka1>>Ka2
主要原因:
一级电离出的H+抑制了二级的电离。
25℃时醋酸的Ka=1.7×10-5 mol·L-1,求0.10 mol·L-1 的醋酸溶液中H+的浓度。
【提示】 结合三段式,利用电离常数的表达式计算。
【解析】 设生成的H+ 物质的量浓度为x。
起始 转化
CH3COOH 0.10 mol·L-1
x
H+ + CH3COO -
0
0
x
x
平衡 (0.10-x)mol·L-1 x
x
Ka=
x2 (0.10-x)mol·L-1
≈
0.10
x2 mol·L-1
=1.7×10-5
mol·L-1
x= [0 .1 0 1 .7 1 0 5(m o lL 1 )2] 1 2 =1.3×10-3 mol·L-1
1.内因:电解质本身的性质。 2.外界条件 (1)温度 越热越电离。
电离过程是吸热过程,温度升高向电离方向移动。 (2)浓度 越稀越电离。 浓度越大,电离程度(转化率)越小。 (3)加入其他物质:抑制或促进。
稀醋酸溶液中, 加水稀释平衡如何移动? 【解析】加稀释一倍时,
QC = 1?/2[H+]·1/2[CH3COO-] =1/2 Kc 1/2[CH3COOH]
增多 增多 减少 增多 减少 增大
Ka
不变 增大 不变 不变 不变 不变
1.用蒸馏水稀释1 mol·L-1 醋酸时,溶液中始终保持
增大趋势的是( D )
A.c(CH3COO-) C.c(CH3COOH)
B.c(H+) D.c(OH-)
2.在0.1 mol·L-1的CH3COOH溶液中存在如下电离平衡:
1.已知25℃时,下列酸的电离常数如下,则相同浓度的
下述溶液中[H+]浓度最小的是( B )
(KHF=7.2×10-4 KHNO2=4.6×10-4 A.HF
KHCN=4.9×10-10 KCH3COOH=1.8×10-5)
B.HCN
C.HNO2
D.CH3COOH
归纳:一元酸的电离常数越大,酸性越强。
2.下列电离方程式书写正确的是(
A.H2CO3
2H++CO32-
B.NaHCO3 ==== Na+ +H++CO32-
C.CH3COOH ====CH3COO-+H+
D.BaCO3
Ba2++CO32-
E.HCO3-+H2O
CO32-+H3O+
F.Fe(OH)3
Fe3++3OH-
EF )
三、影响电离平衡的有哪些因素
