图解blast验证引物教程1
DNA序列比对同源性分析图解BLAST
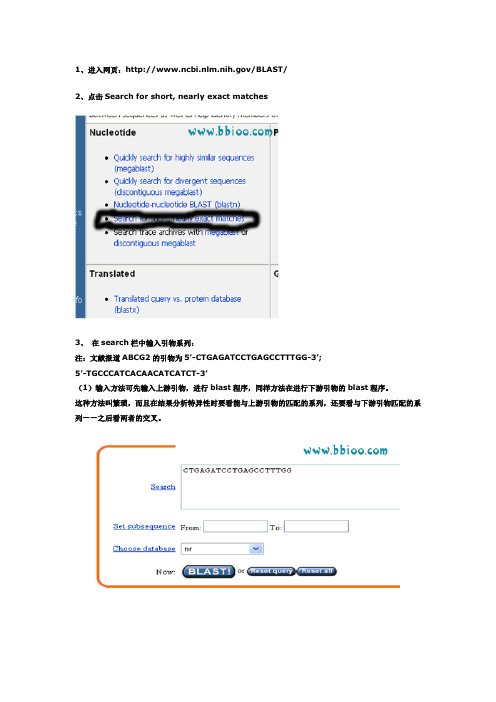
1、进入网页:/BLAST/2、点击Search for short, nearly exact matches3、在search栏中输入引物系列:注:文献报道ABCG2的引物为5’-CTGAGATCCTGAGCCTTTGG-3’;5’-TGCCCATCACAACATCATCT-3’(1)输入方法可先输入上游引物,进行blast程序,同样方法在进行下游引物的blast程序。
这种方法叫繁琐,而且在结果分析特异性时要看能与上游引物的匹配的系列,还要看与下游引物匹配的系列——之后看两者的交叉。
(2)简便的做法是同时输入上下游引物:有以下两种方法。
输入上下游引物系列都从5’——3’。
A、输入上游引物空格输入下游引物B、输入上游引物回车输入下游引物4、在options for advanced blasting中:select from 栏通过菜单选择Homo sapiensExpect后面的数字改为105、在format中:select from 栏通过菜单选择Homo sapiens Expect后面的数字填上0 106、点击网页中最下面的“BLAST!”7、出现新的网页,点击Format!8、等待若干秒之后,出现results of BLAST的网页。
该网页用三种形式来显示blast的结果。
(1)图形格式:图中①代表这些序列与上游引物匹配、并与下游引物互补的得分值都位于40~50分图中②代表这些序列与上游引物匹配的得分值位于40~50分,而与下游引物不互补图中③代表这些序列与下游引物互补的得分值小于40分,而与上游引物不匹配通过点击相应的bar可以得到匹配情况的详细信息。
(2)结果信息概要:从左到右分别为:A、数据库系列的身份证:点击之后可以获得该序列的信息B、系列的简单描述C、高比值片段对(high-scoring segment pairs, HSP)的字符得分。
按照得分的高低由大到小排列。
得分的计算公式=匹配的碱基×2+0.1。
DNA序列比对同源性分析图解BLAST

1、进入网页:/BLAST/2、点击Search for short, nearly exact matches3、在search栏中输入引物系列:注:文献报道ABCG2的引物为5’-CTGAGATCCTGAGCCTTTGG-3’;5’-TGCCCATCACAACATCATCT-3’(1)输入方法可先输入上游引物,进行blast程序,同样方法在进行下游引物的blast程序。
这种方法叫繁琐,而且在结果分析特异性时要看能与上游引物的匹配的系列,还要看与下游引物匹配的系列——之后看两者的交叉。
(2)简便的做法是同时输入上下游引物:有以下两种方法。
输入上下游引物系列都从5’——3’。
A、输入上游引物空格输入下游引物B、输入上游引物回车输入下游引物4、在options for advanced blasting中:select from 栏通过菜单选择Homo sapiensExpect后面的数字改为105、在format中:select from 栏通过菜单选择Homo sapiens Expect后面的数字填上0 106、点击网页中最下面的“BLAST!”7、出现新的网页,点击Format!8、等待若干秒之后,出现results of BLAST的网页。
该网页用三种形式来显示blast的结果。
(1)图形格式:图中①代表这些序列与上游引物匹配、并与下游引物互补的得分值都位于40~50分图中②代表这些序列与上游引物匹配的得分值位于40~50分,而与下游引物不互补图中③代表这些序列与下游引物互补的得分值小于40分,而与上游引物不匹配通过点击相应的bar可以得到匹配情况的详细信息。
(2)结果信息概要:从左到右分别为:A、数据库系列的身份证:点击之后可以获得该序列的信息B、系列的简单描述C、高比值片段对(high-scoring segment pairs, HSP)的字符得分。
按照得分的高低由大到小排列。
得分的计算公式=匹配的碱基×2+0.1。
基于NCBI-primer blast的引物设计及验证

基于NCBI-primer blast的引物
设计及验证
流程
01 02引物的设计(已知模板设计引物)
引物的验证(已知引物查找模板/验证参数)
1-primer blast中引物的设计——模板
可以放序列:
如
也可以放NM号:
如NM_001289746.2
预期引物Tm 值:最适60,无特殊要求无需更改
预期产物大小:如80-150bp
数据库来源:根据模板设置,模板是
cDNA 就选mRNA
跨外显子设置:
RT-qPCR 定量引物为避免gDNA 干扰需设置跨外显子
物种种属设置:根据模板的种属设置
1-primer blast 中引物的设计——生成引物
生成引物:点击生成10对引物,可进行选择
最大扩增子设置:可不做更改,引物设计时前面已设置过产物大小
2-primer blast中已知引物的验证——只需放入引物序列
引物序列:
待验证引物序列放
于此处,注意引物
方向
2-primer blast中已知引物的验证——设置来源和种属
待验证引物来源数据库:
即是基于cDNA(mRNA反转)
的扩增引物,还是基于
gDNA的扩增引物;如定量
则肯定选mRNA
待验证引物来源种属:
即该引物扩增的模板的种属
注:如这两项未知,可先不做选择进行验证;如得不到完全匹配的结果,再进
行更改。
2-primer blast中已知引物的验证——进行验证
验证引物:
点击即可对上述输
入的引物进行验证,
可看到包括Tm值,
扩增子大小等引物
参数。
blast验证引物

程序的选择
点击此按钮, 进入结果页面
等待若干秒之后,出现results of BLAST的网页。 该网页用三种形式来显示blast的结果。
(1)图形格式 通过点击相应的bar 可以得到匹配情况的 详细信息。
(2)结果信息概要:
A B C D E
从左到右分别为: A、数据库系列的身份证:点击之后可以获得该序列的信息 B、系列的简单描述 C、高比值片段对(high-scoring segment pairs, HSP)的字符得分。按照得分 的高低由大到小排列。得分的计算公式=匹配的碱基×2+0.1。举例:如果有20个碱 基匹配,则其得分为40.1。 D、E值:代表被比对的两个序列不相关的可能性。E值最低的最有意义,也就 是说序列的相似性最大。设定的E值是我们限定的上限,E值太高的就不显示了 E、最后一栏有的有UEG的字样,其中: U代表:Unigene数据库 E代表:GEO profiles数据库 G代表:Gene数 据库
blast验证引物
一、概述
BLAST是Basic Local Alignmen类似性检索工具。它采用统计学记分系统,能将真 正配对的序列同随机产生的干扰序列区别开来;同时 采用启发式算法系统,即采用的是局部对准算法 (Local Alignment Algorithm),而不是全序列对准算 法(Global Alignment Algorithm)。
特殊blast
先将待查询的核酸序列和核酸序列数据库中的核酸序列按六种可读框架翻 译成蛋白质序列,然后再将两种翻译结果从蛋白质水平进行查询。
ATGTTGGGGAAATGCTTGACC
引物序 列输入 窗口 数据库的选择 在此,我们选择 第三个数据库 输入方法可先输入上游引物,进行blast程序,同样 方法在进行下游引物的blast程序。在结果分析特异 性时要看能与上游引物的匹配的系列,还要看与下 游引物匹配的系列——之后看两者的交叉。 显示结 果在新 的窗口
如何用Primer-Blast设计和验证引物

如何⽤Primer-Blast设计和验证引物——⽇读⼀帖,解螺旋⼤V团队伴你科研路【科研热点】让你时间⽐别⼈花的少、知道的⽐他早!【基⾦专栏】国⾃然等各项基⾦独到经验见解【SCI 专栏】从开始到接收全程tips【实验技能】这么棒快告诉你⽼板! 关注我们,为您的科研路提速 今天⽼谈给⼤家推荐NCBI的⼀款在线⼯具Primer-BLAST,⽤于PCR的特异性引物设计和特异性检验。
推荐的指数:5颗星。
理由:操作简单,使⽤⽅便,不需要安装程序,⽽且和NCBI数据库已⽐对,不⽤担⼼特异性问题。
理由:⼀、Primer-BLAST介绍 Primer-BLAST可以直接从Blast主页(/)找到,或是直接⽤下⾯的链接进⼊:/tools/primer-blast/,这个⼯具整合了⽬前流⾏的Primer3软件,再加上NCBI的Blast进⾏引物特异性的验证。
Primer-BLAST免除了⽤另⼀个站点或⼯具设计引物的步骤,设计好的引物程序直接⽤Blast进⾏引物特异性验证。
更强⼤的是Primer-BLAST能设计出只扩增某⼀特定剪接变异体基因的引物。
Primer-BLAST有许多改进的功能,⽐单个的⽤Primer3和NCBI BLAST更加准确。
⼆、Primer-BLAST的输⼊ Primer-BLAST界⾯包括了Primer3和BLAST的功能。
提交的界⾯主要包括4部分:PCR Template(模板区), Primer Parameters(引物区), Exon/intron selection(外显⼦内含⼦设置)和specificity check(特异性验证区)。
(1)模板(Template) 在“PCR Template”下⾯的⽂本框,输⼊⽬标模板的序列,FASTA格式或直接⽤Accession Number。
如果你在这⾥输⼊了序列,是⽤于引物的设计。
Primer-BLAST就会根据你输⼊的序列设计特异性引物,并且在⽬标数据库(在specificity check区选择)是唯⼀的。
如何用Primer-Blast设计和验证引物

如何用Primer-Blast设计和验证引物——日读一帖,解螺旋大V团队伴你科研路【科研热点】让你时间比别人花的少、知道的比他早!【基金专栏】国自然等各项基金独到经验见解【SCI 专栏】从开始到接收全程tips【实验技能】这么棒快告诉你老板!关注我们,为您的科研路提速今天老谈给大家推荐NCBI的一款在线工具Primer-BLAST,用于PCR的特异性引物设计和特异性检验。
推荐的指数:5颗星。
理由:操作简单,使用方便,不需要安装程序,而且和NCBI数据库已比对,不用担心特异性问题。
一、Primer-BLAST介绍Primer-BLAST可以直接从Blast主页(/)找到,或是直接用下面的链接进入:/tools/primer-blast/,这个工具整合了目前流行的Primer3软件,再加上NCBI的Blast进行引物特异性的验证。
Primer-BLAST免除了用另一个站点或工具设计引物的步骤,设计好的引物程序直接用Blast进行引物特异性验证。
更强大的是Primer-BLAST能设计出只扩增某一特定剪接变异体基因的引物。
Primer-BLAST有许多改进的功能,比单个的用Primer3和NCBI BLAST更加准确。
二、Primer-BLAST的输入Primer-BLAST界面包括了Primer3和BLAST的功能。
提交的界面主要包括4部分:PCR Template(模板区), Primer Parameters (引物区), Exon/intron selection(外显子内含子设置)和specificity check(特异性验证区)。
(1)模板(Template)在“PCR Template”下面的文本框,输入目标模板的序列,FASTA格式或直接用Accession Number。
如果你在这里输入了序列,是用于引物的设计。
Primer-BLAST就会根据你输入的序列设计特异性引物,并且在目标数据库(在specificity check区选择)是唯一的。
Primer-BLASTNCBI的引物设计和特异性检验工具

Primer-BLAST:NCBI的引物设计和特异性检验工具Primer-Blast介绍Primer-BLAST,在线设计用于聚合酶链反应(PCR)的特异性寡核苷酸引物。
Primer-BLAST可以直接从Blast主页()找到,或是直接用下面的链接进入:这个工具整合了目前流行的Primer3软件,再加上NCBI的Blast进行引物特异性的验证。
Primer-BLAST免除了用另一个站点或工具设计引物的步骤,设计好的引物程序直接用Blast进行引物特异性验证。
并且,Primer-BLAST能设计出只扩增某一特定剪接变异体基因的引物–an important feature for PCR protocols measuring tissue specific expression(注:没办法准确的翻译,只好作罢,汗!)。
Primer-BLAST有许多改进的功能,这样在选择引物方面比单个的用Primer3和NCBI BLAST更加准确。
Primer-BLAST的输入Primer-BLAST界面包括了Primer3和BLAST的功能。
提交的界面主要包括三个部分:target template(模板区), the primers(引物区), 和specificity check(特异性验证区)。
跟其它的BLAST一样,点击底部的“Advanced parameters”有更多的参数设置。
模板(Template)在“PCR Template”下面的文本框,输入目标模板的序列,FASTA格式或直接用Accession Number。
如果你在这里输入了序列,是用于引物的设计。
Primer-BLAST 就会根据你输入的序列设计特异性引物,并且在目标数据库(在specificity check区选择)是唯一的。
引物(Primers)如果你已经设计好了引物,要拿来验证引物的好坏。
可以在Primer Parameters 区填入你的一条或一对引物。
如何运用BLAST进行序列比对、检验引物特异性之欧阳数创编

序列比对,绝大多数战友都会想到BLAST,但BLAST的使用确实又是一个很大的难题,因为他的功能比较强悍,里面涉及到的知识比较多,而且比对结束后输出的结果参数(指标)又很多。
如果把BLAST 的使用详细的都讲出来,我想我发帖发到明天也发不完,更何况我自己也不是完全懂得BLAST的使用。
所以我在这里也就“画龙点睛”——以比对核酸序列为例来给大家介绍一下BLAST的使用,也算是BLAST的入门课程吧。
请看帖的战友好好体会,如果你用心看,在看帖完毕之后BLAST的基本使用(包括其他序列的比对)应该没有问题了。
一、打开BLAST页面,http://www.ncbi.nlm.nih.go/BLAST/ 打开后如图所示:(缩略图,点击图片链接看原图)对上面这个页面进行一下必要的介绍:BLAST的这个页面主体部分(左面)包括了三部分:BLAST Assembled Genomes、Basic BLAST、Specialized BLAST。
相信大家可以看懂这三个短语的意思,我就不多说了;我要说的是,可以认为这是三种序列比对的方法,或者说是BLAST的三条途径。
第一部分BLAST Assembled Genomes就是让你选择你要比对的物种,点击相应物种之后即可进入比对页面。
第二部分Basic BLAST包含了5个常用的BLAST,每一个都附有简短的介绍。
第三部分Specialized BLAST是一些特殊目的的BLAST,如IgBLAST、SNP等等,这个时候你就需要在Specialized BLAST部分做出适当的选择了。
总之,这是一个导航页面,它的目的是让你根据自己的比对目的选择相应的BLAST途径。
下面以最基本的核酸序列比对来谈一下BLAST 的使用,期间我也会含沙射影的说一下其他序列比对的方法。
二、点击Basic BLAST部分的nucleotide blast链接到一个新的页面。
打开后如图所示:screen.width-333)this.width=screen.width-333" width=640 height=462title="Click to iew full2.JPG (849 X 613)" border=0 align=absmiddle> 介绍一下上述页面:Enter Query Sequence部分是让我们输入序列的,你可以直接把序列粘贴进去,也可以上传序列,还可以选择你要比对的序列的范围(留空就代表要比对你要输入的整个序列)。
如何利用BLAST分析验证引物序列

如何利用BLAST分析验证引物序列引物设计完成之后,需要用软件进行分析,找到最佳的引物对,采用Blast分析验证引物,可以知道序列的正确性,也能知道引物的特异性状况、引物的具体位置以及PCR产物的大小。
先找到需要设计引物的目标基因的在有引物序列的mRNA序列,可以通过全文(如最先发现该基因的文章),全文中有时可以找到大鼠c-jun mRNA序列的ACCESSION NUMBER,在PubMed中的“Nucleotide”中用此ACCESSION NUMBER就能找到序列。
可以利用这个ACCESSION NUMBER在PubMed中的“Nucleotide”中搜索到序列后,点击右边的“Links”,再点击里面的“Related Sequences”就能找到所有的大鼠c-jun mRNA序列及其他物种的一些c-jun mRNA序列。
文献中的引物最好先验证其序列正确,并用软件分析引物比较好后再采用。
通过BLAST 验证,既可知道序列是否正确,也可同时了解引物的特异性、引物的位置及PCR产物的大小等。
如果仅仅是为了验证引物序列是否正确(仅适合于基于完全匹配原则设计的引物),也可以用Blast的“Nucleotide-nucleotide BLAST (blastn )”或“Search for short, nearly exact matches”搜索,具体方法为:1. 打开Blast,点击“Nucleotide-nucleotide BLAST (blastn)”或“Search for short, nearly exact matches”2. 等新页面完全显示后,将引物序列直接copy到“Search”框(没有必要将下游引物序列转换成其互补链),下面3种方法都可以(我觉得3种方法的搜索结果没什么区别,没仔细比较过哦!)(1)直接拷贝上游引物序列,然后直接将下游引物序列拷贝在上游引物后面(2)直接拷贝上游引物序列,在上游引物序列后加一空格,然后直接将下游引物序列拷贝在空格后面(3)直接拷贝上游引物序列,换行,然后直接拷贝下游引物序列注意:记住上、下游引物的长度,如上游引物为19bp、下游引物为18bp,这在查看Blast结果时有用。
blast验证引物分析

(3)结果详细信息
序列的信息
上游引物与该序列的正链【Plus/Plus】的 匹配情况: 共有21个碱基匹配,得分42.1分【21×2+ 0.1=42.1】,E值为0.014 上游引物与序列的1~21位点匹配
结果判断: ①验证文献报道的引物是否正确:如果你可以在所显示 的结果中找出你的目的基因,一般说明你的引物正确性 没问题。如果你blast后没有发现你的目的基因,或者分 值很低,该引物就可能不适合用 ②检测该对引物是否可与其它序列匹配,引起PCR的非 特异性扩增。如果找到了你的目的基因名称,而且找到 了一大批同物种的不同基因,(上下游引物分别搜索到 相同的基因),而且分数也较高。这时表明你的引物设 计的特异性不高,极有可能在你的扩增产物中出现非特 异性产物。
1. 进入网页: /blast/Blast.cgi
Blast的页面
常见生物基因组的blast
核酸序列数据库查询;
蛋白质序列数据库 先将待查询的核酸序列按六种可读框架翻译成蛋白质序列,然后将翻译结果 对蛋白质序列数据库进行查询; 先将核酸序列数据库中的核酸序列按六种可读框架翻译成蛋白质序列, 然后将待查询的蛋白质序列及其互补序列对其翻译结果进行查询;
程序的选择
点击此按钮, 进入结果页面
等待若干秒之后,出现results of BLAST的网页。 该网页用三种形式来显示blast的结果。
(1)图形格式 通过点击相应的bar 可以得到匹配情况的 详细信息。
(2)结果信息概要:
A B C D E
从左到右分别为: A、数据库系列的身份证:点击之后可以获得该序列的信息 B、系列的简单描述 C、高比值片段对(high-scoring segment pairs, HSP)的字符得分。按照得分 的高低由大到小排列。得分的计算公式=匹配的碱基×2+0.1。举例:如果有20个碱 基匹配,则其得分为40.1。 D、E值:代表被比对的两个序列不相关的可能性。E值最低的最有意义,也就 是说序列的相似性最大。设定的E值是我们限定的上限,E值太高的就不显示了 E、最后一栏有的有UEG的字样,其中: U代表:Unigene数据库 E代表:GEO profiles数据库 G代表:Gene数 据库
图解blast验证引物教程1

图解blast 验证引物教程——以文献报道的人类的ABCG2的引物为例1、 进入网页:/BLAST/2、 点击Basic BLAST 中的nucleotide blast 选项3、 完成2操作后就进入了Basic Local Alignment Search Tool 界面 (1)在Enter Query Sequence 栏中输入引物序列:注:文献报道ABCG2的引物为5’-CTGAGATCCTGAGCCTTTGG-3’;5’-TGCCCATCACAACATCATCT-3’简便的做法是同时输入上下游引物。
输入上下游引物系列都从5’— 3’。
输入上游引物后,加上≥20个字母n ,再输入下游引物,如下图:生 物 秀(2)在Choose Search Set 栏中:Database 根据预操作基因的种属定了,本引物可选Human genomic + transcript或Others (nr etc.)。
本人倾向于选后者,觉得此库信息更多。
如下图:(3)在Program Selection 中:选择Somewhat similar sequences (blastn)项,如下图:(4)在此界面最下面:如下图生物秀-专心做生物w w w .b b i o o .c o mShow results in a new window 项是显示界面的形式,可选可不选,在此我们选上了。
关键要点击Algorithm parameters 参数设置,进入参数设置界面。
4. 参数设置:(1)在General Parameters 中:Expect thresshold 期望阈值须改为1000,大于1000也可以;在Word size 的下拉框将数字改为7。
如下图:(2)Scoring Parameters 无须修改(3)Filters and Masking 中,一般来说也没有必要改5.点击最下面一栏的BLAST 按钮,如图:6.点击BLAST 按钮后,跳转出现如下界面:7. 等待若干秒之后,自动跳转出现显示BLAST 结果的网页。
NCBI在线Blast的图文说明

NCBI在线Blast的图文说明Blast(Basic Local Alignment Search Tool)是一套在蛋白质数据库或DNA数据库中进行相似性比较的分析工具。
BLAST程序能迅速与公开数据库进行相似性序列比较。
BLAST 结果中的得分是对一种对相似性的统计说明。
BLAST 采用一种局部的算法获得两个序列中具有相似性的序列。
Blast中常用的程序介绍:1、BLASTP 是蛋白序列到蛋白库中的一种查询。
库中存在的每条已知序列将逐一地同每条所查序列作一对一的序列比对。
2、BLASTX是核酸序列到蛋白库中的一种查询。
先将核酸序列翻译成蛋白序列(一条核酸序列会被翻译成可能的六条蛋白),再对每一条作一对一的蛋白序列比对。
3、BLASTN 是核酸序列到核酸库中的一种查询。
库中存在的每条已知序列都将同所查序列作一对一地核酸序列比对。
4、TBLASTN是蛋白序列到核酸库中的一种查询。
与BLASTX相反,它是将库中的核酸序列翻译成蛋白序列,再同所查序列作蛋白与蛋白的比对。
5、TBLASTX是核酸序列到核酸库中的一种查询。
此种查询将库中的核酸序列和所查的核酸序列都翻译成蛋白(每条核酸序列会产生6条可能的蛋白序列),这样每次比对会产生36种比对阵列。
NCBI的在线blast:/Blast.cgi1、进入在线blast界面,可以选择blast特定的物种(如人,小鼠,水稻等),也可以选择blast所有的核酸或蛋白序列。
不同的blast程序上面已经有了介绍。
这里以常用的核酸库作为例子。
NCBI在线blast页面2、粘贴fasta格式的序列。
选择一个要比对的数据库。
关于数据库的说明请看NCBI在线blast数据库的简要说明。
一般的话参数默认。
NCBI在线blast页面3、blast参数的设置。
注意显示的最大的结果数跟E值,E值是比较重要的。
筛选的标准。
最后会说明一下。
blast参数设置4、注意一下你输入的序列长度。
使用 NCBI 查找DNA引物设计BLAST序列比对

最近看到很多战友在论坛上询问如何查询基因序列、如何进行引物设计、如何使用BLAST 进行序列比对……,这些问题在 NCBI 上都可以方便的找到答案。
现在我就结合我自己使用 NCBI的一些经历(经验)跟大家交流一下 BCBI 的使用。
希望大家都能发表自己的使用心得,让我们共同进步!我分以下几个部分说一下 NCBI 的使用:Part one 如何查找基因序列、mRNA、PromoterPart two 如何查找连续的 mRNA、cDNA、蛋白序列Part three 运用 STS 查找已经公布的引物序列Part four 如何运用 BLAST 进行序列比对、检验引物特异性特别感谢本版版主,将这个帖子置顶!从发帖到现在,很多战友对该帖给与了积极的关注,在此向给我投票的(以及想给我投票却暂时不能投票的)各位战友表示真诚的感谢,谢谢各位战友!请大家对以下我发表的内容提出自己的意见。
关于NCBI 其他方面的使用也请水平较高的战友给予补充First of all,还是让我们从查找基因序列开始。
第一部分利用Map viewer 查找基因序列、mRNA 序列、启动子(Promoter)下面以人的 IL6(白细胞介素 6)为例讲述一下具体的操作步骤1.打开Map viewer 页面,网址为:/mapview/index.html 在 search 的下拉菜单里选择物种,for 后面填写你的目的基因。
操作完毕如图所示:2.点击“GO”出现如下页面:3.在步骤二图示的右下角有一个Quick Filter,下面是让你选择的几个复选框,在Gene 前面的小方框里打勾,然后点击Filter. 出现下图:说明一下:1、染色体的红色区域即为你的目的基因所处位置。
2、下面参考序列给出了三个,是不同的部门做出来的,经我验证,序列有微小的差异,但总体来说基本相同。
尽管你分别点击后,序列代码、序列代码等有所差异,但碱基基本一致,不影响大家研究分析序列。
NCBI在线Blast的图文说明

NCBI在线Blast的图文说明Blast(Basic Local Alignment Search Tool)是一套在蛋白质数据库或DNA数据库中进行相似性比较的分析工具。
BLAST程序能迅速与公开数据库进行相似性序列比较。
BLAST 结果中的得分是对一种对相似性的统计说明。
BLAST 采用一种局部的算法获得两个序列中具有相似性的序列。
Blast中常用的程序介绍:1、BLASTP 是蛋白序列到蛋白库中的一种查询。
库中存在的每条已知序列将逐一地同每条所查序列作一对一的序列比对。
2、BLASTX是核酸序列到蛋白库中的一种查询。
先将核酸序列翻译成蛋白序列(一条核酸序列会被翻译成可能的六条蛋白),再对每一条作一对一的蛋白序列比对。
3、BLASTN 是核酸序列到核酸库中的一种查询。
库中存在的每条已知序列都将同所查序列作一对一地核酸序列比对。
4、TBLASTN是蛋白序列到核酸库中的一种查询。
与BLASTX相反,它是将库中的核酸序列翻译成蛋白序列,再同所查序列作蛋白与蛋白的比对。
5、TBLASTX是核酸序列到核酸库中的一种查询。
此种查询将库中的核酸序列和所查的核酸序列都翻译成蛋白(每条核酸序列会产生6条可能的蛋白序列),这样每次比对会产生36种比对阵列。
NCBI的在线blast:/Blast.cgi1、进入在线blast界面,可以选择blast特定的物种(如人,小鼠,水稻等),也可以选择blast所有的核酸或蛋白序列。
不同的blast程序上面已经有了介绍。
这里以常用的核酸库作为例子。
NCBI在线blast页面2、粘贴fasta格式的序列。
选择一个要比对的数据库。
关于数据库的说明请看NCBI在线blast数据库的简要说明。
一般的话参数默认。
NCBI在线blast页面3、blast参数的设置。
注意显示的最大的结果数跟E值,E值是比较重要的。
筛选的标准。
最后会说明一下。
blast参数设置4、注意一下你输入的序列长度。
如何运用BLAST进行序列比对、检验引物特异性之欧阳语创编

序列比对,绝大多数战友都会想到BLAST,但BLAST的使用确实又是一个很大的难题,因为他的功能比较强悍,里面涉及到的知识比较多,而且比对结束后输出的结果参数(指标)又很多。
如果把BLAST 的使用详细的都讲出来,我想我发帖发到明天也发不完,更何况我自己也不是完全懂得BLAST的使用。
所以我在这里也就“画龙点睛”——以比对核酸序列为例来给大家介绍一下BLAST的使用,也算是BLAST的入门课程吧。
请看帖的战友好好体会,如果你用心看,在看帖完毕之后BLAST的基本使用(包括其他序列的比对)应该没有问题了。
一、打开BLAST 页面,http://www.ncbi.nlm.nih.go/BLA ST/ 打开后如图所示:(缩略图,点击图片链接看原图)对上面这个页面进行一下必要的介绍:BLAST的这个页面主体部分(左面)包括了三部分:BLAST Assembled Genomes、BasicBLAST、Specialized BLAST。
相信大家可以看懂这三个短语的意思,我就不多说了;我要说的是,可以认为这是三种序列比对的方法,或者说是BLAST的三条途径。
第一部分BLAST Assembled Genomes就是让你选择你要比对的物种,点击相应物种之后即可进入比对页面。
第二部分Basic BLAST包含了5个常用的BLAST,每一个都附有简短的介绍。
第三部分Specialized BLAST是一些特殊目的的BLAST,如IgBLAST、SNP等等,这个时候你就需要在Specialized BLAST部分做出适当的选择了。
总之,这是一个导航页面,它的目的是让你根据自己的比对目的选择相应的BLAST途径。
下面以最基本的核酸序列比对来谈一下BLAST 的使用,期间我也会含沙射影的说一下其他序列比对的方法。
二、点击Basic BLAST部分的nucleotide blast链接到一个新的页面。
打开后如图所示:screen.width-333)this.width=screen.width-333" width=640 height=462 title="Click to iew full 2.JPG (849 X 613)" border=0align=absmiddle> 介绍一下上述页面:Enter Query Sequence部分是让我们输入序列的,你可以直接把序列粘贴进去,也可以上传序列,还可以选择你要比对的序列的范围(留空就代表要比对你要输入的整个序列)。
Primer-BLAST验证设计引物序列是否合适详细步骤

Primer-BLAST验证设计引物序列是否合适详细步骤1.检验引物的特异性这个⼯具整合了⽬前流⾏的Primer3软件,再加上NCBI的Blast进⾏引物特异性的验证。
Primer-BLAST免除了⽤另⼀个站点或⼯具设计引物的步骤,设计好的引物程序直接⽤Blast进⾏引物特异性验证。
并且,Primer-BLAST还能设计出只扩增某⼀特定剪接变异体基因的引物,⽤于检测在组织中的特异性表达。
Primer-BLAST有许多改进的功能,这样在选择引物⽅⾯⽐单个的⽤Primer3和NCBI BLAST更加准确。
Primer-BLAST的输⼊Primer-BLAST界⾯包括了Primer3和BLAST的功能。
提交的界⾯主要包括三个部分:targettemplate(模板区), the primers(引物区), 和specificity check(特异性验证区)。
跟其它的BLAST⼀样,点击底部的“Advanced parameters”有更多的参数设置。
模板(Template)填写图⽚摘要(选填)在“PCR Template”下⾯的⽂本框,输⼊⽬标模板的序列,FASTA格式或直接⽤Accession Number。
如果你在这⾥输⼊了序列,是⽤于引物的设计。
Primer-BLAST就会根据你输⼊的序列设计特异性引物,并且在⽬标数据库(在specificity check区选择)是唯⼀的。
引物(Primers)如果你已经设计好了引物,要拿来验证引物的好坏。
可以在Primer Parameters区填⼊你的⼀条或⼀对引物。
并且选择好验证的⽬标数据库(在specificity check区选择)。
根据需要可设置产物的⼤⼩,Tm值等。
特异性(Specificity)在specificity check区,选择设计引物或验证引物时的⽬标数据库和物种。
这⼀步是⽐较重要的。
这⾥提供了4种数据库:RefSeq mRNA, Genome (selected referenceassemblies),Genome (all chromosomes),and nr (the standard non-redundant database)。
realtimePCR引物设计的blast使用
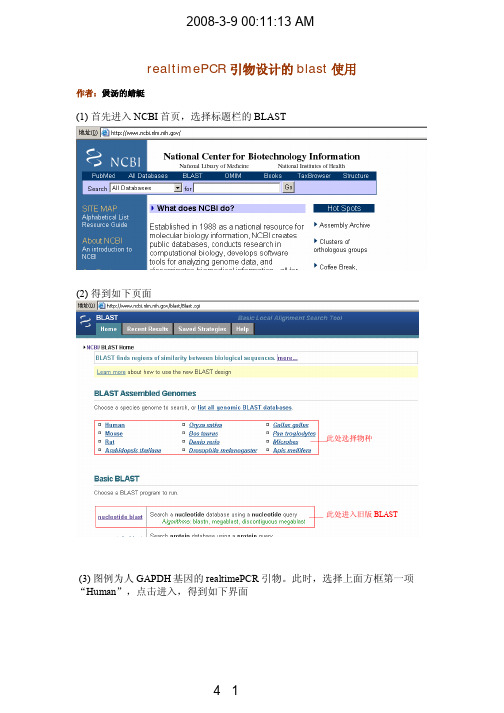
realtimePCR 引物设计的blast 使用作者:煲汤的蜻蜓(1) 首先进入NCBI 首页,选择标题栏的BLAST(2) 得到如下页面(3) 图例为人GAPDH 基因的realtimePCR 引物。
此时,选择上面方框第一项“Human ”,点击进入,得到如下界面此处选择物种此处进入旧版BLAST此处填写引物序此处请选择RefRNA此处需按照图例选择点击此处进入下一步(4) Begin Search后得到如下所示界面,此处不比更改参数,直接点击View report该页面的参数决定结果如何显示,对分析结果没有影响。
(5) 最终,得到同源性分析的结果图上半部分总体概括分析结果,下半部分分别列举结果。
一般来说,不会全部序列都显示,显示多少则根据个人设置的不同而不同。
此时点击NCBI登录号,则能获得该对应序列的详细信息。
几点声明:1关于步骤(3)中 program的选择我在megaBLAST和BLASTN两个选项上疑惑了一下,经过尝试,才了解二者的不同。
Blastn 是比较核酸序列之间的同源性的,能找到目的序列的同源序列,并对同源性打分;而megaBLAST则是用来鉴定目的序列是不是已经被数据库收录的序列,或者是否为新序列。
其实,二者目的截然不同,但对于半路出家的我来说,还真是小小的为难了一下。
请大家不要见笑。
下面把program的其他选择简单的介绍一下(略微有点跑题):Blastp:直接比对蛋白序列的同源性。
Blastx:核酸翻译成蛋白后与蛋白序列比对Tblastn:将库中的核酸翻译成蛋白,比对蛋白序列2 mRNA序列比对得到的HSP和E value,以及U E G分别表示什么,已经有高人在置顶的分享帖中介绍了,我也是从ta那里学来的,涉及到原作者的知识产权问题,我不剽窃了,请大家去那里学习。
3 本人医学检验专业毕业,涉此领域不深,只是写了我在实际工作中的应用方法,理论性不强,并且肯定有需要纠正的地方,请大家不吝指教,小女子万分感激。
图解NCBIBlast

图解NCBIBlast
生物信息的入门史诗级工具NCBI是我们日常接触最多的生物信息综合数据库,基础而不简单,关于它的使用可真是让笔者又爱又恨。
爱其功能强大,恨其复杂。
关于NCBI,笔者也写过其他的短文介绍其使用。
感兴趣的伙伴们自取了不起的NCBI Blast
从NCBI下载基因组数据的N种方式比较
今天又有小伙伴咨询NCBI Blast的使用方法。
借之前的一个ppt 内容,多图详细梳理NCBI blast在线工具的使用方法,希望对大家的工作用所帮助~
(注:以上部分截图内容来自于网络)
微信号:
Mypathogen
微微悦明
科学的乐趣是获得新知识的喜悦
高通量测序、大数据
病原微生物检测和监测
健康大数据行业资讯记录与分享
每一天获得一点微小的收获和进步。
小确幸的科研也很好。
与君共勉!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
图解blast 验证引物教程
——以文献报道的人类的ABCG2的引物为例
1、 进入网页:/BLAST/
2、 点击Basic BLAST 中的nucleotide blast 选项
3、 完成2操作后就进入了Basic Local Alignment Search Tool 界面 (1)在Enter Query Sequence 栏中输入引物序列:
注:文献报道ABCG2的引物为5’-CTGAGATCCTGAGCCTTTGG-3’;
5’-TGCCCATCACAACATCATCT-3’
简便的做法是同时输入上下游引物。
输入上下游引物系列都从5’— 3’。
输入上游引物后,加上≥20个字母n ,再输入下游引物,如下图:
生 物 秀
(2)在Choose Search Set 栏中:
Database 根据预操作基因的种属定了,本引物可选Human genomic + transcript
或Others (nr etc.)。
本人倾向于选后者,觉得此库信息更多。
如下图:
(3)在Program Selection 中:选择Somewhat similar sequences (blastn)项,如下图:
(4)在此界面最下面:如下图
生物秀-专心做生物
w w w .b b i o o .c o m
Show results in a new window 项是显示界面的形式,可选可不选,在此我们选上了。
关键要点击Algorithm parameters 参数设置,进入参数设置界面。
4. 参数设置:
(1)在General Parameters 中:Expect thresshold 期望阈值须改为1000,大于1000也可以;在Word size 的下拉框将数字改为7。
如下图:
(2)Scoring Parameters 无须修改
(3)Filters and Masking 中,一般来说也没有必要改
5.点击最下面一栏的BLAST 按钮,如图:
6.点击BLAST 按钮后,跳转出现如下界面:
7. 等待若干秒之后,自动跳转出现显示BLAST 结果的网页。
该网页用三种形式来显示blast 的结果。
生物秀-专心做生物
w w w .b b i o o .c o m
(1)图形格式:
图中①代表这些序列与引物匹配的得分值小于40分
图中②代表这些序列与引物匹配的得分值位于40~50分
图中③代表这些序列与引物匹配的得分值位于80~120分,
分值越高,特异性越好。
线段代表上或下游引物,其颜色和上面对照后就可得出该条引物的分值。
图中两线段间有连线的代表这些序列与上游引物匹配(Strand=Plus/Plus)、并与下游引物互补(Strand=Plus/Minus),理论上可以扩增出基因片断。
没有连线的,表示单条引物与该基因一致。
点击线段,就能跳转到该基因的结果信息概要。
(2)结果信息概要:
Accession 、数据库系列的身份证:点击之后可以获得该序列的信息 Desscription 、系列的简单描述
Total score 高的就是有两线段间有连线的,如图划线的。
E value :代表被比对的两个序列不相关的可能性。
【The E value decreases exponentially as the Score (S) that is assigned to a match between two sequences increases 】。
E 值最低的最有意义,也就是说序列的相似性最大。
设定的E 值是我们限定的上限,E 值太高的就不显示了
E 、最后一栏有的有UEG 的字样,其中: U 代表:Unigene 数据库
E 代表:GEO profiles 数据库 G 代表:Gene 数据库
(3)结果详细信息:
生物秀-专心做生物
w w w .b b i o o .c o m
划线上代表上游引物与该序列的正链【Plus/Plus 】的匹配情况: 划线下代表下游引物与该序列的负链【Plus/Minus 】的匹配情况: 共有20个碱基匹配,得分40.1分【20×2+0.1=40.1】,E 值为0.077。
为什么与上下游引物匹配的ABCG2序列有多种? A 、 为同一个基因来源的不同的mRNA 片段 B 、 为该基因的DNA 系列 C 、 为同一个基因来源的不同的cDNA 克隆片段。
结果判断:
①验证文献报道的引物是否正确:如果你可以在所显示的结果中找出你的目的基因,一般说明你的引物正确性没问题。
如果你blast 后没有发现你的目的基因,或者分值很低,该引物就可能不适合用
②检测该对引物是否可与其它序列匹配,引起PCR 的非特异性扩增。
如果找到了你的目的基因名称,而且找到了一大批同物种的不同基因,(上下游引物分别搜索到相同的基因),而且分数也较高。
这时表明你的引物设计的特异性不高,极有可能在你的扩增产物中出现非特异性产物。
生物秀-专心做生物
w w w .b b i o o .c o m
生物秀-专心做生物
生物秀论坛—学术交流、资源共享与互助社区
http://
生物部落—生物医药人网络家园
http://
生物百科—生命科学第一百科
http://
生物秀知道—生命科学问题解决之道!
http://
易生物-领先的生物医药商务平台。
