有机化学方程式的书写
必修二 有机化学 方程式总结

乙烯与HX:C2H4+HX催CH3CH2X
乙烯与H2O:C2H4+H2O催CH3CH2OH
乙烯的加聚:nC2H4催[CH2-CH2]n
苯的燃烧: +15O2点12CO2+6H2O
苯的溴代:+Br2Br
苯的硝化:+HNO3浓硫酸50-60℃NO2+H2O
苯的磺化:+H2SO4(浓)70-80℃SO3H +H2O
乙醇与HX:C2H5OH+HX C2H5OX+H2O
乙酸与钠:2CH3COOH+Na 2CH3COONa+H2O
乙酸与NaOH:CH3COOH+NaOH CH3COONa+H2O
乙酸Na2CO3:CH3COOH+Na2CO3CH3COONa+H2O+CO2
乙醇与乙酸:CH3COOH+C2ห้องสมุดไป่ตู้5OH浓硫酸△CH3COOC2H5+H2O
必修二
甲烷和Cl2:CH4+Cl2CH3Cl+HCl
CH3Cl+Cl2CH2Cl2+HCl
CH2Cl2+Cl2CHCl3+HCl
CHCl3+Cl2CCl4+HCl
甲烷燃烧:CH4+2O2点CO2+2H2O
甲烷分解:CH41000℃C+2H2
乙烯燃烧:C2H4+3O2点2CO2+2H2O
乙烯与Br2:C2H4+Br2C2H4Br2
苯与H2:+3H2Ni△
乙醇和钠:2C2H5OH+2Na 2CH3COONa+H2
有机化学方程式书写
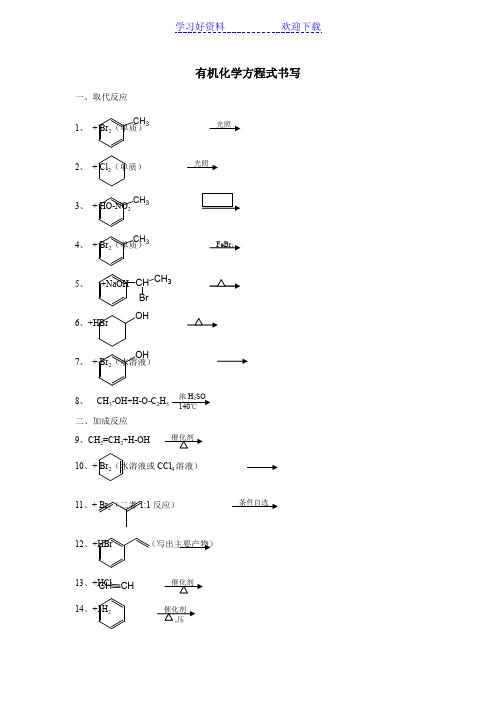
有机化学方程式书写一、取代反应1、+ Br 2(单质)2、 + Cl 2(单质)3、 + HO-NO 24、 + Br 2(单质)5、 +NaOH6、+HBr7、 + Br 2(水溶液)8、 CH 3-OH+H-O-C 2H 二、加成反应9、CH 2=CH 2+H-OH10、+ Br 2(水溶液或CCl 4溶液)11、+ Br 2(二者1:1反应)12、+HBr (写出主要产物)13、+HCl14、+3H 2OH OH CH CHCHBrCH 3CH 3CH 3CH 315、 +H 2(足量)16、+ CH 2=CH 217、+H 2(足量)小结:(1)能与H 2发生加成反应官能团有:(2)能与Br 2发生加成反应的官能团有:三、消去反应18、+NaOH19、+2NaOH20、CH2Br-CH 221、小结:消去反应能发生,在结构上的关键是:四、氧化反应22、+O 223、+O 224、CH 3OH+O 225、+O2小结:醇催化氧化反应能发生,在结构上的关键是:CHOO Br Cl Cl OH H 2C CH H 2C OHCH 2H 3CH 3C H 3COHH 3C H 3H 3C26、27、 + Ag(NH 3)2OH28、+ Cu(OH)2 + NaOH五、酯化反应29、+H-O-C 2H 5 30、 (1mol ) 31、2 六元环状化合物32、 +3 HO-NO 2六、水解反应33、CH 2Br-CH 234、+H 2O35、+ NaOH 36、+ NaOH37、+ NaOHCH CHO CHO CHO H 3C C O18OHC C H 2OH O O H H 3C CH H 2C HC H 2C O O H 3C OOC 2H 5CC H 2OOH 2C O C O38、 + 3 NaOH39、n40、n41、n CH 2=CH 2-CN + n +n42、n43、n HO-CH2-CH2-OH+n HOOC-COOH 44、n 45、n + n HCHO小结:加聚与缩聚反应在生成物上的差别是:八、几个特殊反应46、+Cu(OH)247、+Cu(OH)2 48、6C 6H 5OH+Fe 3+49、C 20H 42CH H 3C CH OHOH H 2C OH H 2C OH H 2C OH HC OHH 2C OH O C H 2CH C H 2C O C 17H 35O C O C 17H 35O C OC 17H 35九、有机物衍变的一般规律(通常以卤代烃为桥烃 卤代烃 醇醛酸CH 3-CH 3CH 3-CH CH 3CH CH 3CHO CH 3COOH 酯CH 2=CH酯22CH 2Cl CH 3CH 2OH COOHCH 3Br CH 3Br CH 3OH CH 3O。
有机化学方程式书写规则

有机化学方程式书写规则摘要:1.有机化学方程式的基本概念2.有机化学方程式的书写原则3.有机化学方程式的种类4.有机化学方程式的配平技巧5.有机化学方程式的注释与简化正文:有机化学方程式是描述有机化合物在化学反应中生成、消耗或转化的公式。
它是有机化学研究的基础,对于学习和研究有机化学具有重要意义。
一、有机化学方程式的基本概念有机化学方程式由反应物、生成物、反应条件和状态符号等组成。
反应物是指参加反应的有机化合物,生成物是指反应后生成的有机化合物,反应条件是指反应所需的温度、压力、溶剂等,状态符号是指反应物和生成物的物态(如固态、液态、气态等)。
二、有机化学方程式的书写原则1.反应物和生成物的化学式要正确。
2.反应条件要明确,如温度、压力、溶剂等。
3.状态符号要标注清楚,如固态、液态、气态等。
4.反应物和生成物的系数要合理,使反应方程式满足质量守恒定律和电荷守恒定律。
三、有机化学方程式的种类有机化学方程式主要分为两类:一类是合成反应方程式,用于表示有机化合物的合成过程;另一类是分解反应方程式,用于表示有机化合物的分解过程。
四、有机化学方程式的配平技巧1.观察法:根据反应物和生成物的原子数量,观察并调整系数,使反应方程式满足质量守恒定律和电荷守恒定律。
2.试错法:通过尝试不同的系数,逐步调整至满足质量守恒定律和电荷守恒定律。
3.代数法:利用代数方法解方程组,求得反应物和生成物的系数。
五、有机化学方程式的注释与简化1.注释:在方程式中添加注释,说明反应物和生成物的性质、结构等。
2.简化:将复杂的有机化学方程式进行简化,如使用简称、缩写等,以便于学习和理解。
总之,掌握有机化学方程式的书写规则,有助于更好地理解和研究有机化学。
有机化学基础化学方程式

有机反应方程式一烷烃1.甲烷燃烧: 2·P34CH4 +2O2CO2 + 2H2O2.甲烷与氯气在光照条件下反应2·P56CH4 + 3Cl2CHCl3+ 3HClCH4 + 4Cl2CCl4 + 4HCl CH4 + 2Cl2CH2Cl2 + 2HCl3.甲烷在一定条件下可被氧化成一氧化碳和氢气2·P562CH4+O22CO+4H24.甲烷高温分解2·P56 CH4 C + 2H2二烯烃1.乙烯与溴的四氯化碳溶液反应2·P60 CH2=CH2 + Br2 CH2BrCH2Br3.乙烯与水反应2·P60 CH2=CH2 + H2O CH3CH2OH4.乙烯的催化氧化制乙醛2·P77 2CH2=CH2 + O22CH3CHO5.乙烯的催化氧化制乙酸2·P77 CH2=CH2 + O22CH3COOH6.乙烯的催化加氢2·P64 CH2=CH2 +H2CH3CH38.乙烯的加聚反应2·P78 n CH2=CH29.乙烯与氯气在一定条件下生成氯乙烯3·P46 CH2=CH2 + Cl2CH2=CHCl+HCl10.乙烯与氯气加成3·P46 CH2=CH2 + Cl2 CH2ClCH2Cl12. 1—丁烯与氢气催化加成3·P47 CH2=CH2CH2CH3 +H2CH3CH2CH2CH313.环己烯催化加氢3·P49H2 +14. 1,3环己二烯催化加氢3·P492H2 +16. 1,3-丁二烯与溴在温度较低和较高时的反应3·P42CH2=CH—CH=CH2+Br2 CH2BrCH=CHCH2BrCH2=CH—CH=CH2+Br2CH2BrCHBrCH=CH2 17. 1,1—二氯乙烯加聚3·P47n CCl2=CH218.丙烯加聚3·P47n H2C=CHCH319. 2—甲基—1,3—丁二烯加聚3·P47n三炔烃1.乙炔燃烧2·P37 2C2H2 + 5O24CO2 + 2H2O2.乙炔与足量溴的四氯化碳溶液反应2·P60 CH≡CH + Br2 CHBr2CHBr23.乙炔与氢气催化加成3·P47 CH≡CH + 2H2 CH3CH34.乙炔制聚氯乙烯2·P60CH≡CH +HCl H2C=CHCl n H2C=CHCl四芳香烃1.苯的燃烧2·P62 2C6H6+15O212CO2 + 6H2O2.苯的催化加氢3·P49 + 3H23.苯与液溴催化反应3·P51 + Br2+ HBr4.苯的硝化反应3·P51 +HO-NO2+ H2O9.苯乙烯与溴的四氯化碳溶液反应3·P56+Br210.甲苯与浓硝酸、浓硫酸的混合酸1000C时获得三硝基甲苯3·P53+ 3HO—NO2 + 3H2O六、卤代烃1.氯乙烷在氢氧化钠水溶液中加热反应3·P64CH3CH2Br + NaOH CH3CH2OH + NaBr2.氯乙烷在氢氧化钠醇溶液中加热反应2·P63CH3CH2Br +NaOH CH2=CH2↑+ NaBr + H2O 4. 1—溴丙烷与氢氧化钾醇溶液共热3·P65CH3CH2 CH2Br +KOH CH3CH=CH2↑ + KBr + H2O —氯丙烷与氢氧化钠水溶液共热3·P65CH3CHClCH3 +NaOH CH3CHOHCH3+ NaCl6. 2—甲基—2—溴丁烷消去溴化氢3·P65七、醇类1.乙醇与钠反应3·P672CH3CH2OH + 2Na 2CH3CH2ONa + H2↑2.乙醇的燃烧2·P34 CH3CH2OH+3O22CO2+3H2O3.乙醇的催化氧化2·P662CH3CH2OH + O2 2CH3CHO + 2H2O4.乙醇制乙烯3·P69 CH3CH2OH CH2=CH2↑ + H2O5.乙醇制乙醚3·P69 2CH3CH2OH CH3CH2OCH2CH3 + H2O6.乙醇与红热的氧化铜反应3·P88CH3CH2OH+CuO CH3CHO+H2O7.浓硫酸、乙醇和溴化钠加热反应制溴乙烷3·P68C2H5OH+NaBr+H2SO4C2H5Br+NaHSO4 + H2O八、酚类1.苯酚与氢氧化钠反应3·P73 + NaOH + H2O2.苯酚与溴水反应3·P73+3Br2↓ + 3HBr九、醛类1.乙醛的催化加氢3·P80CH3CHO + H2CH3CH2OH2.乙醛的催化氧化2·P662CH3CHO + O22CH3COOH3.乙醛与银氨溶液反应3·P80CH3CHO + 2AgNH32OH CH3COONH4+ 2Ag↓ + 3NH3 + H2O4.乙醛与新制氢氧化铜反应3·P80CH3CHO + 2CuOH2 +NaOH CH3COONa + Cu2O↓ + 3H2O5.甲醛与苯酚制酚醛树脂3·P80十、羧酸1.乙酸与乙醇发生酯化反应2·P68CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O2.乙酸与碳酸钠反应2·P67 2CH3COOH+Na2CO3==2CH3COONa+H2O+CO2↑4.两分子乳酸脱去两分子水3·P862CH3CHOHCOOH7.甲酸与银氨溶液反应3·P84HCOOH+2AgNH32OH NH42 CO 3+ 2Ag↓ + 3NH3 + H2O8.甲酸与新制氢氧化铜反应3·P84HCOOH+2CuOH2 +2NaOH Na2 CO3+ Cu2O↓ + 3H2O9.甲酸与碳酸钠反应3·P842HCOOH+Na2CO32HCOONa+H2O+CO2↑十一、糖类1.葡萄糖燃烧2·P45 C6H12O6 + 6O26CO2 + 6H2O2.葡萄糖与乙酸完全酯化3·P91CH2OHCHOH4CHO+5CH3COOH CH3COOCH2CHOOCCH3CHO+5H2O3.葡萄糖与银氨溶液反应3·P91CH2OHCHOH4CHO + 2AgNH32OH CH2OHCHOH4COONH4+ 2Ag↓ + 3NH3↑ + H2O4.葡萄糖与新制氢氧化铜反应2·P71CH2OHCHOH4CHO + 2CuOH2 +NaOH CH2OHCHOH4COONa + Cu2O↓ + 3H2O5.葡萄糖被还原为直链己六醇3·P91CH2OHCHOH4 CHO + H2CH2OHCHOH4CH2OH6.葡萄糖在酒化酶作用下获得乙醇2·P72C6H12O62CH3CH2OH + 2CO2↑7.蔗糖水解3·P93 C12H22O11蔗糖+ H2O C6H12O6葡萄糖+ C6H12O6果糖8.麦芽糖水解2·P71 C12H22O11麦芽糖+ H2O 2C6H12O6葡萄糖9.淀粉水解2·P47 C6H10O5n淀粉+ nH2O n C6H12O6葡萄糖10.纤维素水解2·P45C6H10O5n纤维素+ nH2O n C6H12O6葡萄糖11.纤维素燃烧2·P46 C6H10O5n纤维素+ 6nO26nCO2 + 6nH2O十二、酯类1.乙酸乙酯与H218O混合加入稀硫酸水解3·P13CH3COOCH2CH3 + H218O CH3CO18OH + CH3CH2OH2.油脂的氢化以油酸甘油酯加氢为例3·P993.油脂的皂化反应以硬脂酸甘油酯为例3·P99。
陌生有机方程式的书写

陌生有机方程式的书写
1. 结构式,有机化合物的结构式是最常见的表示方式,它用线
条表示化学键和原子之间的连接关系。
可以使用直线、曲线和箭头
来表示不同的键类型和反应方向。
例如,当两个有机化合物发生取
代反应时,可以使用结构式来表示反应物和产物之间的变化。
2. 分子式,分子式是用化学符号表示有机化合物的组成元素和
原子数量的简略表示法。
例如,乙醇的分子式为C2H6O,表示它由2
个碳原子、6个氢原子和1个氧原子组成。
3. 反应方程式,反应方程式用来描述有机化合物之间的化学反
应过程。
它包括反应物、产物和反应条件。
反应物位于箭头的左侧,产物位于箭头的右侧。
反应条件如温度、压力、溶剂等可以在方程
式上方或下方标注。
例如,乙烯和溴反应生成1,2-二溴乙烷的反应
方程式可以写作,C2H4 + Br2 → C2H4Br2。
4. 机理图,机理图是用来描述有机反应的详细步骤和反应中间
体的表示方法。
它通过箭头和化学结构式来表示反应的步骤和中间
产物。
机理图可以更加详细地展示反应的过程和反应路径。
以上是一些常见的有机方程式的书写方式,它们可以根据需要灵活运用。
当然,在有机化学中还有其他更加复杂的表示方法,如立体化学表示、电子机构表示等,这些方法可以更加准确地描述有机反应的细节。
有机化学方程式书写【范本模板】

有机化学方程式书写(一)1、甲烷与氯气在光照条件下反应 : 反应类型:2、苯与液溴在FeBr 3作催化剂时生成一溴代苯:反应类型:3、苯与浓硝酸、浓硫酸在60℃时反应: 反应类型:4、苯与浓H 2SO 4在催化剂、70—80℃条件下发生反应; 反应类型:5、甲苯与浓硝酸、浓硫酸在100℃时制TNT (烈性炸药)反应类型:6、甲苯与液溴在催化剂(Fe )作用下制一溴代物。
反应类型:7、2—氯丙烷与KOH 的水溶液共热: 反应类型:8、1,2—二氯丁烷与NaOH 的水溶液共热: 反应类型:9、与NaOH 的水溶液共热: 反应类型:10、苯酚与浓溴水反应: 反应类型:11、 与浓溴水反应: 反应类型:12、与浓溴水反应: 反应类型:13、乙醇与氢卤酸(HBr)共热: 反应类型:14、乙醇与浓硫酸共热(140℃)反应类型:15、乙醇与乙酸(浓硫酸作催化剂)共热:反应类型:16、乙二酸与乙醇混合(浓硫酸作催化剂)共热:反应类型:17、乙酸与乙二醇混合(浓硫酸作催化剂)共热:反应类型:18、乙二酸与乙二醇混合(浓硫酸作催化剂)共热:反应类型:19。
对苯二甲酸与乙二醇混合(浓硫酸作催化剂)共热:反应类型:20、纤维素在适当的条件下可与硝酸发生酯化反应生成纤维素硝酸酯(俗称硝化纤维)反应类型:21、纤维素在适当的条件下可与醋酸酐等发生酯化反应生成纤维素醋酸酯(俗称醋酸纤维)反应类型:22、在催化剂作用下生成二肽:反应类型:23、乙酸乙酯在H2SO4催化作用下发生水解反应:反应类型:24、乙酸丙酯在NaOH溶液催化作用下反应:反应类型:25、硬脂酸甘油酯在NaOH溶液催化作用下反应: 反应类型:26、在H2SO4催化作用下发生水解反应:反应类型:有机化学方程式书写(二)27、乙烯与氢气、催化剂作用下反应:反应类型:28、丙烯与溴水反应: 反应类型:29、乙烯与HBr 反应:反应类型:30、乙烯与水在催化剂作用下反应:反应类型:31、乙炔和少量 H2在催化剂作用下反应:反应类型:32、乙炔和足量 H2在催化剂作用下反应:反应类型:33、苯与氢气在温度为180—250℃、压强为18MPa 条件下反应:反应类型:34、苯酚与H催化剂作用下反应; 反应类型:2(1:1)催化剂作用下反应:反应类型:35、1,3—丁二烯与H2(1:1)催化剂作用下反应:反应类型:36、1,3—丁二烯与Br2(1:2)催化剂作用下反应:反应类型:37、1,3-丁二烯与Br2在催化剂作用下反应:反应类型:38、与足量H2反应:反应类型:39、乙醛与加热、加压和有催化剂(如Ni\Pt)条件下与H2反应:反应类型: 40、丙酮与加热、加压和有催化剂条件下与H2反应:反应类型:41、催化剂条件下与H242、与溴水反应:反应类型:有机化学方程式书写(三)43、乙烯在催化剂条件下制聚乙烯:反应类型:44、氯乙烯在催化条件下制聚氯乙烯: 反应类型:45、2—甲基—1、3—丁二烯制聚橡胶(聚合物):反应类型:46、用1,2—二氯乙烯制聚1,2-二氯乙烯:反应类型:47、苯乙烯催化剂作用下制聚苯乙烯: 反应类型:48、苯乙烯和1,3-丁二烯催化剂条件下制丁苯橡胶;反应类型:49、乳酸在催化剂作用下生成聚乳酸;反应类型:50、对苯二甲酸与乙二醇混合(浓硫酸作催化剂)共热生成高聚物:反应类型:51、苯酚与甲醛在催化剂(盐酸)作用下生成酚醛树脂:反应类型:52、丙氨酸催化剂作用下生成聚丙氨基酸: 反应类型:有机化学方程式书写(四)53、甲烷与氧气点燃:反应类型:54、乙烯与氧气点燃:反应类型:55、乙炔在氧气中燃烧:反应类型:56、苯在氧气中燃烧:反应类型:57、乙醇与氧气点燃:反应类型:58、烷烃与氧气点燃: 反应类型:59、烯烃与氧气点燃:反应类型:60、炔烃与氧气点燃:反应类型:61、苯的同系物与氧气点燃:反应类型:62、甲苯被酸性KMnO溶液氧化:(只需写出甲苯的生成物)463、1—丁醇(伯醇)与氧气(Cu或 Ag作催化剂):反应类型:64、2-丁醇(仲醇)与氧气(Cu或 Ag作催化剂):反应类型:65、乙醛与氧气催化剂条件下反应:反应类型:66、乙醛与银氨溶液发生银镜反应: 反应类型:加热: 反应类型:67、丙醛与新制的Cu(OH)2加热:反应类型:68、乙二醛与新制的Cu(OH)269、甲醛与银氨溶液发生银镜反应:反应类型:70、甲酸乙酯与银氨溶液混合:反应类型:有机化学方程式书写(五)71、实验室制乙烯:反应类型:72、2—甲基—2-戊醇与浓硫酸共热(温度:170℃)反应类型:73、氯乙烷与NaOH的醇溶液共热:反应类型:74、3-甲基—3—溴己烷与NaOH醇溶液共热:反应类型:有机化学方程式书写(六)75、苯与液溴在FeBr 3作催化剂时生成一溴代苯: 反应类型:76、苯与浓硝酸、浓硫酸在60℃时反应: 反应类型:77、苯与浓H 2SO 4在催化剂、70—80℃条件下发生反应; 反应类型:78、乙烯与水在催化剂作用下反应: 反应类型:79、油酸甘油酯催化作用下与H 2反应: 反应类型:80、乙二酸与乙醇混合(浓硫酸作催化剂)共热: 反应类型:81、乙醇与浓硫酸共热(140℃) 反应类型:82、辛烷高温条件(隔绝空气)反应: 反应类型:83、硬脂酸甘油酯在NaOH 溶液催化作用下反应: 反应类型:化学方程式书写(七)84、甲烷高温条件(隔绝空气)反应: 反应类型: 85、辛烷高温条件(隔绝空气)反应: 反应类型: 86、乙烯能使酸性KMnO 4溶液褪色: 反应类型:87、乙炔的实验室制取:88、乙醇与金属钠反应:89、乙酸与金属钠反应:90、苯酚与金属钠反应:91、乙酸与Na 2CO 3溶液反应:92、乙酸与NaHCO 3溶液反应:93、苯酚与碳酸钠溶液反应:94、 与碳酸钠溶液反应:95、苯酚与NaOH 溶液反应:96、苯酚钠溶液中通入二氧化碳:97、苯酚钠溶液与盐酸混合:。
有机化学方程式

高中有机化学反应方程式1. 甲烷(烷烃通式:C n H 2n +2)甲烷的制取:CH 3CaO △2CO 3+CH 4↑(1)氧化反应甲烷的燃烧:CH 4+2O 2 点燃CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+Cl 光照3Cl(一氯甲烷)+HClCH 3Cl+Cl 光照2Cl 2(二氯甲烷)+HClCH 2Cl 2+Cl 光照3(三氯甲烷)+HCl (CHCl 3又叫氯仿)CHCl 3+Cl 光照4(四氯化碳)+HCl(3)分解反应甲烷分解:CH 高温22. 乙烯(烯烃通式:C n H 2n )乙烯的制取:CH 3CH 2浓硫酸2=CH 2↑+H 2O(消去反应)(1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 点燃2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2Br —CH 2Br与氢气加成:CH 2=CH 2+H 2催化剂CH 3CH 3 与氯化氢加成:CH 2=CH 2+HCl 催化剂CH 3CH 2Cl 与水加成:CH 2=CH 2+H 2O催化剂CH 3CH 2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n CH 2=CH 2催化剂 [CH 2—CH 2 ] n 适当拓展:CH 3CH =CH 2+Cl 3׀ Cl CH -׀ ClCH 2 CH 3CH =CH 2+H 2催化剂CH 3CH 2CH 3 CH 3CH =CH 2+HCl 催化剂CH 3CH 2CH 2Cl 或CH 3׀ ClCHCH 3 CH 3CH =CH 2+H 2O 催化剂CH 3CH 2CH 2OH 或CH 3׀ OHCHCH 3 n CH 2=CH -CH 3催化剂 [CH 2—׀ CH 3CH ] n (聚丙烯) 3. 乙炔(炔烃通式:C n H 2n-2)乙炔的制取:CaC 2+2H 2 CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 点燃2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
高二化学有机反应方程式书写原则注意事项-卤代烃的性质-有机反应方程式用箭头还是等号

有机反应方程式书写原则注意事项(1)有机反应方程式中有机物写结构简式。
在书写有机物结构简式时,注意:碳只能形成四个共价键,不能少写或多写氢。
例新戊烷(CH3)4C,不能写成(CH2)4C或(CH3)4CH2。
(2)一些基团的连接方式要即正确又合乎习惯,不产生歧义。
例醛基-CHO,不能写成CHO-也不能写成-COH(写成此种形式,可能会误认为碳原子和氧原子之间是单键)。
另外常见官能团-C6H5、-OH、-NO、-NH2、-COOH等不能写成C6H5-、OH-、NO2-、NH2-、COOH-等,尤其注意官能团写在物质左侧的。
(3)注意有机反应的条件,反应物和产物中间用“→”连接。
有机反应方程式举例:烷烃、烯烃、炔烃甲烷的实验室制法C2H5OH CH2=CH2↑+H2O甲烷燃烧CH4+2O2CO2+2H2O甲烷与氯气CH4+Cl2CH3Cl+HClCH3Cl+Cl2CH2Cl2+HClCH2Cl2+Cl2CHCl3+HClCHCl3+Cl2CCl4+HCl4. 甲烷隔绝空气时高温分解CH4C+2H25. 丁烷的裂解(两个方程式)C4H10CH4+C3H6C4H10C2H4+C2H66. 乙烯的实验室制法CH3CH2OH CH2=CH2↑+H2O7. 乙烯燃烧C2H4+3O22CO2+2H2O8. 乙烯使溴水褪色CH2=CH2+Br2→CH2Br─CH2Br9. 乙烯与水在催化剂下反应CH2=CH2+H2O C2H5OH12. 乙烯的加聚13. 乙烯与丙烯1:1加聚14. 异戊二烯聚合15. 苯乙烯与异戊二烯1:1加聚16. 乙炔的实验室制法CaC2+2H2O→CH CH↑+Ca(OH)217. 乙炔与足量氢气反应CH CH+2H2CH3-CH318. 乙炔的聚合19. 由乙炔制备聚氯乙烯CH CH+HCl CH2=CHCl二、苯及其同系物20. 苯燃烧2C6H6+15O212CO2+6H2O21. 苯与液溴反应22. 甲苯的硝化反应23. 苯与氢气反应25. 甲苯与浓硝酸、浓硫酸反应三、卤代烃的性质26. 溴乙烷的消去反应CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O27. 溴乙烷的水解反应CH3-CH2-Br+NaOH CH3-CH2-OH+NaBr28. 氯苯与氢氧化钠水溶液反应四、醇的性质29. 乙醇燃烧C2H5OH+3O22CO2+3H2O30. 乙醇与钠反应2C2H5OH+2Na→2C2H5ONa+H2↑31. 乙醇的催化氧化2C2H5OH+O22CH3CHO+2H2O32. 乙醇与浓硫酸反应(两个方程式)CH3CH2OH CH2=CH2↑+H2O2CH3CH2OH CH3─CH2─O─CH2─CH3+H2O33. 乙醇与乙酸反应C2H5OH+CH3COOH CH3COOC2H5+H2O34. 乙二醇与钠反应35. 甘油与硝酸反应五、酚的性质36. 苯酚与钠反应37. 苯酚与氢氧化钠反应38. 苯酚与浓溴水反应39. 苯酚钠与二氧化碳反应40. 苯酚与甲醛缩聚原子团书写规则一些常见原子团的名称和书写规则。
有机化学基础方程式归纳

有机化学基础方程式归纳一、烷烃(1)氧化反应:CH 4 + 2O 2CO 2 + 2H 2O 燃烧的通式:C n H2n+2 + O 2 nCO 2+ (n+1)H 2O (2)取代反应:CH 4 + Cl 2 CH 3Cl + HCl CH 3Cl + Cl 2CH 2Cl 2+ HClCH 2Cl 2+ Cl 2 CHCl 3+ HClCHCl 3 + Cl 2 CCl 4+ HCl(3)受热分解: CH 4 ==== C + 2H 2(4)实验室制法:CH 3Na 2CO 3 + CH 4二、烯烃(1)氧化反应:CH 2=CH 2 + 2O 2 2CO 2 + 2H 2O 2CH 2=CH 2 + O 2 2 燃烧的通式:C n H 2n + O 2 n CO 2 + n H 2O (2)加成:CH 2=CH 2 + X 2 CH 2X-CH 2XCH 2=CH 2CH 3-CH 2XCH 2=CH 2 + H 2CH 3-CH 3CH 2=CH 2 + H 2CH 3-CH 2OH (3)加聚:n CH 2=CH(4)实验室制法:CH 3CH 2OH CH 2=CH 2 + H 2O 三、乙炔(1)氧化反应:2 + 5O 2 4CO 2 +2 H 2O 燃烧的通式:C n H 2n-2 + O 2 n CO 2 + (n-1)H 20 (2)加成: + H CH 2=CH 2 + 2H 23-CH 3CH 2=CHCl3n+1 2光 光 光 受热 3n-1 23n 2光 [CH 2-CH 2] n CH CH 点燃 ====点燃 ==== 点燃 ==== 点燃 ==== 点燃 ==== 点燃 ==== CH CHCH CH CH CH 浓H 2SO 4 170℃催化剂 CH 3-C-HO+ X2CHX=CHX+ 2H2O(3)实验室制法:CaC2 + 2H2O Ca(OH)2 +四、1、3-丁二烯(1)加成:CH2=CH-CH=CH2 + Br2CH2Br-CHBr-CH=CH2CH2=CH-CH=CH2 + Br2CH2Br-CH=CH-CH2BrCH2=CH-CH=CH2 + 2Br2CH2Br-CHBr-CHBr-CH2Br(2)加聚:n CH2=CH-CH=CH五、苯和苯的同系物(1)氧化反应:+ 15O212CO2 + 6H2O燃烧的通式:C n H2n-6 + O2n CO2 + (n-3)H2O(2)取代反应:+ Br2 + HBr+ HO-NO2+ H2O+ 3HO-NO2+ 3H2O+ HO-SO3+ H2O(3+ 3H2+ 3H2+ 3Cl2六、卤代烃(1)水解反应:CH3CH2CH3CH2OH + NaBrR-OH + NaX(2)消去反应:CH3CH2Br + NaOH CH2=CH2 + NaBr + H2O+ NaX + H2OCH CHCH CHFeBr32-CH=CH-CH2]n点燃====点燃====3n-32浓H2SO450~60℃2370~80℃浓H2SO4100℃CH32ON-CH3-NO2NO2CH3CH3ClClClClCl紫外线R2R3R1 C C R4R2R3R1 C C R4CH CH催化剂CH3-C-HO七、醇(1)与活泼金属:2Na + 2CH 3CH 2OH 2CH 3CH 2ONa + H 22C n H 2n+1OH + 2Na 2C n H 2n+1ONa + H 2 (2)①氧化反应:CH 3CH 2OH + 3O 2 2CO 2 + 3H 2O燃烧的通式:2C n H 2n+1OH + 3nO 22nCO 2 + (2n+2)H 2O②催化氧化:2CH 3CH 2OH + O 2 + 2H 2O2R-CH 2-OH + O 22+ 2H 20 + O 2 2 + + 2H 20 (3)消去反应:CH 3CH 2OHCH 2=CH 2 + H 2O + H 2O (4)酯化反应:CH 3CH 2OH + + H 2O R′-OH + + H 2O+ 3HO-NO 2 + 3H 2O (5)与HX 反应:CH 3CH 2CH 3CH 2X + H 2OR-X + H 2O(6)分子间脱水:CH 3CH 2OH + CH 3CH 2OH CH 3CH 2OCH 2CH 3 + H 2O R 1-OH + R 2R 1-O-R 2 + H 2O(7)制备:CH 2=CH 2 + H 2CH 3-CH 2OH 八、酚(1)弱酸性: H + + ①与NaOH 溶液的反应:+ NaOH + H 2O 点燃 ==== 点燃 ==== CH 3-C-H O 浓H 2SO 4 170℃R 2 R 3R 1 C C R H OH R 2 R 3 R 1 C C R 4 CH 3-C-OH O CH 3-C-O-CH 2-CH 3 OR-C-O-H O R-C-O-R ′ O 浓H 2SO 4 140℃R-C-H O2 2R 1-CH-OH R 1-C-R 2 O 2-OH CH 2-OH CH-OH CH 2-ONO 2CH 2-ONO 2CH-ONO 2催化剂 -OH-O --OH -ONa②与Na 反应:2 + 2Na 2 + H 2 ③苯酚的制备(强酸制弱酸):+ H 2O + CO 2 + NaHCO 3 + HCl+ NaCl (2)取代反应:①苯酚的溴化反应:+ 3Br 2+ 3HBr ②硝化反应: + 3HO-NO 2(浓+ 3H 2O (3)加成反应:+ 3H 2(4)缩聚反应:n + n+ nH 2O (5)显色反应:苯酚遇FeCl 3溶液显紫色九、醛:(1)加成反应: + H CH 3-CH 2-OH + H 2CH 3OH + H 2 R-CH 2-OH(2)氧化反应:①与O 2反应:Ⅰ、燃烧: + 5O 2 4CO 2 + 4H 2O + O 2 CO 2 + H 2O Ⅱ、催化氧化:-OH -ONa -ONa -OH-ONa -OH -OH O 2N -OH -NO 2 NO 2-OH Br- OH-Br -OH OH -OH O nCH 2 OH [ ] OCH 3-C -H OCH 3-C -H 点燃 ==== O H -C -H O R -C -H OH -C -H 点燃 ====2 + O 222+ O2 2+ O CO 2 + H 2O 2 + O 2②与弱氧化剂反应:Ⅰ、银镜反应: + 2Ag(NH 3)2OH+2Ag +3NH 3+H 2O + 4Ag(NH 3)2OH (NH 4)2CO 3 + 4Ag + 6NH 3 + 2H 2O + 2Ag(NH 3)2OH +2Ag +3NH 3+H 2OⅡ、与新制Cu(OH)2反应: + 2Cu(OH) + Cu 2O + H 2O + 4Cu(OH)2O + CO 2 + 5H 2O + 2Cu(OH)2 + Cu 2O + H 2O (3)缩聚反应: n + n + nH 2O 十、羧酸(1)酸性:CH 3COOH CH 3COO - + H +(2)酯化反应:CH 3CH 2OH ++ H 2O (3)缩聚反应:n 十一、酯(1)水解反应:2O 3C 17H 35COOH + OCH 3-C -OH O CH 3-C -H O R -C -H O CH 3-C -H OCH 3-C -ONH 4 O CH 3-C -H O3-C -OH O H -C -H OH -C -OH OR -C -OH OH -C -H OH -C -H O R -C -H OR -C -ONH 4OH -C -H OR -C -HO -C -OH -OH O H -C -nCH 2 OH[ ] CH 3-C-OH O CH 3-C-O-CH 2-CH 3 O--OH O HO -C - O + nHO -CH 2CH 2-OH --O --O O-CH 2CH 2-O - 〔 〕n + 2nH 2O 1735CH C H -COO -CH脂肪酶 CH 2-OH CH -OHCH 2-OH3C 17H 35COONa + (2)加成反应:+ 3H 十二、糖类(1)氧化反应:①燃烧:C 6H 12O 6 (s)+ 6O 2(g) 6CO 2(g) + 6H 2O(l)②被银氨溶液或新制Cu(OH)2氧化:CH 2OH(CHOH)4CHO + 2Ag(NH 3)22OH(CHOH)4COONH 4 + 2Ag + 3NH 3 + H 2OCH 2OH(CHOH)4CHO + 2Cu(OH)2CH 2OH(CHOH)4COOH + Cu 2O + 2H 2O (2)加成反应:CH 2OH(CHOH)4CHO + H CH 2OH(CHOH)4CH 2OH(己六醇)(3)酯化反应:CH 2OH(CHOH)4CHO+5CH 3COOH H 2OCOCH 3(CHOCOCH 3)4CHO+5H 2O+ 3nHO-NO 3 + 3nH 2O (4)水解反应:C 12H 22O 11 + H 2C 6H 12O 6 + C 6H 12O 6C 12H 22O 11 + H 2O 2C 6H 12O 6(C 6H 10O 5)n + nH 26H 12O 6(C 6H 10O 5)n + nH 2nC 6H 12O 6十三、氨基酸(1)两性:H 2N-CH 2-COOH + HCl HOOC –CH 2–NH 3ClC 17H 33-COO -CH 2C 17H 33-COO -CH C 17H 33-COO -CH 21735CH C 17H 35-COO -CH 21735CH C 17H 35-COO -CH 2CH 2-OHCH -OHCH 2-OH 点燃 一定条件 催化剂 OH OH [(C 6H 7O 2) OH]n ONO 2 ONO 2[(C 6H 7O 2) ONO 2]nH 2N-CH 2-COOH + NaOH H 2N –CH 2–COONa + H 2O (2)缩合反应: H 2N-CH 2-COOH + H 2N-CH2-COOH + H 2O(3):酯化反应:H 2N-CH 2-COOH + HOCH 2CH 3 H 2N-CH 2-COOCH 2CH 3+H 2O十四、蛋白质(1)两性:(2)盐析:给蛋白质溶液中加入某些无机盐的浓溶液,如(NH 4)2SO 4、Na 2SO 4等,可使蛋白质的溶解度降低而析出的作用,是可逆过程,故可用于分离、提纯蛋白质。
高中化学-有机反应方程式的书写要求

有机反应方程式的书写要求1.反应箭头和配平:书写有机反应方程式时应注意,反应物和产物之间用“―→”连接,有机物用结构简式表示,并遵循元素守恒进行配平。
2.反应条件:有机物反应条件不同,所得产物不同。
题组三有机转化关系中反应方程式的书写5.一种常见聚酯类高分子材料的合成流程如下:请写出各步反应的化学方程式①________________________________________________________________________;②________________________________________________________________________;③________________________________________________________________________;④________________________________________________________________________;⑤________________________________________________________________________;⑥________________________________________________________________________;⑦________________________________________________________________________。
答案①CH2==CH2+Br2―→②光③――→④⑤⑥+O2――→催化剂⑦+n HO—CH2—CH2—OH浓H2SO4△+(2n-1)H2O1.同分异构体的种类(1)碳链异构(2)官能团位置异构(3)类别异构(官能团异构)有机物分子通式与其可能的类别如下表所示:组成通式可能的类别典型实例C n H2n烯烃、环烷烃CH2==CHCH3与C n H2n-2炔烃、二烯烃CH≡C—CH2CH3与CH2==CHCH==CH2C n H2n+2O饱和一元醇、醚C2H5OH与CH3OCH3C n H2n O醛、酮、烯醇、环醚、环醇CH3CH2CHO、CH3COCH3、CH2==CHCH2OH、与C n H2n O2羧酸、酯、羟基醛、羟基酮CH3CH2COOH、HCOOCH2CH3、HO—CH2—CH2—CHO与C n H2n-6O酚、芳香醇、芳香醚、与C n H2n+1NO2硝基烷、氨基酸CH3CH2—NO2与H2NCH2—COOHC n(H2O)m单糖或二糖葡萄糖与果糖(C6H12O6)、蔗糖与麦芽糖(C12H22O11)2.同分异构体的书写规律书写时,要尽量把主链写直,不要写得歪扭七八的,以免干扰自己的视觉;思维一定要有序,可按下列顺序考虑:(1)主链由长到短,支链由整到散,位置由心到边,排列邻、间、对。
有机化学反应方程式

有机化学化学反应方程式总结(一)烷烃1.甲烷燃烧: CH4 +2O2CO2 + 2H2O2.甲烷与氯气在光照条件下反应:CH4 + 3Cl2CHCl3+ 3HClCH4 + 4Cl2CCl4 + 4HClCH4 + 2Cl2CH2Cl2 + 2HCl3.甲烷高温分解: CH4C + 2H2(二)烯烃乙烯的制取:CH3CH2OH H2C=CH2↑+H2O乙烯的燃烧:H2C=CH2+3O22CO2+2H2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
加成反应与加聚反应1.乙烯与溴的四氯化碳溶液反应:CH2=CH2 + Br2 CH2BrCH2Br2.乙烯与水反应:CH2=CH2 + H2O CH3CH2OH3.乙烯的催化加氢:CH2=CH2 +H2CH3CH34.乙烯的加聚反应:n CH2=CH25. 乙烯与氯化氢加成:H2C=CH2+HCl CH3CH2Cl6.乙烯与氯气加成:CH2=CH2 + Cl2 CH2ClCH2Cl浓硫酸170℃点燃(三)炔烃1.乙炔燃烧: 2C2H2 + 5O24CO2 + 2H2O2.乙炔与足量溴的四氯化碳溶液反应:CH≡CH + Br2 CHBr2CHBr2 3.乙炔与氢气催化加成:CH≡CH + 2H2CH3CH3 4.乙炔制聚氯乙烯:CH≡CH +HCl H2C=CHCl n H2C=CHCl(四)芳香烃1.苯的燃烧: 2C6H6+15O212CO2 + 6H2O2.苯的催化加氢:+ 3H24.苯与液溴催化反应:+ Br2+ HBr5.苯的硝化反应:+HO-NO 2+ H2O 9.甲苯与浓硝酸、浓硫酸的混合酸1000C时获得三硝基甲苯:+ 3HO—NO2+ 3H2O(五)、卤代烃1.氯乙烷在氢氧化钠水溶液中加热反应:CH3CH2Br + NaOH CH3CH2OH + NaBr 2.氯乙烷在氢氧化钠醇溶液中加热反应:CH3CH2Br +NaOHCH2=CH2↑+ NaBr + H2O(六)、醇类 1.乙醇与钠反应: 2CH 3CH 2OH + 2Na2CH 3CH 2ONa + H 2↑2.乙醇的燃烧:CH 3CH 2OH+3O 22CO 2+3H 2O3.乙醇的催化氧化:2CH 3CH 2OH + O 22CH 3CHO + 2H 2O4.乙醇制乙烯:CH 3CH 2OH CH 2=CH 2↑ + H 2O5.乙醇制乙醚:2CH 3CH 2OH CH 3CH 2OCH 2CH 3 + H 2O6. 乙醇与红热的氧化铜反应:CH 3CH 2OH+CuOCH 3CHO+H 2O7. 乙醇和浓的氢溴酸加热反应制溴乙烷: C 2H 5OH+ H BrC 2H 5Br + H 2O(七)、酚类1.苯酚与氢氧化钠反应:+ NaOH+ H 2O2.苯酚钠与CO 2反应:+CO 2+H 2O+NaHCO 33.苯酚与溴水反应:+3Br 2 ↓ + 3HBr—ONa—OH(八)、醛类1.乙醛的催化加氢:CH3CHO + H2CH3CH2OH2.乙醛的催化氧化:2CH3CHO + O22CH3COOH3.银氨溶液的配制:Ag++NH3·H2O===AgOH↓++4NHAgOH+2NH3·H2O===[Ag(NH3)2]++OH-+2H2O 4.乙醛与银氨溶液反应:CH3CHO + 2Ag(NH3)2OHCH3COONH4+ 2Ag↓ + 3NH3 + H2O 5.乙醛与新制氢氧化铜反应:CH3CHO + 2Cu(OH)2 +NaOHCH3COONa + Cu2O↓ + 3H2O (九)、羧酸1.乙酸与乙醇发生酯化反应:CH3COOH+CH3CH2OHCH3COOCH2CH3 + H2O2.乙酸与碳酸钠反应:2CH3COOH+Na2CO3==2CH3COONa+H2O+CO2↑(十)、酯类1.乙酸乙酯与H218O混合加入稀硫酸水解:CH3COOCH2CH3+H218OCH3CO18OH + CH3CH2OH2.乙酸乙酯碱性水解CH3COOC2H5+NaOH H3COONa+C2H5OH (十一)、糖类NaOH1.葡萄糖燃烧:C6H12O6 + 6O26CO2 + 6H2O2.葡萄糖与银氨溶液反应:CH2OH(CHOH)4CHO + 2Ag(NH3)2OHCH2OH(CHOH)4COONH4+ 2Ag↓ + 3NH3↑ + H2O 3.葡萄糖与新制氢氧化铜反应:CH2OH(CHOH)4CHO + 2Cu(OH)2+NaOHCH2OH(CHOH)4COONa + Cu2O↓ + 3H2O4.葡萄糖在酒化酶作用下获得乙醇:C6H12O62CH3CH2OH + 2CO2↑5.蔗糖水解:C12H22O11(蔗糖) + H2O C6H12O6(葡萄糖) +C6H12O6(果糖) 6.麦芽糖水解:C12H22O11(麦芽糖) + H2O 2C6H12O6(葡萄糖) 7.淀粉水解:(C6H10O5)n(淀粉) + nH2O n C6H12O6(葡萄糖)8.纤维素水解:(C6H10O5)n(纤维素) + nH2On C6H12O6(葡萄糖)(十二)、油脂1.油脂的氢化(以油酸甘油酯加氢为例) :2.油脂的皂化反应(以硬脂酸甘油酯为例) :。
有机化学方程式书写规律

有机化学方程式书写规律有机化学方程式是一种通过一定的规则来描述化学反应物之间变化的方式,这种规则称为有机化学方程式书写规律。
有机化学方程式书写规律主要用于描述化学反应以及反应所产生的产物之间的关系,有机化学方程式书写规律不仅仅可以用来理解物质与物质之间的反应,也是一种完整的有机化学逻辑推理的基础。
有机化学方程式书写的规律有以下几点:1、化学反应式的正确书写:有机化学方程式书写时,各种原料和产物的化学设计要清楚,方程式的书写顺序应该是原料放在左边,产物放在右边;方程式中的物质名称要正确,不要把化合物的错误符号混淆;同时,各种物质的量也要完整,要把物质的量表达出来,以便了解反应的情况。
2、在化学反应式中所使用的数学符号:在有机化学方程式书写中,除了表示物质的数学符号之外,还需要使用一些符号来表示反应的特性,包括反应系数、反应物、产物、反应条件等。
3、有机化学方程式书写注意事项:当书写有机化学方程式时,应当注意:反应必须是完整的,不要漏掉任何重要的物质;当反应物式子里有多种反应物时,应当注意显示他们的化学组成;反应式中反应物必须是正确而完整的;对于化学反应中物质量的表示,应当根据物质形态及其特性确定,并且要注意在有机化学方程式中的平衡条件。
由于有机化学方程式书写规律的重要性,它也受到了化学反应中各类物质的关注。
完整准确地书写有机化学方程式可以有效地帮助理解反应中物质的化学变化,进一步推动反应的进展。
因此,要想学好有机化学,首先要掌握有机化学方程式书写规律。
在学习有机化学方程式书写规律时,可以从基础出发:了解每种物质的反应性质,理解物质之间的相互作用;此外,还应当充分了解有机化学方程式书写规律中各种数学符号的意义,了解它们表达的物质及其反应特性;最后,要注意方程式中物质的量的表示,以及反应的平衡条件。
有机化学方程式书写规律的应用很广泛,它可以用来解释化学反应中物质的变化情况,也可以帮助我们更好地控制化学反应,节约一些原料,获得更多的产物。
有机化学方程式书写规则

有机化学方程式书写规则
(原创版)
目录
1.有机化学方程式的基本组成部分
2.有机化学方程式的书写规则
3.举例说明有机化学方程式的书写
正文
一、有机化学方程式的基本组成部分
有机化学方程式是用来描述有机化学反应的化学方程式,它主要包括以下几个部分:
1.反应物:即参加反应的有机化合物。
2.生成物:即反应后生成的有机化合物。
3.反应条件:即反应所需的温度、压力、溶剂等条件。
4.箭头:表示反应过程。
二、有机化学方程式的书写规则
1.反应物和生成物的表示方法
反应物和生成物要用化学式表示,如果反应物或生成物中含有多个相同的原子或原子团,需要在它们的化学式前加上相应的系数,使反应前后原子种类和数目保持不变。
2.反应条件的表示方法
反应条件要写在箭头上方,如温度、压力、溶剂等。
3.箭头的表示方法
箭头表示反应过程,从反应物指向生成物。
如果反应物有多个,箭头
要从第一个反应物开始。
三、举例说明有机化学方程式的书写
例如,对于乙醇和氧气在铜催化下的氧化反应,可以写成如下方程式:C2H5OH + O2 → CH3CHO + H2O
在这个方程式中,乙醇(C2H5OH)和氧气(O2)是反应物,乙醛(CH3CHO)和水(H2O)是生成物,铜(Cu)是催化剂,条件是氧气存在。
箭头表示反应过程,从乙醇指向乙醛。
常见有机化学反应方程式总结

常见有机化学反应方程式总结有机化学是研究碳和其它元素之间的化学反应的科学领域。
有机化学反应方程式描述了有机化合物之间发生的化学变化,是有机化学研究的基本工具。
下面是一些常见的有机化学反应方程式的总结:1. 取代反应(Substitution reactions):-卤素代替反应:R-X+Y→R-Y+X-核磁代替反应:R-H+X→R-X+H2. 加成反应(Addition reactions):-单一加成反应:R=CH2+X-Y→R-CH2-X-Y-烯烃加成反应:R=CH2+H-CH=CH2→R-CH2-CH-CH33. 消除反应(Elimination reactions):-水解反应:R-X+H2O→R-OH+HX-甲醇酯化反应:R-COOH+CH3OH→R-CO-O-CH34. 氧化反应(Oxidation reactions):-伯醇氧化反应:R-CH2-CH2-CH2-OH→R-CH2-CH=CH2-OH-异醛氧化反应:R-CHO+[O]→R-COOH5. 还原反应(Reduction reactions):-烯烃还原反应:R-CH=CH-R→R-CH2-CH2-R-酮还原反应:R-CO-R→R-CH2-R6. 缩合反应(Condensation reactions):-酯缩合反应:R-COOH+R'-COOH→R-COO-R'+H2O-罗宾逊缩合反应:R-CHO+R'-COOH→R-CH=CH-CO-R'7. 加氢反应(Hydrogenation reactions):-炔烃加氢反应:R-CH=CH-R+H2→R-CH2-CH2-R8. 多聚反应(Polymerization reactions):-乙烯聚合反应:nCH2=CH2→-(-CH2-CH2-)n-9. 光化学反应(Photochemical reactions):-阳光下的氯代烃分解反应:R-CH2-Cl→R-CH2•+Cl•10. 还原消除反应(Reductive elimination reactions):-醇酸脱水反应:R-COOH→R-CO•+H2O以上仅是有机化学反应方程式的一小部分,还有许多其他种类的反应。
wps怎么写有机化学方程式

wps怎么写有机化学方程式在进行有机化学实验或学习过程中,方程式的书写是非常关键的一环。
WPS作为一款常用的办公软件,提供了丰富的功能和工具,能够帮助我们准确、规范地书写有机化学方程式。
本文将介绍如何使用WPS软件来书写有机化学方程式,以及一些书写注意事项。
一、有机化学方程式的基本格式有机化学方程式由反应物、产物和反应条件三个部分组成。
一般来说,反应物写在左边,产物写在右边,用箭头表示反应方向,反应条件写在箭头上方。
例如,乙醇和醋酸反应生成乙酸的方程式可以写成:CH₃CH₂OH + CH₃COOH → CH₃COOCH₂CH₃ + H₂O二、使用WPS软件书写有机化学方程式1. 打开WPS软件,选择“新建”创建一个新文档。
2. 在文档中插入一个表格,可以通过点击“插入”选项卡中的“表格”来完成。
3. 在表格中选择合适的行数和列数,以容纳所需的方程式。
一般来说,反应物、需加热或溶剂、产物和反应条件可以分别写在表格的不同行中。
4. 在表格中填写反应物、需加热或溶剂、产物和反应条件的化学式或名称。
例如,乙醇可以用CH₃CH₂OH表示。
5. 使用化学式的上下标功能,来表示元素的离子状态或取代基。
例如,氯离子可以写成Cl⁻。
6. 使用插入符号功能,来添加箭头符号和其他特殊符号。
例如,可以使用向右的箭头符号表示反应方向。
7. 在表格中使用各种文本格式功能,来调整字体大小、粗体、斜体等,以使方程式看起来更加规范和清晰。
8. 完成方程式的书写后,可以保存文件或将其导出为图片等格式,方便日后使用和分享。
三、有机化学方程式书写的注意事项在使用WPS软件书写有机化学方程式时,还需要注意以下几点:1. 方程式中的化学式应该准确无误,包括元素的符号和原子的个数。
可以使用WPS的化学式编辑功能来自动生成化学式,避免出现错误。
2. 方程式中的符号和字体大小应统一,以提高整体的美观性和可读性。
可以选择一种标准的字体和字号,例如Times New Roman和12号字体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学方程式书写练习1.甲烷
烷烃通式:
(1)氧化反应
甲烷的燃烧:
甲烷能否使酸性高锰酸钾溶液及溴水褪色
(2)取代反应
一氯甲烷:
二氯甲烷:
三氯甲烷:
四氯化碳:
2.乙烯
烯烃通式:
(1)氧化反应
乙烯的燃烧:
乙烯能否使酸性高锰酸钾溶液褪色
(2)加成反应
与溴水加成:
与氢气加成:
与氯化氢加成:
与水加成:
(3)聚合反应:
3.乙炔
炔烃通式
(1)氧化反应
乙炔的燃烧:
乙炔能否使酸性高锰酸钾溶液褪色
(2)加成反应
与溴水加成:
与氯化氢加成:
与水加成:
(3)聚合反应:
4.1,3-丁二烯
二烯烃通式
(1)氧化反应
1,3-丁二烯的燃烧:
1,3-丁二烯能否使酸性高锰酸钾溶液褪色
(2)加成反应
与溴水加成:
(3)聚合反应:
5.苯:
苯的同系物通式:
(1)氧化反应:苯的燃烧:
苯能否使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色
(2)取代反应
①苯与溴反应:
②硝化反应:
苯硝化反应生成硝基苯,它是一种带有苦杏仁味、无色油状液体,有毒。
(3)加成反应
苯与氢气加成:
6.卤代烃
(1)溴乙烷与NaOH水溶液共热:
(2)溴乙烷与NaOH醇溶液共热:
7.乙醇
(1)与钠反应:
(2)氧化反应
乙醇的催化氧化:
(4)取代反应:
分子内脱水成醚:
与丙酸酯化反应:
8.乙醛
(1)还原反应:
(2)催化氧化:
(3)与银氨溶液反应:
(4)与新制氢氧化铜悬浊液:
9.乙酸
(1)乙酸的酸性
乙酸的电离:
乙酸与氢氧化钠:
乙酸与氧化钠:
乙酸与钠:
乙酸与碳酸钠:
(2)与乙醇酯化反应:
10.乙酸乙酯
酸性条件下水解反应:
碱性条件下(NaOH)水解反应:练习:
1、CH2=CH—COOH
与钠:
与氢氧化钠:
与碳酸钠:
与乙醇:
与溴水:
与溴化氢:
加聚反应:
2、CH3CH=CH—CH2OH
与钠:
︱ OH
与溴化氢:
加聚反应:
3催化氧化:
乙二醇与乙酸(1﹕1):
乙二醇与乙酸(1﹕2):
4、CH 3
催化氧化: 与乙酸(1﹕2):
5、CH 3CHCOOH (乳酸)
与钠:
与氢氧化钠:
与碳酸钠:
与乙醇:
与乙酸:
两摩尔自身反应生成链状酯: 两摩尔自身反应生成环状酯: 6、
与钠:
与氢氧化钠:
与碳酸钠:
与乙醇:
与乙酸:
两摩尔自身反应生成链状酯:
两摩尔自身反应生成环状酯:。
