流感病毒裂解疫苗 艾美汉信
5联疫苗

24
DTaP-IPV/Hib 主要事实
DTaP/IPV/Hib key Facts
• 多数儿童传染病目前还没消除 预防接种是保护儿童 抵御传染病对的最安全方法 • 新DTaP-IPV/Hib 接种 1 针,提供 5 种疾病的保护 • 无硫柳汞的疫苗比以前的疫苗 更安全且副作用较少
2
1. 联合疫苗
Combination Vaccines
3
联合疫苗
Combination Vaccines
• 一个制品的成份 可同样地分为现有的单个常规疫苗 • 多种疫苗的合并成一个制品 预防不同的疾病 或 预防多种株/型引起的同一疾病 从而减少预防某些疾病的接种次数 • 将多种疫苗制备于同一针剂中 它包括多疾病联合疫苗和 单疾病多型别联合疫苗
注射前用液体DTaP-IPV成份复溶冻干的Hib
Bulletin of the World Health Organization 2008;86:443–451
18
美国《时代》周刊:2008年10大医学突破
Top 10 Medical Breakthroughs of 2008 -TIME
将患者皮肤细胞转变成运动神经元 发炎容易导致心脏病发作 无疤痕手术 基因图谱大众化 新发现4种早老性痴呆基因 五合一疫苗 Pentacel
• 给受种者疫苗接种说明表格 Chart reminders
Performance feedback Home visits Mailed/Telephoned reminders Expanding access in health care settings Patient education Personal health records Combination vaccine
陕西2019年度第二类疫苗入围供应商

A3
甲型肝炎
灭活疫苗
(人二倍体细胞)
0.5ml/支,
西林瓶
重庆智飞生物制品股份有限公司
204.00元/支
进口
A4
甲型肝炎
灭活疫苗
(人二倍体细胞)
1.0ml/支,
西林瓶
北京科兴生物制品有限公司
90.00元/支
艾美康淮生物制药(江苏)有限公司
90.00元/支
A5
甲型肝炎
灭活疫苗
(人二倍体细胞)
84.00元/支
0.5ml/支
B15
重组乙型肝炎疫苗(汉逊酵母)
20µg/支,3支/人份,西林瓶
艾美汉信疫苗(大连)有限公司
70.00元/支
0.5ml/支
D、戊型肝炎疫苗
D1
重组戊型肝炎疫苗(大肠埃希菌)
0.5ml/支,预填充
厦门万泰沧海生物技术有限公司
160.00元/支
E、人用狂犬疫苗
E1
冻干人用狂犬病疫苗(Vero细胞)
168.00元/支
S2
肠道病毒71型
灭活疫苗
(人二倍体细胞)
0.5ml/支,
预填充
中国医学科学院医学生物学研究所
188.00元/支
S3
肠道病毒71型
灭活疫苗
(Vero细胞)
0.5ml/支,
西林瓶
武汉生物制品研究所有限责任公司
168.00元/支
北京科兴生物制品有限公司
168.00元/支
S4
肠道病毒71型
进口
O、霍乱疫苗
O1
重组B亚单位/菌体霍乱疫苗(肠溶胶囊)
240mg/粒
上海联合赛尔生物工程有限公司
企业信用报告_艾美诚信生物制药有限公司

基础版企业信用报告
5.10 司法拍卖..................................................................................................................................................11 5.11 股权冻结..................................................................................................................................................11 5.12 清算信息..................................................................................................................................................11 5.13 公示催告..................................................................................................................................................11 六、知识产权 .......................................................................................................................................................12 6.1 商标信息 ....................................................................................................................................................12 6.2 专利信息 .........................................................................................................................作权................................................................................................................................................14 6.4 作品著作权................................................................................................................................................14 6.5 网站备案 ....................................................................................................................................................14 七、企业发展 .......................................................................................................................................................15 7.1 融资信息 ....................................................................................................................................................15 7.2 核心成员 ....................................................................................................................................................15 7.3 竞品信息 ....................................................................................................................................................15 7.4 企业品牌项目............................................................................................................................................15 八、经营状况 .......................................................................................................................................................16 8.1 招投标 ........................................................................................................................................................16 8.2 税务评级 ....................................................................................................................................................16 8.3 资质证书 ....................................................................................................................................................16 8.4 抽查检查 ....................................................................................................................................................17 8.5 进出口信用................................................................................................................................................17 8.6 行政许可 ....................................................................................................................................................17
流行性感冒病毒及疫苗介绍(上海所)

Pol RNA 依赖 RNA聚合酶
HA NA M1 基质蛋白 1 M2 基质蛋白 2
多形性
NS1 非结构蛋白 1 NS2 非结构蛋白 2
HA亚型15个, NA亚型 9个, 8节段基因组 (13.6Kb), 10 种多肽以上
A型流感病毒的血凝素分型
亚型
H1 H2 H3 H4 H5 H6 H7 H8 H9 H10 H11 H12 H13 H14 H15
甲型H1N1流感病毒 截至北京时间2010年7月3日,共造成至 少18771人死亡。其中,美国有13000人死 亡,墨西哥823人死亡,加拿大401人死亡, 欧联盟1832人死亡,非洲地区109人死亡, 美洲地区6670人死亡,东部地中海地区663 人死亡,东南亚地区990人死亡,西太平洋 地区1039人死亡。
人类
猪
马
鸟
抗原漂移(Antigenic Drift)
RNA
Hemagglutinin Neuraminidase Antibodies Sialic acid
抗原转换(Antigenic shift)
流感病毒的流行 甲型流感:常以流行形式出现,造成世 界大流行 乙型流感:常引起局部爆发 丙型流感:主要以散在病例形式出现
WHO对流感大流行阶段划分
大流行间期 第1阶段:未在人类中检测到新亚型流感病毒。 第2阶段:未在人类中检测到新亚型流感病毒。然而,某种 正在动物中传播的动物性流感病毒亚型对人体发病构成 了实质性的风险 大流行预警期
第3阶段;发生人类感染,但未出现人传人,或仅出 现极为罕见的密切接触病例。
第4阶段;出现有限的人与人之间的传播小规模聚集性病例 。 第5阶段:出现规模较大的聚集性病例,提示病毒已能更好 地适应在人类中生存。 大流行阶段 第6阶段人群范围内广泛、快速、持续传播 大流行结束后
疫苗说明书

【免疫程序和剂量】
1.疫苗稀释用灭菌的1ml注射器将随制品附发的稀释液定量加入冻干皮肉注射用卡介苗安瓿中,放置约1分钟,摇动安瓿使之溶解后,用注射器来回抽取数次,使充分混匀。每支安瓿自稀释时起,必须在半小时内用完,以防污染。 2.接种方法:先用75%酒精消毒上臂外侧三角肌中部略下处的皮肤,然后用灭菌的1ml蓝芯注射器(25-26号针头)吸取摇匀的疫苗,皮内注射0.1ml。
5、被接种者应保存好医生开与的处方。
乙型脑炎减毒活疫苗说明书
成都生物制品研究所
通用名称:
乙型脑炎减毒活疫苗
功能主治:
接种本疫苗后,可刺激机体产生抗乙型脑炎病毒的免疫力,用于预防流行性乙型脑炎。
用法用量:
1.按标示量加入疫苗稀释液,待完全复溶后使用。
2.于上臂外侧三角肌下缘附着处皮下1次注射。
3. 8月龄儿童首次注射0.5ml;分别于2岁和7岁再各注射0.5ml,以后不再免疫。
英文名称:PoliomyelitisVaccineInDrageeCandy(HumanDiploidCell),Live
规格:
每粒糖丸重1g。
成分:
本品系用脊髓灰质炎病毒减毒株接种于人二倍体细胞。
贮藏:
-20℃以下避光保存和运输。
适应症:
主要为2个月龄以上的儿童。全年均适宜接种。
用法用量:
基础免疫为3次。首次免疫从2月龄开始,连续口服3次,每次间隔4-6周,4岁再加强免疫1次,每1次人用剂量1粒。其他年龄组在需要时也可以服用。
【注意事项】
1注射于上臂三角肌内。2应备有肾上腺素,在过敏反应时使用。3用前摇匀,有摇不散的块状物不得使用。4另有乙肝基因工程疫苗为中国仓鼠卵巢细胞分泌的乙肝表面抗原加佐剂氢氧化铝制成,每支10μg,用法同本品。
生物制品注册分类及申报资料项目要求

生物制品注册分类及申报资料项目要求目录一、生物制品注册分类 (2)1. 生物制品通用分类 (2)1.1 基因工程疫苗 (3)1.2 细胞工程疫苗 (4)1.3 蛋白亚单位疫苗 (6)1.4 重组载体疫苗 (6)1.5 其他疫苗 (8)2. 治疗用生物制品 (9)2.1 治疗用生物制品 (10)2.2 预防用生物制品 (12)3. 诊断用生物制品 (14)二、申报资料项目要求 (15)1. 综述资料 (16)1.1 产品概述 (17)1.2 研发历程 (18)1.3 研发背景 (20)1.4 非临床研究总结 (21)1.5 临床研究总结 (22)2. 药学资料 (23)2.1 原料及辅料 (24)2.2 制备工艺 (25)2.3 鉴别方法 (27)2.4 分析方法 (28)2.5 稳定性研究 (29)2.6 无菌检查 (30)2.7 内毒素检查 (31)2.8 微生物限度检查 (31)3. 临床资料 (33)3.1 临床试验方案 (34)3.2 临床试验报告 (35)3.3 临床数据统计分析 (36)3.4 不良反应监测与评价 (38)3.5 临床试验总结 (38)4. 药品说明书和标签样稿 (39)5. 包装、标签及说明书样稿 (41)一、生物制品注册分类预防用生物制品:指用于预防、减轻、治疗人类疾病的疫苗类制品,包括重组蛋白疫苗、重组病毒疫苗、核酸疫苗、炭疽疫苗等。
治疗用生物制品:指用于治疗、诊断人类疾病的治疗性生物制品,包括但不限于抗体药物、基因工程蛋白质药物、细胞治疗产品、免疫疗法产品等。
特殊用途生物制品:指用于特殊人群(如儿童、老年人、孕妇等)或特定疾病状况的生物制品,如免疫球蛋白、血液制品、组织工程产品等。
生物类似药:指在已上市生物制品基础上进行改进,其质量、安全性和有效性与已上市生物制品相当,且具有明显临床优势的生物制品。
生物创新药:指在研发过程中具有全新机制、疗效或结构的生物制品,包括全新的治疗性生物制品和新型疫苗等。
基因工程疫苗

基因工程疫苗发布时间:2012-03-09 |基因工程疫苗是用基因工程方法或分子克隆技术,分离出病原的保护性抗原基因,将其转入原核或真核系统使表达出该病原的保护性抗原,制成疫苗,或者将病原的毒力相关基因删除掉,使成为不带毒力相关基因的基因缺失苗。
戊肝疫苗研制基因工程疫苗是用基因工程方法或分子克隆技术,分离出病原的保护性抗原基因,将其转入原核或真核系统使表达出该病原的保护性抗原,制成疫苗,或者将病原的毒力相关基因删除掉,使成为不带毒力相关基因的基因缺失苗。
包括多肽或亚单位疫苗、颗粒载体疫苗、病毒活载体疫苗、细菌活载体疫苗、基因重配疫苗以及基因缺失疫苗如乙肝疫苗等。
2012年1月11日——一个原本并不特殊的日子,却因一份捷报而注定要被载入史册。
科技部在这一天宣布:由厦门大学和养生堂万泰公司联合研制的“重组戊型肝炎疫苗(大肠埃希菌)”已获得国家一类新药证书和生产文号,成为世界上第一个用于预防戊型肝炎的疫苗。
这是50年来,人类在经受了10余次万人以上的戊肝重大疫情后等来的一份捷报。
14年“磨”出世界第一戊肝疫苗的成功研发,标志着我国在生物制药原始创新领域取得重大突破,它的面世让中国在基因工程病毒疫苗的原始创新上实现了零的突破。
11.3万人、30余万针次的研究显示,该疫苗具有良好的安全性和保护性。
2月28日,疫苗研发团队的核心成员——厦门大学国家传染病诊断试剂与疫苗工程技术研究中心主任夏宁邵教授,在接受科技日报记者采访时表示:“重组戊肝疫苗是迄今唯一使用大肠杆菌表达系统研制的病毒疫苗。
它的成功研制扭转了国际医药界中‘原核系统不能用于病毒疫苗研制’的传统认识。
”“传统的疫苗研制方法主要有两种途径。
一种是将病毒放在细胞内进行大量培养、灭活,再辅以佐剂,用这种方法制成的疫苗叫灭活疫苗;第二种是将病原体在体外反复传代,去除其致病性,但保留其免疫原性,用这种方法制成的疫苗叫减毒活疫苗。
而我们这次是采用的基因工程技术。
四价流感病毒裂解疫苗说明书

核准日期:2023年02月21日修改日期:2023年03月10日四价流感病毒裂解疫苗说明书2023/2024株(婴幼儿剂量)请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:四价流感病毒裂解疫苗英文名称:Influenza Vaccine (Split Virion), Inactivated, Quadrivalent汉语拼音:Sijia Liugan Bingdu Liejie Yimiao【成份和性状】本品在轻摇后为微乳白色液体。
本品系用世界卫生组织(WHO)推荐的甲型和乙型流行性感冒(简称流感)病毒株分别接种鸡胚,经培养、收获病毒液、纯化、裂解、病毒灭活后制成。
-主要成分:每0.5mL含以下毒株的抗原:A/Victoria/4897/2022 (H1N1)pdm09-like virus…………………15µg血凝素A/Darwin/9/2021 (H3N2)-like virus………………………………15µg血凝素B/Austria/1359417/2021 (B/Victoria lineage)-like virus…………15µg血凝素B/Phuket/3073/2013 (B/Yamagata lineage)-like virus ……………15µg血凝素本疫苗生产用毒株符合WHO对本流感季节的推荐(北半球)。
因WHO 每年均推荐当年的流感疫苗生产株,因此每年的生产毒株可能不同。
-其他成分:含氯化钠、磷酸氢二钠二水合物、磷酸二氢钾、氯化钾和注射用水的缓冲液。
-已知残留物:本品可能会含有痕量的鸡蛋成分如卵清蛋白,以及制造过程中使用的新霉素、甲醛和Triton X-100。
【接种对象】本品用于6~35月龄儿童的主动免疫,尤其推荐易发生相关并发症的人群。
【作用与用途】接种本疫苗后,可刺激机体产生抗流行性感冒病毒的免疫力。
用于预防疫苗相关型别流感病毒引起的流行性感冒。
用MDCK细胞生产灭活流感病毒疫苗

对于瘤性和成瘤性细胞作为细胞基质的担忧1,瘤性和成瘤性细胞可以形成肿瘤,有可能转化受体人群形成肿瘤。
解决方法:通过去除完整细胞来解决。
2,外源因子,可以诱导瘤性和成瘤性表型的外源因子可能存在于细胞中,瘤性和成瘤性细胞有更好的支持病毒生长的能力,所以可能存在外源物质。
解决方法:(1)通过限制瘤性和成瘤性细胞的使用,(2).扩大对致瘤性物质和其他相关物质的检测。
3,在瘤性和成瘤性细胞中存在的DNA可能是致瘤性或有感染性的物质。
解决方法:(1). 在动物体内对细胞基质DNA的致瘤性进行检测,(2).降低细胞残留DNA的含量,(3).降低功能性(分子大小和其他性质)残留DNA的含量。
4,病毒宿主和病毒细胞的相互作用,疫苗病毒包装的细胞DNA或者细胞成分是致瘤的。
解决方法:(1).证明最终的疫苗制品中不包含具有转化性质的DNA,(2).这对于细胞质中的RNA病毒(如流感病毒)不是问题,(3).通过灭活病毒方法制造疫苗。
5,用瘤性或者成瘤性细胞生产疫苗可能存在永生化和成瘤性相关的其他机制(致瘤性蛋白、RNA或其他可以诱导后天遗传改变的因子)对受体人群造成风险。
解决方法:(1).科学界的共识是这种其他机制存在的可能性不大,(2).使用弱成瘤性的细胞作为基质。
6,以前使用的成瘤性实验还不能充分确定成瘤性表型和使用成瘤性细胞的相关风险。
用MDCK细胞生产灭活流感病毒疫苗-VRBPAC meeting 2005-11-6流感的疾病影响:流感病毒每年冬季流行,约10-20%的世界人口被感染,在美国,2500万到5000万人被感染,导致2万人死亡和11万人住院,造成约120亿美元的健康负担。
世界范围的流感大流行有三次,1918-1919年西班牙流感流行导致2000万-4000万人死亡,1957年亚洲和1968年香港的流感流行导致150万人死亡。
流感疫苗需求:在美国常规免疫需要1.8亿人口的流感疫苗而且还在增加,目前鸡胚生产流感疫苗不能满足需求,也不能对变化的疫苗需求进行灵活应对。
消除艾滋病、梅毒和乙肝母实施方案

消除艾滋病、梅毒和乙肝母实施方案目录一、前言 (2)二、实施目标 (2)2.1 总体目标 (3)2.2 具体目标 (3)三、实施策略 (4)3.1 预防措施 (5)3.1.1 健康教育 (7)3.1.2 安全套推广 (8)3.1.3 避孕措施 (9)3.2 治疗措施 (10)3.2.1 抗病毒治疗 (11)3.2.2 抗菌治疗 (13)3.2.3 必需抗病毒药物使用 (13)3.3 疫苗接种 (15)3.3.1 新生儿乙肝疫苗接种 (16)3.3.2 高危人群疫苗补种 (17)四、实施计划 (17)4.1 时间表 (18)4.2 责任分工 (19)4.3 预算与资源分配 (20)五、监测与评估 (21)5.1 监测指标 (21)5.2 评估方法 (23)5.3 持续改进 (23)六、风险管理 (25)6.1 风险识别 (26)6.2 风险评估 (27)6.3 风险应对措施 (28)一、前言随着全球范围内艾滋病、梅毒和乙肝等传染病的蔓延,这些疾病已经对人类健康和社会发展造成了严重威胁。
为了有效控制和消除这些疾病的危害,各国政府和国际组织纷纷采取了一系列措施,包括加强宣传教育、推广疫苗接种、提供医疗救助等。
要彻底消除这些疾病的影响,还需要制定一个全面的实施方案,从多个层面入手,形成合力。
二、实施目标降低艾滋病母婴传播率:通过本方案的实施,努力降低艾滋病母婴传播的发生率,确保母婴的身体健康。
控制梅毒感染:积极开展梅毒防控工作,有效控制梅毒在母婴之间的传播,降低母婴感染率。
降低乙肝感染率:加强对乙肝的防控,减少乙肝病毒的传播,特别是在母婴间的传播。
提高母婴健康水平:通过全面干预措施的实施,提高母婴的整体健康水平,确保新生儿的健康成长。
促进群众意识提高:增强广大群众对艾滋病、梅毒和乙肝的防控意识,形成全社会共同参与的防控氛围。
2.1 总体目标普及知识:提高公众对艾滋病、梅毒和乙肝母婴传播的认识,增强自我保护意识,减少歧视和恐惧。
重组乙肝疫苗(汉逊酵母)的介绍

10. 再与氢氧化铝共沉淀,此时抗原吸附在氢氧化铝上
纯度测定
乙肝疫苗是通过肌肉注射的方式进入人体系统,为了降低疫苗内杂质含量对人体产生的 不良影响,必须进行疫苗的纯度检测。
乙肝疫苗表面抗原的纯度检定是疫苗质量控制的关键手段之一。目前分析测定重组乙 型肝炎疫苗纯度的HPLC常用方法是应用TSK-G5000PW分子筛。中国药品生物制品检定所 疫苗二室曾报道应用该系统对Merck酿酒酵母重组乙肝疫苗和CHO细胞重组乙肝疫苗进行 纯度分析,可获得良好的分离效果。对重组汉逊酵母乙肝疫苗,现有的HPLC检测系统应用 0.1mol/L DTT与1:50吐温80等量混合处理后能有效地检测不同类型重组乙肝疫苗表面抗原 的纯度。
疫苗保存
疫苗的稳定性较差,一般在2~8℃下能保存12个月,但当温度升高后,效力很快降低。 在37℃下,许多疫苗只能稳定几天或者几个小时,非常不利于在室温下运输。为了使疫苗 的稳定性提高,可用冻干的方法使之干燥。这样,疫苗的有效期往往可延长1倍或以上,在 室温下其效价的损失亦较慢。 冻干要点是: (1)冷冻,即将疫苗冷冻至共熔点以下。 (2)真空升华,即在真空状态下降水分直接由固态升华为气态。 (3)升温缓慢,即升温的过程尽量缓慢,不使疫苗在任何时间下有融解的情况发生。 (4)冻干好的疫苗应在真空或充氮气后密封保存,使其残余水分保持在3%以下。这样的 疫苗能保持良好的稳定性。
4.细胞破碎后加入表面活性剂使抗原溶解。
5.粗细胞裂解物用0.2微米中空纤维柱进行微滤。抗原和大部分 低分子量宿主细胞内含物通过滤膜,细胞碎片被膜拦截。
6.滤液再进行超滤,此时抗原被膜拦截而低分子浪宿主细胞内含 物通过滤膜除去
乙肝疫苗生产发展简介文档

国内主要的乙肝疫苗生产厂家
厂家
北京天坛生物制品 股份有限公司(北京 生物制品研究所)
疫苗
重组酿酒酵母乙肝疫 苗
深圳康泰生物制品 公司
华北药厂和长春生 物制品研究所等
大连高新(汉信)公 司 和华兰生物疫苗
重组酿酒酵母乙肝疫 苗
重组CHO细胞乙肝 疫苗
重组汉逊酵母乙肝疫 苗
国内乙肝疫苗生产厂家工艺比较
病毒)-----通过改变培养条件,获得 不再致病微生物---培养不再致病微生 物,获得大量的不再致病微生物---铝 吸附-----减毒活疫苗。
乙肝病毒的体外培养至今没有成功
• 前面,我们已经讲过,细菌要在培养基中
繁殖,病毒要在细胞中繁殖,比如,流感 病毒在鸡胚细胞中生长,狂犬病毒要在地 鼠肾细胞中生生长,乙脑病毒要在vero细 胞中生长。可是乙肝病毒在所有实验过的 细胞中都不能生长。乙肝疫苗的研究受到 了严重的困难。人们不得不寻求其他的途 径去生产乙肝疫苗。
• 10, 大连高新(汉信)生物制药从
1998年开始重组汉逊酵母乙肝疫 苗的研制工作,在2002年6月获得 了国家药品监督管理局颁发的“新 药证书”,在2003年开始商业化生 产。
• 11 ,华兰生物在 年也将开始重组
汉逊酵母乙肝疫苗的生产。
乙肝疫苗的发展
• 第一代乙肝疫苗;血源性乙肝疫苗。
• 第二代乙肝疫苗;基因工程乙肝疫苗
基因工程乙肝疫苗。
国外主要的乙肝疫苗生产厂家
厂家
疫苗
美国默克公司 Merck
重组酿酒酵母乙肝疫 苗
比利时史克公司 Smith kline
重组酿酒酵母乙肝疫 苗
法国巴斯德研究所 重组CHO细胞乙肝 Pasteur Merieux 疫苗
流感疫苗十大品牌简介

品牌市场地位
市场占有率
一些品牌在流感疫苗市场上占据 了较大的份额,具有较高的市场
占有率。
影响力
这些品牌在行业内具有较高的知名 度和影响力,对市场和消费者具有 较大的影响。
竞争力
这些品牌在产品质量、技术水平、 市场营销等方面具有较强的竞争力 ,能够抵御来自其他品牌的竞争压 力。
02
品牌产品线
疫苗种类与适用人群
根据收集到的数据,分析消费者对品牌的认知度和满意度的变化趋势 ,为品牌营销策略的制定提供参考。
消费者对品牌产品的评价与反馈意见收集整理情况介绍
1 2 3
产品评价
通过收集消费者对品牌产品的评价,包括产品的 安全性、有效性、使用便利性等方面,以了解消 费者对产品的认可程度。
反馈意见
通过调查问卷、在线咨询等方式,收集消费者对 品牌产品的反馈意见,包括产品改进建议、使用 过程中遇到的问题等。
品牌服务体系与售后服务支持
完善的销售网络
建立完善的销售网络,覆盖全国 各大城市和地区,方便消费者购
买。
专业的售后服务
提供专业的售后服务,解答消费 者在使用过程中遇到的问题。
售后服务支持
提供及时的售后服务支持,确保 消费者在使用过程中得到及时有
效的帮助和支持。
04
品牌竞争格局与市场前景
品牌竞争格局分析
流感疫苗十大品牌简介
汇报人: 2023-12-18
目录
• 品牌概述 • 品牌产品线 • 品牌优势与特色 • 品牌竞争格局与市场前景 • 消费者评价与口碑传播
01
品牌概述
品牌定义与特点
品牌定义
流感疫苗品牌是指专注于研发、 生产、销售流感疫苗的企业或机 构所拥有的品牌。
常见疫苗数据库
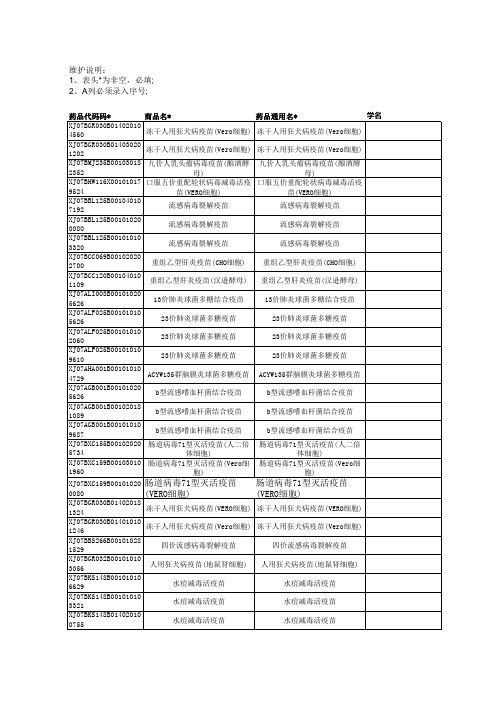
预防接种疫苗 预防接种疫苗 预防接种疫苗 预防接种疫苗 预防接种疫苗 预防接种疫苗
药品剂型* 冻干粉针 冻干粉针 注射剂 口服溶液剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂
1324
冻干人用狂犬病疫苗(VERO细胞) 冻干人用狂犬病疫苗(VERO细胞)
XJ07BGR030B01401010
1246
冻干人用狂犬病疫苗(Vero细胞) 冻干人用狂犬病疫苗(Vero细胞)
XJ07BBS266B00101028 1529
四价流感病毒裂解疫苗
四价流感病毒裂解疫苗
XJ07BGR032B00101010
批发价
国家限价
151 810 153 187 339 339
费用分类* 国药准字 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费
公司代码
产地
1盒 1盒 1盒 1盒 1盒 1瓶
是否基本药物 基本药物类型
来源分类(1国产2进 口)
有效标识* 零售价* 100
272
1310
293
37.3
60
59
141
81.4
569
213
210
224
95
136
86
127
大连汉信生物制药有限公司流行性感冒病毒裂解疫苗项目

1、总论1.1 项目背景大连汉信生物制药有限公司利用其在人用疫苗研制领域的领先技术,研发出成本低、纯度高、免疫效果好,适合工业化生产和大规模人群接种的流行性感冒病毒裂解疫苗。
为早日实现科研成果的产业化,向社会提供预防流感的有效屏障,减少流感流行造成的危害,汉信公司拟投资6000万元,在企业厂内西侧空地内进行流行性感冒病毒裂解疫苗项目的建设,达产后将形成年产流行性感冒病毒裂解疫苗300万人份的生产规模。
1.2 建设地点大连汉信生物制药有限公司流行性感冒病毒裂解疫苗项目拟建于汉信公司现有企业厂内西侧空地。
汉信公司位于大连经济技术开发区49#地块,具体地理位置见图1-1。
1.3 环境敏感保护目标根据现场踏勘,确定本次评价的环境敏感保护目标,具体见表1-1。
表1-1 环境敏感目标注:“相对方位”以汉信公司厂址为基准点,“距离”是指保护目标与厂界的最近距离。
汉信公司厂址比例尺1:82000图1-1 汉信生公司地理位置图2、现有企业回顾性评价2.1 现有企业概况汉信公司现主要进行重组(酵母)乙型肝炎疫苗的生产,年产量为1000万人份(3000万支)。
现有企业项目组成情况见表2-1。
表2-1 现有企业项目组成2.2 生产工艺流程根据调查,汉信公司现有企业目前主要进行了重组(酵母)乙型肝炎疫苗的生产,其生产工艺流程可分为乙型肝炎疫苗的生产工序和西林瓶分装工序两个部分。
1、重组(酵母)乙肝疫苗生产工序图2-1 重组(酵母)乙型肝炎疫苗生产工艺流程2、西林瓶分装工艺流程图2-2 西林瓶分装工艺流程2.3 现有企业污染物排放汇总大连汉信生物制药有限公司现有污染物排放情况汇总见表2-2。
表2-2 现有主要污染物汇总2.4 现有企业存在的环保问题通过对厂区现有污染状况调查,发现企业存在一定的环保问题,如现有污水处理设施实际运行效果并不理想,总排污口浓度虽然能够达标排放,但却一直处于较高的水平。
为此,汉信公司计划利用本项目建设的机会,对现有污水处理设施进行改造,拟增加生化处理工序,进一步减少废水污染物的排放。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
流感病毒裂解疫苗(2014/2015)使用说明
请仔细阅读说明书并在医师指导下使用。
【药品名称】
通用名称:流感病毒裂解疫苗
英文名称:Influenza Vaccine(Split Virion),Inactivated
汉语拼音:Liugan Bingdu Liejie Yimiao
【成份和性状】
本品系用世界卫生组织(WHO)当年推荐的并经国家食品药品监督管理局批准的流行性感冒(简称流感)病毒株,分别接种鸡胚,经培养、收获病毒液,纯化、病毒灭活、裂解后制成。
为微乳白色液体。
有效成分:每0.5ml含
A/California/7/2009(H1N1)pdm09-like virus(NYMC X-181)……………15µg血凝素A/Texas/50/2012(H3N2)-like virus(NYMC X-223)………………………15µg血凝素
B/Massachusetts/2/2012-like virus(NYMC BX-51B)………………………15µg血凝素辅料成分:氯化钠、磷酸氢二钠、磷酸二氢钠、硫柳汞。
【接种对象】
3岁以上易感者及易发生相关并发症的人群,如儿童、老年人、体弱者、流感流行地区人员等。
【作用与用途】
接种本疫苗后,可刺激机体产生抗流感病毒的免疫力。
用于预防本型流感病毒引起的流感。
【规格】
每瓶0.5ml。
每1次人用剂量为0.5ml(成人及3岁以上儿童),含各流感病毒株血凝素应为15µg。
【免疫程序和剂量】
(1)于上臂外侧三角肌肌内注射。
(2)于流感流行季节前或期间进行预防接种。
成人及3岁以上儿童接种一针,注射剂量为0.5ml。
【不良反应】
常见的不良反应
(1)一般接种后24小时内,注射部位可出现疼痛、触痛、红肿和瘙痒,多数情况下于2~3天内自动消失。
(2)受种者在接种疫苗后可能出现一过性发热反应,短期内自动消失,不需处理。
罕见的不良反应
(1)可出现一过性感冒症状和全身不适,可自动消失,不需特别处理。
(2)严重发热反应(体温>39℃):应采用物理方法及药物对症处理,以防高热惊厥。
极罕见不良反应
(1)过敏性皮疹:一般在接种疫苗后72小时内出现荨麻疹,出现反应时,应及时就诊,给予抗过敏治疗。
(2)过敏性紫癜:出现过敏性紫癜反应时应及时就诊,应用皮质固醇类药物给予抗过敏治疗,治疗不当或不及时有可能并发紫癜性肾炎。
(3)过敏性休克:一般在接种疫苗后1小时内发生。
应及时注射肾上腺素等抢救措施进行治疗。
【禁忌】
(1)已知对该疫苗所含任何成份,包括辅料、甲醛、裂解剂及抗生素过敏者。
(2)患急性疾病、严重慢性疾病、慢性疾病的急性发作期、感冒和发热者。
(3)妊娠期妇女。
(4)未控制的癫痫和其他进行性神经系统疾病者,有格林巴利综合征病史者。
【注意事项】
(1)以下情况者慎用:家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者。
(2)疫苗瓶有裂纹、标签不清或失效者、疫苗出现浑浊等外管异常者均不得使用。
(3)疫苗开启后应立即使用。
(4)应备有肾上腺素等药物,以供偶有发生的严重过敏反应时急救用,接受注射者在注射后应在现场观察至少30分钟。
(5)注射免疫球蛋白者应至少间隔1个月以上接种本疫苗,以免影响免疫效果。
(6)注射后出现任何神经系统反应者,禁止再次使用。
(7)严禁冻结!
【贮藏】于2~8℃避光保存和运输。
【包装】内包材为西林瓶,0.5ml/瓶;10瓶/盒。
【有效期】12个月。
【执行标准】YBS00572012
【批准文号】国药准字S2*******
【生产企业】
生产单位:大连汉信生物制药有限公司。
