实验1实验动物的捉持法和给药法
药理学动物实验基本方法

右手拿注射器, 针尖的斜面朝 上,将针 头从远心端插 入血管
回抽有血即可
注射,拔针后 用棉球止血
豚鼠可用足 背静脉注射
实验动物的 给药.MPG
二、实验动物的采血
1 尾尖采血
眼眶静脉丛采血
2
断头采血 腹主动腹脉主动采脉血采血 心脏采血 静脉采血
3 4 5 6
1
尾尖采血
方法:固定动物并露出鼠尾,将尾部在45℃的温水中 浸泡数分钟(或以二甲苯棉球涂擦),使尾部血管扩 张。将鼠尾擦干,用锐器切去尾尖0.3~0.5cm,让血 液滴入盛器或直接以血红蛋白吸管吸取。 对象:大、小鼠 特点:小量采血,可以多次采血。
药理学动物实验基本方法
药学院药理学科组
Contents
1 实验动物的捉持与给药 2 实验动物的采血 3 实验动物的编号和分组 4 实验动物的麻醉
一、捉持与给 药
小鼠 大鼠 豚鼠 家兔 犬
•小鼠的捉持
1、用右手拇指 和食指捏住小鼠 尾巴中部将小鼠 提起,放在饲养 合的面罩上。
用左手拇指和 食指迅速、准 确地捏住小鼠 的两耳后及颈 背部的皮肤, 将小鼠提起。
笼或大小鼠固定 器的孔拉出鼠尾 巴
用左手捏住鼠 尾巴中下部, 用75%
酒精棉球反 复擦拭尾部
大鼠亦可用 舌下静脉注
射
注射时,以左 手拇指和中指 捏住鼠尾两侧, 用食指从下面 托起尾,
右手持4号针 头的注射器, 使针头与
静脉平行 (小于30度角)
•静脉注射给药——犬
前肢皮下头静脉 或后肢小隐静脉 注射 。
用右手食指将 针栓慢慢往下 压,将注射器 中的药液灌入 动物的胃中。
•灌胃给药——兔
将兔放进固 定架
内,灌胃者用左 手拇指和中指挤 压兔两颊,将下 颌挤开使兔被动 张口。
实验一实验动物的捉拿和给药方法

×
➢ 肌内注射法 部位:小鼠臀部外侧肌肉。
➢ 皮下注射法 部位:背部皮下 方法:轻轻拉起背部皮肤,将注射针头刺入皮下,
稍稍摆动针头,若容易摆动则表明针尖的位置确定在皮下, 拔针时,轻捏针刺部位片刻,以防药液逸出。
➢ 尾静脉注射法
1010只只组组方法方法小白鼠的捉拿及给药方法小白鼠的捉拿及给药方法兔子的捉拿及给药方法兔子的捉拿及给药方法捉住小白鼠的尾巴提起转几圈捉住小白鼠的尾巴提起转几圈放在鼠笼盖铁纱网上放在鼠笼盖铁纱网上轻轻向后拉鼠尾然后用左手的拇指与食指沿其背部向前抓轻向后拉鼠尾然后用左手的拇指与食指沿其背部向前抓住其颈部皮肤住其颈部皮肤使腹部朝上左手的无名指及小指压住鼠尾使腹部朝上左手的无名指及小指压住鼠尾使小白鼠完全固定
表面消毒药
75%为体积/体积比
C1V1= C2V2 95%乙醇 :70ml 蒸馏水:25ml
95%*70=70%*95
实验二、常用药物制剂的配制
5%(g/ml)碘酊的配制
表面消毒药 5%为质量/体积比
碘片
5.0g ( 5%(g/ml) )
碘化钾 2.0g ( 2%(g/ml) )
蒸馏水 20mL
95%乙醇加至 100mL
助扩散。
实验动物处理
➢ 小鼠处死(防鼠患):
一手按头,一手拉尾,咔嚓一声。
➢ 家兔处死: 空气针
试验后安排
➢ 班长安排人将动物尸体送兽医院焚烧池 ➢ 各小组清理自己的台面 ➢ 班长安排人打扫卫生
讨论(作业)
实验动物的捉拿和给药方法 操作过程中的注意事项。
实验二、常用药物制剂的配制
75%乙醇溶液的配制
实验动物的捉拿和给药方法

实验一实验动物的捉拿和给药方法【目的】结合实验内容逐步学会实验常用动物的捉拿和给药方法。
【内容】(一)小自鼠的捉拿和给药方法1.捉拿法用右手捉住小白鼠的尾巴将鼠提起.置于鼠笼上面或其他粗糙面上,向后拉轻鼠尾,迅速用左手拇指和示指挥住其两耳及头部皮肤,翻转鼠体,使腹部朝上,然后以无名指及小指压往鼠尾,使小鼠完全固定(实验图1).实验图1 小白鼠的捉拿法2.给药方法(1)灌胃将小白鼠固定后,使口部向上,将颈部拉直,右手持灌胃器自口角插入口腔,沿上颚轻轻进入食管,如动物安静,呼吸元异常、口唇无紫绀现象,即可注入药液(实验图2).灌胃器0.1一O.25ml/10g。
实验图2 小白鼠灌胃器(左)和灌胃法(布)(2)腹腔注射将小白鼠固定后,右手持注射器自下膜一侧向头部方向以30~45度刺入腹腔(角度太小易刺入皮下)。
针头刺入不宜太深或太近上腹部,以免刺伤内脏,注射量一般为0.1~O.2 ml/10g 。
(3)皮下注射捉鼠方法同前,右手持注射器,将计头刺人背部皮下注人药液。
注射量一般不超过0.25 ml/10g。
(4)肌内注射由两人合作,一人固定小白鼠后,另一入持注射器,将针头刺入后肢外侧肌肉内注入药液,注射量为每腿不超过0.lml。
(二)螗蜍或蛙的捉拿和给药方法1.捉拿法通常用左手握蛙,食指和中指夹住蛙的两上肢,无名指和小指夹住蛙的两下肢,将蛙固定于手中。
2.给药方法(淋巴囊注射) 蛙皮下淋巴囊分布见实验图3。
多采用腹囊给药。
由于蛙的皮肤弹性差,被针头刺破后,针眼不易闭合会便药波外溢,故注射针头必须通过一层隔膜,再进人皮下淋巴囊。
如腹囊绐药时,针头应自大腿上端刺人,经过大腿肌层入腹壁肌层.再浅出进人腹壁皮下入腹囊。
注射量每只可达0.25—1.Oml.(三)家免的捉拿和给药方法1.捉拿祛用左手抓住颈背部皮肤将兔提起,以右手托住其臀部,使兔呈坐位姿势。
2.给药方法(1)灌胃两人合作,由一人固定兔身,另一人用兔开口器(实验图4)将兔口张开,并将兔舌压在开曰器下边横放于兔口中。
实验动物的捉拿和给药方法

实验一实验动物的捉拿和给药方法【目的】结合实验内容逐步学会实验常用动物的捉拿和给药方法。
【内容】(一)小自鼠的捉拿和给药方法1.捉拿法用右手捉住小白鼠的尾巴将鼠提起.置于鼠笼上面或其他粗糙面上,向后拉轻鼠尾,迅速用左手拇指和示指挥住其两耳及头部皮肤,翻转鼠体,使腹部朝上,然后以无名指及小指压往鼠尾,使小鼠完全固定(实验图1).实验图1 小白鼠的捉拿法2.给药方法(1)灌胃将小白鼠固定后,使口部向上,将颈部拉直,右手持灌胃器自口角插入口腔,沿上颚轻轻进入食管,如动物安静,呼吸元异常、口唇无紫绀现象,即可注入药液(实验图2).灌胃器0.1一O.25ml/10g。
实验图2 小白鼠灌胃器(左)和灌胃法(布)(2)腹腔注射将小白鼠固定后,右手持注射器自下膜一侧向头部方向以30~45度刺入腹腔(角度太小易刺入皮下)。
针头刺入不宜太深或太近上腹部,以免刺伤内脏,注射量一般为0.1~O.2 ml/10g 。
(3)皮下注射捉鼠方法同前,右手持注射器,将计头刺人背部皮下注人药液。
注射量一般不超过0.25 ml/10g。
(4)肌内注射由两人合作,一人固定小白鼠后,另一入持注射器,将针头刺入后肢外侧肌肉内注入药液,注射量为每腿不超过0.lml。
(二)螗蜍或蛙的捉拿和给药方法1.捉拿法通常用左手握蛙,食指和中指夹住蛙的两上肢,无名指和小指夹住蛙的两下肢,将蛙固定于手中。
2.给药方法(淋巴囊注射) 蛙皮下淋巴囊分布见实验图3。
多采用腹囊给药。
由于蛙的皮肤弹性差,被针头刺破后,针眼不易闭合会便药波外溢,故注射针头必须通过一层隔膜,再进人皮下淋巴囊。
如腹囊绐药时,针头应自大腿上端刺人,经过大腿肌层入腹壁肌层.再浅出进人腹壁皮下入腹囊。
注射量每只可达0.25—1.Oml.(三)家免的捉拿和给药方法1.捉拿祛用左手抓住颈背部皮肤将兔提起,以右手托住其臀部,使兔呈坐位姿势。
2.给药方法(1)灌胃两人合作,由一人固定兔身,另一人用兔开口器(实验图4)将兔口张开,并将兔舌压在开曰器下边横放于兔口中。
药理实验

实验一常用动物的捉拿与给药方法【实验目的】1、了解小鼠的饲养方法2、练习并掌握小鼠的捉拿与给药方法【实验材料】1、器材:鼠笼、饮水瓶、大烧杯、托盘天平、灌胃器、注射器、棉签2、药品:生理盐水、苦味酸溶液、75%酒精3、动物:小白鼠,20~30g【实验方法】1、捉拿与固定:用右手捉住鼠尾,将其提起置于鼠笼或者粗糙平面上,向后轻拉鼠尾,用左手的拇指和食指抓住小鼠两耳及颈背部皮肤,将小鼠置于左手掌心,以小指夹住小鼠尾巴即可。
2、给药法⑴灌胃:将小鼠固定,口朝上,颈部拉直,右手持灌胃针,先从口角处插入口腔,再沿上颚轻轻插入食管。
一般给药剂量。
⑵腹腔注射:将小鼠固定,右手持注射器自下腹部一侧刺入皮下后,再刺入腹腔,缓慢注入药物。
一般给药剂量。
⑶皮下注射:两人合作,一人左手抓住小鼠头部,右手拉住小鼠尾巴固定小鼠,另外一人用左手提起皮肤,右手持注射器刺入皮下注入药物。
一般给药剂量为肌肉注射:最好两人合作,一人固定小鼠,另外一人将针头迅速垂直刺入后肢外侧肌肉,回抽无回血即可注入药物,一侧给药剂量为。
⑸静脉注射:一般采用尾静脉注射。
将小鼠固定,使尾巴露出来,在50℃热水中浸泡或者用75%酒精擦拭尾巴,使血管扩张,左手拉住鼠尾,右手持注射器,从鼠尾巴末梢开始进针,注入药液。
一般给药剂量为【心得体会】实验二不同给药途径对药物作用的影响【实验目的】观察不同给药途径对药物作用的影响【实验材料】4、器材:大烧杯、托盘天平、灌胃器、注射器、棉签少许5、药品:10%硫酸镁溶液、5%氯化钙溶液、苦味酸溶液6、动物:小鼠,18~22g【实验方法】1、取小鼠3只,称重编号,分别放入大烧杯中,观察小鼠的正常活动,记录半个小时内活动、呼吸、粪便情况。
2、给药:一号小鼠灌胃10%硫酸镁溶液10g二号小鼠肌肉注射10%硫酸镁溶液10g三号小鼠静脉注射10%硫酸镁溶液10g3、观察小鼠的反应及活动,记录半小时内小鼠活动、呼吸及粪便变化。
4、当第三只小鼠出现垂头,俯卧时,立即静脉缓慢注射5%氯化钙溶液,直至恢复站立。
药理学动物实验基本方法

用左手托住兔 的臀部
家兔的固定方 式有腹卧式和 仰卧式两种
•犬的捉持
实验者先抚摩, 逐步接近,勿使 其惊恐或将其激 怒。
用粗棉绳兜住 狗的下颌,并 在上颌打结 (勿太紧)。
实验动物的捉 拿.MPG
如犬不合作, 则先用一根特 制长柄狗头夹, 从后面夹住犬 颈,限制犬头 部活动,再按 上述方法捆住 犬嘴。
回抽注射器针 栓,如有回血, 则证明针尖在 血管内,即可 推注药液。
•静脉注射给药——兔
兔放在固定架内, 酒精消毒并揉搓 血管,使兔的耳 缘静脉充盈。
用左手食指和中 指夹住兔的耳缘 静脉的近端,拇 指绷紧静脉的远 端,无名指和小 指放在耳郭下作 垫。
右手拿注射器, 针尖的斜面朝 上,将针 头从远心端插 入血管
4.分别在C2~C11、C12~C21 和C22~C31 单元格中,依次键入“1”、“2”、“3”;用鼠标同时选 中A、B、C 列,单击菜单栏“数据”→“排序”命令,在弹出的“排序”对话框中,选择以“编号” 为排序的“主要关键字”,这样就可以得到各个实验对象的分组编号。
5. 在“D1”中键入“分组号”,在“D2”、“D3”、“D4”和“D5”中分别依次键入“1”、“2”、 “3”和“4”,对余下的各个区组,同样依次输入“1”、“2”、“3”和“4”,作为同一区组内4 对象的分组号。
用左手捏住鼠 尾巴中下部, 用75%
酒精棉球反 复擦拭尾部
大鼠亦可用 舌下静脉注
射
注射时,以左 手拇指和中指 捏住鼠尾两侧, 用食指从下面 托起尾,
右手持4号针 头的注射器, 使针头与
静脉平行 (小于30度角)
前肢皮下头静脉 或后肢小隐静脉 注射 。
•静脉注射给药——犬
先将注射部位毛 剪去 。
动物实验的基本技术

三、动物实验的基本技术(一)实验动物的捉持方法1.青蛙和蟾蜍通常用左手握持,以食指和中指夹住左前肢,大拇指压住右前肢,右手将下肢拉直并固定于无名指和小指之间。
毁脑和脊髓时,左手食指和中指夹持青蛀或蟾蜍的头部,右手将探针经枕骨大孔向前刺入颅腔,左右摆动探针捣毁脑组织。
如需破坏脊髓,毁脑后退回探针刺入椎管即可。
2.小鼠右手提起鼠尾,放在鼠笼(或其它粗糙面)上,向后轻拉其尾,小鼠即固定于鼠笼上,迅速用左手拇指和食指捏住小鼠头颈部皮肤,并以左手小指、无名指压其尾部于手掌尺侧。
另一方法是只用左手,先用食指和拇指抓住小鼠尾巴后用手掌尺侧和小指夹住尾根部,然后用左手拇指和食指捏住头颈部皮肤。
3.大鼠捉持方法与小鼠相似。
因大鼠容易被激怒咬人,捉持时左手应戴防护手套。
右手抓住鼠尾,再用左手拇指和食指握住头部,其余手指与手掌握住脊部和腹部。
注意不要捏其颈部,以防用力过大、过久,造成窒息死亡。
4.豚鼠以左手直接从背侧握持前部躯干,右手托住臀部或抓住两后肢。
体重小者,可用单手捉持。
5.家兔一只手抓住兔颈背部皮肤,将兔轻轻提起,另一只手托住臀部,使兔呈蹲坐姿势。
切不可用手握持双耳提起兔子。
(二)实验动物的性别辨认、标记和去毛方法1.性别辨认鼠类:雄性小鼠和大鼠性器官与肛门距离较远,其间有被毛,阴囊明显可见。
雌性小鼠和大鼠性器官与肛门距离较近,其间无被毛,腹部乳头明显可见。
豚鼠性别辨认方法与小鼠和大鼠相同;家兔:雄兔泄殖孔附近,可见阴囊,用拇指和食指挤压泄殖孔部位,可露出阴茎。
雌兔腹部5对乳头明显可见。
2.标记小鼠、大鼠和兔多采用染色法,一般用1%的苦味酸溶液(黄色)或5%中性红溶液(红色)涂于动物体表不同部位的皮毛处,代表不同号码。
编号原则是先左后右,自前到后。
例如1号涂左前肢;2号涂左侧腹部;本号涂后肢;4号涂右前肢;5号涂右侧腹部;6号涂右后肢;7号涂头部;8号涂背部;9号涂尾部;10号不涂色。
如10只以上动物作标记时,可用两种不同颜色溶液,一种颜色作为个位数,另一种颜色作为十位数,涂在不同部位。
常见实验动物的捉持和给药方法

常见实验动物的捉持和给药⽅法常见实验动物的捉持和给药⽅法⼀、⼩⽩⿏的捉持和给药⽅法1、捉持⽅法右⼿提起⿏尾,放在粗糙物(如⿏笼)上⾯,轻向后拉其尾;此时⼩⿏前肢抓住粗糙⾯不动;⽤左⼿拇指和⾷指捏住双⽿及头部⽪肤,⽆名指、⼩指和掌⼼夹其背部⽪肤及尾部,便可将⼩⿏完全固定。
腾出右⼿,可以给药。
此外,也可单⼿捉持,难度较⼤,但速度快。
先⽤拇指和⾷指抓住⼩⿏尾巴,⽤⼩指、⽆名指和⼿掌压住尾根部,再⽤腾出的拇指、⾷指及中指抓住⿏双⽿及头部⽪肤⽽固定。
2、给药⽅法a.灌胃法⼩⿏固定后,使腹部朝上,颈部拉直,右⼿⽤带灌胃针头的注射器吸取药液(或事先将药液吸好),将针头从⼝交插⼊⼝腔,再从⾆背进沿上腭进⼊⾷道。
若遇阻⼒,应退出后再插,切不可⽤⼒过猛,防⽌损伤或误⼊⽓管导致动物死亡。
灌胃量⼀般不超过0.25ml/10g。
b.腹腔注射法抓⿏⽅法同上,右⼿持注射器(5~6号针头),从耻⾻联合上⼀侧向头端以30度⾓刺⼊腹腔(应避开膀胱)。
可先刺⼊⽪下2~3mm,再刺⼊腹腔,以防药液外漏。
针头刺⼊部位不宜太⾼太深,以免刺破内脏。
注射量⼀般为0.1~0.25ml/10g。
c.⽪下注射法⼀般两⼈合作。
⼀⼈左⼿抓住⼩⿏头部⽪肤,右⼿拉住⿏尾;另⼀⼈左⼿提⾼背部⽪肤,右⼿持住注射器(针头号同上),将针头刺⼊提起的⽪下。
若⼀⼈操作,左⼿⼩指和⼿掌夹住⿏尾,拇指和⾷指提起背部⽪肤,右⼿持注射器给药。
⼀般⽤量为0.05~0.25ml/10g。
d.肌⾁注射法两⼈合作时,⼀⼈抓⿏⽅法同上,另⼀⼈左⼿拉直⼀侧后肢,右⼿持注射器,注射部位多选后腿上部外侧(针头号同上)。
如⼀⼈操作,抓⿏⽅法类似腹腔注射,只是药液注射在肌⾁内。
每腿的注射量不宜超过0.1ml。
e.尾静脉注射法将⼩⿏置于待置的固定筒内,使⿏尾外露,并⽤酒精或⼆甲苯棉球涂擦,或插⼊40℃~50℃温⽔中浸泡⽚刻,使尾部⾎管扩张。
左⼿拉尾,选择扩张最明显的⾎管;右⼿持注射器(4~5号针头),将针头刺⼊⾎管,缓慢给药。
实验一 实验动物给药途径和方法.

实验一实验动物给药途径和方法一、动物的编号、捉拿和固定。
1、动物的编号犬、兔等动物可用特制的号码牌固定于耳。
白色家兔和小动物可用3-5%的黄色苦味酸溶液涂于毛上标号。
如编号1-10号时,将小白鼠背部分前肢、腰部、后肢的左、中、右部共九个区域,从右到左1-9号,第10号不涂黄色(图1-1)如加上其它颜色的染料还可进行1-100号和1-1000号等更多编号。
图1-1 小白鼠背部编号图1-2 小白鼠双手捉持法(引自:医学技能学实验教程. 白波. 2004)(引自:医学技能学实验教程. 白波. 2004)2、动物的捉拿和固定①小鼠:右手抓住其尾,放在实验台上或鼠笼铁纱网上,在其向前爬时,左手拇指及食指沿其背抓住两耳及头颈部皮肤,并以左手的小指和掌部夹住鼠尾固定。
另一抓法是只用手,用食指和拇指抓住鼠尾后再用小指和掌部夹住鼠尾,以拇指及食指捏住其颈部皮肤。
前一种方法易学,后一种方法便于快速捉拿。
(见图1-2,1-3)图1-3 小白鼠双手捉持法(引自:医学技能学实验教程. 白波. 2004)②大鼠:以右手或持夹子夹住尾巴,左手戴上防护手套固定头部防止被咬,应避免用力过大造成大鼠窒息死亡。
根据实验需要麻醉或固定大鼠于鼠笼内或用绳绑其四肢固定于大鼠手术板上。
③豚鼠:以右手抓住豚鼠头颈部,将其两前肢在豚鼠头与右手拇指与食指之间,轻轻扣住颈胸部,右手抓住两后肢(对体重较大的豚鼠则可托起其臀部),使腹部向上。
④兔:用手抓起兔脊背近后颈部皮肤,手抓面积应尽量大些。
以另一手托起兔的臀部。
将兔仰卧固定时,一手抓住颈部皮肤,另一只手顺着腹部抚摸至膝关节处压住关节。
另一人将绳子用活结捆绑兔的四肢,使兔腹部向上固定在兔手术台上。
头部则用兔头固定夹固定,也可用棉线将兔的门牙固定于兔手术台上的柱子上,后者更常用(图1-4)。
图1-4 家兔捉持法(引自:医学技能学实验教程. 白波. 2004)二、实验动物的去毛动物去毛是手术野的皮肤准备之一。
药理实验

实验一常用动物的捉拿与给药方法【实验目的】1、了解小鼠的饲养方法2、练习并掌握小鼠的捉拿与给药方法【实验材料】1、器材:鼠笼、饮水瓶、大烧杯、托盘天平、灌胃器、注射器、棉签2、药品:生理盐水、苦味酸溶液、75%酒精3、动物:小白鼠,20~30g【实验方法】1、捉拿与固定:用右手捉住鼠尾,将其提起置于鼠笼或者粗糙平面上,向后轻拉鼠尾,用左手的拇指和食指抓住小鼠两耳及颈背部皮肤,将小鼠置于左手掌心,以小指夹住小鼠尾巴即可。
2、给药法⑴灌胃:将小鼠固定,口朝上,颈部拉直,右手持灌胃针,先从口角处插入口腔,再沿上颚轻轻插入食管。
一般给药剂量0.1-0.3ml/10g。
⑵腹腔注射:将小鼠固定,右手持注射器自下腹部一侧刺入皮下后,再刺入腹腔,缓慢注入药物。
一般给药剂量0.1-0.3ml/10g。
⑶皮下注射:两人合作,一人左手抓住小鼠头部,右手拉住小鼠尾巴固定小鼠,另外一人用左手提起皮肤,右手持注射器刺入皮下注入药物。
一般给药剂量为0.1-0.2ml/10g⑷肌肉注射:最好两人合作,一人固定小鼠,另外一人将针头迅速垂直刺入后肢外侧肌肉,回抽无回血即可注入药物,一侧给药剂量为0.02-0.05ml/10g。
⑸静脉注射:一般采用尾静脉注射。
将小鼠固定,使尾巴露出来,在50℃热水中浸泡或者用75%酒精擦拭尾巴,使血管扩张,左手拉住鼠尾,右手持注射器,从鼠尾巴末梢开始进针,注入药液。
一般给药剂量为0.1-0.2ml/10g【心得体会】实验二不同给药途径对药物作用的影响【实验目的】观察不同给药途径对药物作用的影响【实验材料】4、器材:大烧杯、托盘天平、灌胃器、注射器、棉签少许5、药品:10%硫酸镁溶液、5%氯化钙溶液、苦味酸溶液6、动物:小鼠,18~22g【实验方法】1、取小鼠3只,称重编号,分别放入大烧杯中,观察小鼠的正常活动,记录半个小时内活动、呼吸、粪便情况。
2、给药:一号小鼠灌胃10%硫酸镁溶液0.2ml/10g二号小鼠肌肉注射10%硫酸镁溶液0.2ml/10g三号小鼠静脉注射10%硫酸镁溶液0.2ml/10g3、观察小鼠的反应及活动,记录半小时内小鼠活动、呼吸及粪便变化。
实验一小白鼠和家兔的捉持与给药方法

实验一小白鼠和家兔的捉持与给药方法1、小白鼠和家兔的捉持与给药方法[目的] 学习小白鼠的捉持和各种给药法。
[材料] 小白鼠3-4只鼠笼天平注射器灌胃针头生理盐水小鼠尾静脉注射用固定筒[方法] 1.1、捉持法以右手提鼠尾,将小鼠放于粗糙面上,将鼠尾轻轻向后拉,以左手的拇指及其食指捏双耳及头部皮肤,无名指、小指及掌心夹其背部皮肤及其尾部,便可将小鼠固定。
1.2、灌胃左手持小鼠,使腹部朝上,颈部拉直,右手拿灌胃器子口交插入口腔,从舌面紧沿上颚进入食道。
若遇阻力,应退出后再插。
1.3、皮下注射一人抓小白鼠头部皮肤,右手拉鼠尾,另一人左手捏背部皮肤,右手持注射器刺入背部皮肤。
1.4、腹腔注射左手抓小白鼠,右手持注射器。
取30º将针头从下腹部刺入腹腔。
1.5、尾静脉注射将小白鼠置于固定筒内或倒置的大漏斗下,使鼠尾露出在外。
用酒精棉球擦鼠尾,使血管扩张。
左手拉住尾尖,选一条扩张最明显的尾静脉将针头刺入血管,推药。
若有阻力,且局部变白,则需从新刺入血管。
2、家兔的捉持与给药方法[目的] 学习家兔的捉持和各种给药法。
[材料] 家兔1-2只兔开口器注射器导尿管生理盐水磅秤兔固定箱[方法] 1.1、捉持法一手抓家兔颈背部皮肤,将兔提起。
另一手托起臀部,使兔成坐位姿势。
1.2灌胃需由两人合作进行。
一人取坐位,用两腿夹持兔身,左手握家兔双耳,右手抓住两前肢。
另一人将木制开口器横插家兔口内,压住舌头,并固定之。
取8号导尿管从开口器中小口插入食道。
插管时易误入气管。
区别之法主要在于谨慎观察插管后动物的反应。
插入器官是可引起剧烈挣扎和呼吸困难。
也可将导尿管的外段进入水中,如有气泡吹出,表示插在气管内,此时应该把管重插。
于判明导尿管确实插在食道内以后,取注射器接在导尿管上,将药液推入。
再推注少量空气,是导尿管中不致有药液残留,慢慢抽出导尿管,取出开口器。
家兔灌胃给药时的药液量一般为5~20ml\kg.试以生理盐水进行练习。
试验动物保定方法

一、实验动物的捉拿、固定及给药方法1.小白鼠:右手抓住鼠尾,放在台上或鼠笼盖铁丝网下,然后用左手拇指沿其背部向前抓住其颈部皮肤,并以左手的小指和掌部夹住其尾固定在手上。
另一抓法是只用左手,先用食指和拇指抓住小鼠尾尖,后用手掌及小指夹住其尾巴,再以拇指及食指捉住其颈部皮肤。
前一方法易学,另一方法稍难,但便于快速捉拿给药。
小鼠灌胃(PO)法:将小鼠固定后,右手持装有灌胃器的注射器,自口角外插入口腔,沿上颚插入食道。
如遇阻力,可将注射器拔出再插,以免穿破食道或误入气管,造成动物死亡。
灌胃容量一般为0.1~0.2ml/10g,不超过0.5ml/只。
小鼠皮下注射法:两人合作,一人一手抓住小白鼠头部皮肤,另一手抓住鼠尾。
另一人注射药物。
注射部位在背部皮下组织。
如一人操作时,左手抓鼠尾,让鼠爬在铁丝笼上,右手将抽好药液的注射器针头插入背部皮下组织。
如一人操作时,左手抓鼠尾,让鼠爬在铁丝笼上,右手将抽好的药液的注射器针头插入背部皮下将药注入。
注射量不超过0.5ml/只。
小鼠腹腔注射法:左手持鼠,右手持注射器从下腹左或右侧(避开膀胱)朝头部方向刺入,宜先刺入皮下,经2~3mm再刺入腹腔,此时针头与腹壁的角度约45度。
针尖插入不宜太深或太近上腹部,避免刺破内脏,注射量一般为0.1~0.25ml/只。
小鼠尾静脉注射法:将小鼠置于固定器内,使其尾巴露出,用70%酒精擦尾部,或将鼠尾浸入50℃热水中。
待尾部静脉扩张后,左手拉尾,右手进针。
注射容量不超过0.5ml/只。
2.兔:用手抓起它脊背近后颈处皮肤,抓的面积越大其持重点越分散。
如家兔肥大,应再以另一手托住它的臀部,将持重点承托于手上。
将兔作仰卧位,一手仍抓住颈部皮肤,另一手顺其腹部抚摸至膝关节,压住关节。
另一人用绳带捆绑四肢,使兔腹部向上,固定在兔手术台上。
头部则用兔头固定夹固定。
兔灌胃法:二人合作,一人固定家兔于两膝之间,一手固定兔头,使头部后仰,另一手将开口器插入兔口,并向后翻转数次,使兔舌伸直并压在开口器下面。
药理学实验

实验一实验动物的捉拿和给药方法【目的】逐步学会常用实验动物的捉拿和给药方法【内容】(一)小白鼠的捉拿和给药方法1.捉拿法以右手捉住小白鼠的尾巴将鼠提起,放置于鼠笼边缘或其他易攀抓处,轻轻向后拉鼠尾,用左手拇指和食指捏住其两耳及头部皮肤,使其腹部朝上,屈曲左手中指使鼠背靠在上面,然后以无名指及小指压住鼠尾,使小鼠完全固定(见实验图-1)。
2.给药方法⑴灌胃:小白鼠固定后,使其口部朝上,将颈部拉直,右手持灌胃器自口角插入口腔,沿上颚轻轻地进入食管,如动物安静、呼吸无异常、口唇无紫绀现象,即可注入药液(见实验图-2)。
灌胃量为0.1~0.25ml∕10g。
⑵腹腔注射:小白鼠固定后,右手持注射器自下腹一侧向头部方向以45°刺入腹腔(角度太小易刺入皮下)。
针头刺入不宜太深或太近上腹部,以免刺伤内脏。
注射量一般为0.1~0.2ml∕10g。
⑶皮下注射:固定小鼠后,右手持注射器,将针头刺入其背部皮下注入药液。
注射量一般不超过0.25ml。
⑷肌内注射:由两人合作,一人固定小白鼠后,另一人持注射器,将针头刺入后肢外侧肌肉内注入药液。
注射量一般每腿不超过0.1ml。
(二)蟾蜍或蛙的捉拿和给药方法1.捉拿法一般由左手握蛙,用食指和中指夹住蛙的两上肢,无名指和小指夹住蛙的两下肢,将蛙固定于手中。
2.给药方法多采用淋巴囊注射。
蛙的皮下有许多淋巴囊(见实验图-3),注入药液易吸收。
一般采用腹囊给药。
注射量每只可达0.25~1.0ml。
(三)家兔的捉拿和给药方法⒈捉拿法用左手抓住兔的颈背部皮肤将其提起,以右手托住其臀部,使兔呈坐位姿势。
⒉给药方法⑴灌胃:由两人合作,一人固定兔身(或用固定器将兔固定),另一人用开口器(见实验图-4)将兔口撑开,并将兔舌压在开口器下面横放于兔口中。
取适当的橡胶管涂以液体石蜡,从开口器的中央孔插入,沿上颚实验图-3 蟾蜍的给药部位实验图-4 家兔的灌胃法实验图-5 家兔的耳缘静脉注射后壁缓缓送入食管约15cm左右,即可进入胃内。
兽医药理学实验

兽医药理学实验实验报告书写题目目的原理材料:实验动物、器材、药品方法:用自己的语言简单扼要描述出来结果:要求真实清楚讨论,将实验结果比较分析,实验中有哪些不足之处,结果异常或失败的原因结论:将实验结果归纳总结实验一:实验动物的捉拿及给药方法一、小白鼠的捉拿和给药方法1、捉拿法:以右手捉住小鼠的尾巴将鼠提起,放置于鼠笼边缘或其他易攀爬处,轻轻向后拉鼠尾,趁其不备,用左手拇指和食指捏住其两耳及头部皮肤,使其腹部朝上,屈曲左手中指靠在鼠背上,然后以无名指压住鼠尾,小指压住其左下肢,使小鼠完全固定。
2、给药方法:1)灌胃:以左手固定小鼠后,使其腹部朝上,颈部伸直,右手持配有灌胃针头的注射器,自口角插入口腔,再从舌面沿上颚壁轻轻进入食管,当推进2~3cm时,灌胃器的前端到达膈肌水平,此时可稍感有抵触。
一般在此位置推注药液即可。
灌胃量为每10g体重0.1~0.3ml 。
2)腹腔注射:将小鼠固定后,使其呈头低臀高位,右手持注射器自下腹一侧向头部方向以45°刺入腹腔,进针部位不宜太高,刺入不宜太深,以免伤及内脏。
注射量一般为每10g 体重0.1~0.3ml 。
3)皮下注射:左手固定小鼠,右手持注射器,将针头刺入背部皮下注入药液。
注射量一般为每每10g体重0.05~0.2ml 。
4)肌肉注射:小鼠因肌肉较少,很少采取肌肉注射,若需要,则由两人合作,一人固定小鼠后,另一人持注射器,将针头刺入小鼠后肢外侧肌肉内注入药液。
注射量每条腿不超过0.1ml。
5)尾静脉注射:将小鼠固定,使鼠尾露出。
用酒精棉球涂搽尾部,使血管扩张。
用左手拉住尾尖,从左右两侧尾静脉中选择一条扩张最明显的,右手持注射器(选用4号针头),将针头由尾端向心刺入血管,用左手拇指与食指固定针头和血管,推入药液。
注射量为每10g体重0.1~0.2ml二、家兔的捉拿和给药方法:1、捉持法:用左手抓住颈背部皮肤将家兔提起,右手托住其臀部,使家兔呈坐位姿势。
实验一 小白鼠和家兔的捉持与给药方法(doc)

实验一小白鼠和家兔的捉持与给药方法(doc)实验动物的捕持和给药是实验操作中非常关键的步骤。
本文主要介绍小白鼠和家兔的捉持和给药方法。
1. 捕持方法小白鼠较为敏感,需要小心捉持。
可以采用直接手抓或使用器械相结合的方法。
① 直接手抓:用左手握住小白鼠的尾巴,将其抬离地面,右手用力抓住身体。
捉持的位置应该落在肩胛骨的后面。
捉持后,将小白鼠稳定住,不要摇晃。
② 使用器械:可以使用长柄刷子、网兜、特殊夹具等工具将小白鼠从底部壁上向上推,然后在手掌捉持。
2. 给药方法对于小鼠的给药方法,有多种选择。
下面分别介绍常见的口服给药和腹腔注射。
① 口服给药:使用灌胃针或切口方法。
前者通常用于液体或悬浮物,后者通常用于固体或片剂。
灌胃针方法:将灌胃针插入小鼠口中,直到其到达胃部。
然后缓慢注入待给药物。
给药完毕后,针头要缓慢拔出。
切口方法:用手或器械拓宽小鼠口腔,将给药物放在其舌根处。
然后轻轻地按住小鼠的颈部,使其吞咽。
② 腹腔注射:使用注射器在小鼠腹部注射待给药物。
首先选择注射部位,一般建议在小鼠的下腹部。
然后用适量的酒精消毒注射部位。
将注射器插入腹部,确保局麻针穿过腹膜。
缓慢注射待给药物后,注射针要慢慢拔出。
二、家兔的捕持和给药方法① 直接手抓:用两只手同时抓住家兔颈部和臀部。
抓住后,将家兔稳定住,不要晃动。
② 使用器械:可以使用外科手套或草绳将家兔绑定在固定位置上。
需要特别注意的是,草绳不要绑定得太紧,以免影响家兔的呼吸。
总的来说,实验动物的捉持和给药方法需要谨慎操作,以保证实验的成功和动物的健康。
在进行操作前,需要进行必要的训练,熟悉其生理特征,了解其习性,确保操作更加顺利。
同时,在实验过程中,也要注意动物的福利和健康,确保其得到最好的关怀和保障。
(医疗药品)实验一小白鼠和家兔的捉持与给药方法

实验一小白鼠和家兔的捉持与给药方法1、小白鼠和家兔的捉持与给药方法[目的]学习小白鼠的捉持和各种给药法。
[材料]小白鼠3-4只鼠笼天平注射器灌胃针头生理盐水小鼠尾静脉注射用固定筒[方法]1.1、捉持法以右手提鼠尾,将小鼠放于粗糙面上,将鼠尾轻轻向后拉,以左手的拇指及其食指捏双耳及头部皮肤,无名指、小指及掌心夹其背部皮肤及其尾部,便可将小鼠固定。
1.2、灌胃左手持小鼠,使腹部朝上,颈部拉直,右手拿灌胃器子口交插入口腔,从舌面紧沿上颚进入食道。
若遇阻力,应退出后再插。
1.3、皮下注射一人抓小白鼠头部皮肤,右手拉鼠尾,另一人左手捏背部皮肤,右手持注射器刺入背部皮肤。
1.4、腹腔注射左手抓小白鼠,右手持注射器。
取30º将针头从下腹部刺入腹腔。
1.5、尾静脉注射将小白鼠置于固定筒内或倒置的大漏斗下,使鼠尾露出在外。
用酒精棉球擦鼠尾,使血管扩张。
左手拉住尾尖,选一条扩张最明显的尾静脉将针头刺入血管,推药。
若有阻力,且局部变白,则需从新刺入血管。
2、家兔的捉持与给药方法[目的]学习家兔的捉持和各种给药法。
[材料]家兔1-2只兔开口器注射器导尿管生理盐水磅秤兔固定箱[方法]1.1、捉持法一手抓家兔颈背部皮肤,将兔提起。
另一手托起臀部,使兔成坐位姿势。
1.2灌胃需由两人合作进行。
一人取坐位,用两腿夹持兔身,左手握家兔双耳,右手抓住两前肢。
另一人将木制开口器横插家兔口内,压住舌头,并固定之。
取8号导尿管从开口器中小口插入食道。
插管时易误入气管。
区别之法主要在于谨慎观察插管后动物的反应。
插入器官是可引起剧烈挣扎和呼吸困难。
也可将导尿管的外段进入水中,如有气泡吹出,表示插在气管内,此时应该把管重插。
于判明导尿管确实插在食道内以后,取注射器接在导尿管上,将药液推入。
再推注少量空气,是导尿管中不致有药液残留,慢慢抽出导尿管,取出开口器。
家兔灌胃给药时的药液量一般为5~20ml\kg.试以生理盐水进行练习。
1.3皮下、肌内及腹腔注射给药方法基本上同小白鼠,为针头可稍大(选用6号或7号针头),给药量可稍多(皮下与肌内0.5~1.0ml\kg,腹腔1.0~5.0ml\kg)1.4静脉注射将家兔置固定箱内,把去耳壳外缘的毛,选择一条比较明显的耳缘静脉,用酒精棉球涂擦皮肤,使血管显露。
实验一 实验动物给药途径和方法.

实验一实验动物给药途径和方法一、动物的编号、捉拿和固定。
1、动物的编号犬、兔等动物可用特制的号码牌固定于耳。
白色家兔和小动物可用3-5%的黄色苦味酸溶液涂于毛上标号。
如编号1-10号时,将小白鼠背部分前肢、腰部、后肢的左、中、右部共九个区域,从右到左1-9号,第10号不涂黄色(图1-1)如加上其它颜色的染料还可进行1-100号和1-1000号等更多编号。
图1-1 小白鼠背部编号图1-2 小白鼠双手捉持法(引自:医学技能学实验教程. 白波. 2004)(引自:医学技能学实验教程. 白波. 2004)2、动物的捉拿和固定①小鼠:右手抓住其尾,放在实验台上或鼠笼铁纱网上,在其向前爬时,左手拇指及食指沿其背抓住两耳及头颈部皮肤,并以左手的小指和掌部夹住鼠尾固定。
另一抓法是只用手,用食指和拇指抓住鼠尾后再用小指和掌部夹住鼠尾,以拇指及食指捏住其颈部皮肤。
前一种方法易学,后一种方法便于快速捉拿。
(见图1-2,1-3)图1-3 小白鼠双手捉持法(引自:医学技能学实验教程. 白波. 2004)②大鼠:以右手或持夹子夹住尾巴,左手戴上防护手套固定头部防止被咬,应避免用力过大造成大鼠窒息死亡。
根据实验需要麻醉或固定大鼠于鼠笼内或用绳绑其四肢固定于大鼠手术板上。
③豚鼠:以右手抓住豚鼠头颈部,将其两前肢在豚鼠头与右手拇指与食指之间,轻轻扣住颈胸部,右手抓住两后肢(对体重较大的豚鼠则可托起其臀部),使腹部向上。
④兔:用手抓起兔脊背近后颈部皮肤,手抓面积应尽量大些。
以另一手托起兔的臀部。
将兔仰卧固定时,一手抓住颈部皮肤,另一只手顺着腹部抚摸至膝关节处压住关节。
另一人将绳子用活结捆绑兔的四肢,使兔腹部向上固定在兔手术台上。
头部则用兔头固定夹固定,也可用棉线将兔的门牙固定于兔手术台上的柱子上,后者更常用(图1-4)。
图1-4 家兔捉持法(引自:医学技能学实验教程. 白波. 2004)二、实验动物的去毛动物去毛是手术野的皮肤准备之一。
实验1 实验动物的捉持法和给药法
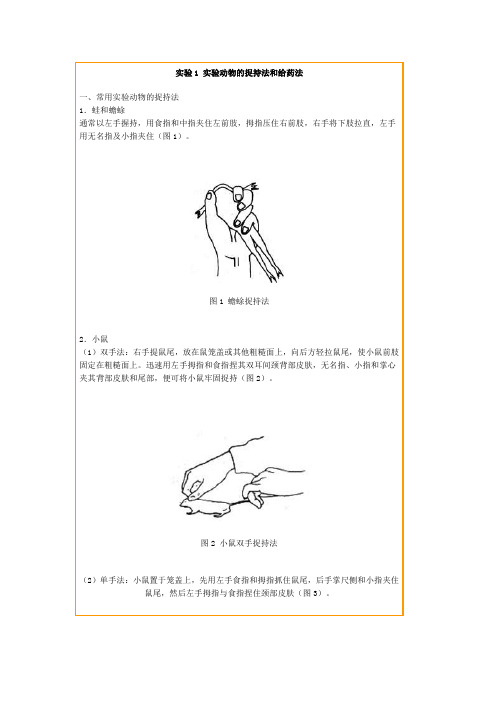
实验1 实验动物的捉持法和给药法一、常用实验动物的捉持法1.蛙和蟾蜍通常以左手握持,用食指和中指夹住左前肢,拇指压住右前肢,右手将下肢拉直,左手用无名指及小指夹住(图1)。
图1 蟾蜍捉持法2.小鼠(1)双手法:右手提鼠尾,放在鼠笼盖或其他粗糙面上,向后方轻拉鼠尾,使小鼠前肢固定在粗糙面上。
迅速用左手拇指和食指捏其双耳间颈背部皮肤,无名指、小指和掌心夹其背部皮肤和尾部,便可将小鼠牢固捉持(图2)。
图2 小鼠双手捉持法(2)单手法:小鼠置于笼盖上,先用左手食指和拇指抓住鼠尾,后手掌尺侧和小指夹住鼠尾,然后左手拇指与食指捏住颈部皮肤(图3)。
图3 小鼠单手捉持法3. 大鼠大鼠容易激怒咬人,捉持时应戴防护手套。
先用右手抓住鼠尾,再用左手拇指和食指握住头部,其余手指与掌部握住背部和腹部。
注意不要捏其颈部,以防用力过大、过久,窒息死亡。
4.家兔一只手抓住兔颈背部皮肤,将兔轻轻提起,另一只手托住臀部,使兔呈蹲坐姿势(图4)。
切不可用手握持双耳提起兔子。
图4 家兔捉持法5.豚鼠豚鼠性情温和,不咬人,用手轻轻握住身体即可抓起。
6. 猫应戴好防护手套。
轻声呼唤,慢慢将手伸入猫笼,轻抚猫头、颈和背部,一只手抓住颈背部皮肤,另一只手抓住腰背部。
性情凶暴的猫可用布袋或网套捉持,操作中应防其利爪和牙齿伤人。
7. 狗驯服的狗可戴上特制嘴套,用绳带固定于耳后颈部;凶暴的狗可用长柄捕狗夹钳住狗的颈部,然后套上嘴套。
狗嘴也可用绳带固定,操作时先将绳带绕过狗嘴的下颌打结,再绕到颈后部打结,以防绳带滑落。
狗麻醉后四肢固定于手术台上,取下嘴套或绳带,将一金属棒经两侧嘴角,穿过口腔压于舌上,再用绳带绕过金属棒绑缚狗嘴,并固定于手术台上。
应将狗舌拉出口腔,以防窒息。
二、常用实验动物给药法1. 经口给药法此法有口服与灌胃两种方法。
适用于小鼠、大鼠、豚鼠、兔、犬等动物。
口服法可将药物放入饲料或溶于饮水中令动物自由摄取。
若为保证剂量准确,可应用灌胃法。
实验1实验动物的捉方法法和给药方法

目录前言 (1)实验1 实验动物的捉持法和给药法 (2)实验2 药物的基本作用 (7)实验3 不同给药途径对药物作用的影响 (8)实验4 肝脏功能对药物作用的影响 (8)实验5 全血水杨酸钠二室模型药动学参数测定 (9)实验6 传出神经系统药物对蟾蜍腹直肌的作用 (12)实验7 传出神经系统药物对麻醉兔血压的作用 (13)实验8 氯丙嗪的安定和抗激怒反应作用 (14)实验9 吗啡的镇痛作用 (15)实验10 有机磷药物的中毒及其解救 (16)实验11 强心苷对在体蛙心的作用 (18)实验12 药物对大鼠离体子宫的作用 (19)实验13 利尿药对兔尿量和尿中氯离子浓度的影响 (20)实验14 利用豚鼠肠肌标本鉴别未知药品 (21)附录一制剂、处方法 (22)附录二常用生理溶液的成分和配制 (24)前言药理学实验教学的目的,不仅是验证药理学理论,还可培养学生基本操作技能,观察和分析解决问题的能力,以及体验科学研究的基本原则和基本程序,从而提高学生实验研究能力和严密的科学思维方法。
为了使各专业的学生能深入理解药理学的基本理论和基本知识,打好临床合理用药的基础,特编写了这本《药理学实验大纲与实验指导》。
本实验指导选择的实验内容经典、实用,做到既与理论课有密切联系,又有实验课的独特体系;既有整体动物(包括清醒动物和麻醉动物)实验,又有器官水平(包括离体和在体器官)实验;既有定性实验,又有定量实验;既有验证性实验,又有设计性实验。
从而使学生初步具备对客观事物进行观察、比较、分析、综合和解决问题的能力,并验证、巩固和加深理解基本理论,从而初步掌握药理学实验的基本方法。
实验1 实验动物的捉持法和给药法一、常用实验动物的捉持法1.蛙和蟾蜍通常以左手握持,用食指和中指夹住左前肢,拇指压住右前肢,右手将下肢拉直,左手用无名指及小指夹住(图1)。
2.小鼠(1)双手法:右手提鼠尾,放在鼠笼盖或其他粗糙面上,向后方轻拉鼠尾,使小鼠前肢固定在粗糙面上。
课题实验一1.常用动物的捉拿,给药,采血方法练习

4.给药:甲组:
乙组:
2.讲授〔时间〕4小时
课题内容
1.观察苯巴比妥钠抗电刺激致惊作用
2.观察苯巴比妥钠抗戊四氮致惊作用
掌握要点
1.电刺激致惊的电压需要予摸〔课堂操作〕
2.戊四氮致惊的指标确认
举例
电刺激的程度不同,致惊程度也不同,与电刺激致痛需要予摸电压一样。
提问
3.小结〔时间〕
1.电刺激法致大发作惊厥:
计算半数致死量的结果
标号方法介绍:
课题实验三抗惊厥试验
教学目的
1.观察抗癫痫药对电惊厥或药物致惊的对抗作用
2.了解癫痫大发作及小发作动物模型的制备方法
教学重点
1.癫痫模型的制作
2.抗癫痫药作用的观察
教学难点
癫痫模型制作
教学方法
实际操作
教具
生理药理多用仪,小白鼠
教学进程
1.导言〔时间〕
我们在理论教学中已了解到癫痫病的种类及抗癫痫药物的作用,通过实验来验证一下。
1.常用动物的捉拿,给药,采血方法
2.不同给药途径对硫酸镁的影响
掌握要点
1.灌胃给药方法
2.肌肉注射速度、角度
3.硫酸镁不同给药途径的不同作用,为什么?
举例
硫酸镁口服产生泻下作用,原因是口服不吸收,在肠道迅速升高渗透压,如同口服甘露醇肠腔渗透压升高,吸收水分在腔中,容积升高,从而刺激肠壁,引起导泻作用。
复习提问
抗癫痫药有多种,可分为对抗不同类型的癫痫,哪些药可以针对大发作型?
药理作用有哪些,机理?
板书设计
实验三抗癫痫实验
1.电刺激法制备的癫痫模型
[目的] 1.观察苯巴比妥抗电惊厥的作用
2.了解实验方法
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验1 实验动物的捉持法和给药法
一、常用实验动物的捉持法
1.蛙和蟾蜍
通常以左手握持,用食指和中指夹住左前肢,拇指压住右前肢,右手将下肢拉直,左手用无名指及小指夹住(图1)。
图1 蟾蜍捉持法
2.小鼠
(1)双手法:右手提鼠尾,放在鼠笼盖或其他粗糙面上,向后方轻拉鼠尾,使小鼠前肢固定在粗糙面上。
迅速用左手拇指和食指捏其双耳间颈背部皮肤,无名指、小指和掌心夹其背部皮肤和尾部,便可将小鼠牢固捉持(图2)。
图2 小鼠双手捉持法
(2)单手法:小鼠置于笼盖上,先用左手食指和拇指抓住鼠尾,后手掌尺侧和小指夹住鼠尾,然后左手拇指与食指捏住颈部皮肤(图3)。
图3 小鼠单手捉持法
3. 大鼠
大鼠容易激怒咬人,捉持时应戴防护手套。
先用右手抓住鼠尾,再用左手拇指和食指握住头部,其余手指与掌部握住背部和腹部。
注意不要捏其颈部,以防用力过大、过久,窒息死亡。
4.家兔
一只手抓住兔颈背部皮肤,将兔轻轻提起,另一只手托住臀部,使兔呈蹲坐姿势(图4)。
切不可用手握持双耳提起兔子。
图4 家兔捉持法
5.豚鼠
豚鼠性情温和,不咬人,用手轻轻握住身体即可抓起。
6. 猫
应戴好防护手套。
轻声呼唤,慢慢将手伸入猫笼,轻抚猫头、颈和背部,一只手抓住颈背部皮肤,另一只手抓住腰背部。
性情凶暴的猫可用布袋或网套捉持,操作中应防其利爪和牙齿伤人。
7. 狗
驯服的狗可戴上特制嘴套,用绳带固定于耳后颈部;凶暴的狗可用长柄捕狗夹钳住狗的颈部,然后套上嘴套。
狗嘴也可用绳带固定,操作时先将绳带绕过狗嘴的下颌打结,再绕到颈后部打结,以防绳带滑落。
狗麻醉后四肢固定于手术台上,取下嘴套或绳带,将一金属棒经两侧嘴角,穿过口腔压于舌上,再用绳带绕过金属棒绑缚狗嘴,并固定于手术台上。
应将狗舌拉出口腔,以防窒息。
二、常用实验动物给药法
1. 经口给药法
此法有口服与灌胃两种方法。
适用于小鼠、大鼠、豚鼠、兔、犬等动物。
口服法可将药物放入饲料或溶于饮水中令动物自由摄取。
若为保证剂量准确,可应用灌胃法。
(1)灌胃法
小鼠:左手捉持小鼠,腹部朝上,右手持灌胃管经口角插入口腔,使灌胃管与食管成一直线,再沿上颚壁缓慢插入食管,稍感有阻力时(大约灌胃管插入1/2),如动物安静,呼吸无异常,即可注入药液。
如遇阻力应抽出灌胃管重新插入,若药液误注气管,小鼠可立即死亡。
一次灌注药量0.1-0.3ml/10g体重。
操作宜轻柔,防止损伤食管(图5)。
灌胃管可用粗大的注射针头制作,磨钝针尖制成,管长4-5cm,直径1mm,连接于1-2ml 注射器上即成。
图5 小鼠灌胃法
大鼠:左手捉持大鼠,右手持灌胃器,灌胃方法与小鼠相同。
若两人合作时,可由助手协助固定后肢与尾巴。
但灌胃管必须长6-8cm,直径1.2mm,尖端呈球状,并安装在5-10ml的注射器上。
注药前应回抽注射器,证明未插入气管(无空气逆流)方可注入药液。
一次投药量1—2ml/100g体重。
家兔:需两人合作,一人坐好将兔躯体夹于两腿之间,左手紧握双耳固定头部,右手抓住两前肢固定前身,使兔头稍向后仰;另一人将木或竹制开口器横放于兔口中,将兔舌压住,以8号导尿管经开口器中央小孔,沿上颚壁慢慢插入食管15-18cm。
为避免误入气管,可将导尿管外口端放入清水杯中,无气泡逸出方可注入药液,并应再注入少量清水以保证管内药液全部进入胃内。
灌毕,慢慢拔出导尿管取出开口器(图6)。
图6 家兔灌胃法
豚鼠:如用灌胃器,灌胃法与大鼠相同。
如用开口器和导尿管,操作方法与兔灌胃法相同。
猫和狗:灌胃方法与兔相似,将导尿管从鼻腔或口腔经食管插入胃内给药。
操作时应防止动物咬伤与抓伤。
(2)口服法
片剂药物可在扒开动物上下齿列后,用镊子夹住药物放在舌根部,迅速合起上下颌即可咽下药物。
给药前若先以水湿润口腔内部,更易咽下。
液体药物可在轻轻固定动物头部后,从口角齿列间注入药液,动物多能自动咽下。
溶于水的药物也可加入饮水中口服,不溶于水的药物可加入饲料中给药。
但这两种给药法必须是无味的药物,且难以保证剂量准确。
2. 注射给药法
(1)皮下注射法:
小鼠:一般需两人合作,一人把小鼠头与鼠尾牵向两端并固定,另一人左手提起背部皮肤,右手持注射器刺入皮下,若针头容易向左右摆动即可注入药液。
拔针时左手捏住针刺部位,防止药液外漏(图7)。
一人操作可把小鼠放在金属网上,左手拉鼠尾,小鼠以其习性向前移动,此时右手持注射器从头端向尾部刺入背部皮下。
注药量0.1-0.3 ml/10g 体重。
图7 小鼠皮下注射法
大鼠:以捉持法握住大鼠,于背部或大腿拉起皮肤,将注射针刺入皮下。
一次注射药量小于1.0ml/100g体重。
家兔:左手将兔背部皮肤提起,右手持注射器,针尖刺人皮下松开左手,进行注射。
豚鼠:注射部位可选用大腿内侧面、背部、肩部等皮下脂肪少的部位。
通常为大腿内侧面注射。
一般需两人合作,一人固定豚鼠,一人进行注射。
猫:将臀部皮肤拉起,将注射针刺入皮肤与肌肉之间,注入药液。
犬:将犬的颈部或背部皮肤拉起,注射针刺入皮下进行注射。
(2)皮内注射法:
先将注射部位剪去毛。
左手绷紧皮肤,右手持注射器,小于15°角刺入皮内,注射药液,注射处出现一白色小皮丘。
(3)腹腔注射法:
小鼠:左手捉持小鼠,腹部向上,右手将注射器针头刺入皮肤,其部位是距离下腹部腹白线稍向左或右的位置。
向前推进3—5mm,接着使注射器针头与皮肤呈45°角刺入腹肌,继续向前刺人,通过腹肌进入腹腔后抵抗消失,这时即可轻轻注入药液。
小鼠的一次注射量为0.1—0.2m1/10g 体重(图8)。
图8 小鼠腹腔注射法
大鼠:腹腔注射与小鼠相同。
注射量为1—2ml/100g体重。
豚鼠、猫、免等:豚鼠、猫腹腔注射部位同小鼠。
兔在下腹部近腹白线左右两侧约lcm 处,犬在脐后腹白线侧边1—2cm处注射为宜。
(4)静脉注射法:
大鼠和小鼠:一般采用尾静脉注射,事先将小鼠和大鼠置于固定的筒内或铁丝罩内,或扣于烧杯内,使尾巴露出,于45—50℃温水中浸泡、或用60-100瓦电灯泡烘烤、或用75%酒精棉球擦之,使血管扩张,选择尾巴左右两侧静脉注射,注射时若出现隆起的白色皮丘,说明未注入血管,应重新向尾根部移动注射。
一次注射量小鼠为0.05—0.1ml/10g 体重(图9)。
注射完毕后用棉球按压止血。
图9 小鼠尾静脉注射法
家兔:一般采用耳缘静脉注射。
可用酒精棉球涂擦耳部边缘静脉,或用电灯泡烘烤兔耳使血管扩张。
以左手指在兔耳下作垫,右手持注射器,针头经皮下进入血管。
注射时若无阻力或无发生隆起现象,说明针头在血管内,注射完毕,压住针眼,拔去针头,继续
压迫数分钟止血(图10)。
图10 家兔耳缘静脉注射法
豚鼠:一般用前肢皮下头静脉注射,后肢小隐静脉注射也可以。
接近下部比较容易刺入静脉。
注射量一般不超过2ml。
猫:一般采用前肢皮下头静脉注射。
注射前先将猫装入固定袋或笼内,左手抓住前肢,酒精棉球涂擦后,从前肢的末稍端将注射器针头刺入静脉。
证实针在静脉内后,即可注射。
犬:可选用前肢皮下头静脉或后肢小隐静脉注射。
以手或橡皮带把静脉向心端扎紧,使血管充血。
酒精棉球涂檫后,针头向近心端刺入静脉,回抽针栓,倘有回血即可推注药液(图11)。
图11 犬后肢外侧小隐静脉(左)和前肢背侧皮下头静脉(右)注射法
(5)肌肉注射法:
兔、猫、犬选择两侧臀部或股部肌肉。
在固定动物后,注射器与肌肉成60°角,一次刺入肌肉注射,但应避免针刺入肌肉血管内。
注射完后轻轻按摩注射部位,以助药物吸收。
小鼠、大鼠、豚鼠因肌肉较小,较少采用肌肉注射,若有必须,以股部肌肉较适,用量不宜过大,特别是小鼠,每侧不宜超过0.1ml。
(6)椎管内注射法:
兔:在腰骶部位剪去毛,酒精棉球涂檫。
一人固定兔体并将兔臀部向腹侧弯曲,使腰骶部凸出,以增大脊突间隙。
一人右手持注射器,将针头自第一骶骨前面正中轻轻刺入,当刺到椎管时有似刺透硬膜感觉,此时兔尾巴随针刺而动,或后肢有跳动,则证明刺入椎管,即可注射。
一般一只兔注药量为0.5—1.0ml (图12)。
图12 兔椎管内注射法
(7)淋巴囊内注射:
蛙及蟾蜍皮下有多个淋巴囊(图13),对药物易吸收。
一般将药物注射于胸、腹或股淋巴囊。
因其皮肤较薄,为避免药液从针眼中漏出,故作胸部淋巴囊注射时,针头由口腔底部穿下颌肌层而达胸部皮下;作股部淋巴囊注射时,应从小腿皮肤刺入,通过膝关节而达大腿部皮下。
注入药量一般为0.25—0.5ml。
图13 蛙淋巴囊内注射法。
