粮食脂肪酶活力、脂肪酸及其组成测定
脂肪酶活测定
一.脂肪酶活测定原理:脂肪酶在一定条件下,将甘油三酯水解。
在不同水解阶段可分别产生脂肪酸、甘油二酯、甘油一酯及甘油。
水解所产生的脂肪酸可以用标准的氢氧化钠滴定,用滴定值表示酶活力。
酸碱滴定法 :酶活力以国际单位表示,即在一定条件下,脂肪酶水解脂肪每分钟产生1微克分子脂肪酸的酶量定为一个国际单位。
脂肪酶活力单位=(A-B)*nf/t*v式中:A为样品耗碱液ml数,B为对照组耗碱液ml数,n为每毫升碱液微克分子数(n=cM=0.05x23x1000),f为稀释倍数,t为作用时间(分),v:反应的酶液的体积二.挥发性脂肪酸(VFA)的测定滴定法分析1原理:将废水以磷酸酸化后,从中蒸发出挥发性脂肪酸,再以酚酞为指示剂用NaOH 溶液滴定馏出液。
废水中的氨态氮可能对测定形成干扰,因此应当首先在碱性条件下蒸发出氨态氮。
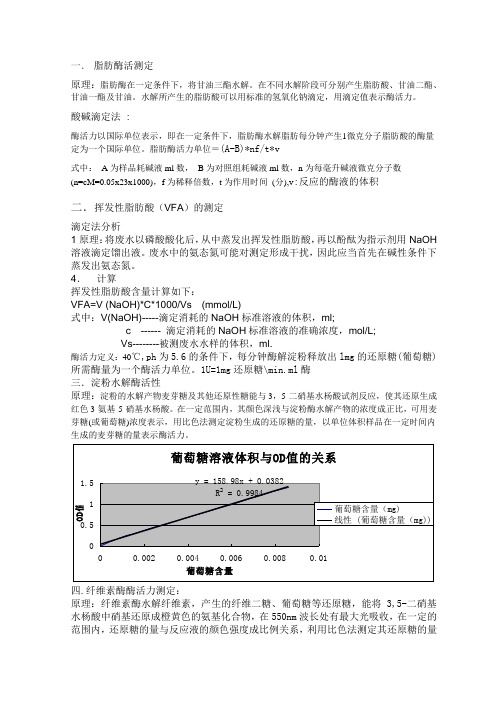
4.计算挥发性脂肪酸含量计算如下:VFA=V (NaOH)*C*1000/Vs (mmol/L)式中:V(NaOH)-----滴定消耗的NaOH标准溶液的体积,ml;c ------ 滴定消耗的NaOH标准溶液的准确浓度,mol/L;Vs--------被测废水水样的体积,ml.酶活力定义:40℃,ph为5.6的条件下,每分钟酶解淀粉释放出lmg的还原糖(葡萄糖)所需酶量为一个酶活力单位。
1U=1mg还原糖\min.ml酶三.淀粉水解酶活性原理:淀粉的水解产物麦芽糖及其他还原性糖能与3,5-二硝基水杨酸试剂反应,使其还原生成红色3-氨基-5-硝基水杨酸。
在一定范围内,其颜色深浅与淀粉酶水解产物的浓度成正比,可用麦芽糖(或葡萄糖)浓度表示,用比色法测定淀粉生成的还原糖的量,以单位体积样品在一定时间内生成的麦芽糖的量表示酶活力。
四.纤维素酶酶活力测定:原理:纤维素酶水解纤维素,产生的纤维二糖、葡萄糖等还原糖,能将3,5-二硝基水杨酸中硝基还原成橙黄色的氨基化合物,在550nm波长处有最大光吸收,在一定的范围内,还原糖的量与反应液的颜色强度成比例关系,利用比色法测定其还原糖的量就可测定纤维素酶的活力。
国内外粮食、油料脂肪测定方法评析

国内外粮食、油料脂肪测定方法评析【国内外粮食、油料脂肪测定方法评析】粮食、油料脂肪是我们日常生活中重要的食品资源,主要由碳水化合物、蛋白质、脂肪、矿物质和维生素等营养素构成。
根据粮食、油料脂肪的不同成分特性,选择不同的测定方法可以更好地了解粮食、油料脂肪的营养素组成,从而促进粮食、油料脂肪的有效利用和开发。
一、粮食成分测定1、水分测定水分测定是粮食分析中最基本也是最常用的方法,分析粮食水分含量对于衡量粮食质量十分重要,目前采用干燥法、霍夫曼法、比重法以及快速水分测定仪等方法来测定粮食的水分含量,但随着技术的发展,现在也可以使用其他方法来测定粮食水分含量。
2、淀粉测定淀粉是粮食中最重要的成分之一,其主要形态有米淀粉、小麦淀粉、玉米淀粉等,也是粮食组成的重要成分。
目前,常用的淀粉测定方法有热重法、比重法、滴定法、粒度法、物理-化学法等。
3、蛋白质测定蛋白质是粮食中一种重要的营养素,其中有多种不同的蛋白质,目前常用的蛋白质测定方法有Kjeldahl法、滴定法、免疫法、物理-化学分析法等。
4、脂肪测定粮食中的脂肪是一种重要的营养素,它能提供大量的能量,其中主要包括不饱和脂肪酸、饱和脂肪酸及脂肪醇类等。
目前,常用的脂肪测定方法有Soxhlet法、霍夫曼法以及免疫法等。
二、油料脂肪测定1、水分测定油料脂肪中的水分测定主要采用干燥法、霍夫曼法、比重法等,但也可以采用其他方法测定,如快速水分测定仪等。
2、脂肪含量测定油料脂肪的脂肪含量是衡量油料脂肪质量的重要指标,目前常用的脂肪含量测定方法有热重法、比重法、滴定法和色谱法等。
3、不饱和脂肪酸含量测定不饱和脂肪酸是油料脂肪中重要的营养成分,其含量测定可以帮助我们更好地了解油料脂肪的营养特性,目前常用的不饱和脂肪酸含量测定方法主要有高效液相色谱法、高效液相色谱-质谱法、气相色谱法等。
4、饱和脂肪酸含量测定饱和脂肪酸是油料脂肪中的重要成分,其含量测定可以帮助我们更好地了解油料脂肪的营养特性。
鲜食玉米中脂氧合酶活力、脂肪酸与挥发性成分的相关性研究

现代食品科技Modern Food Science and Technology2016, Vol.32, No.5鲜食玉米中脂氧合酶活力、脂肪酸与挥发性成分的相关性研究牛丽影1,马玉玲1,2,吴建平1,3,李大婧1,刘春泉1,陈计峦2(1.江苏省农业科学院农产品加工所,江苏南京 210014)(2.新疆石河子大学食品学院,新疆石河子 823000)(3.扬州大学食品科学与工程学院,江苏扬州 225000)摘要:研究了晶甜5号和晶甜紫花糯2号两种鲜食玉米在早于适采期、适采期和晚于适采期三个采收期脂氧合酶(LOX)的活力、脂肪酸和挥发性成分的组成及变化情况。
结果显示样品的LOX活力为2.63~4.28 U/gFW,脂肪酸均以亚油酸的含量最高(32.40%~46.68%),而亚麻酸含量较低(0.97%~2.40%)。
挥发性成分则以己醇或己醛的含量最高,早采和适采期的晶甜5号中己醇含量最高,晚采的晶甜5号和三个采收期的京甜紫花糯2号均以己醛含量最高。
两种玉米的粗脂肪、脂氧合酶活力随采收期的延后而增加,但是亚油酸、己醛却表现为下降趋势。
相关性分析表明LOX途径的底物脂肪酸亚油酸和亚麻酸与己醛呈现显著正相关关系,但与LOX活力的相关性未达显著水平。
这说明鲜食玉米中来自LOX途径的挥发性成分可能主要取决于亚油酸或亚麻酸的量,而并非LOX活力的大小。
另外,两种玉米挥发性成分尤其是C6醛醇含量的不同可能体现了样品间LOX途径上的差异。
关键词:鲜玉米;LOX途径;己醛;亚油酸;相关性分析文章篇号:1673-9078(2016)5-59-64 DOI: 10.13982/j.mfst.1673-9078.2016.5.010 Correlation Analysis of Lipoxygenase (LOX)Activity and Fatty Acids withVolatile Components in Fresh CornNIU Li-ying1, MA Yu-ling1, 2, WU Jian-ping1,3, LI Da-jing1, LIU Chun-quan1, CHEN Ji-luan2(1.Institute of Farm Product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China) (2.College of Food, Shi Hezi University, Xinjiang 823000, China) (3.College of Food Science and Engineering, Y angzhou University,Y angzhou 225000, China)Abstract: The lipoxygenase (LOX) activities and the compositions of fatty acids and volatiles as well as their changes in sweet corn (var. Jingtian 5) and waxy corn (var. Jingtianzihuanuo 2), harvested before, at, and after the favorable harvest time, were investigated. The LOX activities of the samples were in a range of 2.63~4.28 U/gFW, and the fatty acids in the highest and lowest amounts were linoleic acid (32.40%~46.68%) and linolenic acid (0.97%~2.40%), respectively. The volatiles in the highest amount were hexanol and hexanal. Jingtian 5 samples harvested before and at the favorable harvest time showed the highest hexanol content, whereas Jingtian 5 harvested after the favorable harvest time and Jingtianzihuanuo 2 harvested in all three periods had the highest hexanal content. With prolonging of the harvest time, the LOX activities and crude fat content in both cultivars increased, but the contents of linoleic acid and hexanal exhibited a downward trend. Correlation analysis indicated that the substrates linoleic acid and linolenic acid in the LOX pathway had significant positive correlation with the hexanal contents but no significant correlation with LOX activity. These findings indicate that the volatiles from the LOX pathway in these fresh corns may depend on the level of linoleic acid or linolenic acid, rather than the level of LOX activity. In addition, the differences in the volatile contents between the two cultivars, especially of hexanol and hexanal, might reflect the differences in the LOX pathway between the two samples.Key words: fresh corn; lipoxygenase pathway; hexanal; linoleic acid; correlation analysis收稿日期:2015-07-13基金项目:国家自然科学基金资助项目(31301533)作者简介:牛丽影(1977-),女,博士,副研究员,研究方向:果蔬加工 通讯作者:刘春泉(1959-),男,研究员,研究方向:农产品精深加工与产业化近年来,鲜食玉米即乳熟期或蜡熟期采收的玉米广为消费者欢迎。
脂肪酶活检测原理及方法

脂肪酶活检测原理及方法脂肪酶活检测原理及实际方法:一、原理以及标准曲线做法1. 对硝基苯酚酯( 4-Nitrophenyl ester )是脂肪酶水解活力测定中运用最为广泛的一种底物,脂肪酶水解其产生pNP(对硝基苯酚)在碱性条件下显黄色,在410nm 下有吸光值,且灵敏度很高。
2. 所需试剂有:CAS 碳链长度出货号价格名称830-03-5C2N8130-1G ¥462 对硝基苯乙酸酯2635-54-9 C4 N9876-1G ¥570 对硝基苯丁酸酯1956-10-1 C821742-1G-F ¥487 对硝基苯辛酸酯1956-11-2 C12 61716-1G ¥435 对硝基苯月桂酸酯1492-30-4 C16 N2752-1G ¥379 对硝基苯棕榈酸酯14617-86-8C18 N3627-1G¥对硝基苯硬酸脂全部为色谱纯试剂,购于sigma 公司3. 标准曲线绘制:a. 标准对硝基苯酚母液(2mM ,2mmol / L): 称取的对硝基苯酚(p-NP)溶于100ml 的溶液B(即不同pH 的缓冲液) ,置于棕色试剂瓶内,4℃冰箱保存。
方法一:b. 标准曲线绘制:分别取,,,,,的对硝基苯酚母液(2mM) ,用溶液B(即不同pH 的缓冲液)稀释至4ml ,分别测定在410nm 处的吸收值。
以对硝基苯酚浓度x(对应浓度分别是,,,,,,单位:mM ) 为横坐标,吸光值y 为纵坐标,绘制标准曲线。
方法二:全部对硝基苯酚经过与测酶活相同的处理,获得吸光度。
b.标准曲线的绘制:分别取0、、、、15、、30、45μL的对硝基苯酚分别加入、、、55、、40、、μL的异丙醇和(全部都是)的溶液B,40℃15min,95%乙醇,10000r / min ,3min ,测出标准曲线。
上表是方法一测得标准曲线脂肪酶酶活定义:在410nm 下测定吸光值, 以 1 min 内催化水解底物对硝基苯棕榈酸酯(p-NPP)产生1μmol 对硝基苯酸(p-NP) 所需的酶量为 1 个酶活单位(U)。
比色法测定粮食脂肪酸值的研究_严梅荣

谷物化学与品质分析比色法测定粮食脂肪酸值的研究严梅荣(南京财经大学食品科学与工程学院 210003)摘 要 脂肪酸值是粮食储存品质的重要指标,本研究采用比色法来测定粮食脂肪酸值。
本方法使用石油醚提取粮食脂肪酸,利用异辛烷,双-(2-基己基)磺基丁二酸钠和pH=9.0的酚红T ris/HCl溶液形成的透明反胶团体系进行比色分析。
通过比色法和国标法相比较测定了玉米粉、糙米和小麦三种样品的脂肪酸值;结果表明:比色法和国标法两者之间相对误差分别为18.65%,11.24%和6.61%。
比色法的精密度较高,标准偏差相对值在2.0%和5.3%之间。
比色法具有快速灵敏、样品和试剂用量少、测定结果客观、便于大批量样品测定等优点。
关键词 比色法 粮食 脂肪酸值 反胶团 粮食在储藏过程中受到温度、水分和酶的影响,其脂类物质易发生水解和氧化反应。
水解造成粮食游离脂肪酸含量的增加,会对粮食的种用品质和食用品质产生不良影响。
粮食发生霉变时,霉菌产生的脂解酶可促使粮食水解。
由于脂肪酸值与储粮品质有很好的相关性,因此该值已作为粮食储存品质的重要指标,是粮食陈化判定的一个重要参数。
鉴于脂肪酸值对于粮食品质的重要意义,对其测定方法已引起了广泛研究。
为了测定粮食脂肪酸值,通常先用有机溶剂将粉碎试样中的游离脂肪酸提取出来,并经过滤等方法将其与固体物质分离后再进行含量测定,所以对于粮食脂肪酸值测定方法的研究主要集中在溶剂提取分离及提取后的测定两方面。
现行国标法GB/ T15684-1995采用无水乙醇提取粮食脂肪酸,克服了过去使用苯带来的毒性及对环境的严重污染。
此外,乙醇极性明显大于苯,增加溶剂极性可加速破坏脂肪酸与细胞膜和脂蛋白等物质之间的结合〔1〕,提高提取速度,适合快速测定法的需要,所以在GB/ T15684-1995中提取脂肪酸的时间可减少至10 min。
但是溶剂极性的增大也增加了提取粮食非游离脂肪酸的酸性物质的可能性,同时乙醇可溶解醇溶性酶蛋白也会干扰测定。
MMFSCNG粮食油料检验脂肪酶活动度测定法

MM_FS_CNG_0391粮食油料检验脂肪酶活动度滴定法MM_FS_CNG_0391粮食、油料检验脂肪酶活动度测定法1.适用范围本标准适用于商品粮食脂肪酶活动度的测定。
2.主要试剂和仪器.主要试剂1%百里香酚酞乙醇溶液;氢氧化钠乙醇溶液;乙醇和乙醚(4∶1)混合液;甲苯;缓冲液:量取1N乙酸溶液250ml和1N乙酸铵溶液25ml,混合后,加水至1000ml;纯油:量取向日葵油(或用纯花生油代替)约250g注入分液漏斗中加2%碱液100~150ml,摇荡后,静置分层,弃去碱液。
用水将油洗至中性,静置后,将油通过氯化钙柱干燥备用。
.仪器锥形瓶:100ml;移液管:5ml;分液漏斗:500ml;低温烘箱;研钵、细口瓶等。
3.过程简述称取试样(带壳油料称子仁)2g倒入研钵中,加入1ml纯油,混匀,加入5ml缓冲液,研磨成稀糊状,转入锥形瓶中,用5ml水洗净研钵。
锥形瓶中加3滴甲苯,用称量皿盖上瓶口,置于30℃烘箱内保温24h。
取出,加入乙醇乙醚混合液50ml,静置5min,加百里香酚酞指示剂,用碱乙醇溶液滴定至终点(浅蓝色),记下用去的碱液毫升数(V1)。
另称取2g试样做对照试验,除不用30℃保温外,其余操作同上,记下用去的碱液毫升数(V2)。
4.结果计算脂肪酶活动度按下列公式计算:脂肪酶活动度(ml碱液/1g试样)=(V1-V2)·N×1000 W(100-M)式中:V1——试样滴定用去碱液体积,ml;V2——对照试验用去碱液体积,ml;N——实际碱液浓度,N;W——试样重量,g;M——试样水分百分率,%。
双试验结果允许差不超过平均值的10%,取平均值为测定结果。
测定结果取小数点后第一位。
5.来源:GB 5523—85。
预包装小麦粉中脂肪酶活性检测

预包装小麦粉中脂肪酶活性检测作者:李锦才何美霞邓海玲来源:《中国科技博览》2016年第12期[摘要]本文以植物油为底物,在37℃下进行酶催化反应24h后,采用滴定法测定预包装小麦粉中的脂肪酶活力。
该方法准确度较高,重复性较好,标准偏差(RSD)为5.2%~9.2%(n=6)。
[关键词]小麦粉;脂肪酶活力;滴定法中图分类号:TS202.3 文献标识码:A 文章编号:1009-914X(2016)12-0099-01脂肪酶是一种重要的水解酶类,在食品、药品、化工等行业得到广泛的应用。
继禁止在小麦粉中添加过氧化苯甲酰和过氧化钙这两种增白剂之后,脂肪酶在小麦粉增白作用中所表现出来的优异性被人们所重视。
目前,脂肪酶作为面粉改良剂之一,已经广泛应用于小麦粉加工行业。
脂肪酶活性检测方法有浊度测定法、Wilhelmy平板法、红外线光谱学法、酶联免疫吸附测定等方法。
但这些方法不适合测定小麦粉的脂肪酶活力。
本文旨在探讨一种新的方法,能准确检测添加了脂肪酶的小麦粉中的脂肪酶活力。
1 材料与方法1.1 试剂脂肪酶(来源于南极假丝酵母,酶活力~0.3U/mg);磷酸盐缓冲溶液(pH7.5);氢氧化钠标准溶液(0.05000mol/L);石油醚(沸程为30~60℃);乙醚-乙醇混合液(2+1);酚酞指示剂(10g/L);植物油;市售小麦粉10个。
1.2 仪器BSA323S-CW电子天平(北京赛多利斯);GM200刀式混合研磨仪(德国Retsch);INE600电热恒温培养箱(德国 Memmert);数字瓶口滴定器(德国 BRAND)。
1.3 实验方法1.3.1 试样的制备准确称取混合均匀的小麦粉样品100g,转移到制样杯中,加入60g磷酸盐缓冲溶液和40g 植物油,然后用混合研磨仪充分研磨均匀。
将混合物分成2份,分别放入编号为A、B两个500mL广口瓶中。
将B瓶盖上玻璃盖,放入120℃干燥箱中加热10min。
待B瓶冷却后,将A、B瓶同时放入37℃恒温培养箱中,准确反应24h后取出。
稻谷脂肪酸值的测定

稻谷脂肪酸值的测定1. 简介在农产品的品质评价过程中,脂肪酸是一个重要的指标。
脂肪酸的含量和组成对农产品的营养价值、口感和储存稳定性有着重要影响。
因此,测定稻谷中脂肪酸的含量和组成是一项重要的研究任务。
2. 稻谷脂肪酸测定方法2.1 采样与样品处理•从不同产地的稻谷场地中随机采集稻谷样品。
•将采集的稻谷样品除去杂质和异物,并晾干。
•将晾干后的稻谷样品进行研磨,得到均匀的粉末样品。
2.2 脂肪酸提取•取一定量的稻谷粉末样品,加入适量的溶剂(如己烷)进行浸泡。
•使用超声波浴进行提取,提取时间和提取温度可以根据实际情况进行调整。
•将提取液过滤或离心,得到脂肪酸提取物。
2.3 脂肪酸甲酯化•将脂肪酸提取物与甲醇和硫酸进行反应,将脂肪酸转化为甲酯化产物。
•反应时间和反应温度需要根据不同的样品和实验要求进行优化。
•将甲酯化产物进行萃取、洗涤和干燥处理,得到脂肪酸甲酯化产物。
2.4 脂肪酸分析•使用气相色谱仪(GC)进行脂肪酸的分析。
•将脂肪酸甲酯化产物注入GC进行分离和定量。
•GC条件需要根据不同的脂肪酸和实验目的进行调整。
•通过比对标准物质,确定不同脂肪酸的峰值。
3. 稻谷脂肪酸值分析结果的解读3.1 主要脂肪酸含量分析•通过GC分析,得到不同稻谷样品中各个脂肪酸的含量。
•根据各个脂肪酸的峰值面积,计算出相对含量或相对百分含量。
•比较不同样品中各个脂肪酸的含量,分析其差异。
3.2 脂肪酸组成分析•根据不同脂肪酸的相对含量,计算出脂肪酸的组成比例。
•比较不同样品中脂肪酸组成的差异,分析其对稻谷品质的影响。
3.3 脂肪酸结构分析•对某些特定的脂肪酸进行结构分析,如是否存在双键、羟基等。
•利用其结构特点对脂肪酸的性质进行解释。
4. 应用与意义4.1 稻谷营养价值研究•通过脂肪酸的分析,了解稻谷中不同脂肪酸的含量和组成。
•分析不同脂肪酸对稻谷的营养价值的影响。
4.2 品质评价及稻谷加工应用•脂肪酸含量和组成是评价稻谷品质的重要指标之一。
脂肪酶酶活测定方法

附录A(规范性附录)脂肪酶酶活测定方法A.1 原理碱性脂肪酶可将甘油酯(油、脂)水解,在不同阶段可释放出脂肪酸、甘油二酯、甘油单酯及甘油。
水解生成的脂肪酸,可以用标准的碱溶液滴定,以滴定值表示酶活力。
反应式为:RCOOH+NaOH RCOONa+H2OA.2 适用范围本规定仅适用于脂肪酶对油脂水解活性测定方法。
A.3 用语定义A.3.1 酶活在一定条件下(温度36℃和pH9.4),水解甘油三酯每分钟生成1μmol脂肪酸的酶量,即为一个国际单位,以u/ml或者u/g表示。
A.3.2 基质被酶水解的物质,又称为底物。
A.4 试剂A.4.1 0.05 mol/LGly-NaOH缓冲液(pH9.4)A液:0.2 mol/L NaOH,称取NaOH(A.R)8.0 g,用蒸馏水定容至1000 ml;B液:0.2 mol/L Gly,称取甘氨酸15.014 g,用蒸馏水定容1000 ml;使用前取A液16.8 ml + B液50 ml,加部分蒸馏水稀释,再用酸度计调节pH至9.4,定容到200 ml。
A.4.2 橄榄油分析纯。
A.4.3 4%聚乙烯醇(PVA)溶液称取聚乙烯醇40 g(聚合度1750+50),加1000 ml 0.05 mol/L pH 9.4Gly - NaOH 缓冲液,沸水浴完全溶解后,冷却,必要时过滤,溶解过程中蒸发的水分要用蒸馏水补充,定容至1000 ml。
A.4.4 乙醇含量在95 %以上,为分析纯。
A.4.5 0.01 mol/L NaOH称取0.40 g A.R的NaOH,溶于新制备的冷却蒸馏水中并定容至1000 ml,置冰箱。
取分析纯邻苯二甲酸氢钾(A.R)少量于称量瓶中,105℃烘干至恒重(约2小时),然后称取4份,每份各0.600 g,分别放入4个100ml容量瓶中,加蒸馏水定容至刻线,溶解后,分别取10ml至4个250ml的三角瓶中,各取加入40 ml蒸馏水,摇允后,加三滴1 %酚酞,用待标定的NaOH溶液滴定至微红,即为终点。
生化检测实验讲义

生化检测实验讲义实验一粮食、油料检验-脂肪酸值测定法一、实验目的粮食在储藏过程中受到温度、水分和酶的影响,其脂类物质易发生水解和氧化反应。
水解造成粮食游离脂肪酸含量增加,对粮食的种用品质和食用品质产生不良影响。
粮食游离脂肪酸含量以脂肪酸值表示,即中和100g粮食试样中的游离脂肪酸值所需氢氧化钾的毫克数。
通过脂肪酸值的测定,可以判断粮食品质的变化情况,推测储藏方法是否适当。
通过本实验要求掌握测定脂肪酸值的技术。
二、原理浸出法。
脂肪酸能溶于有机溶剂,利用苯来浸出脂肪酸,然后在酒精溶液中用标准KOH溶液中和脂肪酸,根据滴定时所消耗的碱液数量,就可求出脂肪酸值。
三、材料、仪器和试剂1、材料大米2、仪器带塞锥形瓶,量筒,移液管,微量滴定管,表面皿,天平,振荡器,漏斗3、试剂(1)、0.01N KOH(或NaOH)乙醇(95%)溶液先配制约0.5N的KOH水溶液,再取20 ml,用95%乙醇稀释至500mL(2)、苯,95%乙醇(3)、0.04%酚酞乙醇溶液0.2g酚酞溶于500ml 95%乙醇溶液中。
四、操作方法1、浸出称取事先磨细的大米粉20±O.Olg于200ml或250ml锥形瓶中,加入50ml苯,加塞摇动几秒钟后,打开塞子放气,再盖紧瓶塞置振荡器振荡30min(或用手振荡45min),取出,将瓶倾斜静置数分钟,使滤液澄清。
注:粉碎后样品如在20℃以上室温放置,脂肪酸值会很快增加,因此,必须及时进行测定。
2、过滤用快速滤纸过滤,弃去最初几滴滤液后用量筒收集滤液25ml。
3、滴定将25ml滤液移入锥形瓶中,再用原量筒取25m1 0.04%酚酞乙醇溶液加入锥形瓶中,立即用氢氧化钾乙醇溶液滴定至呈现微红色半分钟内不消失为止。
记下所耗用氢氧化钾乙醇溶液毫升数V1。
4、空白试验取25m1 0.04%酚酞乙醇溶液,用氢氧化钾乙醇溶液滴定,记下耗用氢氧化钾乙醇溶液毫升数V2。
五、结果计算脂肪酸值以中和100g大米样品中游离脂肪酸所需氢氧化钾毫克数表示。
脂肪酶酶活测定方法

脂肪酶是一种特殊的水解酶,广泛地存在于动物组织、植物种子和微生物体中,是能水解甘油三酯或脂肪酸酯产生单或双甘油酯和游离脂肪酸,将天然油脂水解为脂肪酸及甘油,同时也能催化酯合成和酯交换的酶。
其在轻工、化工、医药、食品等行业有广泛的用途。
近年来,随着非水酶学和界面酶学的不断深入,脂肪酶应用也不断地扩展,被广泛应用于酯合成、手性化合物的拆分、化工合成中间体的选择性基团保护、高聚物的合成、肽合成等方面,应用前景广阔。
脂肪酶在微生物中有广泛的分布。
脂肪酶催化的反应是:甘油三酸酯+水→甘油二酸酯+游离脂肪酸→甘油酸酯+游离脂肪酸→甘油+游离脂肪酸。
脂肪酶只能在异相系统,即在油-水界面上作用,对水溶性底物无作用,这一点在有机合成中合成手性中间体方面具有很多的优越性。
1 滴定法(参照国家标准,适用于脂肪酶制剂)1.1 脂肪酶活力定义为1g固体酶粉(或1mL液体酶),在一定温度的pH条件下,1min水解底物产生1μmol的可滴定的脂肪酸,即为一个酶活力单位,以u/g(u/mL)表示。
1.2 测定原理脂肪酶在一定条件下,能使甘油三酯水解成脂肪酸、甘油二酯、甘油单酯和甘油,所释放的脂肪酸可用标准碱溶液进行中和滴定,用pH计或酚酞指示反应终点,根据消耗的减量,计算其酶活力。
反应式为:RCOOH+NaOH→RCOONa+H2O。
1.3 仪器设备恒温水浴箱,移液枪,高速匀浆机,pH计,电磁搅拌器1.4 试剂溶液95%酒精4%聚乙烯醇(PVA,聚合度1750±50):称取4g PVA,加蒸馏水80mL,沸水中加热,并不断搅拌,使其完全溶解,慢速搅拌,以免产生过多气泡,冷却后定容至100mL,用双层纱布过滤后备用。
橄榄油(分析纯)底物溶液:按4%聚乙烯醇:橄榄油=3:1比例混合,用高速匀浆机处理6min(分两次处理,间隔5min,每次处理3min)。
稻谷及制品脂肪酸检测

稻谷及制品脂肪酸检测稻谷及制品脂肪酸检测稻谷及制品脂肪酸检测是一种用于评估稻谷及其制品中脂肪酸组成的分析方法。
该检测方法可以帮助我们了解稻谷及其制品的营养价值和潜在食用风险。
下面将按照步骤逐步介绍这个检测过程。
第一步是样品准备。
在进行脂肪酸检测前,我们需要从稻谷或其制品中提取脂肪。
为此,我们可以使用溶剂提取法或机械压榨法来获得脂肪样品。
这些样品通常需要经过粉碎和混合,以确保样品的均匀性和可靠性。
第二步是脂肪提取。
通过溶剂提取法,我们可以将脂肪从稻谷中分离出来。
这一步通常使用有机溶剂(如正己烷)来提取脂肪。
提取后,我们需要通过蒸发有机溶剂的方法将脂肪样品浓缩。
第三步是脂肪甲酯化。
在进行脂肪酸检测之前,我们需要将脂肪样品转化为脂肪酸甲酯。
这可以通过与甲醇和硫酸反应来实现。
甲酯化反应可以将脂肪酸与甲醇酯化,使其更易于分析。
第四步是脂肪酸分析。
在脂肪酸分析中,我们通常使用气相色谱法(GC)或液相色谱法(HPLC)来确定脂肪酸的组成。
GC是最常用的方法,它可以通过脂肪酸在气相色谱柱中的保留时间来分离和定量不同的脂肪酸。
通过与标准品比对,我们可以确定样品中脂肪酸的含量。
第五步是数据分析。
一旦脂肪酸分析完成,我们需要对结果进行数据分析。
我们可以计算每种脂肪酸的相对百分比或绝对含量,并进一步评估其营养特性。
通过比较不同样品之间的脂肪酸组成,我们可以了解它们的营养差异和潜在影响。
总结起来,稻谷及制品脂肪酸检测是一种用于评估稻谷及其制品中脂肪酸组成的分析方法。
通过样品准备、脂肪提取、脂肪甲酯化、脂肪酸分析和数据分析等步骤,我们可以了解这些食物的脂肪酸组成和营养特性。
这种检测方法对于评估食物的营养质量和制定科学的饮食建议具有重要意义。
粮食中脂肪酸值含量的测定

粮食中脂肪酸值含量的测定GB 5510—85本标准适用于商品粮食中脂肪酸值含量的测定。
1 仪器和用具1.1 带塞锥形瓶:150 ml;1.2 量筒;1.3 移液管;1.4 微量滴定管;1.5 表面皿;1.6 天平:感量0.01 g;1.7 电动振荡器;1.8 漏斗等。
2 试剂2.1 0.01 N氢氧化钾(或氢氧化钠)乙醇(95%)溶液:先配制约0.5 N氢氧化钾水溶液,再取20 mL,用95%乙醇稀释至500 ml;2.2 苯、95%乙醇;2.3 0.04%酚酞乙醇溶液(0.2 g酚酞溶于500 ml 95%乙醇溶液中)。
3 操作方法3.1 试样制备:从平均样品中分取样品约80 g,粉碎使90%以上试样通过40目筛。
粉碎后试样加在20℃以上室温放置,脂肪酸值会很快增加,因此,必须及时进行测定。
3.2 浸出:称取试样20±0.01 g(脂肪酸值高于60 mgKOH/100 g时称试样10 g)于200 ml或250 ml锥形瓶中,加入50 ml苯,加塞摇动几秒钟后,打开塞子放气,再盖紧瓶塞置振荡器振荡30 min(或用手振荡45 min),取出,将瓶倾斜静置数分钟,使滤液澄清。
3.3 过滤:用快速滤纸过滤,弃去最初几滴滤液后用25 ml比色管或量筒收集滤液25 ml立即准确调节至刻度。
3.4 滴定:将25 ml滤液移入锥形瓶中,再用原比色管或量筒取25 ml酚酞乙醇溶液加入锥形瓶中,立即用氢氧化钾乙醇溶液滴定至呈现微红色半分钟内不消失为止。
记下所耗用氢氧化钾乙醇溶液毫升数(V1)。
3.5 空白试验:取25 ml酚酞乙醇溶液同3.4用氢氧化钾乙醇溶液滴定,记下耗用氢氧化钾乙醇溶液毫升数(V0)。
4 结果计算脂肪酸值以中和100 g粮食试样中游离脂肪酸所需氢氧化钾毫克数表示。
脂肪酸值按下列公式计算:式中:V1──滴定试样用去的氢氧化钾乙醇溶液体积,ml;V──滴定25 ml酚酞乙醇溶液用去氢氧化钾乙醇溶液的体积,ml;50──浸泡试样用苯的体积,ml;25──用于滴定的滤液体积,ml;N──氢氧化钾(或氢氧化钠)乙醇溶液的当量浓度;56.1──氢氧化钾毫克当量;W──试样重量,g;M──试样水分百分率,%(测定面粉脂肪酸值时按湿基计算,不必减去水分);100──换算为100 g试样重量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
粮食脂肪酶活力、脂肪酸及其组成测定
试验方法
脂肪酶活力的测定
参考文献(Aizono et al.,1973)的方法。
准确称取6.00g糙米粉,加入Tris-HCl (pH7.5)定容至25mL,振荡均匀,置于4℃下浸提1 h,然后于4℃下10000 r/min 冷冻离心15min,过滤。
取滤液l.5mL于试管中,依次加入l mL 0.5 mol/L KCl,l mL 5 m mol/L CaCl2,0.5mL Tris-HCl (pH7.5),然后置于37℃恒温水浴摇床中保温10 min,加入l mL三乙酸甘油酯在37℃恒温水浴摇床中震荡反应l h,沸水浴灭酶10min。
以酚酞-乙醇为指示剂,采用0.05 mol/L NaOH滴定至微红,记录滴定所消耗的体积V。
脂肪酶活力定义为:在上述反应条件下,每分钟消耗0.05 mol/L NaOH 0.01mL为1个酶活力单位U。
酶活力(U) = (V-V0)×l00 / t
其中:V为样品所消耗NaOH的体积(mL),V0为空白消耗NaOH的体积(mL),t为反应时间(min),100为NaOH体积转化为酶活力单位的系数。
数据处理以每克绝干糙米中脂肪酶活力进行分析。
游离脂肪酸含量的测定
参考GB/T15684-1995的方法。
准确称取5.00 g糙米粉于250 mL锥形瓶中,加入40 mL无水乙醇在25 ℃恒温振荡10 min,过滤。
取25 mL滤液用标准KOH-乙醇溶液滴定。
以每100g绝干稻谷消耗的KOH毫克数表示游离脂肪酸的含量。
脂肪酸组成的测定
样品处理:准确称取糙米粉10.00g置于100mL锥形瓶中,加入20mL氯仿-甲醇溶液(体积比为2:l),用均质机均质20s,然后用5mL氯仿-甲醇溶液洗涤均质
机,洗涤两次,洗涤液并入物料中。
静置l h后过滤到具塞量筒,用20 mL氯仿-甲醇溶液分两次清洗锥形瓶,去掉滤渣。
然后加入10 mL 0.88% NaCl溶液到具塞量筒中,静置过夜。
吸出上层液,读取下层液体积,然后吸取下层液5 mL加入到螺纹小管中,N2吹扫,至螺纹管底部出现黄色小油滴,停止吹扫。
加入2 mL H2SO4-甲醇(质量分数为12%)溶液,旋紧螺纹管管口,置于90℃下水浴2h,然后加入2 mL正己烷,振荡均匀。
制得样品密封冷藏与4℃条件下,准备测定。
测定条件:
气相色谱条件:色谱柱:30m×0.25mm×0.25μm VF-5柱;载气:氦气;柱温:程序升温,40 ℃~250 ℃,升温速率8 ℃/min,恒温5 min;进样口温度280 ℃;不分流进样。
质谱条件:电离方式EI,发射电流150 μA,检测器电压350 V,离子源温度250 ℃,传输线温度250 ℃,电子能量70 eV,扫描范围50~650 (相对原子质量单位) 仪器检测限为0.l mmol/L。
张习军. 微波处理对稻谷品质的影响[D].武汉:华中农业大学硕士学位论文,2008。
