15年版微生物原始记录(3)资料
2015版中国药典微生物限度记录

培养基的配制
使用容器
配制培养基使用的容器应该是玻璃器皿或搪瓷器皿等。 禁用金属容器如:铁、铜、铝容器。
培养基制备方法
实验室指南
溶解培养基应当用水浴加热进行溶解。 测定pH值 矫正pH,配制培养基必须矫正pH,并进行验证。 培养基灭菌后冷却至室温( 25 ℃)进行 pH 测试。培 养基pH范围不得超过规定的正负0.2。 <高压灭菌前的pH值应比最终pH值高0.2左右>
2015版药典微生物检查法修订内容——结果判断 微生物计数法和控制菌检查法结果判断
不再规定复试,通过实验室调查、回顾、分析结果 的准确性。
限度标准以指数方式表示:
10的一次方cfu:可接受的最大限度为20;
10 的二次方 cfu ,可接受的最大限度为 200 ;以此类 推。
2015版药典通则非无菌产品微生物限度标准增订内容
4.微生物限度标准
5.控制菌检查:保留部分生化试验 6. 修订后,控制指标更合理,计数方法及标准合理、 准确,反映真实污染情况
2015版药典微生物检查法修订内容——环境要求
目前我国药品微生物检测对环境的要求与国际标准 分级不一致。 国际要求:只要洁净环境分为 A 级、 B 级、 C 级、 D 级。 A (百级)、 B (千级)、 C (万级)、 D (十万级)。 协调案要求:试验在经过设计的可避免外来微生物 污染供试品的环境下进行。 我国修订后药品微生物限度检查对检测环境的要求: 无菌环境下符合微生物技术检验要求,单向流空气 区域内进行。
(二)2015版药典微生物检查法修订内容——环境要求
1. 强调了“微生物实验的各项工作应在专属的区域 进行,以降低交叉污染、假阳性结果和假阴性结 果的风险”。 2.无菌检查 修订前 万级(C级)下局部百级(A)或隔离器 修订后 B+A级或建议D级背景下隔离器 3.微生物限度检查 修订前 万级(C)下局部百级(A) 修订后 不低于D级背景下的B级单向流空气区域内 进行。
微生物检验原始记录
1:100
1:1000
分析号
1
2
3
4
5678源自924±2h初发酵
48h±2h初发酵
BGLB分离培养
检验结论
备注
备注:
1.+表示产气;-表示未产气。
2.24h±2h产气者进行复发酵试验,如未产气则继续培养至48h±2h,产气者进行复发酵试验。
3.复发酵用接种环从产气的LST肉汤管中分别取培养物1环,移种于BGLB管中,培养48h±2h,观察产气情况。
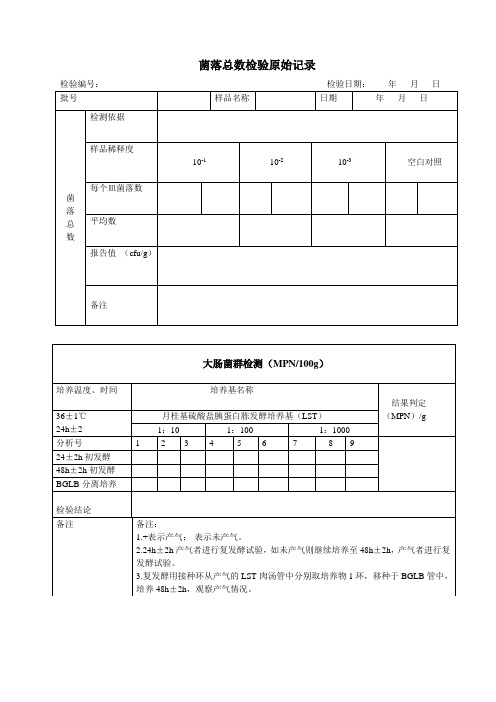
菌落总数检验原始记录
检验编号:检验日期:年月日
批号
样品名称
日期
年月日
菌
落
总
数
检测依据
样品稀释度
10-1
10-2
10-3
空白对照
每个皿菌落数
平均数
报告值(cfu/g)
备注
大肠菌群检测(MPN/100g)
培养温度、时间
培养基名称
结果判定
(MPN)/g
36±1℃
24h±2
月桂基硫酸盐胰蛋白胨发酵培养基(LST)
微生物限度检验原始记录

10-3
阴性对照
1
1
1
2
2
2
平均
平均
平均
结 果: cfu/g
2.霉菌、酵母菌检查:玫瑰红钠琼脂培养基批号: 培养温度: ℃ 培养箱:SPX-150B-Z生化培养箱
24小时观察结果
48小时观察结果
72小时观察结果
碟号
10-1
10-2
阴性对照
碟号
10-1
10-2
阴性对照
碟号
10-1
10-2
阴性对照
常规法 加pH7.0无菌氯化钠-蛋白胨缓冲液: ml □保温振摇法 □研钵法
1.细菌检查: 营养琼脂培养基批号: 培养温度: ℃ 培养箱:SPX-150B-Z生化培养箱
24小时观察结果
48小时观察结果
72小时观察结果
碟号
碟号
10-1
10-2
10-3
阴性对照
碟号
10-1
EMB或MacC平板
TSI斜面
生化反应
血清凝集
结果:
结果:
5.大肠菌群: 6.活螨
0.1g或0.1ml
0.01g或0.01ml
0.001g或0.001ml
活螨检查
直接法□ 集螨法□ 漂浮法□ 分离法□
结果: (个∕g或ml)
结果:
检验人: 复核人:
微生物限度检验原始记录
文件标题
微生物限度检验记录
第1页
共1页
项目
部 门/职 务
姓 名
日 期
起 草
质量控制部
审 核
质量控制部
审 核
质量保证部
批 准
质量副总经理
颁发部门
微生物检测原始记录

微生物检测原始记录菌落总数与大肠菌群检验原始记录共页第页样品名称样品编号仪器设备名称仪器设备编号检验依据检验环境温度:湿度:一、菌落总数cfu/ml(g) 培养基名称:培养温度:培养时间:年月日时--- 年月日时稀释倍数空白∕稀释液对照-1 10-2 10-3 10-4原液10平板1平板2平均值检测结果:二、大肠菌群MPN/100ml (g)培养基名称:培养温度:培养时间:年月日时--- 年月日时LST 发酵1ml × 3 0.1ml × 3 0.0 1ml × 3初发酵结果复发酵试验检测结果主检:年月日校核:年月日菌落总数和大肠菌群检测原始记录共页第页样品名称样品编号仪器设备名称仪器设备编号检验环境温度:湿度:检验依据GB4789.2-2010 GB4789.3-2010一、菌落总数cfu/ml(g) 培养基名称:培养温度:36±1℃培养时间:年月日时--- 年月日时样品数样1 样2 样3 样4 样5稀释倍数平板 1 平板 2 平板 1 平板 2 平板1 平板2 平板1 平板 2 平板1 平板2原液-110-210-310-410空白对照检验结果二、大肠菌群cfu/ml(g) 培养基名称:培养温度:36±1℃培养时间:年月日时--- 年月日时样1 样2 样3 样4 样5 样品数平板 1 平板 2 平板 1 平板 2 平板1 平板2 平板1 平板 2 平板1 平板2 稀释倍数原液-110-210-310-410空白对照验证试验检验结果主检:年月日校核:年月日XXXX检测有限公司水质微生物检验原始记录共页第页样品名称样品编号设备名称检验环境温度:湿度:检验依据一、菌落总数cfu/ml(g) 培养温度:36±1℃-1 10-2 10-3 10-4 10-5 稀释倍数原液10平板 1平板 2平均值检测结果:二、总大肠菌群MPN/100ml (g)培养温度:36±1℃培养时间:LST 培养基10ml ×1ml ×0.1ml ×0.01m l×发酵结果验伊红美蓝琼脂平板证试革兰氏染色乳糖复发酵验检测结果三、大肠埃希氏菌MPN/100ml (g)验自总大肠菌群乳糖发酵试样中的阳性管中取一滴转接伊红美蓝琼脂平板证种与EC 培养基中置44.5℃培养24 小时观察试验四、耐热大肠菌群MPN/100ml (g)将总大肠菌群多管发酵法初发酵或产气的管中验培养后的EC-MUG 管在暗处用用无菌金属接种环将试液接种到EC-MUG 管中波长366nm 功率为6W 的紫外光证置44.5℃培养24 小时观察灯照射试验主检:年月日校核:年月日乳酸菌与大肠菌群检测记录共页第页样品名称样品编号仪器设备名称检验环境温度:湿度:检验依据一、乳酸菌cfu/ml(g) 培养温度:36±1℃培养时间:稀释倍数原液10-3 10-4 10-5 10-6 10-7平板1平板2平均值检测结果:二、大肠菌群MPN/100ml (g)培养温度:培养时间:年月日时--- 年月日时LST 发酵1ml × 3 0.1ml × 3 0.0 1ml × 3发酵结果伊红美蓝琼脂平板验证试验革兰氏染色乳糖复发酵检测结果主检:年月日校核:年月日致病菌检验原始记录共页第页样品名称样品编号仪器设备名称仪器设备编号检验环境温度:湿度:致病菌培养温度:培养时间:年月日时 ---年月日时金黄色葡萄球菌25g 样品+225ml7.5% (定性检验)氯化钠肉汤,均质检验依据:将上述培养物,分别划线接种到涂片染色观察溶血血浆凝固酶试验Baird-Parker 和血平板实验现象检测结果前增菌增菌分离沙门氏菌将上述培养物, 25g样品检验依据:+225mlBPW ,均质分别取 1ml 转接种于 10mlTTB 与 10mlSC 内,进行前增菌再次将上述培养物,分别划线接种于 BS 琼脂平板 XLD 琼脂平板生化试验实验现象检测结果志贺氏菌检验依据:25g 样品+225ml GN 增菌液将上述培养物分别划线接种于HE 平板和 EMB 平板划线接种 TSI, 葡萄糖半固体生化试验实验现象检测结果25g 样品+225ml 生理溶血性链球菌盐水,吸取 5ml 接种于50ml 葡萄糖肉汤曾涂片染色观察溶血血浆凝固酶试验检验依据:菌,划线接种于血平板实验现象检测结果主检:年月日校核:年月日霉菌和酵母菌检验原始记录共页第页样品名称样品编号仪器设备名称仪器设备编号检验依据检验环境温度:湿度:培养基名称培养温度:28±1℃培养时间:年月日时--- 年月日时:观察培养培养温度观察时间观察结果第1 天第2 天第3 天第4 天第5 天观察结论:菌落计数:培养温度:28±1℃培养时间:年月日时--- 年月日时-1 稀释倍数空白∕稀释液对照原液10-210-310-410平板 1平板 2平均值检测结果主检:年月日校核:年月日商业无菌检验原始记录共页第页样品名称样品编号仪器名称检验环境温度:湿度:仪器编号检验依据1、保温试验:将完整试样一份置于36±1℃培养箱保温十天,每天观察胖听、泄漏现象。
2015版中国药典微生物限度记录ppt课件

假单胞菌、金黄色葡萄球菌、梭菌、白色念珠菌
10
2015版药典微生物检查法修订内容——结果判断 微生物计数法和控制菌检查法结果判断 不再规定复试,通过实验室调查、回顾、分析结果
的准确性。 限度标准以指数方式表示: 10的一次方cfu:可接受的最大限度为20; 10的二次方cfu,可接受的最大限度为200;以此类
13
2015版药典抑菌效力检查法修订内容
抑菌剂:是指抑制微生物生长的化学物质,有时也称防腐剂。 1.抑菌效力检查法系用于测定无菌及非无菌制剂的抑菌活性,
以评价最终产品的抑菌效力。 2.用于指导生产企业在研发阶段制剂中抑菌剂浓度的确定,
以防止制剂在正常贮藏或使用过程中可能发生的微生物污 染和繁殖是药物变质而对使用者造成危害,尤其是多剂量 包装的制剂。 3.抑菌剂不能替代药品生产的GMP管理,不能作为非无菌制 剂降低微生物污染的唯一途径。 4.所有抑菌剂都具有一定的毒性,制剂中抑菌剂的量应为最 低有效量。
型限制 4.微生物限度标准 5.控制菌检查:保留部分生化试验 6.修订后,控制指标更合理,计数方法及标准合理、
准确,反映真实污染情况
5
2015版药典微生物检查法修订内容——环境要求
目前我国药品微生物检测对环境的要求与国际标准 分级不一致。
国际要求:只要洁净环境分为A级、B级、C级、D级。 A(百级)、B(千级)、C(万级)、D(十万级)。 协调案要求:试验在经过设计的可避免外来微生物
2015版《中国药典》微生物学 检验技术实施指导与修订解读
1
内容简介 一、2015年版《中国药典》微生物学检验的发展和修订 二、非无菌产品微生物检查:微生物计数法 .修订依据 .格式变化 .适用范围 ④.环境要求 ⑤.微
微生物限度检查记录 版

表:微生物限度检查记录(通用)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)微生物限度检查记录(30~35℃,3~5天)20℃~25℃,5~7天)沙氏葡萄糖琼脂培养基(配制批号:)三、控制菌检查(30-35℃)表:胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)(30℃~35℃)胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)五、耐胆盐革兰阴性菌检查胰酪大豆胨液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:)表:(含药材原粉的片剂)胰酪大豆胨液体培养基(配制批号: )、麦康凯液体培养基(配制批号: )麦康凯琼脂培养基(配制批号: )(30℃~35℃)胰酪大豆胨液体培养基(配制批号: )、RV 沙门增菌液体培养基(配制批号: ),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号: )、三糖铁琼脂(配制批号: )五、耐胆盐革兰阴性菌检查胰酪大豆胨液体培养基(配制批号: )、肠道菌增菌液体培养基(配制批号: ),紫红胆盐葡萄糖琼脂培养基(配制批号: )表:微生物限度检查记录(蛇胆川贝液)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)表:微生物限度检查记录(30~35℃,3~5天)20℃~25℃,5~7天)沙氏葡萄糖琼脂培养基(配制批号:)胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)表:微生物限度检查记录(内包材)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)。
微生物限度记录2015
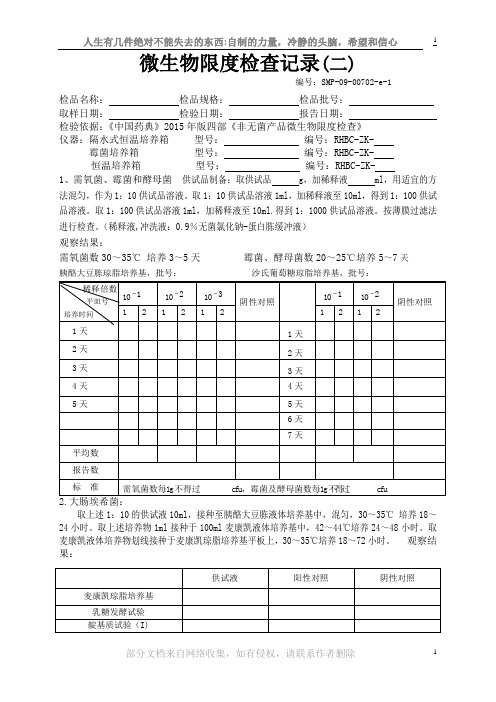
微生物限度检查记录(二)编号:SMP-09-00702-e-1检品名称:检品规格:检品批号:取样日期:检验日期:报告日期:检验依据:《中国药典》2015年版四部《非无菌产品微生物限度检查》仪器:隔水式恒温培养箱型号:编号:RHBC-ZK- 霉菌培养箱型号:编号:RHBC-ZK-恒温培养箱型号:编号:RHBC-ZK-1、需氧菌、霉菌和酵母菌供试品制备:取供试品 g,加稀释液 ml,用适宜的方法混匀,作为1:10供试品溶液。
取1:10供试品溶液1ml,加稀释液至10ml,得到1:100供试品溶液。
取1:100供试品溶液1ml,加稀释液至10ml.得到1:1000供试品溶液。
按薄膜过滤法进行检查。
(稀释液,冲洗液:0.9%无菌氯化钠-蛋白胨缓冲液)观察结果:需氧菌数30~35℃培养3~5天霉菌、酵母菌数20~25℃培养5~7天胰酪大豆胨琼脂培养基,批号:沙氏葡萄糖琼脂培养基,批号:取上述1:10的供试液10ml,接种至胰酪大豆胨液体培养基中,混匀,30~35℃培养18~24小时。
取上述培养物1ml接种于100ml麦康凯液体培养基中,42~44℃培养24~48小时。
取麦康凯液体培养物划线接种于麦康凯琼脂培养基平板上,30~35℃培养18~72小时。
观察结果:取供试品,用胰酪大豆胨液体培养基作为稀释剂制成1:10供试液,混匀,在20~25℃培养约2小时。
取上述预培养物10ml接种至100ml肠道菌液体培养基中,30~35℃培养24~48小时后,划线接种于紫红胆盐葡萄糖琼脂培养基平板上,30~35℃培养18~24小时。
取相当于0.1g、0.01g和0.001g(或0.1ml、0.01ml和0.001ml)的供试品的预培养物接种至 ml的肠道菌液体培养基中,30~35℃培养24~48小时。
取上述培养物分别划线接种于紫红胆盐葡萄糖琼脂培养基平板上,30~35℃培养18~24小时。
观察结果:取供试品10g或10ml,直接接种到200ml胰酪大豆胨液体培养基中,混匀,30~35℃培养18~24小时。
微生物检验原始记录

⑴菌落总数(平板计数琼脂36±1℃、48±2h)
序号
原液(1ml)
1:10稀释液(1ml)
1:100稀释液(1ml)
阴性对照
阳性对照
结果:CFU/mL
1
均值:
2
⑵霉菌、酵母菌计数(孟加拉虎红27±1℃5d)
序号
原液(1ml)
1:10稀释液(1ml)
1:100稀释液(1ml)
微生物检验原始记录
NO:
品名:包装规格:
批号:数量:
生产车间:检品数量:
检验人员:复核人员:
检验依据:检验目的:
检验日期:报告日期:
检验记录与结果:
1.取样:
(1)原液取样
(2)无菌称取样品25g或者25ml,置225ml灭菌的0.85%的生理盐水中,充分混匀,制成1:10稀释液。取1:10稀释液1ml置9ml灭菌的0.9%生理盐水中,制成1:100稀释液。
阴性对照
阳性对照
结果:CFU/mL
1
均值:
2
⑶大肠杆菌(月桂基磺酸盐胰蛋白胨【LST】肉汤,36±1℃、48±2h)
序号
原液(1ml)
1:10稀释液(1ml)
1:10稀释液(10ml)双料
1:100稀释液(1ml)
阴性对照
阳性对照
结果:MPN/mL
1
均值:
2
微生物检测原始记录文本

菌落总数与大肠菌群检验原始记录
共页第页
主检:年月日校核:年月日
菌落总数和大肠菌群检测原始记录
主检:年月日校核:年月日
XXXX检测有限公司
水质微生物检验原始记录
共页第页
主检:年月日校核:年月日
乳酸菌与大肠菌群检测记录
共页第页
主检:年月日校核:年月日
致病菌检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
培养温度:28±1℃培养时间:年月日时 --- 年月日时:
菌落计数:
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
微生物检验原始记录
染色:
TCBS: 无盐胰
胨水: 副 30g/L: 溶 NaCl三 性 糖革铁兰琼氏 弧 染色: 菌 70g/L:
100g/L: 生化试
验: TCBS:
T1N1: 氧酶试
验:
霍 TSI:
乱 弧
KIA:
菌 AGS:
T1N0:
T1N3: 生化试 验:
寄生虫
℃ h
℃ h℃ h
粘丝试 验:
℃ h℃ h
编 号: ℃ h ℃ h ℃ h 检验 结
℃ h℃ h℃ h℃ h
检验 结
℃ h℃ h
℃ h℃ h℃ h检验 结
检验 结
SN0172-92 SN0173-92 SNT1022-2001 93/140/EEC
检验日期: 检 验 员:
验讫 日审 核:
报告 日 复 核:
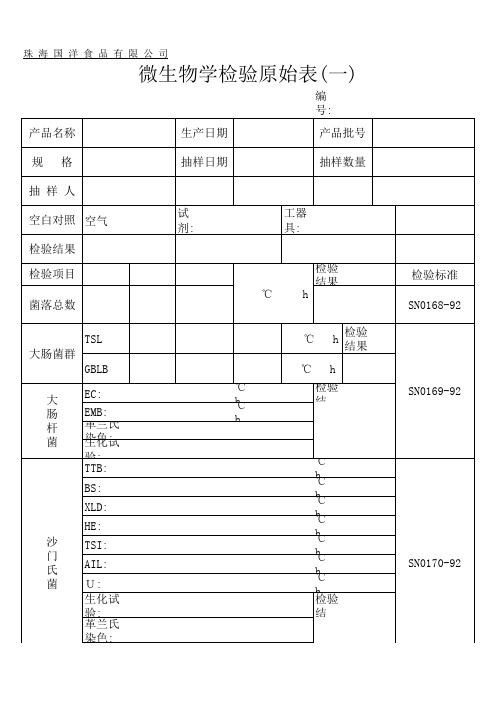
珠海国洋食品有限公司
微生物学检验原始表(一)
编 号:
产品名称
生产日期
产品批号
规格
抽样日期
抽样数量
抽样人 空白对照 空气 检验结果 检验项目 菌落总数
试
工器剂:具:来自检验结果℃
h
TSL 大肠菌群
GBLB
大 EC: 肠 EMB: 杆 革兰氏 菌 染生色化:试
验: TTB:
BS:
XLD:
HE: 沙 TSI: 门 氏 AIL: 菌 U:
生化试 验: 革兰氏 染色:
℃
h
检验 结果
℃h
℃
检验
h℃
结
h
℃ h℃ h℃ h℃ h℃ h℃ h℃ h检验 结
检验标准 SN0168-92 SN0169-92
SN0170-92
血清学 试验:
注射用水微生物计数原始记录

产品名称
注射用水
型号/规格
批量
取样量
取样日期
来源
检验日期
产品批号
产品编号
有效期至
请验单号
温湿度
报告日期
报告编号
检验依据
《中国药典》2015年版
试验方法:薄膜过滤法
试验组:取注射用水100ml至无菌滤杯中,过滤,过滤完毕,取出滤膜,菌面朝上,贴于R2A琼脂培养基上,平行制备2张滤膜。30〜35℃培ቤተ መጻሕፍቲ ባይዱ不少于5天,计数。
阴性对照:以100ml 0.9%无菌氯化钠代替供试液,按试验组方法和条件进行操作,制备1张滤膜。30〜35℃培养不少于5天,计数。
使用稀释液
0.9%无菌氯化钠,配制批号:
微生物计数
判断标准
100ml注射用水中需氧菌总数不大于10cfu,阴性对照无菌生长,为合格
培养基名称
R2A琼脂培养基
培养基配制编号
仪器名称
仪器编号
培养温度
培养时间
观察时间
注射用水
阴性对照
皿1
皿2
皿3
第1天
第2天
第3天
第4天
第5天
第6天
第7天
平均值
计数结果
结论:注射用水,批号,
微生物限度检查——微生物计数结果:
操作人:日期:复核人:日期:
微生物检测原始记录

微生物检测原始记录 Prepared on 22 November 2020
X X X X检测有限公司菌落总数与大肠菌群检验原始记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司
菌落总数和大肠菌群检测原始记录
共页第页
XXXX检测有限公司水质微生物检验原始记录
共页第页
XXXX检测有限公司
乳酸菌与大肠菌群检测记录
共页第页
主检:年月日校核:年月日
XXXX检测有限公司致病菌检验原始记录共页第页
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
共页第页
培养温度:28±1℃培养时间:年月日时 --- 年月日时:
菌落计数:
培养温度:28±1℃培养时间:年月日时 --- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
中国药典2015年版甲硝唑检验原始记录

【性状】㈠.外观性状1.检验结果:本品为。
2.标准规定:本品为白色至微黄色的结晶或结晶性粉末;有微臭。
本品在乙醇中略溶,在水或三氯甲烷中微溶,在乙醚中极微溶解。
3.结论:□符合规定□不符合规定检验人/日期:复核人/日期:㈡.熔点1.仪器:熔点仪型号、编号鼓风干燥箱型号、编号2.操作:取供试品适量,研细,置105℃干燥,然后分取供试品粉末适量,置熔点测定用毛细管中,借助长短适宜的洁净玻璃管,垂直放在实验台面上,将毛细管自上口放入使自由落下,反复数次,使粉末紧密集结在毛细管的熔封端直至装入供试品的高度为3mm。
俟熔点仪温度上升至149℃时,将装有供试品的毛细管浸入传温液中部;继续加热,调节升温速率为每分钟上升1.0~1.5℃,记录供试品在初熔至全熔时的温度,重复测定3 次,取其平均值,即得。
3.检验结果:①℃~℃②℃~℃③℃~℃(极差≤0.5℃)平均值= ℃~℃4.标准规定:熔点为159℃~163℃。
5.结论:□符合规定□不符合规定检验人/日期:复核人/日期:㈢.吸收系数1仪器:电子天平型号、编号紫外-可见分光光度计型号、编号2.试剂:盐酸溶液(9→1000)配制批号3.操作:取本品,精密称取约16.3mg,置50ml量瓶中,加盐酸溶液(9→1000)溶解并稀释至刻度,摇匀,精密量取2ml,置50ml量瓶中,加盐酸溶液(9→1000)稀释至刻度,摇匀制成每1ml中约含13μg的溶液,照紫外-可见分光光度法,在277nm的波长处测定吸收度,吸收系数(E%11cm)为365~389。
AV4.计算公式及结果:E%11cm =----------100WW = g A = V(稀释倍数)=E%1= =1cm)为365~389。
5.标准规定:吸收系数(E%11cm6.结论:□符合规定□不符合规定检验人/日期:复核人/日期:【鉴别】㈠ .1.仪器:电子天平型号、编号2.试剂:氢氧化钠试液配制批号稀盐酸配制批号3.操作及结果:取本品 mg(约10mg),加氢氧化钠试液2ml,微温,即得溶液(应为紫红色);滴加稀盐酸使酸性后即变成(应为黄色),再滴加过量氢氧化钠试液则变成(应为橙红色)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
15年版微生物原始记
录(3)
四川诺迪康威光制药有限公司
微生物限度检验原始记录(3)
:选择方法
(1)平皿法:取本品于 mlPH7.0无菌氯化钠—蛋白胨缓冲液中,溶解或稀释,制成1:10供试液备用。
取1:10供试液1 ml 于1个无菌平皿中,按平皿法测定其菌数。
每稀释剂每种培养基至少制备2个平皿。
(2)培养基稀释法:取本品于 mlPH7.0无菌氯化钠—蛋白胨缓冲液中,溶解或稀释,制成1:10供试液备用。
取1:10供试液1 ml于()个无菌平皿中,按平皿法测定其菌数。
(3)薄膜过滤法:取本品于 ml PH7.0无菌氯化钠—蛋白胨缓冲液中,混匀,过滤,冲洗后取出滤膜,菌面朝上贴于培养基平板上培养。
沉降菌落数:超净工作台:左中右,空白对照生物安全柜:左中右,空白对照
2
大肠埃希菌检查:结束培养时间:月日时菌株编号:CMCC(B)44102
耐胆盐革兰阴性菌检查:结束培养时间:月日时菌株编号:CMCC(B)44102
沙门菌检查:结束培养时间:月日时菌株编号:CMCC(B)50094
铜绿假单胞菌检查:结束培养时间:月日时菌株编号:CMCC(B)10104
金黄色葡萄球菌检查:结束培养时间:月日菌株编号:CMCC(B)26003
活螨:未检出()检出()
结论:本品所检项,结果符合规定()不符合规定()。
检验者:复核者:。
