国家食品药品监管总局公告2017年第35号――关于修订麦考酚类药品说
国家食品药品监督管理局关于修订转为处方药管理的含麻黄碱类复方

国家食品药品监督管理局关于修订转为处方药管理的含麻黄碱类复方制剂说明书的通知【法规类别】药品管理【发文字号】国食药监注[2012]339号【发布部门】国家食品药品监督管理局(原国家药品监督管理局)(已撤销)【发布日期】2012.11.23【实施日期】2012.11.23【时效性】现行有效【效力级别】部门规范性文件国家食品药品监督管理局关于修订转为处方药管理的含麻黄碱类复方制剂说明书的通知(国食药监注[2012]339号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局):根据《关于印发药品类易制毒化学品专项整治行动实施方案的通知》(国食药监电[2012]38号)和《关于加强含麻黄碱类复方制剂管理有关事宜的通知》(国食药监办[2012]260号)的要求,麻黄碱含量超过30mg的复方制剂已从非处方药转为处方药管理。
依据处方药的管理要求,我局已对相关品种药品说明书进行了核准(见附件),现予以发布。
请通知行政区域内药品生产企业在国食药监办[2012]260号文件规定的时限内,按公布的模板修订说明书和标签,并按补充申请事项提交省级食品药品监督管理局备案。
同时,将修订的内容及时通知相关医疗机构、药品经营企业等单位。
相关药品生产企业还应主动跟踪该类药品临床应用的安全性情况,按规定收集不良反应并及时报告。
附件:1.氯雷伪麻缓释片说明书2.复方盐酸伪麻黄碱缓释胶囊说明书3.氨酚氯雷伪麻缓释片说明书4.那敏伪麻胶囊说明书5.扑尔伪麻片说明书6.复方布洛伪麻缓释片说明书国家食品药品监督管理局2012年11月23日附件1:氯雷伪麻缓释片说明书核准日期:请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:氯雷伪麻缓释片英文名称:汉语拼音:【成份】本品为复方制剂,其组份为:每片含氯雷他定5毫克,硫酸伪麻黄碱120毫克。
【性状】【适应症】本品适用于缓解过敏性鼻炎和感冒的症状,包括鼻塞、打喷嚏、流鼻涕、鼻痒、流泪。
氯雷伪麻缓释片能够同时发挥氯雷他定抗组胺特性和硫酸伪麻黄碱的减轻鼻充血作用。
国家食品药品监督管理总局、海关总署公告2013年第54号――关于麻醉药品和精神药品海关商品编号的公告

国家食品药品监督管理总局、海关总署公告2013年第54号――关于麻醉药品和精神药品海关商品编号的公告文章属性•【制定机关】国家食品药品监督管理总局(已撤销),中华人民共和国海关总署•【公布日期】2013.12.30•【文号】国家食品药品监督管理总局、海关总署公告2013年第54号•【施行日期】2014.01.01•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理总局、海关总署公告(2013年第54号)关于麻醉药品和精神药品海关商品编号的公告根据《中华人民共和国药品管理法》、《中华人民共和国海关法》等有关法律法规规定,现公布麻醉药品和精神药品的海关商品编号,自2014年1月1日起施行。
麻醉药品和精神药品目录仍按照食品药品监管总局、公安部、卫生计生委2013年11月11日公布的《麻醉药品品种目录(2013年版)》和《精神药品品种目录(2013年版)》执行。
特此公告。
附件:1.麻醉药品海关商品编号2.精神药品海关商品编号国家食品药品监督管理总局海关总署2013年12月30日附件1麻醉药品海关商品编号备注:1.上述品种包括其可能存在的盐和单方制剂。
2.上述品种包括其可能存在的异构体、酯及醚。
3.上述品种有关盐、异构体、酯、醚对应的海关商品编号不限于本目录,而应以实际海关归类为准,但仍属于麻醉药品管制范围。
4.上述商品的计量单位均为“千克”。
附件2备注:1.上述品种包括其可能存在的盐和单方制剂。
2.上述品种包括其可能存在的异构体。
3.上述品种有关盐和异构体对应的海关商品编号不限于本目录,而应以实际海关归类为准,但仍属于精神药品管制范围。
4.上述商品的计量单位均为“千克”。
国家食品药品监督管理局、卫生部关于加强曲马多等麻醉药品和精神

国家食品药品监督管理局、卫生部关于加强曲马多等麻醉药
品和精神药品监管的通知
【法规类别】药品管理
【发文字号】国食药监办[2007]749号
【发布部门】国家食品药品监督管理局(原国家药品监督管理局)(已撤销)卫生部(已撤销) 【发布日期】2007.12.07
【实施日期】2007.12.07
【时效性】现行有效
【效力级别】XE0303
国家食品药品监督管理局、卫生部关于加强曲马多等麻醉药品和精神药品监管的通知
(国食药监办[2007]749号)
各省、自治区、直辖市食品药品监督管理局(药品监督管理局),卫生厅(局):
2007年10月,国家食品药品监督管理局、公安部、卫生部联合公布了2007年版麻醉药
品和精神药品品种目录(以下简称目录)。
目录对部分麻醉药品和精神药品品种的管理
类别进行了调整,其中,阿桔片、吗啡阿托品注射液列入麻醉药品管理,γ-羟丁酸(包
括其盐和单方制剂,以下同)、盐酸丁丙诺啡舌下片由第二类精神药品调整为第一类精
神药品管理,曲马多(包括其盐和单方制剂,以下同)、氨酚氢可酮片列入第二类精神
药品管理。
目录将自2008年1月1日起施行。
为加强对麻醉药品和精神药品的管理,保
证调整管理类别的品种生产、经营和使用顺利过渡,现将有关事宜通知如下:。
风湿科常用药品之麦考酚酸酯胶囊说明书

【药品名称】麦考酚酸酯胶囊【性状】本品为胶囊剂,内容物为白色粉末。
【药理毒理】霉酚酸酯(简称MMF)是霉酚酸(MPA)的2-乙基酯类衍生物。
MPA是高效、选择性、非竞争性、可逆性的次黄嘌呤单核苷酸脱氢酶(IMPDH)抑制剂,可抑制鸟嘌呤核苷酸的经典合成途径。
MPA对淋巴细胞具有高度选择作用。
抑制淋巴细胞增殖所需的MPA浓度,对大多数淋巴细胞无抑制作用,MPA还能通过直接抑制B细胞的增殖来抑制抗体的形成。
治疗量的MMF并不抑制多糖激活人外周血淋巴细胞产生白介素-I,也不抑制有丝分裂原激活的外周淋巴细胞合成白介素-Ⅱ和其受体表达,这点也不同于环孢霉素、FK-506。
此外,MPA介导的体外淋巴细胞三磷酸鸟苷的耗竭可抑制甘露糖和岩藻糖转化成糖蛋白。
通过这种机制,MPA可降低淋巴细胞和单核细胞在慢性炎症部位的聚集。
【药代学】口服后迅速大量吸收,并代谢为活性成份MPA。
口服平均生物利用度为静脉注射的94%(根据MPA曲线下面积),口服后在循环中测不出MMF。
肾移植病人口服MMF,其吸收不受食物影响,但进食后血MPA峰值将降低40%。
由于肠肝循环作用,服药后6-12hr将出现第二个血浆MPA高峰,与消胆胺同时服用将使MPA曲线下面积减少约40%,表明MPA通过肠肝循环的量很多。
在临床有效浓度下,97%的MPA与血浆蛋白结合。
MPA主要通过葡萄糖醛酸转移酶,代谢成MPA的的酚化葡萄糖苷糖(MPAG),MPAG无药理活性。
MMF代谢成的MPA有极少量(<1%)从尿液排出,多数(87%)以MPAG的形式从尿液排出。
移植后近期内(<40日),平均曲线下面积(AUG)和血峰值(Cmax)比正常志愿者和移植肾功能稳定的病人约低50%。
单剂研究显示,严重的慢性肾功能损害(肾小球滤过率<25mL/分/1.73m2)。
MPA曲线下面积比正常志愿者和轻度肾功能损害病人高25-75%。
同样情况下,MPAG曲线下面积高3-6倍,与MPAG 主要由肾脏排出一致。
国家食药监总局提醒公众注意麦考酚类药品的生殖毒性风险

? 近 日
,
。
钟 立 辉告 诉 记 者
,
该 委 出 具 的 每个 证书 对 应
“
一
套家具
不 允 许 商家 拿 鉴 定 证书 为 商 品 促 销
,
市场 上不 少 商家 存在
。
的现象
一
,
该 委接
到 了 相关 投诉 视购 物节
也 对 南 京 这 家 公 司 的 行 为 叫 停过
。
钟 立 辉提 醒 消 费 者 年 8月
有关 规 定
并 给 王先 生
办 理退 货 手续
王先生咨 询
律师 得 知
,
按照
《
消 费者权 益 保 护法
》
,
商 家上 述 行为 涉 嫌欺 诈
“
,
王先
生 有 权依 法 向 安 徽 卫 视 或者 南 京 和 氏 璧 艺 术 品 投 资 有 限 公 司 要 求
退
一
赔三
2 0
1
”
。
王 先 生 告诉 记
1
)
医 务 人 员 根 据 麦 考酚 类 药 品 说 明 书 推 荐 适 应 症 使用 该 类产 品
,
。
对 于说 明 书 推 荐适 应 症
,
之 外 的 狼疮 性 肾 炎 和 其 他免 疫性 疾 病
鉴于
目 前 尚 无 可 靠袖 循证 医 学 证 据
建议 医务 人 员 权 衡 该
类药 品 的风险 获益
,
近期
,
国 家食 品 药 品 监 督 管 理 总 局 发 布 第
。
七十 四期
《
药 品 不 良 反应 信息 通报
国家食品药品监督管理局关于对部分含特殊药品复方制剂实施电子监管工作的通知

国家食品药品监督管理局关于对部分含特殊药品复方制剂实施电子监管工作的通知文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2010.12.22•【文号】国食药监办[2010]484号•【施行日期】2010.12.22•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于对部分含特殊药品复方制剂实施电子监管工作的通知(国食药监办[2010]484号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局):近期,一些未列入特殊药品管理的处方药和非处方药在部分地区出现从药用渠道流失、被滥用或提取制毒的现象,在国内外造成不良影响,且危害公众健康安全。
为进一步加强药品管理,保证医疗需求,防止从药用渠道流失和滥用,国家局决定对含麻黄碱类复方制剂(不包括含麻黄的中成药,下同)、含可待因复方口服溶液、含地芬诺酯复方制剂实施电子监管,现将有关事项通知如下:一、实施方法和步骤(一)凡生产含麻黄碱类复方制剂、含可待因复方口服溶液、含地芬诺酯复方制剂的企业(药品品种目录见附件1),应在2011年12月31日前加入药品电子监管网,药品出厂前,须按规定在上市产品最小销售包装上加印(贴)统一标识的药品电子监管码(标识见附件2),上述生产企业应按国家局要求做好入网、赋码和核注核销工作。
凡经营以上品种的批发企业,须按规定对上述品种进行核注核销,以确保数据完整、可靠。
(二)2012年1月1日起,对含麻黄碱类复方制剂、含可待因复方口服溶液、含地芬诺酯复方制剂,未入网及未使用药品电子监管码统一标识的,一律不得销售。
(三)各省(区、市)局负责统计和核实辖区内的相关生产企业名单,培训工作由国家局统一部署,各省(区、市)局具体承办。
培训工作方案另行通知。
二、工作要求(一)各省(区、市)局应充分认清当前禁毒工作面临的严峻形势,认清含特殊药品复方制剂流弊可能产生的危害,认清实施药品电子监管对加强药品监管、提高监管效率的重要性,与基本药物电子监管工作同步,按照全国一盘棋的要求,加强领导,明确分工,密切协作,做好含特殊药品复方制剂的入网工作。
国家市场监管总局办公厅关于打击食品中非法添加酚汀(酚丁)、酚酞及其酯类衍生物或类似物违法行为的通知

国家市场监管总局办公厅关于打击食品中非法添加酚汀(酚丁)、酚酞及其酯类衍生物或类似物违法行为的通知文章属性•【制定机关】国家市场监督管理总局•【公布日期】2023.10.08•【文号】市监稽发〔2023〕94号•【施行日期】2023.10.08•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】食品安全正文市场监管总局办公厅关于打击食品中非法添加酚汀(酚丁)、酚酞及其酯类衍生物或类似物违法行为的通知市监稽发〔2023〕94号各省、自治区、直辖市和新疆生产建设兵团市场监管局(厅、委):近年来,宣称功能食品非法添加药品、药品衍生物或类似物的违法案件时有发生,危害人民群众身体健康。
近期,总局组织内蒙古、江苏、安徽、福建、广东等(省、区)市场监管部门查办了宣称“减肥”功能食品非法添加药品、药品衍生物或类似物系列案件,认定了检验方法,并出具了专家有毒有害认定意见。
现将《酚汀(酚丁)、酚酞及其酯类衍生物或类似物有毒有害专家认定意见》(附件)发给你们,可作为案件查办中甄别有毒有害物质成分、实施定罪量刑的参考。
市场监管部门应当从速从严查处此类案件,依法吊销许可并处罚相关责任人;涉嫌犯罪的,要及时移送公安机关处理。
附件:酚汀(酚丁)、酚酞及其酯类衍生物或类似物有毒有害专家认定意见市场监管总局办公厅2023年10月8日附件酚汀(酚丁)、酚酞及其酯类衍生物或类似物有毒有害专家认定意见双丙酚汀是双醋酚汀的类似物,双醋酚汀曾为地方标准批准的药品,但后未获得国家药品监督管理部门批准作为药品或原料药品生产或进口;其类似物双丙酚汀也从未获得国家药品监督管理部门批准作为药品或原料药品生产或进口;双醋酚汀类似物酚酞虽曾为国家获批的药物,但由于其存在严重不良反应,国家药监局于2021年发布了《关于注销酚酞片和酚酞含片药品注册证书的公告(2021年第6号)》。
根据《食品安全法》,食品不得添加药物,而该类原料也从未获得批准作为食品添加剂或新食品原料,以及保健食品原料,因此,在食品中检出酚汀(酚丁)、酚酞及其酯类衍生物或类似物(如4-氯双醋酚丁),均属于非法添加。
国家药品监督管理局关于将麦角胺咖啡因列入精神药品管理的通知

国家药品监督管理局关于将麦角胺咖啡因列入精神药品管理的通知文章属性•【制定机关】国家药品监督管理局•【公布日期】1999.03.13•【文号】国药管安[1999]35号•【施行日期】1999.03.13•【效力等级】部门规范性文件•【时效性】失效•【主题分类】药政管理正文*注:本篇法规已被《国家食品药品监督管理局关于清理规章和规范性文件的公告》(发布日期:2007年3月22日实施日期:2007年3月22日)宣布失效或废止(原因:已被《麻醉药品和精神药品管理条例》和《关于公布麻醉药品和精神药品品种目录的通知》(国食药监安〔2005〕481号)代替)国家药品监督管理局关于将麦角胺咖啡因列入精神药品管理的通知(1999年3月13日国药管安[1999]35号)各省、自治区、直辖市药品监督管理局或卫生厅(局)、医药管理部门:麦角胺咖啡因是《中国药典》收载品种(每片含麦角胺1mg、无水咖啡因100mg),该药所含两种成份分别为联合国《禁止非法贩运麻醉药品和精神药物公约》和国务院《精神药品管理办法》中规定管制的品种。
为加强管理,现规定将麦角胺咖啡因(包括制剂)列入第二类精神药品管理,其生产、经营、使用等必须遵照《精神药品管理办法》的规定执行。
现就有关事项通知如下:一、麦角胺咖啡因所需咖啡因原料必须在国家指定的制药厂或经营单位凭购用证明购买。
制剂厂不得擅自生产咖啡因。
二、麦角胺咖啡因制剂的生产计划需报所在省、自治区、直辖市药品监督管理部门批准。
生产单位必须建立起严格的管理制度。
自2000年1月1日起制剂的包装和说明书应注明“精神药品”标志。
三、麦角胺咖啡因可供应各医疗机构使用,药品经营单位须凭盖有医疗机构公章的医生处方方能零售。
处方留存两年备查。
四、各医药经营单位应立即对库存的麦角胺咖啡因进行清点造册,并按本通知规定进行销售。
凡不具备经营精神药品资格的要转到有资格的单位经营;库存量不大的可于1999年度售完为止。
国家食品药品监督管理局总局国家药品标准(修订)颁布件(简版)

加碘化汞钾试液1 滴、硅钨酸试液1 滴,均生成灰白色沉淀或淡黄色沉淀。
(2)取本品1 袋,煎煮茶加水适量煎煮2 次,每次1 小时,滤过,滤液合并,浓缩至约30 mL,置具塞锥形
瓶中,加盐酸8 mL;袋泡茶加水30 mL,加盐酸8 mL。置水浴回流2 小时,取出,滤过,滤渣105 ℃烘干,连同
滤纸一并剪碎置锥形瓶中,加乙醚40 mL 摇匀,超声处理3 次,每次1 分钟,滤过,合并滤液,挥干,残渣用石
标准号:WS3 B2713972016
沙溪凉茶颗粒
Shaxi Liangcha Keli
【处方】 岗梅 金钮扣 蒲桃
3216 g
2144 g
2144 g
臭茉莉 野颠茄 2144 g
1072 g
【制法】 以上五味,加水煎煮二次,每次2 小时,煎液滤过,滤液合并,浓缩至相对密度为1 05 ~ 1 08
200 mL,用脱脂棉滤过,蒸干,研细,取粉末0 5 g,剩余粉末备用;取袋泡茶1 g。加0 5% 盐酸酸性乙醇15
mL,置水浴加热5 分钟,趁热滤过,滤液用氨试液调节pH 值至中性,蒸干,残渣加5% 硫酸溶液10 mL 使溶
解,滤过,取滤液各1 mL,分置三支试管中:一管中加碘化铋钾试液1 滴,即生成橘红色沉淀;另两管中分别
本标准自颁布之日起6 个月内,生产企业按原标准生产的药品仍按原标准检验,按本标准生产的药 品应按本标准检验。自本标准实施之日起,生产企业必须按照本标准生产该药品,并按照本标准检验, 实施规定 原标准同时停止使用。
请各省(自治区、直辖市)食品药品监督管理局及时通知辖区内有关药品生产企业,自实施之日起执 行修订后的国家药品标准。
节pH 值至中性,置水浴中蒸干,残渣加5% 硫酸溶液5 mL 使溶解,滤过,取滤液各1 mL,分置三支试管中,
食品药品监管总局办公厅关于进一步加强含麻醉药品和曲马多口服复方制剂购销管理的通知

食品药品监管总局办公厅关于进一步加强含麻醉药品和曲马多口服复方制剂购销管理的通知文章属性•【制定机关】国家食品药品监督管理总局(已撤销)•【公布日期】2014.06.05•【文号】食药监办药化监[2014]111号•【施行日期】2014.06.05•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文食品药品监管总局办公厅关于进一步加强含麻醉药品和曲马多口服复方制剂购销管理的通知(食药监办药化监〔2014〕111号)各省、自治区、直辖市食品药品监督管理局:为进一步遏制含麻醉药品和曲马多口服复方制剂的滥用,防止从药用渠道流失,总局决定对含麻醉药品和曲马多口服复方制剂进一步加强管理。
现将有关要求通知如下:一、在药品零售环节,本通知附件所列含麻醉药品和曲马多口服复方制剂一律列入必须凭处方销售的药品范围,无医师处方严禁销售。
二、附件所列含麻醉药品和曲马多口服复方制剂的购销要求,一律按照国家食品药品监管总局办公厅《关于进一步加强含可待因复方口服溶液、复方甘草片和复方地芬诺酯片购销管理的通知》(食药监办药化监〔2013〕33号)的管理规定执行,一律不得通过互联网销售。
三、药品生产和批发企业要提高对含麻醉药品和曲马多口服复方制剂滥用危害的认识,切实增强防范意识。
必须严格执行药品电子监管码赋码和出入库“见码必扫”操作,确保正确核注核销,及时处理系统预警信息。
要加强对下游企业销售的管理,电子监管预警信息提示收货企业核注信息有误的必须立即暂停供货、进行调查,发现销售数量和流向等情况异常应及时向当地食品药品监管部门报告。
四、地方各级食品药品监管部门要加强对上述药品生产和购销的监管,严格执行本通知和有关文件的规定。
要加大监督检查力度,除对供销资格、票据管理、禁止现金交易、电子监管、销售管理等重点环节加强检查外,还应重视药品电子监管信息的利用,对怀疑销售到非法渠道的问题必须追查到底。
要加强对药品零售企业凭处方销售上述药品的监督检查,比对核查药品销售数量和留存处方数量,对不执行凭处方销售的企业,除按照相关法规予以处罚外,还应当取消其处方药经营资格。
含麻制剂管理文件

含麻黄碱复方制剂管理要求1、将单位剂量麻黄碱类药物含量大于30mg(不含30mg)的含麻黄碱类复方制剂,列入必须凭处方销售的处方药管理。
医疗机构应当严格按照《处方管理办法》开具处方。
药品零售企业必须凭执业医师开具的处方销售上述药品。
含麻黄碱类复方制剂每个最小包装规格麻黄碱类药物含量口服固体制剂不得超过720mg,口服液体制剂不得超过800mg。
相关药品生产企业应当在2013年2月28日前完成上述药品的标签、说明书和包装的修改工作,未完成的2013年3月1日后不得销售。
2013年2月28日前上市的药品,按原销售方式售完为止。
2、药品零售企业销售含麻黄碱类复方制剂,应当查验购买者的身份证,并对其姓名和身份证号码予以登记。
除处方药按处方剂量销售外,一次销售不得超过2个最小包装.药品零售企业不得开架销售含麻黄碱类复方制剂,应当设置专柜由专人管理、专册登记,登记内容包括药品名称、规格、销售数量、生产企业、生产批号、购买人姓名、身份证号码。
3、严格执行药品电子监管码赋码,药品零售企业发现销售数量和流向等情况异常超过正常医疗需求,大量、多次购买含麻黄碱类复方制剂的,应当立即向当地食品药品监管部门和公安机关报告。
4、含麻黄碱类复方制剂生产企业应当切实加强销售管理,严格管控产品销售渠道,确保所生产的药品在药用渠道流通。
5、从生产企业直接购进上述药品的批发企业,可以将药品销售给其他批发企业、零售企业和医疗机构;从批发企业购进的,只能销售给本省(区、市)的零售企业和医疗机构。
6、含麻黄碱类复方制剂严禁互联网销售。
7、在药品零售环节,上述药品列入必须凭处方销售的处方药管理,严格凭医师开具的处方销售。
设置专柜由专人管理、专册登记,上述药品登记内容包括药品名称、规格、销售数量、生产企业、生产批号。
如发现超过正常医疗需求,大量、多次购买上述药品的,应当立即向当地食品药品监督管理部门报告.8、加强对药品零售企业凭处方销售上述药品的监督检查,比对核查药品销售数量和留存处方数量,对不执行凭处方销售的企业,除按照相关法规予以处罚外,还应当取消其处方药经营资格。
国家药品不良反应监测报告2017年发布

国家药品不良反应监测年度报告(2017年)发布国家药品监督管理局关于发布国家药品不良反应监测年度报告(2017年)的公告(2018年第3号)根据《中华人民共和国药品管理法》《药品不良反应报告和监测管理办法》,为全面反映2017年我国药品不良反应监测情况,原国家食品药品监督管理总局组织国家药品不良反应监测中心,对2017年全国药品不良反应监测网络收到的全部142.9万份《药品不良反应/事件报告表》情况进行全面分析汇总,形成《国家药品不良反应监测年度报告(2017年)》,现予发布。
特此公告。
附件:国家药品不良反应监测年度报告(2017年)国家药品监督管理局2018年4月10日国家药品不良反应监测年度报告(2017年)为全面反映2017年我国药品不良反应监测情况,提高安全用药水平,促进临床合理用药,更好地保障公众用药安全,依据《药品不良反应报告和监测管理办法》,原国家食品药品监督管理总局组织国家药品不良反应监测中心编撰《国家药品不良反应监测年度报告(2017年)》。
一、药品不良反应监测工作进展2017年,按照习近平总书记对食品药品安全提出的“四个最严”要求,全国药品不良反应监测体系继续扩大监测覆盖面,优化预警体系,夯实企业主体责任,着力防范药品潜在的安全风险。
相关工作取得新进展:进一步扩大药品不良反应监测网络覆盖面,完善药品不良反应监测体系。
基层网络用户数量持续增长,全国药品不良反应监测网络已有34万余个药品生产企业、经营企业和医疗机构注册用户,可在线实时报送药品不良反应报告。
201 7年全国98.0%的区县报告了药品不良反应,较2016年增长0.3个百分点,每百万人口平均报告数为1068份。
2017年继续拓展监测技术手段,与医疗机构合作开展哨点监测,已建立60余家哨点监测平台。
进一步增强药品不良反应分析评价能力,及时采取风险管理措施。
2017年,药品不良反应报告和监测工作有序开展。
通过日监测、周汇总、季度分析等工作机制对国家药品不良反应监测数据进行分析评价,深入挖掘药品风险信号,并采取相应风险管理措施。
国家食品药品监督管理局关于莫匹罗星软膏等66种药品转换为非处方药的通知

国家食品药品监督管理局关于莫匹罗星软膏等66种药品转换为非处方药的通知文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2005.12.16•【文号】国食药监安[2005]614号•【施行日期】2005.12.16•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于莫匹罗星软膏等66种药品转换为非处方药的通知(国食药监安[2005]614号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局):根据国家药品监督管理局令第10号《处方药与非处方药分类管理办法》(试行)的规定,按照《关于开展处方药与非处方药转换评价工作的通知》(国食药监安〔2004〕101号)的要求,经我局审定,莫匹罗星软膏等66种药品(其中化学药品24种,中成药42种)转换为非处方药,现将药品名单(附件1)及其说明书(附件2)予以公布。
并就有关事宜通知如下:一、各省、自治区、直辖市食品药品监督管理局(药品监督管理局)接本通知后,要尽快将有关事宜通知本辖区相关药品生产企业。
二、自本通知下发之日起,各地即可进行以上非处方药品种的审核登记工作。
审核登记工作的有关要求,按照《关于做好2002年非处方药管理有关工作的通知》(国药监办[2002]195号)和《关于做好处方药与非处方药分类管理实施工作的通知》(国食药监安[2005]409号)执行。
附件1.66种转换为非处方药药品名单2.66种非处方药说明书(略)国家食品药品监督管理局二00五年十二月十六日附件1:66种转换为非处方药药品名单一、化学药品┌──┬─────────┬────────────────────┬──┬──┐│序号│药品名称│规格(组成)│分类│备注│├──┼─────────┼────────────────────┼──┼──┤│ 1│莫匹罗星软膏│2%│甲类││├──┼─────────┼────────────────────┼──┼──┤│ 2│盐酸氨溴索口服溶液│0.6%│甲类│双跨│├──┼─────────┼────────────────────┼──┼──┤│ 3│甘露聚糖肽片│5毫克│甲类││├──┼─────────┼────────────────────┼──┼──┤│ 4│奥美拉唑肠溶胶囊│10毫克│甲类│双跨│├──┼─────────┼────────────────────┼──┼──┤│ 5│复方硫酸软骨素滴眼│每毫升含硫酸软骨素1毫克、维生素E 0.1毫克│乙类││││液(润洁)│、维生素B60.1毫克、尿囊素2毫克、牛磺酸2 ││││││毫克│││├──┼─────────┼────────────────────┼──┼──┤│ 6│羔羊胃提取物维B12 │每粒含羔羊胃提取物200毫克(凝乳酶活力不│乙类│双跨│││胶囊│少于40单位,胃蛋白酶活力不少于15单位),││││││维生素B1210微克│││├──┼─────────┼────────────────────┼──┼──┤│ 7│丙酸氟替卡松鼻喷雾│每喷含丙酸氟替卡松50微克,药液浓度0.05% │甲类││││剂│(g/g)│││├──┼─────────┼────────────────────┼──┼──┤│ 8│羧甲基纤维素钠滴眼│0.5%;1%│乙类││││液││││├──┼─────────┼────────────────────┼──┼──┤│ 9│盐酸赛洛唑啉鼻用喷│0.05%;0.1%│甲类││││雾剂││││├──┼─────────┼────────────────────┼──┼──┤│10 │双氯芬酸钾片│12.5毫克│甲类│双跨│├──┼─────────┼────────────────────┼──┼──┤│ 11 │口服凝结芽孢杆菌活│每片350毫克,含凝结芽孢杆菌活菌数不低于5│乙类││││菌片│.0×107CFU/g(即每片含凝结芽孢杆菌活菌数││││││不低于1.75×107CFU)│││├──┼─────────┼────────────────────┼──┼──┤│ 12 │口服酪酸梭菌活菌细│1克/包,其中含酪酸梭菌活菌数应不低于1.0│乙类││││粒(米雅)│×106CFU│││├──┼─────────┼────────────────────┼──┼──┤│ 13 │口服酪酸梭菌活菌片│每片含酪酸梭菌活菌数应不低于0.35×106CFU│乙类││││(米雅)││││├──┼─────────┼────────────────────┼──┼──┤│ 14 │口服酪酸梭菌活菌散│每袋500毫克,含酪酸梭菌活菌数不低于1.0×│乙类││││剂│107CFU/g(即每袋含酪酸梭菌活菌数不低于││││││5×106CFU)│││├──┼─────────┼────────────────────┼──┼──┤│ 15 │口服酪酸梭菌活菌片│每片350毫克,含酪酸梭菌活菌数不低于1.0×│乙类│││││107CFU/g(即每片含酪酸梭菌活菌数不低于││││││3.50×106CFU)│││├──┼─────────┼────────────────────┼──┼──┤│ 16 │口服酪酸梭菌活菌胶│每粒420毫克,含酪酸梭菌活菌数不低于1.0×│乙类││││囊│107CFU/g(即每粒含酪酸梭菌活菌数不低于││││││4.2×106CFU)│││├──┼─────────┼────────────────────┼──┼──┤│ 17 │奥利司他胶囊│0.12克│甲类│双跨│├──┼─────────┼────────────────────┼──┼──┤│ 18 │氯雷他定胶囊│10毫克│甲类││├──┼─────────┼────────────────────┼──┼──┤│ 19 │氯雷他定糖浆│0.1%│甲类││├──┼─────────┼────────────────────┼──┼──┤│ 20 │氯雷他定咀嚼片│5毫克│甲类││├──┼─────────┼────────────────────┼──┼──┤│21 │萘普生分散片│0.25克│甲类│双跨│├──┼─────────┼────────────────────┼──┼──┤│ 22 │复方维生素U片│每片内层含维生素U 25毫克;外层含生物淀粉│乙类│││││酶200025毫克,干燥氢氧化铝凝胶192毫克││││││,氢氧化镁159毫克。
国家食品药品监督管理局关于部分产品分类界定的通知-国食药监械[2003]95号
![国家食品药品监督管理局关于部分产品分类界定的通知-国食药监械[2003]95号](https://img.taocdn.com/s3/m/c5691a06640e52ea551810a6f524ccbff121ca13.png)
国家食品药品监督管理局关于部分产品分类界定的通知正文:----------------------------------------------------------------------------------------------------------------------------------------------------国家食品药品监督管理局关于部分产品分类界定的通知(国食药监械[2003]95号)各省、自治区、直辖市药品监督管理局:近期,我局陆续收到一些省级药品监督管理部门要求将部分产品进行分类界定的请示。
现将这些产品的分类界定通知如下:一、辐照生物羊膜:用作眼科护创敷料,作为Ⅲ类医疗器械管理。
二、麻醉剂助推器(不含针头):不与麻醉药筒中的药液接触,作为Ⅰ类医疗器械管理。
三、便携式影像测量仪:对医学影像载体上的影像进行长度和角度测量的电子仪器,不作为医疗器械管理。
四、耳部熏蒸管:作为Ⅱ类医疗器械管理。
五、手术器械洗涤剂:用于手术器械的去污洗涤,无消毒灭菌功能,不作为医疗器械管理。
六、保温毯:用于保持病人体温,不作为医疗器械管理。
七、基因芯片载体:为各种基因芯片的制备提供基底材料,不作为医疗器械管理。
八、病人体重仪:用于称量病人的体重,不作为医疗器械管理。
九、一次性医用充气瓶:由高分子材料制成,供氧气厂灌入氧气后与一次性使用输液器配套使用。
鉴于医用氧气是按药品管理的,一次性医用充气瓶应视为药品包装材料,不作为医疗器械管理。
十、电脑口吃矫正器:作为Ⅱ类医疗器械管理。
十一、老花眼镜及太阳眼镜:不作为医疗器械管理。
上述凡界定为医疗器械的产品,从2004年1月1日起应凭证生产和上市销售。
特此通知国家食品药品监督管理局二00三年六月十三日——结束——。
农业部235号公告(兽药残留)
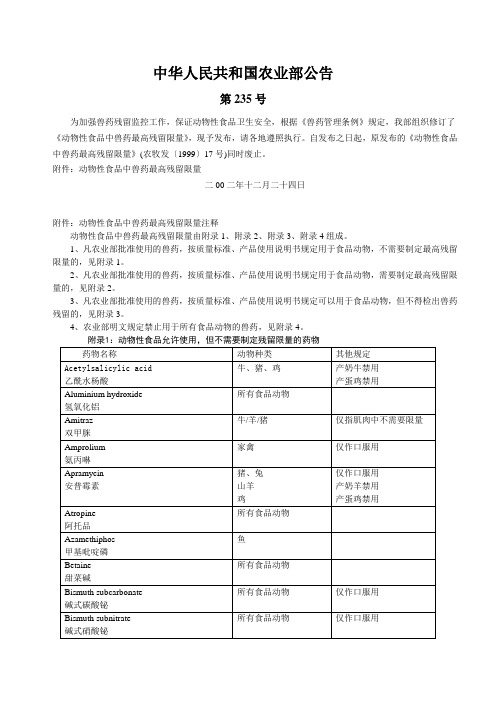
中华人民共和国农业部公告第235号为加强兽药残留监控工作,保证动物性食品卫生安全,根据《兽药管理条例》规定,我部组织修订了《动物性食品中兽药最高残留限量》,现予发布,请各地遵照执行。
自发布之日起,原发布的《动物性食品中兽药最高残留限量》(农牧发〔1999〕17号)同时废止。
附件:动物性食品中兽药最高残留限量二00二年十二月二十四日附件:动物性食品中兽药最高残留限量注释动物性食品中兽药最高残留限量由附录1、附录2、附录3、附录4组成。
1、凡农业部批准使用的兽药,按质量标准、产品使用说明书规定用于食品动物,不需要制定最高残留限量的,见附录1。
2、凡农业部批准使用的兽药,按质量标准、产品使用说明书规定用于食品动物,需要制定最高残留限量的,见附录2。
3、凡农业部批准使用的兽药,按质量标准、产品使用说明书规定可以用于食品动物,但不得检出兽药残留的,见附录3。
4、农业部明文规定禁止用于所有食品动物的兽药,见附录4。
附录3:允许作治疗用,但不得在动物性食品中检出的药物名词定义:1.兽药残留[Residues of Veterinary Drugs]:指食品动物用药后,动物产品的任何食用部分中与所有药物有关的物质的残留,包括原型药物或/和其代谢产物。
2.总残留[Total Residue]:指对食品动物用药后,动物产品的任何食用部分中药物原型或/和其所有代谢产物的总和。
3.日允许摄入量[ADI:Acceptable Daily Intake]:是指人一生中每日从食物或饮水中摄取某种物质而对健康没有明显危害的量,以人体重为基础计算,单位:μg/kg体重/天。
4.最高残留限量[MRL:Maximum Residue Limit]:对食品动物用药后产生的允许存在于食物表面或内部的该兽药残留的最高量/浓度(以鲜重计,表示为μg/kg)。
5.食品动物[Food-Producing Animal]:指各种供人食用或其产品供人食用的动物。
国家食品药品监督管理局、卫生部关于加强曲马多等麻醉药品和精神药品监管的通知

国家食品药品监督管理局、卫生部关于加强曲马多等麻醉药品和精神药品监管的通知文章属性•【制定机关】卫生部(已撤销),国家食品药品监督管理局(已撤销)•【公布日期】2007.12.07•【文号】国食药监办[2007]749号•【施行日期】2007.12.07•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局、卫生部关于加强曲马多等麻醉药品和精神药品监管的通知(国食药监办[2007]749号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局),卫生厅(局):2007年10月,国家食品药品监督管理局、公安部、卫生部联合公布了2007年版麻醉药品和精神药品品种目录(以下简称目录)。
目录对部分麻醉药品和精神药品品种的管理类别进行了调整,其中,阿桔片、吗啡阿托品注射液列入麻醉药品管理,γ-羟丁酸(包括其盐和单方制剂,以下同)、盐酸丁丙诺啡舌下片由第二类精神药品调整为第一类精神药品管理,曲马多(包括其盐和单方制剂,以下同)、氨酚氢可酮片列入第二类精神药品管理。
目录将自2008年1月1日起施行。
为加强对麻醉药品和精神药品的管理,保证调整管理类别的品种生产、经营和使用顺利过渡,现将有关事宜通知如下:一、生产上述品种的药品生产企业,应当按照《麻醉药品和精神药品生产管理办法(试行)》的规定,申报2008年相应品种的生产计划,并于2007年12月31日前申请办理相应品种的定点生产手续。
药品生产(进口)企业应当按照《药品注册管理办法》的规定,办理相应药品标签的变更手续。
自2008年1月1日起,所生产出厂的上述品种(包括国产品种和进口品种)必须在其标签上印有规定的标识。
之前生产出厂的上述品种,仍可继续使用原标签。
二、自2008年1月1日起,凡是不具备麻醉药品和第一类精神药品经营资格的企业不得再经营阿桔片、吗啡阿托品注射液、γ-羟丁酸和盐酸丁丙诺啡舌下片;不具备第二类精神药品经营资格的企业不得再经营曲马多和氨酚氢可酮片;药品零售企业不得再经营γ-羟丁酸和盐酸丁丙诺啡舌下片。
CFDA:关注麦考酚类药品的生殖毒性风险

CFDA:关注麦考酚类药品的生殖毒性风险麦考酚类药品为免疫抑制剂,主要与环孢素及皮质类固醇合并使用,预防接受同种异体肾脏或肝脏移植患者发生急性排斥反应。
麦考酚类药品主要包括麦考酚酸钠和吗替麦考酚酯。
吗替麦考酚酯是麦考酚酸的2-吗啉基乙酯,与麦考酚酸发挥相同的免疫抑制作用。
麦考酚类药品的生殖毒性风险持续引起各国监管部门的关注。
近期,国家药品不良反应监测中心对该类药品进行了安全性评估,提示关注其生殖毒性风险。
1 麦考酚类药品生殖毒性风险及相关证据近期,欧洲药品管理局(EMA)发布警示信息,提示在可选择其它预防移植排斥的药品时,妊娠妇女禁忌使用麦考酚类药品,并在药品说明书中更新了禁忌证、风险控制建议等内容。
更新的产品信息强调了使用本药的妇女和男性应采取有效的避孕措施,在用药前以及治疗过程中根据需要进行妊娠测试,以排除非计划妊娠。
EMA对麦考酚类产品采取风险控制措施是基于一项对吗替麦考酚酯的评估报告。
由于吗替麦考酚酯口服或静脉给药后转化为麦考酚酸,因此麦考酚酸钠应当考虑与吗替麦考酚酯产品相同的风险。
EMA在评估报告中指出,在暴露于吗替麦考酚酯的妇女中,约45%~49%的妊娠发生了自发性流产,与之相比,在接受其他免疫抑制剂治疗的实体器官移植患者中的报告发生率为12%~33%。
母体妊娠期间暴露于吗替麦考酚酯的胎儿中,报告的畸形发生率为23%~27%,与之相比,在接受其他免疫抑制剂治疗的移植患者中出生畸形发生率为4%~5%,在总人群中出生畸形发生率为2%~3%。
与吗替麦考酚酯相关的畸形包括耳、眼和颜面畸形,先天性心脏病包括间隔缺损,多指或并指,气管食管畸形如食管闭锁,对神经系统的影响如脊柱裂,以及肾脏畸形等。
EMA已在药品说明书中更新了禁忌证、风险控制建议等内容。
更新的产品信息强调了使用本药品的妇女和男性应采取有效的避孕措施,在用药前以及治疗过程中根据需要进行妊娠测试,以排除非计划妊娠。
2 麦考酚类药品不良反应监测情况2.1 我国药品不良反应数据库监测情况2004年1月1日至2016年3月31日间,国家药品不良反应病例报告数据库共收到2 000余例含麦考酚类药品不良反应/事件报告,严重报告占49.6%,主要来源于生产企业收集的报告(62.14%)。
国家食品药品监督管理局关于加强碳青霉烯类等药品生产管理的通知-国食药监安[2007]108号
![国家食品药品监督管理局关于加强碳青霉烯类等药品生产管理的通知-国食药监安[2007]108号](https://img.taocdn.com/s3/m/09c48061178884868762caaedd3383c4bb4cb4a7.png)
国家食品药品监督管理局关于加强碳青霉烯类等药品生产管理的通知正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 国家食品药品监督管理局关于加强碳青霉烯类等药品生产管理的通知(国食药监安[2007]108号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局):近年来,β-内酰胺结构类药品逐渐增多,国家局在组织专家论证并广泛征求意见的基础上,现就加强碳青霉烯类等β-内酰胺结构类药品生产管理的有关事宜通知如下:一、碳青霉烯类凡采用半合成工艺生产碳青霉烯类原料药和采用此原料生产制剂的,均必须使用专用设备和独立的空气净化系统,并与其他类药品生产区域严格分开。
凡采用全合成工艺生产碳青霉烯类原料药和采用此原料生产制剂的,可按照普通化学类药品管理。
二、单环β-内酰胺类氨曲南为全合成的单环β-内酰胺类药品,该产品生产可按照普通药品管理,但应与其它β-内酰胺类药品生产区域严格分开。
三、头霉素类、氧头孢烯类该两类产品临床注意事项等均与头孢菌素类产品相似,其生产应按头孢菌素类药品管理。
四、β-内酰胺酶抑制剂为确保药品质量,避免青霉素类与头孢菌素类产品之间的交叉致敏,生产含β-内酰胺酶抑制剂抗生素复方制剂的生产企业,在选择原料药供应商时,必须根据其配伍对象考察相关原料药的生产条件,避免青霉素类产品与头孢菌素类产品交叉污染。
各地应加强对上述各类产品生产企业的监督检查,凡不符合要求的,应责令限期改正。
对执行过程中的问题,请及时与国家局药品安全监管司联系。
国家食品药品监督管理局二○○七年三月五日——结束——。
欧盟更新麦考酚类药品的避孕建议

欧盟更新麦考酚类药品的避孕建议
EMA网站
【期刊名称】《中国医药导刊》
【年(卷),期】2018(20)1
【摘要】2017年12月15日,欧洲药品管理局(EMA)发布安全信息,更新了针对服用麦考酚类药品用于预防移植器官排斥反应的男性和女性患者的风险控制建议。
EMA评估后认为,女性患者怀孕期间胎儿暴露于麦考酚类药品可增加出生缺陷和流产风险是麦考酚类药品的已知风险。
但目前证据尚不能证实父亲服用麦考酚类药品后是否能增加胎儿畸形和流产风险,尽管不能完全排除该类药品的基因毒性风险。
【总页数】1页(P23-23)
【关键词】药品管理局;酚类;风险控制;避孕;欧盟;器官排斥反应;女性患者;胎儿畸形;【作者】EMA网站
【作者单位】不详
【正文语种】中文
【中图分类】R95
【相关文献】
1.警惕!麦考酚类药品生殖毒性风险 [J],
2.CFDA:关注麦考酚类药品的生殖毒性风险 [J],
3.关于我国麦考酚类药品生殖毒性风险的分析及思考 [J], 冯红云;范燕;吴桂芝;董铎
4.英国发布使用吗替麦考酚酯和麦考酚酸应避孕的建议 [J],
5.欧盟建议采取附加措施防止妊娠期使用麦考酚酯 [J], EMA网站
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
国家食品药品监管总局公告2017年第35号――关于修订麦
考酚类药品说明书的公告
【法规类别】药品管理
【发文字号】国家食品药品监管总局公告2017年第35号
【发布部门】国家食品药品监督管理总局
【发布日期】2017.03.17
【实施日期】2017.03.17
【时效性】现行有效
【效力级别】部门规范性文件
国家食品药品监管总局公告
(2017年第35号)
关于修订麦考酚类药品说明书的公告
根据药品不良反应评估结果,为进一步保障公众用药安全,国家食品药品监督管理总局决定对麦考酚类药品〔包括:吗替麦考吩酯制剂(包括片、分散片、胶囊、干混悬剂、注射剂)、麦考酚钠肠溶片〕说明书增加黑框警告、并对【不良反应】、【禁忌】等项进行修订。
现将有关事项公告如下:
一、所有麦考酚类药品生产企业均应依据《药品注册
1 / 1。
