确定元素在元素周期表中的位置
元素周期表中常见的几种应用

元素周期表中常见的几种应用元素周期表是按照元素的周期律排列的,周期表中的元素所在的位置具有专一性和特殊性。
元素的原子序数、元素的性质和它所在周期表中位置是密切相关的,在解题时,元素周期表中“位—构—性”三者之间的关系应用较为广泛。
现把元素周期表中常见的几种应用总结如下:一、在判断元素在周期表中位置时,只要记住了惰性元素(0族元素)的原子序数(He-2,Ne-10,Ar-18,Kr-36,Xe-54,Rn-86),就可以确定主族元素所在的周期和主族。
(1)比相应的惰性元素多1或2,则应在下周期的ⅠA族或ⅡA族。
如87号元素,87-86=1,应在第七周期ⅠA族;例1.已知镭是88号元素,关于镭的性质的描述中不正确的是()A.在化合物中显+2价B.单质遇水反应,放出氢气C.氢氧化物呈两性D.碳酸盐难溶于水解析:由于镭是88号元素,比Rn-86多2,所以镭元素在Rn的下一个周期,第七周期,第ⅡA族。
它的性质中C不正确,镭的氢氧化物是碱性的。
所以答案为C。
(2)比相应的惰性元素少1-5,则应该在本周期的ⅢA—ⅦA族。
如83号元素,86-83=3。
应该在第六周期ⅤA族;例2.已知元素砷(As)的原子序数为33,下列叙述正确的是()A.砷元素的最高化合价为+3B.砷元素是第四周期的主族元素C.砷原子的第3电子层含有18个电子D.砷的氧化物的水溶液呈强碱性解析:砷的原子序数33比Kr的少3,可以推出砷处于第四周期、VA族,为一非金属元素,因此它的最高正价为+5价,其氧化物的水溶液应呈酸性。
所以答案为BC。
二、可以预测新的元素,结合周期表中可以预测的未发现的惰性气体元素(118号),按照上述方法可以推测114号元素应该在第七周期ⅣA族。
例3.2003年RUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。
下列关于Ds的说法不正确的是()A.Ds原子的电子层数为7B.Ds是超铀元素C.Ds原子的质量数为110D.Ds为金属元素解析:Ds元素的金属元素为110,根据未发现的惰性气体元素(118号)在第七周期,所以Ds元素在第七周期,为超铀元素,是金属元素。
原子结构与元素周期表

问题一:原子结构与元素周期系的关系 活动1:思考:教材P14科学探究1,并根 据各周期开头与结尾元素的最外层电子的排布 式总结每一周期元素原子结构特点。 1s1 2s1 3s1 4s1 5s1 6s1 1s2 2s22p6 3s23p6 4s24p6 5s25p6 6s26p6
通式:ns1——ns2np6
5 18
1S2 2s22p6 3s23p6 4s24p6
5s1-2 4d1-85s2 4d105s1-2 5s25p1-5 5s25p6 6 32 6s1-2 4f1-146s2 5d106s1-2 6s26p1-5 6s26p6 5d1-106s2
各区元素的特征:
1、s区元素 最后1个电子填充在 ns 轨道上,价层电子 的排布是 ns1 或 ns2 ,位于周期表的左侧,
【归纳拓展】 1. d、ds、f 区全是金属元素,非金属元素主 p 区。主族主要含 s、p 区,副 要集中 族主要含 d、ds、f 区,过渡元素主要含 d、ds、f 区。 2.价电子特征排布 s区:价电子数=主族序数 d区: 价电子总数=副族序数(第Ⅷ族例外) ds区: 价电子总数=所在的列序数 p区: 价电子总数=主族序数
原子的电子排布与主族的关系
所在列数
1
2
13
IIIA
14
ⅣA
15
ⅤA
16
ⅥA
17
ⅦA
主族序数 ⅠA IIA
2 2 4 ns 最外层电 2np3 ns np ns 子排布 ns1 ns2 ns2np1 ns2np2 np5 价电子数
1
2
3
4
5
6
7
主族元素: 主族序数 = 原子的最外层电子数 = 价电子数
稀有气体定位法确定元素在元素周期表中的位置

稀有气体定位法确定元素在元素周期表中的位置同学们还在为无法确定元素是第几周期第几族而苦恼吗?今天凹凸个性教育化学系的王玉帅老师就来教大家如何利用稀有气体元素来给元素进行定位。
首先大家要牢牢记住稀有气体元素的原子序数2,10,18,36,54,86,118,(简单记忆稀有气体元素原子序数的方法:记住第一个数是2,依次加8/8/18/18/32/32就可以推算出后面的数了)这7个元素位于每个周期的最后一个位置上,也就是说每个周期的元素排列如下所示:第一周期:1-2第二周期:3-10第三周期:11-18第四周期:19-36第五周期:37-54第六周期:55-86第七周期:87-118我们得到一个化学元素根据上面编列情况就可以判断出该元素所属的周期,如铁元素的原子序数是26,26在19-36这个范围内,也就是说铁是第四周期的元素。
铂的原子序数是78,78在55-86这个范围内,也就是说铂是第六周期的元素。
然后大家要记住元素周期表族排列的规律:ⅠA,ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ、ⅠB,ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA,0需要特殊注意以下几点:1.短周期元素(前18号元素)直接靠我们初中背诵的口诀进行记忆。
2.第Ⅷ族的有3个列需要注意,第六周期和第七周期的第ⅢB族会有15个列(锕系元素镧系元素)接下来判断族的方法如下:比如铁是26号元素,我们上面讲过自己根据稀有元素的原子序数列出一个上述的表格,26属于19-36这个范围即是属于第四周期的元素,然后将第四周期的元素展开即是19、20、21、22、23、24、25、26、根据元素周期表族排列的规律,19对应ⅠA,20对应ⅡA、21对应ⅢB,22对应ⅣB,23对应ⅤB、24对应ⅥB、25对应ⅦB,26,27,28这三个对应着Ⅷ,29对应着ⅠB,30对应着ⅡB,31对应着ⅢA,32对应着ⅣA,33对应着ⅤA,34对应着ⅥA、35对应着ⅦA、36对应着0族,可以判断出铁元素是Ⅷ族的。
—新教材课标高中化学必修第一册教师用书:4第二课时 元素周期表 核素 含答案

第二课时元素周期表核素学习目标:1.知道元素周期表的发展历程,培养探索未知的意识。
2.能说出元素周期表的编排原则及其结构。
3.能根据原子序数确定元素在周期表中的位置。
4.知道核素、同位素的含义。
1.元素周期表的结构(1)原子核外电子排布的表现方法:原子结构示意图。
试写出下列原子的结构示意图。
(2)元素周期表的发展历程(3)元素周期表的编排原则①原子序数:按照元素在周期表中的顺序给元素编的序号。
②原子序数与元素的原子结构之间的关系:原子序数=核电荷数=质子数=核外电子数。
③横行原则:把电子层数目相同的元素,按原子序数递增的顺序从左到右排列。
④纵行原则:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排列。
(4)元素周期表的结构①周期a.含义:把电子层数相同的元素,按原子序数递增的顺序从左到右排列的一横行,叫做一个周期。
b.数目:元素周期表有7个横行,有7个周期。
c.特点:周期序数=该周期元素原子的电子层数。
d.分类:②族a.含义:元素周期表18个纵行中,除中间8、9、10三个纵行为一族外,其余每一纵行为一族。
b.数目:元素周期表中有18个纵行,但只有16个族。
c.特点:主族元素的族序数=该主族元素原子的最外层电子数。
d.分类e.常见族的别称(5)认识元素周期表的相关信息元素周期表中每个格中的信息(以Fe为例):2.元素周期表在元素推断中的应用(1)元素在周期表中的位置与原子结构的相互推断①元素的位置与原子结构的关系②填写符合条件的短周期元素符号a.族序数等于周期数的元素有H、Be、Al。
b.族序数是周期数的2倍的元素有C、S。
c.族序数是周期数的3倍的元素是O。
d.周期数是族序数的2倍的元素是Li。
e.周期数是族序数的3倍的元素是Na。
(2)由元素的原子序数推断元素在周期表中的位置。
3.核素同位素(1)核素①概念:具有一定数目质子和一定数目中子的一种原子。
②实例——氢的三种核素(2)同位素①概念:质子数相同而中子数不同的同一元素的不同原子互称为同位素,即同一元素的不同核素互称为同位素。
学习技巧:主族元素在元素周期表中的位置速判法

主族元素在元素周期表中的位置速判法一、根据原子结构示意图的速判法。
1、直接由原子结构示意图速判法。
由原子结构简图可知该元素的电子层数和最外层电子数。
对主族元素而言,其电子层数就是该元素在元素周期表中的周期序数;其最外层上的电子数就是该元素在周期表中的族序数。
由该元素在周期表中的周期和族决定元素的位置。
如某主族元素的原子结构示意图为:根据它有个电子层,最外层上有7个电子,又是主族元素,所以它在元素周期中位于第4周期,第ⅦA族。
2、由原子序数可写出相应的原子结构示意图,进而判定该元素在元素周期表中的位置。
如判断20号元素周期表中位置。
20号元素的原子结构示意图为:在元素周期表中位置第四周期,第ⅡA族二、根据原子序数直接速判法。
1、熟记稀有气体元素的原子序数及周期数。
原子序数:2·10·18·36·54·86·118周期数:一·二·三·四·五·六·七2、比大小,定周期。
比较该元素的原子序数与0族元素的原子序数的大小,找出与其相近的0族元素,那么,该元素就和原子序数大的0族元素处于同一周期。
3、求差值、定族数。
(1)若某元素的原子序数比相应的0族元素多1或2,则该元素位于第ⅠA族或第ⅡA族。
(2)若比相应0族元素的少1~5时,则位于第ⅦA~第ⅢA族例如:确定35号元素在周期表中位置。
由于18<35<36,则35号元素位于第四周期,36-35=1,则35号元素位于36号元素左侧第一格,即第ⅦA族,所以35号元素位于第四周期第ⅦA 族。
例如:确定88号元素在周期表中位置。
由于86<88<118,则88号元素位于第七周期,88-86=2,则88号元素位于第七周期的第二格,即第ⅡA族,所以88号元素位于第七周期第ⅡA族。
判断元素在周期表中位置的方法技巧

返回
2.据国外资料报道,在独居石(一种共生矿,化学成分为
La、Ce、Nd等的磷酸盐)中,经查明含有尚未命名的116、 124、126号元素。试判断116号元素应位于元素周期表 ( A.第6周期ⅣA族 )
B.第7周期ⅥA族
C.第7周期Ⅷ族
D.第8周期ⅥA族
小专题 大智慧 第 1 部 分 第 1 章 判断元 素在周 期表中 位置的 方法技 巧
专题讲坛
专题专练
返回
返回
返回
1.根据核外电子排布规律推断
(1)最外层电子数等于或大于3(小于8)的一定是主族元素。
(2)最外层有1个或2个电子,则可能是ⅠA、ⅡA族元素也 可能是副族、Ⅷ族或0族元素氦。 (3)最外层电子数比次外层电子数多的元素一定位于第2周 期。
②88号元素:由于86<88<118,则88号元素位于第7周
期,88-86=2,所以88号元素位于第7周期的第二格,即 ⅡA族,所以88号元素位于第7周期ⅡA族。
返回
1.下列说法正确的是
(
)
A.原子最外层电子数等于或大于3的元素一定是非金
属元素 B.原子最外层只有1个电子的元素一定是金属元素 C.最外层电子数比次外层电子数多的元素一定位于第 2周期
题意b-9+b-7=b,解之得b=16。因此元素B是硫,则 A是氮,C是氟。
答案:(1)氮
硫
氟
(2)3
ⅥA
(3)
返回
D.某元素的离子最外层电子数与次外层电子数相同,
该元素一定位于第3周期 返回
Байду номын сангаас
解析:A项,金属Al、Sn、Bi等最外层电子数等于或大于3; B项,H原子最外层只有一个原子,是非金属;C项,最外 层电子数不能大于8,除第2周期元素外,原子的次外层电
元素周期表中的规律

元素周期表中的规律一、最外层电子数规律1. 最外层电子数为1的元素:主族(IA族)、副族(IB、VIII族部分等)。
2. 最外层电子数为2的元素:主族(IIA族)、副族(IIB、IIIB、IVB、VIIB 族)、0族(He)、VIII族(26Fe、27Co等)。
3. 最外层电子数在3~7之间的元素一定是主族元素。
4. 最外层电子数为8的元素:0族(He除外)。
二、数目规律1. 元素种类最多的是第IIIB族(32种)。
2. 同周期第IIA族与第IIIA族元素的原子序数之差有以下三种情况:(1)第2、3周期(短周期)相差1;(2)第4、5周期相差11;(3)第6、7周期相差25。
4. 同主族相邻元素的原子序数:第IA、IIA族,下一周期元素的原子序数=上一周期元素的原子序数+上一周期元素的数目;第IIIA~VIIA族,下一周期元素的原子序数=上一周期元素的原子序数+下一周期元素的数目。
三、化合价规律1. 同周期元素主要化合价:最高正价由+1 +7(稀有气体为0价)递变、最低负价由-4 -1递变。
2. 关系式:(1)最高正化合价+|最低负化合价|=8;(2)最高正化合价=主族族序数=最外层电子数=主族价电子数。
3. 除第VIII族元素外,原子序数为奇(偶)数的元素,元素所在族的序数及主要化合价也为奇(偶)数。
四、对角线规律金属与非金属分界线对角(左上角与右下角)的两主族元素性质相似,主要表现在第2、3周期(如Li和Mg、Be和Al、B和Si)。
五、分界线规律位于金属与非金属之间的分界线,右上方的元素为非金属(周期表中的颜色为深绿色),在此可以找到制造农药的元素(如Cl、P等),左下角为金属元素(H除外),分界线两边的元素一般既有金属性,又有非金属性;能与酸和碱反应(如Be、Al等),还可找到制造半导体材料的元素(如Si、Ge等)。
六、金属性、非金属性变化规律1. 同一周期,从左到右(0族除外)金属性减弱,非金属性增强;同一主族,从上到下金属性增强,非金属性减弱。
化学元素周期表和化合价巧计方法

化学元素周期表口诀:口诀A、按周期分:第一周期:氢氦---- 侵害第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙第四周期:钾钙钪钛钒铬锰---- 嫁给康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克第五周期:铷锶钇锆铌---- 如此一告你钼锝钌---- 不得了铑钯银镉铟锡锑---- 老爸银哥印西提碲碘氙---- 地点仙第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河钽钨铼锇---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅---- 一白巾供它牵铋钋砹氡---- 必不爱冬(天)第七周期:钫镭锕---- 防雷啊!B、按族分:氢锂钠钾铷铯钫——请李娜加入私访铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋临身体闭氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点爱氦氖氩氪氙氡——害耐亚克先动C:分组背诵法:把五个元素分成一组来背诵。
1.H He Li Be B (氢氦锂铍硼)2.C N O F Ne(碳氮氧氟氖)3.Na Mg Al Si P (钠镁铝硅磷)4.S ClAr K Ca (硫氯氩钾钙)5.Sc Ti V Cr Mn (钪钛钒铬锰)6.Fe Co Ni Cu Zn (铁钴镍铜锌)规律:一、元素周期表中元素及其化合物的递变性规律1、原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
2、元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同。
3、单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。
高中化学.元素推断专题(普)

高考要求内容要求层次具体要求ⅠⅡⅢ物质结构与元素周期律√通过同周期、同主族元素性质的递变规律,理解“位-构-性”三者之间的相互关系。
√进一步挖掘元素周期表的各元素特殊的结构、性质方面信息,掌握推断的基本思路。
√掌握通过元素间形成的化学键的类型反过来用于元素的推断的能力。
元素周期表与元素化合物的综合运用以推断题出现,是高考必考的一种题型。
未来仍然会以“位-构-性”三者的关系及元素化合物推断为考查重点。
一、根据原子序数推断元素在周期表中的位置记住稀有气体元素的原子序数:2、10、18、36、54、86。
用原子序数减去比它小的而且相近的稀有气体元素原子序数,即得该元素所在的纵行数。
第1、2纵行为第ⅠA、第ⅡA族,第13~17纵行为第ⅢA~ⅦA族,18纵行为第0族(对于短周期的元素,其差即为主族序数)。
二、原子结构与元素在周期表中的位置关系规律3.1周期表推断新课标剖析知识点睛元素推断专题结构位置性质1.对于主族原子而言:电子层数=周期数;最外层电子数=主族的族序数=最高正价。
2.在元素周期表中:由左至右:原子序数逐渐变大,原子半径逐渐变小,金属性逐渐减弱,非金属性逐渐增强。
由上至下:原子序数逐渐变大,原子半径逐渐变大,金属性逐渐增强,非金属性逐渐减弱。
3.2 原子结构与元素性质推断一、主族元素化合价规律1.最高正价=最外层电子数最低负价=最外层电子数8-最高正价最低负价8+=2.化合物中氟元素、氧元素只有负价;金属元素只有正价;3.化合价与最外层电子数的奇、偶关系:最外层电子数为奇数的元素,其化合价通常为奇数,如Cl的化合价有+1、+3、+5、+7和1-价。
最外层电子数为偶数的元素,其化合价通常为偶数,如S的化合价有2-、+4、+6价。
二、周期表中特殊位置的元素(前三周期)1.族序数等于周期数的元素:H、Be、Al;2.族序数等于周期数2倍的元素:C、S;3.族序数等于周期数3倍的元素:O;4.周期数是族序数2倍的元素:Li;5.周期数是族序数3倍的元素:Na;6.最外层电子数等于最内层电子数的短周期元素:Be、Mg7.最外层电子数是次外层电子数一半的短周期元素:Li、Si8.最外层电子数是总电子数一半的短周期元素:Be9.最外层电子数是总电子数1/3的短周期元素:P、Li10.同一主族中相邻上下两元素序数差为2倍关系的元素:O、S三、特殊的元素和特殊结构的微粒1.特殊的元素①形成化合物种类最多的元素,或气态氢化物中氢的质量分数最大的元素,或组成单质熔、沸点最高的元素:C;②常温下呈液态的非金属单质元素:Br;③最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素,或地壳中含量最多的金属元素:Al;④元素的气态氢化物和它的最高价氧化物的水化物能发生化合反应的元素,或大气中含量最多的元素:N;⑤ 其单质能与最高价氧化物的水化物能发生氧化还原反应的元素,或元素的气态氢化物能和它的氧化物在常温下反应生成该元素单质的元素:S ; ⑥ 用于做半导体材料的元素:Si 。
如何由原子序数推断元素在周期表中位置

如何由原子序数推断元素在周期表中位置关于由原子序数推断元素在周期表中位置的习题,是大多数学生感到头痛的问题,本文归纳总结了几种常用的方法。
例如:已知某元素的原子序数为51,确定其在元素周期表中的位置解法一:递减法——记住周期表中各周期所含的元素种类,用原子序数减去各周期所含元素种类,到不够减时止就可确定出周期数,余数为元素所在的纵行数,根据各纵行所对应的族数确定。
如51号元素:51-2-8-8-18=15,当减去前四周期的元素种数时所得余数为15,已不能再减去第五周期的元素种数18,所以该元素应在第5周期,第十五个纵行即第VA族。
用此种方法须记住每一周期的元素种类数,其中第一周期元素种类数为2,二三周期元素种类数均为8,四五周期元素种类数均为18,第六周期元素种类数为32,第七周期为不完全周期,现在只排了26种。
此外还应记住每一纵行对应的族序数,其中,从元素周期表的左边开始数,第一纵行为第IA族,第二纵行为第IIA族,第三纵行为第IIIB族,第四纵行为第IVB族,第五纵行为第VB族,第六纵行为第VIB族,第七纵行为第VIIB族,第八九十纵行为第VIII族,第十一纵行为第IB族,第十二纵行为第IIB族,第十三纵行为第IIIA族,第十四纵行为第IVA族,第十五纵行为第VA族,第十六纵行为第VIA族,第十七纵行为第VIIA族,第十八纵行为第零族。
该法虽能方便的确定周期序数,但不能快速确定元素的周期序数,对于第六第七周期的元素,由于要考虑镧系和锕系元素的特殊情况比较容易出错。
解法二:差值法1公式:原子序数-上周期尾元素序数=差值即用原子序数减去与其最接近且小于或等于它的周期尾元素序数(即比它小的相近的稀有气体的原子序数),得差值,若差值为不为0,则该元素位于尾序数元素的下一周期,差值即为元素在周期表中的纵行数。
如与51号元素最接近且比其小的稀有气体元素的原子序数为36,即51-36=15。
所以该元素应在第5周期,第十五个纵行即第VA族。
元素周期表规律总结 氧化还原反应的几种配平技巧

一. 主族元素的判断方法:符合下列情况的均是主族元素1. 有1~3个电子层的元素(除去He、Ne、Ar);2. 次外层有2个或8个电子的元素(除去惰性气体);3. 最外层电子多于2个的元素(除去惰性气体);二. 电子层结构相同的离子或原子(指核外电子数与某种惰性元素的电子数相同而且电子层排布也相同的单核离子或原子)(1)2个电子的He型结构的是:H-、He、Li+、Be2+;(2)10个电子的Ne型结构的是:N3-、O2-、F-、Ne、Na+、Mg2+、Al3+(3)18个电子的Ar型结构的是:S2-、Cl-、Ar、K+、Ca2+三. 电子数相同的微粒(包括单核离子、原子、也包括多原子分子、离子)1. 2e-的有:H-、H2、He、Li+、Be2+;2. 10e-的有:N3-、O2-、F-;Na+、Mg2+、Al3+;Ne、HF、H2O、NH3、CH4(与Ne同周期的非金属的气态氢化物)NH4-、NH2-、H3O+、OH-;3. 18e-的有:S2-、CL-、Ar、K+、CA2+;SiH4、PH3、H2S、HCl(与Ar同周期的非金属的气态氢化物);HS-、PH4+及、H2O2、F2、CH3-OH、CH3-CH3、CH3-F、CH3-NH2、NH2-NH2、NH2-、OH-等。
四. 离子半径的比较:1. 电子层结构相同的离子,随原子序数的递增,离子半径减小。
2. 同一主族的元素,无论是阴离子还是阳离子,电子层数越多,半径越大。
即从上到下,离子半径增大。
3. 元素的阳离子半径比其原子半径小,元素的阴离子半径比其原子半径大。
五. 同一主族的相邻两元素的原子序数之差,有下列规律:1. 同为IA、IIA的元素,则两元素原子序数之差等于上边那种元素所在周期的元素种类数。
2. 若为IIIA、VIIA的元素,则两元素原子序数之差等于下边那种元素所在周期的元素种类数。
例如:Na和K原子序数相差8,而Cl和Br原子序数相差18。
元素周期表与元素周期律专题复习

元素周期表与元素周期律专题复习【原子序数与位置】1、由原子序数确定元素在周期表中的位置【例1】:已知某主族元素R 的原子序数为31,依据元素周期律对该元素的性质进行预测。
对下列性质的预测,你认为错误的是( )A 、原子核外有4个电子层B 、原子最外层有3个电子C 、该元素是非金属元素D 、最高价氧化物既可以与盐酸反应又可以与NaOH 溶液反应 根据中学的核外电子排布知识很难知道它在周期表中的位置。
训练1:日本理化学研究所的科研人员于近期成功地合成了113号元素,这是亚洲科学家首次合成的新元素。
中国科学院近代物理研究所研究员徐瑚珊和中国科学院高能物理研究所研究员赵宇亮参与了这项研究工作。
该元素所在周期表的位置是( )A 、第6周期,ⅣA 族B 、第7周期,ⅣA 族C 、第6周期,ⅢA 族D 、第7周期,ⅢA 族2、由位置推断原子序数1)同周期相邻主族的原子原子序数 【例2】.已知a 为IIA 族元素,b 为IIIA 族元素,它们的原子序数分别为m 和n ,且A .b为同一周期元素,下列关系式错误的是A .n=m+11B .n=m+25C .n=m+10D .n=m+12)“+”型元素原子序数之间的规律【例3】.(1)原子序数大于4的主族元素A 和B 的离子A m+和B n-它们的核外电子排布相同,据此推断:①A 和B 所属周期数之差为___________________________________, ② A 和B 的核电荷数之差为______________(用含m 、n 的代数式表示) ③ B 和A 的族序数之差为________________(用含m 、n 的代数式表示)(2)A 、B 两元素,A 的原子序数为x ,A 和B 所在周期包含元素种类数目分别为m 和n 。
如果A 和B 同在ⅠA 族,当B 在A 的上一周期时,B 的原子序数为______________;当B 在A 的下一周期时,B 的原子序数为______________;如果A 和B 同在ⅦA 族,当B 在A 的上一周期时,B 的原子序数为______________;当B 在A 的下一周期时,B 的原子序数为______________。
元素周期表的编排原则
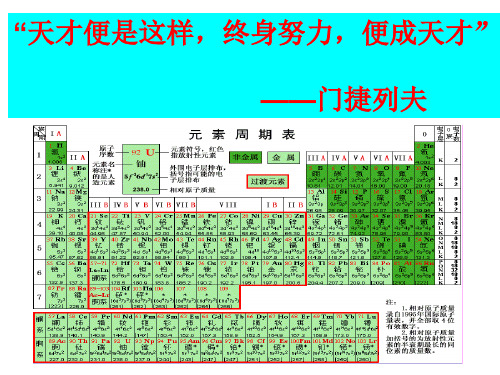
元素周期表及其应用
(一)元素周期表的结构
元素周期表是元素周期律的具体表现形式
(1)周期(横行) 具有相同的电子层数而又按原子 序数递增的顺序排列的一系列元 素,称为一个周期。
元素周期表的编排原则:
• 从左到右元素的原子序数依次递增 • 电子层数相同的元素排在同一行
周期数=电子层数
三短三长一不完全
(3)周期的分类:
短周期
第一周期:2 种元素(1-2)
第二周期:8 种元素 (3-10)
short periods 第三周期:8 种元素(11-18)
周期
periods
(横向)
第五周期:18 种元素(37-54) long periods 第六周期:32 种元素 (55-86)
第一周期: 第二周期: 第三周期: 第四周期: 第五周期: 第六周期: 2 8
8
18 18 32
第七周期:应该有32
34号元素位于第几周期第几族 ?
第一周期原子个数 第二周期原子个数 第三周期原子个数
34-2-8-8=16 因为第四周期有18个原子,所以16在 倒数第三纵行上,所以是 第四周期第VIA族 。
主族
ⅠA ⅡA
0族
Ⅷ 族
Ⅲ A ⅣA ⅤA ⅥA ⅦA
0
副族
ⅢB ⅣBⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
过渡元素
判断下列说法是否正确 1、短周期元素全是主族元素 错,还有0族元素 2、短周期元素共有20种元素
错,短周期包括1、2、3周期,共18种元素
3、过渡元素全是长周期元素 正确,过渡元素还全是金属元素 4、过渡元素全是副族元素
17 Y 35
确定元素在周期表中位置的方法

确定元素在周期表中位置的方法一、利用元素的原子结构推断推断依据:周期序数= 电子层数主族序数= 最外层电子数原子序数= 核电荷数= 核外电子数= 质子数二、根据核外电子排布规律推断(1) 最外层电子数等于或大于3(小于8)元素一定是主族元素。
(2) 最外层有1个或2个电子的元素, 可能是第IA族、第ⅡA族元素,也可能是副族、第Ⅷ族元素或氦元素。
(3) 最外层电子数比次外层电子数多的元素一定位于第二周期。
(4) 某元素的阴离子最外层电子数与次外层电子数相同, 则该元素位于第三周期; 若为阳离子, 则位于第四周期。
三、根据0族元素原子序数判断(1)比大小定周期比较该元素原子序数与0族元素原子序数的大小, 找出与其相近的两个0族元素, 那么该元素就和比其原子序数大的0族元素位于同一周期。
(2) 求差值定族数①若某元素比与其邻近的0族元素的原子序数多1或2, 则该元素应位于该0族元素所在周期的下一周期的第IA族或第ⅡA族。
②若某元素比与其邻近的0族元素的原子序数少1~5, 则该元素应位于该0族元素所在周期的第ⅦA~第ⅢA族。
③若差值为其他数, 则由相应差值找出相应的族。
(3) 实例①53号元素由于36<53<54, 则53号元素位于第五周期, 54-53=1, 故53号元素位于54号元素左侧第一格, 即第ⅦA族, 故53号元素位于第五周期第ⅦA族。
②88号元素由于86<88<118,则88号元素位于第七周期, 88-86=2, 所以88号元素位于第七周期的第二格, 即第ⅡA族,故88号元素位于第七周期第ⅡA族。
【特别提醒】仿照上述推断方法, 若已知碱金属元素的原子序数(分别为3、11、19、37、55、87), 也能推断出某原子序数的元素在周期表中的位置(所在的周期和族), 找出其中的规律。
四、利用“阴上阳下”规律推断具有相同电子层结构的离子, 其对应原子在元素周期表中的位置关系符合“阴上阳下”规律。
元素推断题解答技巧

该题型是高考的热点题型,命题落点是借助元素周期表的片段(某一部分) 推断元素,然后利用位一构一性”关系综合考查元素及化合物性质和化学反应原理的相关内容。
一、元素在周期表中的位置推断1•根据核外电子的排布规律(1)最外层电子规律(2)阴三阳四”规律某元素阴离子最外层电子数与次外层相同,该元素位于第三周期。
若为阳离子,则位于第四周期。
(3) 阴上阳下”规律电子层结构相同的离子,若电性相同,贝y位于同周期,若电性不同,则阳离子位于阴离子的下一周期一一阴上阳下”规律。
2•根据元素周期表结构与原子电子层结构的关系(1) 几个重要关系式①核外电子层数=周期数(对于大部分元素来说);②主族序数=最外层电子数=最高正价= 8 —|最低负价|③|最高正价|最低负价| =(2) 熟悉主族元素在周期表中的特殊位置①族序数等于周期数的元素:H、Be、Al。
②族序数等于周期数2倍的元素:C、S o③族序数等于周期数3倍的元素:0。
④周期数是族序数2倍的元素:Li、Ca o⑤周期数是族序数3倍的元素:Na、Ba o⑥最高正价与最低负价代数和为零的短周期元素:H、C、Si o⑦最高正价是最低负价绝对值3倍的短周期元素:S。
⑧除H夕卜,原子半径最小的元素:F o⑨最高正价不等于族序数的短周期元素:0(F无正价)o二、由元素及其化合物的性质推断(1) 形成化合物种类最多的元素、单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最高的元素:C o(2) 空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。
(3) 地壳中含量最多的元素、氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素:0。
(4) 等物质的量的单质最轻的元素:H ;最轻的金属单质:Li。
(5) 单质在常温下呈液态的非金属元素:Br;金属元素:Hg。
(6) 最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素:Al(7) 元素的气态氢化物和它的最高价氧化物对应的水化物能起化合反应的元素:N ;能起氧化还原反应的元素:S o(8) 元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F o三、综合利用位”构”性”关系推断1.位、构、性”三者之间的关系2•推断元素的常用思路根据原子结构、元素周期表的知识及已知条件,可推算原子序数,判断元素在周期表中的位置等,基本思路如下:四、元素推断的特殊技巧1•公式” +验证”巧推短周期相邻元素(1)若已知三元素的核外电子数(原子序数)之和经验公式:三种元素原子序数之和犬黒中某元素的原子序数注意:若整除则无解。
元素周期表的规律总结

元素周期表的规律一、原子半径同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减;同一族中,从上到下,随着原子序数的递增,元素原子半径递增。
二、主要化合价(最高正化合价和最低负化合价)同一周期中,从左到右,随着原子序数的递增,元素的最高正化合价递增(从+1价到+7价),第一周期除外,第二周期的O、F元素除外最低负化合价递增(从-4价到-1价)第一周期除外,由于金属元素一般无负化合价,故从ⅣA族开始。
元素最高价的绝对值与最低价的绝对值的和为8三、元素的金属性和非金属性同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减;四、单质及简单离子的氧化性与还原性同一周期中,从左到右,随着原子序数的递增,单质的氧化性增强,还原性减弱;所对应的简单阴离子的还原性减弱,简单阳离子的氧化性增强。
同一族中,从上到下,随着原子序数的递增,单质的氧化性减弱,还原性增强;所对应的简单阴离子的还原性增强,简单阳离子的氧化性减弱。
元素单质的还原性越强,金属性就越强;单质氧化性越强,非金属性就越强。
五、最高价氧化物所对应的水化物的酸碱性同一周期中,从左到右,元素最高价氧化物所对应的水化物的酸性增强(碱性减弱);同一族中,从上到下,元素最高价氧化物所对应的水化物的碱性增强(酸性减弱)。
元素的最高价氢氧化物的碱性越强,元素金属性就越强;最高价氢氧化物的酸性越强,元素非金属性就越强。
六、单质与氢气化合的难易程度同一周期中,从左到右,随着原子序数的递增,单质与氢气化合越容易;同一族中,从上到下,随着原子序数的递增,单质与氢气化合越难。
七、气态氢化物的稳定性同一周期中,从左到右,随着原子序数的递增,元素气态氢化物的稳定性增强;同一族中,从上到下,随着原子序数的递增,元素气态氢化物的稳定性减弱。
此外还有一些对元素金属性、非金属性的判断依据,可以作为元素周期律的补充:随同一族元素中,由于周期越高,价电子的能量就越高,就越容易失去,因此排在下面的元素一般比上面的元素更具有金属性。
确定元素在周期表中位置的4种方法

确定元素在周期表中位置的4种方法1.结构简图法:本方法常用于确定原子序数小于18或已知某微粒核外电子排布的元素。
其步骤为原子序数→原子结构简图→“电子层数=周期数”和“最外层电子数=主族序数”。
2.区间定位法:对于原子序数较大的元素,若用结构简图法确定,较复杂且易出错,可采用区间定位法。
其原理:首先,要牢记各周期对应的0族元素的原子序数,从第1周期到第7周期0族元素的原子序数依次为2、10、18、36、54、86、118;其次,要熟悉元素周期表中每个纵行对应的族序数;ⅠA、ⅡA 族为第1、2列,ⅢB~ⅦB是第3~7列,Ⅷ族是第8~10列,ⅠB、ⅡB为第11、12列,ⅢA~ⅦA为第13~17列,0族是第18列。
具备了上述知识,便可按下述方法进行推断:(1)比大小,定周期。
比较该元素的原子序数与0族元素的原子序数的大小,找出与其相近的0族元素,那么,该元素就和原子序数大的0族元素处于同一周期。
(2)求差值、定族数。
用该元素的原子序数减去比它小而相近的0族元素的原子序数,即得该元素所在的纵行数。
由元素所在的纵行数可推出其所在的族。
注:如果有第6、7周期的元素,用原子序数减去比它小而相近的0族元素的原子序数后,再减去14,即得该元素所在的纵行数。
如84号元素所在周期和族的推导:84-54-14=16,即在16纵行,可判断为ⅥA族,第6周期。
3.相同电子层结构法:主族元素的阳离子与上一周期的0族元素原子的电子层结构相同;主族元素的阴离子与同周期的0族元素原子的电子层结构相同,要求掌握氦式结构、氖式结构等。
4.特殊位置法:根据元素在元素周期表中的特殊位置,如周期表中的第1行、第1列、右上角、左下角等来确定。
【例题】X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。
X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子的少1。
下列说法不正确的是A.原子半径由大到小的顺序为Z>Y>XB.元素非金属性由弱到强的顺序为Z<Y<XC.X元素不可能在第1周期,且没有最高正价D.Z在元素周期表的ⅤA族,其最高价氧化物对应水化物的分子式为HZO3【解析】在解有关元素周期表的试题时,首先要确定元素在周期表中的位置,若开始时不能推出其具体位置,可以先推出其相对位置,然而根据其他条件逐步得到其具体位置。
【知识解析】元素在周期表中位置的判断方法

元素在周期表中位置的判断方法1 由基态原子的价层电子排布式判断元素位置(1)主族元素价层电子排布式为n s1(ⅠA族)、n s2(ⅡA族)、n s2n p1~5(ⅢA~ⅦA族)。
例如:某主族元素的价层电子排布式为5s25p3,则该元素在周期表中位于第五周期第ⅤA族。
(2)0族元素价层电子排布式为n s2n p6(He为1s2),周期序数=能层数。
(3)副族元素(4)Ⅷ族:价层电子排布式为(n-1)d x n s0~2,价层电子总数为8、9或10。
2 根据原子序数以0族为基准判断元素位置(1)0族元素在元素周期表中的位置(2)判断方法:由元素原子序数与邻近的稀有气体元素原子序数的大小关系判断其周期序数,进而判断元素所处的纵列,再根据纵列数和族的位置关系确定其位置。
①元素原子序数小于邻近的稀有气体元素原子序数时,元素与稀有气体元素位于同周期,纵列数=18-(稀有气体元素原子序数-元素原子序数)。
②元素原子序数大于邻近的稀有气体元素原子序数时,元素位于稀有气体元素的下一周期,纵列数=元素原子序数-稀有气体元素原子序数。
例如:判断原子序数为38的元素在周期表中的位置,根据38与36接近,38-36=2,可知该元素位于第五周期第ⅡA族。
注意若第六、七周期第ⅢB族(含镧系、锕系元素)后的元素使用此法,则需再减14进行定位。
典例详析例4-17根据下列微粒的最外层或价层电子排布式,能确定该元素在元素周期表中位置的是A.4s1 B.3d104s nC.n s n n p3n D.n s2n p3解析◆价层电子排布式中,包括4s1的有4s1(K)、3d54s1(Cr)、3d104s1(Cu),故不能确定具体位置,A项错误;价层电子排布式为3d104s n包括3d104s1(Cu)、3d104s2(Zn),不能确定具体位置,B项错误;价层电子排布式为n s n n p3n,则n为2,推得具体的价层电子排布式为2s22p6,位于第二周期0族,C项正确;价层电子排布式为n s2n p3时,n可能为2、3、4、5、6、7,不能确定具体位置,D项错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
稀有气体定位法确定元素在元素周期表中的位置
同学们还在为无法确定元素是第几周期第几族而苦恼吗?今天凹凸个性教育化学系的王玉帅老师就来教大家如何利用稀有气体元素来给元素进行定位。
首先大家要牢牢记住稀有气体元素的原子序数2,10,18,36,54,86,118,(简单记忆稀有气体元素原子序数的方法:记住第一个数是2,依次加8/8/18/18/32/32就可以推算出后面的数了)这7个元素位于每个周期的最后一个位置上,也就是说每个周期的元素排列如下所示:
第一周期:1-2
第二周期:3-10
第三周期:11-18
第四周期:19-36
第五周期:37-54
第六周期:55-86
第七周期:87-118
我们得到一个化学元素根据上面编列情况就可以判断出该元素所属的周期,如铁元素的原子序数是26,26在19-36这个范围内,也就是说铁是第四周期的元素。
铂的原子序数是78,78在55-86这个范围内,也就是说铂是第六周期的元素。
然后大家要记住元素周期表族排列的规律:ⅠA,ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ、ⅠB,ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA,0
需要特殊注意以下几点:
1.短周期元素(前18号元素)直接靠我们初中背诵的口诀进行记忆。
2.第Ⅷ族的有3个列需要注意,第六周期和第七周期的第ⅢB族会有15个列(锕
系元素镧系元素)
接下来判断族的方法如下:
比如铁是26号元素,我们上面讲过自己根据稀有元素的原子序数列出一个上述的表格,26属于19-36这个范围即是属于第四周期的元素,然后将第四周期的元素展开即是19、20、21、22、23、24、25、26、根据元素周期表族排列的规律,19对应ⅠA,20对应ⅡA、21对应ⅢB,22对应ⅣB,23对应ⅤB、24对应ⅥB、25对应ⅦB,26,27,28这三个对应着Ⅷ,29对应着ⅠB,30对应着ⅡB,31对应着ⅢA,32对应着ⅣA,33对应着ⅤA,34对应着ⅥA、35对应着ⅦA、36对应着0族,可以判断出铁元素是Ⅷ族的。
比如金元素的原子序数是79,根据周期元素的排列规律,79属于55-86范围内,所以金元素是第六周期的元素。
将第六周期的元素展开为:55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77, 78,79…之前和大家说过六七周期要考虑锕系元素和镧系元素(都是ⅢB有15位),即55是ⅠA,56对应ⅡA,57-71这15个都是ⅢB,72对应ⅣB,73对应ⅤB、74对应ⅥB、75对应ⅦB,,76,77,78这三个对应着Ⅷ,79对应着ⅠB,所以79号金元素是第ⅠB族的元素。
再举一个例子来分析,如锡元素是50号元素,(即原子序数50),50根据周期排列规律,50属于37-54这个范围即是第五周期的元素。
将第五周期元素展开,37,38,39,40,41,41,43,44,45,46,47,48,49,50…,37ⅠA,38ⅡA、39ⅢB,40ⅣB,41ⅤB、42ⅥB、43ⅦB,44-46这三个对应着Ⅷ,47ⅠB,48ⅡB,49ⅢA,
50ⅣA,所以50号锡元素是第ⅣA族的元素。
综上所述锡元素是第五周期第ⅣA 族的元素。
聪明的你学会这个方法了吗?更多解题策略和学习方法请大家随时关注凹凸个性教育微信公众平台!。
