谷胱甘肽还原酶检测试剂盒简介讲课讲稿
谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒(比色法)

离心 10min,取上清用于酶活性的测定。
GSH 工作液的配制:用 GSH 配制夜:GSH 储存液(100μ mol/L)=99:1 的比例稀释至 1mmol/L,即为 GSH 工作液(1mmol/L),该溶液配制好以后可 4℃保存 1 天。
2、 GSH-Px 酶促反应: 可参考下表设置检测反应体系,依次加入试剂:
30.8mg 200ml 125ml 30ml 100ml 说明书
Storage
RT -20℃ RT RT -20℃ 避光 -20℃ 避光
操作步骤(仅供参考):
1、 样本处理: ① 血清、血浆样本:从待测样本中分理出的血清或血浆丌应有溶血,如果含有应去除红细
胞后,直接检测,如超过检测范围,用生理盐水稀释后检测。血清去除红细胞的简易方 法如下:用抗凝管收集血液,颠倒混匀。取至少 500μl 全血。弃上清,用冰冷的红细 胞沉淀 10 倍体积的样品匀浆液重悬沉淀,再同前离心,弃上清。加入约红细胞沉淀 4 倍体积的冰冷的 ddH2O 裂解红细胞。取上清。亦可采用红细胞裂解液去除红细胞,如 Leagene ACK 红细胞裂解液等。 ②组织样本:动物用含有 20U/ml heparin 的生理盐水(0.9% NaCl containing 20U/ml heparin)灌流清除血液后获取组织样品。按照每 20mg 组织加入 200μl 样品匀浆液的比例,
计算:
谷胱甘肽过氧化物酶酶活力单位的定义:1 个酶活力单位(1unit)是指在 37℃, 每 1L 血清,排除非酶促反应,1min 内可以催化 1μmol/L GSH 氧化所需(减少)的酶量为一个 GSH-Px 活性单位。
GSH-Px(U/L)= (A 本底-A 测定-A 空白)/(A 本底-A 空白)×200
还原型谷胱甘肽检测试剂盒(DTNB速率比色法)

还原型谷胱甘肽(GSH)检测试剂盒(DTNB速率比色法)简介:谷胱甘肽(glutathione,GSH)存在于几乎身体的每一个细胞,参与细胞许多功能活动,是一种氧自由基消除剂。
谷胱甘肽能帮助保持正常的免疫系统的功能,保护组织细胞免受氧化损伤,并具有抗氧化作用和整合解毒作用,半胱氨酸上的巯基为其活性基团,故常简写为G-SH或GSH,易与某些药物(如扑热息痛)、毒素(如自由基、碘乙酸、铅、汞、砷等)等结合,具有整合解毒作用。
谷胱甘肽具有广谱解毒作用,在延缓衰老、增强免疫力、抗肿瘤等功能性食品广泛应用。
谷胱甘肽是研究活性氧和自由基的重要指标,亦是机体氧化物牵累的重要指标。
还原型谷胱甘肽(GSH)是一种含γ-酰胺键和巯基的三肽,由谷氨酸、半胱氨酸及甘氨酸组成,能可逆的转变为氧化型谷胱甘肽(GSSG),其存在形式会随着细胞内代谢的情况而发生相互转变。
还原型谷胱甘肽(GSH)检测试剂盒(DTNB速率比色法)(Glutathione Assay Kit)是一种简单易行的检测还原型谷胱甘肽的试剂盒,其检测原理是待测样品中的还原型谷胱甘肽(GSH)与发色底物DTNB反应,产生稳定黄色的TNB和GSSG,通过分光光度法(分光光度计)检测吸光度,与相应处理的GSH标准比较,获得样品的GSH含量。
该试剂盒可用于检测血浆、血清、组织、细胞等样品中还原型谷胱甘肽(GSH)含量。
该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:自备材料:1、离心管或小试管2、蒸馏水3、离心机编号名称TO1037100TStorage试剂(A): 还原型谷胱甘肽(GSH)标准10mg 4℃避光试剂(B): GSH assay buffer 250ml RT试剂(C): DTNB 20mg RT 避光试剂(D): 蛋白沉淀剂4g RT 避光试剂(E): NADPH 10mg -20℃避光使用说明书1份4、水浴锅5、比色杯6、分光光度计或生化分析仪操作步骤(仅供参考):1、配制GSH标准储存液:取还原型谷胱甘肽(GSH)标准加入l ddH2O,溶解并混匀,即为还原型GSH标准储存液(10mM)。
谷胱甘肽过氧化物酶(GSH-Px)试剂盒说明书

谷胱甘肽过氧化物酶(GSH-Px)试剂盒说明书微量法100T/96S注意:正式测定之前选择2-3个预期差异大的样本做预测定。
测定意义:GSH-Px是谷胱甘肽氧化还原循环中催化还原型谷胱甘肽(GSH)氧化的主要酶之一。
GSH-Px不仅能够特异地催化还原型谷胱甘肽与ROS反应,生成氧化型谷胱甘肽GSSG,从而保护生物膜免受ROS的损害,维持细胞的正常功能;而且具有保护肝脏、提高机体免疫力、拮抗有害金属离子对机体的伤害和增加机体抗辐射等能力。
测定原理:GSH-Px催化有机过氧化物氧化GSH,产生GSSG;谷胱甘肽还原酶(GR)催化NADPH还原GSSG,再生GSH,同时NADPH氧化生成NADP+;NADPH在340 nm有特征吸收峰,而NADP+没有;通过测定340 nm光吸收减少速率来计算GSH-Px活性。
自备仪器和用品:低温离心机、水浴锅、可调节移液器、酶标仪、96孔板、和蒸馏水。
试剂组成和配置:试剂一:液体120mL×1瓶,室温保存。
试剂二:粉剂×1瓶,4℃保存。
试剂三:液体10μL×1支,-20℃保存。
试剂四:液体200μL×1瓶,4℃保存。
粗酶液提取:1. 组织:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL试剂一)进行冰浴匀浆。
8000g,4℃离心10min,取上清置冰上待测。
2. 细菌、真菌:按照细胞数量(104个):试剂一体积(mL)为500~1000:1的比例(建议500万细胞加入1mL试剂一),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后8000g,4℃,离心10min,取上清置于冰上待测。
3. 血清等液体:直接测定。
GSH-Px测定操作:1. 酶标仪预热30 min,调节波长到340 nm。
2. 混合试剂在25℃或者37℃(哺乳动物)水浴中预热30min。
3. 混合试剂配制:临用前,在试剂二中加入试剂一20 mL,充分震荡溶解后加入全部试剂三,混匀。
还原型谷胱甘肽 (reduced glutathione,GSH)含量测定试剂盒使用说明

还原型谷胱甘肽(reduced glutathione,GSH)含量测定试剂盒使用说明产品简介:GSH/GSSG是细胞内最重要的氧化还原对之一。
因此,测定细胞内GSH和GSSG含量以及GSH/GSSG比值,能够很好地反映细胞所处的氧化还原状态。
DTNB与GSH反应生成复合物,在412nm处有特征吸收峰;其吸光度变化与GSH含量成正比。
试验中所需的仪器和试剂:可见分光光度计、低温离心机、水浴锅、可调节移液器、1ml比色皿、双蒸水产品内容:试剂一×1支,充分溶解于100ml双蒸水,4℃保存试剂二×1支,充分溶解于50ml试剂一中,4℃保存试剂三×1支,充分溶解于10ml双蒸水中,4℃避光保存操作步骤:一、样品前处理:取组织约0.1g,加1ml试剂二,冰上充分研磨,8000rpm4℃离心10min,取上清。
(如上清不清澈,再离心3min)GSH测定操作:测定前将试剂一于25℃水浴20min按每100mg组织加入1000µL生理盐水的比例进行匀浆。
8000g4℃离心10分钟,取上清,置冰上待测。
对于非哺乳动物组织:按每100mg组织加入1000µL提取液的比例进行匀浆。
8000g 4℃离心10分钟,取上清,置冰上待测。
(2)血清(浆)样品:直接检测。
二、测定操作表:测定管空白管样本0.1ml/试剂一0.7ml0.7ml蒸馏水/0.1ml试剂三0.2ml0.2ml 迅速混匀,于412nm测吸光值,并记录第60s的OD值GSH含量计算:GSH标准曲线公式:y=0.0015x+0.0818(x为GSH浓度,y为吸光值)液体中GSH(µmol/L)=[(OD测定管-OD空白管)-0.0818]/0.0015×样品稀释倍数组织中GSH计算:①GSH(µmol/mg prot)=[(OD测定管-OD空白管)-0.0818]/0.0015×样品稀释倍数÷样品蛋白浓度(Cpr)②GSH(µmol/g mass)=[(OD测定管-OD空白管)-0.0818]/0.0015×样品稀释倍数÷样品质量(g)注意事项:(1)样品处理等过程均需要在冰上进行,且须在当日测定酶活力,以免影响其活力测定时,除试剂一外,其它试剂均需放置在冰上;(2)样本测定前先取1-2个样做预实验,如吸光值太高(超过标准曲线范围,即y >0.2时),应先用试剂二稀释到适当倍数,使得吸光值在标准曲线范围内。
谷胱甘肽还原酶(glutathione reductase, GR)活性测定试剂盒使用说明

谷胱甘肽还原酶(glutathione reductase,GR)活性测定试剂盒使用说明产品简介:GR是广泛存在于真核和原核生物中的一种黄素蛋白氧化还原酶,通常昆虫中GR被TrxR取代,是谷胱甘肽氧化还原循环的关键酶之一。
GR催化NADPH还原GSSG生成GSH,有助于维持体内GSH/GSSG比值。
GR在氧化胁迫反应中对活性氧清除起关键作用,此外GR 还参与抗坏血酸-谷胱甘肽循环途径。
GR能催化NADPH还原GSSG再生GSH,同时不断消耗NADPH;通过测定NADPH减少量,即可测定GR活性。
试验中所需的仪器和试剂:可见分光光度计、低温离心机、水浴锅、可调节移液器、1ml比色皿、双蒸水产品内容:试剂一×1支,充分溶解于100ml双蒸水,4℃保存3个月试剂二×1支,充分溶解于6ml双蒸水中,4℃保存3个月试剂三×2支,临用前配制,每支充分溶解于3ml双蒸水中操作步骤:一、样品前处理:取组织约0.1g,加1ml试剂二,冰上充分研磨,10000rpm4℃离心10min,取上清。
(如上清不清澈,再离心3min)GR测定操作:测定前将试剂一于25℃水浴20min二、测定操作表:测定管空白管试剂一0.75ml0.85ml试剂二0.05ml0.05ml样本0.1ml/试剂三0.1ml0.1ml迅速混匀,于340nm处测定3min内吸光值变化,第0s吸光值记为A1,第180s吸光值记为A2。
GR活力计算:GR活力单位定义:在25℃,pH8.0条件下,每毫克蛋白每分钟氧化1mmol NADPH的酶量为1U(U/mg prot)。
计算公式:GR酶活(U/mg prot)=(△A测定管-△A空白管)/3÷6.22×(V总/V样)×稀释倍数×1000/Cpr=(△A测定管-△A空白管)×535.91×稀释倍数÷Cpr△A=A1-A2,6.22:NADPH的毫摩尔消光系数,V总:反应总体积(ml),V样:所用样品体积(ml),Cpr:蛋白浓度(mg/ml)。
S0055-谷胱甘肽还原酶检测试剂盒

谷胱甘肽还原酶检测试剂盒产品简介:谷胱甘肽还原酶检测试剂盒(Glutathione Reductase Assay Kit)是一种简单易行的通过紫外比色来检测细胞、组织或其它样品中谷胱甘肽还原酶(Glutathione reductase)活性的试剂盒。
谷胱甘肽还原酶可以还原氧化型谷胱甘肽(GSSG)生成还原型谷胱甘肽(GSH)。
谷胱甘肽还原酶在许多组织中都有分布,可以维持细胞内充足的还原型谷胱甘肽(GSH)水平。
GSH可以清除自由基和一些有机过氧化物,或作为谷胱甘肽氧化酶(Glutathione peroxidase)的底物来清除一些过氧化物。
谷胱甘肽还原酶可以催化如下反应。
NADPH在340nm有吸收峰,因此可以通过测定A340的减小来计算出谷胱甘肽还原酶(Glutathione reductase,简称GR)的活性。
本试剂盒可以检测组织匀浆产物、细胞裂解产物等生物样品中的谷胱甘肽还原酶的活性。
一个试剂盒共可以进行100次检测。
保存条件:-20℃保存,半年有效。
NADPH溶解后宜-70℃保存,4℃可以保存一天,-20℃保存一周后NADPH会减少10%以上。
GSSG 在配制成溶液后,适当分装,-20℃保存。
注意事项:本试剂盒检测时牵涉到氧化还原反应,所有氧化剂或还原剂都会干扰本试剂盒的测定。
另外,硫酸钠、硫酸铵和铁氰化物都会干扰本试剂盒的测定。
请尽量避免。
样品可以立即测定,也可以-70℃冻存待以后测定。
一定要严格控制反应时的温度,否则会引起较多误差。
NADPH不太稳定,要严格按照后续说明操作,谨防失活。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:1.样品的准备:a.细胞样品的准备。
可以用碧云天生产的Western及IP细胞裂解液(P0013)参考相应的说明裂解细胞样品。
b.组织样品的准备。
动物用含有1mM EDTA的生理盐水(0.9% NaCl)灌流清除血液后获取组织样品。
可以用碧云天生产的Western及IP细胞裂解液参考相应的说明裂解组织样品。
《实验一谷胱甘肽》课件

步骤二
按照一定比例混合谷氨酸、半胱氨酸和甘 氨酸,加入磷酸盐缓冲液调节pH值。
步骤四
通过高效液相色谱法检测谷胱甘肽的合成 情况。
步骤三
在一定温度和pH值条件下,通过酶促反 应合成谷胱甘肽。
02
谷胱甘肽介绍
谷胱甘肽的化学结构
谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸组成的 三肽。
谷胱甘肽分子中,谷氨酸和半胱氨酸之间形成了 一个肽键。
实验原理
谷胱甘肽是一种重要的三肽,由谷氨酸、半胱氨酸和甘氨酸组成,具有抗氧化、解毒和维持细胞内环境稳定等作用。 本实验将通过化学合成和生物提取两种方法制备谷胱甘肽,并对其性质和功能进行表征。
步骤一
谷胱甘肽的合成
THANKS
感谢观看
讨论与展望
总词
综合讨论与未来方向
详细描述
在讨论与展望部分,应对实验结果进行综合分析和推理,探讨实验结果的可能应用和实 际意义。同时,应结合当前领域的发展趋势和未来需求,提出对实验的改进和进一步研
究的方向,为后续的研究提供参考和启示。
05
结论
本实验的主要发现
谷胱甘肽具有抗氧化和解毒作用
实验结果显示,谷胱甘肽能够清除自由基,减轻氧化应激对细胞的损伤,同时能够结合并 排除有毒物质,保护细胞健康。
《实验一谷胱甘肽》 ppt课件
目录
• 实验简介 • 谷胱甘肽介绍 • 实验操作过程 • 结果与讨论 • 结论 • 参考文献
01
实验简介
实验目的
探究谷胱甘肽对某些疾病 的治疗作用。
了解谷胱甘肽在生物体内 的生理作用。
掌握谷胱甘肽的合成方法 。
01
03 02
实验原理
01
谷胱甘肽是一种含有活性巯基(-SH)的三肽,由谷氨酸、半胱氨 酸和甘氨酸组成。
谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)试剂盒使用说明

谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒使用说明微量法注意:正是测定之前选择2-3个预期差异大的样本做预测定。
货号:BC1195规格:100管/96样产品内容:试剂一:液体×1瓶,4℃保存。
试剂二:粉剂×1瓶,4℃保存。
试剂三:液体×1支,-20℃保存。
混合试剂配制:临用前,在试剂二中加入试剂一20mL,充分震荡溶解后加入全部试剂三,混匀。
(注意:必须现配现用,当天使用完)试剂四:液体×1瓶,4℃保存。
产品说明:GSH-Px是谷胱甘肽氧化还原循环中催化还原型谷胱甘肽(GSH)氧化的主要酶之一。
GSH-Px不仅能够特异地催化还原型谷胱甘肽与ROS反应,生成氧化型谷胱甘肽GSSG,从而保护生物膜免受ROS的损害,维持细胞的正常功能;而且具有保护肝脏、提高机体免疫力、拮抗有害金属离子对机体的伤害和增加机体抗辐射等能力。
GSH-Px催化H2O2氧化GSH,产生GSSG;谷胱甘肽还原酶(GR)催化NADPH还原GSSG,再生GSH,同时NADPH氧化生成NADP+;NADPH在340nm有特征吸收峰,而NADP+没有;通过测定340nm光吸收减少速率来计算GSH-Px活性。
自备仪器和用品:紫外分光光度计/酶标仪、低温离心机、水浴锅、可调节移液器、微量石英比色皿/96孔板和蒸馏水。
操作步骤:一、粗酶液提取:1.组织:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取0.1g组织,加入1mL试剂一)进行冰浴匀浆。
10000rpm,4℃离心10min,取上清置冰上待测。
2.细菌、真菌:按照细胞数量104个:试剂一体积(ml)500~1000:1的比例,建议500万细胞加入1mL试剂一),冰浴超声波破碎细胞(率300w,超声3s,间隔7s,总时间3min)然后10000rpm,4℃,离心10min,取上清置冰上待测。
总谷胱甘肽检测试剂盒
50 μl
50 μl
50 μl
b. 加入50微升0.16mg/ml NADPH溶液,混匀。
c. 立即用酶标仪测定A412,每5分钟测定一次或实时测定,共测定25分钟,测得5个数据。(说明:为了简化实验步骤,可 以在加入NADPH溶液混匀后25分钟,仅测定一次A412)。如果仪器可以设置温度,把温度设置在25℃,否则就在室温
2. Xiao-Long W, Chuan-Ping Y, Kai X, Ou-Jv Q. Selenoprotein W depletion in vitro might indicate that its main function is not as an antioxidative enzyme. Biochemistry (Mosc). 2010;75(2):201-7.
NADPH。每检测一个样品需50微升0.16mg/ml NADPH。
2. 标准品的准备:
把10mM GSH储备液用蛋白去除试剂S溶液稀释成50μM GSH溶液。然后依次稀释成25、15、10、5、2μM GSH溶液。取
50、25、15、10、5、2μM GSH溶液六个点做标准曲线。注意:由于GSH在蛋白去除试剂S溶液中不太稳定,用蛋白去除
b. 细胞样品的准备。请尽量使用新鲜的细胞进行测定,而不要使用冻存的细胞进行测定。PBS洗涤细胞一次,离心收集
细胞,吸尽上清。加入细胞沉淀体积3倍量的蛋白去除试剂S溶液,即如果细胞沉淀为10微升,则加入30微升蛋白去除
试剂S溶液,充分Vortex。(细胞沉淀的体积可以根据细胞沉淀的重量进行估算。收集细胞前后分别对离心管进行称
等处理,而直接加入适量蛋白去除试剂S溶液进行匀浆)。4℃放置10分钟后,10,000g 4℃离心10分钟,取上清用于总
还原型谷胱甘肽(GlutathioneReduced,GSH)含量测定试剂盒使用说明

还原型谷胱甘肽(GlutathioneReduced,GSH)含量测定试剂盒使用说明还原型谷胱甘肽(Glutathione Reduced,GSH)含量测定试剂盒使用说明货号:BC1170常量法(50T/48S)一、试剂盒组成:试剂Ⅰ液体1瓶50ml(4℃保存)试剂Ⅱ液体1瓶50ml(4℃保存)试剂Ⅲ液体1瓶15ml(4℃避光保存)标准品粉末1支10mg(4℃避光保存)说明书一份二、实验原理谷胱甘肽是由谷氨酸(Glu)、半胱氨酸(Cys)和甘氨酸(Gly)组成的天然三肽,是一种含巯基(—SH)的化合物,广泛存在于动物组织、植物组织、微生物和酵母中。
谷胱甘肽能和5,5’-二硫代-双-(2-硝基苯甲酸)(5,5’-dithiobis-2-nitrobenoic acid,DTNB)反应产生2-硝基-5-巯基苯甲酸和谷胱甘肽二硫化物(GSSG)。
2-硝基-5-巯基苯甲酸为黄色产物,在波长412nm处具有最大光吸收。
因此,利用分光光度计法可测定样品中谷胱甘肽的含量。
三、实验仪器分析天平、微量匀浆器(规格2ml)、低温离心机、水浴锅、移液器、可见分光光度计、1ml比色皿。
四、操作步骤1、样品的处理组织处理新鲜组织首先用PBS冲洗2次,然后称取动物组织或者植物组织0.1g。
加入用试剂Ⅰ润洗过的匀浆器中(匀浆器提前放冰上预冷);然后加入1ml试剂Ⅰ(组织/试剂Ⅰ比例保持不变即可),迅速冰上充分研磨(使用液氮研磨效果更好);8000rpm4℃离心10min;取上清液放置于4℃待测,若暂时不能完成测试可放于-80℃保存(可保存10天)。
血液处理血浆:将收集的抗凝血于4℃,600g离心10分钟,吸取上层血浆到另一支试管中,加入等体积的试剂Ⅰ,4℃,8000g离心10分钟,将上清移入新的试管中放置于4℃待测,若暂时不能完成测试可放于-80℃保存(可保存10天)。
血细胞:将收集的抗凝血于4℃,600g离心10分钟,弃去上层血浆用3倍体积的PBS 清洗3次(用PBS重悬血细胞,600g离心10分钟),加入等体积试剂Ⅰ,混匀后4℃放置10分钟,8000g离心10分钟,吸取上清放于4℃待测,若暂时不能完成测试可放于-80℃保存(可保存10天)。
谷胱甘肽还原酶检测试剂盒

GSSG。1 U=1000 mU。
c. 对于谷胱甘肽还原酶:1mU/ml=1nmol NADPH/min/ml=(A340/min)/0.00622 即相当于:[检测体系中谷胱甘肽还原酶活力]=[A340/min(sapmle)-A340/min(blank)]/0.00622 注:[检测体系中谷胱甘肽还原酶活力]的单位为mU/ml。
如果A340/min(sapmle)=0.0255,A340/min(blank)=0.0006,那么 [检测体系中谷胱甘肽还原酶活力]= (0.0255-0.0006)/0.00622=4.0mU/ml
[样品中谷胱甘肽还原酶活力]= 4.0mU/mlX10X20/(0.5mg/ml)=1.6U/mg(蛋白)
注意事项:
¾ 本试剂盒检测时牵涉到氧化还原反应,所有氧化剂或还原剂都会干扰本试剂盒的测定。另外,硫酸钠、硫酸铵和铁氰化 物都会干扰本试剂盒的测定。请尽量避免。
¾ 样品可以立即测定,也可以-70℃冻存待以后测定。 ¾ 一定要严格控制反应时的温度,否则会引起较多误差。 ¾ NADPH不太稳定,要严格按照后续说明操作,谨防失活。 ¾ 为了您的安全和健康,请穿实验服并戴一次性手套操作。
产品编号 S0055
谷胱甘肽还原酶检测试剂盒
产品名称 谷胱甘肽还原酶检测试剂盒
包装 100次
产品简介:
¾ 谷胱甘肽还原酶检测试剂盒(Glutathione Reductase Assay Kit)是一种简单易行的通过紫外比色来检测细胞、组织或其它样 品中谷胱甘肽还原酶(Glutathione reductase)活性的试剂盒。谷胱甘肽还原酶可以还原氧化型谷胱甘肽(GSSG)生成还原型谷 胱甘肽(GSH)。谷胱甘肽还原酶在许多组织中都有分布,可以维持细胞内充足的还原型谷胱甘肽(GSH)水平。GSH可以清 除自由基和一些有机过氧化物,或作为谷胱甘肽氧化酶(Glutathione peroxidase)的底物来清除一些过氧化物。
谷胱甘肽还原酶测定试剂盒(谷胱甘肽底物法)产品技术要求jiuqiang

谷胱甘肽还原酶测定试剂盒(谷胱甘肽底物法)适用范围:本试剂盒用于体外定量测定人血清谷胱甘肽还原酶的含量。
1.1 包装规格包装规格见表1。
表1 包装规格1.2 主要组成成分主要组成成分见表2。
表2 主要组成成分2.1 外观试剂1a为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂1b为无色或浅黄色粉末状物质,复溶后为无色或浅黄色液体,目测不得有任何沉淀及絮状悬浮物;试剂2为无色或浅黄色粉末状物质,复溶后为无色或浅黄色液体,目测不得有任何沉淀及絮状悬浮物;质控品为无色或浅黄色粉末状物质,复溶后为无色或浅黄色液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量液体试剂的净含量应不少于标称量。
2.3 试剂空白吸光度2.3.1 试剂空白吸光度A340nm下测定空白吸光度应≤1.5000。
2.3.2 试剂空白吸光度变化率A340nm下测定试剂空白吸光度变化率(ΔA/min)应≤ 0.0100。
2.4 准确度与已上市产品进行比对试验:在[12,184] U/L区间内,相关系数r≥0.975,在[12,50] U/L区间内测定的绝对偏差应不超过±7.5 U/L,在(50,184]U/L区间内测定的相对偏差应不超过±15%。
2.5 分析灵敏度样本浓度为70U/L时,其吸光度变化率应不超过0.5000。
2.6 线性范围在[12,184] U/L区间内,线性相关系数r≥0.990,在[12,50]U/L区间内线性绝对偏差应不超过±7.5U/L,在(50,184] U/L区间内线性相对偏差应不超过±15%。
2.7 测量精密度2.7.1 重复性使用高、低不同浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 瓶间差试剂1b、试剂2、质控品的瓶间差应≤10%。
谷胱甘肽还原酶测定试剂盒(谷胱甘肽底物法)产品技术要求广州科方生物技术

医疗器械产品技术要求编号:谷胱甘肽还原酶测定试剂盒(谷胱甘肽底物法)2.性能指标2.1试剂盒性能指标2.1.1外观试剂盒各组分应齐全、完整、无液体渗漏;液体试剂应为澄清透明、无絮状物、无肉眼可见颗粒及沉淀的液体;包装标签应清晰,准确、牢固。
2.1.2装量液体试剂的装量应不小于标示量。
2.1.3试剂空白2.1.3.1试剂空白吸光度在温度37℃、波长340nm条件下检测,试剂空白吸光度应≥0.5000(比色杯光径1.0cm)。
2.1.3.2试剂空白吸光度变化率试剂空白吸光度变化率(△A/min)应≤0.0100(比色杯光径1.0cm)。
2.1.4分析灵敏度测定谷胱甘肽还原酶活性为70U/L的样品时,其吸光度变化率(△A/min)应≤0.5000。
2.1.5线性a)线性区间[4,300]U/L,相关系数r应≥0.9900;b)[4,30]U/L区间内绝对偏差应不超过±4.5U/L;(30,300]U/L区间内相对偏差应不超过±15%。
2.1.6精密度2.1.6.1重复性CV应≤10%。
2.1.6.2批间差相对极差(R)应≤10%。
2.1.7准确度以企业参考品为检测样本,测定结果与企业参考品靶值浓度的相对偏差应在±15%范围内。
2.2校准品性能指标2.2.1性状校准品应为无色至淡黄色液体。
2.2.2装量校准品装量应不少于标示值。
2.2.3正确度使用校准物校准后测量参考物质,量值传递的正确度应符合|En|≤1。
2.2.4均匀性a)瓶内均匀性:CV≤10%;b)瓶间均匀性:CV≤15%。
2.3质控品性能指标2.3.1外观质控品应为无色至淡黄色液体。
2.3.2装量质控品装量应不少于标示值。
2.3.3预期结果用校准品校准测量程序后测定质控物,结果应在靶值范围内。
2.3.4均匀性瓶间均匀性:CV应≤15.0%。
谷胱甘肽还原酶(GSR)测定试剂盒 (谷胱甘肽底物法)产品技术要求利德曼
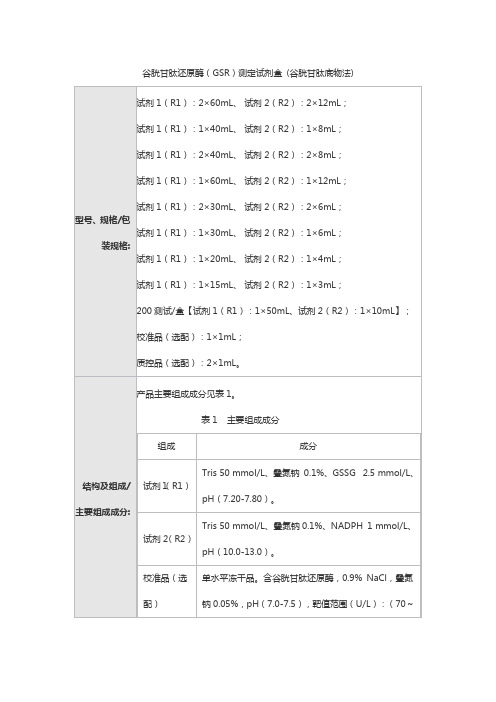
谷胱甘肽还原酶(GSR)测定试剂盒(谷胱甘肽底物法)1.1包装规格试剂1(R1):2×60mL、试剂2(R2):2×12mL;试剂1(R1):1×40mL、试剂2(R2):1×8mL;试剂1(R1):2×40mL、试剂2(R2):2×8mL;试剂1(R1):1×60mL、试剂2(R2):1×12mL;试剂1(R1):2×30mL、试剂2(R2):2×6mL;试剂1(R1):1×30mL、试剂2(R2):1×6mL;试剂1(R1):1×20mL、试剂2(R2):1×4mL;试剂1(R1):1×15mL、试剂2(R2):1×3mL;200测试/盒:【试剂1(R1):1×50mL、试剂2(R2):1×10mL】。
校准品(选配):1×1mL。
质控品(选配):2×1mL。
1.2主要组成成分产品主要组成成分见表1。
表1 主要组成成注:校准品和质控品浓度具有批特异性,具体数值见瓶标签。
2.1外观试剂盒各组分应齐全、完整,液体无渗漏。
包装标签文字符号应清晰。
液体双试剂:试剂1(R1)为无色澄清液体;试剂2(R2)为无色至淡黄色澄清液体。
校准品:冻干品,复溶后为无色至淡黄色澄清液体。
质控品:冻干品,复溶后为无色至淡黄色澄清液体。
2.2 装量液体试剂的净含量不得低于标示体积。
2.3 试剂空白2.3.1空白吸光度在37 ℃、(340 nm±10%)范围内的波长、1cm光径条件下,用纯化水或生理盐水作为样品加入试剂测试时,试剂空白吸光度应≤2.5。
2.3.2空白吸光度变化率在37℃、(340 nm±10%)范围内的波长、1cm光径条件下,用纯化水或生理盐水作为样品加入试剂测试时,空白吸光度变化率(ΔA/min)应≤0.01 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
谷胱甘肽还原酶检测试剂简介
谷胱甘肽还原酶的作用:
一、谷胱甘肽还原酶(GR)在人类细胞中具有极其重要的生理功能,广泛存在于人体肝、肾、心红细胞、单核巨噬细胞等组织细胞中。
它可及时地清除人体代谢过程中产生的氧自由基(OFR),是维持细胞中还原型谷胱甘肽(GSH)含量的主要黄素酶。
对保护肝细胞膜完整具有非常重要的作用意义。
在《临床肝病实验诊断学》和《临床检验诊断解析》中明确标示,血清谷胱甘肽还原酶活性测定可用于协助诊断肝脏疾病,血清谷胱甘肽还原酶活性上升可以辅助诊断肝炎、肝硬化、梗阻性黄疸及相当数量引发的肝肿瘤。
原发性肝细胞癌和广泛转移性肝肿瘤时,血清谷胱甘肽还原酶活性明显升高,急性病毒性肝炎或中毒性肝炎中度升高,而肝硬化是血清GR轻度升高。
二:检测谷胱甘肽还原酶的临床意义
1、急性肝炎早期阶段,血清谷胱甘肽还原酶敏感性最高,可用于肝损的早期检测;
2、急性肝炎患者GR比转氨酶更早增加达到峰值,早早期肝脏损伤判断的首选指标;
3、GR有助于判断亚临床DILI,提高临床DILI的诊断率
4、不同于ALT和AST在肝细胞膜破裂和线粒体破裂时才能检测出来,GR填补肝细胞受损早期自我修复阶段至破裂进程中诊断的空白,将更有利于早期肝炎的诊断和治疗
三、临床解读:
谷胱甘肽和谷丙、谷草在化验单上的具体解读,谷胱甘肽的血清血浆正常值是33-73U/L,共有四种情况。
1、谷胱甘肽指标升高,谷丙和谷草指标正常,提示有肝损伤的风险,建议加强对肝脏的检测频率,有利于发现早期肝损伤。
2、谷胱与谷丙,谷草同时升高,提示进入肝损伤爆发期,建议临床治疗措施干预。
3、谷胱甘肽升高,谷丙、谷草下降,提示正在进行肝损伤修复,可以结合三者评估临床治疗情况。
4、当三者都出现下降,情况有两种极端提示:(1)是修复完成,临床好转。
(2)是重型肝炎出现严重情况,出现胆酶分离现象。
另外一种是红细胞的检测,正常值4.7-13.2U/gHb
红细胞主要针对“蚕豆病”和遗传性伯氨喹溶血病人,谷胱甘肽还原酶降低,红细胞的细胞膜容易被氧化和分解,导致溶血性贫血和溶血性黄疸。
