18 19 专题1 第2单元 第1课时 离子键
高中化学专题1第2单元第1课时离子键课件高一化学课件

12/11/2021
第二十七页,共四十八页。
栏目导航
电子式的书写
书写要点及注意事项 在元素符号周围用“·”或“×”来表示原子最外层电子的 原子 式子。例如:
12/11/2021
第二十八页,共四十八页。
栏目导航
简单 简单阳离子是由金属原子失电子形成的,原子的最外层已
阳离 无电子,故用阳离子符号表示。如:Na+、Li+、Ca2+、Al3 子 +等
活 活泼 泼金 非属 金属―化―合→MN―+―-―m―n→ee→--NMmn-+―吸达―引到―、―平排―衡斥→离子键
12/11/2021
第九页,共四十八页。
栏目导航
(2)静电作用包括静电吸引和静电排斥。静电吸引即阴、阳离子 之间的相互吸引;静电排斥即原子核与原子核、核外电子与核外电 子的排斥作用。
、氢氧根离子:
12/11/2021
第三十页,共四十八页。
栏目导航
每个离子都要单独写,而且要符合其实际相邻关系。例如,
离子
化合 CaCl2 要写成
,不能写成
物
,也不能写成
12/11/2021
第三十一页,共四十八页。
栏目导航
【典例 2】 下列有关化学用语正确的是( )
12/11/2021
第三十二页,共四十八页。
简单 不但要画出最外层电子,而且还应用方括号“[ ]”括起 阴离 来,并在右上角用“n-”标明电荷。例如,氧离子:
子
、氟离子:
12/11/2021
第二十九页,共四十八页。
栏目导航
不仅要画出各原子最外层电子,而且还应用方括号“[ ]”
括起来,并在右上角用“n-”或“n+”标明电荷。例如, 复杂
离子 铵根离子:
专题131离子键教学案-高一化学同步精品课堂必修21.doc

化学键(第1课时)一、教材分析:初中化学中介绍了离子的概念,学生知道Nf和CL由于静电作用结合成化合物NaCl,又知道了物质是由原子、分子和离子构成的,但并没有涉及离子化合物、化学键的概念,《离子键》在初中基础上对离子键和离子化合物有更深的理解。
二、教学目标(一)知识与能力1•掌握离子键的概念;2.学握离子键的形成过程和形成条件,并能熟练地用电子式表示离子化合物的形成过程。
(二)过程与方法1.通过对•离子键形成过程的教学,培养学生抽象思维和总和概括能力。
2.通过电子式的书写,培养学生的归纳比较能力;通过构型的教学,培养学生的空间想象能力。
(三)情感态度与价值观1•培养学生用对立统一规律认识问题。
2•通过对离子键形成过程的分析,培养学生怀疑、求实、创新的精神。
3.培养学生由个例到一般的研究问题的方法。
从宏观到微观,从现象到本质的认识事物的科学方法。
三、教学重难点教学重点:离子键和离子化合物的概念;用电子式表示离子化合物的形成过程。
教学难点:用电子式表示离子化合物的形成过程。
四、教学过程预习探究(学生用)1.离子键:阴阳离子Z间的静电作用。
2.成键微粒:阴离子和阳离子。
3.成键实质是静电作用(离子间的静电吸引力和电子电子之间、核与核之间的静电排斥达到平衡)。
4.形成条件:活泼金属与活泼非金属化合时,一般形成离子键。
5.存在:所有离子化合物屮都有离子键。
6.电子式用原子的最处展电子表示。
Na^ci:—•[:d:]7._____________________________________ 用电子式表示NaCl形成的过程:o互动课堂(一)情景激思(教师用)【引入】牛顿力学解释了苹果落回地面,卫星绕地球运行时因为地球引力。
宏观物质之间作用力而稳定存在。
那么在我们丰富多彩的物质世界中,构成物质的微观粒子之间是否存在作用力呢?【教师强调】本节课的课标是:理解离子键、离子化合物的概念,学会用电子式表示离子化合物的形成过程。
高中化学 专题一 第二单元 第1课时《离子键》课件(苏教版必修2)

(3)由于离子键较强,故离子化合物一般具有较大的硬度和 较高的熔点。 (4)大多数离子化合物能溶于水,在熔融状态下和水溶液中
能导电。
5.离子键与离子化合物的关系 含有离子键的化合物一定是离子化合物,而离子化合物中
却不一定只含有离子键。如:NH4NO3、Na2O2 是离子化合物,
但在 NH4NO3、Na2O2 中除了含有离子键外,还含有共价键。
4.(双选)下列电子式书写正确的是( BD)。
解析:Na2S 的电子式为
· · 子的电子式为· · 错误。 O ,C · ·
,A 错误;O 原
5.下列关于离子及离子化合物的电子式书写的说法,正确 的是( C )。
A.离子的电子式中元素符号周围都有表示 8 个电子的小
黑点
B.离子的电子式无须标明所带电荷
C.熔融状态能导电
D.可以溶于水 解析:离子键存在于离子化合物中。离子化合物与共价化 合物最主要的区别在于熔融状态能电离出阴、阳离子。共价化 合物液态(纯物质)本身不能电离,在水溶液中可能电离。
1.(2010 年广东深圳检测)某元素的原子最外层只有一个电 子,它跟卤素相结合时,可形成的化学键( C )。 A.一定是共价键 B.一定是离子键 C.可能是共价键,也可能是离子键 D.上述说法都不正确
最外层电子 ____________。如:Mg 表示为_______;F—表示为__________; ×Mg× NaCl 表示为______________。
离子键
离子化合物
1.离子键的实质
离子键的实质是一种静电作用。静电作用既包括阴、阳离 子间的静电吸引,又包括电子与电子、原子核与原子核间的静 电排斥。
三、离子化合物
1.概念 阴、阳离子 静电作用 由__________通过________形成的化合物叫做离子化合物。 2.形成条件 活泼金属 活泼非金属 _________与____________反应形成离子化合物。 3.类别
离子键 课件

1.离子键Biblioteka (1)成键粒子:阴、阳离子
静电引力
(2)离子键的实质:静电作用 静电斥力
(3)成键元素:活泼金属和活泼非金属间
NaCl的微观结构
特殊:AlCl3中不存在离子键,铵盐虽无金属元素,但铵根与酸根间 存在离子键
练习:判断下列哪些物质中含有离子键?
NaCl H2O2 NaOH CH4 Na2O NH3 HClO
用电子式表示氯化镁的形成过程:
1.下列微粒的电子式书写错误的是( C )。
A.氯原子: C····l·
··
B.氧离子:
[··
·· O··
··]2-
C.氢化钠: Na+H—
D.氧化钠:
Na+[··
·· O··
··]2-Na+
2.下列化合物的形成过程表示正确的是( D )
阴阳离子间,远了要相互想念,近 了又要相互排斥,适中就好,大抵 人与人之间的关系也是这样罢,合 适的距离产生不一样的美。
NH4Cl Na2O2 N2
属于离子化合物的是:
HCl CO2 CaCl2 H2O Ne
NaCl 、NaOH 、 Na2O NH4Cl 、 Na2O2 、 CaCl2
2.离子化合物 ——由离子键构成的化合物。
包括的物质类别主要有: 强碱、大多数盐及金属氧化物
例1. 下列说法正确的是( D )。 A . 离 子 键 就 是 使 阴 、 阳 离 子 结 合 成 化 合 物 的 静 电 引 力 还有静电斥力 B . 所 有 金 属 与 所 有 非 金 属 原 子 之 间 都 能 形 成 离 子 键AlCl3中不存在离子键 C . 离 子 化 合 物 中 一 定 含 有 金 属 元 素 铵盐是离子化合物,但不含金属元素 D.含有离子键的化合物一定是离子化合物
《离子键》ppt课件

在离子化合物中,根据库仑定律,阴、阳离
子之间的静电引力
q+q-
F = k r2
应用:判断离子键强弱
离子半径越 、小离子带电荷越 ,多离子键 就越 。强离子键越强,破坏它所需能量就越 。大
例题3、下列离子键最强的是( C )
A KCl C MgO
B CaCl2 D Na2O
3、离子键的特征 ——无方向性
2、活泼的金属元素和酸根离子(或氢氧根离子) 形成的化合物
3、铵根和酸根离子(或活泼非金属元素离子) 形成的盐。
例1、下列各数值表示有关元素的原子序数, 其所表示的各原子组中能以离子键相互结合
成稳定化合物的是( C)
A.10与12
B.8与属元素与非金属元素之间只能形成 离子键吗?非金属元素之间可形成离子键?
只要空 间条件 允许, 每个离 子将尽 可能多 的吸引 异性离 子,达 到降低 体系能 量的目 的
氯化钠晶体的结构
ClNa+
离子键特征:没有方向性和饱和性:
(1)氯化钠晶体Na+可从不同方向吸引六个Cl-; 同样,Cl-也可从不同方向吸引六个带正电荷的Na+。 (2)每个离子周围尽可能多的排列带异性电荷的离子以达到降低体系
氯 化 钠 晶 体
Na+Cl-CNl-a+NaCN+laN-+aC+l- Na+
Na+ClC- l-
NaC+ l-
Cl- NaN+a+NaCC+ll--
Na+
的
ClNa+ Cl-
Cl-
Na+
结
因构为离子的电荷分布通常被看成是球形对称
一课时离子键课件共16页
离子键
1.离子键
使带相反电荷的离子结合的__________。
带相反电荷 静电作用
的离子
2.离子化合物
相互作用
由 _________________ 主 要 通 过 __________
形成的化合物。
看书第二页下午5时22分
长阳民族高中
离子键的拓展
(1)离子化合物(强碱、大多数盐、活泼金属与 活泼非金属的化合物等)中一定存在离子键。 (2)含有阴、阳离子的化合物一定是离子化合 物,阳离子对周围的阴离子都有静电作用。 (3)完全由非金属元素组成的化合物也可能含 有离子键,如NH4Cl等铵盐。 (4) 金属与非金属的化合物不一定属于离子化 合物,比如AlCl3。 (5)离子化合物可以通过单质化合、离子沉淀、 化合物化合等途径得到。
电子式的书写
简单阳离子的电子式与离子符号相同
简单阴离子的电子式需要注明最外层电子, 并给方括号,再标明所带电荷数目符号。
离子化合物的电子式书写时,如果有相同的
离子,不可以合并,要分别书写,排布匀
⊕⊕
⊕⊕
称。例如MgBr2的电子式为
[ ⊕⊕Br⊕⊕]-Mg2+[ ] ⊕⊕Br⊕⊕ -
⊕⊕
⊕⊕
不能写作 。 ⊕⊕
⊕⊕
O ⊕ ⊕
⊕⊕ 2
⊕⊕
2
[Mg2+]
[
] O ⊕ ⊕ 2-
⊕⊕
⊕⊕
长阳民族高中
小试牛刀5
用电子式表示下列离子化合物
的形成过程。
MgO
⊕Mg⊕ +
⊕⊕
⊕O ⊕
⊕⊕
Na2S
⊕⊕
Na⊕+ ⊕S ⊕+ Na⊕ ⊕⊕
离子键PPT精品课件_1

(1)含义:指全面内战爆发后,中共领导国统区人
民掀起的反对国民党独裁、内战、卖国政策的人民民
主运动。它是针对解放区军民反对国民党军事进攻的
栏
战线而言的,称为“第二条战线”。
目 链
接
(2)特点:这次运动主要发生在1946年冬到1947
年5月,各阶层人士广泛参加,斗争形式以合法斗争为
主,并有武装起义的方式。在运动中逐步形成了人民
属原子N 电子
Nn-
离子键 化 合 物
子 式 表 示
例 Cl Mg Cl
Cl Mg2 Cl
第七单元 无产阶级和人民群众争取民主的斗 争
第4课 抗战胜利后的人民民主运动
栏 目 链 接
A.主要内容:坚决避免内__战________,建设独立、
自由和富强的新中国;国民党迅速结束“训政宪”政,实
施“________”;召开政治协商会议;保证人民享有民
行。(影响较大的有““一_二__·_一__”__血__案______”、“下关惨 案”、“________”)。 李闻血案
(2)概况:
(2)表现:1948年初,沈_钧__儒_____、章伯钧等人在 香港中改国组民__主__同__盟__________,并宣布与南京反动独裁 政府彻底决裂。
4.推翻国民党的反动统治,建立新中国。
温馨提示:中共争取民主斗争胜利的原因在于
它代表中国人民和整个中华民族的根本利益,制定 栏
了正确的路线、方针、政策。同时说明中国走社会
目 链
接
主义道路是近代中国历史发展的必然结果,是中国
人民的必然选择。
④民主党派、中间人士异常活跃,积极参加各 项政治活动,并提出独立的主张。
(2)原因。
2018新步步高学案导学苏教版化学必修二导学案:专题1 微观结构与物质的多样 第二单元 第1课时离子键导

一、离子键及离子化合物1.离子键的形成过程(以NaCl为例)Na原子和Cl原子最外层电子数分别为1和7,均不稳定。
即它们通过得失电子后达到8电子稳定结构,分别形成Na+和Cl-,两种带相反电荷的离子通过静电作用结合在一起,形成新物质NaCl。
2.离子键(1)离子键的概念是带相反电荷离子之间的相互作用。
构成离子键的粒子是阳离子和阴离子。
(2)离子键的实质是静电作用。
这种静电作用不只是静电引力,而是指阴、阳离子之间的静电引力与电子之间、原子核之间斥力处于平衡时的总效应。
(3)成键条件(4)成键微粒:阴、阳离子。
(5)离子键成键的原因是原子间相互得失电子达到稳定结构;体系的总能量降低。
3.离子化合物(1)离子化合物的概念是由离子键构成的化合物。
(2)请举例说明常见的离子化合物的类型:活泼金属氧化物(如Na2O、MgO等);绝大多数盐(如NaCl、K2SO4、CaCO3等);强碱[如NaOH、Ba(OH)2等]。
离子键的三个“一定”和两个“不一定”(1)三个“一定”①离子化合物中一定含有离子键;②含有离子键的物质一定是离子化合物;③离子化合物中一定含有阴离子和阳离子。
(2)两个“不一定”①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等;②含有金属元素的化合物不一定是离子化合物,如AlCl3。
1.下列说法正确的是()A.离子键就是使阴、阳离子结合成化合物的静电引力B.所有金属与所有非金属原子之间都能形成离子键C.在化合物CaCl2中,两个氯离子之间也存在离子键D.含有离子键的化合物一定是离子化合物2.下列哪一组元素的原子间反应容易形成离子键()元素 a b c d e f gM层电子数 1 2 3 4 5 6 7A.a和c B.a和f C.d和g D.c和g二、用电子式表示离子化合物1.由于在化学反应中,一般是原子的最外层电子发生变化,为了方便,我们在元素符号周围用“·”(小黑点)或“×”(叉号)表示原子或离子的最外层电子的式子叫做电子式。
离子键课件

A、
B、
C、
D、
微粒
间的 化学键→ 离子键 →离子化合物
作用 力
?
? 电子式
(2)
成键元素
成键微粒
成键本质
活泼金属元素( ⅠA、ⅡA ) 阴、阳离子 活泼非金属元素( ⅥA、ⅦA)
阴、阳离子 间静电作用
活动: 1、举出一些可能含有离子键的物质 2、从物质分类讨论:哪些类别的物质含有离子键?
结论:
大多数 盐:
含
离
强碱:
离
子
活泼金属氧化物:
子
化
…
键
合
物
练习与活动 1、判断下列哪些物质是离子化合物 ACEGHI
第二单元 微粒之间的相互作用力
第一课时
一、化学键
a Cl-
b Na+
cd
左图中a与b、 a与c、 a与d 之间作用力是否属于化学键?
化学键定义:物质中直接相邻的原子或离子之间存在 强烈的相互作用。
活动:
请用原子(或离子)结构示意图表示NaCl中化学键的 形成的过程。
1、离子键 (1)定义:使阴、阳离子结合的强烈的相互作用
(5)酸、碱、盐的。
√
(3)电子式
定义:用“·或×”将最外层电子表示在元素符号 周围的式子。
写出下列物质的电子式(竞写活动)
第三周 期原子
简单阴阳离子
简单离子化合物
Mg2+ Al3+ S2-
MgS NaF 挑战: MgCl2 Na2O
练习 下列电子式书写正确的是( A )
A.MgCl2 B. HCl
C. NH4Cl
D.NH3·H2O E.MgO
F.CO2
离子键优秀课件1

第三节
(一)离子键的形成过程
活泼金属 ne-
活泼非金属
失电子 阳离子 被氧化
得电子 被还原
阴离子
化学键
静电作用 离子化合物
(离子键)
(二)离子键:使阴、阳离子结合成化合物的静电作用。
离子键
(1)定义:使阴阳离子结合成化合物的静电作用
(2)成键原因: 电子得失 (3)成键微粒: 阴、阳离子 (4)成键实质: 静电作用(静电吸引和静电排斥)
Na+ [ :O····:]2- Na+ A2B型
MgO
MgCl2
NaBr
K2O
(6)用电子式表示离子化合物的形成过程
NaCl: Na Cl
Na Cl
K2S: K
S
K
MgBr2:
Br Mg Br
2-
K SK Br Mg2 Br
1、下列各式用电子式表示的化合物的形成过程,正确的B是( )
D、
2、用电子式表示氧化钠、氟化钙的形成过程。
(5)成键过程: 阴阳离子接近到某一定距离时,吸引 和排斥达到平衡,就形成了离子键
(6)成键元素:活泼的金属元素(ⅠA、ⅡA)与活泼 的非金属元素(ⅥA、ⅦA)
活泼的金属元素和活泼的非金属元素:
ⅠA ⅡA 1H
ⅢA ⅣA ⅤA ⅥA ⅦA 0 He
2 Li Be 3 Na Mg
B C N O F Ne Al Si P S Cl Ar
Na2O2等 注意:AlCl3、BeCl2不是离子化合物。
思考: 如何形象地表示离子化合物的形成?
电子式
(1)定义:在元素符号周围用“ · ”或“×”来表示
原子最外层电子的式子
(2)原子的电子式
离子键ppt课件
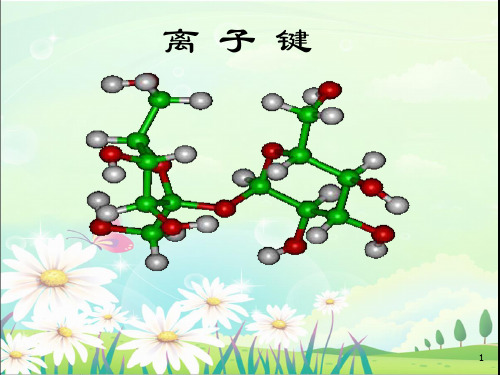
活泼金 失去 阳离子
离用
属原子M 电子 Mm+
静电作用 子
电
化子
活泼非金 得到 阴离子 属原子N 电子 Nn-
离子键 合 物
式 表 示
例 Cl Mg Cl
Cl Mg2 Cl
18
随堂检测
1.下列电子式有误的是 ( )
A.氯原子 • ‥C‥l∶ ‥
C.溴离子 [∶Br∶]‥
B.硫离子∶‥‥S∶ D.钙离子Ca2+
13
判断下列微粒电子式的正误,并从错误中归纳 总结出书写原子和阴阳离子的要点。
:O:
[:Na:]+
[:S:]-2
: :: ::
书写要点:
1.金属阳离子的电子式就是其离子符号; 2.非金属阴离子电子式要做到“二标”即 标“[ ]”和“电荷数”。
14
d:离子化合物的电子式:
AB型
NaCl
A2B型
Na2S ‥ Na+[∶‥S∶]2-Na+
概念要点: 成键本质 —— 得失电子 成键微粒 —— 阴阳离子 键的实质 —— 静电作用
9
2. 离子键的形成条件:
活泼金属元素(ⅠA, ⅡA) 活泼非金属元素(ⅤⅠA, ⅤⅡA)
10
3.过渡并设问引出电子式: 如何形象地表示原子的最外层电子? 电子式:用“·”或“×”表示原子最外层电子 的式子。
C 离子化合物的电子式: AB型、A2B型、AB2型
d 用电子式表示离子化合物的形成过程
21
C F Mg D H Cl
F
[ Mg 2 F ]2
H [ Cl ]
20
板书设计
化学键:相邻的原子之间强烈的
相互作用,叫做化学键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
微粒之间的相互作用力第二单元1 离子键课时第1.2.学习目标:了解离子键的概念和成因及离子化合物知道化学键的概念。
()3.()难点重点能用电子式表示简单的离子化合物。
的概念。
[ ·]知自探主习预新一、化学键1.概念:物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。
2 :离子键和共价键是两种常见的化学键。
.类型二、离子键与离子化合物1(NaCl) 为例离子键的形成以.(1) 图示(2) 分析2 离子化合物.由阴、阳离子通过静电作用形成的化合物叫做离子化合物。
3 离子键.(1) 离子键的定义使带相反电荷的阴、阳离子结合的相互作用,称为离子键。
(2) 成键微粒:阴、阳离子。
三、电子式1.概念:由于在化学反应中,一般是原子的最外层电子发生变化,为了方·()()表示原子或离子的最外便,我们在元素符号周围用“或“×””叉号小黑点层电子的式子叫做电子式。
2 电子式的书写.Na·(1)H·。
、氮原子原子的电子式:氢原子、钠原子、氯原子(2)简单阳离子的电子式:简单阳离子是原子失去最外层电子后形成的,其2++NaMg等。
电子式就是其阳离子符号,如、页1 第(3)。
简单阴离子的电子式:氯离子、氧离子(4)。
、硫化钾离子化合物的电子式:氧化钙][基础自测1() 正确的打“√”,错误的打“×”判断正误.(1)() 活泼金属与活泼非金属化合时易形成离子键。
(2)()离子化合物中一定含有金属元素。
(3)() 由金属元素与非金属元素形成的化合物一定是离子化合物。
(1)(2)(3) ××【答案】√2() .下列叙述中正确的是A .化学键只存在于分子之间B .化学键只存在于离子之间C .形成化学键的微粒可以是原子也可以是离子D .化学键是相邻的分子之间强烈的相互作用[C 化学键是物质中直接相邻的原子或离子之间的强烈的相互作用。
在把握概念时注意:①相邻,因为若不相邻,其作用力必然很弱;②原子或离子是成键] 微粒;③强烈的相互作用区别于弱的相互作用。
3().下列电子式书写正确的是[AABC B中,两个氟离子中,氧原子的电子式不用中括号,正确。
错。
CD中,钾离子不应合并写,正确的电子式为,错。
] 。
不用加中括号,正确的电子式为[ ·]难攻究合作重探离子键、离子化合物的辨析][背景材料观察下面漫画,思考有关问题。
][思考交流(1)观察漫画,分析哪些元素之间易形成离子键?【提示】活泼的非金属元素容易活泼金属元素容易失去电子形成阳离子,页 2 第A(HⅠ不含族得电子形成阴离子,阴阳离子之间形成离子键。
即元素周期表中)AAA ⅦⅥⅡ族元素之间易形成离子键。
、族元素和元素族、(2)金属元素都能形成离子化合物吗?非金属元素一定不能形成离子化合物吗?【提示】离子化合物通常由活泼的金属与活泼的非金属形成,但氯化铝就不是离子化合物而是共价化合物;非金属元素之间也可以形成离子化合物,如氯化铵、硝酸铵等铵盐就是由非金属元素形成的离子化合物。
(3) 离子键与离子化合物的关系是怎样的?【提示】离子化合物中一定含有离子键,含有离子键的化合物一定是离子化合物。
1 .离子键(1)特点:形成离子键的微粒发生了电子得失,使双方带有电荷。
即得电子的微粒带负电荷称为阴离子;失电子的微粒带正电荷称为阳离子。
(2)形成过程:当阴、阳离子相互靠近到一定距离时,正负电荷的静电吸引力与原子核及核外电子之间的排斥力达到平衡,形成稳定的离子键。
(3)(AA)ⅡⅠ原子与易族元素如形成条件:易失去电子的活泼金属元素族、(AA)ⅦⅥ原子之间,容易形成离子键,族、得电子的活泼非金属元素族元素如NaClKOMgClCaS 等都是靠离子键结合的。
如、、、222 离子化合物.(1)①活泼的金属元素与活泼的非金属元素形成的化合常见的离子化合物:NaFCaCl 等;物,如、2NaCOMgSO ②等;、活泼的金属元素与酸根形成的盐类化合物,如432NaOHBa(OH) ③等;、活泼的金属元素与氢氧根形成的碱,如2页 3 第()NHHCONHNO 等。
铵盐、④铵根与酸根形成的盐类化合物,如3443(2)离子键与离子化合物的关系:含有离子键的化合物一定是离子化合物,NHNONaO是离子化合物,但而离子化合物中却不一定只含有离子键。
如、2342NHNONaO 中除了含有离子键外,还含有共价键。
在、2342电子式的书写] [背景材料][思考交流(1)怎样正确书写离子的电子式?【提示】对阴离子还要加要正确地标出离子的电荷。
书写离子的电子式,][”“,以表示原子得来的电子全归己有而不是共用。
像钠离子、镁离子一个故其电子式就是普通的离子符等这样的简单阳离子,由于其价电子已全部失去,][][”““”,号,自然也就不再加但是写复杂的阳离子的电子式时,要加了。
如(2)NaOCaCl 吗?的电子式能写成观察电子式,思考222CaCl。
【提示】的电子式应写成不能。
2电子式的书写及注意事项书写要点及注意事项·““×””在元素符号周围用来表示原子最外层电子的式或原子子。
例如:简单简单阳离子是由金属原子失电子形成的,原子的最外层已无电阳离32CaLiNaAl等。
、、子,故用阳离子符号表示。
如:、++++子页 4 第子。
][”括起不仅要画出各原子最外层电子,而且还应用方括号“nn-+”标明电荷。
例如,铵根离子:”或“来,并在右上角用“复杂离子。
、氢氧根离子:CaCl例如,每个离子都要单独写,而且要符合其实际相邻关系。
2离子,也不要写成,不能写成化合物。
能写成] [ ·基当双堂达固标1离子键的形成题组) 1(.以下叙述中错误的是13572019】【导学号:ANaCl后,其结构的稳定性增强.钠原子和氯原子作用生成B还存在电子与电子、在氯化钠中,除氯离子和钠离子的静电吸引作用外,.原子核与原子核之间的排斥作用C.任何离子键在形成的过程中必定有电子的得与失D.金属钠与氯气反应生成氯化钠时,放出大量的热,体系能量降低OH[Na C 结合有些离子键的形成过程中不一定发生电子的得失,如与-+]NaOH。
成) MgNaOCl(2、、.、四种元素两两之间只以离子键结合的化合物有13572019】【导学号:4C 3B 2A 5D种.种.种.种.页 5 第MgClNaClMgO[NaO C,共、两两之间只以离子键结合的化合物有、、22]4种。
2 离子化合物题组3().下列叙述中不正确的是A .活泼金属元素与活泼非金属元素化合时,能形成离子键B .阴、阳离子通过静电引力所形成的化学键叫做离子键C .离子所带电荷的符号和数目与原子成键时得失电子有关D .阴、阳离子间通过离子键形成的化合物一定是离子化合物[B活泼金属元素容易失去电子形成阳离子,活泼非金属元素容易得电子形A选项正确;静电作用包括成阴离子,阴、阳离子间通过静电作用形成离子键,B选项错误;原子形成离子键时,失电子带正电荷,得电静电引力和静电斥力,C选项正确;由离子键形成子带负电荷,且离子所带电荷数与得失电子数一致,D]选项正确。
的化合物一定是离子化合物,4 () .下列有关离子键和离子化合物的说法中正确的是13572021 】【导学号:A .凡含离子键的化合物,一定含金属元素BMgCl 中,两个氯离子之间也存在离子键.在化合物2C .离子化合物一定能导电D119的元素能够形成离子化合物,该化合物中存在离子.原子序数为与键[ANHClB D 中,离子键中,如晶体中含有离子键,但不含金属元素。
4C中,离子化合必须是阴、阳离子间的相互作用,两个氯离子间不存在离子键。
D中,原子序只有在熔融状态或溶于水才能导电。
物处于晶体状态时不能导电,F] 119Na、属于活泼金属与活泼非金属元素,的元素是可形成离子键。
,数为与离子键及其化合物易错分析页 6 第(1)形成离子键的阴、阳离子之间不仅存在静电引力,还存在静电斥力。
(2)由金属元素和非金属元素形成的化合物不一定含有离子键或是离子化合AlClBeCl等含有共价键,是共价化合物。
物。
如、32)((3)如可能含有离子键只由非金属元素组成的化合物不一定是共价化合物,NHNOHNH中含有离子键,属于离子化合物。
、344OH(4)H+由阳离子和阴离子结合生成的化合物不一定是离子化合物,如-+===CHCOOHHCHCOO===HO等,反应产物均是共价化合物。
;+-+3233 电子式的书写题组5() .下列关于电子式的说法不正确的是A .每种元素的原子都可以写出电子式B .简单阳离子的电子式与它的离子符号相同C .阴离子的电子式要加方括号表示D .电子式就是核外电子排布的式子[·D”“×”“来表示原子的最外层电电子式是指在元素符号的周围用或ABCD 错、正确,、子,以简明的表示原子、离子的最外层电子排布的式子,]误。
6 .写出下列物质的电子式:13572019 】【导学号:(1)F________S________ 。
,2-+________O(2)K ________。
,(3)KCl________NaS________CaCl________ 。
,,22【答案】离子化合物电子式书写的注意事项(1)离子化合物的构成微粒是阴、阳离子,这是判断离子化合物电子式的第MgO肯定错误。
的电子式写成一步,如把页 7 第21-+B(2)A型,应写合离中化合物相同的子不能并,如为子离2成不能写或,21页 8 第-+AB 型应写为。
;同理2。
