2021-2022年高中化学 专题2 第1单元 第1课时 化学反应速率的表示方法限时训练 苏教版选修
高中化学 专题2 化学反应与能量转化 第一单元 化学反应速率与反应限度 2.1.1 化学反应的速率导

专题2 化学反应与能量转化 第一单元 第1课时 化学反应的速率[知识梳理]例:某温度下,在一固定容积的容器中进行如下反应:H 2(g)+I 2(g) ⇌2HI(g),下列情况一定能说明反应已达到限度的是 A .压强不再随时间而改变时 B .气体的总质量不再改变时 C .混合气体中各组成成分的含量不再改变时D .单位时间内每消耗1 mol I 2,同时有2 mol HI 生成时 [课时训练]一、选择题(每空4分,共36分)1.下列有关反应速率的叙述中,不正确的是( ) A .反应速率用于衡量化学反应进行的快慢 B .反应物的性质是决定反应速率快慢的主要因素 C .在不同温度时,鲜牛奶变酸的速率:28 ℃时>5 ℃时D .相同体积、不同浓度的盐酸分别与大小、形状都相同的铁片反应的速率:1 mol·L-1时<0.1 mol·L -1时2.在某一化学反应A +3B===2C +D 中,反应物A 的浓度在20 s 内由1.0 mol/L 变成化学反应速率意义:衡量 物理量 表示方法:v= 【单位: 】 简单计算:同一化学反应中各物质的 等于各物质的化学计量数之比,也等于各物质的变化浓度之比影响因素 内因: 外因 浓度: 可以加快反应速率, 可以加快反应速率 温度:升高温度,可以 ; 降低温度,可以催化剂:使用 可以加快化学反应速率 其他因素:0.2 mol/L,则在这20 s内用C表示的平均反应速率为( )A.0.01 mol/(L·s)B.0.8 mol/(L·s)C.0.04 mol/(L·s)D.0.08 mol/(L·s)3.对于反应A2+3B2===2C来说,以下化学反应速率的表示中,反应速率最快的是( ) A.v(B2)=0.8 mol/(L·s) B.v(A2)=0.4 mol/(L·s)C.v(C)=0.6 mol/(L·s) D.v(B2)=4.2 mol/(L·s)4.用一定量的SO2和O2在容积固定的2 L密闭容器内发生反应:2SO2+O2=2SO3,如果v(SO2)=0.05 mol/(L·min),则2 min后SO3的物质的量为( )A.0.1 mol/L B.0.2 mol/LC.0.1 mol D.0.2 mol5.在C(s)+CO2(g)===2CO(g)的反应中,现采取下列措施:①缩小体积,增大压强②增加碳的量③通入CO2④恒容下充入N2⑤恒压下充入N2能够使反应速率增大的措施是( )A.①④B.②③⑤C.①③D.①②④6.下列措施能减慢化学反应速率的是( )A.用Zn和2 mol·L-1 H2SO4反应制取H2时,向溶液中滴加少量CuSO4溶液B.日常生活中,将食物贮藏在冰箱中C.用过氧化氢溶液制氧气时添加少量二氧化锰粉末D.用相同质量的锌粉替代锌粒与同浓度、同体积的盐酸反应制氢气7.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )A.NaHSO4(固体) B.Na2SO4溶液C.CuSO4(固体) D.NaCl(固体)8.为了说明影响化学反应进行快慢的因素,甲、乙、丙、丁四位同学分别设计了如下A~D四个实验,你认为结论不正确的是( )A.大小相同、形状相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大B.在相同条件下,等质量的大理石块和大理石粉与相同浓度的盐酸反应时,大理石粉反应快C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解D.两支试管中分别加入相同质量的氯酸钾,向其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同9.一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。
新教材高中化学第2章第1节第1课时化学反应速率课件新人教版选择性必修1ppt

A.v(A)=0.3 mol·L-1·min-1 B.v(B)=0.6 mol·L-1·min-1 C.v(C)=0.5 mol·L-1·min-1 D.v(A)=0.01 mol·L-1·s-1
()
错解:A、B
错因分析:部分同学看到选项中反应速率的数值最大,从而错选 B; 没有注意到选项中反应速率的单位的不同,从而错选 A。
起始/mol:6
5
0
0
转化/mol:3
1
2
2
平衡/mol:3
4
2
2
α(B)=51×100%=20%,B 正确;平衡时,c(A)=34mLol=0.75 mol/L,
1 mol
C 错误;v(B)=ΔcΔtB=
4L 5s
=0.05
mol/(L·s),D 错误。
任务二 比较化学反应速率大小的方法
核心素养
2.化学反应速率与化学计量数之间的关系
对一个化学反应:mA+nB===pY+qZ,用不同物质表示的反应速 率其关系是 v(A)∶v(B)∶v(Y)∶v(Z)=_m_∶__n_∶__p_∶__q__,或vmA=___v_n_B___ =vpY=___v_qZ____。
3.化学反应速率的测定 (1)测定原理。 任何一种与物质浓度有关的可观测量都可以加以利用。 (2)可测定的具体物理量。 气体体积、__体__系__压__强___、__颜___色__深__浅__、光的吸收、__导__电__能__力___ 等。
化学反应速率的比较
[深化理解]
对于同一化学反应速率用不同物质表示的数值可能不同,但比较反
应速率的大小不能只看数值的大小,而要进行一定的转化,具体比较方
法如下:
(1)归一法:将不同物质的化学反应速率转化成同一物质的化学反应 速率。
化学反应速率 高中化学课件 高考化学课件

6、注意
(1)化学反应速率是用来衡量化学反应的快慢的尺度,它 与时间和浓度变化有关.
(2)在同一反应中用不同物质来表示时,其数值可以不同, 但都表示同一个反应的速率.因此,表示化学反应的速率 时,必须说明反应物中哪种物质做标准.不同物质的速率 的比值一定等于化学方程式中相应的化学计量数之比.
一、化学反应速率
4、请区别: ⑴物质的量 ⑵物质的量浓度 ⑶物质的量浓度变化 ⑷物质的量浓度变化的快慢
一、化学反应Biblioteka 率5、练习:(讨论)在体积为2L的密闭容器中充入2mol的氮气与 8mol氢气,一定条件下发生反应。5min后,测得容 器内生成的氨气的浓度为1mol/L,求:
①、分别用H2 N2 NH3的浓度变化表示的反应速率 ②、以上三者数值是否相等?是否矛盾?数值大小 有何关系?有何规律?
第一节:化学反应速率
第一课时
一、化学反应速率
1、概念:
化学反应速率是用表示化学反应快慢的物理量。通常用 单位时间内反应物浓度的减小或生成物浓度的增加来表示。
2、数学表达式:
化学反应速率=反应物(或生成物)浓度的变化/反应时间
3、各物理量的单位:
化学反应速率 mol/L﹒S,mol/L ﹒ min 等 反应物(或生成物)浓度mol/L 反应时间 S,min,h 等
(2)实验室利用氯酸钾制氧气。某学生测得生成氧气 的平均速率为0.01mol/L·min,氧气的密度z约为 1.28g/L,欲制取500mL的氧气,需要时间为:
A、2min B、4min C、6min D、8min
(3)向2L的密闭容器(内有催化剂)充入2mol的SO2和 1molO2,经2S,测得容器内有1mol的SO3,则该反应 的速率可怎样表示。
高中化学必修二专题2《化学反应与能量变化》知识点复习及练习(有答案)非常详细

必修二 专题2《化学反应与能量变更》复习一、化学反应的速度和限度 1. 化学反应速率(v )⑴ 定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变更 ⑵ 表示方法:单位时间内反应浓度的削减或生成物浓度的增加来表示⑶ 计算公式:v=Δc/Δt (υ:平均速率,Δc :浓度变更,Δt :时间)单位:mol/(L •s )应速率不变。
(2)、惰性气体对于速率的影响:①恒温恒容时:充入惰性气体→总压增大,但是各分化学反应速率 意义:衡量化学反应快慢物理量 表达式:v = △c/△t 【单位:mol/(L ·min)或mol/(L ·s) 】 简洁计算:同一化学反应中各物质的反应速率之比等于各物质的化学计量数之比,也等于各物质的浓度变更量之比 影响因素 内因:反应物的结构的性质 外因 浓度:增大反应物的浓度可以增大加快反应速率;反之减小速率 温度:上升温度,可以增大化学反应速率;反之减小速率 催化剂:运用催化剂可以改变更学反应速率 其他因素:固体的表面积、光、超声波、溶剂压强(气体): 增大压强可以增大化学反应速率;反之减小速率压不变,各物质浓度不变→反应速率不变②恒温恒体时:充入惰性气体→体积增大→各反应物浓度减小→反应速率减慢2.化学反应限度:大多数化学反应都具有可逆性,故化学反应都有肯定的限度;可逆反应的限度以到达化学平衡状态为止。
在肯定条件下的可逆反应,当正反应速率等于逆反应速率、各组分浓度不再变更时,反应到达化学平衡状态。
(1)化学平衡定义:化学平衡状态:肯定条件下,当一个可逆反应进行到正逆反应速率相等时,更组成成分浓度不再变更,达到表面上静止的一种“平衡”,这就是这个反应所能达到的限度即化学平衡状态。
(2)化学平衡的特征:动:动态平衡等:υ(正)=υ(逆)≠0定:各组分的浓度不再发生变更变:假如外界条件的变更,原有的化学平衡状态将被破坏(3)化学平衡必需是可逆反应在肯定条件下建立的,不同的条件将建立不同的化学平衡状态;通过反应条件的限制,可以变更或稳定反应速率,可以使可逆反应朝着有利于人们须要的方向进行,这对于化学反应的利用和限制具有重要意义。
高中化学-化学反应速率的表示方法

对点练习
1、在反应:2A(g)+3B(g)
2C(g)中,开始时,
A的浓度为2 mol·L-1,B的浓度为4 mol·L-1,2 min后,
A的浓度减少了0.8 mol·L-1.
则v(B)=________,v(C)=________,在2 min末,C
的浓度是________,B的浓度是________。
求这段时间v(N2)、v(NH3)和v(H2)。
答案 V(N2)=0.4mol/(L·min) V(H2)=1.2mol/(L·min) V(NH3)=0.8mol/(L·min) 解析
方法1.
开始
N2 + 3H2
8 mol/L 20 mol/L
2NH3
0
变化
2 mol/L 6 mol/L 4 mol/L
反应在不同条件下反应的快慢时,应选择同一物质 来表示(单位统一),才能用数字的大小来比较快慢 (6)化学反应速率是通过实验测定的。
练习
1、已知:反应 A + 3B = 2C + 2D
在四种不同条件下的反应速率为:
(1)v(A)=0.3 mol/L·s (2)v(B)=0.6 mol/L·s (3)v(C)=0.4 mol/L·s (4)v(D)=0.45 mol/L·s
则该反应速率的快慢顺序为 (1)>(4)>(2)=(3) 。
2、反应A(g) + 3B(g)=2C(g)在2L密闭容器中反 应,0.5min内C的物质的量增加了0.6mol,有
关反应速率正确的是( A )
A、V(A)=0.005mol/(L·s)
B、V(C)=0.002mol/(L·s)
C、V(B)=V(A)/3
NO2 C(NO2)/ mol/L
化学中的化学反应速率(化学知识点)

化学中的化学反应速率(化学知识点)化学反应速率是指单位时间内反应物消失或产物生成的速率。
反应速率的快慢对于化学反应的研究和应用具有重要的意义。
本文将介绍化学反应速率的定义、影响因素以及如何测定反应速率。
一、化学反应速率的定义化学反应速率是指在一定条件下,反应物消失或产物生成的速率。
一般情况下,反应速率可以通过反应物消失的速率来描述,以此来衡量反应进行的快慢。
化学反应速率可以用如下公式来表示:速率= ΔC/Δt其中,ΔC表示反应物浓度的变化量,Δt表示时间的变化量。
速率的单位可以是摩尔/升·秒(mol/L·s)、分子/升·秒(molecules/L·s)等。
二、影响化学反应速率的因素化学反应速率受到多种因素的影响,主要包括以下几个方面。
1.反应物浓度:当反应物浓度增加时,反应物之间的碰撞频率增加,从而增加了反应的可能性,使得反应速率加快。
2.温度:提高温度会增加反应物的动能,使反应物之间的碰撞更加频繁且具有更高的能量。
因此,温度升高会加快反应速率。
3.催化剂:催化剂可以降低反应的活化能,使反应物更容易发生反应。
催化剂的存在可以提高反应速率,而不参与反应本身。
4.表面积:反应物的表面积越大,反应物颗粒之间的碰撞频率就越高,反应速率也会增加。
5.反应物的物理状态:气相反应相较于固相反应和液相反应具有更高的反应速率,因为气态分子之间的自由运动能带来更频繁的碰撞。
三、测定反应速率的方法测定反应速率是研究反应动力学的重要手段,常用的方法有以下几种。
1.逐点法:在反应过程中,定时取样,通过测定不同时间点上反应物消失或产物生成的量来计算反应速率。
2.连续监测法:利用分光光度计、电导计等仪器对反应过程进行实时监测,获得反应物浓度的变化曲线,从而计算反应速率。
3.消失溶液平行测定法:将相同溶液分装到多个容器中,分别对不同容器中的反应液进行逐点法测定并计算平均速率,以提高测定结果的准确性。
高二化学化学反应速率的表示方法PPT教学课件 (2)

化
学 反 应 速 率 与 化
化 学 反 应 速 率
学
平
衡
第一 课时
化学 反应 速率 的表 示方 法
课前预习 ·巧设计
名师课堂 ·一点通
创新演练 ·大冲关
设计1 设计2 设计3 考点一
考点二
课堂10分钟练 习
课堂5分钟归纳 课下30分钟演
练
(1)各种化学反应进行的快慢不同。有的进行的很快, 如炸药的爆炸反应、酸碱中和反应;有的进行的很慢,如 溶洞的形成,不使用催化剂时的合成氨反应,这是由 反应物本身的性质 决定的。
比色电 不同,因此可以通过吸光度来测定反
基本 物理
应物的浓度,从而计算反应速率。
方法 方法
根据离子导电能力的差异,通过电导
导法法 率的变化来测定反应物中离子浓度的
变化,从而计算化学反应速率。
1.能否用固体或纯液体的浓度变化来表示化学反应速率? 分析:对于有固体或纯液体参与的反应,由于在一定条 件下,固体或纯液体的浓度可视为常数,所以固体或纯 液体在化学反应中浓度不改变,因此在表示化学反应速 率时,不能用固体或纯液体的浓度来表示。
(5)一个确定的化学反应涉及反应物、生成物多种物 质,因而定量表示一个化学反应的反应速率时,必须指 明是用哪一个反应物或生成物来表示。
[例1] 下列关于化学反应速率的说法中,正确的是 ()
A.化学反应速率是指一定时间内任何一种反应物 浓度的减少或任何一种生成物浓度的增加
B.化学反应速率为0.8 mol·L-1·s-1是指反应1 s时 某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以推知化学反应进行 得快慢
D.对于一个化学反应来说,其反应速率越大,反 应现象就越明显
苏教版高二化学选修四专题2第一单元2.1.1化学反应速率的表示方法

苏教版高二化学选修四专题2 第一单元2.1.1化学反应速率的表示方法1.化学反应速率的意义?怎样表示化学反应速率?提示:用化学反应速率衡量化学反应进行的快慢。
化学反应速率可用单位时间内反应物的浓度减少或生成物浓度的增加表示。
2.为什么不能用固体或纯液体表示化学反应速率?提示:化学反应速率通常用反应物浓度的减少或生成物浓度的增加来表示,而固体或纯液体的浓度为常数,其浓度不发生变化,所以不用固体或纯液体表示反应速率。
3.对于某一化学反应用不同物质表示反应速率,数值不同,意义如何? 提示:数值不同,但意义相同。
[新知探究]探究1 化学反应速率的概念和表示方法探究2 正确理解化学反应速率 据表达式v (A)=ΔcΔt 中三个物理量:(1)v (A)——A 物质的反应速率:使用v 时必指明具体的物质。
原因:对于同一化学反应,用不同的物质表示,其数值可能不同,但意义相同。
(2)Δc ——反应物或生成物的浓度变化量:Δc 只取正值,因为固体或纯液体的浓度固定不变,视为常数,则Δc 无意义,因此不能用固体或纯液体表示反应速率。
(3)Δt ——一定的时间间隔: 化学反应速率为平均值而非瞬时值。
探究3 对于同一个化学反应,用不同物质表示的化学反应速率,其数值有何关系? a A(g) + b B(g) === c C(g) + d D(g) 化学计量数比: a ∶ b ∶ c ∶ d 物质的量变化量比: Δn (A) ∶ Δn (B) ∶ Δn (C) ∶ Δn (D) 物质的量浓度变化量比: Δc (A) ∶ Δc (B) ∶ Δc (C) ∶ Δc (D) 化学反应速率之比: v (A) ∶ v (B) ∶ v (C) ∶ v (D) 在同一时间段、同一容器中的同一个反应,上述四个比例关系式相等。
[成功体验]1.判断正误(正确的打;错误的打)。
(1)化学反应速率通常用单位时间内反应物或生成物的质量变化来表示。
( ) (2)化学反应速率可取正值,也可取负值。
高一化学化学反应速率2(PPT)5-2
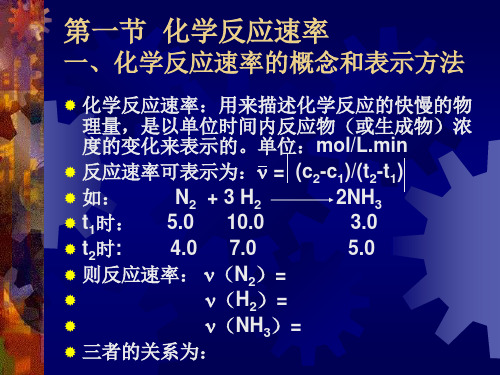
一、化学反应速率的概念和表示方法
化学反应速率:用来描述化学反应的快慢的物
理量,是以单位时间内反应物(或生成物)浓 度的变化来表示的。单位:mol/L.min
反应速率可表示为: = (c2-c1)/(t2-t1)
如:
N2 + 3 H2
2NH3
t1时: 5.0 10.0
3.0
t2时:
4.0 7.0
5.0
则反应速率: (N2)=
(H2)=ቤተ መጻሕፍቲ ባይዱ
(NH3)=
三者的关系为:
护林~住风沙。②名起遮蔽或阻挡作用的东西:越过~|清除~。 【馝】[馝馞]()〈书〉形形容香气很浓。 【箅】[箅子](?)名有空隙而能起间隔 作用的器具,如蒸食物用的竹箅子,下水道口上挡住垃圾的铁箅子等。 【弊】①欺诈蒙骗、图占便宜的行为:作~|营私舞~。②害处;毛病(跟“利”相 对):兴利除~|切中时~。 【弊病】名①弊端:管理;广东海绵厂 广州海绵厂 广东海绵厂 广州海绵厂 ;混乱,恐有~。②缺点或毛 病:制度不健全的~越来越突出了。 【弊端】名由于工作上有漏洞而发生的损害公益的事情:消除~。 【弊害】名弊病;害处。 【弊绝风清】ī形容社会风 气好,没有贪污舞弊等坏事情。也说风清弊绝。 【弊政】〈书〉名有害的政治措施:抨击~|革除~。 【髲】〈书〉假发。 【獘】〈书〉同“毙”。 【薜】 ①[薜荔]()名常绿藤本植物,茎蔓生,叶子卵形。果实球形,可做凉粉,茎叶可入。②()名姓。 【觱】[觱篥]()名古代管乐器,用竹做管,用芦 苇做嘴,汉代从西域传入。也作觱栗、??篥、筚篥。 【篦】动用篦子梳:~头。 【篦子】?名用竹子制成的梳头用具,中间有梁儿,两侧有密齿。 【壁】① 墙:~报|~灯|家徒四~◇铜墙铁~。②某些物体上作用像围墙的部分:井~|锅炉~|细胞~。③像墙那样直立的山石:绝~|峭~。④壁垒:坚~清 野。⑤二十八宿之一。 【壁报】名机关、团体、学校等办的报,把稿子张贴在墙壁上。也叫墙报。 【壁布】名贴在室内墙上做装饰或保护用的布。 【壁橱】 名墙体上留出空间而成的橱。也叫壁柜。 【壁灯】名装置在墙壁上的灯:一盏~。 【壁挂】名挂在墙壁上的装饰物:毛织~|印染~|木雕~。 【壁柜】 名壁橱。 【壁虎】名爬行动物。身体扁平,四肢短,趾上有吸盘,能在壁上爬行。吃蚊、蝇、蛾等小昆虫,对人类有益。也叫蝎虎。旧称守宫。 【壁画】名 绘在建筑物的墙壁或天花板上的图画:敦煌~。 【壁垒】名①古时军营的围墙,泛指防御工事。②比喻对立的事物和界限:两种观点~分明|唯物主义和唯 心主义是哲学中的两大~。 【壁垒森严】比喻防守很严密或界限划得很分明。 【壁立】动(山崖等)像墙壁一样陡立:~千仞|~的山峰。 【壁炉】名就 着墙壁砌成的生火取暖的设备,有烟囱通到室外。 【壁球】名①球类运动项目之一。场地一端是一面墙,比赛时一方向墙击球,球弹回落地后由另一方回击。 分单打和双打。也叫壁式网球。②壁球运动使用的球,用纯橡胶或合成橡胶制成。 【壁上观】见页〖作壁上观〗。 【壁虱】ī名①蜱()。②〈方〉臭虫。 【壁式网球】
高中化学第一节化学反应速率课件新人教选修4.ppt

化学反应速率测定的基本思路:
可用于化学反应速率测定的基本性质 ①可直接观察的性质,如释放出的气体的体积和体 系的压强 ②依靠科学仪器才能测量的性质,如颜色的深浅、 光的吸收、光的发射、导电能力 ③在溶液中,当反应物或生成本身有比较明显的颜 色时,人们常常利用颜色深浅和显色物质浓度间的 正比关系来跟踪反应的过程和测量反应的速率.
A、v (O2)=0.01 mol/L·s
C、 v (H2O)=0.003 mol/L·s mol/L·s
B、 v (NO)=0.008 mol/L·s D、 v (NH3)=0.002
v (NO)=0.3/(5×30) =0.002 mol/L·s
2、比较反应速率的大小
例2、反应A + 3B == 2C + 2D在四种不同情况下的反应速 率分别为①VA = 0.15mol·L-1·s-1 ②VB = 0.6mol·L-1·s-1
0.3
0.2
2s末浓度(mol/L) 0.4
1.2
0.2
V (N 2 ) △ △ C t 0 .1 m 2 o sl/L 0 .0 5 m o l/( L ? s)
V (H 2 ) △ △ C t 0 .3 m 2 o sl/L 0 .1 5 m o l( /L ? s)
V (N H 3 ) △ △ C t 0 .2 m 2 o sl/L 0 .1 0 m o l( /L ? s)
3、浓度仅指溶液或气体的,固体、纯液体无浓度可言。
【例题】在2L的密闭容器中,加入1molN2和3molH2,
发生 N2+3H2 = 2NH3 ,在2s末时,测得容器中含有
0.4mol的NH3,求该反应的化学反应速率。
三步法
专题2化学反应速率和化学平衡 第一单元 化学反应速率知识点归纳

专 题 2 化学反应速率与化学平衡第一单元 化学反应速率知识点复习一、化学反应速率的表示方法1)化学反应速率1.概念:通常用化学反应速率来衡量化学反应快慢。
2.表示方法:通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
3.表达式若用v 表示化学反应速率,Δc 表示反应物或生成物物质的量浓度的变化(取绝对值),Δt 表示一定的时间间隔,则v =ΔcΔt。
如对于化学反应a A +b B===c C +d D ,用A 、B 、C 、D 四种物质的浓度变化来表示,则v (A)=Δc A Δt ,v (B)=Δc BΔt,v (C)=Δc CΔt,v (D)=Δc DΔt。
4.单位:常用mol·L -1·s -1或mol·L -1·min -1。
5.平均速率与瞬时速率(1)平均速率由v =ΔcΔt 求得的。
v 是在反应时间间隔Δt 内反应的平均速率。
(2)瞬时速率:①当Δt 非常小时,由v =ΔcΔt 可求化学反应在某一时刻的瞬时速率。
②通过c -t 图像,运用数学方法也可求得瞬时速率。
【注意】(1)化学反应速率,是某一时间段的平均速率而不是瞬时速率。
(2)不论是反应物还是生成物,其化学反应速率值都取正值。
(3)固体或纯液体(注意:不是溶液)的物质的量浓度可视为不变的常数,因此,一般不用固体或纯液体表示化学反应速率。
(4)同一化学反应里,用不同物质表示的反应速率可能不同,但意义相同,故描述反应速率时必须指明具体的化学物质。
①在同一个化学反应中,用不同物质表示的化学反应速率,其数值大小不一定相同,但表示的速率相同,即一种物质的速率就代表了整个化学反应的速率。
②用不同反应物表示化学反应速率时,化学反应速率之比=物质的量浓度变化之比=物质的量变化之比=化学计量数之比。
2)化学反应速率的计算与比较1.化学反应速率的计算方法 (1)定义式法利用公式v (A)=Δc AΔt 计算化学反应速率。
专题2 第一单元 第1课时 化学反应速率的表示方法

第一单元化学反应速率第1课时化学反应速率的表示方法[核心素养发展目标] 1.变化观念:了解化学反应速率的概念及其表示方法,形成不同的反应可用不同的方法来表示化学反应速率的变化观念。
2.证据推理:根据化学反应速率的测定原理,设计实验学会化学反应速率的测定方法,通过对比的方法,发展基于变量关系的证据推理素养。
一、化学反应速率及其表示方法1.化学反应速率的概念及其表示方法2.对于化学反应a A+b B===c C+d D若用v 表示化学反应速率;Δc 表示反应物或生成物的物质的量浓度的变化(绝对值);Δt 表示一定时间间隔,则用A 、B 、C 、D 四种物质分别表示的化学反应速率表达式为: v (A)=____________;v (B)=____________; v (C)=____________;v (D)=____________。
答案Δc (A )Δt Δc (B )Δt Δc (C )Δt Δc (D )Δt(1)化学反应方程式中,任何一种物质均可用v =ΔcΔt 求出该物质表示的化学反应速率( )(2)化学反应速率指的是某时刻的瞬时速率( ) (3)化学反应速率越大,化学反应的现象越明显( )(4)同一化学反应中,不同物质表示的化学速率可能数值不同,但表示的意义(快慢)相同( ) 答案 (1)× (2)× (3)× (4)√1.H 2O 2分解时H 2O 2浓度的变化如下表,思考解答下列问题:(1)请把表中的数据在下图的直角坐标系中表示出来。
答案(2)根据表格或图像分别计算第0~20 min 、40~50 min 内过氧化氢分解的平均速率。
答案 0~20 min 过氧化氢分解速率: ①H 2O 2浓度变化量:0.80 mol·L -1-0.40 mol·L -1=0.40 mol·L -1 ②时间变化量:20 min所以v (H 2O 2)=0.40 mol·L -120 min=0.02 mol·L -1·min -140~50 min 过氧化氢分解速率:由(1)图像读出50 min 时过氧化氢的浓度约为0.14 mol·L -1,。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2021年高中化学专题2 第1单元第1课时化学反应速率的表示方
法限时训练苏教版选修4
考查点一化学反应速率及应用
1.在化学反应A(g)+3B(g)2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是( )
A.v(A)=v(B) B.v(A)=2v(C)
C.3v(B)=v(C) D.v(B)=3v(D)
【答案】D
【解析】根据反应速率之比等于化学计量数之比进行推断。
2.某温度时,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中发生可逆反应生成气体Z,充分反应后X2的浓度为0.4 mol·L-1,Y2的浓度为0.8 mol·L-1,生成的Z的浓度为0.4 mol·L-1,则该反应是(Z用X、Y表示)( )
A.X2+2Y22XY2B.2X2+Y22X2Y
C.X2+3Y22XY3D.3X2+Y22X3Y
【答案】D
【解析】浓度的变化量之比等于化学方程式的计量数之比。
3.某温度时,在2 L密闭容器中,X、Y、Z三种物质的物质的量n(mol)随时间t(min)变化的曲线如图所示。
由图中数据分析:
(1)该反应的化学方程式_________________________________________。
(2)反应开始至2 min末Z的反应速率为___________________________。
【答案】(1)Y+3X2Z (2)0.05 mol·L-1·min-1
【解析】由图示先确定反应物和生成物,X、Y随时间变化物质的量减少,说明为反应物,Z随时间变化物质的量增多为生成物,再根据反应速率和各物质的计量数关系确定方程式。
另外从图中可知,经过一段时间各物质的量都不为零,所以该反应为可逆反应,这一点非常重要。
考查点二化学反应速率的有关计算
4.反应4A(s)+3B(g)2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。
对此反应速率的表示正确是( )
A.用A表示的反应速率是0.8 mol·L-1·s-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值都是相同的
【答案】B
【解析】反应物A是固体,浓度为常数,通常不用其表示反应的速率,A不正确;v(B)=0.6 mol·L-1/2 min=0.3 mol·L-1·min-1,是2 min内的平均反应速率,而不是 2 min 末时的反应速率,C错;反应中B和C的计量数不同,表示的反应速率的值不同,D不对。
只有B选项正确。
5.将5.6 g铁粉投入足量的100 mL 2 mol·L-1稀硫酸中,2 min时铁刚好完全溶解。
下列有关这个反应的速率表示正确的是( )
A.铁的反应速率为0.5 mol·L-1·min-1
B.硫酸的反应速率为0.5 mol·L-1·min-1
C.硫酸亚铁的反应速率为0.25 mol·L-1·m in-1
D.氢气的反应速率为0.5 mol·L-1·min-1
【答案】B
【解析】根据反应速率计算公式,要计算2 min时间内反应物浓度的变化量,在反应Fe+H2SO4===FeSO4+H2↑中,溶液中的溶质浓度发生变化的只有反应物硫酸和生成物
硫酸亚铁。
5.6 g Fe 的物质的量=5.6 g
56 g·mol-1
=0.1 mol,故反应消耗H2SO4的物质的量=生成FeSO4的物质的量=0.1 mol。
H2SO4的消耗速率=FeSO4的生成速率=
0.1 mol
0.1 L×2 min
=0.5 mol·L-1·min-1。
6.将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)。
若经2 s后测得C的浓度为0.6 mol·L-1。
现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质B的浓度为0.7 mol·L-1
④在该条件下,再经2 s后C的浓度为1.2 mol·L-1
其中正确的是( )
A.①④B.①③
C.②④D.③④
【答案】B
【解析】解答本题可先根据化学方程式计算出A和B的浓度的减少,然后根据化学反应速率的概念进行计算。
2 s 后C 的浓度为0.6 mol·L -1,则生成C 为0.6 mol·L -1×2 L=1.2 mol ,消耗A 1.2 mol ,消耗B 0.6 mol ,则Δc (A)=1.2 mol 2 L =0.6 mol·L -1,Δc (B)=0.6 mol
2 L =
0.3 mol·L -1
故v (A)=Δc A Δt =0.6 mol·L -12 s =0.3 mol·L -1·s -1
v (B)=0.3 mol·L -12 s =0.15 mol·L -1·s -1
2 s 时B 的浓度为2 mol -0.6 mol
2 L
=0.7 mol·L -1
v (C)=v (A)=0.3 mol·L -1·s -1
在该条件下,随着反应的进行,反应速率逐渐减小,所以后2 s 内反应速率小于0.3 mol·L -1·s -1,经2 s 后C 的浓度小于1.2 mol ·L -1。
7.将等物质的量的A 和B 混合于 2 L 的密闭容器中,发生如下反应:3A(g)+B(g)
x C(g)+2D(g),经5 min 后,测得D 的浓度为0.5 mol·L -1,c (A)∶c (B)=3∶5,
C 的平均反应速率是0.1 mol·L -1·min -1。
A 在5 min 末的浓度是________,B 的平均反应速率是________________,
D 的平均反应速率是________________,x 的值是________。
【答案】0.75 mol·L -1 0.05 mol·L -1·min -1 0.1 mol·L -1·min -1 2
【解析】v (D)=0.1 mol·L -1·min -1=v (C),则x =2。
8.计算3~18 s 内第2组实验中生成I -3的平均反应速率(写出计算过程,结果保留两个有效数字)。
【答案】c(I-3)=Δc Δt
=11.8×10-3mol·L-1-3.5×10-3mol·L-1
18 s-3 s
=5.5×10-4 mol·L-1·s-1
【解析】由图给数据,可知Δc(I-3)=(11.8×10-3mol/L-3.5×10-3mol/L)=8.3×10-3mol/L,由速率公式,得c(I-3)=Δc(I-3)/Δt=8.3×10-3mol/L÷(18-3)s=5.5×10- 4mol/(L·s)。
9.某温度时,在2 L的密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
(1)根据下表中数据,在下图中画出X、Y、Z的物质的量(n)随时间(t)的变化曲线:
t/min X/mol Y/mol Z/mol
0 1.00 1.000.00
10.900.800.20
30.750.500.50
50.650.300.70
90.550.100.90
100.550.100.90
140.550.100.90
(2)体系中发生反应的化学方程式是_____________________________________。
(3)列式计算该反应在0~3 min时间内产物Z的平均反应速率:________________________________________________________________________。
【答案】(1)见下图
(2)X+2Y2Z
(3)
0.50 mol
2 L×
3 min
≈0.083 mol·L-1·min-1
【解析】相同时间内各物质的变化量之比等于方程式中对应化学计量数之比。
