降钙素原测定试剂盒(荧光免疫层析法)产品技术要求万华普曼生物
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求runnuosi
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:用于体外定量测定人血清中降钙素原的含量。
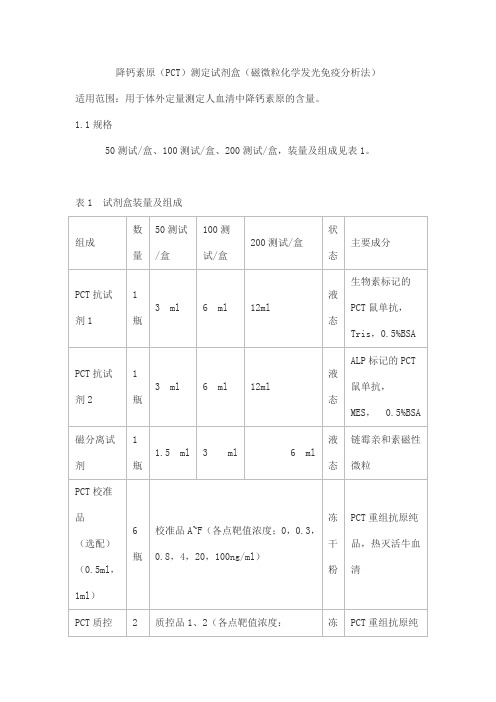
1.1规格50测试/盒、100测试/盒、200测试/盒,装量及组成见表1。
表1 试剂盒装量及组成2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3 液体组分应澄清,无沉淀或絮状物;2.1.4 包装标签应清晰,无磨损。
2.2准确度将已知浓度的PCT抗原加入到样本中,其回收率应在(85%~115%)范围内。
2.3空白检测限应不大于0.02ng/ml。
2.4线性在(0.02,100)ng/ml的测量范围内,试剂盒的相关系数r应≥0.99。
2.5重复性变异系数(CV)应不大于10%。
2.6质控品测值测值应在质控范围内。
2.7批间差批间变异系数(CV)应不大于15%。
2.8校准品瓶间差校准品的瓶间变异系数(CV)应不大于10%。
2.9分析特异性2.9.1 浓度不低于5000pg/ml白介素(IL-6)的零浓度PCT样本,在本试剂盒上测定结果应不高于0.03ng/ml。
2.9.2 浓度不低于10ng/ml降钙素(CT)的零浓度PCT样本,在本试剂盒上测试结果应不高于0.02ng/ml。
2.10稳定性2.10.1效期稳定性:试剂盒在2℃~8℃贮存,有效期为12个月,到效期后的试剂盒检测外观、准确度、空白检测限、线性、重复性和质控品测值,应符合2.1~2.6的要求。
2.10.2复溶稳定性:校准品与质控品复溶后,在2℃~8℃环境下保存3天后进行以下检测:a)校准品:进行准确度、质控品测值的检测,结果应符合2.2,2.6的要求。
b)质控品:进行质控品测值的检测,结果应符合2.6的要求。
4.01 降钙素原 ∕ 白介素-6测定试剂盒(荧光免疫层析法)技术要求

医疗器械产品技术要求编号:降钙素原/白介素-6测定试剂盒(荧光免疫层析法)1 产品型号/规格及其划分说明1.1 型号型号:型号G、型号Q。
1.2 规格1人份/盒,2人份/盒,3人份/盒,5人份/盒,10人份/盒,20人份/盒,25人份/盒,30人份/盒,40人份/盒,50人份/盒,100人份/盒,200人份/盒。
1.3 产品型号/规格划分说明产品型号划分主要根据产品注册单元进行划分,其中型号G由检测卡、样本缓冲液组成;型号Q由检测卡、样本缓冲液、质控物组成。
规格划分主要根据产品单人份铝箔包装的检测卡装量来进行规格划分。
产品形式由产品型号和规格组合形成。
产品型号/规格划分类型(例子)2 性能指标2.1 物理检查2.1.1 外观试剂盒各组分齐全、完整,包装无破损;液体组分澄清、无漏液;标签牢固,内容清晰、准确。
质控物应外观均匀,形成完整的冻干品,复溶后清亮,无浑浊及沉淀。
2.1.2 液体移行速度液体移行速度应不小于10mm/min。
2.2 线性2.2.1 PCT项目试剂盒项目PCT线性在0.1ng/mL~50.0ng/mL范围内,线性相关系数|r|应≥0.990。
2.2.2 IL-6项目试剂盒项目IL-6线性在3.0pg/mL~4000.0pg/mL范围内,线性相关系数|r|应≥0.990。
2.3 准确性2.3.1 PCT项目测定回收率应在85%~115%范围内。
2.3.2 IL-6项目用IL-6国际标准品配制的准确性校准品或经标化的准确性校准品进行检测,其检测结果的相对偏差应在±15.0%范围内。
注:国家、省质量监督抽检和风险监测、第三方仲裁检验时应采用国家/国际标准品。
2.4 检出限试剂盒项目PCT检出限不高于0.05ng/mL,项目IL-6检出限不高于1.5pg/mL。
2.5 重复性试剂盒项目PCT和IL-6每个项目的重复性变异系数(CV)不高于10%。
2.6 批间差试剂盒项目PCT和IL-6每个项目的批间变异系数(CV)不高于15%。
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)产品技术要求puenguangde
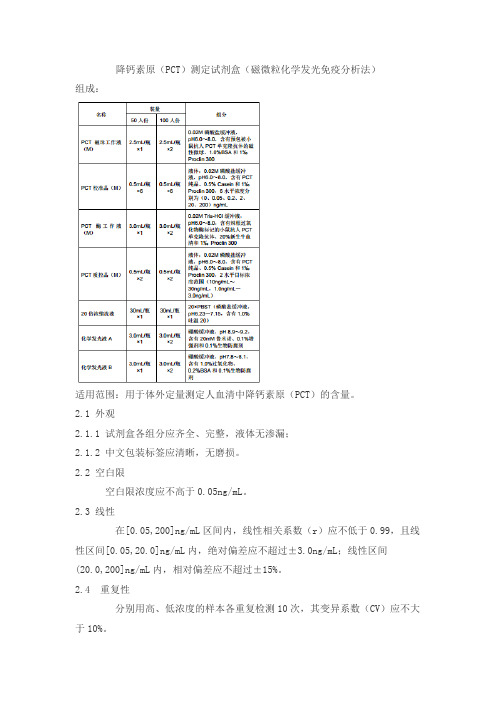
降钙素原(PCT)测定试剂盒(磁微粒化学发光免疫分析法)组成:适用范围:用于体外定量测定人血清中降钙素原(PCT)的含量。
2.1 外观2.1.1 试剂盒各组分应齐全、完整,液体无渗漏;2.1.2 中文包装标签应清晰,无磨损。
2.2 空白限空白限浓度应不高于0.05ng/mL。
2.3 线性在[0.05,200]ng/mL区间内,线性相关系数(r)应不低于0.99,且线性区间[0.05,20.0]ng/mL内,绝对偏差应不超过±3.0ng/mL;线性区间(20.0,200]ng/mL内,相对偏差应不超过±15%。
2.4 重复性分别用高、低浓度的样本各重复检测10次,其变异系数(CV)应不大于10%。
2.5 准确度将纯品配制的溶液(A)加入到人源样本(B)中,其回收率应在85%~115%之间。
2.6 分析特异性将下表规定浓度的干扰物质用试剂盒进行测定,检测结果的浓度值不得超过0.05ng/mL。
2.7 溯源性根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容。
校准品溯源至企业工作校准品,并与已上市产品比对赋值。
2.8 质控品赋值有效性本试剂盒质控品的测定结果应在质控范围内。
2.9 批间差用3个批号的产品分别检测同一份样本,3批产品间的相对极差(R)应不大于15%。
2.10稳定性试剂盒在(2~8)℃储存条件下的有效期为12个月,试剂盒在规定的条件下保存,取到效期后的试剂盒进行检测,检验结果应符合2.1、2.2、2.3、2.4、2.5、2.6的规定。
降钙素原(PCT)测定试剂盒(胶体金免疫层析法)产品技术要求meikang

降钙素原(PCT)测定试剂盒(胶体金免疫层析法)适用范围:用于体外定量检测人血清中的降钙素原,与南京美宁康诚生物科技有限公司生产的Mokosensor-A300型胶体金免疫分析仪配套使用。
1.1 包装规格20人份/盒、100人份/盒。
1.2 主要组成成分由相应人份的检测卡组成,其中,检测卡:检测线包被来源于小鼠的降钙素原单克隆抗体A、质控线包被羊抗鼠IgG多克隆抗体、金标垫上固定胶体金标记来源于小鼠的降钙素原单克隆抗体B。
2.1外观2.1.1外观平整,材料附着牢固,内容齐全,包装标签应清晰;2.1.2膜条宽度为4mm±0.2mm;2.1.3液体移行速度应不低于10mm/min。
2.2 空白限不高于0.10μg/L。
2.3 线性2.3.1试剂盒线性范围为[0.10,100.00]μg/L,线性相关系数r不低于0.9900;2.3.2 [0.10,0.25]μg/L绝对偏差不超过±0.02μg/L,(0.25,100.00]μg/L 线性偏差在±10%范围内。
2.4重复性检测高、低两个浓度的样本,变异系数(CV)应不大于10% 。
2.5准确度回收率在85%~115%。
2.6分析特异性检测浓度为100.00μg/L超敏C反应蛋白中降钙素原的浓度,计算交叉反应率,应小于10%。
2.7批间差检测一个高浓度的样本,相对极差应在±10%范围内。
2.8稳定性:常温(10℃~30℃)保存,有效期12个月,有效期末分别检测2.2~2.5项,其结果应符合各项要求。
2.9 校准品溯源性试剂盒校准信息所用校准品按照GB/T 21415-2008 《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,溯源到本公司工作校准品,工作校准品通过已上市产品试剂盒比对赋值。
降钙素原(PCT)测定试剂盒(荧光免疫层析法)产品技术要求puenguangde

降钙素原(PCT)测定试剂盒(荧光免疫层析法)
适用范围:用于体外定量测定人血清、血浆或全血中降钙素原(PCT)含量。
1.1包装规格
10人份/盒,25人份/盒,50人份/盒。
1.2主要组成成分
试剂盒由PCT荧光免疫层析检测卡、PCT样品稀释液(F)、PCT校准卡组成,各组分及数量见表1。
表1:试剂盒组成成分
2.1外观
外包装盒应完整,无破损;单包铝箔袋应完整,无破损,保持密封包装;液体组分应澄清透明,无沉淀、无渗漏。
2.2物理性状
2.2.1 试纸条的宽度:应不超于(
3.40±0.10)mm 。
2.2.2 液体移行速度:应不低于5mm/min。
2.3空白检出限
空白检出限浓度应不高于0.05ng/ml。
2.4线性范围
在[0.05,40]ng/ml范围内线性相关系数r≥0.990。
2.5精密度
2.5.1 重复性
变异系数CV不超于15%。
2.5.2 批间差
变异系数CV不超于20%。
2.6准确度
回收率应在85%~115%之间。
2.7分析特异性
测试按表2规定浓度范围的降钙素、白介素-6、C反应蛋白的样品,检测结果应不超过0.1ng/ml。
表2:交叉反应物及浓度列表
2.8效期稳定性试验
试剂盒2℃~30℃保存,铝箔袋密封状态下存放,取有效期满后两个月内的产品进行检测,结果应符合2.2、2.3、2.4、2.5.1、2.6项要求。
降钙素原(PCT)检测试剂盒(免疫层析法)产品技术要求模板

医疗器械产品技术要求编号:
降钙素原(PCT)检测试剂盒(免疫层析法)
1.产品型号/规格及划分说明
1.1产品型号/规格
20人份/盒。
1.2结构组成
由检测卡、干燥剂、比色卡、使用说明书组成。
其中:检测卡由检测区(T)(鼠抗PCT单抗)、质控区(C)(羊抗鼠IgG)和胶体金结合物(胶体金鼠抗PCT单抗)和硝酸纤维素膜支持物等组成。
1.3 适用范围
适用于体外检测全血、血浆或血清样本中的降钙素原(PCT)的含量。
2.性能指标
2.1外观及性状
2.1.1检测卡应无明显划痕、气泡、外观平整,材料附着牢固。
2.1.2检测卡的文字和标记应清晰、准确。
2.2膜条宽度
检测条的宽度应≥2.5mm。
2.3液体移行速度
液体移行速度应不低于 10mm/分钟。
2.4灵敏度(最低检出限)
本试剂盒对 PCT 最低检出限为 0.1ng/mL。
2.5检测范围
本试剂盒对 PCT 检测范围为 0.1ng/mL~250.0ng/mL。
2.6特异性
当样本中血红蛋白(Hb)浓度≤9mg/mL,胆红素(Bil)浓度≤0.5mg/mL,甘油三酯(TG)浓度≤18mg/mL 时,对试剂盒检测结果无干扰。
2.7精密度
2.7.1批内精密度
取同一批号试剂对精密度参考品分别进行 10 次测定,反应结果应一致,且显色度应均一。
2.7.2批间精密度
分别取连续三个批号试剂对精密度参考品分别进行 10 次测定,反应结果应一致,且显色度应均一。
1。
降钙素原(PCT)测定试剂盒(胶体金免疫层析法)产品技术要求mkjy

降钙素原(PCT)测定试剂盒(胶体金免疫层析法)适用范围:用于体外定量测定人全血中降钙素原的含量。
1.1 包装规格20人份/盒、100人份/盒。
1.2 主要组成成分每人份包括1个检测卡、1包干燥剂、1个铝箔袋,每盒试剂包括1个校准信息U盘,(内含校准曲线、产品批号、生产日期、“有效期至”信息)。
其中,检测卡:硝酸纤维素膜,检测线(T线)包被鼠抗人的降钙素原单克隆抗体A、质控线(C线)包被羊抗鼠IgG多克隆抗体、金标垫(材质:玻璃纤维)上固定胶体金标记的鼠抗人降钙素原单克隆抗体B、金标垫的下端装配有玻璃纤维材质的滤血膜。
2.1 外观2.1.1 外观平整,材料附着牢固,内容齐全,包装标签应清晰;2.1.2 膜条宽度为4mm±0.2mm;2.1.3 液体移行速度应不低于10mm/min。
2.2 空白限不高于0.1μg/L。
2.3 定量限测定0.2μg/L的降钙素原样本,变异系数(CV)应不大于10%。
2.4 线性2.4.1 线性范围为[0.2,100.0]μg/L,线性相关系数r不低于0.9900;2.4.2 [0.2,2.0]μg/L绝对偏差不超过±0.2μg/L,(2.0,100.0]μg/L线性偏差在±10%范围内。
2.5 重复性检测高、低两个浓度的样本,变异系数(CV)应不大于10%。
2.6 准确度将已知浓度的降钙素原加入到人全血基质或其它体液成分中, 回收率在85%~115%。
2.7 分析特异性测定浓度为100.0μg/L C反应蛋白,结果应小于0.2ug/L。
2.8 批间差用3个不同批号的试剂盒检测25.0ug/L高浓度样本,相对极差应在±10%范围内。
2.9量值溯源根据GB/T 21415规定了校准曲线的溯源情况,溯源至公司内部工作校准品,并与已上市产品比对赋值。
2.10稳定性:10℃~30℃保存,有效期12个月。
过有效期后进行检测,应符合2.2、2.3、2.4、2.5、2.6的要求。
降钙素原测定试剂盒(化学发光法)产品技术要求新产业
2.性能指标
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;试剂盒内组分(磁性微球除外)应为澄清的液体,无沉淀、无悬浮物、无絮状物;磁性微球悬浮溶液应该均匀分布,无肉眼可观察到的团聚颗粒,无异物,无块状沉淀。
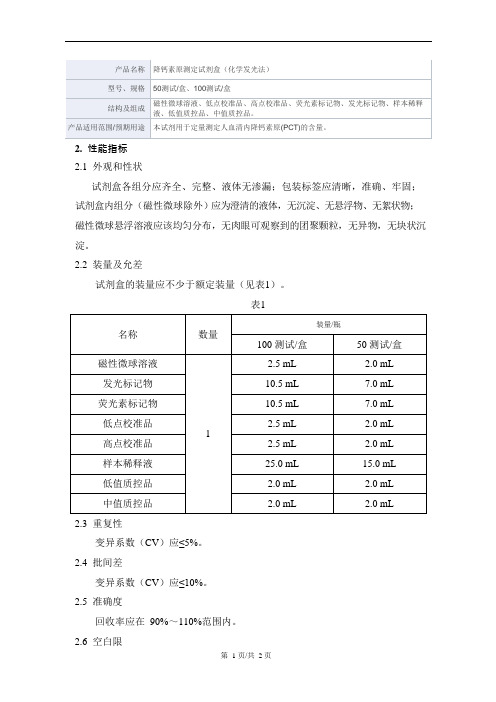
2.2装量及允差
试剂盒的装量应不少于额定装量(见表1)。
表1
2.3重复性
变异系数(CV)应≤5%。
2.4批间差
变异系数(CV)应≤10%。
2.5准确度
回收率应在90%~110%范围内。
2.6空白限
试剂盒的空白限应≤0.01 ng/mL。
2.7检出限
试剂盒的检出限应≤0.04 ng/mL。
2.8线性
在(0.06~100.0)ng/mL 浓度范围内,线性相关性系数(r)绝对值应大于0.9900。
2.9校准品均一性
校准品均一性变异系数(CV 均一性)应≤5%。
2.10质控品预期结果
低值质控品每次检测结果应在(0.330~0.770)ng/mL 范围内,中值质控品每次检测结果应在(5.82~10.8)ng/mL 范围内。
2.11质控品均一性
质控品均一性变异系数(CV
)应≤5%。
均一性。
降钙素原测定试剂盒(荧光免疫层析法)产品技术要求普迈德

降钙素原测定试剂盒(荧光免疫层析法)适用范围:本产品用于体外定量测定全血、血清或血浆中降钙素原(PCT)含量。
1.1包装规格10人份/盒、20人份/盒、50人份/盒。
1.2主要组成成分每盒含10/20/50人份的试纸条、样品缓冲液(主要成分:0.01 mol/L的PBS缓冲液,pH:7.4±0.2,装量:至少2mL×1支/3mL×1支/6mL×1支)和标曲信息卡。
每人份的试纸条含1份检测卡、1套取样滴管(选配)、1支离心管(选配)和1包干燥剂。
检测卡由样品垫、硝酸纤维素膜(T线包被鼠抗降钙素原单克隆抗体;C线包被羊抗鼠多克隆抗体)、荧光垫(包被荧光标记的鼠抗降钙素原单克隆抗体)、吸水纸、塑料载板组成。
2.1物理性状2.1.1外观测定试剂应整洁完整、无毛刺、无破损、无污染;材料附着牢固;标签字迹清晰,无破损。
2.1.2膜条宽度测定试剂的膜条宽度≥2.5mm。
2.1.3液体移行速度液体移行速度应不低于10 mm/min。
2.2空白限空白限应不高于0.2ng/mL。
2.3重复性分别检测低、中2个浓度的样本,变异系数(CV)应不高于15.0%。
2.4批间差用3个批号试剂分别检测低、中浓度的样本,变异系数(CV)应不高于15.0%。
2.5线性在[0.2,40]ng/mL的范围内,线性相关系数应不低于0.990。
2.6准确度回收率应在85%~115%之间。
2.7分析特异性含浓度为35mg/mL白蛋白的零浓度PCT样本,检测结果不高于0.2ng/mL。
2.8稳定性将测定试剂在4℃~30℃的环境中放置18个月后,取样分别检测2.1.3、2.2、2.3、2.5、2.6、2.7项,结果应符合各项目的要求。
2.9溯源性按照GB/T 21415-2008及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,校准曲线信息溯源至公司内部工作校准品。
降钙素原测定试剂盒(荧光免疫层析法)产品技术要求万泰

降钙素原测定试剂盒(荧光免疫层析法)适用范围:本试剂盒与厦门万泰沧海的免疫荧光定量检测仪配套使用,用于体外定量测定人血清或血浆中降钙素原(PCT)的含量。
1.1 包装规格:10人份/盒,50人份/盒1.2 主要组成成分检测卡:附着荧光标记鼠抗人PCT单克隆抗体的玻璃纤维、包被有鼠抗人PCT 单克隆抗体的硝酸纤维素膜、玻璃纤维、塑料背衬。
样本稀释液:0.05M pH9.6碳酸盐缓冲液。
定标代码:贮存有试剂盒批号及对应定标曲线信息。
2.1 外观外包装完整、无破损;液体试剂无杂质、无絮状物、无渗漏,标签应清晰,易识别。
2.2 膜条宽度应不小于2.5mm。
2.3 液体移行速度液体移行速度应不低于10mm/min。
2.4 净含量液体组分的净含量与标示值相对偏差不超过±10%。
2.5 线性范围在线性范围[0.05,20]ng/mL内,线性相关系数r应不低于0.9900;[0.05,4]ng/mL浓度线性绝对偏差不超过±0.6ng/mL;(4,20]ng/mL浓度线性相对偏差应不超过±15%。
2.6 定量限检测0.05ng/mL定量限参考品,变异系数(CV,%)应均不超过20%。
2.7 准确度试剂盒回收率在80%~120%范围内。
2.8 重复性检测低、高两个浓度重复性参考品CV1和CV2,变异系数(CV,%)应均不超过15%。
2.9 批间差用3个批号试剂盒检测低、高两个浓度重复性参考品CV1和CV2,其结果相对偏差(R)应均不超过±15%。
2.10 稳定性效期稳定性:取2℃~30℃干燥处保存18个月以上的留样试剂盒,检测2.1~2.8,2.11项,结果应符合各项目规定的要求。
2.11 特异性检测特异性参考品T1~T4,结果应均<0.5ng/mL。
其中T1为(30±5)ng/mL的降钙激素,T2为(10±2)ng/mL的降钙素,T3为(10±2)μg/mL的CGRPα,T4为(10±2)μg/mL的CGRPβ。
降钙素原(PCT)测定试剂盒(荧光免疫层析法)产品技术要求sz

批间变异系数(CV)应≤15%。
2.6准确度
回收率应在 85%~115%范围内。
1
2.1.3膜条宽度
膜条宽度为 4.00±0.40mm。
2.1.4液体移行速度
液体移行速度应不低于 25mm/min。
2.2线性范围
试剂的线性范围为0.2ng/ml~60ng/ml,在此线性范围内:线性相关系数r应不小于0.990。
2.3检测限
检测限应不大于 0.2ng/ml。
2.4批内精密度
变异系数(CV)应≤15%。
产品适用范围/预期用途
本试剂盒用于体外定量测定人血清、血浆和全血样本中降钙素原(PCT)的含量。临床上主要用于细菌感染性疾病的辅助诊断。
2,材料附着牢固;
样本稀释液为无色透明液体,无悬浮物及沉淀物。
2.1.2样本稀释液净含量
样本稀释液净含量偏差不大于标示量的±10%。
产品名称
降钙素原(PCT)测定试剂盒(荧光免疫层析法)
型号、规格
20人份/盒, 40人份/盒,60人份/盒
结构及组成
试剂盒由检测卡、稀释液和ID卡组成;检测卡主要组成成分有硝酸纤维素膜,玻璃纤维素膜,吸水纸,PVC板,红细胞抗体(RBC);其中硝酸纤维素膜在特定的位置上包被有PCT单克隆抗体和兔IgG,玻璃纤维素膜上喷有荧光微球标记的PCT单克隆抗体和兔IgG抗体。稀释液组分:PB缓冲液;Proclin300。ID卡包含校准曲线和批号。
04.PCT测定试剂盒(荧光免疫层析法)工艺规程
文件名称: 降钙素原(PCT)测定试剂盒(荧光免文件编号:疫层析法)工艺规程版本/修改状态: V1.0/00 受控状态:受控编制人:日期:年月日审核人:日期:年月日批准人:日期:年月日生效日期:年月日颁发部门:质量部颁发份数: 2 份分发部门:生产部、质量部受控编号:降钙素原(PCT)测定试剂盒(荧光免疫层析法)1.产品名称、剂型、注册分类、规格、定义、组成及用途中文名称:降钙素原(PCT)测定试剂盒(荧光免疫层析法)规格:25人份/盒、40人份/盒剂型:诊断试剂注册分类:二类6840体外诊断试剂定义、组成及预期用途:本产品采用高度特异性的抗原抗体反应及免疫层析分析技术,通过夹心法检测原理来体外定量测定人血清、血浆样本中降钙素原(PCT)的含量。
依据:《降钙素原(PCT)测定试剂盒(荧光免疫层析法)产品技术要求》文件名称: 降钙素原(PCT)测定试剂盒(荧光免文件编号:疫层析法)工艺规程版本/修改状态: V1.0/00 受控状态:受控目录1.生产工艺流程图2.试剂卡制备生产工艺3.质量控制点4.主要原辅料、包装材料消耗定额、能源消耗定额、物料平衡的计算方法5.包装要求、标签、说明书(附样本)与产品贮存方法及有效期6.设备一览表7.技术安全及劳动保护文件名称: 降钙素原(PCT )测定试剂盒(荧光免疫层析法)工艺规程文件编号:版本/修改状态: V1.0/00受控状态: 受 控1. PCT 生产工艺流程图羊抗兔IgG 抗体鼠抗PCT抗体包被液配制(C 线)包被液配制(T 线)划线(NC 膜)BSA 及其他化学试剂贴膜组装探针稀释液配制样品垫制作 # ★BSA 及其他化学试剂样本稀释液配制分装★切条样品垫处理NC 膜干燥 # ★压卡装袋贴签、组装成品检验烧数据卡化学试剂不合格合格入库不合格品控制不合格十万级洁净区十万级洁净区干燥环境#★:关键工序◇:质量控制点#:湿度≤30%半成品检验十万级洁净区干燥环境#不合格品控制合格合格兔IgG 抗体微球偶联物鼠抗人PCT 抗体微球偶联物BSA 及其他化学试剂样品垫处理液配制不合格品控制探针配制....半成品检验半成品检验不合格品控制不合格合格标准曲线制作万级洁净区不合格文件名称: 降钙素原(PCT )测定试剂盒(荧光免疫层析法)工艺规程文件编号:版本/修改状态: V1.0/00受控状态: 受 控2. 试剂卡制备生产工艺2.1工序一:样品垫制作 2.2工序二:NC膜制备 2.3工序三:样本稀释液制备 2.4工序四: 贴膜组装 2.5工序五: 切条 2.6工序六:压卡装袋 2.7工序七:烧数据卡2.8工序八:降钙素原(PCT )测定试剂盒(荧光免疫层析法)试剂盒组装2.1 工序一:样品垫制作 2.1.1 探针稀释液 2.1.1.1 标准配方名称 物料名称 配制1000ml 使用量75人份使用量探针稀释液三羟甲基氨基甲烷2.4228g0.12ml调节PH=8.4±0.2 蔗糖 150g 牛血清白蛋白 5g 吐温-20 5ml Proclin3000.3ml纯化水定容至1000ml2.1.1.2 配制方法按照标准配方准确称取三羟甲基氨基甲烷2.4228g ,放入洁净烧杯中,加纯化水800ml ,放入1个洁净的磁力搅拌子,置磁力搅拌器上搅拌至充分溶解后,使用多参数测试仪测量PH 值应在8.4±0.2范围内,再依次加入蔗糖150g 、牛血清白蛋白5g 、吐温-20 5ml 、Proclin300 0.3ml ,置磁力搅拌器上搅拌至充分溶解后,将溶液缓缓倒入容积为1000ml 的容量瓶中,用纯化水反复冲洗3次烧杯,所有溶液倒入上述容量瓶中,用纯化水定容至1000ml 。
降钙素原检测试剂盒(胶体金免疫层析法)产品技术要求注册模板

医疗器械产品技术要求编号:降钙素原检测试剂盒(胶体金免疫层析法)1.产品型号/规格及划分说明1.1产品规格30人份/盒(卡式)50人份/盒(条式)1.2主要组成成分本试剂盒是由:30人份测试卡/50人份测试条及1瓶样本稀释液(5毫升装)、比色卡1个、塑料滴管30个(卡式)/50个(条式)组成。
试剂条组成成分:C线标记鸡IgY多克隆抗体,包被羊抗鸡IgY多克隆抗体,T线标记和包被鼠抗降钙素原单克隆抗体。
硝酸纤维素膜。
稀释液主要组成成分:酪蛋白(1%)、磷酸氢二钠(0.54%)、磷酸二氢钠(0.08%)、氯化钠(0.9%)、Tween-20(0.4%)。
1.3适用范围本试剂盒可体外半定量的检测人体血清、血浆或全血中的降钙素原(PCT)的浓度。
1.4产品储存条件及有效期(体外诊断试剂适用):2℃~30°C保存,有效期24个月。
2.性能指标2.1物理检查2.1.1外观试剂盒外观整齐,包装完整无破损,标签清晰可辨。
2.1.2膜条宽度膜条宽度应不低于2.5mm。
2.1.3液体移行速度液体在膜上移行速度应不低于10mm/min。
2.1.4液体装量及pH值稀释液装量应不低于其标示值,pH值7.0~7.6。
2.2性能要求2.2.1试剂盒检测浓度梯度和范围,见表1:表1试剂盒检测浓度及范围分别用阴性质控液和浓度为0.5ng/ml、2ng/ml和10ng/ml的降钙素原质控液(来源及赋值见附录A,下同)重复测试20次,检测结果与相应的质控液标示值相差同向不超过一个量级,不得出现反向相差。
阳性质控液不得出现阴性结果,阴性质控液不得出现阳性结果,各浓度检测结果一致性不低于90%。
2.2.3HOOK效应检测浓度为100ng/ml的降钙素原质控液,检测3次,结果均为阳性。
2.2.4批间差取三个批次的试剂盒,分别对同一份阳性质控液进行重复检测20次,检测结果之间不超过一个量级。
2.2.5特异性测定以下常见干扰物质的样本,在下列浓度时检测结果不出现阳性,见表1:表1常见干扰物质浓度及检测结果选择以下之一进行:2.2.6.1加速稳定性,37℃放置20天,应符合2.2.2~2.2.4的要求。
降钙素原测定试剂盒(胶体金免疫层析法)产品技术要求lepu

降钙素原测定试剂盒(胶体金免疫层析法)适用范围:该产品用于定量检测人血清、血浆和全血样本中的降钙素原的水平。
1.1 规格卡型1人份、10人份/盒、20人份/盒、50人份/盒。
1.2组成每盒含规格要求人份试剂条和1份说明书。
每人份试纸条包括1份降钙素原检测试纸、1支滴管和1包干燥剂。
降钙素原检测试纸由样品垫、硝酸纤维素膜(T 线包被鼠抗人降钙素原单克隆抗体;C线包被兔抗鼠抗抗体)、金标垫(胶体金标记的鼠抗人降钙素原单克隆抗体)、吸水纸、塑料载板组成。
2.1物理性状2.1.1外观检测卡应整洁完整、无毛刺、无破损、无污染;材料附着牢固。
2.1.2膜条宽度检测卡的膜条宽度≥2.5 mm。
2.1.3液体移行速度液体移行速度应不低于10 mm/min。
2.2空白检出限空白检出限应不高于0.5ng/mL。
2.3精密度2.3.1批内精密度批内精密度(CV%)应不高于15.0%。
2.3.2批间精密度批间精密度(CV%)应不高于15.0%。
2.4剂量-反应曲线的线性2.4.1相关系数在 0ng/mL~25ng/mL的范围内,用线性拟合公式拟合,剂量-反应曲线相关系数应不低于0.975。
2.4.2偏差测试浓度0~2.5ng/mL的降钙素原测定样品液,绝对偏差不超过±0.5ng/mL;测试浓度>2.5ng/mL的降钙素原测定样品液,相对偏差不超过±20%。
2.5 准确度检测已知浓度的降钙素原标准品(Randox),实测值与标示值的偏差范围应不高于15%。
2.6稳定性将试剂盒在4℃~30℃的环境中放置18个月后,取样分别检测2.1,2.2,2.3.1,2.4,2.5项,结果应符合各项目的要求。
荧光免疫层析分析仪产品技术要求万华普曼生物工程

荧光免疫层析分析仪适用范围:与荧光免疫层析法试剂配套使用,用于对人体样本中的待测物进行体外定量检测。
.产品型号/规格及其划分说明. 1. 产品型号:WH FAR200. 2 型号划分说明. 3. 结构组成主要由光学单元、机械单元、控制单元、输出/显示单元、电源适配器组成。
5)运行环境:Linux3.4及以上版本操作系统6)硬件配置:CPU—处理器880MHz及以上;内存—128MB及以上;闪存—128MB及以上;2.1工作条件.环境温度:10℃~30℃;.相对湿度:20%~80%;.大气压力:86.0kPa~106.0kPa;.电源要求:100-240VAC,50/60Hz。
2.2外观在自然光下以正常视力或矫正视力目视检查,应满足如下要求:.外观整洁,无裂纹或划痕,无毛刺等缺陷,文字和标识清晰;.分析系统运动部件运行平稳,无卡住突跳;.紧固件连接牢固可靠,不得有松动;.信息显示应完整、清晰;2.3功能2.3.1自检功能;2.3.2 录入校准信息功能;2.3.3 结果的存储和查询功能;2.3.4 故障提示功能;2.3.5具有打印功能;2.4 网络安全2.4.1数据接口:UDP协议,RS-232协议,USB2.0协议;可通过USB2.0接口导出数据,数据存储格式为CSV文件格式;2.4.2用户访问控制:用户类型分为管理员用户和普通用户,系统采用用户名和密码登录。
在用户登录前,系统具有创建普通用户和用户密码修改两种功能。
使用普通用户登录:可以使用测试、批量测试、历史、项目、设置功能,只能访问本用户的测试数据;使用管理员用户登录:可以使用测试、批量测试、历史、项目、设置功能,可访问所有用户的测试数据。
2.5 性能2.5.1重复性测试高、中、低的三种浓度的标准荧光卡,变异系数CV≤3%2.5.2 线性测试标准荧光卡,线性回归的相关系数r≥0.992.5.3稳定性测试标准荧光卡,测量结果的相对极差RR≤5%2.5.4准确度测试CRP国际标准品(NIBSC代码:85/506),检测结果相对偏差(B)不超过±15%2.6 安全要求应符合GB4793.1-2007、GB4793.9-2013和YY0648-2008(瞬间过电压类型:II 类,额定污染等级:2级)中适用章条的要求。
降钙素原测定试剂(荧光免疫层析一步法) 产品技术要求万孚生物

降钙素原测定试剂(荧光免疫层析一步法)
性能指标
1外观检查
外观应平整,材料附着应牢固,各组分应齐全,卡固定紧密。
2物理检查
膜条宽度应不小于 2.0mm;液体移行速度应不低于10mm/min。
3 准确度
在试剂的线性范围内,检测3 个不同浓度的参考品,其测量结果的相对偏差(Bias%)不应超过±15% 。
4 最低检出限
应不大于0.1ng/mL。
5 线性
试剂在(0.3~80)ng/mL 的范围内,线性相关系数r≥0.99。
6 精密度
6.1批内精密度
在试剂的线性范围内,检测2 个不同浓度的样本,所得结果的变异系数 CV (%)应不大于 10%。
6.2批间精密度
在试剂的线性范围内,检测 2 个不同浓度的样本,所得结果的变异系数 CV (%)应不大于 15%。
7 分析特异性
选择同一浓度的PCT 样本分别加入胆固醇、甘油三酯、胆红素、血红蛋白,使干扰物最终浓度胆固醇20mg/mL、甘油三酯20mg/mL、胆红素0.2mg/mL、血红蛋白1 mg/mL,各干扰样本重复检测3 次,计算样本检测结果的均值和相对偏差,其中相对偏差(Bias%)在±15% 内。
降钙素原(PCT)质控品产品技术要求万孚生物

降钙素原(PCT)质控品
性能指标
1外观检查
质控品复溶前为白色或类白色疏松饼状结构,应在30秒内完全复溶,复溶后为澄清、透明液体,无沉淀、悬浮物和絮状物。
2包装
包装瓶为棕色玻璃瓶,盖有橡胶瓶内塞和塑料外盖;盒贴、瓶贴、标签标识应完整、清晰。
橡胶瓶内塞与玻璃配合后应无泄漏;塑料外盖应无明显划痕、崩缺。
3均一性
3.1瓶内均一性
瓶内CV≤15%。
3.2瓶间均一性
瓶间CV≤15%。
4靶值及靶值范围
4.1赋值程序
每批质控品均应提供本批产品的靶值和靶值范围表,并应提供赋值方法程序文件。
4.2赋值的准确性
用校准后的测量程序测定该质控物,检测结果应在其靶值范围内。
降钙素原测定试剂盒(化学发光免疫分析法)产品技术要求万孚

2性能指标
2.1外观
外观应符合如下要求:
a)磁珠包被物R1摇匀后应为棕褐色悬浊液;静止久后,棕褐色磁珠沉降于底部,上清液应为无色液体;酶标记物R2应为无色液体,无沉淀或絮状物;校准品应为外观均匀,成形完整,呈乳白色的冻干品,复溶后较清亮,无浑浊及沉淀;
b)试剂盒各组分应齐全、完整,液体无渗漏;
c)中文包装标签清晰,无磨损。
2.2准确度
对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10%范围内。
2.3空白限
不大于0.02ng/mL。
2.4线性
试剂盒在0.02ng/mL~100ng/mL 区间内,其相关系数(r)绝对值不低于0.9900。
2.5重复性
变异系数CV≤8%。
2.6批间差
变异系数CV≤10%。
2.7校准品
2.7.1校准品准确度
测定校准品,C1,C2 测定结果的相对偏差在±10%范围内,C0 测定结果的绝对偏差的绝对值不高于0.02ng/mL。
2.7.2校准品瓶内均一性
校准品C1,C2 瓶内均一性≤8%,C0 的SD≤0.02ng/mL。
2.7.3校准品瓶间均一性
校准品C1,C2 瓶间均一性≤5%,C0 的SD≤0.02ng/mL。
1。
降钙素原 白介素6 C反应蛋白质控品产品技术要求kangchesitan
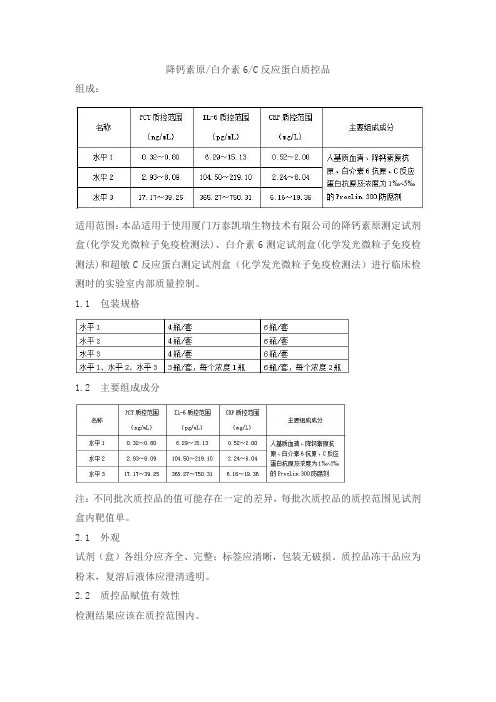
降钙素原/白介素6/C反应蛋白质控品
组成:
适用范围:本品适用于使用厦门万泰凯瑞生物技术有限公司的降钙素原测定试剂盒(化学发光微粒子免疫检测法)、白介素6测定试剂盒(化学发光微粒子免疫检测法)和超敏C反应蛋白测定试剂盒(化学发光微粒子免疫检测法)进行临床检测时的实验室内部质量控制。
1.1 包装规格
1.2 主要组成成分
注:不同批次质控品的值可能存在一定的差异,每批次质控品的质控范围见试剂盒内靶值单。
2.1 外观
试剂(盒)各组分应齐全、完整;标签应清晰,包装无破损。
质控品冻干品应为粉末,复溶后液体应澄清透明。
2.2 质控品赋值有效性
检测结果应该在质控范围内。
2.3 瓶间差
瓶间变异系数应不高于15%。
2.4 瓶内均匀性
瓶内变异系数应不高于10%。
2.5 稳定性
2.5.1 复溶稳定性
原包装质控品在开瓶完全复溶后,置于2℃~8℃条件下保存。
放置8小时后进行检测,结果应符合2.2项的规定。
2.5.2 效期稳定性
原包装质控品在2℃~8℃的条件下储存,有效期为36个月。
取效期末产品进行检测,结果应符合2.1、2.2、2.4项的规定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
降钙素原测定试剂盒(荧光免疫层析法)
适用范围:用于体外定量测定人血清或血浆样本中降钙素原(PCT)的浓度。
1.1 包装规格
1人份/袋,25人份/盒;
1人份/袋,40人份/盒;
1人份/袋,100人份/盒。
1.2主要组成成分
试剂盒由检测卡、ID卡(1个/盒)组成。
其中:检测卡由降钙素原(PCT)测定试剂条和卡塞组成。
试纸条上主要成分有硝酸纤维素膜、荧光标记一体垫金、吸水纸和PS板。
硝酸纤维素膜包被羊抗人降钙素原多克隆抗体(T线)和羊抗鼠多克隆抗体(C线),荧光标记一体垫金包被荧光微球标记鼠抗人降钙素原单克隆抗体的玻璃纤维膜。
ID卡:贮存有试剂盒名称、批号、生产日期及对应定标曲线信息。
2.1物理性能
2.1.1外观:试剂盒应整洁,文字符号标识清晰,封装无破损,内容物齐全。
2.1.2膜条尺寸:不低于2.5mm。
2.1.3移行速度:液体在加样区与测试区之间的移行速度应≥10mm/min。
2.2 溯源性
应根据GB/T 21415《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源》及有关规定提供所用降钙素原企业标准品的来源、赋值过程以及测量不确定度相关内容。
ID卡校准曲线可溯源至降钙素原企业标准品。
2.3 检出限:检出限应≤0.1ng/mL。
2.4 准确度:回收率应在85%-115%。
2.5 线性
在[0.1,100]ng/mL内,其线性相关系数(r)≥0.990。
2.6 重复性
用同一批次试剂盒对浓度为(0.5±0.05)ng/mL、(10.0±1.0)ng/mL的降钙素原样本进行测定,每个浓度样本重复测定10次,所得结果的变异系数(CV)应不大于12.5%。
2.7 批间差
随机抽取三个不同批号的试剂盒,分别对浓度为(0.5±0.05)ng/mL、(10.0±1.0)ng/mL的降钙素原样本进行测定,每个浓度样本重复测定10次,计算30次测定结果的变异系数(CV)应不大于 15.0%。
2.8 效期稳定性
4~30℃保存,有效期为24个月,产品应符合2.3~2.6的要求。
