遗传毒性杂质的警示结构_马磊
基于多成分测定及特征图谱评价不同批次肠炎宁片质量

·2170·氯丁酸甲酯(methyl 4-chlorobutyrate) 2.4-氯丁酸乙酯(ethyl 4-chlorobutyrate)·2172··2174··2176·gallic acid) 4.新绿原酸(neochlorogenic acid) 6.绿原酸(chlorogenic acid) 7.隐绿原酸(cryptochlorogenic acid (rutin) 17.迷迭香酸(rosmarinic acid) C.254 nm 混合对照品色谱图Chromatograms of mixed reference substancesChineseJournal of Pharmaceutical Analysis·2178·同图1(same as Fig. 1)320 nm C.254 nm 肠炎宁样品色谱图Chromatograms of Changyanning samples试品色谱图比较,可以判定1和15号色谱峰均存在于金毛耳草、地锦草、香薷及枫香树叶四味药材中,号峰存在于金毛耳草和枫香树叶中,9号峰存在于地锦草药材中,17号主要存在于香薷药材中;通过记录没食子酸、新绿原酸、绿原酸、隐绿原酸、柯芦丁和迷迭香酸的峰面积,计算各化学成分结果见表2。
由表可知,10批样品中没食子酸5.69~8.79 mg·g-1,其中在样品S6中含量最低,在样品S1中含量最高;新绿原酸、迭香酸成分在样品S1中含量最低,在样品量最高;隐绿原酸含量在3.71~8.81 mg样品S1中含量最低,在样品S6中含量最高;京含量在1.66~2.35 mg·g-1,其中在样品最低,在样品S2中含量最高;芦丁含量在mg·g-1,其中在样品S2中含量最低,在样品量最高。
Journal of Pharmaceutical Analysis Chinese'()*+同图1(samo as Fig. 1)缺金毛耳草阴性样品(negative sample without Hedyotis Chrysoticha) E.缺地锦草阴性样品(negative sample without Euphorbia humifusa Herba 品(negative sample without Elsholtzia ciliate(Thunb.)Hyland) G.缺枫香树叶阴性样品(negative sample withoutH.缺樟树根阴性样品(negative sample without Cinnamomum camphora root) 阴性供试品色谱图(320 nm)Chromatograms of negative samplesChineseJournal of Pharmaceutical Analysis·2180·批样品HPLC特征图谱HPLC characteristic chromatograms of 10 batches of samplesChineseJournal of Pharmaceutical Analysis。
基因毒性杂质作用原理-中文版

遗传毒性致癌物发生致癌和致突变的作用,第一步一般认为都是和DNA发生反应。
从机理上理解基因毒性杂质的作用原理,不用死记硬背,就能轻松记住所有的基因毒性杂质。
根据Miller的理论:致癌物要么是亲电试剂,要么可以代谢成亲电试剂。
然后和DNA的亲核基团发生反应。
DNA的亲核活性基团主要有:•碱基上的氮•碱基上的氧•磷酸酯骨架先来看一下DNA的结构双螺旋的DNA主要含有四个碱基,分别是腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶以及磷酸酯的串联骨架。
这些嘧啶和嘌呤上面的氮氧都富有电子,如果遇见一些缺电子的试剂,很容易发生取代等反应。
事实上,DNA的反应种类除了只反应某一处位点外,还会有一些比较复杂的反应类型:•可以看到有的碱基上不仅含有一个亲核位点,如果一个致癌物有两处亲电位点,反应一处后,还会和碱基的另外一个位点反应,生成一些小环。
•双亲电基团的另外一个基团也有可能和两个不同的碱基链接,甚至可以和两个螺旋上的不同碱基链接。
•也会有可能另外一个基团和蛋白质反应,造成DNA-蛋白质的链接。
DNA的反应活性除了亲核性之外,主要受空间结构的影响。
Guanine中的N7位置位于DNA双螺旋的大沟槽处,空间较大,容易和亲电试剂接触,反应活性显然要比Adenine中处于小沟槽中的N3(红色数字)要高。
当然根据结构也能预知,Adenine的N1和Cytosine的N3(绿色数字)位置处于狭窄的分子空间内,又有氢键相连,所以基本上没有反应活性。
DNA反应并不都是反应在氧和氮上,比如粉红色的C8位置也能发生反应,不过该反应也是先和相邻的N7反应然后重排到C8。
纯粹的理论说明略显枯燥,下面会详细介绍每一类含有警示结构的致癌物。
酰化试剂酰基卤化物酰基卤化物由于卤原子电负性较大,吸引电子,导致羰基碳非常缺电子,一旦和DNA接触,会和腺嘌呤的羰基氧发生酯化反应。
二甲氨基甲酰氯和二乙氨基甲酰氯被IARC归为致癌物2A类。
异氰酸酯是具有多种商业应用的高活性化合物。
5 遗传毒性杂质

ICH M7
目前在第四阶段
FDA
2005年工作小 组成立 2008年指南
内容
一、简介
二、ICH M7
三、遗传毒性杂质的分类
四、限度控制
五、案例
六、总结
ICH M7
• 引言 • 指导原则的范围 • 总体原则
• 上市药品需要考虑的事项
• 原料药和制剂的杂质评估 • 风险评估因素(杂质分类) • 风险表征(控制限度) • 控制策略 • 文件 • 注意事项 词汇表 参考文献 附录
ICH M7对遗传毒性杂质的控制
• 遗传毒性杂质可能出现在起始物料、溶剂、中间
体、副产物和降解产物中,并可能引入到制剂中 • ICH M7提供了一个可用于遗传毒性杂质鉴别、分 类、定量分析和控制的可行性框架。 限制潜在的致癌风险 提供了安全性评估和质量风险控制的概念
对ICHQ3A和Q3B的补充
O
高于1.5g的TTC
• 遗传毒性杂质:致癌性与时间和剂量均有关系;
较短时间内可以承受高于1.5 g/天的剂量,不影 响致癌性。 • 含义:短时间+高浓度和长时间+低浓度得到同样 的效果 • Haber定律:浓度(C)时间(T)=常数(k)
阶段性的TTC限度
放宽限度-阶段性TTC数据
• 低于终身给药剂量的限度(Less-Than-Lifetime):基 于TTC可接受的限度为1.5 g/天是计算患者终生服药的 基础上得出的理论值,按照70岁寿命计算: • 1.5 g/天*365天*70年(25,550天)=38.3mg
分析潜在的杂 质
必要时重复以 上工作
对杂质进行结 构评价
提交完整的控 制策略
遗传毒性杂质的控制原则
EMEA人用药品委员会(CHMP)《遗传毒性杂质限度指导原则》中文译稿

1EMEA人用药品委员会(CHMP)《遗传毒性杂质限度指导原则》原文:European Medicines Agency: Guideline on the Limits of Genotoxic Impurities. CPMP/SWP/5199/02。
EMEA/CHMP/QWP/251344/2006。
London, 28 June 2006关键词:杂质;遗传毒性;毒理学担忧阈值(TTC);构效关系(SAR)摘要遗传毒性杂质的毒理学评估和药物原料中此类杂质的可接受限度确定是难题,现有ICHQ3X指南中未充分说明。
常用遗传毒性杂质数据库差异很大,而数据库是决定(dictates)可接受限度评估所用方法的主要因素。
当运用已建立风险评估方法所需资料缺乏时,包括致癌性长期试验资料或提供遗传毒性阈值机制证据的资料等,建议采用毒理学担忧阈值(TTC)所定义的普遍适用方法。
对大部分药物(Pharmaceuticals),认为TTC值为遗传毒性杂质摄入量1.5µg/天时相关的风险可接受(一生中额外的癌症风险<1/100000)。
根据该阈值,药物原料中允许水平可根据预计每日剂量计算得到。
短期暴露等特定情况下可能有理由提高限度。
1.1前言在原料药(Q3A,新药物原料中的杂质)和药物制剂(Q3B,新药物制剂中的杂质)的指导原则中描述了杂质限度确定的一般概念,将限度确定定义为确定在特定水平下单个杂质或给定杂质谱的生物学安全性的资料的获得和评价过程。
对于有遗传毒性潜力的杂质,确定可接受剂量水平通常被认为是特别重要的问题,现有指导原则尚未专门涵盖。
1.2适用范围本指导原则阐述了如何处理新药物原料中遗传毒性杂质的一般框架和实践方法。
若新申请的已有药物原料经合成路线、过程控制和杂质谱评估未提供合理保证,证明与EU已批准的含相同药物原料的药品相比,未引入新的或更高水平的遗传毒性杂质,本指导原则也适用于已有药物原料的新申请。
遗传毒性杂质在医药工业中的来源与控制路径

遗传毒性杂质在医药工业中的来源与控制路径摘要:制药企业生产出的药品如果存在遗传毒性杂质,使得药品带有可遗传的毒性,会对人类健康造成严重威胁。
近年来,药品中遗传毒性杂质问题已成为了药品监管机构重点关注的问题之一。
本文将简要概括遗传毒性杂质的属性和含义,详细分析遗传毒性杂质的具体来源,并在最后提出如何控制生产药品中遗传毒性杂质的具体途径。
关键词:遗传毒性杂质;医药工业;来源;控制路径在制药环节中,很多药品通过合成或者天然产物结构修饰制成。
相关制药企业为了在复杂的合成过程中尽可能提高生产效率,而使用大剂量的化学试剂。
这种化学试剂过量会使反应继续发生,进而发生副反应,产生副产物最后仍然储存在药品中售卖。
这样的药品中含有大量不明杂质,可能会影响人类的身体健康。
药品监管局了解到这一问题后,开始聚焦遗传毒性杂质在药品中的含量这一指标,这一问题也成了各位专家的研究重点。
一、遗传毒性杂质的属性和含义首先,我们要明确遗传毒性是指物理或化学的某些因素与生物体内的DNA等遗传物质相结合,进而发生作用并最终表现为毒性。
遗传物质进入人体后,会刺激和加快基因突变或者使人体细胞发生癌变,会对人体健康造成不利影响。
因此,遗传毒性杂质本身具有致突变性和致癌性两种基本属性,容易使得生物体发生基因突变或者发生致癌现象,这种突发性大多情况下是无法及时反应或者预测的。
二、遗传毒性杂质的来源遗传毒性杂质主要来源于药品生产过程中。
药品生产过程涉及到的原料或产物有很多,都从属于化学试剂。
例如反应物、催化剂、副产物等等。
根据研究,遗传毒性杂质的遗传毒性机制是嘧啶和嘌呤碱的N原子、O原子以及磷酸二甲酯骨架,在特殊情况下进入DNA找到碱基的亲核中心,破坏连接的键,进而使得整条DNA双链断裂。
遗传毒性杂质的常见来源包括试剂、副反应的生成物和有机溶剂三种方式。
(一)试剂含有遗传毒性杂质的试剂包括硼酸、芳香胺类、烷基卤化物、环氧乙烷、肼试剂、氮氧化物等。
环氧乙烷自身带有环,而DNA中心受到环的张力会与该物质发生亲核反应,进而产生大量遗传毒性杂质。
EMA_关于基因毒性杂质限度指南的问答(中文)

EMA 关于基因毒性杂质限度指南的问答2010-9-23背景:本问答文件的目的是对 2006 年出版的基因毒性杂质限度指南( EMEA/CHMP/QWP/251344/2006 )进行相关内容统一和说明。
问答Q1:该指引并不要求对已批准销售的产品进行基因毒性杂质再评估,除非有一个特定的“重要原因”(cause-for-concern )。
请问什么是“重要原因”?A1:如果原料药的生产过程基本上没有改变,就不需要对基因毒性杂质进行重新评价。
但是,如果新知识表明有新原因时,例如几年前发现的甲磺酸盐药物可能形成甲磺酸烷基的基因毒性杂质,这需要进行基因毒性杂质的再评估,包括EP 药典中收载的所有甲磺酸盐类产品,并出示“生产声明”。
Q2:该指引指出:即使按决策树程序其水平低于毒理学关注阈值 (threshold of toxicological concern,TTC) ,也要尽可能地减少已知或未知的诱变杂质( mutagenic impurity )。
如果已知其诱变杂质的水平低于 TTC (TTC 是一个非常保守的值),为什么要还进一步减少呢?实际上这还涉及定量限在 1ppm 左右的分析方法,可以这样做但可能没结果,这是否有必要呢?A2:如果一个诱变杂质的水平低于毒理学关注阈值 (相当于临床剂量≤1.5微克 /天),就没有必要这样做。
除非它具有一个高度关注的风险结构:如N - 亚硝基,黄曲霉毒素类和氧化偶氮物就需要这样做。
Q3 :该指引规定:“当一个潜在的杂质包含“警示结构”(structural alerts )时,应考虑用细菌突变试验对其杂质进行的基因毒性分析”。
i )如果一个杂质能诱发“警示结构”,该杂质的致突变试验( Ames)结果为阴性时,是否就足以得出结论:该化合物不属于关注的遗传毒性杂质?是否还需要进一步的确认研究?ii )“警示结构”不存在就足以说明不属于关注杂质呢?iii )假设某杂质属于“警报结构”,但只要加以控制确保其杂质水平低于 TTC ,不进行常规检测是否可以接受?A3 回答:i)是的。
基因毒性杂质培训 PPT课件

对甲苯磺酸季戊酯(布洛芬): 苯:溶剂石油醚可能含有苯
右旋布洛芬中可能含有的基因毒性杂质
右旋布洛芬中合成路线
甲苯中要控制苯!
布洛芬赖氨酸中可能含有的基因毒性杂质
布洛芬赖氨酸合成工艺
=
布洛芬赖氨酸水杨醛的限度问题
台湾2016年9月缺陷信及回复:
氟马西尼合成工艺
氟马西尼中N,N-二甲苯胺基因毒性
盐酸格拉司琼中可能含有的基因毒性杂质
Granisetron起始原料1-甲基吲唑-3-羧酸 中可能含有的基因毒性杂质
Granisetron起始原料氮杂壬胺可能含有的基因毒性杂质
盐酸格拉司琼中可能含有的基因毒性杂质
盐酸格拉司琼欧洲药品质量管理局(EDQM) 缺陷信
磷酸氟达拉滨中可能含有的基因毒性杂质
Fludarabine起始原料合成工艺
磷酸氟达拉滨合成工艺
氯苄
氯苄的毒性资料
The Carcinogenic Potency Database (CPDB)致癌物数据库公布的1547种致癌物质中有氯苄:
托拉塞米中可能含有的基因毒性杂质
托拉塞米起始原料合成工艺
O
O NH2 A Carbamates 氨基甲酸类
AA NN
AR Hydrazines and azo Compounds 肼和偶氮化合物
EWG
Michale-reactive Acceptors 迈克尔加成反应受体
O P
OR
O S
OR
Alkyl Esetrs of Phosphonates or Sulfonates 膦酸酯或者磺酸酯
D-(+)-樟脑磺酸乙酯
基因毒性杂质

由LD50推算PDE值建议
《原料药工厂中清洁验证指南》一文中的NOEL 的单位是mg/天,而不是上文公式中的 mg/kg/天 LD50计算NOEL的公式:NOEL=LD50×70/2000,公式中的70是欧洲人的评价体重 如果需要用LD50计算NOEL用于计算PDE,推荐公式应该是NOEL=LD50/2000 (见参考文献) 不推荐在基因毒物质研究中使用
4.药品杂质毒性判别方法 5.药品杂质研究限度策略 6.药品杂质风险评估的分析方法建立策略
1.药品杂质研究的法规依据
杂质是指药物中存在的无治疗作用或者影响药物的稳定性、疗效,甚至对人体的健康有害的物质 产品质量重点关注杂质:工艺杂质、 降解杂质 安全性重点关注高毒性杂质:致癌、致突变类杂杂质 中国药典、美国药典、欧洲药典、日本药典等各国药典
在检索剂量数据前需要全面检索该物质是否有致癌致畸性,例如氯乙酸CPDB数据TD50显示阴性 盐酸盐的药物在重结晶过程中的接触醇类容易产生氯代烷烃,单一卤代物在M7中有36ug/day指导规则 关注环氧丙醇、环氧氯丙烷、3-氯-1,2-丙二醇三者之间的转化关系 毒性数据会被不断的更新,更多的研究数据会被不断的上传
已知杂质研究策略讨论 结构已知的杂质研究:起始物料及其已知杂质、中间体、试剂、反应副产物、降解产物
根据工艺路线梳理出产品待研究的杂质清单 进行毒性杂质评估分类:文献报道、软件预测 根据各国药典及ICH Q A\B\C规则分别建立有关物质和溶剂残留方法 建立满足专属性和灵敏度的方法(LOQ<30%限度浓度),收集多批次API中目标杂质含量 基于已有的有关物质方法和溶剂残留方法,增加供试品浓度或改变检测器 基于杂质检出情况制定杂质添加实验,考察工艺的杂质的去除能力 基于杂质分类、毒性评估、产品检出情况制定方法学验证策略及产品控制策略
盐酸司来吉兰相关杂质G的合成

盐酸司来吉兰的化学名为(R )-N ,α-二甲基-N-(2-丙炔基)苯乙胺盐酸盐,是一种选择性单胺氧化酶-B 抑制剂,可以抑制多巴胺的再摄取及突触前受体,能增加及延长左旋多巴的效果,可减少左旋多巴的剂量。
与左旋多巴并用时,特别能减少帕金森病的波动。
盐酸司来吉兰的合成已有很多报道,文献[1-3]方法是以天然产物甲基苯丙胺经先取代后拆分或先拆分后取代制备盐酸司来吉兰。
合成路线如下:文献报道和化合物专利路线[1-3],收率高,工艺稳定,但是起始原料或中间体使用了(-)-R-甲基苯丙胺,为冰毒(+)-S-甲基苯丙胺的对映异构体。
(-)-R-甲基苯丙胺虽不认为具有成瘾可能,甚至可用于心血管病的治疗,但其来源及获取极为困难,文献报道[1-3]主要通过苯丙胺(安非他明)N-甲基化合成,且安非他明也是受管控的化学品,所以,企业获得盐酸司来吉兰生产许可的难度很大。
沈阳药科大学的张丽娟等[4]于2005年在《中国药物化学杂志》报道了一种以1-苯基-2-丙胺为原料经N-甲基化、D-酒石酸拆分,再经炔基化、成盐四步反应合成盐酸司来吉兰的方法。
该法起始物料是受管控的化学品苯丙胺,使用剧毒物硫酸二甲酯,但拆分后会有一半的副产物(+)-S-甲基苯丙胺(冰毒)。
华东理工大学药学院孙郁等[5]于2008年报道了以苯乙腈作起始物料,经两步反应合成苯基丙酮,经水相发酵构建碳原子的手性,再经对甲苯磺酰化、叠氮化和Pd/C 还原得到R-苯丙胺。
R-苯丙胺经N-甲基化、炔基化得到司来吉兰。
该方法使用危险的叠氮试剂(叠氮化钠),价昂的Pd/C 试剂,每步收率不高且易产生杂质。
中山大学药学院赵旭等[6]于2020年报道了以N-Fmoc-D-丙氨酸为手性源,经过Friedel-Crafts 酰基化、脱保护和还原反应制得R-苯丙胺,然后经炔丙基化及还原甲基化反应制得盐酸司来吉兰。
该法每步中间体都需过柱纯化,使用价昂的Pd/C 试剂,不利于工业化生产。
LC_MS_MS法检测奥拉帕尼中的遗传毒性杂质_白培锋

据奥拉帕尼的最大日服用剂量为 800 mg 计算,奥拉 帕尼中含杂质 A 和杂质 ALPN-1 的 总 量 不 能 超 过 1. 875 μg·g -1 。作者目前尚未见到关于上述 2 个杂质 检测法的相关报道。本实验建立了 HPLC-MS / MS 方 法用于同时检测杂质 A 和杂质 ALPN-1,该法准确、快 速、灵敏,可用于奥拉帕尼的质量控制。
400 ℃ ; 源 内 气 体 1 流 速 为 40 psi; 气 体 2 流 速 为 40 psi; 气帘气体压力为 20 psi; 其他参数如表 1。
名称 ALPN 杂质 A 杂质 ALPN-1
表 1 ALPN,A 和 ALPN-1 的质谱参数
母离子 /子离子 435. 3 /281. 2 285. 4 /185. 5 467. 3 /367. 2
865 中国新药杂志 2016 年第 25 卷第 8 期
Chinese Journal of New Drugs 2016,25(8)
瘤细胞 DNA 修复途径的缺陷而优先杀死癌细胞[6]。 奥拉帕尼合成过程中用到含有氨基甲酸酯的起始原 料,因而可能产生杂质 A 和杂质 ALPN-1( 结构式见 图 1) ,因此需要对奥拉帕尼产品中可能存在的上述 2 个遗传毒性杂质的残留量进行严格控制,以保证 药品安全。基于 TTC 可接受限度为 1. 5 μg·d -1 ,根
方法与结果
1 溶液的配制 1. 1 杂质 A 和杂质 ALPN-1 储备液 精密称取杂
质 A 和杂质 ALPN-1 对照品各约 20 mg 至于 100 mL 量瓶中,用甲醇超声溶解定容为 200 μg·mL - 1 的溶 液,取上述溶液 100 μL 置于 200 mL 量瓶中,用流动 相稀释成终浓度约为 100 ng·mL - 1 溶液,作为杂质 A 和杂质 ALPN-1 储备液。 1. 2 样品溶液 精密称取奥拉帕尼供试品 30 mg, 用适量甲醇溶解后,再用流动相稀释成浓度约为 3 mg·mL - 1 的溶液作为样品溶液。 2 检测条件的确定 2. 1 色谱条件 色谱柱: Phenomenon luna C18 ( 33
遗传毒性杂质控制指导原则

遗传毒性杂质控制指导原则遗传毒性杂质控制指导原则用于指导药物遗传毒性杂质的危害评估、分类、定性和限值制定,以控制药物中遗传毒性杂质潜在的致癌风险。
为药品标准制修订,上市药品安全性再评价提供参考。
一、总则遗传毒性(Genotoxcity)是指遗传物质中任何有害变化引起的毒性,而不考虑诱发该变化的机制,又称为基因毒性。
遗传毒性杂质(Genotoxic Impurities,GTIs)是指能引起遗传毒性的杂质,包括致突变性杂质和其它类型的无致突变性杂质。
其主要来源于原料药的生产过程,如起始原料、反应物、催化剂、试剂、溶剂、中间体、副产物、降解产物等。
致突变性杂质(Mutagenic Impurities)指在较低水平时也有可能直接引起DNA损伤,导致DNA突变,从而可能引发癌症的遗传毒性杂质。
本指导原则主要关注致突变机制的遗传毒性杂质,非致突变机制的遗传毒性杂质在杂质水平的剂量下,一般可忽略其致癌风险。
药品生产、药品标准提高及上市药品再评价过程中发现杂质后,可按本指导原则进行风险评估,确定其是否为遗传毒性杂质,尤其是致突变性杂质。
如果一个杂质被鉴定为具有潜在的致癌风险,应制定相应的限值。
在制订可忽略致癌风险的杂质限值时,应进一步分析生产工艺,兼顾安全性和质量风险管理成本两方面的因素,综合考虑制定合适的限值。
本指导原则包括危害评估方法、可接受摄入量计算方法和限值制定方法。
本指导原则中描述的对杂质潜在致突变性的评估方法不适用于以下类型的原料药和制剂:生物/生物技术制品、肽类、寡核苷酸、放射性药物、发酵产品、中药和动物或植物来源的粗制品。
也不适用于已上市药物中使用的辅料、调味剂、着色剂和香料,以及与药物包材相关的可浸出物。
本指导原则中对杂质潜在致突变性的评估方法不适用于用于晚期癌症适应症的原料药和制剂,以及用于其它适应症但本身在治疗剂量下就具有遗传毒性,且预计可能与癌症风险增加有关的原料药。
在这些情况下,致突变性杂质不会显著增加原料药的致癌风险。
UPLC-MS_法测定磷酸西格列汀中的2_种磷酸酯杂质的含量

第52卷第11期 辽 宁 化 工 Vol.52,No.11 2023年11月 Liaoning Chemical Industry November,2023基金项目: 吉林省医药健康产业发展专项引导资金项目(项目编号:YYZX201905)。
收稿日期: 2022-09-27UPLC -MS 法测定磷酸西格列汀中的2种磷酸酯杂质的含量朱红茹1,王广祁1,2*,王健1,3,王芳1,姜斌4(1. 通化东宝药业股份有限公司,吉林 通化 134123; 2. 沈阳药科大学 生命科学与生物制药学院,辽宁 沈阳 110016;3. 沈阳药科大学 制药工程学院,辽宁 沈阳 110016;4. 山东汇智药物研究有限公司,山东 济南 250101)摘 要: 建立了UPLC -MS 法测定磷酸西格列汀中2种磷酸酯杂质含量的检测方法。
采用C 18色谱柱(2.1 mm×50 mm,1.7 μm )分离,0.01%甲酸和乙腈为流动相进行梯度洗脱,采用单极四级杆检测器,电喷雾离子源,正离子模式进行监测,外标法定量,分析方法时长13 min。
结果表明:该方法的线性关系相关系数r ≥0.995;磷酸西格列汀样品加标回收率为82.05%~105.53%(n =9);磷酸三甲酯(TMP)检测限为0.007 4 μg·mL -1,磷酸三异丙基酯(TIP)检测限为0.007 8 μg·mL -1。
与常规高效液相方法相比,该方法简单快速,灵敏度高,准确度好,适用于磷酸西格列汀中磷酸三甲酯和磷酸三异丙基酯杂质的检测。
关 键 词:UPLC -MS;磷酸西格列汀;基因毒性杂质;磷酸三甲酯;磷酸三异丙基酯 中图分类号:O657.7 文献标识码: A 文章编号: 1004-0935(2023)11-1702-04药品在生产的过程中,由于工艺条件、环境温度、生产设备的多种影响,往往可能产生杂质,杂质的存在对患者更是“有害无益”。
基因毒性杂质控制

3
TTC限度或以下;或进行细菌致 含警示结构的物质,与API结构 突变性试验。 无关,无致突变性数据 如果无致突变性=第5类; 如果有致突变性=第2类。
所含警示结构与活性成份(API) 相同,或与已证实无基因毒性 按一般杂质控制 原料药结构相关化合物的警示 结构相同 无警示结构,或有充分的数据 证明其警示结构无致突变性 按一般杂质控制
d、成品基于TTC的可接受限度为50ppm。
结论: 起始物料Y中杂质B控制限度0.1%可接受,不需提供中试及商业化 批
数据。
案例3:关于结构相似的基因毒性杂质的控制(芳硝基位置异构体 杂质);
需控杂质与已建立可接受限度的中间体物化特性相似,清除方式相似, 且残留更低。
案例4:高反应活性基因毒性物质(二氯亚砜)。
(1)工艺杂质控制 方法1:原料பைடு நூலகம்质量标准中控制在可接受限度以下
至少连续6批中试或连续3批放大检出低于限度30%以下,可周期性检验。
方法2:起始原料或中间体标准或中控过程中控制在可接受限度以下; 方法3:起始原料或中间体标准或中控过程中控制在可接受限度以上;
明确杂质的去向及清除过程; 根据实验室研究,成品残留在可接受限度的30%以下(推荐加标试验); 必要时有中试或商业化批数据支持。
4、基因毒性杂质的限度
(3)非终生暴露(Less than lifetime,LTL)的控制 采用Staged TTC Approach
单个基因毒性杂质可接受摄入量
治疗期 日摄入量 (μg/day)
≤1月 120
>1-12月 20
>1-10年 10
>10年至 终生 1.5
间隔给药按实际给药天数计,例:某药治疗期2年,每周给药一次,2
基因毒性杂质控制相关文件及指南介绍
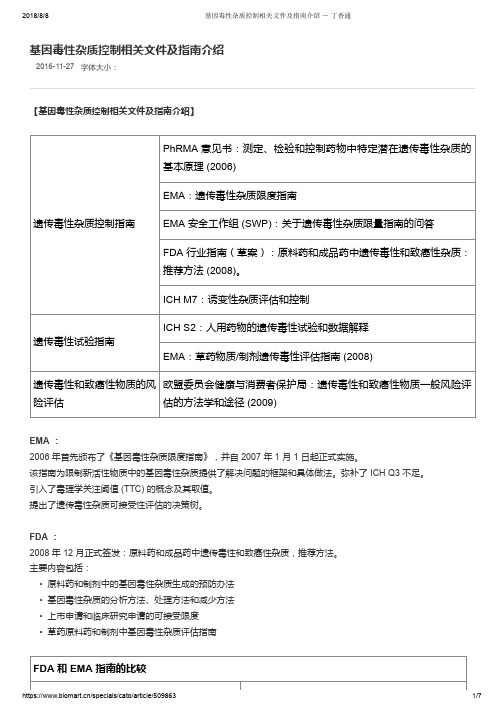
2016-11-27字体大小:基因毒性杂质控制相关文件及指南介绍【基因毒性杂质控制相关文件及指南介绍】遗传毒性杂质控制指南PhRMA 意见书:测定、检验和控制药物中特定潜在遗传毒性杂质的基本原理 (2006)EMA:遗传毒性杂质限度指南EMA 安全工作组 (SWP):关于遗传毒性杂质限量指南的问答FDA 行业指南(草案):原料药和成品药中遗传毒性和致癌性杂质:推荐方法 (2008)。
ICH M7:诱变性杂质评估和控制遗传毒性试验指南ICH S2:人用药物的遗传毒性试验和数据解释EMA:草药物质/制剂遗传毒性评估指南 (2008)遗传毒性和致癌性物质的风险评估欧盟委员会健康与消费者保护局:遗传毒性和致癌性物质一般风险评估的方法学和途径 (2009)EMA :2006 年首先颁布了《基因毒性杂质限度指南》,并自 2007 年 1 月 1 日起正式实施。
该指南为限制新活性物质中的基因毒性杂质提供了解决问题的框架和具体做法。
弥补了 ICH Q3 不足。
引入了毒理学关注阈值 (TTC) 的概念及其取值。
提出了遗传毒性杂质可接受性评估的决策树。
FDA :2008 年 12 月正式签发:原料药和成品药中遗传毒性和致癌性杂质,推荐方法。
主要内容包括:• 原料药和制剂中的基因毒性杂质生成的预防办法• 基因毒性杂质的分析方法、处理方法和减少方法• 上市申请和临床研究申请的可接受限度• 草药原料药和制剂中基因毒性杂质评估指南FDA 和 EMA 指南的比较相似点不同点推荐的鉴定和认证潜在遗传性杂质的方法相同 推荐的处理遗传毒性和致癌性杂质的方法相同FDA 指南包含致癌性杂质TTC 设定为 1.5 μg/天指南允许的 14 天内用药的 TTC 水平为 120 μg , 而非仅针对单次用药临床试验中短期暴露的 TTC 更高FDA 指南不允许根据现售药品的短期暴露情况而 提高 TTC ICH M7【基因毒性杂质的控制策略】具有阳性致癌数据的诱变杂质(第1类)---计算可接受摄入量( AI ): • M7 Addendum 中列出的 15 种化合物中有 10 个为该计算方法计算 • Carcinogenicity Potency Database (CPDB )中列明了 1574 种致癌物质的 TD50 值毒理学关注门槛---TTC 法(第 2/3 类): • ICHM7 主要讨论的方法,主要针对第 2/3 类基因毒性杂质,比如低级磺酸酯类等。
基因毒性杂质培训PPT演示幻灯片

32
甲磺酸伊马替尼中可能含有的基因毒性杂质
33
伊马胺:
甲磺酸伊马替尼起始原料合成工艺
伊马酸:
34
甲磺酸伊马替尼合成工艺
35
米力农中可能含有的基因毒性杂质
36
米力农起始原料合成工艺
米力农起始原料有4-甲基吡啶、乙酰氯、原甲酸三乙酯以及氰乙酰胺,目前没有这几个起始原料的合成工艺。
62
布洛芬合成路线
63
布洛芬中具有结构警示的杂质
3-氯-2,2-二甲基-1-丙醇
64
布洛芬中基因毒性杂质的讨论
2-氯丙酸 3-氯-2,2-二甲基-1-丙醇 1,3-二氯-2,2-二甲基丙烷
对甲苯磺酸季戊酯(布洛芬):
苯:溶剂石油醚可能含有苯
65
右旋布洛芬中可能含有的基因毒性杂质
66
右旋布洛芬中合成路线
27
醋酸阿比特龙中可能含有的基因毒性杂质
28
醋酸阿比特龙加拿大缺陷信1/1(2018.5)
29
Continued!
30
醋酸阿比特龙起始原料合成工艺
3-吡啶硼酸合成工艺: 31
醋酸阿比特龙合成工艺
Mesityl oxide is a by-product which is originated from the aldol condensation of acetone to give diacetone alcohol 丙酮缩合成二丙酮醇,二丙酮醇脱水生成异亚丙基丙 酮 (2ppm):
23
甲溴后马托品起始原料扁桃酸的合成路线
24
甲溴后马托品起始原料托品醇的合成路线 见前述!
25
甲溴后马托品的合成路线
基因毒性杂质(genotoxic

第十页,共四十四页。
11 第十一页,共四十四页。
二、无足够实验依据的阈值 没有足够的(实验性的)证据(zhèngjù)来支持阈值界
定的基因毒性杂质的可接受剂量评价应该包括药 学和毒理学的评价。一般来说,如果不可能避免 毒性,那么药学的评价措施应该以尽可能低的控 制水平为指导。
12 第十二页,共四十四页。
EMA对基因毒性杂质的指导要求
判断是否为基因毒性杂质 决策树 Q&A
3 第三页,共四十四页。
参考 法规 (cānkǎo)
EMA:2006年率先颁布《基因毒性杂质限度指南》,于2007 年1月1日证实实施。该指南为限制活性物质中的基因毒性杂质提
供了解决问题的框架和具体做法
ICH:2006年,Q3A(R2)step4 vision“新原料药中的杂质” FDA:2008年12月,Guidance for industry-Genotoxic and
DNA都有潜在的破坏性,这种破坏可能导致肿瘤的产生。但不能说 “不存在明显的阀值,或是任何的摄入水平都具有致癌的风 险”。
新药合成、原料纯化、储存运输(与包装物接触)等过程都 可能产生基因毒性杂质
5
第五页,共四十四页。
可接受 风险的摄入量 (jiēshòu)
对于那些可以与DNA进行反应的化合物,由于在 较低剂量时机体自身保护机制可以有效的运行, 按照摄入量由高到低所造成的影响进行线性推断 是很困难的。目前,对于一个给定诱变剂,很难 从实验方面证实它的基因毒性存在一个阈值。
能被理解为绝对无风险的保障。
8 第八页,共四十四页。
TTC
意思是:假如有一个基因毒性杂质,并且我们对 它的毒性大小不了解,如果它的每日摄入量低于 TTC值,那么,该基因毒性杂质的致癌风险将不 会高于100000分之一的概率。
遗传毒性及机制

VS
某些遗传毒性物质如某些化学物质、 辐射等,可能引起DNA突变或染色体 异常,导致基因缺陷或缺失,从而引 发遗传疾病,如唐氏综合征、威廉姆 斯综合征等。
05 遗传毒性物质暴露途径与 风险评估
暴露途径
吸入
通过空气吸入遗传毒性物质是 最常见的暴露途径,如吸入苯
、甲醛等有害气体。
食入
摄入含有遗传毒性物质的食物 或饮用水,如摄入农药残留、 重金属超标的食品。
DNA损伤与修复
DNA损伤
物理、化学、生物因素引 起的DNA损伤。
DNA修复
细胞内DNA修复机制对损 伤进行修复。
DNA突变
DNA损伤未被修复而导致 的基因突变。
表观遗传学改变
DNA甲基化
DNA序列中特定位置的甲基基团添加或去除。
甲基化调控
甲基化影响基因表达,调控细胞功能。
表观遗传修饰
除甲基化外的其他表观遗传修饰,如组蛋白 乙酰化、磷酸化等。
皮肤接触
直接或间接接触含有遗传毒性 物质的物品或环境,如接触有 毒化学物质或放射性物质。
母婴传递
遗传毒性物质可通过胎盘或哺 乳传递给胎儿或婴儿。
风险评估方法
暴露量评估
对个体或群体接触遗传毒性物质 的量进行定量评估,包括吸入量、 食入量、皮肤接触量等。
健康影响评估
根据暴露量评估结果,结合毒理 学和流行病学数据,评估遗传毒 性物质对个体或群体的健康影响。
3
通过遗传毒性研究,可以发现潜在的致突变物质, 为新药研发接遗传毒性物质
致癌物质
致癌物质可以与DNA结合,导致基因突变,进而引发癌症。常见 的致癌物质包括多环芳烃、芳香胺、亚硝胺等。
诱变剂
诱变剂能够诱导基因突变,增加后代发生遗传性疾病的风险。常见 的诱变剂包括烷化剂、碱基类似物等。
基因毒性杂质-基毒、重金属概要

遗传毒性杂质遗传毒性:泛指各种因素(物理、化学因素)与细胞或生物体的遗传物质发生作用而产生的毒性。
1、致突变性:与DNA相互作用产生直接潜在的影响,使基因突变(bacteria reverse mutation(Ames)试验)2、致癌性:具有致癌可能或倾向(需要长期研究!)3、警示结构特征:一些特殊的结构单元具有与遗传物质发生化学反应的能力,会诱导基因突变或者导致染色体重排或断裂,具有潜在的致癌风险。
遗传毒性物质:在很低的浓度下即可诱导基因突变以及染色体的断裂和重排,因此具有潜在的致癌性。
EMA通告(1)、具体事项:1、哪些品种中会出现甲磺酸酯(或甲磺酸烷基酯)。
特别是甲磺酸盐等形式的API或其合成中用到甲磺酸的API,甲磺酸烷基酯-甲磺酸甲酯、乙酯、其它低级醇酯,应认定为潜在杂质。
2、羟乙基磺酸盐、苯磺酸盐、对甲苯磺酸盐的API。
应说明类似物质磺酸烷基酯或芳基酯污染的危险。
3、限度要求:无其它毒性数据时,这些高风险杂质应依据TTC设定限度。
1.5μg÷以g为单位的最大日剂量得ppm限度。
4、法律依据:EP专论要求凡以甲磺酸盐和羟乙基磺酸盐形式存在的API,均应在其生产过程中采取以下安全措施:必须对生产工艺进行评估以确定家磺酸烷基酯(羟乙基磺酸烷基酯)形成的可能,特别是反应溶媒含低级醇的时候,很可能会出现这些杂质。
必需时需对生产工艺进行验证以说明在成品中未检出这类杂质。
(2)、落实措施:1、API生产是否涉及在甲磺酸(羟乙基磺酸盐、苯磺酸盐、对甲苯磺酸等低分子量磺酸)或相应酰氯存在下,使用甲醇、乙醇、正丙醇、异丙醇等低级脂肪醇(如甲醇、乙醇、正丙醇、异丙醇等)。
2、对相应酯形成的可能性是否降到最低。
3、是否有有效的清除精制步骤。
设备清洗-是否设计的低级脂肪醇的使用(方法,TTC限度)?起始物料(低分子量磺酸盐或酰氯)中是否控制了其低级脂肪醇酯(方法,TTC限度)?当被磺酸酯或相关物质污染的磺酸用于API合成时能否保证其中潜在的遗传毒性杂质不超过TTC?应考虑各种烷基或芳基磺酸酯杂质累积的风险。
