第四章 酰化反应
酰化反应原理与实例解析

第四章酰化技术本章教学设计工作任务通过本章的学习及本课程实训,完成以下三个方面的工作任务:1、围绕典型产品的生产过程,完成以羧酸、羧酸酯为酰化剂制备酰胺类产品;2、围绕典型药品生产过程,完成以酸酐、酰氯为酰化剂生产酰胺类产品;3、围绕典型药物的生产过程,完成用羧酸法、酯交换法、酸酐法、酰氯法生产酯类产品。
学习目标1、掌握羧酸、羧酸酯、酸酐、酰氯酰化剂的特点、适用范围、使用条件及其N-酰化、酯化中的应用;2、掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法;3、掌握生产中操作及注意事项;4、掌握Friedel-Crafts酰化反应的基本原理、影响因素以及在药物合成中的应用,在生产中的应用及注意事项5、理解Hoesch反应、Gattermann反应、Vilsmeier反应的用途、适用条件及在药物合成中的应用;6、掌握活性亚甲基化合物α位C-酰化的原理、使用条件及在药物合成中的应用;7、了解新型酰化剂及其在医药科研、生产中的新技术与应用学时安排课堂教学10学时现场教学6学时实训项目项目一:对氯苯甲酰苯甲酸的制备项目二:扑热息痛的制备项目三:草酸二乙酯的制备学习目标● 掌握羧酸酰化剂、羧酸酯酰化剂的特点、适用范围、使用条件及其N-酰化中的应用; ● 掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法。
● 掌握生产中操作及注意事项● 了解新型酰化剂及其在医药科研、生产中的新技术与应用第四章 酰化技术第一节 概述一、酰化反应 1. 概念酰化反应就是指有机物分子中与氧、氮、碳、硫等原子相连的氢被酰基取代的反应。
酰基 就是指从含氧的有机酸、无机酸或磺酸等分子中脱去羟基后所剩余的基团。
2. 反应通式RZOR SOHZ(式中RCOZ 为酰化剂,Z 代表X,OCOR,OH,OR ˊ,NHR ″等;SH 为被酰化物,S 代表R ˊO 、R ″、Ar 等。
)二、常用酰化剂及其活性★1.常用酰化剂:羧酸、羧酸酯、酸酐、酰氯等酰化剂的活性规律:当酰化剂(RCOZ)中R 基相同时,其酰化能力随Z —的离去能力增大而增加(即酰化剂的酰化能力随离去基团的稳定性增加而增大)★常用酰化试剂的酰化能力强弱顺序:酰氯 >酸酐 > 羧酸酯 > 羧酸 > 酰胺三、酰化反应在化学制药中的应用永久性酰化 制备含有某些官能团的药物 保护性酰化第二节 N-酰化常用酰化剂:羧酸酰化剂、羧酸酯酰化剂、酸酐酰化剂与酰氯酰化剂 一、羧酸酰化剂 1、反应过程R C NR'R''O R C L O NR'R''R C LO R'R''NHH HL_★2、适用对象 羧酸就是弱的酰化试剂,一般适用于酰化活性较强的胺类。
酰化反应-碳原子上的酰化反应

3. 熟悉羰基α 位碳酰化反应的相关内容,掌握Claisen
反应和Dieckmann反应的特点和应用 (重点) 。
碳原子上的酰化反应
被酰化物 (R-H)
酰化剂 (R1CO-)
制备醛、酮 (RCOR1)
按碳原子 的类型分 按碳原子 的类型分
不饱和碳原子的酰化
饱和碳原子的酰化
芳烃(重点)、烯烃的碳酰化
四 个 酮 酸 酯 的 混 合 物
(2)常用的酯缩合形式
(a) 含活泼氢相同羧酸酯之间的缩合,制备得到单一 的β-酮酸酯产物。
(b) 含活泼氢的羧酸酯与不含活泼氢的羧酸酯之间 的缩合,制备得到单一的β-酮酸酯产物
常用的不含活泼氢的羧酸酯: 甲酸酯 (HCO-OR)、 苯甲酸酯 (PhCO-OR)、 草酸酯 (ROOC-COOR)、 碳酸酯 (RO-CO-OR)
应用实例
2-氯苯乙酮 (氯喘通的合成中间体)的制备
(氯喘通)
2. Claisen反应 (重点)
Claisen 反应:羧酸酯与另一分子含-活泼氢的酯进
行缩合得到β-酮酸酯的反应。
(1)同时含两个活泼氢不同酯之间的缩合
含有两个活泼氢的酯之间的缩合理论上得到四个β酮酸酯的混合物,在实际合成中没有应用价值。
发生类似反应。
应用
二、烯烃的碳酰化反应(自学)
三、羰基α位的碳酰化反应
1. 活性亚甲基化合物的碳酰化 -二酮类、 -羰基酸酯类、丙二酸酯类、丙二腈类、 氰基乙酸酯类等活性亚甲基化合物在碱催化下与酰化
剂 (一般多用酰氯)反应,很容易发生碳酰化反应。
活性亚甲基的化合物的碳酰化反应可以用于合成新的 二羰基化合物。
对比Freidel-Crafts烷基化反应,进一步掌握酰基化反应的 特点与影响因素。 (2) 间接的亲电酰化反应 掌握 Hoesch反应、 Vilsmeier-Haack反应和Reimer-
药物合成反应— 酰化反应

1. 羧酸为酰化剂
应用
DCC为催化剂的酰化反应 DCC:增强羧酸的酰化能力
2. 羧酸酯为酰化剂(酯的氨解反应)
应用 1)羧酸甲酯、乙酯的应用
2)活性酯的应用
3)在实际药物合成中的应用
3. 酸酐为酰化剂 机理
4. 酰氯为酰化剂 机理
应用 缚酸剂:(1)有机碱
三乙胺、吡啶等有机碱可中和反应中产生的HCl; 以吡啶、N,N-二甲氨基吡啶类为缚酸剂时,在中和产生的酸的同 时,还可以与酰氯生成络合物,起催化作用。
酰化反应
Acylation Reaction
第一节 概述
案例——神秘的阿司匹林(Aspirin)
➢ 镇痛 ➢ 解热 ➢ 消炎 ➢ 抗风湿 ➢ 对血小板聚集有抑制作用
O
COOH
CH3C
H+
+
O
OH
CH3C
O
被酰化物
酰化试剂
COOH
+
O CCH3 O
O CH3C OH
酰化反应:在有机物分子结构中的C、N、O或S等原子
(有机酸)对甲苯磺酸、萘磺酸
作用形式:与羧酸的羰基形成烊盐,增强羰基碳原子的正电性
Lewis酸 BF3、AlCl3、FeCl3、TiCl4 作用形式:与羧酸的羰基O形成络合物,增强羰基碳原子的正电性
副反应少\收率高\条件温和
DCC (P54)——良好的酯化缩合剂
作用形式:增强羧酸的活性 特点:条件温和、收率高、立体选择性强、价格贵
上导入酰基的反应。
1. 酰基是某些药物重要的药效基团; 2. 也是药物合成中官能团转换的重要合成手段; 3. 在涉及-OH、氨基等基团的保护时,将其酰化也是一种常见 的保护方法。
有机化学酰化反应

R-C
ALCL4
R-C
+ ALCL4
F-C反应的影响因素
(1)酰化剂的影响:酰卤﹥酸酐﹥羧酸、酯
O C 的 α位 为 叔 碳 时 发 生 烃 化 反 应
H3C
AlCl3 Cl
H3C H3C
AlCl3 O Cl H3C
O
CH3
C
CO2(碳酸酐)
CO(甲酸酐)
(3)酰氯
O CH3-C-Cl , O C-Cl , H 3C SO2Cl , O Cl-C-Cl , Cl N N
Cl N Cl
(4)羧酸酯
ClCH2COOC2H5, CH3COCH2COOC2H5
O , H C N CH3 CH3
(5)酰胺
O H2N C NH2
(6)其他:如双乙烯酮、二硫化碳
醇或酚分子中的羟基氢原子被酰基取代 而生成酯的反应,叫做O-酰化反应,也叫做 酯化反应。 酰化试剂:羧酸; 酸酐; 酯(酯交换)
8.3.1 用羧酸的酯化
反应历程 质子酸催化下的双分子历程
O R-C-OH + H+ OH R-C-OH
R'OH
OH R-C-OH + H O R'
O OH OH + -H2O -H 互变异构 R-C-OR' R-C-OR' R-C-OR' OH2
NHCOCH3 R
• 羧酸作酰化剂 DCC脱水法(二环己基碳化二亚胺)
O O H O R C O C N O R C O R' + N H O C N H NH + R' O H
酰化反应原理与实例解析

第四章酰化技术本章教学设计工作任务通过本章的学习及本课程实训,完成以下三个方面的工作任务:1.围绕典型产品的生产过程,完成以羧酸、羧酸酯为酰化剂制备酰胺类产品;2.围绕典型药品生产过程,完成以酸酐、酰氯为酰化剂生产酰胺类产品;3.围绕典型药物的生产过程,完成用羧酸法、酯交换法、酸酐法、酰氯法生产酯类产品;学习目标1.掌握羧酸、羧酸酯、酸酐、酰氯酰化剂的特点、适用范围、使用条件及其N-酰化、酯化中的应用;2.掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法;3.掌握生产中操作及注意事项;4.掌握Friedel-Crafts酰化反应的基本原理、影响因素以及在药物合成中的应用,在生产中的应用及注意事项;5.理解Hoesch反应、Gattermann反应、Vilsmeier反应的用途、适用条件及在药物合成中的应用;6.掌握活性亚甲基化合物α位C-酰化的原理、使用条件及在药物合成中的应用;7.了解新型酰化剂及其在医药科研、生产中的新技术与应用学时安排课堂教学 10学时现场教学 6学时实训项目项目一:对氯苯甲酰苯甲酸的制备项目二:扑热息痛的制备项目三:草酸二乙酯的制备学习目标掌握羧酸酰化剂、羧酸酯酰化剂的特点、适用范围、使用条件及其N-酰化中的应用;掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法;掌握生产中操作及注意事项了解新型酰化剂及其在医药科研、生产中的新技术与应用第四章酰化技术第一节概述一、酰化反应1.概念酰化反应是指有机物分子中与氧、氮、碳、硫等原子相连的氢被酰基取代的反应;酰基是指从含氧的有机酸、无机酸或磺酸等分子中脱去羟基后所剩余的基团;2.反应通式式中RCOZ为酰化剂,Z代表X,OCOR,OH,ORˊ,NHR″等;SH为被酰化物,S代表RˊO 、R″、Ar等;二、常用酰化剂及其活性★1.常用酰化剂:羧酸、羧酸酯、酸酐、酰氯等酰化剂的活性规律:当酰化剂RCOZ中R 基相同时,其酰化能力随Z—的离去能力增大而增加即酰化剂的酰化能力随离去基团的稳定性增加而增大★常用酰化试剂的酰化能力强弱顺序:酰氯>酸酐>羧酸酯>羧酸>酰胺三、酰化反应在化学制药中的应用永久性酰化制备含有某些官能团的药物保护性酰化第二节 N-酰化常用酰化剂:羧酸酰化剂、羧酸酯酰化剂、酸酐酰化剂和酰氯酰化剂一、羧酸酰化剂1.反应过程★2.适用对象羧酸是弱的酰化试剂,一般适用于酰化活性较强的胺类;3.反应条件及催化剂1反应条件酸过量为了加速反应,并使反应向生成酰胺的方向移动,必须使反应物之一过量,通常是酸过量;脱水可用以下方法脱水高温熔融脱水酰化法适用于稳定铵盐的脱水,例如苯甲酸和苯胺加热到225℃进行脱水,可制得N-苯甲酰苯胺;反应精馏脱水法主要用于乙酸与芳胺的N-酰化,例如,将乙酸和苯胺加热至沸腾,用蒸馏法先蒸出含水乙酸,然后减压蒸出多余的乙酸,即可得N-乙酰苯胺;溶剂共沸脱水法主要用于甲酸沸点100.8℃与芳胺的N-酰化反应;以上方法大多在较高温度下进行,因此,不适合热敏性酸或胺2催化剂强酸作催化剂适用于活性较强的胺类的酰化缩合剂作催化剂适用于活性弱的胺类、热敏性的酸或胺类常用的此类缩合剂有★DCC Dicyclohexylcarbodiimide,二环己基碳二亚胺DIC Diisopropyl Carbodiimide,二异丙基碳二亚胺等;DCC是一个良好的脱水剂,以DCC作脱水剂用羧酸直接酰化,条件温和,收率高,在复杂结构的酰胺、半合成抗生素及多肽的合成中有较多的应用;二、羧酸酯酰化剂反应过程1.反应物活性1对于羧酸酯RCOORˊ位阻若酰基中R空间位阻大,则活性小电性有吸电子取代基则活性高,易酰化;离去基团的稳定性离去基团越稳定,则活性越高2对于胺类胺的碱性碱性越强,活性越高,空间位阻空间位阻越小,活性越高3羧酸二酯与二胺类化合物,如果反应后能得到稳定的六元环,则反应易发生;如哌拉西林等青霉素药物中间体乙基-2,3-哌嗪二酮6催眠药苯巴比妥Phenobarbital,7等的合成;2.催化剂1强碱作催化剂由于酯的活性较弱因此在反应中常用碱作为催化剂脱掉质子,以增加胺的亲核性;用的碱性催化剂有醇钠或更强的碱,如NaNH2、n-BuLi、LiAlH4、Na等2反应物胺作催化剂过量的反应物胺也可起催化作用;3催化剂的选择与反应物的活性有关反应物活性越高,则可选用较弱的碱催化;反之,则需用较强的碱催化;4在此类酰化反应中还可加入BBr3来提高酰化的收率;3.活性酯制备活性酯时主要考虑增加酯分子中离去基团的稳定性,以促使其离去★4.生产实例头孢噻肟酸的合成将7—ACA 、水、丙酮加入反应体系中,降温,加入三乙胺、活性酯,反应至7-ACA基本消失后,加有机酸酸,有头孢噻肟酸沉淀生成;操作注意事项1水和丙酮的配比2三乙胺用量及滴加速度3活性酯质量4终点检测5有机酸的种类及用量6温度控制流程框图学习目标 掌握酸酐酰化剂、酰氯酰化剂的特点、适用范围、使用条件及其N-酰化中的应用; 掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法; 掌握生产中操作及注意事项了解新型酰化剂及其在医药科研、生产中的新技术与应用第二节 N-酰化三、酸酐酰化剂1.反应过程★2.反应条件与催化剂酸酐 用量 一般略高于理论量的5~10%不可逆,最常用的酸酐是乙酸酐,通常在20~90℃可顺利进行反应活性高溶剂不另加溶剂 被酰化的胺和酰化产物熔点不太高时非水惰性有机溶剂 被酰化的胺和酰化产物熔点较高时降温 酯化终点检结晶 过滤 产品头孢噻肟酸7-ACA水 丙酮三乙胺 活性酯有机酸注: TLC 检测终点水被酰化的胺和酰化产物易溶于水乙酰化速度比乙酸酐的水解速度快★3.应用脂肪族酸酐主要用于较难酰化的胺类酸酐酰化能力强环状的酸酐为酰化剂时,制得二酰亚胺类化合物高温4.混合酸酐★特点反应活性更强应用范围更广位阻大或离去基团离去能力强制备混合酸酐由某些位阻大的羧酸与一些试剂作用制得★5.生产实例1头孢拉定的生产头孢拉定的合成是以双氢苯甘氨酸DHPC为原料,成盐后经两次缩合制成混酐,再与7-ADCA进行酰化反应,而后经水解、中和、结晶和精制等过程制得的;反应过程2对硝基―α―乙酰氨基苯乙酮氯霉素中间体的制备反应过程操作过程向乙酰化反应罐中加入母液加入乙酸酐,搅拌均匀后,先慢后快地加入38%~40%的乙酸钠溶液;反应,测定反应终点终点到达后,冷却析出晶体,过滤、洗涤甩干称重交缩合岗位滤液回收乙酸钠终点测定取少量反应液,过滤,往滤液中加入碳酸氢钠溶液中和至碱性,在40℃左右加热后放置15min,滤液澄清不显红色示终点到达,若滤液显红色或混浊,应适当补加乙酸酐和乙酸钠溶液,继续反应;★反应条件及影响因素PH值PH过低,在酸的影响下反应物会进一步环合,PH过高,不仅游离的氨基酮会发生双分子缩合,而且乙酰化物也会发生双分子缩合;加料次序和加乙酸钠的速度四、酰氯酰化剂酰氯性质活泼,很容易与胺反应生成酰胺反应为不可逆反应过程1.反应条件1加入碱性试剂以中和生成的氯化氢防止氯化氢与胺反应成铵盐中和生成的氯化氢可采用三种形式使用过量的胺反应加入有机碱同时起到催化作用加入无机碱2反应采用的溶剂常常根据所用的酰化试剂而定对于高级的脂肪酰氯由于其亲水性差,而且容易分解,应在无水有机溶剂如氯仿、乙酸、苯、甲苯、乙醚、二氯乙烷以及吡啶等中进行;吡啶既可做溶剂,又可中和氯化氢,还能促进反应,但由于其毒性大,在工业上应尽量避免使用;对于乙酰氯等低级的脂肪酰氯由于其反应速度快,反应可以在水中进行;为了减少酰氯水解的副反应,常在滴加酰氯的同时,不断滴加氢氧化钠溶液、碳酸钠溶液或固体碳酸钠,始终控制反应体系的pH值在7~8左右对于芳酰氯芳酰氯的活性比低级的脂肪酰氯稍差,反应温度需要高一些,但一般不易水解,可以在强碱性水介质中进行反应;★2.应用活性低的氨基的酰化位阻大的胺以及热敏性物质的酰化3.生产实例在干燥的反应器中加入DMA、羟基-EPCP,溶解后冷却,向其中加入7-ATCA的DMA溶液,反应得头孢哌酮酸;向上述反应液中加入碳酸氢钠,缓慢升温反应;加盐酸调PH值,结晶得头孢哌酮钠;★4.生产操作控制方案进料流量控制方案反应温度与夹套温度串接控制方案反应温度与冷却剂流量串接控制方案改变冷却剂控制温度方案学习目标掌握Friedel-Crafts酰化反应的基本原理、影响因素以及在药物合成中的应用;理解Hoesch反应、Gattermann反应、Vilsmeier反应的用途、适用条件及在药物合成中的应用;掌握活性亚甲基化合物α位C-酰化的原理、使用条件及在药物合成中的应用;掌握主要反应在生产中的应用及注意事项一、芳烃的碳酰化酰化反应1基本原理★Friedel-Crafts酰化反应在三氯化铝或其他Lewis酸或质子酸催化下,酰化剂与芳烃发生芳环上的亲电取代,生成芳酮的反应;★注意事项①反应生成的酮和AlCl3以络合物的形式存在, AlCl3必须过量;酸酐酰化剂常用反应物摩尔数2倍以上的AlCl3催化;酰氯酰化剂常用反应物摩尔数1倍以上的AlCl3催化;②反应结束后,产物需经稀酸处理溶解铝盐,才能得到游离的酮;★2主要影响因素催化剂常用的催化剂为AlCl3、BF3、SnCl4、ZnCl2等Lewis酸以及液体HF、多聚磷酸、H2SO4、H3BO3等质子酸;被酰化物结构当芳环上含有给电子基时,反应容易进行;因酰基的立体位阻比较大,所以酰基主要进入给电子基的对位,对位被占,才进入邻位;溶剂选择溶剂时,要注意溶剂对催化剂活性及酰基引入的位置也有影响:用过量的低沸点芳烃作溶剂回收用过量的酰化剂作溶剂另外加入适当的溶剂反应组分均不是液体时3酰化剂及其应用①酸酐酰化剂常用的酸酐多数为二元酸酐,如丁二酸酐、顺丁烯二酸酐、邻苯二甲酸酐及它们的衍生物;如苯与丁二酸酐反应最后可制得奈满酮;②酰卤酰化剂酰卤中最常用的是酰氯③羧酸酰化剂羧酸可以直接作酰化剂,且当羧酸的烃基中有芳基取代时,可以进行分子内酰化得芳酮衍生物;其反应难易与形成环的大小有关,一般由易到难的顺序是:六元环>五元环>七元环; 2.Hoesch反应★1概念:腈类化合物与氯化氢在Lewis酸ZnCl2催化下,与含羟基或烷氧基的芳烃进行反应,可生成相应的酮亚胺,再经水解得含羟基或烷氧基的芳香酮——是合成酚或酚醚类芳酮的一个重要方法;2反应过程★3应用:适用于由间苯二酚、间苯三酚、酚醚以及某些杂环;腈化物中的R可以是芳基、烷基、卤代烃基,其中以卤代烃基腈活性最强,可用于烷基苯、卤苯等活性低的芳环的酰化;催化剂一般用无水氯化锌,有时也用三氯化铝、三氯化铁等;溶剂以无水乙醚最好,冰醋酸、氯仿-乙醚、丙酮、氯苯等也可使用;反应在低温下进行; 3.Gattermann及Gattermann-Koch反应了解1Gattermann反应改用无水ZnCN2和HCl来代替氰化氢和氯化氢,可用于烷基苯、酚、酚醚及某些杂环如吡咯、吲哚等的甲酰化;2Gattermann-Koch反应用AlCl3和氯化亚酮为催化剂,在芳烃中通入一氧化碳和氯化氢,使芳烃上引入甲酰基;该反应主要用于烷基苯、烷基联苯等具有推电子烷基的芳醛的合成工业制法; 4.Vilsmeier反应取代的甲酰胺在三氯氧磷作用下,在芳环上引入甲酰基的反应1应用:用于活泼的芳环及某些多π电子的芳杂环2催化剂 POCl3及COCl2、ZnCl2、SOCl2、Ac2O、COCl2等;氮取代甲酰胺可以是单取代或双取代烷基、芳烃基衍生物、N-甲基甲酰基苯胺、N-甲酰基哌啶等;3改进的Vilsmeier反应可制备某些芳酮和杂环芳酮类;二、活性亚甲基化合物α-位C-酰化1反应条件常用强碱如NaOR、NaH、NaNH2等作催化剂,可用镁在乙醇中加少量的CCl4为活化剂与活性亚甲基化合物反应,生成乙氧基镁盐EtOMg+C—HCOOEt2,再与酰化剂反应;常用酰氯与酸酐为酰化试剂,羧酸、酰基咪唑等也有应用;2应用制备β-二酮、β-酮酸酯、结构特殊的酮等类化合物★三、应用实例对氯苯甲酰苯甲酸的制备反应过程操作过程1.付—克酰化反应1向反应器中迅速加入氯苯和无水三氯化铝,2开动搅拌,油浴加热至70o C,再缓慢加入邻苯二甲酸酐③,加料温度控制在75~80o C之间④,3加完后,继续在此温度下反应小时,得透明红棕色粘稠液体,停止反应,自然冷却;2.提取与精制1酸化2碱化3酸化结晶★注意事项①反应中有氯化氢气体逸出,需在球形冷凝器顶端连接气体吸收装置②邻苯二甲酸酐质量对收率影响较大,应采用熔点为~的原料;③邻苯二甲酸酐加入速度应控制,过快反应剧烈,温度不易控制,大量氯化氢气体逸出,有冲料危险;④反应应控制在75~80o C之间,过低反应不完全,太高反应物容易分解, 影响产品质量和收率;⑤酸化时酸度应控制在pH3以下,否则可能有氢氧化铝一起析出;学习目标掌握羧酸、羧酸酯、酸酐、酰氯酰化剂的特点、适用范围、使用条件及其在酯化、中的应用掌握生产中操作及注意事项了解新型酰化剂及其在医药科研、生产中的新技术与应用第四节酯化反应一、羧酸法1.基本原理可逆平衡反应,反应式如下:①提高反应物活性,设法提高平衡常数;②打破平衡;★2.影响因素1醇和羧酸结构电性因素、位阻因素;醇:伯醇〉仲醇〉叔醇〉苄醇、烯丙醇〉酚羧酸:脂肪族羧酸〉芳酸;脂肪酸:甲酸活性高,侧链越多,反应越困难;芳酸:羧基的邻位连有给电子基活性降低;羧基的对位有吸电子基时反应活性相对增大;HOCH CH NEt Xyl2N COOCH 2CH 2NEt 2COOH O 2N (97.6%)2配料比及操作特点增大反应物醇或酸的配比,同时不断将反应生成的水或酯从反应系统中除去;除去水的方法: ①加脱水剂,如浓硫酸、无水氯化钙、无水硫酸酮、无水硫酸铝;②蒸馏除水,如直接加热、导入热的惰性气体、减压蒸馏等;③共沸脱水对溶剂的要求:a 共沸点应低于100℃;b 共沸物中含水量尽可能高;c 溶剂和水的溶解度应尽可能小;常用的有机溶剂有苯、甲苯、二甲苯等;优点:产品纯度好、收率高,不用回收催化剂;3温度与催化剂①质子酸如浓硫酸、四氟硼酸、氯化氢气体、磷酸等无机酸及苯磺酸、对甲苯磺酸等有机酸;Cl OCH 2COOH Cl OCH 2COOCH 2CH 2NMe 2HCl(gas)Cl OCH 2COOCH 2CH 2NMe 2②强酸型离子交换树脂优点:反应速度快,反应条件温和,选择性好,收率高;产物后处理简单,无需中和及水洗;树脂可循环使用,并可连续化生产;对设备无腐蚀,废水排放少等;③脱水剂如DCC,多用于酸、醇的价格较高,或具有敏感官能团的某些结构复杂的酯及酰胺等化合物的合成; N CH 3O CH 2COOH CH 3H (CH )COH DCC N CH 3OCH 2COOC(CH 3)3CH 3H (吲哚美锌钠中间体)★3.选择性酰化两种方法:一是采用基团保护;二是通过选择适当的酰化剂、催化剂、适宜的反应条件;二、酯交换法1.基本原理2.影响因素1反应物①亲核性:烷氧基RˊˊO—RˊO—②沸点:RˊO H 〉RˊˊOH2催化剂酸或碱酸催化剂:硫酸、对甲苯磺酸、等质子酸,或Lewis酸碱催化剂:醇钠或其他的醇盐,或胺类;取决于醇的性质注意:①无水条件;②其他醇生成的酯类产品不宜在乙醇中进行重结晶,其他酸生成的酯类产品不宜在乙酸中进行重结晶;3.应用反应条件温和,适合于热敏性或反应活性较小的羧酸,以及溶解度较小或结构复杂的醇等化合物;三、酸酐法★1.影响因素1催化剂可用酸或碱催化以加速反应酸:硫酸、氯化锌、三氟化硼、对甲苯磺酸等碱:吡啶、三乙胺、喹啉、等胺类、无水乙酸钠;选用哪种催化剂,要根据羟基的亲核性、位阻的大小及反应条件;2溶剂反应比较平稳,可不用溶剂,或用与酸酐对应的羧酸为溶剂;若反应激烈,不易控制,可加入惰性溶剂;常用苯、甲苯、硝基苯、石油醚等;严格控制反应体系中的水分2.应用用于反应困难位阻大的醇以及酚羟基的酰化;混合酸酐的开发与利用:★四、生产实例阿司匹林的生产反应过程操作过程在干燥的反应器中,依次加入水杨、醋酐,开动搅拌,加浓硫酸打开冷却水,逐渐加热到70℃,在70-75℃反应半小时取样测定反应完成后,将反应液倾入冷水中继续缓缓搅拌,直至乙酰水杨酸全部析出抽滤,用水洗涤、压干,即得粗品★反应条件及影响因素酰化反应严格无水温度控制醋酐用量★工艺流程框图★工艺流程图学习目标通过对典型药物的生产过程的分析,熟悉药品生产的一般过程;掌握分析、解决问题的思路与方法;熟悉酰化技术在药物合成中的地位;酰化技术典型案例分析案例一阿司匹林的生产反应过程工艺流程框图工艺流程图★分析:1.阿司匹林的生产应用的是哪种酰化技术反应时能否用其他的酰化剂为什么2.阿司匹林制备反应会发生哪些副反应产生哪些副产物3.阿司匹林制备反应可采用什么方法检测反应终点4.本实验所用的仪器、量具为何干燥无水5.根据工艺流程简要描述阿司匹林的生产过程;6.比较结晶釜和酰化釜的异同;7.母液循环有何意义8.结晶釜上的“接真空”有何作用9.冷冻盐水和冷却水有何区别若所需温度更低,可选哪种冷却介质10.通过旋风分离器的产品为何要过筛11.结晶釜和酰化釜分别可选择什么样的搅拌器案例二头孢氨苄的生产反应过程操作过程1酯化、氧化将丙酮、吡啶、三氯乙醇吸入反应罐,加入青霉素G钾盐,搅拌,控制内温10℃,滴加三氯氧磷,加毕后反应1h,酯化结束;反应液转入氧化罐,冷却至内温0℃,滴加过氧乙酸与双氧水混合液,反应温度应不超过20℃,加毕反应2h;加水,继续搅拌30min,静置、过滤、洗涤、干燥,得S-氧化物;收率为80%;配料比青霉素G钾盐:三氯乙醇:三氯氧磷:吡啶:过氧乙酸=::::重量比2重排、扩环、氯化、醚化、水解、成盐将乙酸丁酯吸入反应罐,加入S-氧化物、磷酸、吡啶,搅拌回流3h,以薄层层析观察,无明显S-氧化物点存在即表示反应结束;减压回收部分乙酸丁酯,再经浓缩,得浓缩液;冷却,析出黄色结晶,过滤、洗涤、干燥,熔点125-127℃的经晶即为重排物;将重排物及二氯乙烷加入反应罐,搅拌使全溶,冷至内温-10℃,加入吡啶及五氯化磷,温度不超过-2℃;加毕后在-5℃反应2h,再降温至-15℃,缓缓加入甲醇进行醚化,加毕,在-10℃反应;然后加水,于室温水解30min,以1mol/L NaOH中和至PH为,静置,分取有机层,浓缩至一定量,加入对甲苯磺酸PTS,即得淡黄色结晶,冷却、过滤、洗涤、干燥,得7-ADCA 酯PTS盐;收率为65%-70%以S-氧化物计;配料比 S-氧化物:乙酸丁酯:磷酸:吡啶=:::重量比重排物:五氯化磷:甲醇:对甲苯磺酸=1:::重量比3酰化将7-ADCA酯PTS盐加入二氯乙烷中,加入碳酸氢钠饱和液使7-ADCA酯游离;分取有机层入反应罐,冷至内温0℃,加入NaHCO和苯甘氨酰氯盐酸盐,于0℃反应31h,15-20℃反应2h,反应过程中使PH为;反应结束过滤,有机层经薄膜浓缩后加入乙醚,析出酰化物,过滤、洗涤、干燥即得头孢酯酰化物;收率为60%;:苯甘氨酰氯盐酸盐:乙醚:二氯乙烷=1:1:1:配料比 7-ADCA酯PTS盐:NaHCO34:9重量比4水解将酰化物、甲酸加入反应罐使全溶,加入锌粉温度不超过50℃,加毕于50℃反应30min;冷至室温,过滤除去锌泥,洗涤,合并滤、洗液,浓缩、加水,用氨水调节PH为,加入乙腈即有结晶析出,再用乙醇精制一次,即得头孢氯苄;分析:1.从上述生产过程中找出有关酰化技术的操作过程,并说出在酰化操作中的注意事项;2.根据工艺过程画出生产流程图和流程框图;3.从生产操作及工艺的角度分析,制备7-ADCA酯PTS中间体的目的;4.本工艺中第一步酯化O-酰化用的酰化剂是什么酯化的目的有哪些其中吡啶的作用是什么-酰化中所用酰化剂是什么其特点有哪些6.指出本工艺中需要改进的地方,提出改进思路;7.实际生产过程中,为何原料配比与理论不一致8.本生产过程是以青霉素为原料,请以其他物质为原料,设计头孢氨苄的生产路线,并简要说明所设计中的注意事项;。
药物合成第四章酰化及缩合反应习答案

9、 Cl
CH3 O C COOH +
CH3
EtOH
H2SO4
CH3
Cl
O C COOEt
CH3
10、
CH3 (CH2)5COCl
AlCl3
ClCH2CH2Cl, 0 oC
CH3
CH3
CH3 O
11、
CH3 + C6H5NCHO
POCl3 90-95 oC
CHO
12、 O
CH3C
H2 O CC
OC2H5+ HO
O
H2 CH3C C C O
140 oC 4~5hr
13、
14、
OH
BCl3 Cl3CCN
H2O
OH COCCl3
三、1. 写出羧酸与醇反应生成酯的反应机理 (通式)。
HOR'
R C OH H R C OH R'OH R C OH
O
OH
OH
OR' R C OH
OH2
OH
R C OH
CH3 O + CH2=CH COOCH3 KOC(CH3)3
O CH3 O CH2CH2CHOCH3
9、
10、
O
O
+
H3PO4
O
Al(t-BuO)4
OH
O
11、
O
CH3 +
NO2 OH /H2O
CHO
O2N
O CH3
12、
O
> 2mol
Ph3P=CHCH3
O
H3CHC
CHCH3
13、
O
ClCH2CO2CH3 CH3ONa
药物合成反应 第四章 酰化反应

O CHCl2 H2O
CHO
Vilsmeier甲酰化反应 芳香化合物、杂环化合物及活泼烯烃化合物用二取代 甲酰胺及氧氯化磷处理得到醛类的反应称Vilsmeier甲酰化 反应。是芳香环的甲酰化反应最普通的方法。
POCl3 R1 R1 + ArCHO ArH + N C H NH R2 R2 O
机理
B: PhCOCl
CH3COCHCOOC2H5 COPh
PhCOOH + CH2
X -CN -H -CN
X DEPC/Et3N/DMF X PhCOCH Y r.t. Y
Y -COOC2H5 -NO2 -CN 收率 93.4% 85.5% 92.8% 96.8%
-COOC2H5 -COOC2H5
(2). 酮及羧酸衍生物的-位C-酰化 Claisen酯缩合反应 含有-氢的酯在醇钠等碱性缩合剂作用下发生缩合作 用,失去一分子醇得到酮酯的反应称为Claisen酯缩合反应。
N CH3.I
C O + ( CH2 )n O
n=5 (89%) n=11 (69%)
N O CH3
(3) 羧酸三硝基苯酯
O R''OH+ R-C-OH + Cl
O2N NO2
O R-C-OR''
O2N
O R C O
O2N NO2
难 于 分 离 ,所 以 三 种 物 质 一 起 加 入
O2N
酸酐为酰化剂
73%
COOH
CH3
+
H3C
C
CH3
OH
(CF3CO)2O
COOBu-t
混合酸酐的应用 ②羧酸-磺酸混合酸酐
第4章 烷基化反应和酰基化反应.

含活泼亚甲基氢的化合物如乙酰乙酸乙酯、丙二酸 二乙酯、2,4-戊二酮等与卤代烷的C-烷化反应可用于制 备其α-H被烃基取代的衍生物。
H C2H5ONa + H C COOC2H5
C4H9 C H COOC2H5
R'OR'OH
RHC O
CH2
[RCHCH2OR'] O-
RCHCH2OR' + R'OOH
高级脂肪醇能加成环氧乙烷生成高级脂肪醇聚氧乙烯醚型 非离子表面活性剂:
ROH + n H2C O CH2 RO (CH2CH2O )n H
高级脂肪酸也能加成环氧乙烷生成酯类聚氧乙烯型非离子表 面活性剂,是一种性能优良的乳化剂:
ROH + NaOH RO-Na+ + XAlk RO-Na+ + H2O ROAlk + NaX
在氢氧化钾和相转移催化剂聚乙二醇-400存在下,酚类与卤 代烷的反应非常顺利,如:
OH + CH3 I + KOH 聚乙二醇-
CH2Cl2,H2O
OCH3
+ KI + H2 O
用氯乙酸做烷基化剂可用于制备苯氧乙酸类的化合物。
O C
O Cl
<
H3C
C
Cl
4.4.1 用羧酸的N-酰化 用羧酸对胺类化合物进行酰化是合成酰胺的重要方法,反应有 水生成,是一个可逆反应,其酰化反应通式为:
R'NH2 + RCOOH R'NHCOR + H2O
化学反应中的酰化反应

化学反应中的酰化反应化学反应是我们日常生活中不可缺少的一部分,它不仅应用于我们周围的生活和工作中,也是科研领域中不可或缺的一个技术支撑。
而酰化反应则是其中的一个十分重要的反应类型。
本篇文章将介绍酰化反应的定义、机理、应用等方面的内容。
1. 酰化反应的定义酰化反应是一种有机合成反应,指的是酸酐(anhydrides)或酸卤(acyl halides)与醇(alcohol)或酚(phenol)等亲核试剂发生酰化反应。
其中,酸酐和酸卤均具有电子丰富的羰基(carbonyl)结构,容易被亲核试剂进行攻击,产生新的酯(ester)化合物。
2. 酰化反应的机理酰化反应的机理可分为两步:亲核试剂攻击和质子转移。
在第一步中,亲核试剂(如醇或酚)的亲核性中心(如羟基)攻击羰基碳原子,形成一个稳定的中间体:酸酐或酸卤与亲核试剂的加合物。
接着,在第二步中,质子转移将中间体中的酰基(acyl)基团从原来的酸酐或酸卤转移到了亲核试剂中,同时释放出质子(H+),生成酯化合物。
3. 酰化反应的应用酰化反应在有机合成领域中具有广泛的应用,尤其是在制备大分子化合物和药物研发中更是不可或缺。
例如,酰化反应被用于制备各种功能酯和酰胺(amides)等有机化合物,这些化合物在多种领域都有广泛的应用。
同时,酰化反应还可以被用作催化反应的催化剂。
除了有机合成领域外,酰化反应还在食品、香料、染料等领域中有应用。
例如,在香水制造过程中,酰化反应可以用于制备各种具有特殊香味的酯化合物。
4. 酰化反应的影响因素酰化反应的影响因素有很多,其中最为重要的因素是反应物的浓度和反应温度。
反应物浓度的影响是非常明显的。
当反应物浓度越高时,相同的酰化反应所需要的时间和反应温度就相对较低。
这是因为反应物浓度高,反应速度快,反应所需要的时间和温度就自然而然地降低了。
反应温度也是影响酰化反应的重要因素。
当反应温度较低时,由于分子运动较慢,分子之间的相对位置不稳定,酰化反应的过程会较为缓慢。
酰化反应

-
-
R带吸电子基团 利于进行反应;R带给电子不利于反应; R的体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进行; R为芳基时,由于芳基与N原子或O原子的共轭效应,使N原子或O原子 上的云密度降低而反应活性下降,所以RNH2>ArNH2;ROH>ArOH 。
10
概 述 催化
酸碱催化
碱催化作用是可以使较弱的亲核试剂H-Nu转化成亲核性较强的 亲核试剂Nu-,从而加速反应。 酸催化的作用是它可以使羰基质子化,转化成羰基碳上带有更 大正电性、更容易受亲核试剂进攻的基团,从而加速反应进行。
16
第一节 氧原子的酰化反应
一 醇的氧酰化
b.催化剂
(1)质子酸催化法: 常用浓硫酸,氯化氢气体,磺酸,四氟硼酸等
O R C OH H+ OH R C OH OH R C OH
1) 羧酸为酰化剂
各种质子酸都具有各自卑优点和缺点。
17
第一节 氧原子的酰化反应
一 醇的氧酰化
1) 羧酸为酰化剂
浓硫酸具有催化能力强、性质稳定、价廉等优势,其缺 点是有一定的氧化性、易发生磺化、脱水、脱羧等副反应, 所以一般不饱和酸、羟基酸、甲酸、草酸、丙酮酸等不宜采 用之。 无水氯化氢具有催化能力强、无氧化性、价廉等优势,其 缺点是易发生加成、卤代等副反应,另外对反应设备的有一 定腐蚀性和易对环境造成一定的污染。一般不饱和酸(醇)、 叔醇等不易采用之。 对甲苯磺酸具有浓硫酸的一切优点,且无氧化性,在有机 溶剂中的溶解度较大,不易发生磺化副反应等优点,尤其是在 使用共沸带水等反应条件时更为适用,但其缺点是价格比较贵, 一般用于复杂结构的酯的制备中。
O C X
当然还有(硫代)异氰酸酯[R-N=C=O(S)]等.
第四章酰化反应

RCOCl N
SH
Et3N
N
该活性酯(21)常用于合成大环内酯及β-内酰胺类化合 物,收率较高。
OH CH3 COOH HO O O O O
(21)/Ph3P/AcOH/THF
OH O
CH3 (75%)
O
O
O
4.活性酯及其应用 .
羧酸三硝基苯酯
COONa H3C ROH H3C CH3 H3C COOR Cl TNB H3C CH3 R=CH3 (96%) R= i Pr (22%) R= t Bu (7%)
羧酸吡啶酯
Et3N/RCOOH
I
N CH3
Cl
OH ( CH2 )n
Hale Waihona Puke IN CH3OCOR
I
N CH3
HO(CH2)nCOOH Cl
Et3N ,7.5~8h
I
N CH3
C O O
(CH2 )n C O O N CH3 O
三、酸酐酰化剂
(RCO)2O R'OH( ArOH )
酸或碱
RCOOR'( RCOOAr )
Ac2O DMAP 95
(CH3CH2CO)2O DMAP/Et3N 94
Ac2O PPY/Et3N 92
Ac2O PPY/Et3N 86
1、主要影响因素
催化剂
当醇、酚羟基共存时,采用三氟化硼为催化剂可对醇羟基进行选择性酰化
BF3 Et2O
HO
CH2OAc
(68%)
HO
CH2OH
Ac2O Py
AcO
NO2
COOC2H5
NH2 HOOCCH2CH2CHCOOH
ROH/HBF4/Na2SO4 25~60
第四章 酰化反应 答案
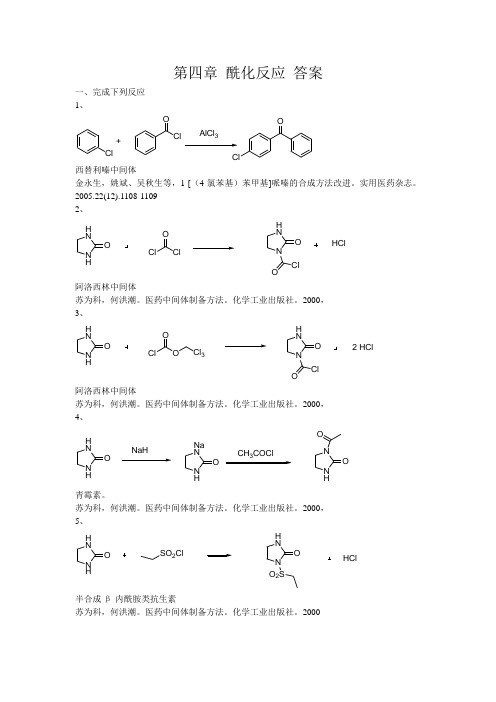
第四章 酰化反应 答案一、完成下列反应 1、ClClClOO+AlCl 3西替利嗪中间体金永生,姚斌、吴秋生等,1-[(4-氯苯基)苯甲基]哌嗪的合成方法改进。
实用医药杂志。
2005.22(12).1108-1109 2、 N HH NO ClO ClN H NO ClOHCl阿洛西林中间体苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
2000, 3、 N HH NO ClO ON H NO ClO2 HClCl 3阿洛西林中间体苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
2000, 4、 N HH NO NaHN HNa NO CH COClN HNO O青霉素。
苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
2000, 5、 N HH NO SO 2ClN H NO O 2SHCl半合成β-内酰胺类抗生素苏为科,何洪潮。
医药中间体制备方法。
化学工业出版社。
20006、OOO3C OCH 2CH 2COOH芬不芬章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,1340 7N HS CH3C O O CCH O NS COCH 3乙酰丙嗪8NH 2COOHNHCOCH 3COOH安眠酮章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,13 9N N SH 2NSHCH3C O CCH 3O N N S HN SHCOCH 3乙酰唑胺章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,14 10 NH 2OHCH3C O O CCH O NHCOCH 3OH嘧啶苯芥章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,15 11 NH 23NHCOCH 3磺胺类药物章思规。
实用精细化学品手册(有机卷)下。
化学工业出版社。
1996,17 12NH2 F3CCl2NHCOClF3CClCH3CN卤卡班章思规。
实用精细化学品手册(有机卷)下。
2015酰化反应

反应机理:
RCOOH + C6H11N C NC6H11 C6H11 N C N C6H11 H RCOO NHC6H11 O RCOOH R C O C NC6H11 O C NHC6H11 O + RCOO R C O C NHC6H11 A O C6H11NHCNHC6H11
A
R'OH
R
O R' + H
酰化反应
酰化反应
定义:有机化合物分子中引入酰基的反应称为酰化 反应。主要发生在碳、氧、氮、硫等原子上。 用途:活性化合物的必要官能团 结构修饰和前体药物 羟基、胺基等基团的保护 类型:直接酰化 间接酰化
Page 2
直接酰化反应类型
亲电酰化反应 亲核酰化反应 自由基酰化反应
-H RCO2R'
Page 9
氨基的酰化:
O R' + H N R C OH R''
RCOO NH2R'R'' O R C OH NH R' R'' O R C N R' R''
羧酸与胺 需高温脱水 催化剂:可用DCC、DIC等缩水剂(活化羧酸)
Page 10
COOH NH2 N H CH3OH SOCl2 N H COOMe DCC/Et3N/CH2Cl2 COOH N H HN O
用量:至少是底物的一倍以上(?)
Page 32
催化剂的选择:
以酰氯、乙酸酐为酰化剂时,多用Lewis酸为催化剂如AlCl3、 FeCl3、TiCl4、ZnCl2
O C Cl F + AlCl3 NH2 O C F
NH2
酰化反应'

酰基 ?
从含氧的有机酸(羧酸或磺酸)或无 含氧的有机酸(羧酸或磺酸) 机酸的分子中除去一个或几个羟基后所剩 的分子中除去一个或几个羟基 机酸的分子中除去一个或几个羟基后所剩 余的基团。 余的基团。
举例说明
酰化剂 ?
⑴ ⑵ ⑶ ⑷ ⑸ ⑹ 羧酸 如甲酸、乙酸和乙二酸等 如甲酸、 如乙酐、 酸酐 如乙酐、甲乙酐等 如碳酸二酰氯(光气)、 )、乙酰氯 酰氯 如碳酸二酰氯(光气)、乙酰氯 羧酸酯 如乙酰乙酸乙酯 酰胺 如尿素等 其他
脂肪羧酰氯
如3,4-二氯苯胺溶于含吡啶的二氯乙 烷溶剂,加壬酰氯(室温) 壬酰化物。 烷溶剂,加壬酰氯(室温)→壬酰化物。
NH2 NHCOC9H19
吡啶 + C9H19COCl 二氯乙烷,r.t. Cl
Cl Cl
+ HCl
Cl
苯甲酰氯和对硝基苯甲酰氯。 芳羧酰氯:苯甲酰氯和对硝基苯甲酰氯。 如2,5-二乙氧基苯胺的酰化 2,5OC2H5 NH2 OC2H5 COCl OC2H5 H2O, Na2CO3 85~90℃ ℃ OC2H5 NHCO
RNH2 + AcCl 常用酰氯? 常用酰氯? RNHAc + HCl 不可逆
羧酰氯、芳磺酰氯、三聚氰酰氯、 羧酰氯、芳磺酰氯、三聚氰酰氯、光气
注意:
酰化时生成HCl,与游离胺成盐, 酰化时生成HCl,与游离胺成盐,降 低反应速度,需加缚酸剂 缚酸剂, 低反应速度,需加缚酸剂,使:介质保持 中性或弱碱性,氨基保持游离态, 中性或弱碱性,氨基保持游离态,提高收 率和速度。 率和速度。但 碱性太强,酰氯水解,耗用量增加。 碱性太强,酰氯水解,耗用量增加。
酰化剂强度顺序? 酰化剂强度顺序?
酰氯>酸酐>羧酸 酰氯>酸酐> why
精细有机合成第四章酰化

O CH3 C
O
CH3 C O
R1 + ቤተ መጻሕፍቲ ባይዱH
R2
O R1 CH3C N R2 +
O CH3C OH
式中R1可以是氢、烷基或芳基,R2可以是氢或烷 基。这个反应不生成水,因此是不可逆的。
Company Logo
4.1.2 酸酐的N-酰化
❖ 如果被酰化的胺和酰化产物熔点不太高,在乙酰 化时可不另加溶剂。
Company Logo
4.1.1用酰氯的N-酰化
用酰氯进行N-酰化的反应通式如下:
R NH2 + Ac Cl
R NHAc + HCl
式中R表示烷基或芳基,AC表示各种酰基,这类反应 是不可逆的。酰氯是比相应的酸酐更活泼的酰化剂。 许多酰氯比相应的酸酐容易制备,因此常常用酰氯作 酰化剂。最常用的酰氯有长碳链脂肪酸的酰氯,芳羧 酰氯、芳磺酰氯、光气和三聚氰酰氯等。
用羧酸的N-酰化是一个可逆的过程,首先生成铵 盐,然后脱水生成酰胺:
O R C OH + H2N R'
成盐
O R C O H3NR'
-H2O 加热
OH R C N R'
Company Logo
4.1.3 羧酸的N-酰化
为了使酰化反应尽可能完全并使用过量不太多的 羧酸,必须除去反应生成的水,脱水的方法主要 有下述几种。 ❖ 1.高温熔融脱水酰化法 ❖ 2.反应精馏脱水酰化法 ❖ 3.溶剂共沸蒸馏脱水酰化法 此3种方法的用法见书P253页。
❖ 如果被酰化的胺和酰化产物熔点较高,就需要另 外加苯,甲苯或氯苯等非水溶性惰性有机溶剂。
❖ 如果被酰化的胺和酰化产物易溶于水,而乙酰化 的速度比乙酐的水解速度快的多,乙酰化反应也 可以在水介质中进行。
酰化反应原理与实例解析

精心整理第四章酰化技术本章教学设计工作任务通过本章的学习及本课程实训,完成以下三个方面的工作任务:1.围绕典型产品的生产过程,完成以羧酸、羧酸酯为酰化剂制备酰胺类产品;2.围绕典型药品生产过程,完成以酸酐、酰氯为酰化剂生产酰胺类产品;实训项目项目一:对氯苯甲酰苯甲酸的制备项目二:扑热息痛的制备项目三:草酸二乙酯的制备学习目标●掌握羧酸酰化剂、羧酸酯酰化剂的特点、适用范围、使用条件及其N-酰化中的应用;●掌握根据不同的被酰化物,正确选择酰化剂、反应条件的方法。
●掌握生产中操作及注意事项●了解新型酰化剂及其在医药科研、生产中的新技术与应用第四章酰化技术第一节概述一、酰化反应1.概念酰化反应是指有机物分子中与氧、氮、碳、硫等原子相连的氢被酰基取代的反应。
酰基是指从含氧的有机酸、无机酸或磺酸等分子中脱去羟基后所剩余的基团。
2.反应通式代表RR基反应精馏脱水法主要用于乙酸与芳胺的N-酰化,例如,将乙酸和苯胺加热至沸腾,用蒸馏法先蒸出含水乙酸,然后减压蒸出多余的乙酸,即可得N-乙酰苯胺。
溶剂共沸脱水法主要用于甲酸(沸点100.8℃)与芳胺的N-酰化反应。
(以上方法大多在较高温度下进行,因此,不适合热敏性酸或胺)(2)催化剂强酸作催化剂适用于活性较强的胺类的酰化缩合剂作催化剂适用于活性弱的胺类、热敏性的酸或胺类常用的此类缩合剂有★DCC(Dicyclohexylcarbodiimide,二环己基碳二亚胺)DIC(DiisopropylCarbodiimide,二异丙基碳二亚胺)等。
DCC是一个良好的脱水剂,以DCC作脱水剂用羧酸直接酰化,条件温和,收率高,在复杂结构的酰胺、半合成抗生素及多肽的合成中有较多的应用。
二、羧酸酯酰化剂反应过程1.反应物活性(1)对于羧酸酯(RCOORˊ)的合成)将7—ACA、水、丙酮加入反应体系中,降温,加入三乙胺、活性酯,反应至7-ACA 基本消失后,加有机酸酸,有头孢噻肟酸沉淀生成。
酰化反应原理与实例解析

精心整理第四章酰化技术本章教学设计工作任务通过本章的学习及本课程实训,完成以下三个方面的工作任务:1.围绕典型产品的生产过程,完成以羧酸、羧酸酯为酰化剂制备酰胺类产品;N-6.掌握活性亚甲基化合物α位C-酰化的原理、使用条件及在药物合成中的应用;7.了解新型酰化剂及其在医药科研、生产中的新技术与应用学时安排课堂教学10学时现场教学6学时实训项目项目一:对氯苯甲酰苯甲酸的制备项目二:扑热息痛的制备项目三:草酸二乙酯的制备学习目标)随离去基团的稳定性增加而增大)★常用酰化试剂的酰化能力强弱顺序:酰氯>酸酐>羧酸酯>羧酸>酰胺三、酰化反应在化学制药中的应用永久性酰化制备含有某些官能团的药物保护性酰化第二节N-酰化常用酰化剂:羧酸酰化剂、羧酸酯酰化剂、酸酐酰化剂和酰氯酰化剂一、羧酸酰化剂1.反应过程★2.适用对象羧酸是弱的酰化试剂,一般适用于酰化活性较强的胺类。
3.反应条件及催化剂(1)反应条件酸过量为了加速反应,并使反应向生成酰胺的方向移动,必须使反应物之一过量,通常是酸过量。
脱水可用以下方法脱水?高温熔融脱水酰化法适用于稳定铵盐的脱水,例如苯甲酸和苯胺加热到225℃进行脱水,可制得N-苯甲酰苯胺。
电性有吸电子取代基则活性高,易酰化。
离去基团的稳定性离去基团越稳定,则活性越高(2)对于胺类胺的碱性碱性越强,活性越高,空间位阻空间位阻越小,活性越高(3)羧酸二酯与二胺类化合物,如果反应后能得到稳定的六元环,则反应易发生。
如哌拉西林等青霉素药物中间体乙基-2,3-哌嗪二酮(6)催眠药苯巴比妥(Phenobarbital,7)等的合成。
2.催化剂(1)强碱作催化剂由于酯的活性较弱因此在反应中常用碱作为催化剂脱掉质子,以增加胺的亲核性。
用的碱性催化剂有醇钠或更强的碱,如NaNH2、n-BuLi、LiAlH4、Na等(2)反应物胺作催化剂过量的反应物胺也可起催化作用。
(3)催化剂的选择与反应物的活性有关反应物活性越高,则可选用较弱的碱催化;反之,则需用较强的碱催化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H3C
N COOH
CH2OH/C6H6 HCl
H3C
N
COOC2H5
(2)
. HCl
一、醇的O-酰化
(二)影响因素 3.反应物的结构 羧酸的结构对反应速度的影响除了电子效应影响着羰 基碳的亲电能力外,主要是立体效应对反应速度起着主导 作用。
立体位阻 越大,反应越困难。 一般情况下伯醇易于反应,仲醇次之,叔醇则由于立 体位阻而使反应更加困难。
140
2h ,
二、氮原子上的酰化反应
3.活性酯及其应用
(1)芳环上具有强吸电子基的取代酚与羧酸形成的酚酯, 如羧酸的对硝基苯酯、五氟酚酯等均为活性酯常用于酰胺的 制备。
Et3 N/DMF r.t. 10mni
t BuOOCCHCH2COOC6F5 Fmoc NH
PhCH2CHCOOH NH2
t BuOOCCHCH3CONHCHCOOH Fmoc NH CH2Pt (77%)
NH2 CH3COOH OH
NaHSO3 150 156
NHCOCH3
OH
(12)
二、氮原子上的酰化反应
(二)羧酸酯为酰化剂 1.反应机制
O R C OR R NH2 R O C NH2R OR R OH C NHR
碱
OR
羧酸酯为酰化剂的N酰化反应过程也可以 视为酯的氨解反应
O R O RCONHR R C NHR O R
- H2O
O R C NHR H
OH H
二、氮原子上的酰化反应
(2)胺的结构 羧酸作为酰化剂一般用于碱性较强的胺类,氨基氮原子 上的电子云密度愈大,空间位阻愈小,则反应活性愈强。胺 类化合物酰化反应的活性:伯胺>仲胺;脂肪胺>芳香胺。 在芳香族胺类化合物中,芳环上有给电子基团时,反应活性 增强;反之,有吸电子基团时,则反应活性下降。
二、氮原子上的酰化反应
(3)配料比与水
RCOOH
R NH2
RCONHR
H
为加快反应到达平衡并向生成酰胺的方向移动,必须 使反应物之一过量,通常是羧酸过量。移去反应生成的水 对酰化反应有利。一般在高温下脱水,但对于热敏性酸或 胺是不适用的。若在反应物中加入甲苯或二甲苯进行共沸 蒸馏,同样能脱去水份;也可加入化学脱水剂以吸收反应 生成的水。
R
CHO 、 R X - LiX
R
CH
R Li 、 R
C
一、醇的O-酰化
反应难易取决于醇的亲核能力及酰化试剂的活性。 一般情况下:伯醇>仲醇>叔醇
O C OH H C OH2 RCOOH H2O C H C O C R
对于醇的酰化常用的酰化剂有羧酸、羧酸酯、 酸酐、酰氯、酰胺、烯酮等.
一、醇的O-酰化 (一)反应机制
最常用的酸酐是乙酐,由于其酰化活性较高,通常在 20~90℃即可顺利反应。
NH2 (CH3CO)2O NH2 HCl
水介质 40
NHCOCH3 CH3COOH NH2 HCl
羧酸-磺酸混合酸酐:在一定条件下,使羧酸与磺酰氯作用产 生混合酸酐,此混合酸酐不经分离可直接与胺反应制得酰胺。 羧酸-磷酸混合酸酐:羧酸与磷酸衍生物形成的混合酸酐
间接酰化法
(1)间接亲电酰化
N(CH3)2 [ R2N CH Cl ] . OPOCl2 - HOPOCl2 N(CH3)2 CH Cl H2O N(CH3)2 CHO R2NH HCl NR2
间接酰化法
(2)间接亲核酰化
HS HS R 、C R S S S S O H2O/HgCl2 R C C4H9Li S S
二、氮原子上的酰化反应 (一)羧酸为酰化剂
1.反应机制
RCOOH R R NH RCOO .H2N R R O R C X RCONR R H2O HNR R
首先氨基氮原子的未共用电子对向羰基碳原子 作亲核进攻,形成过渡状配位化合物,然后脱水形 成酰胺。故不适于热敏性酸或胺。
二、氮原子上的酰化反应
R3C R3C
OH HOOCR
R3C
OH2 R3C O
R3C O 、 C R
H2O
一、醇的O-酰化 (三)应用实例 例1 盐酸普鲁卡因(Procaine Hydrochloride)的合成
O2 N COOH HOCH2CH2N(C2H5)2 / 二甲苯 。 146 C , 6h H2N O2 N COOCH2CH2N(C2H5)2
一、醇的O-酰化 (二)影响因素 1. 反应温度与催化剂 为了加快反应速度,缩短 反应时间,多采用加热回流的方法以提高反应温 度,并常加入催化剂使反应尽快达到平衡。 降血脂药物氯贝丁酯(安妥明,clofibrate,1)合成:
CH3 Cl O C COOH CH3
(1)
C2H5OH/H2SO4 80℃~84℃
间接酰化法,
酰化反应中,氧、氮原子上引入酰基的反应多数 属于直接亲电酰化反应,而在碳原子上引入酰基 ,有的为亲电酰化,有的属于亲核酰化
直接酰化法
(1)直接亲电酰化
O R C Z SH R
O C S H Z
Z= H , OCOR', OH, OR', NHR'
S= R''NH, R''O , Ar
直接酰化法
二、氮原子上的酰化反应
(三)酸酐为酰化剂 1.反应机制 (RCO)2O HN R R R O C O O C
R
HN R R
O R C O COR RCON R R RCOOH
HN R R 酸酐是活性较强的酰化剂,可用于各种结构胺的酰化 ,其反应为不可逆反应
二、氮原子上的酰化反应
2.反应条件及酰化剂
O O OH
HO OH H R C OH
反应通式: 反应机理:
O R C
R
C
H
、 OR
、 R OH
R
HOR、 R C OH
C
OR、 H2O
、 OR .. C OH OH2
OH
R
OH H2O R C 、 OR R H
O C 、 OR
由于反应为可逆平衡反应,为促进反应完全,常采用增 大其中一种反应物(醇或酸)的配比,或除去其中一种生成 物(水或酯)
Fe/HCl 2h 45 。 C, 浓HCl pH=5.5
20%NaOH COOCH2CH2N(C2H5)2 . HCl H2N
COOCH2CH2N(C2H5)2
H2N
COOCH2CH2N(C2H5)2 . HCl
一、醇的O-酰化 (三)应用实例
例2 雌激素雌二醇戊酸酯(Estradiol Valerate)的合成
C C C O
H N N H C O
二、氮原子上的酰化反应
2.催化剂的影响 在反应中常用碱作为催化剂脱掉质子,以增加胺的亲 核性。常用的碱性催化剂有:
NaH 2、n-BuLi、LiAlH 4、NaH、Na
一般来说,反应物的活性越大时,可选择较弱的碱催化; 反之,反应物的活性越小时,则选用较强的碱催化。
二、氮原子上的酰化反应
例如磺胺甲噁唑中间体的合成,采用羧酸酯与活性高 的氨气,在较温和的条件下反应
COOCH3 H3C O N
(过量) NH3
CONH2 H3C O N
30
35
羧酸二酯与二胺类化合物反应时,如果能生成六员 环的化合物,则反应更易进行,活性更大。例如哌拉西 林等青霉素类药物中间体乙基-2,3-哌嗪二酮、催眠药苯 巴比妥等药物的合成。
二、氮原子上的酰化反应
3.应用实例
例1 :抗结核药异烟肼(Isoniazid 11)的合成。
CH3
O2
COOH
H2NNH2•H2O 260℃~280℃ 120℃~130℃
O
C
NHNH2
(90%)
N
N
(70~75%)
N
(11)
二、氮原子上的酰化反应
3.应用实例 例2:解热镇痛药对乙酰氨基酚(扑热息痛,Paracetamol 12) 的合成
OH CH3(CH2)3COOH 。 170-180 C HO
OCO(CH2)3CH3
HO
(77%)
一、醇的O-酰化
(三)应用实例 例3 对氨基苯甲酸乙酯的合成 (局部麻醉药苯佐卡因原料)
1.性状:无色斜方形结晶;mP92℃;bP183℃~184℃;1g本 品溶于250mL水,5mL乙醇,2mL氯仿。
Et O RCOOH R NH2 Et O
O P
Et3N/DMF
O N BDP
N N N
r.t.20min
RCONHR
二、氮原子上的酰化反应
2.影响因素
(1)催化剂 为加快酰化反应的速度,有时需加入少量强酸 作为催化剂。
RCOOH H RC OH OH OH H RC OH OH R NH2 R C N R
O R C Z SH R
O C S HZ
式中的RCOZ为酰化剂:Z代表X,OCOR,OH,OR’, NHR等。 SH为被酰化物质: S= R O, R NH ,Ar等
二、酰化反应的类型
(一)根据接受酰基的原子不同酰化反应可分
氧酰化
氮酰化 碳酰化 (二)根据酰基的引入方式不同,酰化反应可分为
直接酰化法
二、氮原子上的酰化反应
对羧酸酯而言,酰基上R空间位阻越大,则活性越小, 酰化反应速率越慢,需要在较高温度或一定压强下进行反应; 反之,若R空间位阻越小,且具有吸电子作用(氯乙酸酯、 腈乙酸酯、丙二酸二乙酯、乙酰乙酸酯等),则活性高,酯 结构中的离去基团( )越稳定,活性越高,反应越易进 RO 行。 对胺而言,空间位阻越小,碱性越强活性越高,反之越 小。
二、氮原子上的酰化反应
CH3COCH2COOC2H5 + PhCH2NH COOC2H5 COOC2H5 NH2
