18 其他脂肪族含氮化合物
含氮

2)仲胺 )
Ar(R)NH(或R2NH) + HONO 或 2o胺 Ar(R)N NO(或R2N NO) 或 N-亚硝基胺 亚 致癌剂
3)叔胺 ) 脂肪族: 脂肪族:只与亚硝酸作用成盐 芳香族: 芳香族:发生亚硝化反应
N(CH3)2 + HO NO 3o胺
ON
N(CH3)2 (绿色结晶) 绿
7. 芳香胺的取代反应 定位效应 -NH2、-NHR、-NR2、-NHAr等是强邻对位定位基。 等是强邻对位定位基。 、 等是强邻对位定位基
Br
Cl
NO 2
HNO3 H 2 SO 4
NO2
NH2
Fe
Cl2 FeCl3
N2+BrCl
HCl
Cl
Br
CuBr
Cl
NaNO2 HBr
HBr
Cl
(2)被氢原子取代 )
N2+ClH3PO2 H 2O
次磷酸水溶液或乙醇。 次磷酸水溶液或乙醇。
N2+HSO4+ N2 CH3CH2OH + N2
[讨论 讨论] 讨论
[思考题 如何实现下列转变? 思考题] 思考题
CH3
1. 硝化 2. 还原
CH CH33
1. (CH3CO) 2O 2. 硝化 3. 还原
CH3
1. 重氮化 2. 水解 NH2 OH
CH3
OH NHCOCH3
NH2
NHCOCH3
CH3
H+/H2O 1. 重氮化
CH3
OH NH2
2. H3PO 2
OH
NH2
浓H2SO4
+
NH2HSO4-
-H2O
脂肪族化合物定义

脂肪族化合物定义
脂肪族化合物又称开链化合物,分子中的碳原子连接成链状,分为饱和化合物和不饱和化合物。
脂肪族化合物是链状烃类(开链烃类)及除芳香族化合物以外的环状烃类及其衍生物的总称。
脂肪族化合物可以是饱和化合物,由单键连接;也可以是不饱和化合物,包含双键和叁键。
除了碳、氢元素以外,还可以包含氧、氮、硫、氯等元素。
最简单的脂肪族化合物是甲烷(CH)。
脂肪族化合物涵盖有机化合物的所有品种,如烯类、烷烃类、醇类、醚类、酮类、醛类、酯类等。
石油和天然气是脂肪烃和脂环烃及其衍生物的主要来源。
来自动植物的胆甾醇、萜类等天然产物也属于脂肪族化合物,它们或用作香料或作为药物。
第18章 硝基化合物及其它含氮有机物

-
L
Nu
-
L
Nu
Nu + L-
1902年Meisenheimei即已分离出这种中间产物:
OEt O2N NO2 NO2 MeOK EtO O2N OMe NO2 N+ -O O-K+ EtOK O2N NO2 OMe NO2
脂肪族硝基化合物为无色有香气的液体,在水中的溶解度很小。能溶 于多数有机溶剂中,硝基甲烷(沸点102℃)的介电常数(37)较大, 是一种有用的溶剂。 芳香族硝基化合物为无色或淡黄色高沸点液体或低熔点固体,不溶于 水,常常可以随水蒸气蒸馏出来。芳香族硝基化合物常有剧毒。多硝基 化合物为固体,有爆炸性,三硝基甲苯(TNT)是著名的炸药,在实验 室应在水中保存。 芳香族硝基化合物的紫外光谱中,在250~300nm处有一强(ε~6000) 而宽的吸收峰,其位置取决于溶剂和苯环上的取代基的性质。在2-硝基1,3,5-三甲苯的紫外光谱图中硝基的吸收强度明显降低(ε~800)。结构 研究证明:硝基苯分子中所有原子在同一平面内,而在2-硝基-1,3,5-三 甲苯分子中,硝基所在的平面与苯环平面之间的角度为60°左右。由于 硝基偏离苯环平面,不能与苯环有效共轭,紫外吸收强度也相应降低。
§18.1 硝基化合物
硝基化合物一般可分为脂肪族硝基化合物和芳香族硝基化合物,写为R- NO2,Ar-NO2,不能写成R-ONO(R-ONO表示硝酸酯)。硝基化合物 尚未见天然存在,它们均是人工合成的。
18.1.1 硝基化合物的命名和结构
硝基化合物的命名与卤代烃相似。有机化合物命名中,硝基从来都不能作 为母体,只能作为取代基命名,即便硝基与烷基或芳基相连接。
18其他脂肪族含氮化合物

H 2C CH2
第三节 脂肪族偶氮化合物
C H 3 C H 3
C H 3CNNCC H 3
C N C N
C H 3
2 C H 3C +N 2
C N
自由基引发剂
E t O 2 C N N C O 2 E t
偶氮二甲酸二乙酯
Mitsunobu Reaction
DEAD
其中:HY中的Y基团可以各种各样,如HY为羧酸则 发生酯化反应。
H
C l C H 2 C H 3 C
C l
Simmons-Simith 反应
CH2I2+Zn(Cu) 与烯烃加成,生成环丙烷类似物的反应。
C H 3 C H H 3 C 2CC H 2C H 2 I2 E ,t Z 2 n O ( C u )
C H 2 C H 3 C H 3
CH2I2+Zn(Cu) 称为Simmons-Simith试剂,类碳烯。
R O C H 3 + A l ( O R 1 ) 3
CH2N2 是一种良好的甲基化试剂
2). 与醛、酮的反应
O
eg 1
RC - H - +CH 2N2
O
eg 2
RC - R - '+CH 2N2
O RC - C - H3 + N2
O
O
R'
+ RC - C - H 2R' +N2
R
反应机理:
O RC - R - '+ -CH2N+ N
O-
+
R-C-CH2-N N
R'
O-
+
R- C- CH 2
含氮化合物

N,N’-二苯基 对苯二胺
O2N
NH
NO2
4,4’-二硝基二苯胺
d、 四个相同或不同的烃基与氮原子相连的化合物 称为季铵化合物,其中R4N+X-称为季铵盐, R4N+OH-称为季铵碱。 命名胺与酸生成的盐或季铵类化合物时,用 “铵”代替“胺”,并在前面加负离子的名称。
C6H5N+H3Cl(C2H5N+H3)2SO42-
H2,Pt 醇
NHCOCH3 NH2
b、芳环上的亲电取代反应
NO2 Br2 Fe,140 ℃ NO2 发烟HNO3,浓H2SO4 95 ℃ NO2 发烟H2SO4 110 ℃ SO3H NO2 Br NO2
二、
胺
按烃基数目,分为伯(1º )、仲(2º )、叔(3º )胺
按氨基数目,分为一元胺、二元胺和三元胺 NH3 RNH2
α-萘胺 (伯胺)
二苯胺 (仲胺)
N,N-二甲苯胺
(叔胺)
命名:
a、 简单的脂肪胺在烃基名称后面加上“胺”
NH2 (CH3)2NCHCH2CH3 H2N(CH2)6NH2 CH3
CH2NH2
1,6-己二胺
环己胺
二甲(基)仲丁(基)胺
苄胺
b、 复杂的脂肪胺以烃作母体,氨基作为取代基
NH2 CH2CH2CHCH3
CH3
CH3
Cl
HNO3,H2SO4 100-110℃
Cl NO2
Cl
CH3
+
NO2
NO2
Cl
HNO3,H2SO4 130℃
NO2
芳香族硝基化合物的化学性质
a、 还原
NO2
NO
NHOH
NH2
试验室废液分类成分说明

(综合废液)
1.碳氢类溶剂水溶液:五氯酚钾(CC15ONa)、加扶保(C12H15NO3)、十二烷基硫酸钠(C12H25NO4S)
1.福尔马林水溶液
2.碘液、醋酸水溶液
3.蛋白质、醣类、指示剂。
4.磷酸二氢甲、氯化镁。
5.一般无机盐类
无机废液
一般重金属废液
1.含有金属元素、金属化合物重金属的铜、亚铅、铁的混合废液。
2.分析使用过的高浓度金属化合物废液。
3.含有多量有机物及铜离子螫合生成物或是其金属化合物的物质,需预先分解处理。
汞性废液
1.无机汞:汞金属、硫酸汞、硝酸汞、氯化汞….等。
2.有机汞。
六价铬废液
含六价铬化合物。
废酸液
硫酸、硝酸、盐酸。
实验室废液分类成分说明
废液类别
成分说明
有
机
废
液
碳氢类溶剂
(一般有机溶剂)
1.脂肪族碳氢化合物:石油醚、已烷、庚烷、辛烷等。
2.脂肪族氧化物:醛缩醇(acetal)、醇类、丙酮、丙烯铜、醋酸酯等。
3.脂肪族含氮化合物:乙睛、甲基氰(acetonitrile)等。
4.芳香族化合物:苯、甲苯、二甲苯、苯乙烯等。
5.芳香族含氮化合物:砒碇(pyridine)等。
6.含硫碳氢化合物:硫醇、烷基苯磺酸盐(ABS)、硫尿(thiourea)
卤素类溶剂
(含氯有机溶剂)
1.脂肪族卤素类化合物:氯化甲烷、二氯甲烷、氯仿、四氯化碳及甲基碘等。
2.芳香族卤素类化合物1.灯油、轻油、松节油等废油。
2.重油、杂酚油(creosote oil)、锭子油及变压器油等。
3.齿轮油、马达油等。
4.动植物油脂、脂肪等。
有机含氮化合物

有机含氮化合物有机含氮化合物是指分子中氮原子和碳原子直接相连的有机物,也可看成是烃分子的一个或几个氢原子被含氮的官能团所取代的衍生物,前面学过的包括氨基酸、腈、酰胺,亚胺、肟、腙。
一、硝基化合物硝基化合物是指烃分子中的氢原子被硝基取代后得到的化合物,常用RNO2或ArNO2表示。
根据硝基所连接烃基的不同可以分为脂肪族和芳香族硝基化合物,根据分子中所连硝基的多少又可以分为一硝基化合物和多硝基化合物。
共振论的观点认为硝基化合物是两种极限式的共振杂化体。
大部分芳香族硝基化合物为淡黄色固体,大多数具有苦杏仁气味。
硝基对苯环有亲电取代又有亲核取代。
(一)芳核上的亲核取代反应(1)硝基对苯环上取代基特别是邻、对位取代基的性质有很大影响卤苯型化合物中的卤素卤素很不活泼。
,难以发生亲核取代.,但当卤素的邻、对位有硝基存在时,卤原子活泼型增加,硝基越多,亲核取代反应越容易进行。
有证据表明该反应是分两步进行的,第一步是亲核加成,形成带负电荷的活性中间体买森海默尔配合物,第二步是离去基团卤素的离去。
在这个反应中,决定反应速率的步骤中有两种分子参与,所以是双分子历程。
原因。
由于邻、对位硝基对卤素的强吸电子作用,使得与卤素相连的碳原子密度降低。
容易受到亲核试剂的进攻。
硝基在邻位的情况与之在对位的情况相似,如果邻对位均有硝基,芳香亲核取代反应则更容易。
(二)硝基的还原反应硝基化合物易被还原,反应条件对还原产物有较大影响,在酸性介质中,以zn,Fe,或Sn 为还原剂,硝基将被还原成氨基,该反应的中间产物是亚硝基苯及羟基苯胺,但它们比硝基苯更容易还原,不容易分离出来。
,进一步还原为氨基,若以二氯化锡为还原剂,还可选择还原硝基,避免醛基得还原。
在中性或弱酸性下,主要得芳基羟胺。
在碱性介质中,主要发生双分子还原,还原剂不同,还原产物有很大差异。
,但产物经酸性条件进一步还原最终形成苯胺。
若用硫化钠,硫氢化钠,可以选择性地还原一个。
(三)缩合反应有a氢的硝基化合物在碱性条件下生成负碳离子,缩合反应。
含有氮元素的有机化合物就称为含氮有机化合物如我们学

§14· 1 硝基化合物
一、硝基化合物的命名和结构
1、
分类:
1>、据分子中–NO2的数目:分为一元和多元硝基 化合物。 2>、据与– NO2直接相连的碳原子的种类:伯、仲、 叔硝基化合物。
3>、据与– NO2相连的烃基的种类:脂肪族硝基化 合物和芳香族硝基化合物。
2、 命名:
硝基化合物的通式为R – NO2。命名与卤 代烃相似; – NO2只作取代基。如: 硝基甲烷、2 –硝基丙烷、4 –硝基甲苯、 硝基苯 3、 结构: N为SP2杂化, – NO2为共扼体系,与亚硝 酸酯R – ONO互为同分异构体。
1、 物理性质:沸点比相应的卤代烃高,有 毒,蒸汽可渗透皮肤;芳香族硝基化合物中, 除一元硝基化合物是高沸点的液体外,一般 为无色或黄色结晶体;多硝基化合物有爆炸 性。 2、 脂肪族硝基化合物的化学性质: 1>、还原:可催化加氢,也可用Fe/HCl等还 原。
如: RNO2+3H2
RNH2+H2O
2>、酸性:硝基化合物的a-H具有酸性,
—CH2N(CH3)2
H2O2
160℃
=CH2 —CH2N(CH3)2 O– 7、芳胺的特性:-NH2是第一类基,使苯环活 化。 1>、氧化:苯胺被二氧化锰氧化就成对苯醌; 苯胺也容易被空气中的氧所氧化。
2>、卤代:
NH2 Br NH2 Br
+3 Br2
Br NHCOCH3 + 3Br2 (白 ↓ )
LiAlH4
RCH2NH2 RNH2 CHNH2
H2
NaOBr
3、 还原氨化:
C
O
+NH3
–H2O
C
含氮化合物的分类一

NH
+ H2O
4. 酰基化 脂肪族或芳香族1°胺和2°胺可与酰基化试剂酰卤、
酸酐,生成N-取代酰胺或N,N-二取代酰胺。
叔胺N上没有H原子,故不发生酰基化反应。
该反应的用途: (1)用于胺类的鉴定
生成的N-取代酰胺均为结晶固体,具有固定而敏锐的 熔点,根据所测熔点,可推断出原来胺的结构。
(2)从胺的混合物中分离出叔胺 由于酰胺容易水解,而叔胺又不发生酰基化,利用这 一性质可将叔胺从混合胺中分离出来。
由于铵盐是弱碱所生成的盐,因此它遇到强碱就会游
离出来。
RNH+3Cl + NaOH
RNH2 + NaCl + H2O
利用这一性质可将胺类与非碱性物质分离开来。如:
十二烷
3. 烃基化 胺是一种亲核试剂,可以与卤代烷或活泼芳卤发生亲
核取代反应,在胺的N原子上引入烃基,故称烃基化反应。
:
RNH2 + R X SN2 以1°RX为佳
如:
pkb:
(CH3)2NH > CH3NH > (CH3)3N
3.27
3.38
4.21
电子效应: 3°>2°>1° 空间效应: 1°>2°>3° 溶剂化效应: 1°>2°>3°
H RNH
H
OH2
OH2 OH2
RH
>
N
RH
OH2
>
R RN H
OH2
R
共轭酸稳定性好,酸性弱,碱性强。
OH2
芳胺
:
: :
R
+
R NH2X
NaO H
R
RX
NH
R
NaOH R3N
NH2 +
含氮化合物-化工

NH2
应用:制联苯胺及衍生物 例:
Zn-NaOH-CH3OH-H2O NO2 ? H2N CH3
NH2 CH3
H
+
H3 C
D.部分还原
还原剂:(NH4)2S, NH4SH, Na2S, NaHS
NO2 NaHS CH3OH NO2
NO2 CH3 NaHS CH3OH NH2 NO2
NH2
NO2
CH3
+
NH3
Ni / H2
CH2NH2
O CH
+
CH2NH2 Ni / H2
CH2NHCH2
应用:合成伯胺、仲胺 机理:先生成亚胺,再还原—C=N—
3、酰基化: 伯、仲胺与酰氯、酸酐作用,生成酰胺:
O R C Cl O
+
NH2R' R'NHR'
R C NHR' O R C N-R'
R' 工业上制备酰胺采用羧酸与胺的反应
叔醇
(CH3 )3C-Cl
叔卤代烃
(CH3 )3C-NH2
伯胺
CH3CHCH3 NH2
伯胺
CH3CHCH3 Cl
仲卤代烃
NH4+上的4个氢都被取代,生成季铵盐(碱):
(CH3)4N Cl
+
_
(CH3)4N OH
+
_
根据氨基的数目分:一元胺、二元胺、多元胺。
CH3CH2 NH2
乙胺
CH3CH2 NHCH2CH3
生成的负碳离子能够被硝基的强吸电子作用所 稳定:
_ _
RCH-N O_
+
O
RCH=N
含氮有机化合物和杂环汇总

(1) 伯胺与亚硝酸反应 R-NH2 + HNO2 N2 + 混合物
23
NaNO2 + HCl
NH2· HCl
0~5℃
N2Cl + H2O
氯化重氮苯
重氮化反应
N2Cl + H2O
OH + N2↑ + HCl
24
(2)仲胺和亚硝酸反应
(CH3)2NH
+
N
HNO 2
(CH3)2N
O
+
37
拓展
偶氮染料Βιβλιοθήκη 偶氮染料是合成染料中品种最多的一类, 广泛用于多种天然和合成纤维的染色和印花, 也用于油漆、塑料、橡胶等的着色。近几十 年人们发现有100多种偶氮染料可转变为对人 体有致癌作用的芳香胺类化合物,这些偶氮 染料被禁用。
HO N=N
苏丹红
38
第三节
酰胺
39
化学性质 1. 酸碱性
O .. R C N H H
H2O
黄色
25
NHCH 3
+ HNO2
N N
O CH3 + H2O
黄色
26
拓展
亚硝胺
亚硝酸盐容易与体内的仲胺合成 亚硝胺类物质。已发现80多种N-亚硝 基化合物和亚硝胺具有较强的致癌作 用。作为一类广谱强致癌物,N-亚硝 基化合物和亚硝胺类几乎可以引发人 体所有脏器肿瘤,其中以消化道癌最 为常见。
+ N H
Cl
-
氯化吡啶
59
2. 氧化反应
CH3 N KMnO4
N COOH
60
(三)吡啶的衍生物
61
拓展
含氮化合物

1°使卤苯易水解、氨解、烷基化 卤素直接连接在苯环上很难被氨基、烷氧基取代,当苯环上有 硝基存在时,则卤代苯的氨化、烷基化在没有催化剂条件下即可 发生。 2°使酚的酸性增强
OH OH OH NO 2 NO 2 pKa 9.89 7.15 NO 2 4.09 O2N NO 2 0.38 OH NO 2
R NH3Cl + NaOH
RNH2 + Cl + H2O
胺的碱性强弱,可用Kb或pKb表示:
R NH 2 + H2O Kb = R NH 3 RNH2 Kb OH R NH 3 + OH pKb = logKb
碱性: 脂肪胺 > 氨 > 芳香胺 pKb < 4.70 4.75 >8.40
脂肪胺 在气态时碱性为: (CH3)3N > (CH3)2NH > CH3NH2 > NH3 在水溶液中碱性为: (CH3)2NH > CH3NH2 > (CH3)3N > NH3 原因:气态时,仅有烷基的供电子效应,烷基越多,供电子效应 越大,故碱性次序如上。
第十章
含氮有机化合物 (Nitrogen)
第一节 硝基化合物
一、分类、命名、结构
1. 硝基(NO2-)取代烃分子中的氢原子所成的化合物称为硝基 化合物。硝基是它的官能团。 按烃基的不同,硝基化合物可分为:脂肪族硝基化合物 (RNO2),例如:CH3NO2 硝基甲烷、CH3CH2NO2 硝基乙烷。芳香族 硝基化合物(Ar-NO2). 例如:
1、物理性质 脂肪族硝基化合物多数是油状液体,芳香族硝基化合物除了硝基苯 是高沸点液体外,其余多是淡黄色固体,有苦仁气味,味苦。不溶 于水,溶于有机溶剂和浓硫酸(形成 盐)。 2.脂肪族硝基化合物的化学性质 (1)还原 硝基化合物可在酸性还原系统中(Fe、Zn、Sn和盐酸) 或催化氢化为胺。
含氮有机化合物

不能发生傅-克反应
NO 2 NO 2 + Br2
NO 2
亲电取代反应: 亲核取代反应:
AlCl3 Br
NO 2 KOH
+ HBr
NO 2 OH
NO 2
2. 硝基对芳环上取代基的活化作用
Cl NaOH 200℃
Na2CO 3 130℃
×
Cl NO 2
NO 2 O 2N Cl NO 2
OH NO 2
Hofmann彻底甲基化反应
RCH2CH2NH2
+
3CH3I
+
RCH2CH2N(CH3)3 I
-
AgOH
RCH2CH2N(CH3)3 OH-
Δ
RCH=CH2 + N(CH3)3 +H2O
第三节 重氮盐及其性质
一、重氮盐的制备
二、苯重氮盐的结构
N
N X-
SP杂化
三、重氮盐的性质
留氮反应 还原 偶合
RCH2NH2 ArCH2NH2
RCH2NH2
3. 肟还原
RCH=NOH
4. 亚胺还原
NH3 H /Ni RCH2NH2 RCHO _ RCH=NH 2 H 2O R R R'NH2 C=O _ H 2O R C=NR' R H2/Ni R CHNHR' R
5. 酰胺还原
O R-C-NH2 O R-C-NHR' O R-C-NR2'
酰卤、酸酐、酯
O R' C NHR + HY
酰胺
2. 磺酰化反应
有酸性
RNH2 R2NH R3N
H3C
NaOH
试验室废液分类成分及废液桶样式说明
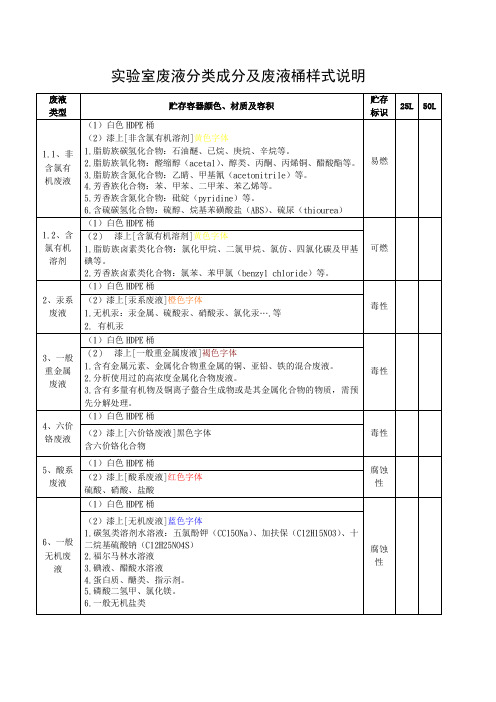
(2)漆上[无机废液]蓝色字体
1.碳氢类溶剂水溶液:五氯酚钾(CC15ONa)、加扶保(C12H15NO3)、十二烷基硫酸钠(C12H25NO4S)
2.福尔马林水溶液
3.碘氢甲、氯化镁。
6.一般无机盐类
2.芳香族卤素类化合物:氯苯、苯甲氯(benzyl chloride)等。
2、汞系废液
(1)白色HDPE桶
毒性
(2)漆上[汞系废液]橙色字体
1.无机汞:汞金属、硫酸汞、硝酸汞、氯化汞….等
2.有机汞
3、一般重金属废液
(1)白色HDPE桶
毒性
(2)漆上[一般重金属废液]褐色字体
1.含有金属元素、金属化合物重金属的铜、亚铅、铁的混合废液。
实验室废液分类成分及废液桶样式说明
废液
类型
贮存容器颜色、材质及容积
贮存标识
25L
50L
1.1、非含氯有机废液
(1)白色HDPE桶
(2)漆上[非含氯有机溶剂]黄色字体
1.脂肪族碳氢化合物:石油醚、已烷、庚烷、辛烷等。
2.脂肪族氧化物:醛缩醇(acetal)、醇类、丙酮、丙烯铜、醋酸酯等。
3.脂肪族含氮化合物:乙睛、甲基氰(acetonitrile)等。
2.分析使用过的高浓度金属化合物废液。
3.含有多量有机物及铜离子螫合生成物或是其金属化合物的物质,需预先分解处理。
4、六价铬废液
(1)白色HDPE桶
毒性
(2)漆上[六价铬废液]黑色字体
含六价铬化合物
5、酸系废液
(1)白色HDPE桶
腐蚀性
(2)漆上[酸系废液]红色字体
硫酸、硝酸、盐酸
6、一般无机废液
(1)白色HDPE桶
含氮有机物的大π键

含氮有机物的大π键
摘要:
1.含氮有机物的大π键的定义和特点
2.含氮有机物的大π键的种类
3.含氮有机物的大π键的性质和应用
4.含氮有机物的大π键的研究现状和前景
正文:
一、含氮有机物的大π键的定义和特点
含氮有机物的大π键,是指在有机化合物中含有氮原子,并且氮原子与其他原子(如碳、氧等)形成π键的化合物。
这类化合物具有很高的稳定性,其大π键能提供较大的键能和较稳定的分子结构。
同时,含氮有机物的大π键还具有丰富的化学反应性和生物活性。
二、含氮有机物的大π键的种类
1.脂肪族含氮化合物:如吡啶、吡咯等,它们的氮原子与相邻碳原子形成大π键。
2.芳香族含氮化合物:如吡喃、吡唑等,它们的氮原子与苯环形成大π键。
3.其他含氮有机化合物:如腈、胺等,它们的氮原子与其他原子形成大π键。
三、含氮有机物的大π键的性质和应用
1.化学反应性:含氮有机物的大π键具有较高的反应活性,可进行亲电取
代、加成等反应。
2.生物活性:含氮有机物的大π键在生物体内具有重要的生物活性,如酶活性、信号传导等。
3.材料应用:含氮有机物的大π键可用于制备高性能材料,如聚合物、液晶等。
四、含氮有机物的大π键的研究现状和前景
随着科学技术的发展,对含氮有机物的大π键的研究越来越深入。
目前,研究者们已经在理论和实验方面取得了许多重要成果,揭示了这类化合物的结构、性质和反应机制。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
+ C6H5CH2CCl + NaN3 O
RN3 + NaBr
O
C6H5CH2CN3 + NaCl
NH2 1) HCl, NaNO2 2) NaN3
N3
二. 反应
1) 还原反应 用于胺的合成
RN3 LiAlH4 or 催化加氢 RNH2
C6H5CH2CH2N3 2-苯乙基叠氮
Wolff 重排
由 α- 重氮酮转化为烯酮
烯酮
阿恩特--艾司特反应
反应式
O 加成-消除 R-C-Cl + H-CHN 2
Ag2O H2O
O + R-C-CH=N=N O RCH2C-OH
重氮酮
Ag2O ROH
O RCH2C-OR' O RCH2C-NH2
Ag2O NH3
Arndt-Eistert 合成法(增加碳链的方法)
CH2CHOEt + Cห้องสมุดไป่ตู้H5CH=CH2
二卤碳烯
CHX3
CH3 H C C H CH2CH3
强碱 -HX
+ CHCl3
CX2
烯烃
顺式加成
CH3 H Cl C Cl H CH2CH3
(CH3)3COK, (CH3)3COH
Simmons-Simith 反应 CH2I2+Zn(Cu) 与烯烃加成,生成环丙烷类似物的反应。
O+ R-C-CH2-N N R'
OR-C-CH 2 R'
+
普通酮主要生成环氧化合物, 醛与环酮以重排产物为主,重排时, 基团的迁移能力是: H>CH3>RCH2>R2CH>R3C
O R-C-CH2R'
O R' R
O + CH2N2
O CH2 + N N
O + N2
O C CH2 CH2N2 CH2
硝基为强的吸电子基
IR
脂肪族硝基化合物: 芳香族硝基化合物:
1560 cm-1, 1390 cm-1 1530 cm-1, 1340 cm-1
谱 学 特 征
-NO2与芳环共轭使吸收峰向低波数移动。
1HNMR
-NO2 为强吸电子基,使苯环上质子的化学位移 向低场移动。
二. 脂肪族硝基化合物的化学性质
O C CH2 + N N
O C
环丙酮
3). 与酰氯的反应
O R + C Cl + H2C N N O R O H C CH2 Cl + -H+ N N O R C CH + N N
O N R C CH2Cl
+ N N
脱去氯化氢
α- 重氮酮
氯甲基酮
-Cl
H+
R
C CH
O
R C CH2
+ N
Cl-
要想得到α- 重氮酮,需要将酰氯滴加到过量的重氮甲烷溶液中
第十八章
其他脂肪族含氮化合物
脂肪族硝基化合物 重氮甲烷的性质和反应 脂肪族偶氮化合物 叠氮化合物
第一节
脂肪族硝基化合物
一 硝基甲烷的结构
+ N O
CH3
sp2杂化
O
C-N 147pm , <ONO = 127
N-O
+ N O O
122pm
+ N O O
+ N
O O
p, π 共轭
CH3
NO2
μ= 3.5 D
CH3CH2 H3C C CH2 CH2I2, Zn(Cu) Et2O CH2CH3 CH3
CH2I2+Zn(Cu) 称为Simmons-Simith试剂,类碳烯。
CH3CH2 H C C CH2CH3 CH2I2, Zn(Cu) CH3CH2 H Et2O H CH2CH3 H
顺式加成,烯烃构型不变 反应产率低,但仍然是一种合成三元环的好方法。
练习:完成下列转化
OH
1)
OH
H+
H2C
2)
H2 C
X
MgX
CH2OH
CH2
第三节
CH3
脂肪族偶氮化合物
CH3 CN
CH3 C N N C CH3 CN
CH3 2 CH3 C CN
+ N2
自由基引发剂
EtO2C N N CO2Et
偶氮二甲酸二乙酯
Mitsunobu Reaction
DEAD
CH3CH2CHCH3 N3
2) Curtius 重排与Schmidt 重排(见胺的制备)
反应机理
O + - R C Cl + CH2-N N
加成
OR-C-Cl CH 2-N N
+
-ClAg2O
O + R-C-CH-N N H
-H+
O + R-C-CH=N=N
重氮酮,中性分子
H2O -N2
O R-C-CH
酰基卡宾
重排
RCH=C=O 烯酮
加成,互变异构
O H2O RCH2C-OH O ROH RCH2C-OR'
H H
重氮甲烷的结构
CH2N2
CH 2=N
+
N
-
+
CH2-N N
线状分子 偶极矩不大
C
N
N
3原子4电子的大键
sp2
sp
sp
电负性: C(2.6) N(3.0)
2. 重氮甲烷的制备 1). N-甲基-N-亚硝基酰胺的碱性分解
O R-C-Cl + CH3NH2 O CH2-H R-C-N N=O O RCNHCH3 HNO2
2) 烷烃和硝酸——硝化反应(得混合物作溶剂)
• 主要产物为一硝基化合 物;同时发生碳键的断裂 而生成低级硝基化合物。
第二节 重氮化合物
通式:R2C=N2
R2C + N N
一. 重氮化合物(Diazo Compounds)的制备
NO
1. 由 R
CH3
N CH3
型化合物遇碱反应 (R = 烃基,酰基,磺酰基)
LiAlH4, Et2O H2O
C6H5CH2CH2NH2 2-苯基乙胺 OH H2, Pt N3 OH NH2 反-2-胺基环己醇
O
RN3
1,2-环氧环己烷
反-2-叠氮基环己醇
CH3CH2CHCH3 Br
CH3CH2CHCH3 NH2
1) LiAlH4, Et2O 2) H2O
NaN3, EtOH
+ N=N=CHCOEt O COEt O + N CH O COEt
N2=CHCO2Et + N CH
N
N
hv
O CH2COEt
+ N2
卡宾的性质:
与烯烃加成生成环丙烷及其衍生物 (由于碳周围只有六个电子, 可做为亲电子体。)
R2C=CR2 + H2C O R R R R C6H5 COOEt
SO2NCH3 NO KOH CH2N2 + CH3 SO3
2. 酮腙的氧化汞去氢
(C6H5)2C=NNH2 HgO (C6H5)2C=N2
重氮二苯甲烷
3. 由氨基乙酸酯制备
H2NCH2CO2Et NaNO2, HCl 0° C N2=CHCO2Et
二. 重氮甲烷的性质和反应
1. 分子式 : 共振式: 结构:
Eg 4
R-OH + CH2N2 R-OH + CH2N2
HBF4
R-OCH3
反应机理:
O R C O H
+ H2C N
N
+ R C O + H3C N N
O
将酸转为甲基酯的好方法
RCOOCH3 + N2
一般的醇酸性太弱,需要在有催化剂存在的情况下条件
下,才能用CH2N2 甲基化
Al(OR1)3 + RO H CH2N2 N2 + RO CH3 Al(OR1)3
NH3
O RCH2C-NH2
注:由于反应中产生的氯化氢易使中间产物重氮酮分解生成氯甲基酮,所以 反应中重氮甲烷要过量,用于消除反应过程中生成的氯化氢。
4). 制备卡宾(光照分解)
CH2N2 h
CH2 + N2
R2CN2
h
CR2 + N2
反应机理:
CH2N2
CH2=N+=N -
CH2 + N2
其它重氮化合物也可以制成相应的卡宾。
RCH2NO2
R
R2CHNO2
(2) Nef 反应
R1 CH NO2 R2
红色
蓝色
OH-
R1
C N R2 O
O- H2SO4
R1 R2
C O
上述反应中三级硝基化合物不反应
三 脂肪族硝基化合物的制备
1)
RX + NaNO2
DMF
RNO2 + R ONO
SN2反应
卤代烷 = 溴代,碘 代 亚硝酸盐 = Li, Na, K 盐
H2O
例如:
β -羟基硝基化合物
2)还原反应:
CH3 HOCH2 C NO2 CH3 1) Fe, H2SO4, H2O 2) NaOH CH3 HOCH2 C NH2 CH3
3) 脂肪族硝基化合物的其他反应
(1) 与亚硝酸的反应(利用产物颜色差别可以区分各类化合物)
