2-气体和溶液
无机化学-气体和溶液

b —— 体积常数。
(2)实际气体分子间有作用力。因此理想压强P为分子碰撞器 壁产生的压强P实际和内层分子作用力产生的压强P内之和。
热力学推导:
令比例系数为a
a —— 引力常数。分子不同时,相互吸引力不同,a不同。
1
范德华方程: ( p+a n2 )(V - nb)=nRT V2
注:范德华方程仍然是近似的
2、道尔顿分压定律:
∑ p总= p1+ p2+ p3 ⋅⋅ ⋅⋅ ⋅ ⋅= pi
§1.2 溶液
§1.2.1 溶液的概念 §1.2.2 非电解质稀溶液的依数性 §1.2.3 胶体溶液
2
§1.2.1 溶液的概念
相: 物理、化学性质均相同的一部分物质,称为一个相。
一个相
纯物质 (同一状态) 以分子、离子、原子形式均匀混合的混合物
在此假想状态下,描述气体性质的物理量 p、V、T、n 之间服从下列关系式:
pV = nRT
理想气体状态方程式
其中: p — 压强(Pa,kPa, atm,mmHg), T — 温度(K) V — 体积(m3、cm3、L,ml), n — 物质的量(mol) R —— 气体常数。
在标准状况下,p =101325Pa, T=273.15K n=1.0 mol时, Vm=22.414L=22.414×10-3m3
∆p = p* - p = p* - p*xB = p*xA
p* — 纯溶剂蒸气压; p — 溶液蒸气压; xA — 溶质的摩尔分数
稀溶液中,nA << nB , ∆p = p*xA≈ p*×MB/1000×bA=KbA
当溶剂一定时,MB、p*一定,故p* ⋅MB/1000为一个常数,用K表示。
第二章 物质的状态 气体、液体、溶液
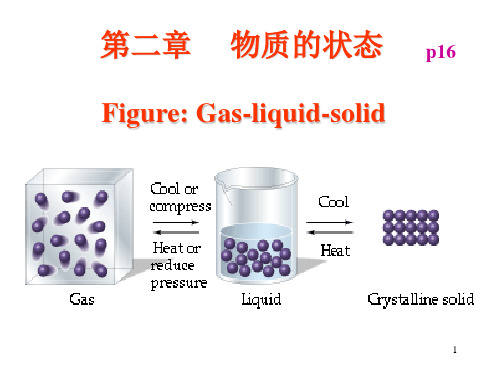
临界现象? 临界现象
课本p26 课本
Tb (沸点) < 室温 沸点) Tc < 室温, 室温, 室温下加压不能 液化
Tb < 室温, 室温, Tc > 室温, 室温, 室温下加压可液 化 Tb > 室温 Tc > 室温, 室温, 在常温常压下为 液体
24
临界常数: 临界常数:
p26
• 每种气体液化时 各有一个特定温度叫临界温度 每种气体液化时, 各有一个特定温度叫临界温度 临界温度Tc. 在Tc 以 无论怎样加大压力, 都不能使气体液化. 上, 无论怎样加大压力 都不能使气体液化 • 临界温度时 使气体液化所需的最低压力叫临界压力 临界温度时, 使气体液化所需的最低压力叫临界压力 临界压力Pc. • 在Tc 和 Pc 条件下 1 mol 气体所占的体积叫临界体积 条件下, 气体所占的体积叫临界体积 临界体积Vc.
17
压力P愈小 温度T愈高 愈高, 压力 愈小, 温度 愈高 愈接近理想气体 愈小
1mol N2气
Z=
18
不同气体的比较 (1mol, 300K )
Z=
19
图总结: 气体 Z-P 图总结:
1. 常压常温下,沸点低的气体,接近理想气体 常压常温下,沸点低的气体, 2. 起初增加压力时,对于分子量较大的分子,分子间作用力增 起初增加压力时,对于分子量较大的分子, 加占主导, 加占主导,使得 Z < 1 3. 增加较大压力时,分子的占有体积占主导,使得 Z > 1 增加较大压力时,分子的占有体积占主导,
第二章
物质的状态
p16
Figure: Gas-liquid-solid Gas-liquid-
1
本章主要内容: 本章主要内容: 一、气体
气体液体和溶液的性质

第一章 气体、液体和溶液的性质§1-1 气体的性质本节的重点是三个定律:1.道尔顿分压定律(Dalton’s law of partial pressures ) 2.阿码加分体积定律(Amagat’s law of partial volumes ) 3.格拉罕姆气体扩散定律(Graham’s law of diffusion )一、理想气体(Ideal Gases )――讨论气体性质时非常有用的概念1.什么样的气体称为理想气体?气体分子间的作用力很微弱,一般可以忽略; 气体分子本身所占的体积远小于气体的体积。
即气体分子之间作用力可以忽略,分子本身的大小可以忽略的气体,称为理想气体。
2.理想气体是一个抽象的概念,它实际上不存在,但此概念反映了实际气体在一定条件下的最一般的性质。
3.实际气体在什么情况下看作理想气体呢?只有在温度高和压力无限低时,实际气体才接近于理想气体。
因为在此条件下,分子间距离大大增加,平均来看作用力趋向于零,分子所占的体积也可以忽略。
二、理想气体定律(The Ideal Gas Law )1.由来(1) Boyle’s law (1627-1691)British physicist and chemist - The pressure-volume relationshipn 、T 不变 , V ∝ 1/ p or pV = constant(2) Charles’s law (1746-1823)French scientist 1787年发现-The temperature-volume relationshipn 、p 不变 , V ∝ T or V /T = constant(3) Avogadro’s law (1778-1823)Italian physicistAvogadro’s hypothesis :Equal volumes of gases at the same temperature and pressure contain equal numbers of molecular.Avogadro’s law The volume of a gas maintained at constant temperature andpressure is directly proportional to the number of moles of the gas.T 、p 不变 , V ∝ n2.理想气体方程式(The ideal-gas equation )由上三式得:V ∝ nT / p ,即pV ∝ nT ,引入比例常数R ,得:pV = nRT pV = nRT R---- 摩尔气体常量 在STP 下,p =101.325kPa, T =273.15K n =1.0 mol 时, V m =22.414L=22.414×10-3m 3R =8.314 kPa ⋅L ⋅K -1⋅mol -1nT pV R =K15.2731.0m ol m 1022.414Pa 10132533⨯⨯⨯=-11K m ol J 314.8--⋅⋅=4.理想气体方程式应用 可求摩尔质量(1) 已知p ,V ,T , m 求 M (2) 已知p ,T ,ρ 求 M5.实际气体(Real gas )与理想气体的偏差(Deviations of ideal behavior) (1) 实例:1mol 几种气体 pV / RT ~ p 曲线从两个图中,可以得知:a .分子小的非极性分子偏差小,分子大的极性强的分子偏差大;b .温度越高,压力越低,偏差越小。
气体与溶液的扩散与溶解

气体与溶液的扩散与溶解气体与溶液的扩散与溶解是化学领域中一对重要的现象。
本文将探讨气体和溶液在扩散和溶解过程中的特点、原理以及相关应用。
一、气体的扩散气体的扩散指的是气体分子自高浓度区域向低浓度区域移动的过程。
这种移动是由于气体分子之间的碰撞而产生的,并且遵循了高浓度区域分子数较多、碰撞频率较高的规律。
在气体扩散的过程中,有两个重要因素需要考虑,即浓度差和温度。
浓度差越大,气体分子的移动速率越快,扩散速度也就越快。
而温度的升高也会增加气体分子的平均动能,从而增加扩散速度。
气体扩散广泛应用于各个领域。
例如,在生物学中,氧气通过扩散进入人体的肺部,供给身体所需。
在环境科学中,大气中的污染物通过扩散到达地表,影响着空气质量。
因此,研究气体的扩散规律对于我们理解和改善环境以及生命健康具有重要意义。
二、溶液的扩散溶液的扩散指的是溶解在液体中的溶质分子在液体中的不断运动使得溶质分子能够均匀分布的过程。
溶液中的溶质分子会沿着浓度梯度的方向,从高浓度区域向低浓度区域运动。
与气体的扩散不同,溶液的扩散受到溶液浓度、温度以及凝聚相间物质的类型等因素的影响。
溶液浓度越高,扩散速率越快,而温度的升高也会增加溶液分子的运动速率,从而加快扩散过程。
溶液的扩散在日常生活和科学研究中有着广泛的应用。
例如,我们入浴时加入的香皂、洗发水等都是通过溶液扩散使得其中的有效成分能够渗透到皮肤和头发之中。
在生物学和生物化学研究中,细胞内的各种物质也通过溶液的扩散进入或离开细胞。
三、气体和溶液的溶解气体和溶液的溶解是指气体分子通过与溶剂分子相互作用而在溶液中分散的过程。
气体溶解通常遵循亨利定律,该定律表明气体的溶解度与气体分压成正比。
也就是说,气体的溶解度随着气体分压的增加而增加。
溶解度受到温度和压力的影响。
温度升高会降低溶质与溶剂之间的吸引力,从而提高溶解度。
压力的升高会增加气体分子的相互碰撞频率,从而提高溶解度。
气体和溶液的溶解在很多实际应用中都有重要意义。
化学反应中的气体和溶液知识点总结

化学反应中的气体和溶液知识点总结化学反应是物质间发生变化的过程,其中气体和溶液是常见的反应方式。
本文将围绕化学反应中的气体和溶液两个方面进行知识点总结,帮助读者更好地理解这些概念。
一、气体的特性和性质气体是一种无定形的物质形态,具有以下特性和性质:1. 可压缩性:气体的分子间距离较大,分子运动剧烈,因此气体具有可压缩性。
2. 可扩散性:气体分子具有高速运动,可以自由地在容器内扩散和混合。
3. 可溶性:气体可以溶解于液体或固体中,其溶解度受温度和压力的影响。
4. 气压和温度:根据理想气体状态方程P×V = n×R×T,气体压强和温度成正比,压强的单位是帕斯卡(Pa),温度的单位是开尔文(K)。
二、溶液的组成和性质溶液是由溶质和溶剂组成的混合物,其中溶质是被溶解的物质,溶剂是用于溶解溶质的物质。
溶液具有以下组成和性质:1. 溶解度:溶解度是指单位溶剂中能溶解的最大溶质量,常用质量分数或摩尔分数表示。
2. 饱和溶液:当在一定温度下,无法再溶解更多溶质时,称为饱和溶液。
3. 浓度:溶液的浓度可以通过质量浓度、摩尔浓度或体积浓度等方式表示。
4. 溶解过程:溶质分子与溶剂分子之间的相互作用力决定了溶解过程的进行与否。
5. 离子溶液:当溶质是离子时,溶液中的离子数量与电解质的浓度成正比。
三、气体反应常见类型1. 常规气体反应:包括氧化反应、还原反应、酸碱中和反应等。
例如:2H2 + O2 → 2H2O2. 气体的摩尔关系:根据化学计量关系,在气体反应中可以根据反应物的物质的摩尔比例推导出产物的物质摩尔比例。
例如:2H2 + O2 → 2H2O,2摩尔氢气与1摩尔氧气反应生成2摩尔水。
3. 气体溶解平衡:气体溶解于溶液中时,会达到一个平衡状态,溶解度受温度和压力的影响。
四、溶液反应常见类型1. 酸碱反应:酸和碱在溶液中反应生成盐和水的化学反应。
例如:HCl + NaOH → NaCl + H2O2. 沉淀反应:两种溶液混合时,产生的沉淀物是由两种阳离子和阴离子结合形成的固体颗粒。
第一章 气体和溶液

溶液的蒸气压降低的原因:
溶质是难挥发非电解质,因此溶液的蒸气压实际上 是溶液中溶剂的蒸气压。
pA*
p
水
糖水
蒸气压与溶液的浓度有没有定量规律? 1887年,法国著名物理学家拉乌尔根据大量的实验 结果,总结出一个经验定律,这就是拉乌尔定律。
拉乌尔(Raoult)定律 在一定温度下,难挥发非电解质稀溶液的蒸气压(p) 等于纯溶剂的蒸气压(pA*)乘以溶剂在溶液中的摩尔分 数(xA)。即: p = p A * · xA
第一章 气体和溶液
基本要求 掌握理想气体状态方程及其应用;掌握道尔
顿分压定律的应用和计算;熟悉溶液浓度的表示方法;
理解稀溶液的依数性及应用;熟悉胶体的结构、性质、
稳定性等;掌握胶粒聚沉的方法和电解质对溶胶聚沉作 用的影响规律。 学习重点 理想气体状态方程;分压定律;溶液浓度的
表示方法;稀溶液的依数性;胶体的性质与结构;影响
∵ xA + xB = 1 ∴ p = pA*(1-xB) 溶液的蒸气压下降值Δp为 Δp = pA*-p
= pA*-pA*(1-xB)
Δp = pA*xB 因此拉乌尔定律也可以这样说:
拉乌尔(Raoult)定律:
在一定温度下,难挥发非电解质稀溶液的蒸气压下
降(Δ p)与溶质的摩尔分数(xB)成正比,而与溶质的本
理想气体:忽略分子的大小和分子间的作用 力 理想气体状态方程:pV= nRT
式中:p为压力 (Pa), V为体积(m3), n为物质的量(mol), R为摩尔气体常数, T为热力学温度(K)。
气体状态方程式的另一些形式:
物质的量(n)与质量(m)、摩尔质量(M)的关系
m pV RT M pM RT
无机及分析化学——第一章 气体和溶液

依数性来源于分散微粒间距离远,作用力小。
通常所说的“依数性”,包括四个方 面: • 蒸气压下降 (The lowering of the vapor pressure)
• 沸点升高 (The elevation of the boiling point)
• 凝固点降低 (The depression of the freezing point) • 渗透压 (The phenomenon of osmotic pressure)
c)粗分散系:
1000 nm (> 10-6 m), 例如:泥浆水(悬浊液)、牛奶、豆 浆等。肉眼或在显微镜下可观察到微粒,静置易沉淀,是一种 不稳定的体系。
相与界面
相(phase):体系中物理性质和化学性质完全相同的部分。 相界面(简称界面,interface):将相与相分隔开来的部分。 相与相之间在指定的条件下具有明确的界面,在界面两边体 系的性质会有突跃变化。处于界面上的原子或分子的受力情况 与相内部的不同,往往存在剩余引力,具有界面能。一般来说, 体系中存在的界面越多,能量就越高,体系也越不稳定。
体来说,只要温度不是太低(高温,高于273K),压力不
是太高(低压 , 低于数百 kPa ),都可以近似用理想气体 状态方程作有关p、V、T、n 的计算。
2. 理想气体状态方程
理想气体的温度(T)、压力(p)、体积(V)和物质的 量(n)之间, 具有如下的方程式关系: pV = nRT 在SI制中,p—Pa,V—m3,T—K,n—mol。 标准状况(p=101.325 kPa,T=273.15 K)下,1 mol 气 体的标准摩尔体积为 22.414×10-3 m3 ,摩尔气体常数 R 的 单位及数值为: pV 1.01325 105 Pa 22.414 103 m3
无机化学-气体和溶液

1-1 气体
一、理想气体(ideal gas)的状态方程:
(1)分子本身不占体积,分子是具有质量的几何点, (2)分子之间没有作用力, (3)分子之间、分子与容器壁之间的碰撞不造成动能损
失(完全弹性碰撞)。
研究结果表明:在高温(高于273K)、低压(低于数百 kPa)条件下,许多实际气体很接近理想气体。
可见光波长400-700 nm,溶胶直径1-100nm,发生散射。 每一个胶体粒子变成一个小光源,向四周发射与入射 光波长相同的光波。
真溶液粒子太小,光散射微弱,显示不出丁达尔现象。 可用丁达尔现象来区别溶胶和真溶液。
3)电学性质:电泳 电泳——在电场作用下,胶体粒子在分散介质中作定向移动的现象。
Tb = Kb·b
II = bRT
来测定溶质的摩尔质量。只有对摩尔 质量特别大的物质(如血红素等生物 大分子)才采用渗透压法。
●配制等渗透液:渗透现象在许多生 物过程中有着不可缺少的作用,特别 是人体静脉输液所用的营养液(如葡 萄糖液等)都需要经过细心调节以使 之与血液具有同样的渗透压(约 780kPa),否则血红细胞将遭到破坏。
五、胶体的稳定性与聚沉(coagulation) 1)稳定性: 溶胶具有很大的比表面积,总是有自发聚集成更大颗粒,降低表面能的倾向,
因此,是热力学不稳定体系,但胶体具有相对稳定性。 溶胶相对稳定的原因: 1)布朗运动, 2)胶粒带电, 3)溶剂化作用(扩散层和吸附层离子都水合)——起保护作用。 可用来衡量溶胶的稳定性: 越大,胶粒带电量越多,扩散层厚,溶剂化层也厚,溶胶就越稳定。 2)聚沉: 聚沉:溶胶失去稳定性,相互碰撞导致颗粒变大,最后以沉淀形式析出。
p总
气体和溶液

气体和溶液【1-1】在0℃和100kPa 下,某气体的密度是1.96g·L -1。
试求它在85千帕和25℃时的密度。
解:根据公式p M=ρRT 得111222P T P T ρρ=, 所以21121285.0 1.96273.15===1.53100298.15P T PT ρρ⨯⨯⨯g·L -1 【1-2】 在一个250 mL 容器中装入一未知气体至压力为101.3 kPa ,此气体试样的质量为0.164 g ,实验温度为25℃,求该气体的相对分子质量。
解:-1101.30.250=n 8.314n=0.0102mol 0.1640.0102=16.1g mol 298.15⨯⨯÷⋅,, 【1-3】收集反应中放出的某种气体并进行分析,发现C 和H 的质量分数分别为0.80和0.20。
并测得在0℃和101.3 kPa 下,500 mL 此气体质量为0.6695 g 。
试求该气态化合物的最简式、相对分子质量和分子式。
解:(1)(0.80(12.01):(0.20(1.008) = 1:3.0,最简式为CH 3(2)-1101.30.500=n 8.314n=0.0223mol 0.66950.023=30.0g mol 273.15⨯⨯÷⋅,, (3)C 2H 6【1-4】将0℃和98.0 kPa 下的2.00 mL N 2和60℃ 53.0 kPa 下的50.00 mL O 2在0℃混合于一个50.0 mL 容器中,问此混合物的总压力是多少? 解:112298.0 2.00(N ) 3.92kPa 50.0p V p V ⨯===122153.0273(O )43.5kPa 333p T p T ⨯===3.9243.547.4kPap =+=混合【1-5】现有一气体,在35℃和101.3 kPa 的水面上捕集,体积为500 mL 。
如果在同样条件下将它压缩成250 mL ,干燥气体的最后分压是多少?解:查教科书第4页表1-1,得35℃时水的饱和蒸气压为5.63 kPa , 101.3 5.630.500=n 8.314n=0.01867mol 308.15-⨯⨯(), P 0.250=0.018678.314P=191.3kPa 308.15⨯⨯, 【1-6】CHCl 3在40℃时蒸气压为49.3 kPa ,于此温度和101.3 kPa 压力下,有4.00 L 空气缓缓通过CHCl 3(即每一个气泡都为CHCl 3蒸气所饱和),求:(1)空气和CHCl 3混合气体的体积是多少?(2)被空气带走的CHCl 3质量是多少?解:(1)49.3:(101.3 - 49.3) = V:4.00, V = 3.79 (L),4.00 + 3.79 = 7.79 (L)(2)49.37.79=n 8.314n=0.1475mol 0.1475119.2=17.6g 313.15⨯⨯⨯,, 【1-7】在15℃和100 kPa 压力下,将3.45 g Zn 和过量酸作用,于水面上收集得1.20 L 氢气。
大学化学01第一章 气体和溶液

第一章 气体和溶液学习要求1. 了解分散系的分类及主要特征。
2. 掌握理想气体状态方程和气体分压定律。
3. 掌握稀溶液的通性及其应用。
4. 掌握胶体的基本概念、结构及其性质等。
5. 了解高分子溶液、乳状液的基本概念和特征。
1.1 气体1.1.1 理想气体状态方程气体是物质存在的一种形态,没有固定的形状和体积,能自发地充满任何容器。
气体的基本特征是它的扩散性和可压缩性。
一定温度下的气体常用其压力或体积进行计量。
在压力不太高(小于101.325 kPa)、温度不太低(大于0 ℃)的情况下,气体分子本身的体积和分子之间的作用力可以忽略,气体的体积、压力和温度之间具有以下关系式:V=RT p n (1-1)式中p 为气体的压力,SI 单位为 Pa ;V 为气体的体积,SI 单位为m 3;n 为物质的量,SI 单位为mol ;T 为气体的热力学温度,SI 单位为K ;R 为摩尔气体常数。
式(1-1)称为理想气体状态方程。
在标准状况(p = 101.325 Pa ,T = 273.15 K)下,1 mol 气体的体积为 22.414 m 3,代入式(1-1)可以确定R 的数值及单位:333V 101.32510 Pa 22.41410 m R T1 mol 27315 Kp n .-⨯⨯⨯==⨯3118.314 Pa m mol K --=⋅⋅⋅11= 8.314 J mol K --⋅⋅ (31 Pa m = 1 J ⋅)例1-1 某氮气钢瓶容积为40.0 L ,25 ℃时,压力为250 kPa ,计算钢瓶中氮气的质量。
解:根据式(1-1)333311V 25010Pa 4010m RT8.314Pa m mol K 298.15Kp n ---⨯⨯⨯==⋅⋅⋅⨯4.0mol =N 2的摩尔质量为28.0 g · mol -1,钢瓶中N 2的质量为:4.0 mol × 28.0 g · mol -1 = 112 g 。
第一章 气体和溶液

1. 稀溶液蒸气压下降
(1) 溶剂的蒸汽压 vapor pressure
(2) 稀溶液的蒸汽压下降 pressure lowering
(2) 稀溶液的蒸汽压下降 pressure lowering
溶液的蒸发与纯水蒸发相比,速率要慢得多,因为: 溶液表面被溶质微粒所占据,使溶液表面动能较高,足以克 服分子间引力而进入气相的溶剂分子相对含量降低,减少溶 剂分子蒸发的机会。
4. 质量分数
定义:B物质的质量与混合物质量之比, 表示相同质量单位物质的相对含量。 单位:1
表示式: ωB= mB /(mA+ mB)
表示方法:分数或者小数
举例: ω硫酸 = 98% or 0.98
5. 质量浓度
定义: B物质的质量与混合物体积之比。 符号:ρB 单位:Kg/m -3;g· -1;mg · -1;μg · -1 L L L
B组分气体分压的求解:
nB RT pB V p nRT V
pB nB xB p n
nB pB p xB p n
x B B的摩尔分数
1.4 分压定律的实 际应用 计算气体混合物中各组分气体分压
例题:
在25℃、99.43kPa下,以排水集气法在水面上收 集到的氢气体积为0.4006L,计算在同样温度、压力 下,用分子筛除去水分后所得干燥氢气V’ 和n。已知 25℃时水的饱和蒸气压为3.17kPa 解: T =(273+25)K = 298K p=99.438kPa V=4.16L
C
水
水的 相图 是根 据实 验绘 制的:
A f
冰
P
610.62
O
D
B
273.16
q 水蒸气
无机化学 第一章 气体和溶液.

V
10.0
1.2 溶 液
一、浓度的几种表示方法 (溶质为A;溶剂为B)
1. 物质的量浓度 (c)
C nA (mol L1)
V
2.摩尔分数(X) xA =
nA ; n总
则:xA +xB =
xB =
nB ; n总
nA nB 1 n总 n总
推广:溶质和溶剂的摩尔分数 之和=1
3.质量摩尔浓度(b)
解:(1) pM RT
M
RT
p
0.5977 103 103 8.314 (273 1000) 97 103
65.2 103kg mol1 65.2 g mol1
(2) 65.2 2.03 32.07
硫蒸气的化学式为S2
只有一种气体
要计算该气体压强:
第一章 气体和溶液
物质的存在状态通常有三种: 气态、液态和固态。 本章重点介绍气体和溶液的一些基本规律。
1.1 对气体而言,主要掌握理想气体状态方程式和道尔顿分压定律 的应用。
1.2 对溶液而言,主要掌握稀溶液的“依数性”的公式和应用。 1.3 对胶体溶液而言,主要了解其相关性质。(自学)
1.1 气 体
解: PV nRT
PV m RT M
M m RT PV
M
=
0.118创10- 3 Kg 8.315Pa 鬃m3 mol-1 状K-1 73.3创103 Pa 250? 10- 6 m3
(25 +
273)K
M = 16醋10- 3 Kg mol- 1
例1-2:在1000 ℃和97 kPa压力下,硫蒸气的密度是 0.5977 gL-1。试求:(1)硫蒸气的摩尔质量,(2)硫 蒸气的化学式。
气体与溶液.

(1) (2) (3)
O2、N2的物质的量; O2、N2的分压力; 混合气体的总压力
(4) O2、N2的分体积
解:(1)混合前后气体物质的量没有发生变化:
(n O )= p1V1
0.3103kPa 1dm3
0.12mol
2 RT 8.314J/(mol K) (25+273)K
3dm3
0.1MPa 0.14MPa
2.14dm3
V (N 2
)=V总
( p N2 ) p总
=3dm3
0.04MPa 0.14MPa
0.86dm3
注意:单位的统一和换算!
(n N )= p2V2
0.06103kPa 2dm3
0.048mol
2 RT 8.314J/(mol K) (25+273)K
(2)O2、N2的分压是它们各自单独占有3 dm3时所产生的压 力。当O2由1 dm3增加到
(p O )= 2
p1V1 V
0.3MPa 1dm3 3dm3
0.1MPa
当N2由2 dm3增加3 dm3到时:
( p N )= p2V2 0.06MPa 2dm3 0.04MPa
2
V
3dm3
(3)混合气体总压力:
p总=(p O2)+p(N2) 0.1MPa+0.04MPa=0.14MPa
(4)O2、N2的分体积:
V (O2 )=V总
( p O2 ) p总Fra bibliotekn m M
pV= mRT/M
ρ=m/V
ρ= pM/RT
在标准状况下,1摩尔气体的体积Vm=22.414×10-3m3
拉乌尔定律和亨利定律

拉乌尔定律和亨利定律--溶液的蒸气压我们知道,液体可以蒸发成气体,气体也可以凝结为液体。
在一定的温度下,二者可以达成平衡,即液体的蒸发速度等于蒸气的凝结速度。
达到这种平衡时,蒸气有一定的压力,这个压力就叫做此液体的饱和蒸气压(简称蒸气压)。
蒸气压与温度有关,温度越高,分子具有的动能越大,蒸发速度越快,因而蒸气压越大。
溶液的蒸气压除与温度有关外,还与浓度有关。
拉乌尔定律和亨利定律所描述的就是溶液蒸气压和浓度之间的关系。
3.3.1 拉乌尔定律1887年法国物理学家拉乌尔(Raoult)在溶液蒸气压实验中总结出著名的拉乌尔定律。
拉乌尔定律指出:如果溶质是不挥发性的,即它的蒸气压极小,与溶剂相比可以忽略不计,则在一定的温度下,稀溶液的蒸气压等于纯溶剂的蒸气压与其克分子分数的乘积。
即式中p1--溶剂的蒸气压,溶质是不挥发性时,即为溶液的蒸气压;x1 ──溶液中溶剂的克分分数。
拉乌尔定律还可以表述为:在一定的温度下,当不挥发物质溶解在溶剂中时,溶液的蒸气压相对下降等于溶质的克分子分数。
即式中△p——溶液的蒸气压下降值;x2——溶质的克分子分数。
对于溶质是挥发性物质,它的蒸气压不能忽略时,拉乌尔定律仍然适用,但要注意此时p1是溶液中溶剂的蒸气压。
3.3.2 亨利定律亨利定律是1803年由亨利在对气体在液体中溶解度的实验研究中得出的。
亨利定律指出:在一定的温度下,气体在液体中的溶解度和该气体的平衡分压成正比。
即p2=k x x2 (3.22)式中x2 ──气体溶质在溶液中的克分子分数;p2──该气体的平衡分压;k x──常数。
亨利定律中的浓度单位除可用克分子分数外,也可用其他浓度单位表示,但是采用不同的单位时,常数k不同。
亨利定律可以推广到具有挥发性溶质溶于液体的稀溶液。
但是需要特别注意的是,亨利定律的应用是有条件的:只有当溶质在液相和在气相里都以相同的质点存在时亨利定律才适用。
由于气体在金属中往往以原子状态存在,因此气体在金属中的溶解往往不服从亨利定律。
气体和溶液

凝固点下降值: ΔT f = T f * - Tf
22
根据拉乌尔定律,难挥发非电解质稀溶液的沸 点升高值与溶液的质量摩尔浓度有下述关系成立: ΔTb = Kb · b 有下述关系成立: ΔT f = K f ·b Kb-沸点升高常数 ; (1-13) Kf -凝固点降低常数 (1-12)
同理,凝固点下降值与溶液的质量摩尔浓度
6
pM = ρRT
补充例题:在298 K和9.93 ×104Pa压力下, 0.304L二氧化硫重0.78g,求二氧化硫的分子量。 解:根据气体状态方程式: pV=mRT/M 代入以上数据: M = 0.78 × 10-3 ×8.314 ×298/(9.93 ×104 ×0.304 ×10-3 ) = 0.064kg/mol=64g/mol 单位:kg ×Pa·L/mol ·K ×K/ Pa·L = kg/mol
必然降低单位体积内的水分子数目,单位时间内逸 出 的 水 分子数 目减少 。 因 此一 定温度下 达 到 平衡 时,溶液的蒸汽压比起纯溶剂的蒸汽压更低。这里 溶液的蒸气压实际上是溶液中溶剂的蒸气压。
pA*
p
图示为溶液的蒸汽 压降低。溶液的蒸气 压下降值Δp为
Δp = pB*-p
15
比较不同浓度溶液的蒸气压。显然,浓度越 大 ,溶液的 蒸 气压 越 低。 蒸 气压 与 溶液的 浓 度的 关 系 遵循拉乌 尔定律。 表 述 为:在 一 定温度下, 难挥 发非电 解 质稀溶液的 蒸汽 压等于 纯 溶 剂 的 蒸汽 压乘 以溶剂在溶液中的摩尔分数。 即: p = pB* xB (1-9) p: 为溶液的蒸汽压 pB*:为纯溶剂的蒸汽压 xB:为纯溶剂的摩尔分数 ∵ xA + xB = 1 ∴ p = pB*(1-xA) 溶液的蒸气压下降值Δp为 Δp = pB*-p = pB*-pB*(1-xA) Δp = pB*xA (1-10 )
第二章 化学基础知识

渗透压平衡与生命过程的密切关系: ① 给患者输液的浓度;② 植物的生长; ③ 人的营养循环。
结论: 蒸气压下降,沸点上升,凝固点下降,
渗透压都是难挥发的非电解质稀溶液的通性; 它们只与溶剂的本性和溶液的浓度有关5 依数性的应用
(a)测定物质的摩尔质量
例2-8 在26.6gCHCl3中溶解0.402g难挥发非电解质 溶质,所得溶液的沸点升高了0.432K,CHCl3的沸点升 高常数为3.63K· mol-1,求该溶质的平均分子质量Mr。 kg· 例2-9 把0.322g萘溶于80g苯中所得的溶液的凝固点 为278.34K,求萘的摩尔质量。
OB线:冰的蒸气压曲线(升华曲 线),代表冰的蒸气压随温度 变化的情况。 OC线:水的凝固点曲线,代表水 的凝固点随压力改变的情况。 三条曲线的共同点都是两 相处于平衡状态。要维持体系 的两相平衡状态,必须使体系 所处的条件(P、T)沿着曲线 变动。因此P、T这两个条件中 只能自由地改变一个,另一个 则必然随之而确定,否则平衡 状态会破坏。
实验测得(2-4)的比例系数是R,于是得到
(2—4)
pV=nRT
(2—5) 理想气体状态方程式
注意:R的取值,P、V、n、单位之间关系
2、气体分压定律
分压:指在相同温度下混合气体中的某种气体单独占
有混合气体的体积时所呈现的压强。(Pi表示)
分体积:在相同温度下,组分气体具有和混合气
体相同压力时所占的体积。(Vi表示)
2-2-5-1 蒸气压下降
稀溶液的蒸气压比纯溶剂的蒸气压低。 法国物理学家拉乌尔根据实验得出结论:
在一定的温度下,难挥发非电解质稀溶液 的蒸气压等于纯溶剂的蒸气压乘以溶剂的摩尔 分数。(拉乌尔定律)
气体与溶液性质

气体与溶液性质气体与溶液是化学中重要的物质状态,它们在许多领域都有着广泛的应用。
本文将详细介绍气体与溶液的性质,包括其定义、组成、特点以及普遍规律。
首先,我们来谈谈气体的性质。
气体是一种无定形的物质状态,其分子之间的相互作用力相对较小,使得气体具有较高的扩散性、可压缩性和可混合性。
气体可以通过改变温度和压力来调整其体积和密度。
气体分子之间的平均距离较大,分子之间几乎没有相互作用,因此气体没有固定的形状和体积。
气体的分子自由运动,具有高度的熵和无序性。
气体在常温、常压下的体积可以根据阿伏伽德罗定律确定,即相同条件下气体的体积与分子的个数成正比。
气体的性质还包括压力和温度的影响。
根据理想气体状态方程,气体的压强与温度成正比,温度越高,气体分子的平均动能越大,压强也相应增加。
而根据查理定律,给定体积的气体,在恒定温度下,压强与气体的体积成反比。
根据博伊尔定律,给定质量的气体,在恒定温度下,压强与气体的体积成正比。
这些定律为我们研究和应用气体提供了重要依据。
接下来,我们来探讨溶液的性质。
溶液是由溶质和溶剂组成的一种均相混合物。
其中溶质是指溶解在溶剂中的物质,而溶剂是指用于溶解其他物质的介质。
在溶液中,溶质的存在形式可以是分子、原子或离子。
溶液中的溶质和溶剂之间会发生相互作用,这种相互作用可以使溶质分子被溶剂分子包围和稳定,并随着溶剂的运动而分散。
溶液的性质受到溶质和溶剂的特性影响。
溶液中的溶质可以是固体、液体或气体。
当溶质是固体时,其溶解度受温度、压力和溶剂性质的影响。
其中,温度对溶解度的影响最为显著。
在一些情况下,增加温度可以提高固体溶质的溶解度,而在其他情况下,增加温度反而会降低溶解度。
溶解度曲线描述了溶质在不同温度下的溶解度变化规律。
同时,在气体溶液中,溶质的溶解度还受到压力的影响。
亨利定律表明,溶解度与气体的分压成正比。
在恒定温度下,增加气体的分压会增加气体分子进入溶液的速率,进而增加溶解度。
此外,溶液的浓度也是一个重要的性质。
无机化学宋天佑讲课化学基础知识

2-1-3 混合气体的分压定律
2-1-4 气体扩散定律()
2-1-5 气体分子的速率分布和能量分 布 ( )
4
2-1 气体
2-1-1 理想气体的状态方程
理想气体:一种假想的气体模型。
要求:
(1) 气体分子间没有作用力; (2) 分子本身不占有体积(质点)。
5
2-2-2 饱和蒸气压
2-2-3 非电解质稀溶液的依数性
27
溶液 (solution):由两种及两种以上物 质均匀分布而形成的分散系统。
溶液并不限于液体状态,任何聚集 状态都可以成为溶液,如空气是气体 溶液,合金是固体溶液。 一般常将溶液中含量较多的组分称 为溶剂 (solvent),而将其他组分称为 溶质 (solute)。当有一组分为水时,通 常把水看成是溶剂。
第 2章
化学基础知识
1
2-1 气体 2-2 液体和溶液 2-3 固体
2
气体、液体和固体
气体(g) 分子间作用力 体积 形状 扩散性 可压缩性 流动性 弱 无 无 有 可压缩 易流动
液体(l) 居中 有 无 扩散较慢 不可压缩 易流动
固体(s) 强 有 有 无 刚性 不流动
3
2-1 气体
2-1-1 理想气体的状态方程
38
• 饱和蒸气压与溶剂的本性有关。同一溶 剂的蒸气压又随温度的升高而增大。
表1 水的蒸气压
t/℃ 10.0 20.0 30.0 40.0 50.0 p*/kPa t/℃ 1.228 2.338 4.243 7.376 12.33 60.0 70.0 80.0 90.0 100.0 p*/kPa t/℃ 19.92 31.16 47.34 70.10 110.0 120.0 130.0 140.0 P*/kPa 143.3 198.6 270.2 361.5 476.2 39
2 气体和溶液

⑵溶液的分类: 按组成溶液的溶质和溶剂分为三类: ①. 液态溶液: ⅰ.气态溶于液态:HCl气体溶于水, 将液态物质定为溶剂。 ⅱ.固态溶于液态:NaCl溶于水, 将液态物质定为溶剂。 ⅲ.液态溶于液态:乙醇溶于水, 将含量多的物质定为溶剂。
②.气态溶液:所有的气态混合物均为气态溶液: 例:空气,N2、O2、CO2混合物 等。
拉罕姆指出:同温同压下, a
某种物质的扩散速度与其 b
密度的平方根成反比。-----气体扩散定律。
a b b
b a
a
为扩散速度
为气体密度
❖ 因为:同温同压下,气体密度与其相对分子 量Mr成正比,所以上式可改写成:
a
Mrb
b
Mra
即气体的扩散速度与其相对分子量的平方根 成反比。
利用此公式可以进行相对分子量的计算。
=2.99kg
❖ 例2:在373k,100kpa压强下,UF6 (密度最大的一种气体) ❖ 的解密:度由是PV多=n少R?T 是==H>2的PV多=少WM倍RT?
❖
==> PM= W RT =ρRt
V
❖ ∴ ρ=PM/RT=100×103Pa×352×10-3 /(8.314×373)
❖
=11.4(Kgm-3 )
在临界温度下,使气体液化所需的最小 压强,称为临界压强。用Pc表示。
在Tc,和Pc时1mol气态物质所占有的体 积,称为临界体积,用Vc表示。
Tc,Pc,Vc同称为临界常数。
从临界常数可知:He,H2,N2, O2是熔点、 沸点很低的物质,临界常数很低,难于液化。 (非极性分子之间的引力太小造成的。)
解: 3.173gNaCl :
nB=3.173/(23+35.5) =3.173/58.5
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
m 1.5 10 kPa 50L 8.314kPa.L.mol1.K 1 293K 32g.mol1 m 985g
3
1.1.3 气体分压定律(law of partial pressure )
分压 (1801-J.Dalton) 混合气体中,某一组分气体所产生的压力为 该组分气体的分压力。 分压力等于该组分气体在相同的温度下,单 独占据与混合气体相同体积时所产生的压力。ຫໍສະໝຸດ 蒸发H2O(l)凝聚
H2O(g)
为什么水有时蒸发?有时凝聚?
对于任意状态下液体的蒸气压p,则有
p < po 液体蒸发
p > po
p = po
气体凝聚
气、液共存(平衡状态)
不同的液体蒸气压是否一样? 液体蒸气压的大小与那些因素有关?
(2)蒸气压曲线
p
乙醚 乙醇 水
t
(3)影响饱和蒸气压的因素
A 物质本性:
溶剂的蒸气压与溶剂摩尔分数的乘积。
P=PA° xA
*在一定温度下,难挥发非电解质稀溶液的
蒸气压下降值P与溶质的摩尔分数成正比. P= PA°xB
1.4.2 溶液的沸点(boiling-point, bp)
(1) 液体的沸点 当液体的蒸气压力等于外压时,液体沸腾,此时 的温度称为该液体的沸点.
特点:液体的饱和蒸气压等于外压
如:定性估计下列溶液
0.1mol/kg 蔗糖溶液 0.1mol/kg NaCl 0.1mol/kg BaCl2
蒸气压、沸点、凝固点
1.5 电解质溶液(Electrolyte Solution)
非电解质(不电离) 强电解质 物 质 (完全电离)
电解质(电离)
实 验 发 现
弱电解质 (部分电离)
实际离子浓度 小于理论值 ?
1
1g/12000g m ol1 T 0.52K k g m ol 0.1k g 4.33 10 4 K
(2) 凝 固 点 下 降 法 T K f b
1
T 1.86K kg mol 1.6 10 3 K
1g/12000gmol1 0.1kg
c 施加最小外压防止 渗透发生
(1)半透膜(semipermeable membrane):只允 许某些分子通过的物质。 (2)渗透现象():溶剂分子通过半透膜进入溶
液的现象。
(3)渗透压:在一溶液上方加一额外压力,恰 能使渗透作用达到平衡,该额外压力为该溶 液的渗透压。
(4)定量计算渗透压
= cB R T
p—气体压力 V—气体体积 n—物质的量 T—热力学温度 SI单位 kPa SI单位 L SI单位 mol SI单位 K
R—气体摩尔常数 8.314 kPaLK-1 mol-1
1.1.2、应用(application)
例1:淡蓝色氧气钢瓶的体积一般为50L,在室 温为20℃下,钢瓶内的压力降至1.5106Pa时, 试估计氧气钢瓶中所剩氧气的质量。 M(O2)=32g.mol-1
排水集气法收集氢气V =0.4000L。计算氢 气物质的量n(H2)。已知25℃时水的饱和 蒸气压p(H2O)= 3.17kPa。
解:p(H2) = p(总) - p(H2O)
= 99.43kPa - 3.17kPa = 96.26kPa
p(H 2 )'V n( H 2 ) RT 96.26kPa 0.4L -1 -1 8.315kPa L mol K (273.15 25)K 1.5510 mol
2.67 g M (荼 ) 0.1kg
例:一种蛋白质,摩尔质量约为12000g· -1。 mol
欲测定其摩尔质量,试通过计算讨论用凝固点
下降法、沸点上升法或渗透压法哪种方法较好?
Kf (H2O) =1.86K· mol-1, kg·
Kb (H2O) =0.52K· mol-1, kg·
解: 设 样本溶解在 假 1g 100g水 中 (1) 沸 点 上 升 法 T K b b
1.4.5 稀溶液依数性的应用(application)
例:将2.67g萘 (C10H8)溶于100g苯中,测 得该溶液的沸点升高了0.531K(纯苯的 沸点为80.2℃),求苯的摩尔质量。(苯 的Kb=2.55K kg mol-1)
解: Tb=KbbB 0.531K=2.55K Kg M(萘)=128.2g mol-1 mol-1
分体积(1880-E.H.Amagat)
某组分的分体积等于该组分产生与混合气体 相同的压力时所占据的体积。
分压定律 混合气体的总压力(或总体积)等于各 组分分压(或分体积)之和 其数学表达式为: p = p 1 + p2 + … pi V = V1+V2 + … Vi
例题2 在25℃、p =99.43kPa压力下,利用
正比。 Tb=KbbB
Tb为稀溶液沸点的升高值, K;
Kb为溶剂的摩尔沸点上升常数,Kkgmol-1,
bB为溶质的质量摩尔浓度。
mol kg -1
1.4.3 溶液的凝固点( freezing point )
(1)液体的凝固点
凝固点——物质的固相与其液相达成 平衡时的温度 正常凝固点?
(3) 溶液的凝固点下降
当外压为101.3kPa时液体沸点为正常沸 点(normal boiling point )。
沸点高低与那些因素有关?
A 物质本性,一定的外压下,易挥发的 液体沸点低。 B 同一物质沸点与外压有关,外压越大, 沸点越高。 C 外压一定时,纯净物质具有固定的沸 点。(应用?)
(2)溶液的沸点升高 溶液的沸点升高值与溶液中溶质的摩尔分数成
Tf=Kf bB
Kf: K kg mol-1。 Tf : K。
?
1、从溶液中析出的固体是纯净物还是混合物? 是何物? 2、溶液的沸点和凝固点是否具有一定的值? 3、利用上面二性质可用来检验物质的纯度, 简述原理?
1.4.4 渗透压(osmotic pressure)
a 开始
b 水分子向糖溶 液渗透
2
1.1.4 实际气体(real gas )
实际气体的状态方程
an ( p 2 )(V nb) nRT V
a,b为校正常数,可查表。对于不同的气体,有不同的 数值。
2
1.2 分散系(disperse system )
1.2.1 分散系定义 分散系——由一种或多种物质分散在其它 一种物质中构成的系统。
(3)渗透压法
cRT
1g/12000g mol1 8.314kPa mol1 K 1 L1 293K 0.1L 2.03kPa
The Best
注意
• 稀溶液依数性的定量关系只适应于非电解质稀
溶液(难挥发),而对于浓溶液或电解质溶液,
定量关系不再成立,但性质依然存在。
1.5.1 离子氛模型(model of ionic atmosphere )
1.5.2 活度(activity )
B BcB / c
B为B的活度
B 为活度系数(activity coefficient),与溶液中离子间的相互 作用有关 cB为物质B的浓度 国标规定 b为标准浓度(1.0mol kg-1)-通常用c= 1.0molL-1
同一温度下,易挥发的液体蒸气压大。 那些液体物质易挥发?
B 温度:
同一液体,温度越高,蒸气压越大(?)。
(4)溶液的蒸气压降低 实验
经过一段 时间 水 糖
水
糖
溶液的蒸气压 比纯溶剂的低
(1)怎样利用液体的饱和蒸气压解释实验现象?
(2)为什么溶液的蒸气压会降低呢?
水及水溶液的蒸气压曲线
(5)拉乌尔规律(F M Raoult) 在一定温度下,稀溶液的蒸气压等于纯
多相
能通过半透膜
不能通过紧密滤纸
1.3 溶液的组成标度(solution scale)
1.3.1 B的质量分数(mass fraction of B )
mB wB m溶 液
wB为B的质量分数,SI单位为1
mB为B的质量, Sl单位为kg
m 为溶液的质量, Sl单位为kg
1.3.2 B的物质的量浓度
溶液的性质与那些因素有关?
导电性 酸碱性 氧化还原性 … 溶质的本质决定
蒸气压、凝固点、沸点、渗透压… 溶质的数量
1.4.1 溶液的蒸气压(vapor-pressure)
(1) 饱和蒸气压(saturated vapor pressure )
在一定温度下,与液体达成平衡的蒸汽所产生的压力 称为液体的饱和蒸气压 。 po
; kPa
R: 8.314 kPaL mol-1 K-1
cB:
mol L -1
(1)渗透方向:
小
溶剂 稀溶液 (2)等渗溶液: 渗透能力相同的溶液 1 = 2
大
溶液 浓溶液
c1= c2
(3)反渗透作用 在浓溶液一方施加较其渗透压还大的外
压,强迫溶剂分子由渗透压大的溶液进
入渗透压小的溶液。
1 气体和溶液
Gas and Solution
理解道尔顿分压定律 了解理想气体的状态方程及其应用
掌握溶液组成的标度
掌握稀溶液的性质及其应用
了解电解质溶液活度和离子强度的概念。
作业: 1.1, 1.3, 1.4 , 1.6, 1.8
1.1 气体(Gas)
1.1.1 理想气体状态方程 ( equation of state of ideal gas) pV=n RT
1
0.208mol kg
-1
1. 实验时使用bB 还是 cB更为方便?
