第二章 气体、液体和溶液
第二章 物质的状态 气体、液体、溶液
临界现象? 临界现象
课本p26 课本
Tb (沸点) < 室温 沸点) Tc < 室温, 室温, 室温下加压不能 液化
Tb < 室温, 室温, Tc > 室温, 室温, 室温下加压可液 化 Tb > 室温 Tc > 室温, 室温, 在常温常压下为 液体
24
临界常数: 临界常数:
p26
• 每种气体液化时 各有一个特定温度叫临界温度 每种气体液化时, 各有一个特定温度叫临界温度 临界温度Tc. 在Tc 以 无论怎样加大压力, 都不能使气体液化. 上, 无论怎样加大压力 都不能使气体液化 • 临界温度时 使气体液化所需的最低压力叫临界压力 临界温度时, 使气体液化所需的最低压力叫临界压力 临界压力Pc. • 在Tc 和 Pc 条件下 1 mol 气体所占的体积叫临界体积 条件下, 气体所占的体积叫临界体积 临界体积Vc.
17
压力P愈小 温度T愈高 愈高, 压力 愈小, 温度 愈高 愈接近理想气体 愈小
1mol N2气
Z=
18
不同气体的比较 (1mol, 300K )
Z=
19
图总结: 气体 Z-P 图总结:
1. 常压常温下,沸点低的气体,接近理想气体 常压常温下,沸点低的气体, 2. 起初增加压力时,对于分子量较大的分子,分子间作用力增 起初增加压力时,对于分子量较大的分子, 加占主导, 加占主导,使得 Z < 1 3. 增加较大压力时,分子的占有体积占主导,使得 Z > 1 增加较大压力时,分子的占有体积占主导,
第二章
物质的状态
p16
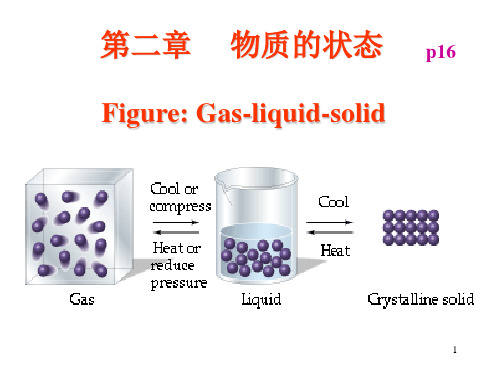
Figure: Gas-liquid-solid Gas-liquid-
1
本章主要内容: 本章主要内容: 一、气体
气体吸收
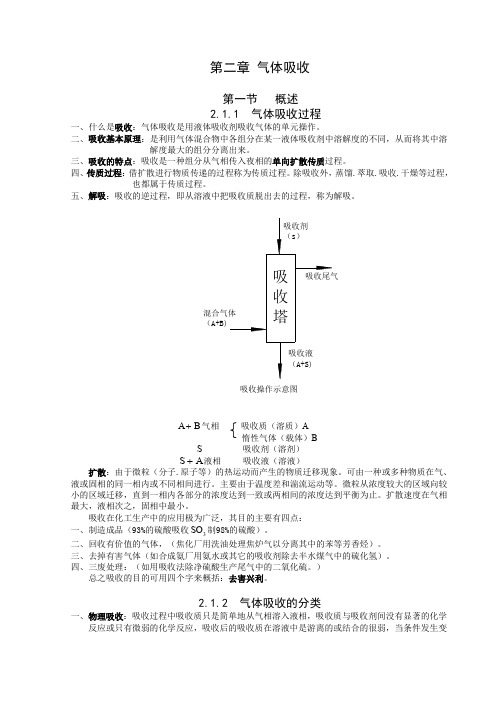
第二章气体吸收第一节概述2.1.1 气体吸收过程一、什么是吸收:气体吸收是用液体吸收剂吸收气体的单元操作。
二、吸收基本原理:是利用气体混合物中各组分在某一液体吸收剂中溶解度的不同,从而将其中溶解度最大的组分分离出来。
三、吸收的特点:吸收是一种组分从气相传入夜相的单向扩散传质过程。
四、传质过程:借扩散进行物质传递的过程称为传质过程。
除吸收外,蒸馏.萃取.吸收.干燥等过程,也都属于传质过程。
五、S吸收剂(溶剂)S+液相吸收液(溶液)A扩散:由于微粒(分子.原子等)的热运动而产生的物质迁移现象。
可由一种或多种物质在气、液或固相的同一相内或不同相间进行。
主要由于温度差和湍流运动等。
微粒从浓度较大的区域向较小的区域迁移,直到一相内各部分的浓度达到一致或两相间的浓度达到平衡为止。
扩散速度在气相最大,液相次之,固相中最小。
吸收在化工生产中的应用极为广泛,其目的主要有四点:SO制98%的硫酸)。
一、制造成品(93%的硫酸吸收3二、回收有价值的气体,(焦化厂用洗油处理焦炉气以分离其中的苯等芳香烃)。
三、去掉有害气体(如合成氨厂用氨水或其它的吸收剂除去半水煤气中的硫化氢)。
四、三废处理:(如用吸收法除净硫酸生产尾气中的二氧化硫。
)总之吸收的目的可用四个字来概括:去害兴利。
2.1.2 气体吸收的分类一、物理吸收:吸收过程中吸收质只是简单地从气相溶入液相,吸收质与吸收剂间没有显著的化学反应或只有微弱的化学反应,吸收后的吸收质在溶液中是游离的或结合的很弱,当条件发生变化时,吸收质很容易从溶剂中解吸出来。
如用水吸收二氧化碳。
物理吸收是一个物理化学过程,吸收的极限取决于操作条件下吸收质在吸收剂中的溶解度、吸收速率则取决于吸收质从气相主体传递入液相主体的扩散速率。
物理吸收都是可逆的一般热效应较小。
二、化学吸收:吸收过程中吸收质与吸收剂之间发生显著的化学反应。
例如NaOH 吸收2CO 。
化学吸收时,吸收平衡主要取决于当时条件下吸收反应的化学平衡,吸收速率则取决于吸收质的扩散速率和化学发应速率,因为化学吸收降低了吸收质的浓度故吸收速率一般比同样条件下没有化学反应的物理吸收速率大。
气体液体和溶液的性质

第一章 气体、液体和溶液的性质§1-1 气体的性质本节的重点是三个定律:1.道尔顿分压定律(Dalton’s law of partial pressures ) 2.阿码加分体积定律(Amagat’s law of partial volumes ) 3.格拉罕姆气体扩散定律(Graham’s law of diffusion )一、理想气体(Ideal Gases )――讨论气体性质时非常有用的概念1.什么样的气体称为理想气体?气体分子间的作用力很微弱,一般可以忽略; 气体分子本身所占的体积远小于气体的体积。
即气体分子之间作用力可以忽略,分子本身的大小可以忽略的气体,称为理想气体。
2.理想气体是一个抽象的概念,它实际上不存在,但此概念反映了实际气体在一定条件下的最一般的性质。
3.实际气体在什么情况下看作理想气体呢?只有在温度高和压力无限低时,实际气体才接近于理想气体。
因为在此条件下,分子间距离大大增加,平均来看作用力趋向于零,分子所占的体积也可以忽略。
二、理想气体定律(The Ideal Gas Law )1.由来(1) Boyle’s law (1627-1691)British physicist and chemist - The pressure-volume relationshipn 、T 不变 , V ∝ 1/ p or pV = constant(2) Charles’s law (1746-1823)French scientist 1787年发现-The temperature-volume relationshipn 、p 不变 , V ∝ T or V /T = constant(3) Avogadro’s law (1778-1823)Italian physicistAvogadro’s hypothesis :Equal volumes of gases at the same temperature and pressure contain equal numbers of molecular.Avogadro’s law The volume of a gas maintained at constant temperature andpressure is directly proportional to the number of moles of the gas.T 、p 不变 , V ∝ n2.理想气体方程式(The ideal-gas equation )由上三式得:V ∝ nT / p ,即pV ∝ nT ,引入比例常数R ,得:pV = nRT pV = nRT R---- 摩尔气体常量 在STP 下,p =101.325kPa, T =273.15K n =1.0 mol 时, V m =22.414L=22.414×10-3m 3R =8.314 kPa ⋅L ⋅K -1⋅mol -1nT pV R =K15.2731.0m ol m 1022.414Pa 10132533⨯⨯⨯=-11K m ol J 314.8--⋅⋅=4.理想气体方程式应用 可求摩尔质量(1) 已知p ,V ,T , m 求 M (2) 已知p ,T ,ρ 求 M5.实际气体(Real gas )与理想气体的偏差(Deviations of ideal behavior) (1) 实例:1mol 几种气体 pV / RT ~ p 曲线从两个图中,可以得知:a .分子小的非极性分子偏差小,分子大的极性强的分子偏差大;b .温度越高,压力越低,偏差越小。
第二章 气体和溶剂

一章1、气体除杂净化的主要对象:除去液雾和固体颗粒、干燥、除氧、除氮2、吸附剂由于作用不同分类:物理吸附、化学吸附、功能机吸附3、分子筛的定义:分子筛是具有均一微孔结构,而能将不同大小分子分离或选择性大小的固体吸附剂或催化剂,是一种结晶型的含水硅铝酸盐。
俗称“泡沸石”。
4、分子筛在空气装置中的应用:1)用于净化空气2)制取富氧空气3)用于纯化空气5、选择吸附剂做干燥剂时应考虑的因素:1)干燥剂的吸附容量,吸附容量越大越好。
2)吸附效率,吸附效率愈快愈好。
3)残留水的蒸汽压,吸附平衡后残留水的蒸汽压愈小愈好。
4)干燥剂的再生,干燥剂越易再生成本越低。
6、质子惰性溶剂分类:1)惰性溶剂,基本上不溶化不自电离2)偶合质子惰性溶剂,极性高但电离程度不大3)两性溶剂,极性强能电离的溶剂4)无机分子溶剂,不接受质子也不自电离。
(如so2、N2o4)二章7、化学气相沉积法的几种方法:1)高压化学气相沉积法2)低压化学气相沉积法3)等离子化学气相沉积法4)激光化学气相沉积法5)金属有机化合物化学气相沉积法6)高温化学气相沉积法7)中温化学气相沉积法8)低温化学气相沉积法8、化学气相沉积法的几种反应类型:1)热分解反应2)化学合成反应3)化学运输反应4)等离子体增强的反应5)其他能源增强反应9、等离子体增强反应沉积的优缺点:1)优点:基本温度低、沉积速率快、成膜质量好、针孔较少不易龟裂。
2)缺点:○1设备投资大,成本高,气体纯度要求高。
○2涂层过程中噪音大,强光辐射,有害气体、金属对人体有害。
○3对小针孔内表面难以涂层。
10、电阻炉中常用的发热体:金属发热体、碳素材料发热体、碳化硅发热体11、影响高温固相反应速度的因素:1)反应物固体的表面积和反应物间的接触面积2)生成物相的成核速度3)相界面间特别是通过生成物相层的离子扩散速度12、高温还原反应中,金属还原法还原剂的选择时应考虑因素:还原能力强、不与被还原金属生成合金、得到的金属纯度高、容易分离、成本低廉、容易处理。
高中化学必修一第二章知识点总结及练习

第二章化学物质及其变化一、物质的分类1、分类是学习和研究化学物质及其变化的一种常用的基本方法,它不仅可以使有关化学物质及其变化的知识系统化,还可以通过分门别类的研究,了解物质及其变化的规律。
分类要有一定的标准,根据不同的标准可以对化学物质及其变化进行不同的分类。
交叉分类和树状分类是常用的分类方法。
2、分散系及其分类把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫分散系。
被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
溶液、胶体、浊液三种分散系的比较二、物质的化学变化1、物质之间可以发生各种各样的化学变化,依据一定的标准可以对化学变化进行分类。
(1)、根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:A、化合反应(A+B=AB)B、分解反应(AB=A+B)C、置换反应(A+BC=AC+B)D、复分解反应(AB+CD=AD+CB)(2)根据反应中是否有离子参加可将反应分为:A、离子反应:有离子参加的一类反应。
主要包括复分解反应和有离子参加的氧化还原反应。
B、分子反应(非离子反应)(3)根据反应中是否有电子转移可将反应分为:A、氧化还原反应:反应中有电子转移(得失或偏移)的反应实质:有电子转移(得失或偏移)特征:反应前后元素的化合价有变化B、非氧化还原反应2、离子反应(1)、电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。
酸、碱、盐都是电解质。
酸:电离时生成的阳离子全部是氢离子的化合物碱:电离时生成的阴离子全部是氢氧根离子的化合物。
盐:电离时生成金属离子(或铵根离子)和酸根离子的化合物在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。
注意:①电解质、非电解质都是化合物,不同之处是在水溶液中或融化状态下能否导电。
②电解质的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电。
③能导电的物质并不全部是电解质:如铜、铝、石墨等。
2第二章 溶液1.溶液的概念

溶液各部分 性质一样
外界条件不变时, 溶液不分层,也 不析出固体沉淀
2. 溶液的组成 溶质:被溶解的物质 溶剂:能溶解其他物质的物质
溶液质量 = 溶质质量 + 溶剂质量
溶液中溶质和溶剂是如何确定的?
观察下列生活中常见的溶液,说出其中的溶剂和溶质
食醋
碘酒
硫酸铜溶液
葡萄糖注射液
盐酸
溶液中溶质和溶剂的划分:
溶剂
酒精 水 水 水 水
10ml汽油和90ml豆油? 90ml酒精和10ml水?
溶质和溶剂的划分原则:
1. 有水存在时水作溶剂,其它作溶质; 2. 固体、气体与液体形成溶液时,液体作溶剂
固体、气体作溶质; 3. 同种状态的物质形成溶液时,量多的作溶剂
课堂练习1:
1. 无色透明的液体就是溶液 2. 溶液一般是液态的,也有固态和气态的溶液 3. 溶液中的溶剂只能是一种,溶质也只能是一种 4. 在一杯糖水中底部的糖水要比上面的甜 5. 溶液一定是无色的
例1. 500m1氢氧化钠溶液中含2g NaOH, 求该溶液中NaOH的物质的量浓度?
解:
n
mV
cB?
V=0.5L m=2g MNaOH=40g/mol
n=
m M
=
2g 40g/mol
=0.05mol
溶液中NaOH的物质的量浓度为:
cB =
nB V
=
0.05mol 0.5L
=0.1mol/L
例2. 配制100ml 3mol/L KCl 溶液,需要 KCl的质量是多少? cKCl V n m ?
1. 概念:在一定温度下, 一定量饱和溶液中所含 溶质的量,就是溶质在该温度的溶解度
溶解度的表示方法
普通化学辅导:气体、液体和溶液常见问题1

普通化学辅导:气体、液体和溶液常见问题11. effusion(小孔扩散,渗流)和diffusion(相对扩散)有什么区别?答:小孔扩散与相对扩散的区别在于前者是气体向真空扩散,比较适合作为理论模型。
相对扩散时两侧气体分子相互撞击,虽然它仍然符合Graham扩散定律,但是比前一种情况要复杂一些。
2. 为什么气体速率分布函数会有两种不同表示形式?答:我们在课堂上学到了Maxwell-Boltzmann气体速率分布函数的两种形式。
一个是球极坐标系的表达式,另外一个是直角坐标系的表达式。
(参见“补充材料”里的“Maxwell-Boltzmann气体速率分布函数的推导”)通常我们根据体系性质的特点来选择坐标系。
例如考虑气体分子运动体系,通常我们都会选择直角坐标系,因为这样比较直观简捷。
但是当我们考虑中心力场体系时,如原子内部核与电子的相互吸引、气体分子各向同性的运动速率时,我们倾向于使用球极坐标。
因为这样可以方便推导、简化公式。
3. 在实验测定气体分子速率分布的装置中,用两个同速转动的圆盘来筛选符合要求的分子。
那么如果较慢的分子恰好与检出分子的速率相差一个或几个周期时会出现什么情况?答:我们可以检查实验测定中各个运动速率是否存在周期性关系。
如果的确发现周期性关系的话,那么我们就应当校正相应部分。
4. 实际气体压缩因子与压力的曲线:为什么在压力刚开始加大时,压缩因子会下降?答:我们知道实际气体分子之间存在范德华力。
范德华力的特点是:远距离相互吸引,近距离相互排斥。
当压力开始增加时,气体之间的引力增加,使得气体实际压力下降,导致压缩因子下降。
当气体压缩到一定程度之后,气体分子之间以排斥力为主,导致气体体积下降慢于压力的提高。
所以会有压缩因子-压力曲线先降后升的现象。
实际气体在高压下还会形成范德华簇,使实际气体的行为进一步复杂化。
另外,温度也是影响上述曲线的关键因素,通常温度越高,实际气体的行为越接近于理想气体。
新人教版高中物理选修三第二章《气体,固体和液体》测试(答案解析)

一、选择题1.(0分)[ID:130033]关于饱和汽和相对湿度,下列说法正确的是()A.饱和汽压跟热力学温度成正比B.温度一定时,饱和汽的密度为一定值,温度升高,饱和汽的密度增大C.空气的相对湿度定义为水的饱和汽压与相同温度下空气中所含水蒸气的压强之比D.空气的相对湿度越小,空气中水蒸气的压强越接近饱和汽压2.(0分)[ID:130022]下列反映一定质量理想气体状态变化的图象中,能正确反映物理规律的是()A.图(a)反映了气体的等容变化规律B.图(b)反映了气体的等容变化规律C.图(c)反映了气体的等压变化规律D.图(d)反映了气体的等温变化规律3.(0分)[ID:130020]空气压缩机的储气罐中储有1.0×105Pa的空气6.0L,现再充入1.0×105Pa的空气9.0L。
设充气过程为等温过程,空气可看做理想气体,则充气后储气罐中气体压强为()A.2.5×105Pa B.2.0×105Pa C.1.5×105Pa D.1.0×105Pa4.(0分)[ID:130012]如图,容器被绝热活塞分成两部分,分别装有理想气体A、B,开始时,A的温度为T A,B的温度为T B,且T A>T B;气体A、B均处于平衡状态,活塞静止.加热容器,使两边气体缓慢升高相同的温度,若不计活塞的摩擦,则活塞将( )A.向右移动B.向左移动C.保持不动D.因体积未知而无法确定5.(0分)[ID:130008]液晶属于A.固态B.液态C.气态D.固态和液态之间的中间态6.(0分)[ID :130007]一定质量的气体,保持体积不变,温度由0℃升高到10℃时,其压强的增量为Δp 1,当它由100℃升高到110℃时,所增压强为Δp 2,则Δp 1与Δp 2之比是( ) A .10∶1 B .373∶273 C .1∶1 D .383∶283 7.(0分)[ID :130004]如图所示,两根粗细相同、两端开口的直玻璃管A 和B ,竖直插入同一水银槽中,各用一段水银柱封闭着一定质量同温度的空气,空气柱长度H 1>H 2,水银柱长度h 1>h 2,今使封闭气柱降低相同的温度(大气压保持不变),则两管中气柱上方水银柱的运动情况是( )A .均向下移动,A 管移动较多B .均向上移动,A 管移动较多C .A 管向上移动,B 管向下移动D .均向下移动,B 管移动较多8.(0分)[ID :130000]关于液体的表面张力,下面说法中正确的是A .表面张力是液体内部各部分间的相互作用B .表面张力的方向总是垂直液面,指向液体内部C .表面张力的方向总是与液面平行D .因液体表面层分子分布比液体内部密集,分子间相互作用表现为引力9.(0分)[ID :129984]如图所示,封有空气的气缸挂在测力计上,测力计的读数为().F N 已知气缸质量为()M kg ,内截面积为()2S m 活塞质量为()m kg ,气缸壁与活塞间摩擦不计,外界大气压强为()0p Pa ,则气缸内空气的压强为( )A .0Mg p Pa S ⎛⎫-⎪⎝⎭ B .0mg P Pa S ⎛⎫- ⎪⎝⎭C .()0F M m g P Pa S ⎡⎤-+-⎢⎥⎣⎦D .()0F M m g P Pa S ⎡⎤---⎢⎥⎣⎦10.(0分)[ID :129976]如图所示,一端开口、另一端封闭的玻璃管内用水银柱封闭一定质量的气体,保持温度不变,把管子以封闭端为圆心,从开口向上的竖直位置逆时针缓慢转到水平位置的过程中,可用来说明气体状态变化的p-V 图像是( )A .B .C .D . 11.(0分)[ID :129972]如图所示,一个横截面积为S 的圆筒形容器竖直放置.金属圆板A 的上表面是水平的,下表面是倾斜的,下表面与水平面的夹角为θ,圆板的质量为.M 不计圆板与容器内壁之间的摩擦.若大气压强为0p ,则被圆板封闭在容器中的气体的压强p 等于( )A .0cos P Mg S θ+B .0cos cos P Mg S θθ+C .20cos Mg P Sθ+ D .0Mg P S+ 12.(0分)[ID :129956]以下结论正确的是( )A .晶体和非晶体都有固定的熔点B .浸润和不浸润现象都是分子力作用的表现C .对于同一种液体,饱和汽压是不随温度而变化的D .同种物质不可能以晶体和非晶体两种不同形态出现 二、填空题13.(0分)[ID :130147]如图,一粗细均匀、底部装有阀门的U 型管竖直放置,其左端开口、右端封闭、截面积为4cm 2.现关闭阀门将一定量的水银注入管中,使左管液面比右管液面高5cm ,右端封闭了长为15cm 的空气柱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
压力恒定时(不太大),一定量气体的体积与它的热力学温度成正比;
或恒压时,一定量气体的体积与温度的商值是恒量。即
VT V=bT
Vt/V0=(t+273)/273 热力学温标概念的引出
热力学温标概念的引出 将一定量的气体在沸水(100ºC)中的体积V100, 与冰水(0ºC)的 体积V0,相比增加37%。
pV= nRT= (m/M)RT 所以 M= (m/V)(RT/p)= ρ(RT/p)= [0.899 g.dm-1×8.31 kPa.dm3.mol-1.K-1 × 273+80)K] / 15.6 kPa= 169 g. mol-1
已知相对原子质量: Xe-131, F-19, 所以 131+ 19x= 169, x= 2
这种氟化氙的分子式是XeF2。
2.1.2 气体实验定律 (1) 气体化合体积定律 (Gay-Lussac, 1808)
在恒温恒压下,气体反应中各气体的体积互成简单整
数比。
ቤተ መጻሕፍቲ ባይዱ
道尔顿原子论无法解释
导致引出分子的概念
基本方法是:将从p1, V1, T1 到p2, V2, T2的过程分解为2个步骤: (1) 等温变化:从p1, V1, T1 到p2, V’, T1 (2) 等压变化:再从p2, V’, T1到p2, V2, T2 然后分别利用上述定律,通过V’将二者结合起来,即可得到
p1V1/T1 = p2V2/T2 = 恒量
物质的状态
特殊条件下: 等离子体(宇宙空间) 玻色-爱因斯坦冷凝体 (1995) 费米冷凝体 (2003)
➢与温度和压力条件有关 ➢分子间的距离不同 ➢分子间的作用力不同
固态
液态
气态
在通常的温度和压力条件下
气体或气态物质研究
重要性: 1. 相对分子量的测定 (定性到定量的过渡); 2. 分子的概念 3. 深化了对原子结构的认识(氢光谱); 4. 实用价值(气体计量,真空测量,气态物质的 分离和提纯)。
到19世纪末,人们才普遍使用现行形式的理想气体状态方程式,也 叫Clapeyron方程
pV = nRT
应用:相对分子量的测定
惰性气体氙与氟能形成多种氟化氙XeFx。实验测定在 80ºC, 15.6KPa时,某氟化氙样品的密度为0.899g.dm-1. 试 确定分子量。
应用:相对分子量的测定
惰性气体氙与氟能形成多种氟化氙XeFx。实验测定在80ºC, 15.6KPa时,某氟化氙样品的密度为0.899g.dm-1. 试确定分子 量及分子式。 解 求出摩尔质量,即可确定分子式 设氟化氙的摩尔质量为M,密度为ρ (g.dm-3), 质量为m (g), R应选用 8.31kPa.dm3.mol-1.K-1。
相关单位换算: 1 Pa = 1 Nm2 1 bar = 1105 Pa = 100 kPa 1 atm = 760 mmHg = 1.010325105 Pa 101 kPa 0.1 Mpa 1 kPadm3 = 1 J = 0.239 cal 1 cal = 4.184 J
英国化学家波义耳 (1627-1691)
第二章 气体、液体和溶液
2.1 理想气体及相关定律 2.2 实际气体和van der Waals方程 2.3* 气体分子运动论简介 2.4 相变与相平衡 2.5 相图 2.6 液体和液晶的基本性质 2.7 溶液浓度与溶解度 2.8 非电解质稀溶液和电解质溶液
第一章 气体 习题
教材一:习题 1.2;1.5;1.7;1.11;1.15.
理想气体状态方程 (The Ideal Gas Law):
pV = nRT( 形式简单,变量多,适用范围广)
式中 p:压力 (压强,Pa或kPa);
V:体积(dm3或cm3)
n:气态物质的量 (摩尔,mol); R:摩尔气体常数,或叫普适
气体恒量
摩尔气体常数 R
R = pV = 0.082057 L atm mol1 K1 nT = 8.3145 m3 Pa mol1 K1 = 8.3145 J mol1 K1
2.1 理想气体及相关定律
2.1.1 理想气体的概念及理想气体状态方程
理想气体的概念:温度不太低,压力不太高的稀薄气体。 两点基本假设:
(1) 分子间距离很远,相互作用力可忽略不计; (2) 分子自身的体积很小,与气体所占体积相比,可忽略不计。
显然,理想气体并不存在。但当气压趋近于零时,可无限接近理想气体。
Boyle定律 (1662):(恒温过程)
Robert Boyle的J型玻璃管恒温气体压缩实验结果:
p 1 V
pV = constant
即:温度恒定时,一定量气体的压力和它的体积的乘积为 常数。
用J型管测定恒温下的p V关 系
Charles (1787)-Gay-Lussac (1802)定律 :(恒压过程)
(V100- V0 )/V0=0.366= 100/273
(Vt- V0 )/V0= t/273
Vt/V0= 1+ t/273 V/T= constant
T: 热力学温标, T/K= t/ºC + 273.15 K: 温标单位
10
Clapeyron方程
19世纪,法国科学家Clapeyron综合波义耳定律和Charles定律,把 描述气体状态的3个参量p, V, T归并于一个方程式。
ftp账号:wangbw 密码:bwwang%%ccme 地址:ftp:///wangbingwu 习题课,理教206,周一10-11节
火
火焰是一种状态或现象,是可燃物与 助燃物发生氧化反应时释放光和热量 的现象。
单纯的说成固体或者气体都不合理的。
在物质变为气态以后,如果从外界继续得到能量,到一定程度后, 它的粒子又可以进一步分裂为带负电的电子和带正电的离子,即 原子或分子发生了电离。电离使带电粒子浓度超过一定数量(通 常大约需千分之一以上)后,气体的行为虽然仍与平常的流体相 似,但中性粒子的作用开始退居到次要地位,带电粒子的作用成 为主导的,整个物质表现出一系列新的性质。像这样部分或完全 电离的气体,其中自由电子和正离子所带的负、正电荷量相等, 而整体又呈电中性,行为受电磁场影响,称为“等离子体”。
