药品评价性抽验讲义-张立群
测定通脉灵片中丹参素含量
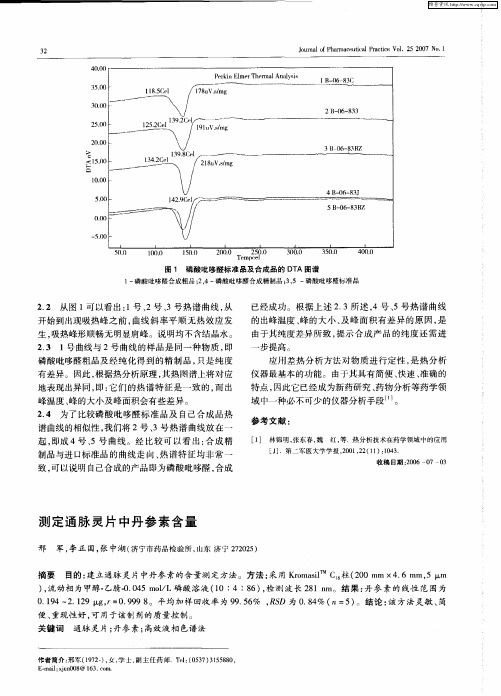
AB T AC Obet e T s bi P C m to fted t m nt no epzw tnh qi0 ei T n m in a e s SR T jci : oet l h aH L e d o h e r ia o ft r aasi unn n og aig t l . v a s h e i h e n l b e
制 品与进 口标 准品 的 曲线走 向 、 热谱 特 征 均 非 常 一
仪器最基本的功能。由于其具有简便 、 快速 、 准确 的 特点 , 因此它已经成为新药研究 、 药物分析等药学领 域 中一 种必 不 可少 的仪 器分析 手段 … 。 参考文献 :
[ ] 林锦明 , 1 张东存 , 魏 红 , 热分析技术在药学领域 中的应用 等.
X N u ,I hn —u ,H N hn -u Is t ef rgC nrl f iigCt, n g 7 05,hn ) I GJn L Z e ggo Z A G Z o gh (ntu rDu ot nn i J i 2 2 C ia it o ooJ y in 2
一
已经成功。根据上述 23所述 , 、 . 4号 5号热谱 曲线 的出峰温度 、 峰的大小 、 峰面积有差异 的原因 , 及 是
由于其 纯度 差 异所 致 , 示 合 成 产 品 的 纯度 还 需 进 提
步提高。 应用羞热分析方法对物质进行定性 , 是热分析
有差异。因此 , 根据热分析原理 , 其热图谱上将对应 地表现出异 同, : 即 它们的热谱特征是一致的, 而出 峰温度 、 峰的大小及峰面积会有些差异。 24 为 了 比较磷 酸 吡 哆醛 标 准 品及 自己合 成 品 热 . 谱曲线的相似性 , 我们将 2号、 号热谱 曲线放在一 3 起, 即成 4号 、 曲线 。经 比较 可 以看 出 : 成 精 5号 合
20081128215034 章

二、前药分子设计方法
(三) 设计生物前体 利用体内氧化、还原、降解、转位、水合、 脱水等相代谢反应释放活性药物,例如抗病毒 药阿昔洛韦水溶解度低,亲脂性透膜性差,口 服生物利用度15-20%。设计6-脱氧阿昔洛韦, 水溶性高318倍,生物利用度高5倍,体内被酶 催化氧化成阿昔洛韦。
6-脱氧阿昔洛韦和阿昔洛韦
• 前药与药物制剂的区别 药物制剂通过改变药物的物理状态,或与其他 惰性物质的物理组合或者调整介质的物理性质,以 达到易于呈现药效的目的,并不改变药物分子的化 学结构。 • 前药与同源类似物的区别 类似物本身具有活性,前药则需体内经生物转 化;类似物是为了改善药效,前药则为了改善药代 动力学性质;类似物合成较难,成功率则较低。
特点 组成
载体前药
生物前体
原药+基团、片段或 原药结构改变, 载体 无载基
亲脂性
活化反应
变化较大
水解
变化较小
氧化或还原
催化作用
化学作用或酶解
酶催化
前药是一种简便实用行之有效的新药 研发技术
• 据统计, 6.9%德国上市药品属于狭义前药, 另有4%属于广义性前药即代谢物为药物活性形 式。上市前药中49%经水解活化,23%属于生物 前体。前药型重磅炸弹药品也不少见,如奥美 拉唑、辛伐他丁、洛伐他丁、依那普利、阿昔 洛韦等。
–阿 霉 素 - 连 接 分 子 - Ala-Phe-Lys , 纤 溶 酶 ( Plasmin ) 在 体 内 以 原 酶 存 在 , 在 癌 组 织 被 plasminogen活化因子激活,参于癌浸润和转移过 程 、 血 管 生 成 、 肿 瘤 生 长 , Ala-Phe-Lys 是 Plasmin的底物。该前药经Plasmin水解除去三肽, 生成的中间体经1,6-消除反应去间隔臂释放阿霉 素,故毒性很低,活性相同。
制剂研发与申报

质中提取的有效部位及其制剂。 6.未在国内上市销售的中药、天然药物复方制剂。 7.改变国内已上市销售中药、天然药物给药途径
的制剂。 8.改变国内已上市销售中药、天然药物剂型的制
原则
研究用药
制剂?原料药?
尽量使用接近临床使用的药物 尽量为后续制剂研究提供空间
原则
- 须使用制剂进行研究的(同时考察原料药)
制剂中使用的辅料或溶酶对原料药吸收特征 可产生明显影响 - 原料药须在某辅料/溶酶中溶解 - 含特殊溶酶的注射剂 - 含特殊赋形剂的外用制剂 - 含特殊辅料的特殊剂型
鼓励创新
特殊制剂 - 申报主体:企业、研究单位 - 新药证书:靶向制剂、缓释制剂等 - 监测期:特殊剂型- 3年
政策 引导
避免简单重复
一般制剂 申报主体:生产企业 新药证书、监测期:无 延长审评时限:160日 采用新技术:提高质量、安全 与原剂型比:明显的临床优势
政策 引导
评价 - 安全 ?
途径/制剂创新
原途径改变的制剂
化药 2 类 中药、天然药物7类
途径与有效性
给药途径对ADME的可能影响? - 药效影响?
硫酸镁 口服- 导泻 静注- 镇静
途径与安全性
硫酸庆大霉素不同给药途径比较 - 致耳毒性、发生率 83例静滴和77例肌注- 常规剂量
随访期间--
肌注比静滴听力损害严重(高频区) 夜间给药听力损伤的可能性更大
(1)新药或其代谢产物的结构与已知致癌物质的 结构相似的;
(2)在长期毒性试验中发现有细胞毒作用或者对 某些脏器、组织细胞生长有异常促进作用的;
最新国家药品审评中心解读精品ppt课件

国食药监注[2008]7号通知
• 08年1月10日国家局发布了化学药品注射剂基 本技术要求。
• 国家局已受理但尚未批准注册的化学药品注射 剂应参照《技术要求》进行研究。
• 已经批准注册的化学药品注射剂也应参照《技 术要求》进行相关研究(完善灭菌工艺等), 并在申报再注册时提供相关研究资料。
国家药品审评中心
国家药品审评中心
6
计算实例
• 假设当某批药品的实际染菌率为5%时,
如果根据通常取样的数量为20支,则该 批药品通过无菌检查的概率
P=(1-q)n=(1-0.05)20 =0.359
即有35.9%的可能性,该批药品将会被判
定为无菌。
国家药品审评中心
7
无菌检查特性数据表
编号 污染 率 n=1
15
95
105
0.025 40.000
100
0.008 125.00
国家药品审评中心
13
• 湿热灭菌法:将物品置于灭菌柜内利用 高压饱和蒸汽、过热水喷淋等手段使微 生物菌体中的蛋白质、核酸发生变性而 杀灭微生物的方法。
• 湿热灭菌法通常分为过度杀灭法和残存 概率法两种。
国家药品审评中心
14
过度杀灭法
– F0不低于12 – 适用于热稳定性好的产品 – 以彻底杀灭任何污染的微生物为实
国家药品审评中心
19
无菌保证水平应用实例1
• 假定N0为100cfu/瓶,D值为1分钟,要达 到SAL不小于6,灭菌F0值应达到多少? 相当于115 ℃下灭菌多少分钟?
✓F0=(SAL+lgN0)×D =(6+ lg100) ×1= 8分钟。
✓换算成115 ℃下的F0 /L115=8/0.25=32分钟。
中药注射剂安全性再评价基本技术要求解读Z

(二)辅料及包装材料
• 1.中药注射剂用辅料的种类及用量应与国家 中药注射剂用辅料的种类及用量应与国家 标准一致。包装材料应与批准的一致。 标准一致。包装材料应与批准的一致。 • 建议不要改变辅料,如有变动,应有充分 建议不要改变辅料,如有变动, 的实验依据,尤其是对安全性的影响。 的实验依据,尤其是对安全性的影响。 • 2.注射用辅料、直接接触药品的包装材料应 注射用辅料、 注射用辅料 固定生产企业,严格进行供应商审计, 固定生产企业,严格进行供应商审计,应 提供生产企业资质证明文件、执行标准、 提供生产企业资质证明文件、执行标准、 检验报告、购货发票、供货协议等, 检验报告、购货发票、供货协议等,进口 辅料还应提供进口注册证。 辅料还应提供进口注册证。
(四)质量研究
• 3.应结合产品的安全性、有效性及均一性, 应结合产品的安全性、有效性及均一性, 应结合产品的安全性 进行相关质控方法的研究。 进行相关质控方法的研究。
(三)生产工艺
• 2.中药注射剂应严格按工艺规程规定的工艺 中药注射剂应严格按工艺规程规定的工艺 参数、工艺细节及相关质控要求生产, 参数、工艺细节及相关质控要求生产,并 强化物料平衡和偏差管理, 强化物料平衡和偏差管理,保证不同批次 产品质量的稳定均一。 产品质量的稳定均一。 • 要求制订详细的 要求制订详细的SOP,每一步骤均应有质 , 控要求,且应具有可操作性。 控要求,且应具有可操作性。 • 要对以药材投料的控制收率,积累数据, 要对以药材投料的控制收率,积累数据, 制订合理的收率幅度。 制订合理的收率幅度。
(一)原料
• 如确需固定多个基原或产地的,应提供充分的研 如确需固定多个基原或产地的, 究资料,并保证药材质量稳定。 究资料,并保证药材质量稳定。 • 建议不要固定多基原,可固定多产地,但要围绕 建议不要固定多基原,可固定多产地, 着制剂的控制指标去选择不同产地,而不是只追 着制剂的控制指标去选择不同产地, 求含量的高低。 求含量的高低。 • 应进行相应的质量对比研究 • 可选用不同产地的药材进行勾兑后提取,但应有 可选用不同产地的药材进行勾兑后提取, 试验数据支持。 试验数据支持。
2023年执业药师考试药物分析讲义

第一章国家品原则1.概念2.制定原则3.中国药典构造和现行版本4.其他常用药典5.药物分析有关旳凡例规定1.国家药物原则概念记载有药物规格、检查措施以及生产工艺旳技术规定旳、各药物有关部门和单位共同遵照旳法定根据、技术文献。
三类:药典、药物原则、药物注册原则2.制定原则三性药物针对性措施科学性:精确敏捷简便迅速,先进不乏合用(利于普及)程度合理性3.中国药典构造和现行版本中国药典Ch.P,2023年版,三部构造:凡例、正文、附录、索引凡例概念:共性问题统一规定,有法律约束力有关规定“贮藏”:密闭、密封、熔封或严封阴凉处、凉暗处、冷处、常温、未规定贮藏温度措施:法定措施,仲裁根据含量及程度:重量百分数;原料药含量>100%;未规定上限有关规定原则品、对照品:指定部门制备、标定及供应;对照品含量除另有规定外,按干燥品(或无水物)计算;原则品用于生物检定、抗生素或生化药物含量或效价测定,按效价单位(或μg计)。
精确度(例子):称取,“约”若干,称定、精密称定、精密量取,恒重,“按干燥品计”,空白试验,未注明旳试验温度旳试验温度规定正文内容:品名、构造式、分子式、分子量、含量或效价规定、性状、鉴别、检查、含量测定、规格、类别、贮藏、制剂性状:外观、臭、味、溶解度、物理常数鉴别:化学法(显色、沉淀、产气)、物理化学法、生物学法检查:安全性、有效性、均一性、纯度(例子)含量测定:重量百分数、干燥品计化学分析法:精密度高、精确性好仪器分析法:敏捷度高、专属性强生物测定法:成果与活性有关附录内容:制剂通则、通用检测措施、指导原则作用:“通用”措施和“指导原则”旳技术文献一般鉴别试验、分析措施、物理常数测定措施、特殊基团和物质测定措施、一般杂质检查措施、试液、滴定液配制等外国药典美国药典:USP英国药典:BP日本药局方:JP欧洲药典:E.P.第二章药物分析基础1.药物检查基本程序2.计量器具旳使用与校正3.数据处理4.措施验证药物检查旳基本程序取样:3件、300件、三公式、3次用检查:性状、鉴别、检查、含量测定记录和汇报记录与汇报旳内容:检查对象、检查根据、检查项目与措施、数据、成果和结论、检查人(复核人)、负责人原则:真实、完整、简要、详细、清晰涂改方式计量器具旳使用与校正计量器具:分析天平、紫外与红外分光光度计、pH计、旋光计、容量瓶、滴定管和移液管分析天平用途:含量测定、对照品、滴定液标定等旳“精密称定”感量:0.1mg 0.01mg, 0.001mg选用:不一样称量范围选用不一样感量旳天平(原理与例子)玻璃仪器校正原理:V=W/d容量瓶:允差为1/1000,校正时,瓶内洁净、干燥、不挂水珠移液管:100ml允差:1/1000;25ml:2/1000滴定管:分段校正;允差:10ml如下2/1000,20ml以上1/1000数据处理误差旳概念绝对误差和相对误差系统误差与偶尔误差系统误差特点:方向、大小固定,反复出现,来自措施、试剂、操作、仪器;消除原因可消除偶尔误差特点:方向、大小不固定,大误差概率小,小误差概率大,正负误差几率相等;反复测定平均可减少有效数字(所有计量旳数据)精确数字+最终一位不精确数位数修约:四舍六入五留双运算法则:加减传递绝对误差;乘除传递相对误差(例子)分析措施验证验证内容: 精确度、精密度、专属性、检测限、定量限、线性、范围和耐用性精确度:回收率(%)及其公式精密度:同一均匀样品,偏差或原则偏差(SD)或相对原则偏差(RSD)及其公式;精密度与精确度关系精密度评估旳三层次:反复性(同一人多次)、中间精密度(同试验室不一样人多次)、重现性(不一样试验室不一样人)专属性检测限:能检出旳最低浓度或量目视法信噪比法S/N定量限:能精确定量旳最低浓度或量信噪比10/1线性:测定成果与样品浓度正比关系最小二乘法回归,有关系数r范围:在到达精确度、精密度和线性规定下,合用旳高下限浓度区间耐用性:测定条件变动对措施成果旳影响程度分析措施定性分析(如鉴别):检测限、专属性、耐用性定量分析常量定量:精确度、精密度、线性、范围、专属性、耐用性微量定量:精确度、精密度、定量限、线性、范围、专属性、耐用性附表检查项目和验证内容鉴别杂质测定含量测定及溶出量测定定量程度精确度精密度反复性中间精密度专属性检测限定量限线性范围耐用性---+---+++++-++++---++---+++++--+++第三章物理常数测定法物理常数测定旳意义物理常数:熔点、凝点、相对密度、比旋度、黏度、碘值、皂化值、酸值、吸取系数、馏程、折光率(二点三度三值一数一馏率)本章内容:熔点、旋光度和pH值熔点测定法概念:熔点、熔程、初熔、全熔、熔融同步分解测定法:三法考试要素:105℃或五氧化二磷干燥;3mm,2.5cm,样品于汞球中部,升温速率,反复三次平均;b形管;通过校正旳0.5℃刻度分浸型温度计;内径0.9-1.1mm,壁厚0.1mm旳中性硬质玻璃毛细管;传温液旋光度测定法:概念:平面偏振光,顺右逆左比旋度概念应用:鉴别、检查、含量测定,记住测定比旋度或用旋光法进行检查和含量测定旳药物测试措施:0.01°,无气泡澄清溶液,溶剂空白校正,中国药典20℃、钠光谱D线(589.3nm)pH值测定概念:氢离子活度负对数pH值测定系统(原电池):指示电极、参比电极、待测液测定措施原则缓冲溶液旳选择定位和斜率调整高pH值旳碱误差:锂玻璃电极新沸放冷旳纯化水、电极清洗第二部分分析措施第四章滴定分析法原则液(滴定液)(A)待测物(B)+指示剂A+B=C滴定分析概念:滴定液与待测物定量反应;指示剂滴定特点:精确可靠,简便迅速,原料药分析首选滴定类型及其原理指示剂选用及终点现象滴定液配制与标定(基准物、有特点旳措施)应用酸碱滴定类型原理特点滴定剂指示剂应用强酸、强碱滴定突越大,计量0.05mol/L硫酸、酚酞、甲基红、滴定液标定滴定剂标定氧化还原滴定第五章分光光度法紫外-可见分光光度法、红外分光光度法,掌握:1.原理2.仪器基本构造3.应用紫外-可见分光光度法原理价电子能级跃迁,200-760nm光吸取定量:单色光,比吸取系数、摩尔吸取系数,A值范围0.3-0.7 仪器构造光源:氢灯、氘灯和钨灯单色器:光栅+狭缝吸取池:玻璃、石英检测器:光电倍增管二极管阵列(同一时间得到全波长光谱)应用规定1.溶剂:溶解药物、不挥发、无化学作用、吸光度符合规定2.空白对照:溶剂3.测定波长:偏差不不小于±2nm4.供试液浓度:使A值在0.3-0.75.狭缝宽度(保证单色光和敏捷度):狭缝再小,吸光度不再大类型1.鉴别:查对光谱特性参数()比较光谱、比较A比值2.杂质检查:如肾上腺素旳酮体检查3.含量测定:对照品比较法吸取系数法计算分光光度法比色法红外分光光度法原理:分子振动、转动能级跃迁,偶极矩大峰强度大,4000-400cm-1仪器构造光源:能斯特灯和硅碳棒吸取池:气、液、固均可,固体为KBr、氯化钾压片或糊法、薄膜;液体溶剂为CHCl3或CS2,盐片有:KBr、氯化钾、氯化钠盐片单色器:光栅或尼克尔干涉仪检测器:真空热电偶、高来池红外吸取与构造关系官能团区4000-1300cm-1与指纹区1300-400cm-1及其特点重要旳官能团吸取特性应用鉴别:药物红外光谱集检查:甲苯咪唑低效晶型第六章色谱法色谱旳概念与分析特点色谱理论色谱分类色谱仪器基本构造(检测器)色谱分析应用色谱基础知识1.色谱分析特点:高敏捷度、高效能、高选择性、迅速度2.色谱峰三参数:峰面积(定量)、峰位(定性)、峰宽(柱效)色谱理论分派系数、容量因子:k=K×(V s/V m)=(C s/C m)×(V s/V m);容量因子差异是色谱分离旳先决条件;分派系数差异是物质分离旳前提。
UPLC法同时测定通脉颗粒中5个主成分的含量及其灰色关联度分析

UPLC法同时测定通脉颗粒中5个主成分的含量及其灰色关联度分析*鄢长余,石亚囡,赵月然,高珊,姜范成,胡景莲**,门启鸣**(大连市药品检验所,大连116021)摘要 目的:建立超高效液相色谱法同时测定通脉颗粒中丹参素、原儿茶醛、葛根素、大豆苷和丹酚酸B 含量,并通过灰色关联度分析法对5种成分进行分析评价。
方法:采用XBridge TM C18色谱柱(4.6 mm×75 mm,2.5 μm),以乙腈(A)-0.2%磷酸(B)为流动相,梯度洗脱,流速0.7 mL·min-1,测定波长280 nm。
结果:通脉颗粒中丹参素、原儿茶醛、葛根素、大豆苷和丹酚酸B进样量分别在0.011~0.106 μg(r=0.999 9),0.004~0.043 μg(r=0.999 9),0.019~0.193 μg(r=0.999 8),0.008~0.084 μg(r=0.999 9),0.005~0.048 μg (r=0.999 9)范围内呈良好线性关系,平均回收率(n=9)分别为99.5%、95.0%、96.8%、97.6%、100.8%;含量测定结果分别在0.18~18.45、0.01~0.78、0.04~9.75、0.01~1.80、0.05~1.58 mg·g-1之间。
通过灰色关联度方法分析,结果在0.25~0.72之间,表明各生产企业之间产品质量差异较大。
结论:该方法为通脉颗粒的质量控制和评价奠定了基础。
关键词:通脉颗粒;丹参;川芎;葛根;丹参素;原儿茶醛;葛根素;大豆苷;丹酚酸B;含量测定;灰色关联度;超高效液相色谱中图分类号:R 917 文献标识码:A 文章编号:0254-1793(2017)04-0624-07doi:10.16155/j.0254-1793.2017.04.10Simultaneous determination of 5 main components inTongmai granules by UPLC and grey relational analysis *YAN Chang-yu,SHI Ya-nan,ZHAO Yue-ran,GAO Shan,JIANG Fan-cheng,HU Jing-lian**,MEN Qi-ming**(Dalian Institute for Drug Control,Dalian116021,China)Abstract Objective:To establish a UPLC method for simultaneous determination of danshensu,protocatechuic aldehyde,puerarin,daidzin and salvianolic acid B in Tongmai granules.To analyze and evaluate the 5 components with grey relational analysis.Methods:Separation was performed on a XBridge TM C18 column(4.6 mm×75 mm,2.5 μm).And the mobile phase consisted of acetonitrile(A)and 0.2% phosphoric acid(B)with gradient elution at a flow rate of 0.7 mL·min-1.The detection wavelength was 280 nm.Results:Danshensu,protocatechuic aldehyde,puerarin,daidzin and salvianolic acid B showed good linearity in the ranges of 0.011-0.106 μg(r=0.999 9), * 2015年国家药品评价性抽验项目 ** 通信作者 胡景莲 Tel: (0411)84255298;E-mail:1430128258@ 门启鸣 Tel: (0411)84255200;E-mail: mqm@ 第一作者 Tel: (0411)84255298;E-mail: 125743509@0.004-0.043 μg (r =0.999 9),0.019-0.193 μg (r =0.999 8),0.008-0.084 μg (r =0.999 9),0.005-0.048μg (r =0.999 9),respectively .The average recoveries (n =9)were 99.5%,95.0%,96.8%,97.6%,100.8%,respectively .Their contents in samples were between 0.18-18.45 mg ·g -1,0.01-0.78 mg ·g -1,0.04-9.75 mg ·g -1,0.01-1.80 mg ·g -1,0.05-1.58 mg ·g -1,respectively .Results of grey relational analysis were between 0.25 and 0.72,illustrating that the quality of the products from different manufacturing enterprises was greatly different .Conclusion :The method offered the foundation for the quality control and evaluation of Tongmai granules .Keywords :Tongmai granules ;Salviae Miltiorrhizae Radix et Rhizoma ;Chuanxiong Rhizoma ;Puerariae Lobatae Radix ;danshensu ;protocatechuic aldehyde ;puerarin ;daidzin ;salvianolic acid B ;assay ;grey relational ;UPLC (4.6 mm ×75 mm ,2.5 μm ;填料:十八烷基键合硅胶;Waters 公司);Sartorius BP211D 、Sartorius BP221S 电子天平(Sartorius 公司)。
含刺五加药材的两种中成药快速检验方法的研究

含刺五加药材的两种中成药快速检验方法的研究
王春红;张立群;聂晶;张洪
【期刊名称】《中成药》
【年(卷),期】2009(031)007
【总页数】3页(P1138-1140)
【作者】王春红;张立群;聂晶;张洪
【作者单位】湖北省药品检验所,湖北武汉,430064
【正文语种】中文
【中图分类】R927.1
【相关文献】
1.香砂养胃系列中成药的快速检验方法研究 [J], 颜晓航;单玉荣
2.两种凝胶电泳法在含蛋白中药材鉴定中应用的比较研究 [J], 张波;黄开颜;黄文;张克纯;刘群良
3.采用HPLC法快速检验几种含黄芩、丹参中成药的研究 [J], 齐红梅;胡新颖
4.含毒性药材中成药的使用情况分析研究 [J], 辛丹; 丁庆明; 刘美颖
5.对含发酵类药材六神曲的中成药卫生标准研究 [J], 杨荣州;韩威;李之英
因版权原因,仅展示原文概要,查看原文内容请购买。
药品抽验抽验培训PPT课件

可编辑
20
5、药材经销商被抽取的药材的来源或者产
地凭证、进货量、库存量、销售量和购销记录 等相关资料。
6、其他认为需要提供的资料。
可编辑
21
(二)确定抽样场所**
抽样场所一般为药品生产企业的成品仓库 和药用原辅料仓库,药品经营企业的仓库和 门市部,药品使用单位的药房和药库,以及 其他认为需要抽样的场所。具体抽样地点由 抽样人员确定。抽样前应认真检查药品的贮 藏条件是否符合药品质量标准中规定的贮藏 要求,并做好记录。
可编辑
25
4、需抽真空或充氮气的药品,应预先准备相应的设 备和器材,以便对样品和被拆包的抽样单元抽真空或 充氮气,并立即加以密封。
5、凡直接接触药品的包装,须拆包取样时,应在下 列洁净级别要求下施行: (1)原料药:
①法定药品标准中列有无菌检查项目者,应在100级 或10000级背景下局部100级。
②其他原料药为不低于300000级。 (2)制剂口服固体药品为30000级。
可编辑
26
(三)抽样过程应注意安全操作 1、对毒性、腐蚀性或易燃易爆药品,抽样 时须穿戴必要的防护用具(如防护衣、防护 手套、防护镜或防护口罩等),小心搬运和 取样,所取样品包装外应标以“危险品”的 标志,以防止发生意外事故。 2、易燃易爆药品应远离热源,并不得震动。
可编辑
23
六、注意事项
(一)抽样时抽样人员应认真检查药品包装是否按照 规定印有或者贴有标签并附有说明书,标签上的药品 名称、批准文号、批号、生产企业名称等字样是否清 晰;标签或者说明书的内容是否与药品监督管理部门 核准的内容相符;麻醉药品、精神药品、医疗用毒性 药品、放射性药品、外用药品和非处方药的标签是否 印有规定的标志等。同时,应当核实被抽取药品的库 存量。抽样过程中应注意从包装情况、进货渠道等方 面勘验药品的真伪,发现有假冒疑点的,应进行针对 性抽样,并在抽样记录中注明。
药物现代评价方法 第八章 药物体内过程评价 6-9节 学生讲课课件

临床药学二班 祝明月 郭崇真 马思宇 宋馨
C
目录
ONTENTS
第六节、新药开发研究中的药物体内过程评价 第七节、药物体内过程评价中的生物样品检测方法 第八节、生理药动学模型简介 第九节、群体药动学方法简介
新药开发研究中的药物体 6 1内过程评价
第六节 新药开发研究中的药物体内过程评价
பைடு நூலகம்
三、药物体内过程评价的要求
(一)、新药临床前药动学研究的要求
3、临床前药动学研究 (3)采样点的确定:空白样品—给药前 至少持续3~4 个半衰期,或 吸收相—2~3个采样点 持续到Cmax 平衡相—3~4个采样点 的1/10~1/20. 消除相—4~6的采样点 (4)药动学参数的估算:可采用适宜的房室模型或非房室模型。
标准曲线方程
标准曲线至少应有6个浓度点(不包括零点)组成并应覆盖全 部生物样品的浓度范围,不得用外推的方法计算样品浓度。
第七节 药物体内过程评价中的生物样品检测方法
三、生物样品检测方法的评价指标与要求
(六)生物样品的稳定性 应根据具体情况进行稳定性考察,以保证检测结果的准确性和重现性。 (七)提取(萃取)回收率 定义:是指样品经萃取(提取)后进行测定时,引入测定仪器中供测 定的被测组分占样品中原有被测组分的百分率,也成为绝对回收率。 目的:评价分离纯化过程中被测组分的损失大小,即分离的定量程度。 要求:一般只要求大于50%,但必须相对恒定。
三、药物体内过程评价的要求
(一)、新药临床前药动学研究的要求
4、组织分布试验:一般用大鼠或小鼠,选定一个有效剂量给药后, 分别在吸收相、分布相和消除相各选一个时间 点取样测定。 注:每个时间点至少有5只动物的数据;测定的样本包括心、肝、 肾、肺等。
薄层扫描法测定肉桂中桂皮醛的含量

薄层扫描法测定肉桂中桂皮醛的含量
刘伟华;孙晓菊;张立群
【期刊名称】《中国中药杂志》
【年(卷),期】1992(17)6
【摘要】用氯仿提取,薄层扫描法直接测定药材中桂皮醛的含量,可作为评介肉桂质量的指标。
【总页数】2页(P358-359)
【关键词】肉桂;桂皮醛;分析
【作者】刘伟华;孙晓菊;张立群
【作者单位】湖北省药品检验所
【正文语种】中文
【中图分类】R284.1
【相关文献】
1.GC法测定肉桂中桂皮醛的含量 [J], 李会平
2.薄层扫描法测定茯参胶囊中桂皮醛的含量 [J], 芦金清;朱婷;舒翔;曹杨
3.薄层扫描法测定牵正膏中桂皮醛的含量 [J], 任孝德;刘杰
因版权原因,仅展示原文概要,查看原文内容请购买。
处方点评抽样与统计分析方法

处方点评抽样与统计分析方法一、统计学概述统计学是把科学和艺术结合在一起进行收集和分析数据资料的一门学科。
因为科学研究常研究的是事物的一般规律,研究的是其共性;艺术张扬的是其个性,两者相差很远。
而统计学是通过张扬有差别的个性来寻求事物背后的一般规律,所以它是连接科学和艺术的一个桥梁。
早在16世纪,意大利人把统计学称为国情学。
这种说法后来传播到法、德、荷等欧陆国家。
在17,18世纪,这些国家的大学里讲授的“统计学”课程,实际上就是讲“国情学”,包括有关人口,经济,地理,乃至政治方面的内容。
到十九世纪初,逐步演变为现代西方统计学——Statistics。
统计学可与各领域、各专业相结合,已在社会、人口、教育、环境等各领域的应用研究中被广泛应用,因为它是一门方法学,是破解各领域难题的科学工具。
如工业统计,卫生统计,生物统计,医药统计,金融统计,法学统计,心理统计,交通统计、教育统计等等。
卫生统计学属应用统计学,运用数理统计学的原理和方法,研究医学科研及卫生工作中有关数据的收集、整理、分析的科学。
其内容包括三部分:1、统计设计:抽样方法、研究设计方案样本含量(大小)的确定2、整理资料:数据录入、核查和汇总3、分析资料:统计描述、统计推断。
二、目的意义处方点评是加强合理用药的管理手段,目的是要解决临床不合理用药问题,不断提高临床医疗水平。
在处方点评中应用卫生统计学的意义:1、控制影响处方点评的因素2、保证处方点评的质量3、提高处方点评的水平4、促进临床合理用药在处方点评工作应用卫生统计,其内容包括处方抽取的数量(样本含量)和抽样方法、处方数据资料的整理、分析、解释和描述。
将获得可靠的结果,作出科学的推断或预测,为政府或卫生管理部门在医疗工作中进行管理决策和行动提供依据和建议。
因此在处方点评中应用卫生统计,必须做到以下原则:1、要有足够的样本含量;2、被抽查的处方要有代表性;3、抽样方法要科学;4、点评结果要有可比性。
中成药口服固体制剂的系统分类与溶出度方法建立浅析

中成药口服固体制剂的系统分类与溶出度方法建立浅析
白政忠;刘利群;张丁丁;张清波;张秋生
【期刊名称】《中国药品标准》
【年(卷),期】2015(0)3
【摘要】自1994年,王冬梅等学者报道溶出度应用于中成药的质量考察以来,经过众多学者的研究,现已经明确了溶出度对中成药口服固体制剂的质量控制是一个十分重要的质量指标。
为此,对中成药口服固体制剂的溶出度方法建立的系统研究具有积极意义。
本文根据化学药口服固体制剂生物药剂学分类系统( BCS)的思路,拟给出可能的中成药口服固体制剂的分类体系模式,旨在为中成药口服固体制剂溶出度方法的建立提供宏观上的思路。
【总页数】4页(P163-166)
【作者】白政忠;刘利群;张丁丁;张清波;张秋生
【作者单位】黑龙江省食品药品检验检测所,哈尔滨150088;黑龙江省食品药品检验检测所,哈尔滨150088;黑龙江省食品药品检验检测所,哈尔滨150088;黑龙江省食品药品检验检测所,哈尔滨150088;黑龙江省食品药品检验检测所,哈尔滨150088
【正文语种】中文
【中图分类】R921.2
【相关文献】
1.改进溶出度评价方法,提高固体药物制剂水平--论如何提高我国口服固体制剂的内在品质(溶出度研究系列二) [J], 谢沐风
2.口服固体制剂溶出度测定方法的研究与应用进展 [J], 张伟;刘建芳;赵彩霞
3.含抑菌成分中成药固体制剂微生物限度检查验证方法的建立 [J], 任敬超
4.含抑菌成分中成药固体制剂微生物限度检查验证方法的建立 [J], 任敬超
5.改善口服固体制剂溶出度的方法 [J], 黄胜炎
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药品评价性抽验
指导原则及分析思路
张立群
湖北省食品药品监督检验研究院
2012.4.武汉
药品标准是国家对药品质量规格及检验方法所作y
出的技术规定,是按照规定的处方和工艺条件合法生产的药品应该达到的技术标准。
是药品质量法生产的药品应该达到的技术标准是药品质量
评价的重要依据。
对上市后的药品以抽验的方式以法定标准为依y对上市后的药品以抽验的方式,以法定标准为依据,以法定检验和探索性研究为手段,对药品进
行质量评价,为药品安全监管、有效控制质量风行质量评价为药品安全监管有效控制质量风险提供科学依据。
药品评价性抽验
围绕药品安全性有效性稳定性用现代质量y围绕药品安全性、有效性、稳定性,用现代质量控制的理念、思路、方法开展探索性研究。
y定位于上市后药品质量的评价。
法定检验与质量评价并重、有效性与安全性检测并重、质量控制与风险检测并重。
探索性研究项目内容重在评价意义和评价效果y探索性研究项目内容重在评价意义和评价效果。
药品评价性抽验
依据现行标准检验结果分析
y
y对重要检验项目的结果分析。
对现行标准中与药品安全性、有效性、稳定性有直接关联,明显影响药安全性有效性稳定性有直接关联明显影响药
品质量的检验项目的检验结果进行分析,重点分析不合格的原因。
不合格的原因
y对检验中发现问题的分析。
依据现行标准检验时,应积极主动发现检验中存在的问题并进行分析尽应积极主动发现检验中存在的问题并进行分析,尽
可能找出这些问题与原辅料、生产工艺及生产过程管理之间的关系。
管理之间的关系
y对现行检验标准的评价分析。
检验项目的设置、限度、以及检验方法的合理性、科学性。
度以及检验方法的合理性科学性
药品评价抽验质量分析指导原则
探索性分析研究
y
y根据法定检验结果,对可能存在的非法添加、违法投料、违反生产工艺等建立探索性分析研究检法投料违反生产工艺等建立探索性分析研究检
验方法。
对探索性分析研究检验方法的合理性科学性进y对探索性分析研究检验方法的合理性、科学性进行验证并提供验证结果。
y对法定标准检验结果与探索性研究分析结果进行对比分析,找出存在的主要问题。
根据存在的问题提出标准修订加强生产监管等y根据存在的问题提出标准修订、加强生产监管等建议
药品评价抽验质量分析指导原则
1原料药材的质量
y、原料药材的质量。
y2、工艺稳定性对质量的影响,
多药味多成分多组分的专属性检测y3、多药味、多成分、多组分的专属性检测y4、有害物质、有害元素、有毒成分的检测整体质量均性稳定性评价
y5、整体质量均一性、稳定性评价
y6、违法生产、非法添加、非法染色的检测y7、辅料、添加剂的检测。
y8、药品的稳定性及包装材料的影响。
y9、中药注射剂质量评价及安全性检测。
10、近红外检测。
y
质量评价内容
关注投料药材的质量特别是分列药材混淆品y关注投料药材的质量。
特别是分列药材、混淆品种、紧缺濒危药材、替代品种(金银花、土大黄、
五味子黄柏葛根木香等)检测等
五味子、黄柏、葛根、木香等)检测等。
y对标准未控制的药味应重点关注。
特别是主要药味、以药粉入药的品种其鉴别及含量测定可以直味以药粉入药的品种其鉴别及含量测定可以直
接反映投料药材的质量。
y对标准已收载的专属性不强的鉴别加强专属性验证。
分列药材、易替代品种等。
y多药味鉴别和多成分检测是中药制剂质量评价的重要内容之一。
原料药材质量
加强毒性药味和毒性成分的检测尤其标准中未y
加强毒性药味和毒性成分的检测,尤其标准中未控制的毒性药味更应加强毒性成分及检测方法的研究研究。
y 以饮片投料,考察饮片炮制品是否符合标准规定。
制川乌制草乌附子马钱子朱砂雄黄等制川乌、制草乌、附子、马钱子、朱砂、雄黄等。
毒性药味的检测
重金属农药残留生物毒素二氧化硫钴y
重金属、农药残留、生物毒素、二氧化硫、钴60辐射等检测均应根据具体品种确定。
注重项目设置的针对性合理性及检测结果的评y 注重项目设置的针对性、合理性及检测结果的评价意义。
评估质量安全风险。
外源性有害物质检测
生产过程可能造成重金属和砷盐污染的中药制剂y生产过程可能造成重金属和砷盐污染的中药制剂,含有矿物药、海洋药物、地龙等动物药及可能被
重金属和砷盐污染的中药材生产的中药制剂。
重金属和砷盐污染的中药材生产的中药制剂
y含发酵的原料药材及易霉变的果实种子类的制剂含硫磺熏蒸药材的制剂
y含硫磺熏蒸药材的制剂。
y特定功能中成药非法添加,注意检测的依据和合理性。
理性
y非法染色药材的检测。
非法添加与非法染色
中药注射剂添加剂检测应予以关注增溶剂(聚y中药注射剂添加剂检测应予以关注,增溶剂(聚山梨酯80)、抗氧化剂、抑菌剂等。
指纹图谱考察原料中间体成品质量稳定性y指纹图谱考察原料、中间体、成品质量稳定性。
y有关物质、有害元素、5-HMF、
大分子致敏物质等检查蛋白质鞣质等
y大分子致敏物质等检查。
蛋白质、鞣质等。
y安全性检测,热原、无菌、异常毒性、过敏反应渗透测定
y渗透压测定
y生产工艺的合理性、稳定性。
y对标准不完善的品种加强专属性鉴别及多成分含量测定。
中药注射剂质量评价
指纹图谱反映质量整体性均一性稳定性
y指纹图谱反映质量整体性、均性、稳定性。
y特征图谱主要体现整体鉴别属性。
建立图谱用于质量评价应考察药材中间体制y建立图谱用于质量评价应考察药材、中间体、制剂的相关性,图谱应尽可能多的反映处方中的药
味,对主要色谱峰进行归属、指认。
味对主要色谱峰进行归属指认
y能够反映不同企业的药材质量、工艺水平及制剂质量的稳定性,通过指纹图谱考察可以评价该品质量的稳定性通过指纹图谱考察可以评价该品
种整体质量稳定状况及其潜在的质量风险。
图谱差异大的品种可结合现场调研分析原因
y图谱差异大的品种可结合现场调研分析原因。
特征图谱/指纹图谱
将生物活性测定引入中药质量控制和评价体系y将生物活性测定引入中药质量控制和评价体系,将质量评价与活性作用结合起来。
多数根据药效作用选择解热抗炎抑菌抗病y多数根据药效作用选择解热、抗炎、抑菌、抗病毒、调节免疫等试验。
对检测指标有效成分不明确的制剂可以开展生y对检测指标、有效成分不明确的制剂可以开展生物测定方法进行质量评价。
评价性抽验不等同于药品再评价生物活性测定y评价性抽验不等同于药品再评价。
生物活性测定在于发现质量问题,评价质量,不是对药品功效
进行验证和评价
进行验证和评价。
生物活性测定
药包材对药品质量的影响应根据具体品种确定y药包材对药品质量的影响应根据具体品种确定。
y注射剂可根据具体品种考察包材的相容性,包括迁移、吸附等。
迁移吸附等
y液体制剂重点控制容器的密封性能
引湿性强的固体制剂对阻隔性能要求较高
y引湿性强的固体制剂对阻隔性能要求较高。
y考察不同包装材料对产品质量的影响包材若对产品质量产生明显影响时考察包材质量更有意义。
品质量产生明显影响时考察包材质量更有意义
y胶囊质量检测。
药包材及稳定性
y
稳定性考察针对性,挥发性成分、不稳定的液体制剂引湿性强的制剂等制剂,引湿性强的制剂等。
y 考察批批间差异、工艺稳定性及不同企业产品的稳定性
稳定性。
稳定性考察
如何进行工艺控制评价
y
y对不合格产品或针对探索性研究中发现的问题进行工艺考察。
行工艺考察
y药材前处理及饮片质量的检验。
工艺条件的控制及中间体质量的控制
y工艺条件的控制及中间体质量的控制。
y对工艺研究可以考察转移率以比较不同企业的药材质量和工艺水平是有意义的。
成品率、转移率材质量和工艺水平是有意义的成品率转移率
评价的意义。
艺对产质量的影响以在调中解通过y工艺对产品质量的影响可以在调研中了解,通过比较不同企业的产品质量,提出建议,促使改进。
工艺的质量控制
评价性抽验探索性研究不等同于以下药品质量基y
础研究:
y药效物质基础研究
y药代研究、代谢产物的研究等涉及药物作用机理研究
y化学物质类别研究
y品种的替代研究
y质量标准方法的研究与改进
评价性抽验与药品质量研究
评价抽验结果要进行评估方法先进项目齐全y评价抽验结果要进行评估,方法先进、项目齐全,不一定就是评价的质量高水平高,而要注意探索
性研究项目的意义、作用和评价实际结果。
性研究项目的意义作用和评价实际结果
y对于探索性研究中发现的一般质量问题和质量隐患,可以结合现场检查,分析原因,督促改进。
患可以结合现场检查分析原因督促改进
y对于涉及药品安全有效的质量问题,应研究制定补充检验方法,按规定程序报批后作为法定检验补充检验方法按规定程序报批后作为法定检验
依据出具报告。
