初中酸碱盐反应规律图
酸碱盐知识导图

氮肥 钾肥 磷肥 复合肥
种类 鉴别
合理使用化肥
盐 化肥
化肥及其 鉴别
盐及盐的化 学性质
氯化钠
常见的盐
碳酸钠 碳酸氢钠
粗盐提纯
碳酸钙 与某些金属反应
盐的通性
与某些酸反应 与某些碱反应
与某些盐反应 复分解反应
实质
应用
(浓)盐酸 常 见
(浓)硫酸 的 酸
中和反应 及其应用
常 见
氢氧化钠
的 碱
氢氧化钙
与指示剂作用 酸
与碱反应 酸
酸和 碱 碱
与指示剂作用 碱 与酸反应
与活泼金属反应 的
与某些金属 氧化物反应
通 性
溶液的酸 碱性与酸
碱度
的
通 与某些非金属
性反应
酸碱性
酸碱度
的检验
(定量)
浙教版科学中考复习:酸碱盐优先反应 (共38张PPT)【完美版】

• [解析] 向H2SO4和CuSO4的混合溶液中逐滴滴入Ba(OH)2溶液至过量,因为 Ba(OH)2溶液显碱性,最终pH>7。
• 向H2SO4和CuSO4的混合溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液的不 断加入,H2SO4不断消耗,质量不断减小。
• 随着Ba(OH)2溶液的不断加入,溶液质量不断增加,CuSO4的质量分数不断减小。 • 向H2SO4和CuSO4的混合溶液中逐滴滴入Ba(OH)2溶液,H2SO4与Ba(OH)2会发
• bc段(不含b点),氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,反应的化 学方程式为MgCl2 +2NaOH===Mg(OH)2↓+2NaCl,B正确;
• 从前面的分析可知,在整个过程中,氯离子没有和其他离子结合生成沉淀、气 体或水,故氯离子数目从未改变,C正确;
• d点时,氢氧化钠和氯化镁恰好完全反应,此时溶液中只含有氯化钠一种溶质,D 错误。
酸碱性
pH变化
16
浙教版科学中考复习:酸碱盐优先反 应 (共38张PPT)【完美版】
2.用图像序号填空。
序号 点或线段
(1) O点
(2)
P点
(3) M点
(4) N点
(5) OP段
(6) PM段
(7) MN段
溶质成分 NaOH、Na2CO3 NaCl、Na2CO3
NaCl NaCl、HCl NaOH、NaCl、Na2CO3 NaCl、Na2CO3 NaCl、HCl
19
浙教版科学中考复习:酸碱盐优先反 应 (共38张PPT)【完美版】
专项训练
• 1.向一定量CaCl2和盐酸的混合溶液中滴加过量某物质,溶液的pH随滴入X的
初三化学酸碱盐归纳总结
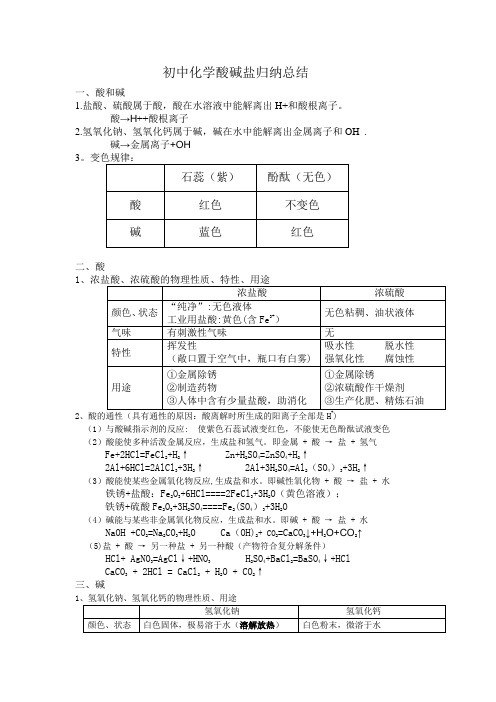
初中化学酸碱盐归纳总结一、酸和碱1.盐酸、硫酸属于酸,酸在水溶液中能解离出H+和酸根离子。
酸→H ++酸根离子2.氢氧化钠、氢氧化钙属于碱,碱在水中能解离出金属离子和OH¯. 碱→金属离子+OH ¯ 3二、酸12(1)与酸碱指示剂的反应: 使紫色石蕊试液变红色,不能使无色酚酞试液变色 (2)酸能使多种活泼金属反应,生成盐和氢气。
即金属 + 酸 → 盐 + 氢气Fe+2HCl=FeCl 2+H 2↑ Zn+H 2SO 4=ZnSO 4+H 2↑2Al+6HCl=2AlCl 3+3H 2↑ 2Al+3H 2SO 4=Al 2(SO 4)3+3H 2↑(3)酸能使某些金属氧化物反应,生成盐和水。
即碱性氧化物 + 酸 → 盐 + 水 铁锈+盐酸:Fe 2O 3+6HCl====2FeCl 3+3H 2O (黄色溶液); 铁锈+硫酸Fe 2O 3+3H 2SO 4====Fe 2(SO 4)3+3H 2O(4)碱能与某些非金属氧化物反应,生成盐和水。
即碱 + 酸 → 盐 + 水 NaOH +CO 2=Na 2CO 3+H 2O Ca (OH)2+ CO 2=CaCO 3↓+H 2O+CO 2↑ (5)盐 + 酸 → 另一种盐 + 另一种酸(产物符合复分解条件) HCl+ AgNO 3=AgCl ↓+HNO 3 H 2SO 4+BaCl 2=BaSO 4↓+HClCaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ 三、碱12、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH )(1)碱溶液与酸碱指示剂的反应: 使紫色石蕊试液变蓝色,使无色酚酞试液变红色 (2)酸性氧化物+碱 → 盐+水 2NaOH+CO 2=Na 2CO 3+H 2O (3)酸+碱 → 盐+水NaOH + HCl = NaCl + H 2O(4)盐+碱 → 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)HCl+ AgNO 3=AgCl ↓+HNO 3 H 2SO 4+BaCl 2=BaSO 4↓+HCl CaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ 注:①难溶性碱受热易分解(不属于碱的通性) 如Cu(OH )2 ΔCuO +H 2O 2Fe(OH)3 ΔFe 2O 3+3H 2O②常见沉淀:AgCl ↓ BaSO 4↓ Cu(OH)2↓ F e (OH)3↓ Mg (OH)2↓ BaCO 3↓ CaCO 3↓③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
八圈图(附 氧化物酸碱盐相互关系)
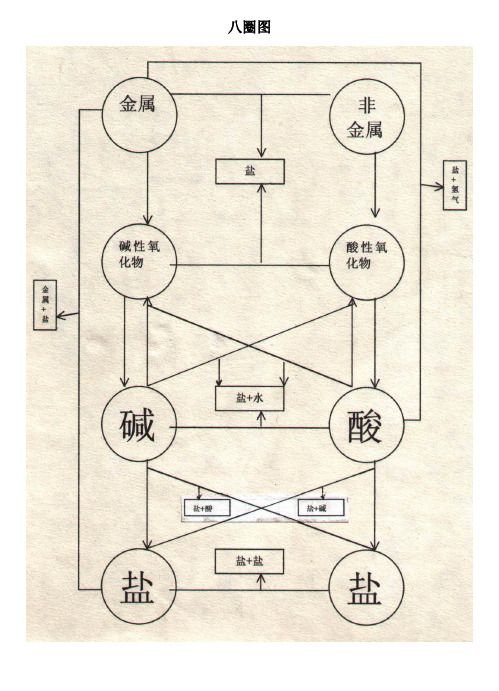
八圈图竖的关系:1. 金属+氧气→碱性氧化物; MgO O Mg 222点燃==+2. 碱性氧化物+水→碱;(一般仅:K,Na,Ba,Ca,Mg 的氧化物可以。
) 22Ca(OH)O H CaO ==+3. 碱−→−∆碱性氧化物+水;(除K,Na,Ba,Ca,Mg 的氢氧化物外一般都可以。
) ()O H CuO OH Cu 22+==∆4. 碱――→盐(有三种方法);(即: 酸性氧化物+碱→盐+水; 碱+酸→盐+水; 碱+盐→新碱+新盐.)5. 非金属+氧气→酸性氧化物; 522254O P O P 点燃==+6. 酸性氧化物+水→酸;(一般都可以,但SiO 2不行。
) 3222CO H O H CO ==+7. 酸−→−∆酸性氧化物+水;(一般都可以,但硫酸不行。
) O H CO CO H 2232+↑== 8. 酸――→盐(有三种方法);横的关系:1. 金属+非金属→盐(无氧酸盐); NaCl Cl Na 222点燃==+2. 碱性氧化物+酸性氧化物→盐(含氧酸盐); 32CaCO CO CaO ==+3. 碱+酸→盐+水(中和反应); ()O H CuCl HCl OH Cu 22222+==+4. 盐+盐→新盐+新盐(△) ()白色↓+==+AgCl NaNO NaCl AgNO 33 斜的关系:1. 碱性氧化物+酸→盐+水; O H FeCl HCl O Fe 2332326+==+2. 酸性氧化物+碱→盐+水; O H SO Na NaOH SO 23222+==+3. 碱+盐→新碱+新盐;(△) ()()白色↓+==+33222CaCO NaOH CO Na OH Ca 4. 酸+盐→新酸+新盐;(△) O H CO CaCl HCl CaCO 22232+↑+==+5. 金属+酸→盐+氢气;(★) ↑+==+2442H ZnSO SO H Zn6. 金属+盐→新金属+新盐。
(★) Cu Cu 44+==+FeSO SO Fe△ 生成物要有沉淀或气体或水。
酸碱盐反映的规律

酸、碱、盐反应的一些规律考试大本营 - 赛蝶网 2008-04-24 03:03:30 浏览:76次【大中小】【打印】【繁体】【红绿黄黑】【发表】【关闭】【评论】赛蝶网讯:一、置换反应:(1)金属+酸——盐+水例如:zn+h2so4=znso4+h2条件:金属在活动性顺序表中必须排在h前,有mg、al、zn、fe、sn、pb酸主要是指hcl、h2so4(2)金属+盐——新金属+新盐例如:fe+cuso4=cu+feso4条件:金属在活动性顺序表中必须排在组成盐的金属前,如:fe排在cu的前面;盐必须溶解于水。
二、化合反应(1)酸性氧化物+水——酸大多数非金属氧化物是酸性氧化物例如:so3+h2o=h2so4co2+h2o=h2co3(2)碱性氧化物+水——碱大多数金属氧化物是碱性氧化物例如:cao+h2o=ca(oh)22nao+h2o=2naoh条件:碱可以溶解于水三、分解反应(1)碱——碱性氧化物+水例如:cu(oh)2=cuo+h2o条件:碱不可以溶解于水四、复分解反应总的条件:反应后生成物中必须有一种沉淀或一种气体或水(1)酸+碱——盐+水(中和反应)例如:naoh+h2so4=na2so4+2h2o (2)酸+碱性氧化物——盐+水例如:h2so4+mgo=mgso4+h2o6hcl+fe2o3=2fecl3+3h2o(3)酸+盐——新酸+新盐例如:h2so4+bacl2=baso4+2hclhcl+agno3=agcl+hno3条件:强酸制弱酸、稳定性酸制不稳定性酸、不挥发性酸制挥发性酸,总的来说各中酸排列的顺序是:h2so4、hcl、hno3、h2co3前面的酸可以制取后面的酸,而后面的酸不可以制取前面的酸。
(4)碱+盐——新碱+新盐例如:2naoh+cuso4=na2so4+cu(oh)23ca(oh)2+2fecl3=3cacl2+2fe(oh)3 条件:反应的碱和反应的盐必须都溶解于水(5)盐+盐——新盐+新盐例如:nacl+agno3=nano3+agclbacl2+na2so4=2nacl+baso4条件:两种反应的盐必须都溶解于水在置换反应中,金属fe参加反应总是生成+2价的亚铁盐例如:fe+2hcl=fecl2+h2在复分解反应中金属元素的化合价不变,这可以帮助我们写出复分解反应中金属元素的化合物的化学式例如:fe2o3+3h2so4=fe2(so4)3+3h2o。
初中化学应用广泛的酸、碱、盐知识点图

第七章应用广泛的酸、碱、盐知识脉络图
一、酸
1.重要的酸:
性质:
盐酸
用途:
性质:
硫酸
用途:
①酸性
②与活泼金属发生置换反应
2、酸的共性:③与金属氧化物反应
④与碱的反应(中和反应),中和反应的应用
⑤与盐的反应
3、酸碱指示剂及溶液的pH:
二、碱
1、重要的碱:
性质:
氢氧化钠
用途:
氢氧化钙性质:
用途:
性质:
氨水
用途:
2、碱的共性:①碱性
②与金属氧化物反应
③与盐发生反应
④与酸反应(中和反应)
三、盐
1、重要的盐:氯化钠,碳酸钠
2、盐的组成和分类,盐的溶解性
3、复分解反应发生的条件:
4、金属活动顺序及应用
四、化学肥料
1、氮肥:NH4HCO3, CO(NH2)2, 氨水等
2、钾肥:KCl,K2SO4,,草木灰等
3、磷肥:磷矿粉,过磷酸钙,重过磷酸钙等
4、复合肥:KNO3,(NH4)2HPO4等。
酸碱盐的反应规律

酸碱盐的反应规律具体内容单质、氧化物、酸、碱、盐之间的相互反应, 可归纳成下图来表示。
① 金属 + 氧气?金属氧化物除Ag 、Pt 、Au 外的金属, 一般都可与氧气发生化合反应, 金属越活泼与氧化合就越容易,反应就越剧烈。
金属氧化物大多数是碱性氧化物。
② 碱性氧化物 + 水?可溶性碱可溶性碱对应的碱性氧化物能与水反应生成对应的碱,K 2O 、Na 2O 、BaO都能跟水反应。
Ca (OH )2微溶于水,它对应的CaO 也能与水反应。
其余的碱性氧化物一般与水不反应或不易反应。
③ 碱?盐由碱转化成盐的三个途径: 碱 + 酸性氧化物?盐 + 水 碱 + 酸?盐 + 水碱 + 某些盐?另一种碱 + 另一种盐 ④ 碱?碱性氧化物 + 水不溶性的碱在加热的条件下,一般可分解为对应的碱性氧化物和水。
碱中的金属越不活泼,则该碱越容易分解。
⑤ 非金属 + 氧气?非金属氧化物除F 2、Cl 2、Br 2、I 2外的非金属,一般都可直接与O 2反应生成非金属氧化物。
非金属氧化物大多数是酸性氧化物。
⑥ 酸性氧化物 + 水?含氧酸除不溶性的SiO 2外, 常见的酸性氧化物都可与水反应生成对应的含氧酸。
⑦ 酸?盐由酸转化成盐有四个途径:某些金属 + 某些酸?盐 + 氢气 酸 + 碱性氧化物?盐 + 水 酸 + 碱?盐 + 水酸 + 某些盐?另一种酸 + 另一种盐 ⑧ 酸?酸性氧化物 + 水在一定条件下含氧酸分解可生成酸性氧化物(酸酐)和水。
⑨ 金属 + 非金属?无氧酸盐此处的非金属H 2、O 2除外。
当金属越活泼, 非金属也越活泼时,反应就越容易进行。
⑩ 酸性氧化物 + 碱性氧化物?含氧酸盐(非初三知识)强酸(H 2SO 4、HNO 3)的酸酐与活泼金属的氧化物在常温下即可反应,其余的需在加热或高温条件下才能发生反应。
碱性氧化物 + 酸?盐 + 水强酸(H 2SO 4、HNO 3、HCl )可与所有碱性氧化物反应,弱酸(H 2CO 3、H 2S等)只能和活泼金属的氧化物反应。
化学 酸碱盐氧化物关系图(整理简洁版)ppt课件

(4)碱+酸==盐+H2O
NaOH+HCl=NaCl+H2O
2NaOH+H2SO4=Na2SO4+2H2O23
酸(不稳定)
H2CO3
非金属氧化物+水
CO2↑+H2O
24
ቤተ መጻሕፍቲ ባይዱ温
2CuO+C 2Cu+CO2↑
古代炼铜的△方法之一
CuO+H2 Cu+H2O
非复分解反应,没有交换成分
13
碱+酸==盐+H2O NaOH+HCl=NaCl+H2O 2NaOH+H2SO4=Na2SO4+2H2O Cu(OH)2+2HCl=CuCl2+2H2O 2Fe(OH)3+3H2SO4=Fe2(SO4)3+
2H2O
复分解反应,生成物有水 14
酸 +盐=盐+酸
H2SO4+BaCl2=2HCl +BaSO4 ↓
Al(OH)3+FeCl3≠
解释:因为反应物有沉 淀存在,不能进行
18
盐 + 盐 = 新盐 + 新盐
AgNO3+NaCl=AgCl↓ +NaNO3
CaCl2+Na2CO3=CaCO3↓+2NaCl
Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO
BaCl2+Na2SO4=BaSO4↓+2NaCl
HNO3+NaOH=NaNO3+H2O
H2SO4+2KOH=K2SO4+2H2O
酸碱盐金属氧化物之间的反应规律

酸、碱、盐、金属、氧化物之间的反应规律一、活泼金属+酸→盐+氢气反应条件:1.金属位于金属活动顺序表中氢以前2.酸不能是硝酸、浓硫酸等强氧化性酸Fe+HCl一Mg+H2SO4一Al+H2SO4一Zn-十HCl一Cu+HCl一Mg+4HNO3==Mg(NO3)2+2H2O+2NO2↑二、金属氧化物+ 酸→盐+ 水Fe2O3 + H2SO4一FeO + HCl—CuO + HNO3—Na2O + HCl一三、酸+ 碱→盐+ 水HCl + NaOH —Fe(OH)3 + H2SO4一Cu(OH)2 + HNO3—Ca(OH)2 + HCl一四、盐+ 酸→新盐+ 新酸1.生成的新盐是不溶于新酸的沉淀AgNO3 + HCl一BaCl2 + H2SO4一2.碳酸盐都能与盐酸、硫酸、硝酸反应CO32-+ 2H+== CO2↑+ H2OCaCO3 + HCl—Na2CO3 + H2SO4一BaCO3+ HNO3—MgCO3 + HCl一五、非金属氧化物(CO2、SO2、SO3)+ 碱→盐+ 水CO2 + NaOH—SO2 + KOH—SO3 + NaOH—CO2 + Ca(OH)2—六、碱+ 盐→新碱+ 新盐反应条件:1.反应物中的碱和盐都能溶于水2.生成物中的新碱和新盐至少有一种是沉淀NaOH + CuSO4一NaOH + FeCl3—KOH + AlCl3—Ba(OH)2 + CuSO4一Ca(OH)2 + Na2CO3—NaOH + KNO3—七、金属+ 盐→新金属+ 新盐反应条件:1.金属比盐中所含的金属活泼2.反应物中的盐可溶于水3.能直接与水反应的金属除外(如:K、Ca、Na)Fe + CuSO4Cu + Hg(NO3)2—Al + CuSO4一Zn + AgNO3一Zn + MgSO4—Fe + AgCl —八、盐+ 盐→盐+ 盐反应条件:反应物中的两种盐均溶于水,生成物中的盐至少有一种是沉淀NaCl + AgNO3—K2SO4+ BaCl2一MgSO4 + K2CO3—Ba(NO3)2 + Na2SO4一BaCO3 + K2SO4一NaCl + KNO3。
化学 酸碱盐氧化物关系图(整理简洁版)

复分解反应,生成物有水
精选ppt
11
非金属氧化物+水
CO2+H2O SO3+H2O
酸(含氧酸)
H2CO3 H2SO4
精选ppt
12
碱+非金属氧化物=盐+H2O
2NaOH+SO3=Na2SO4+H2O 2NaOH+CO2=Na2CO3+H2O
Ca(OH)2+CO2=CaCO3↓+H2O 2KOH+SO2=K2SO3+H2O
+酸 +盐ห้องสมุดไป่ตู้
+盐 +碱
盐
精选ppt
盐
4
点燃
金属+氧气 或△ 金属氧化物
2Mg+O2点燃 2MgO
4Al +3O2 点燃 2Al2O3
3Fe+2O2 点燃 Fe3O4
2Cu +O2 △ 2CuO
精选ppt
5
金属氧化物+水
CaO+H2O Na2O+H2O
碱(可溶)
Ca(OH)2 2NaOH
精选ppt
6
并且反应物要全溶才能反应!
精选ppt
17
Mg(OH)2+Na2CO3≠
Al(OH)3+FeCl3≠
解释:因为反应物有沉 淀存在,不能进行
精选ppt
18
盐 + 盐 = 新盐 + 新盐
AgNO3+NaCl=AgCl↓ +NaNO3
CaCl2+Na2CO3=CaCO3↓+2NaCl
Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO
单质氧化物酸碱盐的相互转化关系
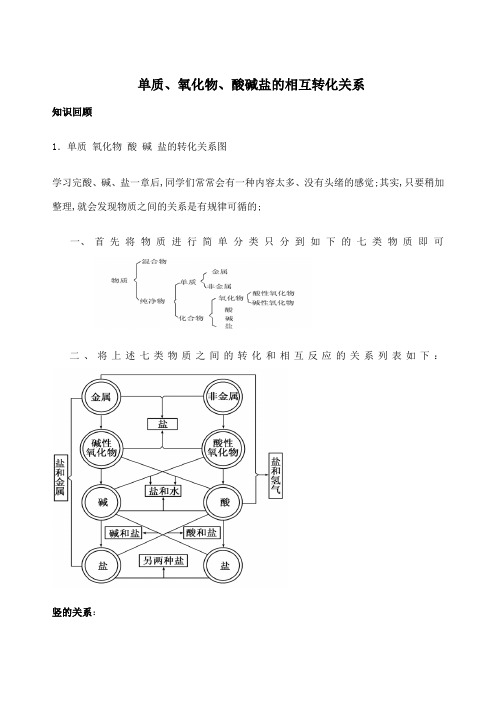
单质、氧化物、酸碱盐的相互转化关系知识回顾1.单质氧化物酸碱盐的转化关系图学习完酸、碱、盐一章后,同学们常常会有一种内容太多、没有头绪的感觉;其实,只要稍加整理,就会发现物质之间的关系是有规律可循的;一、首先将物质进行简单分类只分到如下的七类物质即可二、将上述七类物质之间的转化和相互反应的关系列表如下:竖的关系:1. 金属+氧气→碱性氧化物; MgO O Mg 222点燃==+2.碱性氧化物+水→碱;一般仅:K,Na,Ba,Ca 的氧化物可以;只有四种可溶性碱KOH,NaOH,CaOH 2,BaOH 2对应的碱性氧化物K 2O,Na 2O,CaO,BaO 可直接与水化合生成相应碱,其余不能 如:Na 2O+H 2O==2NaOH CaO+H 2O==CaOH 2故:上述四种氧化物溶于水时得到的都是相应碱的溶液,除CaOH 2是微溶碱外,其余都易溶;2. 碱−→−∆碱性氧化物+水;除K,Na,Ba,Ca 的氢氧化物外一般都可以; a 、不溶性碱....受热才能发生分解反应 b 、反应前后元素的化合价不变特别注意金属元素的化合价如:2FeOH 3Fe 2O 3+ H 2O CuOH 22CuO+H 2O3. 碱――→盐有三种方法;即: 酸性氧化物+碱→盐+水; 碱+酸→盐+水; 碱+盐→新碱+新盐.4. 非金属+氧气→酸性氧化物; 522254O P O P 点燃==+5. 酸性氧化物+水→酸;一般都可以,但SiO 2不行; 3222CO H O H CO ==+a 除SiO 2外,其余酸性氧化物一般都能直接与水化合生成相应酸b 、反应前后元素的化合价一定不变特别注意除氢、氧外的非金属元素的化合价如:CO 2+ H 2O== H 2CO 3 SO 3+ H 2O== H 2SO 4故:酸性氧化物溶于水时得到的都是相应酸的溶液;6. 酸−→−∆酸性氧化物+水;一般都可以,但硫酸不行; O H CO CO H 2232+↑==a 、仅有含氧酸才能分解b 、反应前后元素的化合价一定不变特别注意除氢、氧外的非金属元素的化合价c 、酸性氧化物又叫酸酐原因是:酸性氧化物可看作是含氧酸脱水的产物如:H 2SO 3 H 2O+ SO 2↑ H 2CO 3 H 2O+ CO 2↑例1;根据下表列出的氯的含氧酸跟它对应的氧化物叫酸酐的化合价关系.判断HN03的酸酐是B N 2O 5例2. 写出下列几种含氧酸的酸酐:H 2SO 4______ HNO 3_____ H 3PO 4_____ H 2SO 3____7. 酸――→盐有三种方法;横的关系:1. 金属+非金属→盐无氧酸盐; NaCl Cl Na 222点燃==+ 2. 碱性氧化物+酸性氧化物→盐含氧酸盐; 32CaCO CO CaO ==+3. 碱+酸→盐+水中和反应; ()O H CuCl HCl OH Cu 22222+==+4. 盐+盐→新盐+新盐△ ()白色↓+==+AgCl NaNO NaCl AgNO 33斜的关系:1. 碱性氧化物+酸→盐+水; O H FeCl HCl O Fe 2332326+==+2. 酸性氧化物+碱→盐+水; O H SO Na NaOH SO 23222+==+3. 碱+盐→新碱+新盐;△ ()()白色↓+==+33222CaCO NaOH CO Na OH Ca a 、参加反应的碱和盐必须都是可溶的b 、必须符合复分解反应发生的条件c 、可溶性碱跟铵盐一定能反应原因是该反应一定有水和氨气生成如:2NaOH+CuSO 4==Na 2SO 4+CuOH 2↓ 3NaOH+FeCl 3==3NaCl+FeOH 3↓CaOH 2+2NH 4Cl==CaCl 2+H 2O+NH 3↑4. 酸+盐→新酸+新盐;△ O H CO CaCl HCl CaCO 22232+↑+==+a 、只要符合复分解反应发生的条件即可b 、碳酸盐跟酸一定能反应原因是该反应一定有水和二氧化碳生成如:HCl+AgNO 3==AgCl ↓+HNO 3 H 2SO 4+BaCl 2== BaSO 4↓+2 HCl2 HCl+CaCO 3==CaCl 2+H 2O+CO 2↑5. 金属+酸→盐+氢气;★ ↑+==+2442H ZnSO SO H Zna 、这里的酸通常是指盐酸和稀硫酸硝酸、浓硫酸跟金属反应一般不产生氢气b 、只有排在氢前面的金属才能置换出酸中的氢c 、铁跟盐酸和稀盐酸反应生成亚铁盐...如:Mg+2HCl==MgCl 2 +H 2↑Fe+H 2SO 4== Fe SO 4+ H 2↑6. 金属+盐→新金属+新盐;★ Cu Cu 44+==+FeSO SO Fea 、盐必须是可溶的b 、参加反应的金属必须排在盐中金属的前面c 、等活泼金属放入盐溶液时,发生的反应有两个,但不能置换..出盐中的金属;如:把钠放入溶液中发生的反应为:2Na+2H 2O==2NaOH+H 2 ↑ 2NaOH+CuSO 4==CuOH 2↓+Na 2SO 4 d 、铁跟盐反应生成的是亚铁盐...; 如Fe+CuSO 4== FeSO 4 +Cu Cu+HgNO 32==CuNO 3 2+ Hg△ 生成物要有沉淀或气体或水;反应物一般要能溶于水;但在4中,若酸是强酸,盐是碳酸盐,则盐能否溶于水,不做要求;★ 按金属元素活动顺序,进行反应;酸碱盐化学方程式归纳总结试题:一.两个置换反应规律 1.酸+金属==盐+氢气反应条件:①酸不能用强氧化性酸,如硝酸、浓硫酸,常用稀硫酸、盐酸②金属必须位于氢以前常用Mg 、Al 、Zn 、FeMg+ HCl== Mg+ H 2SO 4==Al+ HCl== Al+ H 2SO 4==Zn+ HCl== Zn+ H 2SO 4==Fe+ HCl== Fe+ H 2SO 4===2.盐+金属==新盐+新金属反应条件: ①盐反应物必须溶于水②金属单质反应物比盐中金属活泼,不用钾、钙、钠Fe+CuSO 4== Al+ CuSO 4==Zn+CuSO 4== Cu+ AgNO 3==Cu+HgNO 32==二.三个分解反应规律1.酸含氧酸==非金属氧化物+水=== H 2O+CO 2↑2.碱难溶性== 金属氧化物+水CuOH 2 FeOH 33.碳酸盐难溶性==金属氧化物+二氧化碳CaCO3三.四个化合反应规律1.金属+氧气 == 金属氧化物Mg+O2 Fe+ O2Cu+ O22.金属氧化物+水 == 碱可溶性CaO+H2O== Na2O+H2O==3.非金属+氧气==非金属氧化物S+O2 P+O2C+O2碳充分燃烧C+O2碳不充分燃烧 H2+O24.非金属氧化物+水==酸CO2+H2O== SO3+H2O== SO2+H2O==四.五个复分解反应规律亚硫酸1.酸+碱==盐+水CuOH2+ HCl== AlOH3+ HCl==CuOH2+H2SO4== MgOH2+ HNO3==2.酸+盐==新酸+新盐反应条件:符合复分解反应发生的条件实际反应条件很复杂CaCO3+ HCl== Na2CO3+ HCl==AgNO3+ HCl==Na2CO3+H2SO4== H2SO4+BaCl2==H 2SO4+BaNO32==3.盐+碱==新盐+新碱反应条件:反应物都溶于水,生成物至少有一种不溶前溶后沉CuSO4+ NaOH== FeCl3+ NaOH==Na2CO3+CaOH2== CuSO4+BaOH2==4.盐+盐==新盐+新盐反应条件:反应物都溶于水,生成物至少有一种不溶前溶后沉NaCl+AgNO3== Na2SO4+BaCl2==Na2SO4+BaNO32==5.酸+金属氧化物==盐+水Fe2O3+ HCl== Fe2O3+H2SO4==CuO+ HCl== CuO+ H2SO4==MgO+ HNO3==五.其它反应1.碱+非金属氧化物==盐+水不属于四种化学反应基本类型NaOH+CO2== NaOH+SO2==NaOH+SO3== CaOH2+CO2==2.三种还原剂H2 、、C 、O2跟氧化物反应H2+CuO 置换反应 CO+CuOCO+Fe2O3C+CuO 置换反应C+CO2化合反应 3.实验室制取三种气体常用方法KMnO4 KClO3Zn+ HCl== Zn+ H2SO4==CaCO3+HCl== 4.盐分解Cu2OH2CO3CaCO3KMnO4 KClO35.三种有机物燃烧CH4+ O2C2H5OH+O2CH3OH+O2。
化学酸碱盐氧化物关系图整理简洁版

+酸 +盐
盐
+盐 +碱
盐
3Fe+2O2 金属+氧气 点燃 或△ 2Mg+O2 点燃 4Al +3O2 点燃 点燃 2Cu +O2 △
Fe3O4 金属氧化物
2MgO 2Al2O3
2CuO
CaO+H2O 金属氧化物+水 Na2O+H2O
Ca(OH)2 碱(可溶)
2NaOH
碱
盐
+酸
碱
盐
+盐
NaOH+HCl=NaCl+H2O
2NaOH+CuS
O4=Na2SO4
+Cu(OH)2↓
碱+酸==盐 +H2O
酸+金属氧化物==盐 +H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O CuO+H2SO4=CuSO4+H2O MgO+H2SO4=MgSO4+H2O K2O+H2SO4=K2SO4+H2O
复分解反应,生成物有水
H2SO4+2KOH=K2SO4+2H2O
H2SO4+BaCl2=BaSO4 ↓ +2HCl
HCl+AgNO3=AgCl↓ +2HNO3
碱+盐= 盐+ 碱
NaOH + FeCl3 = 3NaCl+Fe(OH) 3↓
2NaOH+H2S
O4=Na2SO4
+2H2O
NaOH+HCl= NaCl+H2O
(2)碱+非金属氧化物=盐+H2O
九年级化学 酸碱盐思维导图

酸+金属氧化物→盐+水;酸+碱→盐+水;酸+盐→新酸+新盐;碱+盐→新碱+新盐;盐+盐
两种化合物互相交换成分,生成两外两种新的化合物。
AB+CD→AD+CB
成分换,价不变。
成分换指导谁和谁组合,价不变指导写对化学式。
自由移动离子数目的减少。
化学变化→反应物减少→成分换→动→溶
生成物角度:↑、↓或水生成;反应物角度:碱+盐、盐+盐,反应物均可溶。
复 分 解 反 应
定义 特点 实质 条件 类型 H ++OH -=H 2O
金属离子+OH -
碱
H ++酸根离子
酸
溶液
酸 碱 性
酸碱度pH 表示 用
应
中和反应
应 用 于 医 药
改
良 土 壤 处
理
废 水
盐
金属离子+酸根离子 与盐
作用
与金属 氧化物作用 与金属 作用 与指示 剂作用
与盐作用
与非金属 氧化物作用 与指示 剂作用 常用
浓H 2SO 4 吸水性 脱水性 腐蚀性
浓HCl 挥发性 腐蚀性 浓HNO 3 挥发性 腐蚀性 见光易分解
化 工 原 料
金 属
除 锈 化 工 原 料
去 除 油 污 建 筑
材 料 常用
NaOH 火碱 烧碱 苛性钠 吸水性 易潮解 腐蚀性 Ca(OH)2 熟石灰 消石灰
与金属
作用 与酸 作用 与碱 作用 与盐 作用
NaCl ,调味品、化工原料、生理盐水
CaCO 3建筑材料,珍珠首饰,炼铁、炼钢,制水泥
Na 2CO 3,苏打、纯碱;造纸,洗涤剂、洗衣粉,印染,制玻璃、瓷砖
NaHCO 3,小苏打;治疗胃酸过多、面点发酵剂、灭火剂。
酸和碱网络图
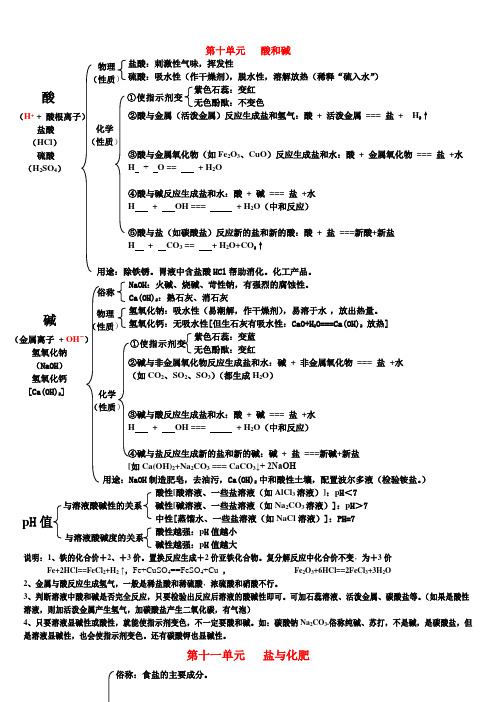
第十单元 酸和碱盐酸:刺激性气味,挥发性硫酸:吸水性(作干燥剂),脱水性,溶解放热(稀释“硫入水”) 紫色石蕊:变红 无色酚酞:不变色②酸与金属(活泼金属)反应生成盐和氢气:酸 + 活泼金属 === 盐 + H 2↑ ③酸与金属氧化物(如Fe 2O 3、CuO )反应生成盐和水:酸 + 金属氧化物 === 盐 +水 H + O == + H 2O④酸与碱反应生成盐和水:酸 + 碱 === 盐 +水H + OH === + H 2O (中和反应)⑤酸与盐(如碳酸盐)反应新的盐和新的酸:酸 + 盐 ===新酸+新盐H + CO 3 == + H 2O+CO 2↑用途:除铁锈。
胃液中含盐酸HCl 帮助消化。
化工产品。
NaOH :火碱、烧碱、苛性钠,有强烈的腐蚀性。
Ca(OH)2:熟石灰、消石灰氢氧化钠:吸水性(易潮解,作干燥剂),易溶于水 ,放出热量。
氢氧化钙:无吸水性[但生石灰有吸水性:CaO+H 2O===Ca(OH)2 放热]紫色石蕊:变蓝 无色酚酞:变红 ②碱与非金属氧化物反应生成盐和水:碱 + 非金属氧化物 === 盐 +水 (如CO 2、SO 2、SO 3)(都生成H 2O ) ③碱与酸反应生成盐和水:酸 + 碱 === 盐 +水H + OH === + H 2O (中和反应)④碱与盐反应生成新的盐和新的碱:碱 + 盐 ===新碱+新盐[如Ca(OH)2+Na 2CO 3 === CaCO 3↓+ 2NaOH用途:NaOH 制造肥皂,去油污,Ca(OH)2 中和酸性土壤,配置波尔多液(检验铵盐。
) 酸性[酸溶液、一些盐溶液(如AlCl 3溶液)]:p H <7与溶液酸碱性的关系 碱性[碱溶液、一些盐溶液(如Na 2CO 3溶液)]:p H >7中性[蒸馏水、一些盐溶液(如NaCl 溶液)]:PH=7 酸性越强:p H 值越小 碱性越强:p H 值越大说明:1、铁的化合价+2、+3价。
置换反应生成+2价亚铁化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 / 1
金属 + 氧气→金属氧化物
除Ag 、Pt 、Au 外的金属,一般都可与氧气发生化合反应,金属越活泼与氧化合就越容易,反应就越剧烈。
金属氧化物大多数是碱性氧化物。
碱性氧化物 + 水→可溶性碱 可溶性碱对应的碱性氧化物能与水反应生成对应的碱,K 2O 、Na 2O 、BaO 都能跟水反应。
Ca (OH )2微溶于水,它对应的CaO 也能与水反应。
其余的碱性氧化
碱→盐
由碱转化成盐的三个途径: 碱 + 酸性氧化物→盐 + 水 碱 + 酸→盐 + 水
碱→碱性氧化物 + 水 不溶性的碱在加热的条件下,一般可分解为对应的碱性氧化物和水。
碱中的金属越不活泼,则该碱越容易
非金属 + 氧气→非金属氧化物
除F 2、Cl 2、Br 2、I 2外的非金属,一般都可
直接与O 2反应生成非金属氧化物。
非金属氧化物大多数是酸性氧化物。
酸性氧化物 + 水→含氧酸
除不溶性的SiO 2外, 常见的酸性氧化物都可与水反应生成对应的含氧酸。
酸→酸性氧化物 + 水 在一定条件下含氧酸分解可生成酸性氧化物(酸酐)
酸→盐
由酸转化成盐有四个途径: 某些金属 + 某些酸→盐 + 氢气 酸 + 碱性氧化物→盐 + 水 酸 + 碱→盐 + 水
金属 + 非金属→无氧酸盐
此处的非金属H 2、O 2除外。
当金属越活泼, 非金属也越活泼时,反应
就越容易进行。
酸性氧化物 + 碱性氧化物→含氧酸盐(非初三知识)
强酸(H 2SO 4、HNO 3)的酸酐与活泼金属的氧化物在常温下即可反应,其余的需
在加热或高温条件下才能发生反应。
酸 + 碱→盐 + 水
参加反应的酸和碱至少有一种是易溶于水的。
盐 + 盐→另两种盐
参加反应的两种盐必须都能溶于水,若生成物中有一种是难溶性的盐时,则反应可以进行。
金属+盐→另一种金属+另一种盐 在金属活动性顺序里, 排在前面的金属(K 、Ca 、Na 除外)能把排在后面的金属从它的盐溶液里
金属 + 酸→盐 + 氢气
在金属活动性顺序里, 排在氢前的金属能从酸溶液中把氢置换出来。
这里的酸主要是指盐酸和稀硫酸。
浓硫酸和硝酸因有强氧化性, 跟金属反应时不会生成氢
碱性氧化物 金 属
碱
盐
酸性氧化物
非 金 属
酸
盐。
