医学的研究的报告规范CONSORT声明共32页文档
医学研究报告的写作指南和注意事项

医学研究报告的写作指南和注意事项一、引言部分的撰写在医学研究报告中,引言部分是非常重要的一个组成部分。
它应该概述研究的背景、目的和意义,并对已有研究进行评述。
撰写引言时,需要注意以下几点:1. 简洁明确地阐述研究的背景和目的。
不要过多地细述相关知识,而应将焦点放在解决问题上。
2. 引入的文章和研究的方法。
对于引用的文章,需要说明其与研究主题的关联性,并指出引文的限制性。
对于研究方法的选择,需要说明其适用性以及研究的独特之处。
3. 研究的意义。
在引言部分最后,需要明确指出研究结果对医学领域的影响,以及研究的重要性和必要性。
二、方法和材料的描述在医学研究报告中,方法和材料的描述是重要的研究部分,需要提供足够的细节,以便读者能够理解和重复该研究。
以下是撰写方法和材料描述时需要注意的几个方面:1. 按照实验的步骤进行描述。
确保描述的内容是有条理的,并按照实验的先后顺序进行叙述。
同时,需要提供足够的细节,包括实验设计、样本收集和处理过程等。
2. 描述实验所使用的仪器和设备。
详细列出使用的仪器和设备的名称、型号、制造商和主要规格,并说明其在研究中的作用。
3. 对材料的描述要准确。
包括样本来源和特征、动物模型的选择、药物和试剂的使用等。
此外,还需要说明关于伦理批准和知情同意的细节。
三、结果的陈述和分析在医学研究报告中,结果部分是最重要的内容之一。
在撰写结果时,需要注意以下几个方面:1. 对结果进行简洁、准确的描述。
结果陈述应包括主要的定量数据和统计学方法,避免过多使用文字描述。
同时,要确保结果的陈述与方法和材料的描述相对应。
2. 运用图表和表格进行数据的清晰呈现。
通过图表和表格可以更直观地展示结果,同时有助于读者对结果的理解。
3. 结果的分析和讨论。
在结果部分的结尾,需要对结果进行分析和讨论。
分析时应注意对结果的合理解释,并结合已有的研究给出可能的解释和发现。
四、讨论的策略和技巧讨论部分是医学研究报告中非常重要的一个组成部分。
RCT临床研究遵循CONSORT规范

RCT临床研究遵循CONSORT规范随着临床研究的不断发展,为了提高研究的可信度和可复现性,各国学者和研究者积极推行并执行研究报告规范化的指南。
其中,CONSORT (Consolidated Standards of Reporting Trials)是目前使用最广泛的一个指南,其主要目的是提供设计、实施和报告RCT(Randomized Controlled Trials)的准则和标准。
CONSORT指南为临床研究的报告提供了一个详尽的标准化框架,以确保研究结果的全面透明和准确传达。
目前CONSORT指南已经发布了多个版本,其中包括了填写CONSORT流程图的扩展、新的附录和补充材料等。
同时,CONSORT还有特定的模板供研究者使用,以便更好地执行该指南。
CONSORT指南包括了三个主要领域:报告RCT的背景和方法、报告RCT的结果以及报告RCT的其他信息。
报告RCT的背景和方法部分主要包括了研究目标、研究设计、研究参与者、随机分组方法、盲法和试验的描述。
这些信息的准确报告有助于评估和解释研究的内部和外部效度。
报告RCT的结果部分主要包括了研究的主要和次要结局指标、分析方法、主要结果的描述和解释,以及与RCT相关的其他结果信息。
这些结果的详细报告和解释可以帮助读者更好地理解研究的观察结果和结论。
报告RCT的其他信息部分主要包括了RCT的注册信息、质量控制和质量保证措施,以及其他与研究设计和分析相关的信息。
这些信息的报告不仅可以帮助读者评估研究的可信度,还可以支持其他研究者在对该研究进行后续研究时的设计和分析决策。
CONSORT指南的使用对于保证RCT研究的质量和可信度至关重要。
它有助于防止研究报告的选择性报道和偏见的存在,改善了研究的内部和外部效度的评估。
同时,CONSORT指南还提供了适当报告方法的规范和模板,方便研究者进行研究设计和实施的规划。
通过广泛应用CONSORT指南,我们可以提高研究的潜在影响力,并促进基于证据的医学实践的发展。
consort临床试验报告标准

consort临床试验报告标准临床试验是评估新药物、治疗方法或其他干预措施安全性和疗效的重要途径。
为了提高临床试验的可靠性和可重复性,研究者和科研机构需要遵循一定的报告标准。
其中,Consort(Consolidated Standards of Reporting Trials)临床试验报告标准被广泛接受和认可。
本文将重点介绍Consort标准的内容和其对临床试验报告的重要意义。
一、Consort标准的背景和介绍Consort标准最初于1996年发布,是一个国际性的报告标准,用于规范临床试验的报告。
其目的是确保研究结果的透明度,从而有助于读者更好地理解和评估临床试验的设计、实施和结果。
随着时间的推移和临床试验方法的发展,Consort标准也经历了多次更新和修订,以适应不断变化的临床研究环境。
二、Consort标准的主要内容1. 标题与摘要:试验报告应具备清晰、准确的标题和摘要,以便读者迅速了解试验的主要目的和结果。
2. 引言:简要描述研究背景和目的,明确研究问题以及试验的相关性和创新性。
3. 方法:详细描述试验设计、参与者招募、分组方法、干预措施、随访计划和数据采集等内容。
同时,应明确试验的主要终点和次要终点指标,并解释其选择的原因。
4. 结果:报告应包含试验的主要结果,包括主要终点指标和次要终点指标的数据。
结果应以图表、表格等形式进行展示,并结合文字进行解读和分析。
5. 讨论:对试验结果进行客观、全面的讨论,包括结果的一致性、可靠性以及与其他研究的比较。
同时,应对试验的局限性进行说明,并提出进一步研究的建议。
6. 结论:简明扼要地总结试验的主要结论,并强调其对临床实践的意义和潜在的影响。
7. 其他信息:试验报告还应提供试验注册信息、试验团队成员和出资来源等相关信息,以增加试验结果的透明度和可信度。
三、Consort标准的重要意义1. 提高临床试验的可重复性:Consort标准规范了试验报告的内容和格式,有助于读者理解和评估试验的可重复性,从而提高临床试验研究的严谨性和准确性。
继续解读:随机对照临床研究的报告规范CONSORT声明

继续解读:随机对照临床研究的报告规范CONSORT声明《柳叶刀》呼吁中国医学界应大力开展临床研究,而不是扎堆基础研究。
通过临床研究,其成果可以有效转化到临床实践和卫生政策的制定中。
医生们赶快开展临床研究吧!开展一项临床研究,从设计到写作发表都要遵循一系列规范。
今天,我们就接着上一期的话题,继续解读CONSORT清单的“方法”部分和“结果”部分。
CONSORT清单的“方法”部分Item 12a. 主要结局指标做组间比较的统计方法:——总体要求:详细描述统计学方法,以使读者能够通过原始数据验证所报告的结果;——计划书上,每一项分析用什么方法都要说明;——报告中,需说明所用方法是原计划规定的;——在报告的结果部分进一步解释细节。
Item 12b. 附加分析的方法,比如亚组分析和校正分析:——不鼓励亚组分析,因为假阳性率常常很高,容易出虚假结果。
事后的亚组间比较(Post hoc subgroup comparisons)是看到数据之后才想起来做的分析,往往不能被进一步研究所确认,这类分析不可信。
——校正分析必须事先在研究计划里规定,并说明理由。
例如,(1)关于分层变量的校正。
(item 8b 随机化中采用的分层变量)必须说明选择被校正的变量是计划规定的还是事后根据数据提议的。
(2)关于baseline的校正。
(item 16)如果事先没有规定,事后发现baseline有统计学差异,才来决定校正,不能算是正式结果,只能算是探索性分析。
CONSORT清单的“结果”部分Item 13. 受试者流程图:——分组后排除受试者并不随机;如:有些受试者因为急性恶化或出现副作用而失访,如果这类受试者在两组间的排除不均衡,就会导致错误结论。
——了解多少人没有按分配接受干预或没有完成治疗有助于读者判断多大程度低估或高估了疗效;——为了详细报告受试者流程图及相关信息,研究者须:(1)事先周密计划随访事宜;(2)实施过程中,由专人负责随访;详细记录随机化分组之后每一位病人的信息(case report form)。
随机对照临床试验CONSORT声明解读

随机对照临床试验CONSORT声明解读王瑞平李斌(上海市皮肤病医院临床研究与创新转化中心 上海 200443)摘 要 随机对照试验(randomized controlled trial, RCT)是临床研究的重要组成部分,合理设计、良好实施并规范报道的RCT临床研究通常可以为疾病的干预和治疗提供最高等级的循证医学证据。
为规范RCT临床研究的结果报告和学术发表,David Moher和Drummond Rennie于1996年起草了第1版随机对照试验报告统一标准(consolidated standards of reporting trials, CONSORT)声明,并分别于2001、2010年进行修订。
本文就最新版的CONSORT声明,从题目和摘要、介绍、研究方法、随机化方案、结果、讨论和其他信息等7个部分25个条目进行详细解读,为医务人员今后开展临床研究设计和临床研究结果报告撰写提供参考。
关键词 随机对照试验临床试验 CONSORT 结果规范报告中图分类号:R19-0 文献标志码:C 文章编号:1006-1533(2022)05-0058-05引用本文 王瑞平, 李斌. 随机对照临床试验CONSORT声明解读[J]. 上海医药, 2022, 43(5): 58-62.Interpretation of CONSORT statements on randomized controlled clinical trialWANG Ruiping, LI Bin(Clinical Research & Innovation Center, Shanghai Skin Disease Hospital, Shanghai 200443, China) ABSTRACT Randomized controlled trial (RCT) are essential for clinical research, and RCT that are rationally designed, well-implemented and reported can usually provide the highest level of evidence-based medical evidence for disease interventions and treatments. In order to standardize the result reporting and academic publication of RCT clinical studies, the first edition of the Consolidated Standards of Reporting Trials (CONSORT) statement was drafted in 1996 by David Moher and Drummond Rennie and revised in 2001 and 2010, respectively. The latest version of the CONSORT statement was interpretated in detail from 7 sections and 25 items including title and abstract, introduction, methods, randomization, results, discussion, and other information so as to provide reference for medical staff to carry out the writing of result report on clinical research design and clinical research in the future.KEy WORDS RCT; clinical trials; CONSORT; specification results reporting为规范随机对照临床试验(randomized controlled clinical trial, RCT)的结果报告,降低RCT研究的偏倚,1996年David Moher和Drummond Rennie教授起草第1版随机对照试验报告统一标准(consolidated standards of reporting trials, CONSORT)声明,该声明在很大程度上规范了RCT研究结果发表,提高了研究论文的质量[1-2]。
按CONSORT声明要求报告随机对照试验

摘要举例
• Results Of 102 patients in group 1, 22 (22 percent) reached the primary end point, as compared with 44 of 108 patients given benazepril in group 2 (41 percent) and 65 of 107 patients given placebo in group 2 (60 percent). As compared with placebo, benazepril was associated with a 43 percent reduction in the risk of the primary end point in group 2 (P = 0.005).
• 文题和摘要
– 如何把参加者分配到干预组(如:“随机分 配”、“随机化”、“随机指定”)
文题举例
• Efficacy and Safety of Benazepril for Advanced Chronic Renal Insufficiency (贝 那普利)
• Efficacy and Safety of Benazepril for Advanced Chronic Renal Insufficiency:a randomized, double-blind study
• 临床试验学家 • 统计学家 • 流行病学家 • 生物医学编辑
CONSORT声明主要内容
• 一个流程图:介绍病例入组到进入分析 各阶段的动态变化
• 一个核查表:22个项目,从文题到讨论 都有要求
CONSORT声明核查表
CONSORT声明核查表
最新consort声明(版)

CONSORT声明1220世纪90年代中期,国际上一个由临床流行病学家、临床专业人员、统计学3家和医学杂志编辑组成的课题组,花费近2年的时间制作了一个随机对照临床4试验报告的规范,并在国际著名的临床医学杂志上应用。
最先采用该规范的著5名期刊有《美国医学会杂志(JAMA)》、美国的《新英格兰医学杂志》、英国的《柳6叶刀》杂志、《英国医学杂志》和《内科学年鉴(Ann Intern Med)》等。
该规7范在使用5年后被更新和完善。
实践应用规范的结果表明,临床试验报告的质8量有了很大提高。
这一报告规范称为“CONSORT(Consohdated Standards of9Reporting Trials)声明”。
10随后几年的调查表明,国际上随机对照试验发表的质量得到了显著提高,该11规范也以多种语言版本在全世界发表。
根据几年的使用和反馈意见,该小组对12报告又进行了修订,由上述杂志于2001年再次发表。
最新的CONSORT声明可从13下列网址免费获取:。
14完整的随机对照试验报告应包括22条基本要素(表1),可供临床试验研究者、15杂志编辑和审稿专家对一篇随机对照试验进行核对,并督促作者按照该规范的16要求撰写随机对照临床试验报告。
此外,临床研究者还可根据该规范的各项条17目严格设计一项随机对照临床试验。
18表1 随机对照试验报告规范中的条目(CONSORT 声明)条目(共22条)定义及说明标题和摘要1以结构式摘要报告目的、对象和方法、治疗、主要结果和结论前言2简要介绍研究的背景、科学意义和立论依据方法对象3诊断标准、纳入/排除标准、研究场所、资料收集的来源治疗措施4试验治疗和对照治疗的详细用药方案、疗程及依从性试验目的5特定的目的和假设评价的结局6主要及次要结局的名称、测量方法和时段样本量7说明样本量估算的依据随机化随机分配的方8具体说明用什么方法进行随机分配法分配方案的隐藏9说明随机分配方案的执行过程,有无做到治疗方案的隐藏实施10说明随机分配方案的制作者、试验对象的纳入和分组执行者盲法11说明受试对象、治疗实施者、结局评估者是否对其设盲统计学方法12用于结局资料组间比较的分析方法(包括亚组和校正分析)结果受试对象流程图13以示意图表示受试对象纳入试验各阶段的数目和流失情况对象纳入的期间14说明从纳入第一例到最后一例的时间段及随访情况基线资料15各组纳入病例的基线人口学和临床特征(通常列表比较)纳入分析的例数16说明各组纳入分析的例数和退出/失访例数,意向性治疗分析结局和效应大小17报告每一主要及次要结局,给出原始数据及分析结果亚组或校正分析18对事先说明的亚组和校正因素进行附加的资料分析不良事件19报告各组的不良事件、副作用或药物不良反应讨论对结果的解释20结合研究的目的或假设、可能存在的偏倚,对结果进行解释21试验结果对实际应用的意义和价值结果的推广应用性概括证据22根据当前其他研究所获得的证据,对该试验结果进行概括192021222324。
按CONSORT声明要求报告随机对照临床试验

( 1 ) 描述研究设计 ,包括 :a研 究设计 方 析 。
式 ,说明是平行或多 因子等设 计方式 ,并详 述 4 结 果 各组人数 比例 ;b研 究概念 ,说 明是 优势或 是 ( 1 )受试 者流程图 :使用流程 图表示 复杂
p o r t i n g T r i a l s的英 文缩 写 .是 C O NS O R T小 组 同等或是不劣性试 验 的研 究设计 ;c 作 者采 用 的试 验 过 程 ,包 括 多 少 受 试 者 、入 选 标 准 、分 Re
[ M].北京 :北京市儿童保健所 ,1 9 8 6 .
3 李树春 李 晓捷 . 儿 童 康复 医学 [ M].北京 :人 民卫生 出版社 ,
2 0 06: 1 1 3 —1 1 8 .
4 张炬光 ,李继慧 ,邓 国生 ,等 .新 生儿先 天性 甲状腺 功能 低下 的 筛查研究 [ J ].实用心脑肺 血管病 杂志 ,2 0 1 0 ,1 8( 1 0 ) :1 4 6 6 .
错误解读 。
2 前 言
析 ,研究者必 须说 明在此 时研究 停止 的原 因。 结果的可能 。( 2 )研究结果 的外推性 :作者须 对 同一 资料做 多次统计分析必须 提 出适 当的校 说 明研究治疗方式的优缺点及其适 用的对象 和
必须说 明进行此研究 的科 学背景 ,或者提 正方法 ,否则会导致错误 的结果 和解读 。 ( 7) 临床上的可行性 。( 3 )对结果做 出解释 ,平衡 到 目前 尚缺乏这样 的研究 ,以说明此研究 的必 随机分组 的方法 、保持盲性 的方 法必须 向读 者 讨论结果 的优缺 点 ,考虑 其他 相 关研 究 的结 要性 ;并说 明此 研 究 要测 试 的假 说 及研 究 目 展示 。( 8 )结果统计分析方式 :不同类 型的资 果 。
CONSORT声明(2010版)

CONSORT声明20世纪90年代中期,国际上一个由临床流行病学家、临床专业人员、统计学家和医学杂志编辑组成的课题组,花费近2年的时间制作了一个随机对照临床试验报告的规范,并在国际著名的临床医学杂志上应用。
最先采用该规范的著名期刊有《美国医学会杂志(JAMA)》、美国的《新英格兰医学杂志》、英国的《柳叶刀》杂志、《英国医学杂志》和《内科学年鉴(Ann Intern Med)》等。
该规范在使用5年后被更新和完善。
实践应用规范的结果表明,临床试验报告的质量有了很大提高。
这一报告规范称为“CONSORT(Consohdated Standards of Reporting Trials)声明”。
随后几年的调查表明,国际上随机对照试验发表的质量得到了显著提高,该规范也以多种语言版本在全世界发表。
根据几年的使用和反馈意见,该小组对报告又进行了修订,由上述杂志于2001年再次发表。
最新的CONSORT声明可从下列网址免费获取:。
完整的随机对照试验报告应包括22条基本要素(表1),可供临床试验研究者、杂志编辑和审稿专家对一篇随机对照试验进行核对,并督促作者按照该规范的要求撰写随机对照临床试验报告。
此外,临床研究者还可根据该规范的各项条目严格设计一项随机对照临床试验。
表1 随机对照试验报告规范中的条目(CONSORT 声明)条目(共22条)定义及说明标题和摘要 1 以结构式摘要报告目的、对象和方法、治疗、主要结果和结论前言 2 简要介绍研究的背景、科学意义和立论依据方法对象 3 诊断标准、纳入/排除标准、研究场所、资料收集的来源治疗措施 4 试验治疗和对照治疗的详细用药方案、疗程及依从性试验目的 5 特定的目的和假设评价的结局 6 主要及次要结局的名称、测量方法和时段样本量7 说明样本量估算的依据随机化随机分配的方法分8 具体说明用什么方法进行随机分配配方案的隐藏9 说明随机分配方案的执行过程,有无做到治疗方案的隐藏实施10 说明随机分配方案的制作者、试验对象的纳入和分组执行者盲法11 说明受试对象、治疗实施者、结局评估者是否对其设盲统计学方法12 用于结局资料组间比较的分析方法(包括亚组和校正分析)结果受试对象流程图13 以示意图表示受试对象纳入试验各阶段的数目和流失情况对象纳入的期间14 说明从纳入第一例到最后一例的时间段及随访情况基线资料15 各组纳入病例的基线人口学和临床特征(通常列表比较)纳入分析的例数16 说明各组纳入分析的例数和退出/失访例数,意向性治疗分析结局和效应大小17 报告每一主要及次要结局,给出原始数据及分析结果亚组或校正分析18 对事先说明的亚组和校正因素进行附加的资料分析不良事件19 报告各组的不良事件、副作用或药物不良反应讨论对结果的解释20 结合研究的目的或假设、可能存在的偏倚,对结果进行解释结果的推广应用性21 试验结果对实际应用的意义和价值概括证据22 根据当前其他研究所获得的证据,对该试验结果进行概括。
按CONSORT声明要求报告随机对照临床试验

2 季 宁东 ,丁善 戎 ,薛 彩 萍 ,等 .农 村卫 生 人员 培训 提倡 个 性化 [ J ] . 中国医药指南 , 2 0 0 8 ,6 ( 1 3 ) :1 7 8 — 1 7 9 .
( 收稿 日期 : 2 0 1 2—1 0— 0 8 ;修 回 日期 :2 0 1 2—1 1 —3 0 )
造学习交流氛围 ,并 给专业技术人员一定的学习压力 :定期开
身具有局 限性 ,一 般 以面授 为 主 ,讨论 、技能 操作 、 自学 为
辅 ,但是全科型卫生人才 的培养 ,在作为综合性医院和社区卫 生服务 中心的轮转与见习学习是必不可少 的环节。 因此 ,建立
办学习交流会、案例讨论会等专题活动 ;要求专业技术人员修 满继续教育学 分 ;为其 提供适 宜培训 信息 ;为其创造 培训 条 件 ;定 期开展多种形式 的院内考核 。
・
7 5・
人员 的素 质、能力 、水 平 ,单 靠短 期培 训很 难有 较大 幅度 提 升 ,提高他们 的 自学意识 、 自学能力是 当务之急 。 3 . 2 人才 队伍建设长效机 制 的建 立问题 一定 时期 内的集 中
培训所取得 的效果是显著 的,也是有 限的。集 中培训的方式本
国际医学研究报告清单及规范:1-CONSORT Checklist---临床干预性试验
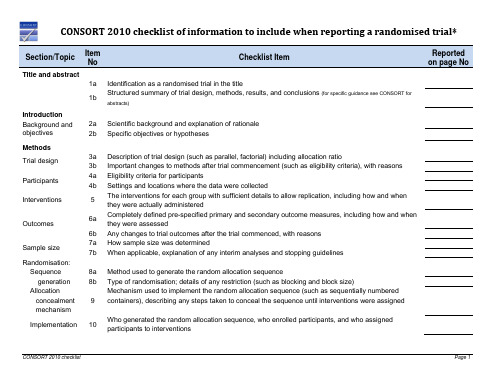
CONSORT 2010 checklist of information to include when reporting a randomised trial*Section/Topic ItemNoChecklist ItemReportedon page NoTitle and abstract1a Identification as a randomised trial in the title1b Structured summary of trial design, methods, results, and conclusions (for specific guidance see CONSORT for abstracts)IntroductionBackground and objectives 2a Scientific background and explanation of rationale 2b Specific objectives or hypothesesMethodsTrial design 3a Description of trial design (such as parallel, factorial) including allocation ratio3b Important changes to methods after trial commencement (such as eligibility criteria), with reasonsParticipants 4a Eligibility criteria for participants4b Settings and locations where the data were collectedInterventions 5 The interventions for each group with sufficient details to allow replication, including how and when they were actually administeredOutcomes 6aCompletely defined pre-specified primary and secondary outcome measures, including how and when they were assessed6b Any changes to trial outcomes after the trial commenced, with reasonsSample size 7a How sample size was determined7b When applicable, explanation of any interim analyses and stopping guidelinesRandomisation:Sequencegeneration 8a Method used to generate the random allocation sequence8b Type of randomisation; details of any restriction (such as blocking and block size)Allocationconcealment mechanism 9Mechanism used to implement the random allocation sequence (such as sequentially numbered containers), describing any steps taken to conceal the sequence until interventions were assignedImplementation 10 Who generated the random allocation sequence, who enrolled participants, and who assigned participants to interventionsBlinding 11a If done, who was blinded after assignment to interventions (for example, participants, care providers, those assessing outcomes) and how11b If relevant, description of the similarity of interventionsStatistical methods 12a Statistical methods used to compare groups for primary and secondary outcomes 12b Methods for additional analyses, such as subgroup analyses and adjusted analysesResultsParticipant flow (a diagram is strongly recommended)13aFor each group, the numbers of participants who were randomly assigned, received intended treatment, and were analysed for the primary outcome13b For each group, losses and exclusions after randomisation, together with reasonsRecruitment 14a Dates defining the periods of recruitment and follow-up 14b Why the trial ended or was stoppedBaseline data 15 A table showing baseline demographic and clinical characteristics for each groupNumbers analysed 16For each group, number of participants (denominator) included in each analysis and whether the analysis was by original assigned groupsOutcomes and estimation 17aFor each primary and secondary outcome, results for each group, and the estimated effect size and its precision (such as 95% confidence interval)17b For binary outcomes, presentation of both absolute and relative effect sizes is recommendedAncillary analyses 18 Results of any other analyses performed, including subgroup analyses and adjusted analyses, distinguishing pre-specified from exploratoryHarms 19 All important harms or unintended effects in each group (for specific guidance see CONSORT for harms) DiscussionLimitations 20 Trial limitations, addressing sources of potential bias, imprecision, and, if relevant, multiplicity of analysesGeneralisability 21 Generalisability (external validity, applicability) of the trial findingsInterpretation 22 Interpretation consistent with results, balancing benefits and harms, and considering other relevant evidenceOther informationRegistration23 Registration number and name of trial registryProtocol24 Where the full trial protocol can be accessed, if availableFunding25 Sources of funding and other support (such as supply of drugs), role of funders*We strongly recommend reading this statement in conjunction with the CONSORT 2010 Explanation and Elaboration for important clarifications on all the items. If relevant, we also recommend reading CONSORT extensions for cluster randomised trials, non-inferiority and equivalence trials, non-pharmacological treatments, herbal interventions, and pragmatic trials. Additional extensions are forthcoming: for those and for up to date references relevant to this checklist, seexxxxxx。
随机临床试验研究的报告规范(CONSORT声明)中关于文题、摘要、前

白 内 障 术 后 角 膜 水 肿 的 疗 效 分 析
[ J ] . 国 际眼科杂 志 , 2 0 1 5 , 1 5( 2 ):
3 2 9 — 3 3 0 .
部滴 用有脱水作用 , 可促 进角膜组织脱 [ 2 ] 曹芳 , 王臻 , 戴 静桃 .年 轻汉族 女性 水 并 恢 复 正 常厚 度 和 功 能 。 我 院 用 面部 比例 的测 量 与评估 [ J ] .广东 牙
引起 角膜 水肿 。角 膜 内皮细 胞不 可再 膜 水肿 治疗 不仅 效果 好 也未 发现对 眼 所 以 生, 是 以健康 的角膜扩展延 伸来补充受 局部有 明显 刺激及全身不 良反应 , 损角膜 内皮细胞 , 这样角膜 内皮密度下 值 得推广 。
杨帆 , 翟 建 伟 .小切 口白 内 J 梁晟 崎 ,
白 内障术 后 患者视 功 能 生存 质 量的 影 响[ J ] . 现 代 医院 , 2 0 1 5 , 1 5 ( 1 2 ) :
62 — 6 3. 6 5 .
3 讨 论
白 内障术 中灌 注 液 及机 械 性操 作 究 其使 用期 限 和保存 方法 。 作者认 为 会对角膜 内皮发生机械 和化学性损 伤 , 该 混合 液对 白内障 术后早 期 中重度 角
( 收稿 : 2 0 1 6 — 0 8 — 2 6 编辑 : 黄月 薪 )
障 术 后 当 天 开 放 滴 眼 的 临 床 观 察 [ J ] . 实 用 医学 杂 志 , 2 0 0 7 , 2 3 ( 1 8 ) :
2 8 8 9 — 2 8 9 0.
。
雷蕾 , 康伟 , 翁 小玲 , 等 .有 旋 美 托 咪 定滴 鼻用 于 d , J L 腭裂 整 复术 麻 醉
病 防治 , 2 0 1 5, ( 2) : 8 4 — 8 6 .
按CONSORT声明要求报告随机对照试验

何谓CONSORT声明
– CONSORT小组
• • • • 临床试验学家 统计学家 流行病学家 生物医学编辑
CONSORT声明主要内容
• 一个流程图:介绍病例入组到进入分析 各阶段的动态变化 • 一个核查表:22个项目,从文题到讨论 都有要求
CONSORT声明核查表
CONSORT声明核查表
CONSORT声明核查表
CONSORT声明的内容
• 引言 科学背景和原理的解释
引言举例
• Angiotensin-converting–enzyme (ACE) inhibitors slow the progression of chronic kidney disease in the presence or absence of diabetes, particularly in patients with mildto-moderate renal insufficiency, as reflected by a serum creatinine level of 1.5 to 3.0 mg per deciliter (133 to 265 µmol per liter).1-3
引言举例
• Many infer that the unique benefits of these drugs in patients with advanced renal failure might not be superior to those afforded by blood-pressure control alone.4 As a result, patients with advanced chronic kidney disease have not been included in prospective, large-scale clinical trials of ACE inhibitors.1,6
(完整word版)RCT临床研究遵循CONSORT规范(中文版)

位置
编号
项目说明
页码
附例
Title and abstract
1a
题目中说明研究的性质,如随机对照双盲研究
1b
结构式摘要,按期刊要求
Introduction(前言部分)
2a
研究背景、并说明理由
2b
明确的研究目的与假说
Methods(方法学部分)
Trial design试验设计
7b
When applicable, explanation of any interim analyses and stopping guidelines
必要时,解释期中分析及试验终止原则
Randomisation:随机化
Sequence generation随机序列产生的方法
8a
Method used to generate the random allocation sequence
Participants受试者
4a
Eligibility criteria for participants受试者的纳入、排除和退出标准
4b
Settings and locations where the data were collected数据收集的环境及地点
4c
伦理学至上原则
Interventions干预方法
5
The interventions for each group with sufficient details to allow replication, including how and when they were actually administered
(完整word版)RCT临床研究遵循CONSORT规范(中文版)

Outcomes and estimation结局
17a
For each primary and secondary outcome, results for each group, and the estimated effect size and its precision (such as 95% confidence interval)
Participants受试者
4a
Eligibility criteria for participants受试者的纳入、排除和退出标准
4b
Settings and locations where the data were collected数据收集的环境及地点
4c
伦理学至上原则
Interventions干预方法
有详细,规范的CRF表记录患者详细的基线资料
Numbers analysed试验人群的数量
16
For each group, number of participants (denominator) included in each analysis and whether the analysis was by original assigned groups
13a
For each group, the numbers of participants who were randomly assigned, received intended treatment, and were analysed for the primary outcome
报告随机分配到每一组的受试者,接受治疗的例数以及进行首要结果分析的病例数
