序列拼接
序列拼接工具使用指南

序列拼接工具使用指南金唯智
A. 序列拼接工具在哪
B. 如何使用序列拼接工具-使用测序订单号拼接-上传.ab1文件拼接
序列拼接工具在哪?
登录金唯智订单系统 工具箱 序列拼接
如何使用序列拼接工具?
A.通过测序订单号拼接(推荐)
B.通过上传.ab1文件拼接
A. 使用测序订单号
①输入所需拼接的订单号(如有多份订单用“;”隔开)
②点击拼接就会出现拼接好的结果,根据需要下载对应格式的文件
B.通过上传ab1文件(测序结果)进行拼接
①点击上传ab1文件
②选中需拼接的样品,点击打开,系统即会自动进行拼接,结果同A中方法一致,下载操作。
基因组序列拼接

3.序列所在链不确定 由于测序过程中无法确定特定片断属于DNA 双链中的哪一条链上,所以我们在拼接过程中并 不清楚使用的是read的正义链,还是其互补链。
4.重复序列的干扰 DNA序列自身含有高度重复的子序列,它们 一种表现为短序列的串级重复,比如:(GGAA)n。 或AmTn等。另一种表现为大量相似序列(其拷贝数 可达几十万)散布在基因组的各个地方。Repeat 的存在,将导致fragments间overlap的不真实性, 进而产生错拼的结果。因此在拼接过程中耍确定 这些序列的形式及大小,才能保证以高概率恢复 出其在原始真实序列中的位置.
基因组序列拼接
序列拼接
序列拼接任务即将测序生成的reads短 片段拼接起来,恢复出原始的序列。该问 题是序列分析的最基本任务,是基因组研 究成功与失败的关键,拼接结果直接影响 到序列标注,基因预测、基因组比较等后 续任务。 基因组序列的拼接也是基因组研究必须 解决的首要难题。其困难不仅来自它的海 量数据(以人类基因组序列为例,从数量为 10兆级的片断恢复出长度为亿级的原始序 列),而且源于它含有高度重复的序列。
2.不完全覆盖性 不是所有的碱基被测序的次数都等于 平均测序覆盖度。极端的情况,可能会出 现源基因组序列上部分区域未被测序的情 况(这段区域称为gap)。即,测序的reads 集合不是原始基因组序列一个完整覆盖。 此时需要借助于各种图谱如:基因组指纹 图谱(genome fingerprint map), 基因组级 物理图谱(genome-wide physical map),细 胞发生图谱(cytogenetic maps)等协助对 reads进行定位.
拼接算法评价
以上拼接问题的四个难点不仅极大的增 加了解决实际拼接问题的难度,而且从某种 程度上说无法完整地恢复出原始DNA序列来。 即实际上仅能构建出若干个contig(重建的 fragments的一种排列形式,它覆盖基因组 上一段连续区域)这些contig将指导测序项目 finishing阶段的实验方法最终构建DNA完整 序列。
生物信息学中的序列比对与拼接算法研究

生物信息学中的序列比对与拼接算法研究序列比对和拼接是生物信息学中的重要研究内容,它们是分析和解读生物序列的关键步骤。
序列比对是将两个或多个序列进行比较,确定它们之间的相似性和差异性。
而序列拼接则是将分割或碎片化的序列片段重新组装成完整的序列。
在生物信息学中,序列比对和拼接的重要性不言而喻。
它们可以帮助我们理解基因组结构和功能,发现基因突变和变异,还可以揭示物种间的亲缘关系。
此外,在研究疾病诊断和治疗方面,序列比对和拼接也发挥着重要作用。
在进行序列比对时,有多种算法可以选择。
其中,最常用的算法之一是Smith-Waterman算法。
这个算法采用动态规划的方法,能够在给定序列中搜索相似的片段。
Smith-Waterman算法将比对的序列划分为多个片段,并对每个片段进行得分。
然后,将得分最高的片段进行拼接,形成两个序列之间的最优比对结果。
另一个常用的序列比对算法是Needleman-Wunsch算法。
该算法同样基于动态规划的原理,但与Smith-Waterman算法不同的是,它将整个序列进行比对,而不是划分为片段。
Needleman-Wunsch算法通过递归计算分数矩阵,并选择得分最高的路径作为最优比对结果。
此外,还有一种经典的序列比对算法是BLAST(基本局部比对搜索工具)。
BLAST算法通过构建索引和预处理的方式,能够在大规模数据集中高效地搜索相似的序列。
BLAST算法基于快速的启发式搜索策略,它可以快速地找到相似性较高的序列片段,并返回最有可能的比对结果。
除了序列比对算法,序列拼接算法也是生物信息学中的研究热点。
在面对大规模的序列数据时,拼接算法可以将分散的序列片段组合成完整的序列,为后续的基因组装和功能预测提供基础。
在序列拼接领域,有许多算法可以选择。
最常用的算法之一是Overlap-Layout-Consensus(OLC)算法。
OLC算法通过比对序列片段的重叠区域,并根据重叠区域的一致性进行序列拼接。
利用SeqMan进行序列拼接

类型3错误拼接的类型13 2• 为了区分修整过和没有修整 过的数据,我们给修整过的 数据加一个有颜色的背景。 选择菜单 Project→Parameters→Editing Color打开下面的对话框。确 定use consensus match color 和use other color已被选中。
• 修整完毕后 Alignment View 中在序列的左边会有一个黑色的垂直棒, 右边有一个小的黑三角形。
• 要找回修整去掉的序列末端,只需把垂直棒向序列的两端拖动即可, 以前修整去掉的序列有明亮的黄色背景。
Pre-Assembly Options 操作及序列装配
• 在拼接前面,可以将所要拼接的片段中清除载体和污染序列,优化 装配顺序,设定片段末端和标记重复序列
查看修整序列前后的跟踪数据
• 右键选择6 号样本,然后Show Original Trace Data,打开Trace:Sample 6.abi 窗口
• 从 5’末端起变淡的部分是载体序列,将不会用于序列装配,故被清除。 • 垂直的黑棒出现于修整和未修整的序列之间,根据需要拖动垂直黑棒,可以调
整用于装配的序列末端。
利用SeqMan进行序列拼接
Step2:加入你要拼接的序列
点击Add sequences
查找并选中要拼接的 序列
点击Add按钮
填加完后点击done
注:最好用测序的图谱(*.abi)尽量不要直接用测序得到的序列 (.seq)
1 点击Assemble按钮 2 点击拼接好的co
Alignment of contig1 窗口中点击 左三角显示序列的测 序图谱
1. 两条序列的测序结果 不一致并明显一条测 序质量好而另一条质 量差
处理:直接将该处修改为 正确的碱基
最新利用SeqMan进行序列拼接

Step5:修改拼接错误
3. 两条序列的测序结果不 一致并明显两条测序质量 都好
处理:测序过程出现 问题,重新测定
类型3
错误拼接的类型
Step6:导出拼接的序列
• 可选择合适的格式,导出拼接好的序列
1
3 2
• 通过以上几步我们就能很快将几个测序片 段进行拼接,大家可以拿着自己的序列试 试!
• „还可用左下角的快捷按钮查找错误的拼接
Step5:修改拼接错误
1. 两条序列的测 序结果不一致 并明显一条测 序质量好而另 一条质量差
处理:直接将该 处修改为正确的 碱基
错误拼接的类型
Step5:修改拼接错误
2. 两条序列的测序结果 不一致并两条测序质量 都比较差
处理:重新测序或用 新的合适引物重新测定
• SeqMan根据trace数据的质量和载体序列在 装配之前可以自动地进行末端修整。然而 有时候修改的程度难以掌握,下面我们将 用手工的方法找回修整过的末端。
手动修改
• 为了区分修整过 和没有修整过的 数据,我们给修 整过的数据加一 个有颜色的背景。 选择菜单 Project→Paramete rs→Editing Color 打开下面的对话 框。确定use consensus match color和use other color已被选中。
去除载体序列
• 单击 Scan All按钮,将出现一个report窗口。
• 现在载体栏显示:载体名字前都有一个检 测通过的标志,说明Janus 载体在全部14 序 列中都已经检测到了。
• 单击assemble按钮,进行序列拼接。
查看末端修整和载体序列去除细节报告
• 选择Project 菜单的Trim Report打开Trim report窗口。
生物信息学中的基因组序列拼接与基因功能预测研究

生物信息学中的基因组序列拼接与基因功能预测研究生物信息学是一门运用计算机科学和生物学技术相结合的学科,其核心任务之一是利用生物信息学工具对基因组序列进行拼接和基因功能预测的研究。
这些研究为我们深入理解生物体的基因组结构和功能提供了重要的信息。
下面,我将介绍基因组序列拼接和基因功能预测的基本概念、方法和应用。
基因组序列拼接是指将分散在基因组中的DNA片段按照正确的顺序连接起来,形成完整的基因组序列。
由于目前测序技术的限制,我们往往无法一次性得到完整的基因组序列。
因此,我们需要使用拼接算法将测序得到的片段序列进行组装。
拼接算法主要包括重叠图法和de Bruijn图法。
重叠图法是通过寻找片段之间的重叠区域,将它们按照正确的顺序连接起来。
该方法依赖于片段间的重叠信息,即两个片段共同的序列部分。
通过比对和比较这些重叠序列,我们可以确定它们的正确相对位置和顺序。
然后,我们将重叠的片段合并成较长的序列,重复这一过程直到得到完整的基因组序列。
de Bruijn图法则是先将片段序列切割成短的kmer序列,并将这些kmer序列转化为节点。
然后,通过比对和比较这些节点之间的连接关系,我们可以构建一个图,即de Bruijn图。
图中的每个节点代表一个kmer序列,边表示两个节点之间的连接关系。
通过在图中查找路径,我们可以将这些节点连接起来,形成基因组序列。
基因功能预测是指根据基因组序列推测基因的功能。
基因功能是指基因在生物体内所扮演的生物学角色。
对于已经知道功能的基因,我们可以通过比对新的基因组序列和已知的基因组序列数据库,来推测新的基因的功能。
这是一种比较直接的方法,被称为同源比较。
如果新的基因序列与已知序列数据库中的某个基因有高度相似性,那么我们可以认为它们在功能上是相似的。
此外,还有一些基因功能预测的方法是基于基因序列的特征和结构的。
例如,基因组能预测数据库(Gene Ontology,简称GO)使用了一套规范的词汇来描述基因的功能、进程和组件。
序列拼接

DNAStar应用之SeqMan篇
新的拼接任务开始→所有程序→DNAstar →SeqMan
添加序列
打开保存序列的文件夹
选择序列
导入
整理一下末端
用鼠标拖动手
动更改末端
用鼠标点击更改
序列方向和形式选择载体
自动查找
看看结果拼接
点开测序图
6种阅读框
选择的序
列的位置NCBI查询所选择的序列
保存结果
打印成PDF文件也是一个不错的选择
Vecotr NTI Suite应用之Contig Express篇
运行VNTI 程序
Contig Express 程序窗口,可以设定参数,一般用默认值即可。
导入测序结果(文
件扩展名ab1改成
abi)相关软件
EditView for Macs;
Chroma for Windows]也可以用鼠标右键
导入后可以双击查看和编辑各个测序结果
选择序列,根据实际情况调整序列末端
选择序列拼接
双击查看结果
输出结果到剪贴板,注意最上面的像机按钮,直观吧。
Sequencher应用
开始→所有程序
导入序列选择序列
详细说明
此界面调整参数
拼接
双击查看结果
后记
——时间仓促,工具
栏一些细节没有涉及,抛
砖引玉而已。
输出结果
隔洋乡音渺,背井岁月长;
梦里双亲貌,犹是旧时光。
青萤。
SeqMan进行序列拼

宏基因组序列拼接
总结词
将多个微生物的测序数据拼接成更完整的基因组,用于 研究微生物群落结构和功能。
详细描述
在宏基因组研究中,由于测序数据来自多个微生物,需 要将这些数据拼接成更完整的基因组,以便更好地了解 微生物群落的结构和功能。这个过程需要解决不同微生 物基因组的拼接问题,以及可能的基因重排和倒位等结 构变异。宏基因组序列拼接有助于深入了解微生物群落 的生态学和进化,为环境科学、农业和医学等领域提供 有价值的信息。
保存的拼接结果可以用于后续的分析和实验验证。
04
序列拼接的质量控制
拼接准确率的评估
准确率
评估拼接序列与原始序列的一致性,计算拼接序列中正确碱基的比例。
错误率
计算拼接序列中错误碱基的比例,反映拼接过程中的误差水平。
拼接效率的评估
拼接时间
评估拼接过程所需的时间,分析拼接效率。
内存使用
评估拼接过程所需的时间,分析拼接效率。
质量控制的方法和标准
质量控制标准
设定拼接准确率、错误率和拼接效率等 质量控制标准,确保拼接结果的质量。
VS
质量控制方法
采用多种质量控制方法,如统计检验、可 视化分析和重复实验等,对拼接结果进行 全面评估和验证。
05
序列拼接的应用实例
基因组序列拼接
要点一
总结词
将测序得到的短读段(reads)拼接成长度更长的序列,用于 基因组组装。
序列编辑
SeqMan软件提供了丰富的编辑 功能,如删除、替换、添加等, 方便用户对序列进行修改和调整。
序列比对
SeqMan软件支持多种序列比对 算法,能够快速比对新旧序列或 不同来源的序列数据。
软件应用领域
基因组学
生物信息学和基因组学中的序列比对和拼接

生物信息学和基因组学中的序列比对和拼接序列比对和拼接是生物信息学和基因组学研究中的重要技术。
通过比对和拼接,可以研究基因组中的基因序列、RNA序列、蛋白质序列等生物分子序列信息。
序列比对是指将两条或多条生物分子序列进行对比,找出它们之间的相似性和差异性。
通常通过计算相似性分数来衡量序列的相似性,常用的相似性评估方法包括百分比相似性、编辑距离、曼哈顿距离等。
其中,百分比相似性是最常用的方法,其计算公式为“相同碱基的数量 / 总碱基数× 100%”。
序列比对的方法包括全局比对和局部比对。
全局比对是将整条序列进行比对,适用于序列差异较大的情况。
局部比对是将序列中的片段进行比对,适用于序列存在重复区域或异构体等复杂情况。
序列拼接是指将两条或多条生物分子序列拼接起来形成一条完整的序列。
在基因组测序中,常用的拼接方法包括Overlap-Layout-Consensus(OLC)和De Bruijn图。
OLC方法将测序产生的大量短序列通过比对形成序列重叠区域,再根据重叠区域构建一张序列图形,最后生成最长的序列。
De Bruijn图方法将测序产生的短序列进行碎片化,然后根据这些碎片构建De Bruijn图,最后生成最长的序列。
序列比对和拼接在研究生物分子序列中具有广泛的应用。
比对和拼接结果可以用于推断序列之间的进化关系、预测序列的结构和功能,以及发掘新的序列之间的关联性等。
利用序列比对和拼接,可以更深入地了解生物体内复杂的分子交互,从而为研究生物体的生长和发育等生命过程提供理论基础。
目前,随着生物信息学和基因组学技术的发展,序列比对和拼接算法也在不断地改进和优化,增强了对生物体内分子行为的研究能力。
这一领域未来的发展趋势将会更加普及化和多样化,便于更多科研人员探究生物体内复杂的分子行为,为生命科学进一步发展做出贡献。
测序结果分析及序列拼接

3、测序出现套峰的结果
Hale Waihona Puke 3.3 序列拼接实例分析一、序列拼接软件
DNAman Vector NTI中的ContiExpress Lasergene中的SeqMan
二、利用DNAman软件拼接序列
1、启动DNAman软件 2、导入序列
导入待拼接序列及参数设置
1.点击 Add file
测序结果分析及序列拼接.ppt
3.2 测序结果分析(p60)
测序图谱分析
理想的测序图谱峰形尖锐,峰间距均匀,信噪比高,各种颜 色的峰高度均匀,基线平直。
以ABI3730x进行测序,在反应良好时,30~800bp间的序列 为可信区。
1、测序反应良好的结果
2、测序出现杂峰的结果
2. 点击 Assemble
3、拼接序列
点击 Show result
序列拼接效果图
点击 Export
4、导出结果
点击“是”
数据的保存
数据的比对验证
/
数据的比对验 证
数 据 的 比 对 验 证
数据的比对验 证
DNA测序结果拼接方法
待拼接序列显示区
点击
运用PBIL进行在线拼接
粘贴要拼接的 两个序列
点击
点击Contigs,即可出现 拼接好的序列
运用DNAMAN进行 本地ORF
搜索—开放阅读框
文件--打开--(拼接好的序列)
搜索—开放阅读框--(得到的东西)
蛋白质—翻 译纵览(结 果)
点击(得到的结果)
对序列进行在线ORF
点击
粘贴拼接好 的序列
点击
点击查 看详情
点击
结果
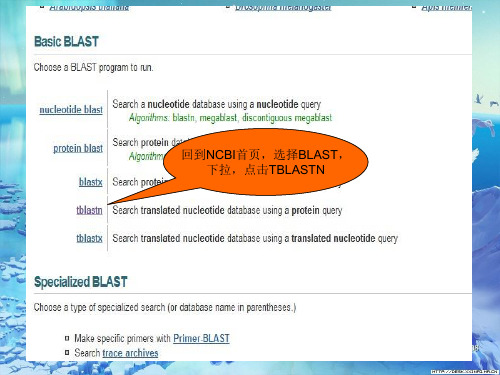
回到NCBI首页,选择BLAST, 下拉,点击TBLASTN
粘贴下载的序列
填写你想拼 接的序 列。。。进 行blast
选择一个序列,进入
将序列下载下来
点击blast
点击
粘贴序列
选择otherS
填写想比对的物种
选入两个待拼接的 序列的保存地址
RNA序列拼接与组装分析的步骤与技巧

RNA序列拼接与组装分析的步骤与技巧随着高通量测序技术的发展,RNA序列在生物学研究中扮演着重要的角色。
在进行RNA测序后,我们需要将这些短片段的序列拼接起来,以便进行进一步的分析。
RNA序列的拼接与组装分析对于研究基因表达调控、发掘新的转录本、研究剪接变异等具有重要意义。
本文将介绍RNA序列拼接与组装分析的步骤与技巧。
1. 数据预处理在进行RNA序列拼接与组装分析前,需要对测序数据进行预处理。
常见的预处理步骤包括去除测序引物序列、去除低质量序列、去除接头序列等。
这些步骤可以使用专业的测序数据分析软件进行,如Trimmomatic、Fastp等。
预处理后的数据更适合进行后续的分析。
2. 数据质量评估在进行RNA序列拼接与组装分析之前,需要对数据质量进行评估。
这可以通过软件工具进行,如FASTQC、Nanoplot等。
数据质量评估有助于判断测序数据的可靠性,并进一步了解实验中的潜在问题,如测序深度是否足够、样品间的比较是否可靠等。
评估结果有助于优化后续的分析步骤。
3. 序列拼接序列拼接是将测序得到的短片段序列拼接成完整的转录本序列。
对于无刺激(unstimulated)的RNA测序数据,可以使用常规的拼接方法,如TGICL、CAP3等。
对于有刺激(stimulated)的RNA测序数据,由于存在剪接变异等复杂情况,通常需要使用更高级的拼接方法,如Trinity、StringTie等。
这些软件提供了多种算法和参数选项,可以根据实际情况选择适合的方法。
4. 异常削减与错误修复在进行序列拼接后,可能会存在部分异常序列或序列错误的情况,如插入缺失、碱基替换等。
为了消除这些异常序列的影响,可以使用异常削减(abundance filtering)和错误修复(error correction)的方法。
异常削减通过比对已知转录本或参考基因组来过滤掉异常或假阳性的序列。
错误修复可以根据测序深度和碱基质量分数来对序列进行修正,常见的错误修复工具有Rcorrector、BFC等。
[剖析]序列拼接
![[剖析]序列拼接](https://img.taocdn.com/s3/m/7259580ca9114431b90d6c85ec3a87c240288a3d.png)
序列拼接* 为了保证测序结果的准确性,单基因短片段(700pd左右)测序一般应采用双向测序,然后将双向测序的结果拼接在一起,从而获得一致性序列。
线粒体基因组测序和DNA长片段测序一般是通过分段测序来完成的,最后也需要将测出的短片段拼接成一条完整的序列。
序列拼接可以在不同的软件中进行。
一、使用“组装批处理文件byLHM.pg4”进行拼接1. 在预定的位置建立一个文件夹“gap”,将需要使用的3个软件“组装批处理文件byLHM.pg4”、“V ector_primer4pMD18-T.vec_pri”、“pMD18-T_V ector.seq”拷贝到该文件夹下,再将需要拼接的测序文件拷贝到该文件夹下。
2. 双击运行“组装批处理文件byLHM.pg4”程序。
3. 在程序运行后出现的界面右侧点击“Add files”按钮,打开要拼接的序列文件。
为了保证拼接后输出的是正向序列,最好先添加上游引物序列,然后添加下游引物序列,因为在一般情况下软件将添加的第一条序列默认为正向参照序列;有时由于测序效果等因素的影响,有时即使首先添加的是上游引物序列,但拼接后仍然会以测序效果明显更好的下游引物序列为正向参照序列,此时需要按照后面介绍的方法将上游引物序列转换为正向参照序列再输出一致性序列。
4. 点击界面上方第二行的“Configure Modules”,在弹出的窗口左边的任务栏中点击“[x]Sequencing vector Clip”,再点击右边的“Browse”按钮,通过弹出的窗口打开“V ector_primer4pMD18-T.vec_pri”程序;点击左边任务栏中的“[] Cloning V ector Clip”,再点击右边的“Browse”按钮,通过弹出的窗口打开“pMD18-T_V ector.seq”程序;点击左下角的“Run”按钮,即开始数据处理,处理结果将自动保存到“gap”文件夹中。
5. 在“gap”文件夹中双击“AssMit_tmp.o.aux”文件,将鼠标移到弹出的“Contig Selector”窗口中的直线上,点击右键,选择“Edit Contig”,即弹出“Contig Editor”窗口,点击最右边的“setting”按钮,在下拉菜单中选择“By background colour”,即可显示比对结果的有差异碱基;双击某一序列,即可显示该序列的测序峰图,以检查核对该位点碱基的测序情况。
生物信息学序列拼接

但是实际上G并不可知,那么退而求 其次, G的序列片断Gk亦可,事实上Gk亦 不可知。所以将所有的read切割成小片nmers,所有Solid的n-mers形成的集合称 为Gk的近似。最后,构造De Bruijn图。
编辑ppt
15
现有算法的主要问题
虽然已经开发了以上的算法,基因组 序列拼接问题尚未彻底解决,以上两类算 法都存在着各自的缺陷。
编辑ppt
22
1.Overlap定义
如果一个串的前缀是另一个串的后缀则 认为这两个串之间存在overlap,并根据 over-lap构建超串。对给定的串f和g,存在 多个可能的overlap关系.
比如说,若f=ACTGGGAGCAGC, g=AGCAGCTTTTACT,
那么他们之间至少存在两个overlap形式。
编辑ppt
13
将每个read和Gk的近似进行比对,寻 求read的最小改变能够使得read的所有nmers包含在Gk的近似集合中。从而构建了 高质量序列,而对于Poor read,直接抛弃, 对Chimeric read(两端在n-mers中但整体不 在的reads)进行特殊处理。
编辑ppt
14
初始的想法是要实现去除reads中的 测序错误的目的,如果知道原始序列G, 那么直接使用测序获得的read和G进行比 较即可。
编辑ppt
23
编辑ppt
24
在我们的算法中,仅考虑两个串之间最 大的overlap情况,并定义overlap(f,g)表 示f和g之间存在的多个overlap关系中最长 的一个overlap所包含的字符个数。
在上面的例子中overlap(f,g)=6。如果 f和g之间overlap区域长度小于M(M是一个 足够小的正整数),则overlap(f,g)=0。
序列拼接简介

丁香园论坛:/bbs/thread/1247063#1247063问:从测序仪的光密度采样与分析、碱基读出、载体标识与去除、拼接、填补序列间隙、到重复序列标识、读框预测和基因标注的每一步都是紧密依赖基因组信息学的软件和数据库。
答:一、这应该是对DNA及mRNA的基本分析,有很多免费的软件可以利用,但是想做流程就需要用perl一样的胶水语言进行组合。
从测序仪结果开始:phred 进行base calling,即碱基判读cross_match 去除载体及引物序列repeatmask屏蔽重复序列longorf.pl 进行最长读码框预测blast2/blat定位样本序列到已知基因或者基因组用emboss软件包中各种软件可以进行进一步分析,如DNA/RNA/PRotein二级结构,跨膜区,信号肽分析等。
GO数据库对基因分类研究还可以进行分支研究,如利用测序结果进行SNP/Mutation研究,用polyphred/consed,或者mutation surveyor软件(有demo版和商业版)再以后的研究思路就非常细化了,可以结合具体分析目的进行。
二、1、基因组序列拼接——phred/phrap/consedPhred 简介Phred是一个采用快速傅利叶变换分析技术以及动态规划算法从DNA测序所得到的图形数据中提取DNA序列排列顺序信息(Base Calling)得到DNA序列的软件。
Phred 对序列中的每一个数据产生一个被广泛接受的带有质量控制标准(quality scores)的“Base Call”。
Phred质量指标x就相当于约10-x/10的误差概率。
因此,PHRED质量指标20就相当于在原始数据中一个Base Call的精确度为99%。
Phred可以读取DNA测序仪生成的色谱图文件(二进制格式),通过分析每个碱基的“质量”信息而输出每个测序序列的碱基序列和质量信息文件(文本格式)。
它自动的判断并读取ABI 373、377、3700和MegaBase等大多数DNA测序仪产生的色谱图文件,而且还可以自动识别经过gzip或Unix compress压缩的数据文件。
ContigExpress 序列拼接(优选.)

此名为ContigExpress的软件可用于做序列拼接,主要使用方法如下:1.解压缩下载的压缩文件contig.zip文件,保证文件CExpress.exe,Gexudat.def在同一个目录下,打开Cexpress.exe应用程序,进入ContigExpress操作界面,如图1。
图12.点击菜单上的“Project”选择“Add Fragments”,一般我们发给您的是AB1文件,如果您有其它格式的文件,也可以选择,在这里我们选择AB1文件,以其为例,如图2。
图23.选择您存放AB1文件(即我们Email给您的测序结果的彩图文件)的目录,选择文件类型为ALL FILES, 之后打开要拼接的AB1,从而添加进ContigExpress软件。
在此以A、B 两个序列为例,如果有多个序列的也可以同时添加进入。
图34.选中要拼接的序列,再选菜单“Assemble”栏下的“Assemble Selected Fragments”命令,或用工具栏上的按钮,如图3。
若两个结果能够拼接起来的,会得到一个Assemble1下的contig1的结果,如图4。
图45.双击contig1,打开拼接后的结果,选中菜单“VIEW”栏,进入VIEW OPTION,将SHOW ALIGNMENT AS 由TEXT 改为GRAPH.,点击OK 后得到结果如图5。
此时可能会因为两条序列的测序结果误差,会有不同的地方,在拼接图片框中的绿色竖杠就表示了这些不同的地方,如图所示。
接着可点击绿色竖杠找到有误差的地方,进行修改。
6.在修改过程中,遇到有误差的地方,可以根据峰形来判断是多读还是漏读来进行修改,此时电脑认为是漏读碱基的地方会以点来表示,如图5,此处很明显是A序列上多读了一个G碱基,可将其删除。
(注:因为软件本身的问题,只有在拼接过程中是正向的序列才能进行修改操作,若在反向上修改碱基,保存时会产生错误而直接关闭程序。
所以若要修改反向序列上的碱基,可先保存后,把原有的Assemble1的结果拆开,点序列图标上的“Name”,如图3,所选中的序列上的一个“name”横栏,使序列按Name的升降次序来排列,把要作为正向的序列放到要作为反向序列上面即可。
序列组装的过程

序列组装的过程
序列组装是将从高通量测序仪中得到的短序列片段(reads)通过计算方法拼接成原始DNA或RNA序列的过程。
以下是序列组装的一般过程:
1. 数据预处理:对从测序仪获得的短序列片段进行质量控制和去除低质量的reads,同时还需要去除适配体序列、重复序列和污染序列等。
2. 序列比对:将清洗后的reads与参考基因组或已知参考序列进行比对。
这可以通过多种算法和工具实现,如Burrows-Wheeler Transform (BWT) 算法、BLAST、Bowtie等。
比对的目的是找到reads在参考序列上的位置,从而为后续的组装提供依据。
3. 碎片组装:根据比对结果,将相互之间有重叠区域的reads拼接在一起形成碎片(contig)。
这个过程就是使用图论算法和启发式策略来将reads进行拼接,生成可能的序列碎片。
4. 空隙填补:在组装过程中,有些区域可能由于读长不够而无法拼接,或者有未知序列导致无法组装。
通过采用测序技术或者利用长读长的第三代测序技术进行填补,获得更完整的序列。
5. 错误校正:根据reads的拼接位置和质量信息来修复一些可能存在的错误。
这可以通过多种方法实现,如使用参考序列进行校正、利用更长的reads校正等。
6. 组装验证和评估:对组装结果进行验证和评估,检查组装序列的准确性和完整性。
通常会与参考基因组或已知序列进行比较,使用统计学方法评估组装质量。
以上是序列组装的一般过程,需要注意的是,在不同的组装策略和算法中,可能会有一些细微的差异和额外的步骤。
同时,对于大规模基因组的组装,可能需要结合其他分析手段和高级算法来提高组装质量和效率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
序列拼接
* 为了保证测序结果的准确性,单基因短片段(700pd左右)测序一般应采用双向测序,然后将双向测序的结果拼接在一起,从而获得一致性序列。
线粒体基因组测序和DNA长片段测序一般是通过分段测序来完成的,最后也需要将测出的短片段拼接成一条完整的序列。
序列拼接可以在不同的软件中进行。
一、使用“组装批处理文件byLHM.pg4”进行拼接
1. 在预定的位置建立一个文件夹“gap”,将需要使用的3个软件“组装批处理文件byLHM.pg4”、“V ector_primer4pMD18-T.vec_pri”、“pMD18-T_Vector.seq”拷贝到该文件夹下,再将需要拼接的测序文件拷贝到该文件夹下。
2. 双击运行“组装批处理文件byLHM.pg4”程序。
3. 在程序运行后出现的界面右侧点击“Add files”按钮,打开要拼接的序列文件。
为了保证
拼接后输出的是正向序列,最好先添加上游引物序列,然后添加下游引物序列,因为在一般情况下软件将添加的第一条序列默认为正向参照序列;有时由于测序效果等因素的影响,有时即使首先添加的是上游引物序列,但拼接后仍然会以测序效果明显更好的下游引物序列为正向参照序列,此时需要按照后面介绍的方法将上游引物序列转换为正向参照序列再输出一致性序列。
4. 点击界面上方第二行的“Configure Modules”,在弹出的窗口左边的任务栏中点击“[x]
Sequencing vector Clip”,再点击右边的“Browse”按钮,通过弹出的窗口打开“Vector_primer4pMD18-T.vec_pri”程序;点击左边任务栏中的“[] Cloning Vector Clip”,再点击右边的“Browse”按钮,通过弹出的窗口打开“pMD18-T_Vector.seq”程序;点击左下角的“Run”按钮,即开始数据处理,处理结果将自动保存到“gap”文件夹中。
5. 在“gap”文件夹中双击“AssMit_tmp.o.aux”文件,将鼠标移到弹出的“Contig Selector”
窗口中的直线上,点击右键,选择“Edit Contig”,即弹出“Contig Editor”窗口,点击最右边的“setting”按钮,在下拉菜单中选择“By background colour”,即可显示比对结果的有差异碱基;双击某一序列,即可显示该序列的测序峰图,以检查核对该位点碱基的测序情况。
* 注:执行此操作时一定要检查正向序列是否为上游引物序列;如果不是,则需要将上游引物序列转换成正向序列后再执行下面的“输出及保存序列”操作;具体的操作步骤是:点击“GAPv4.10 AssMit_tmp.o”窗口中的“Edit”菜单,在下拉菜单中选择“Complement
a contig”命令,在弹出来的“Complement contig”小窗口中检查确认“Contig identifier”
框中的序列为上游引物序列,然后点击“OK”即将完成序列转换。
6. 点击“GAPv4.10 AssMit_tmp.o”窗口中的“File”菜单,在下拉菜单中选择“Save
consensus”可保存一致序列,nomors------ok ,序列即保存在刚刚使用过的那个文件夹中,然后把文件名改成用“*.txt”形式,以便保存的文件成为文本文件,若忘记在文件名后加“.txt”,则保存完毕后可将文件的扩展名改成“.txt”;只有拼接好的一致序列才可用于后面的序列分析。
7.然后把在ncbi里查到的相近种的序列放到一起,也可以直接放到刚才那个cons.txt文本文
档中,然后打开clustalx.exe进行序列比对,file------load sequence ------G盘-----004文件夹-----cons.txt-----aligenment-----do complete aligenment,这时如果发现两条序列的保守区域很不对,极可能是刚刚测得这个种的序列反了,需要用Bioedit把它正过来,
8.在程序里打开已经安装好的Bioedit,例如找file---------open----G盘---004----cons.txt,打开,
选sequence--------下拉菜单中找Nuclic acid,在菜单中找reverse complement,点击它
然后在另一对话框中例如G:/004/CONS.TXT中点击保存save Aligenment. 这样序列即
被正转过来并且保存在刚才建的cons.txt记事本中,即可用于下面的各种分析。
