各种动物骨髓单个核细胞分离液试剂盒
实验项目一猪骨髓间充质干细胞的分离和培养

猪骨髓间充质干细胞的培养与分离实验准备:器材:手术刀片,手术刀柄,剪刀,镊子,弯钳,5ml灭菌注射器,7号注射针头,10ml离心管,离心机,100mm培养皿,75ml培养瓶试剂:低糖DMEM(含有10%FBS,75μg/ml青霉素,50μg/ml硫酸链霉素)1000iu/ml青链霉素的PBS(生理盐水)(装入灭菌的洗瓶中)无血清低糖DMEM.2%台盼蓝染液材料采集:一,胎猪骨髓采集:【1】 1,无菌条件下从猪子宫内取出胎儿置入到保温瓶中,加入含有青链霉素的PBS或生理盐水中,立即送回实验室。
2,在无菌操作下取下左右股骨,除净肌肉、骨膜及股骨两端软骨组织;用PBS冲洗3-4次用灭菌生理盐水冲洗干净,在超净工作台内剥离肌肉和骨膜,得到完整的股骨。
立即用含有1.0ml DMEM+3000iu/ml肝素的注射器冲骨髓腔,迅速换上5号的针头将冲出的骨髓血轻轻吹打,再加入等量培养液(DMEM+10%FBS)稀释,然后以1:4比例缓慢加入到Percoll分离液(1.073g/ml)的表面,1000r/min 30min,小心吸取乳白色的有核细胞层。
目前用于分离MSCs的方法主要有密度梯度离心法,流式细胞仪分离法和贴壁筛选法。
密度梯度离心法目前主要包括利用percoll分离液分离MSCs和利用淋巴细胞分离液分离MSCs两种。
Percoll密度梯度离心法根据细胞密度不同将细胞分为数层,因此得到的MSCs纯度较高,但是操作繁琐,而淋巴细胞密度梯度离心法虽得到的MSCs不及percoll密度梯度离心法得到的细胞纯度高,但是操作简单,且获得的MSCs增殖活性较强。
【13】来自:胎猪骨髓间充质干细胞核移植及核移植胚胎干细胞的分离取2-3月龄猪胎儿,在无菌操作下取下左右股骨,用含1000iu/ml青链霉素的PBS浸泡30min,除净肌肉、骨膜及股骨两端软骨组织;用PBS冲洗3-4遍;用吸有4ml а-MEM细胞培养液的一次性无菌5ml注射器刺入处理好的股骨的一端,冲出骨髓,然后用7号针头轻轻吹吸数次,使冲出的骨髓尽可能分散为单个细胞,100目滤沙过滤;1000rpm/min,离心5min,用а-MEM细胞培养液制成细胞悬液,计数后,调整有核细胞的密度为1-2x107/ml.,然后接种培养。
EasyPure Genomic DNA Kit 01

EasyPureTM Genomic DNA Kit
Material Mammalian Cell Mammalian Tissues Mouse Tail E.coli Cells Yeast Cells
Amount 1-5×106 cell
≤25 mg
0.5 cm sections ≤2×109 cell ≤5×107 cell
试剂盒内容
Components Lysis Buffer 2 (LB2) Binding Buffer 2 (BB2) Clean Buffer 2 (CB2) Wash Buffer 2 (WB2) Elution Buffer (EB) RNase A (20 mg/ml) Proteinase K (20 mg/ml) 10% SDS Spin Column with Collection Tubes
EE101-01 (50 rxns) 10 ml 12 ml 55 ml 12 ml 25 ml 1 ml 1 ml 2 mns) 40 ml 45 ml 2×110 ml
2×22 ml 90 ml 4 ml 4 ml 8 ml 200个
特点
● 提取速度快,提取量高。 ● 最少的RNA污染。 ● 基因组DNA大小20-50 kb。 ● 高质量的DNA、下游酶切、PCR、Southern 杂交等实验可靠稳定。 操作步骤
使用前加不同体积100%乙醇到WB2。
50 rxns (48 ml)
200 rxns (2×88 ml) 所有离心均在室温下进行。
Ficoll实验最佳条件确定
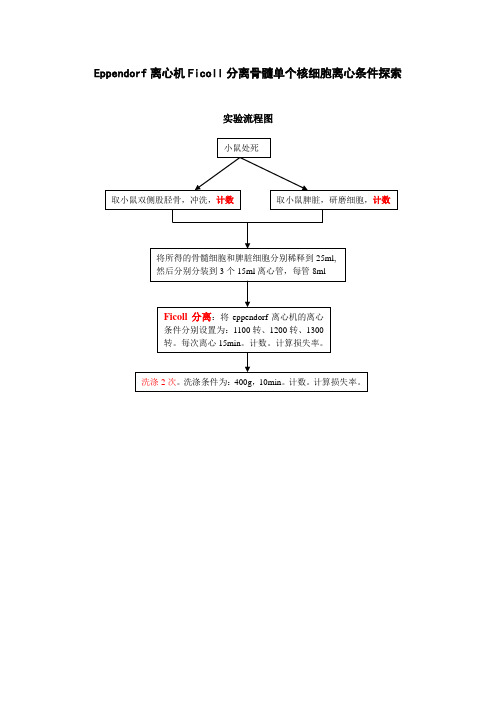
Eppendorf离心机Ficoll分离骨髓单个核细胞离心条件探索实验流程图实验目的:本实验拟建立使用eppendorf离心机进行小鼠单个核细胞Ficoll分离时的最佳离心条件。
实验材料与方法:1、实验材料:C57小鼠(购自???)2、实验试剂:Hank’s液:自配类标准胎牛血清:民海生物公司,批号:200610093、实验仪器超净台:北京东联哈尔滨仪器制造有限公司;苏州净化设备有限公司,SW-CJ-1FD型;倒置显微镜:美国Beckman Coulter Altra;离心机:eppendorf AG 22331 Hamburg玻璃滴管手术器械移液枪 Tip头参与人员Xxx Xxx Xxx观察指标1、不同离心条件下Ficoll分离单个核细胞的产率;2、确定eppendorf离心机做Ficoll分离时的最佳离心条件。
实验步骤1、收集骨髓细胞使用70%的乙醇清洁工作区及仪器颈部脱臼处死小鼠用70%乙醇浸湿小鼠,用来灭菌和降低污染可能。
无菌分离股胫骨、脾脏,并将它们放入冰上含有2%胎牛血清的HBSS培养基(HF)中。
将骨髓细胞和脾脏细胞分别稀释到25ml。
第一次细胞计数:得到细胞浓度,并根据细胞浓度和细胞体积计算细胞的总数。
2、细胞分装将骨髓细胞和脾脏细胞分别分装到6个15ml离心管中,每管8ml。
3、Ficoll密度梯度离心将细胞悬液室温下加在5mlFicoll溶液上方每次取1管骨髓细胞和1管脾脏细胞,室温无级离心。
条件分别设置为:1100转、1200转、1300转。
每次15min。
每次离心升降均为无档。
将分离到的单核细胞(中间层)与上层Ficoll(试管中剩余2.5mlFicoll)转入15ml离心管中第二次细胞计数:得到细胞浓度,并根据细胞浓度和细胞体积计算细胞的总数。
然后与第一次细胞计数相比较,计算细胞损失率(细胞回收率)。
4、洗涤以下步骤均处冰上用10mlHBSS培养基(HF)洗涤细胞,并在4度400g离心5min(1800rpm,20min),用10mlHF重复洗涤一次(1600rpm,15min) 注意这两次离心降速均为无档降速用1mlHF将细胞悬起第三次细胞计数:然后与第一次、第二次细胞计数相比较,计算细胞损失率(细胞回收率),以及细胞总的损失率(细胞总的回收率)。
间充质干细胞和单个核细胞异种移植治疗小鼠肝损伤的研究

首 次换液 , 以后 每隔 2— 3d换液 1 , 次 去除悬浮生长的 细胞 。待贴壁细胞 生长 占瓶底 面积 的 8 % ~ 0 0 9 %时 ,
用 0 2 %胰酶/ .2 D A( : ) .5 0 0 %E T 1 1 消化 并 以 1 2比例 :
传代 。取生长 良好 、 形态 上呈 较为 均一梭 形 的第 3代 培养细胞 , 消化 后配 成 1×1 - L 的单 细胞 悬 液 , 0 m 加入 FT IC标记 的 C 4 D 4抗 体 、 D 0抗 体和 P C9 E标记 的 C4 D 5抗 体 染 色 , 流 式 细 胞 仪 检 测 , 取 表 型 为 以 选
MS sC 4 、 D 0均表达 阳性 , C 4 C D 4 C 9 而 D 5表 达阴性 ; 2个细胞移植组在 T ~ 时点 A T和 A T浓度差异 有统计 l L S
学意义 ( 0 0 ) 与肝损伤 对照组比较 , C 移植 组 A_ 和 A T浓度在 T 一B 时点均 降低 ;MS s P< . 1 ; MS s I T I S 1 C 移植 组肝 损
目前 , 治疗肝 损伤引起 的肝纤 维化及 各种终 末期
肝 病主要 方法有肝 脏移植 、 肝细胞 移植 和干细胞 移植
MN s细胞 悬液 按 4 m
等, 但都 面临供体来源 困难 和免疫排 斥等 问题 。为此 , 人们一直努力 寻求一种 理想 的生物人 工肝或新 型种子 细胞。研究显示 , 具有 多 向分 化潜 能 的问充 质干 细胞 ( C) MS s 有体外 易获得 、 源可靠 、 疫原 性很 弱且 异 来 免 体移植不 易发生免疫排斥 等优 点 J异体 M C 有望 , Ss 成 为一种新 型的种 子细胞 , 为治疗 各种终末 期肝病 提 供新策 略。 自20 0 9年 1 至 2 1 月 0 0年 2月 , 研究拟 比 本 较大 鼠骨髓 MS s C 和单 个核 细胞 ( C ) 四氯化 碳 MN s 在 ( C 诱 导性小 鼠肝损 伤治疗 中的作用 。 CI )
小鼠外周血单个核细胞分离、纯化

小鼠外周血单个核细胞分离、纯化徐太哲;李丽;王长山【摘要】目的:探讨小鼠外周血单个核细胞(PBMC)最佳分离条件,提高细胞获得率与纯度,以便后续分子生物学实验.方法:小鼠摘除眼球取血,设置离心力、离心时间、实验环境温度等梯度优化,分别采用EDTA-K2、肝素、枸橼酸钠抗凝,Ficoll密度梯度离心法分离单个核细胞,直接进行贴壁培养和分析获得率、纯度,计数存活率.结果:Ficoll密度梯度离心法经条件优化后分离的PBMC纯度可达85%,细胞获得率最高可达80%以上,活细胞百分率在92%以上.结论:Ficoll密度梯度离心法在优化条件下可有效地分离PBMC,对后续分子生物学实验无影响.【期刊名称】《黑龙江医药科学》【年(卷),期】2016(039)004【总页数】3页(P10-11,13)【关键词】小鼠;Ficoll密度梯度离心;PBMC【作者】徐太哲;李丽;王长山【作者单位】佳木斯市红十字医院,黑龙江佳木斯154003;佳木斯大学,黑龙江佳木斯154007;佳木斯大学,黑龙江佳木斯154007【正文语种】中文【中图分类】R446.11+3外周血单个核细胞(Peripheral blood mononuclear cells,PBMCs)包括淋巴细胞和单核细胞。
是免疫系统的重要组成,是研究免疫老化和衰老的主要依据。
研究T、B淋巴细胞首要分离外周血单个核细胞,主要的分离方法是Ficoll-hypaque密度梯度离心法,因血液中各组成成分的沉降系数存在差异,而得以分离[1]。
离心后,单个核细胞因与分离液密度相当,集中在血浆层和分层液的界面上,呈白雾层,吸取该层细胞经洗涤离心即获得PBMC。
PBMC分离是分子生物学试验常用的技术,其效果直接影响PCR等后续试验结果。
实验对象小鼠因体重小,体内血液量少,Ficoll密度梯度离心法正适用这样少量血液的分离,本文探讨小鼠外周血单个核细胞的分离最佳条件。
1.1 材料与分组BALB/c小鼠18只,5~6月龄,体重23~25g,雌雄不限;小鼠外周血单核细胞分离液试剂(天津市灏洋生物制品科技有限责任公司)。
多发性骨髓瘤骨髓单个核细胞分泌VEGF的临床研究

3 9例 MM患者 , 中男 2 , 1 , 其 9例 女 0例 年龄 5 ~ 7岁 , 07 平均 (3±8 岁 , Ⅱ、 6 ) I、 Ⅲ期 患者分别 为 1 、 、3例 , 062 诊断 、 分期
及疗效判断均按文献【 标准 。收集本 院创 伤骨科 、 l 】 心外科 手
术切除的 1 2例非恶性肿瘤及非血液病患者髂骨及肋骨标本
( 070 .6收稿 20 .71 20 .10 0 71.5修 回) 孙东建 ) ( 文编辑 本
clnz gsan rt m f t 【. ul e it,04,6 ooin t isi pee i a s J T r P dar20 4 i r n r nn 】 【J
( )2 5E F水平差别 有统计学意义 ( F=42 , . P<0 5 , 9 . )部 0 分缓解 组低于进 步组及无 效组 , 差异有统 计学 意义 ( q分别 为 39 . 0和 3 9 P<0 )进步组又低 于无效 组 , . , 9 . , 5 0 差异亦有统 计学意义( 口=41 , .3P<0 5 。 . ) 0 表 2 MM 患者骨髓单个核细胞 V GF分 E 泌■治 疗前 后变化 ( g , ±s n/ 面 ) L
公司 。
2 初诊 MM患者骨髓单个 核细胞 V G . 2 E F水平 与疗 效的关
系 见表 2 。无 论是无 效 、 步还是部 分缓解 患者 , 进 治疗 后 V G E F水平均低于治疗前 ( <00 ) 均 .1 。不同疗效的 MM患者
1 . 骨髓单个核 细胞 ( MMN 分离和培 养 .2 2 B c)
21 初诊 MM 患者骨髓 单个 核细胞 V G . E F分 泌水平 MM 患者骨髓单个核细胞 V G E F的分泌水平为 (3 . 5 8 6±181 ) 4 1. 7 19 9 9年 1 月一2 o o 6年 1 2月于我 院初诊 的 n/ , 照组为 (6 .8±2 .3 n/ , 者显著 高于后者 ( = gL 对 1 0 4 96 )gL 前 £ 354 P<0 1 。各期患者 V G . , 0 . ) 0 E F分泌水平差异有统计学意 义 , E F分泌水平随着疾病进展而升 高 , V G 见表 1 。 表1 MM 患者 骨髓 单个核细胞 V F EG 分泌 ■与疾病分期关 系 11 一般 资料 .
骨髓单个核细胞分离液试剂盒使用说明

骨髓单个核细胞分离液试剂盒使用说明规格:4×200mL/kit保存:18-25℃保存,有效期2年。
骨髓单个核细胞分离液试剂盒易感染细菌,需无菌条件下操作。
无菌条件下操作,启封后置于常温保存。
如4℃保存,本分离液易出现白色结晶,影响分离效果。
试剂盒内容:动物骨髓单个核细胞分离液200mL样本稀释液200mL清洗液200mLF液200mL一、各种动物骨髓细胞的采集方法1.大鼠、小鼠骨髓的采集:用颈椎脱臼法处死动物,剥离出胸骨或股骨,用注射器吸取少量的F液,冲洗出胸骨或股骨中全部骨髓液,以500g(约1800转/分)离心20分钟,弃上清。
沉淀以F液重复洗涤一次后用全血及组织稀释液悬起(细胞浓度为2×108-1×109个/mL),备用。
2.大动物骨髓的采集:A.骨髓穿刺点定位(1)胸骨:穿刺部位在胸骨中线,胸骨体与胸骨柄连接处,或选胸骨上1/3部。
(2)胫骨:穿刺部位在胫骨内侧,胫骨上端的下方1厘米处。
(3)肋骨:穿刺部位在第5~7肋骨各自的中点上。
(4)髁骨:穿刺部位在髁前上棘后2~3厘米的髁嵴。
(5)股骨:穿刺部位在股骨内侧面,靠下端的凹面处。
B.骨髓穿刺方法(1)实验动物按要求固定,穿刺部位去毛、消毒、麻醉,要求局部麻醉范围直达骨膜,也可作全麻。
(2)操作人员带消毒手套,确定穿刺点,估计从皮肤到骨髓的距离并依此固定骨髓穿刺针长度。
左手拇、食指绷紧穿刺点周围皮肤,右手持穿刺针在穿刺点垂直进针,小弧度左右旋转钻入,当有落空感时表示针尖已进入骨髓腔。
用左手固定穿刺针,右手抽出针芯,连接注射器缓慢抽吸骨髓组织,当注射器内抽到少许骨髓时立即停止抽吸,收集骨髓细胞加入4-5mL F液混匀,以500g(约1800转/分)离心20分钟,弃上清,沉淀以F液重复洗涤两次后用全血及组织稀释液悬起(细胞浓度为2×108-1×109个/mL),备用。
(3)左手压住穿刺点周围皮肤,迅速拔出穿刺针,用棉球压迫数分钟。
单抗制备实验报告

一、实验背景单克隆抗体(Monoclonal Antibody,简称mAb)是一种具有高度特异性和亲和力的抗体,由单个B细胞克隆产生。
单抗在生物医学研究、疾病诊断、治疗药物研发等领域具有广泛的应用。
本实验旨在通过细胞融合技术制备小鼠单克隆抗体,并对其特异性、亲和力和效价进行鉴定。
二、实验材料1. 实验动物:雌性小鼠,体重18-22g。
2. 试剂与耗材:淋巴细胞分离液、Ficoll、RPMI-1640培养基、胎牛血清、链霉素、青霉素、聚乙二醇(PEG)、小鼠抗小鼠IgG-FITC、兔抗小鼠IgG-HRP、ELISA 试剂盒、抗体稀释液、抗体亲和层析柱等。
3. 仪器:超净工作台、显微镜、酶标仪、离心机、冰箱、培养箱等。
三、实验方法1. 动物免疫(1)选择雌性小鼠,将其随机分为两组,每组10只。
(2)对实验组小鼠进行免疫,每次免疫剂量为1mg抗原,间隔2周进行第2次免疫。
(3)对照组小鼠仅给予生理盐水注射。
2. 细胞分离与培养(1)免疫后第3周,处死实验组小鼠,无菌操作取出脾脏。
(2)将脾脏剪碎,加入Ficoll分层液,进行细胞分离。
(3)收集单个核细胞,用RPMI-1640培养基洗涤2次,计数。
(4)将脾细胞与小鼠骨髓瘤细胞进行混合,加入PEG进行细胞融合。
(5)将融合后的细胞进行培养,选择杂交瘤细胞。
3. 单抗制备(1)将杂交瘤细胞进行扩大培养,收集培养上清。
(2)用ELISA试剂盒检测培养上清中的抗体效价,筛选出高亲和力抗体。
(3)将高亲和力抗体进行亲和层析纯化。
4. 单抗鉴定(1)用小鼠抗小鼠IgG-FITC和兔抗小鼠IgG-HRP进行Western blot检测,鉴定单抗的特异性。
(2)用ELISA试剂盒检测单抗的效价。
(3)用抗体亲和层析柱对单抗进行亲和力测定。
四、实验结果1. 动物免疫实验组小鼠在免疫过程中未出现明显异常,免疫成功。
2. 细胞分离与培养成功分离出脾细胞和骨髓瘤细胞,细胞融合率为90%。
骨髓间充质干细胞培养

废液缸 PBS 或 N.S.冲洗 N.S.冲洗 5ml PBS 5%trypsin+EDTA 0.125~0.25ml 血清200 血清200 ul 混合液
25 cm2
显微镜观察3~5 显微镜观察3~5 min 废液缸 PBS 或 N.S.
废液缸Biblioteka 工作液离心机 1200rpm× 1200rpm×10min
离心机 1200rpm× 1200rpm×10min 6ml (25 cm2) 12~18ml (75 cm2)
废液缸
废液缸
工作液
离心机 1200rpm× 1200rpm×10min 培养瓶
去除悬浮液
废液缸
PBS 或 N.S.冲洗 N.S.冲洗
工作液
换液
废液缸(半量) 废液缸(半量)
工作液
消化传代
人骨髓源间充质干细胞 分离培养技术
24~48h
取骨髓
72h
分离单个核细胞
80%
去除悬浮液 存
换
液
消化传代
冻
分离单个核细胞
淋巴细胞分层液 骨髓样本(缓慢) 骨髓样本(缓慢) (经PBS稀释3~4倍) 经PBS稀释3~4倍) 单个核细胞 PBS
离心机 离心管 1400rpm× 1400rpm×30min (慢) (慢 PBS 或 N.S. 或 D-HANKS
废液缸
离心机 1200rpm× 1200rpm×10min
离心机 1200rpm× 1200rpm×10min
离心机 1200rpm× 1200rpm×10min
废液缸
1ml 冻存液
冻存管
注意:
• 多份样本应提前标注; • 放入CO2孵箱前应松瓶口,并注意孵箱内水 放入CO
动物源性基因组DNA提取试剂盒说明书
动物源性基因组DNA提取试剂盒说明书试剂盒简介本试剂盒可用于多种动物源性基因组DNA的提取,将处理好的样品通过裂解后加入到纯化柱内高速离心,核酸可以特异性结合在吸附柱内,通过洗涤液处理可最大限度去除杂质蛋白及细胞中其他有机化合物,获取高纯度、质量稳定的DNA。
试剂盒用途本试剂盒适用于饲料、多种动物细胞和动物组织等样品的动物源性基因组DNA提取与纯化。
试剂盒组成(50T/Kit)注:请自备无水乙醇(分析纯)储存条件及有效期蛋白酶K于-20 ℃保存,其余组分均室温保存。
有效期一年。
注意事项1.当缓冲液DA、DB及洗液1于低温保存时,可能会有沉淀析出,将试剂瓶于室温下放置一段时间,使析出物充分溶解并混匀即可。
2.缓冲液DA、DB及洗液1中含有胍盐,与次氯酸钠、漂白液(粉)以及酸性液体混合会产生毒性气体,切记不能将两类液体倒在一起。
3.如样本脂类含量过高,影响操作,可在操作步骤1结束后用等体积氯仿抽提一次,避免脂类对后面操作的影响。
4.所有离心步骤室温下进行即可。
5.为了避免外源DNA酶或细菌降解DNA提取物,操作时请戴口罩和手套。
准备工作13 ml洗液1浓缩液加入17 ml无水乙醇;7ml洗液2浓缩液加入23 ml无水乙醇。
操作步骤1. 样品处理1.1 饲料:将饲料充分研磨粉碎后,称取50 mg样本加入到1.5 ml洁净的离心管中,加入300μl缓冲液DA、20 μl蛋白酶K溶液。
振荡混匀后56 ℃水浴1 h,每隔10~15 min取出颠倒混匀一次。
1.2 动物细胞或组织:剪取不超过50 mg样本加入到1.5 ml洁净的离心管中,用研磨棒充分研磨,加入300 μl缓冲液DA、20 μl蛋白酶K溶液。
振荡混匀后56 ℃水浴1 h,每隔10~15 min取出颠倒混匀。
2. 向处理好的样品加入400 μl的缓冲液DB,振荡混匀后70 ℃水浴10 min后,12 000 rpm离心3 min。
取400 μl上清液到新的1.5 ml洁净的离心管中。
北京汇智和源生物技术有限公司细胞与细胞分选产品手册说明书

地址:北京市北京经济技术开发区科创十四街汇龙森18号楼1单元301邮箱:*********************网址:https:// 电话:+86 400-127-6686北京汇智和源生物技术有限公司细胞与细胞分选产品手册FUTURE OF INNOVATIVE REAGENT R&D创新试剂 研发未来公司最早立足于ADMEs 系列产品的开发,助力于药物早期筛选。
经10余年自主研发和产品支持等方面成功经验的积累,公司加大了对药代动力学、药理学、微生物学、免疫学、遗传学和临床医学等领域创新性产品的研发力度,逐步丰富了产品组合。
市售产品经过内部标准或国际标准(例如 OECD 和 ICH)的质量验证,获得了系列资质/专利证书和行业内的广泛认可。
公司核心竞争力是基于我们在化学分析、生物分析、细胞遗传学、基因工程、蛋白质和抗体开发以及免疫分析等领域积累的创新技术能力和经验,我们的使命是为生命科学、医药创新提供产业引领试剂!北京汇智和源生物技术有限公司奉行“创新试剂,研发未来”的发展理念,恪守“诚实、严谨、务实、创新”的企业宗旨,以市场为导向,力求为国内外企业和科研机构提供代表先进技术水平的高品质产品,实现IPHASE 的品牌承诺。
企业理念创新试剂研发未来一家聚焦于生物医药以及生命科学研究领域的高新技术企业完善的知识储备 不懈的科学探索10余年自主研发和产品支持等方面成功经验的积累ABOUT US关于我们北京汇智和源生物技术有限公司是一家聚焦于生物医药以及生命科学研究领域的高新技术企业。
我们的科学团队致力于通过完善的知识储备、不懈的科学探索,竭诚为科学工作者提供高品质的创新生物试剂产品和相关技术服务。
目录前言 (1)原代细胞 (2)免疫细胞亚群 (3)单个核细胞 (4)外周血单个核细胞 (4)脾脏单个核细胞 (5)骨髓单个核细胞 (6)脐带血单个核细胞 (6)动员外周血单个核细胞 (7)红细胞 (7)血小板 (8)原代肝细胞 (9)经代谢验证原代肝细胞 (9)经诱导验证原代肝细胞 (10)经转运体验证原代肝细胞 (10)3D培养原代肝细胞 (11)细胞分离产品 (12)单个核细胞分离试剂盒 (13)红细胞分离试剂盒 (13)血小板分离试剂盒 (13)细胞分选产品 (14)分选试剂盒 (14)抗体 (15)生物素化抗体 (15)流式抗体 (16)磁珠 (17)细胞培养产品 (18)T淋巴细胞活化/增殖 (18)NK细胞培养 (19)原代肝细胞培养 (21)发展历程 (22)重点客户 (23)免疫细胞(Immune cell),由多种不同类型的细胞组成,如单核细胞、巨噬细胞、树突状细胞、自然杀伤细胞等。
小鼠骨髓中性粒细胞分离

小鼠骨髓中性粒细胞的分离实验器材:器械(眼科小直剪2把,小弯镊3把),无菌塑料滴管,15ml离心管,4mlEP 管,培养皿,1ml注射器,70um尼龙筛网,低温离心机试剂:PBS(1×,10×),HBSS,percoll,percoll储存液(percoll:10×PBS=9:1),percoll 溶液(45%,81%,62%,55%,50%,分别用1×PBS稀释Percoll储存液到相应浓度)Histopaque1119,小鼠中性粒细胞缓冲液(MNB,既含0.1%牛血清白蛋白,1%葡萄糖的HBSS 溶液)材料:8-12周C57小鼠实验步骤:1.拉颈处死小鼠,分离其胫骨和股骨,用纱布将胫骨和股骨擦干净,置于75%酒精中浸泡5min2.用小直剪剪掉骨髓两端,暴露骨髓腔,用MNB冲洗,每次1ml,胫骨冲洗两次,股骨冲洗3次。
3.冲洗液用70um尼龙筛网过滤,离心收集细胞,600g 4℃10min,低减速。
4.弃上清,用3ml45%percoll溶液重悬细胞5.Percoll梯度准备:3ml81%,2ml62%,2ml55%,2ml50%percoll溶液6.小心的将细胞悬液置于percoll梯度上,1600g,30min,10℃,无制动离心。
7.弃掉62%percoll层以上的溶液,收集62%-81%之间的percoll层。
8.10mlMNB洗两次,600g,10℃,10min,离心。
弃上清,用3mlMNB重悬细胞。
9.将细胞悬液小心得置于3mlHistopaque1119上,1600g,10℃,30min,无制动离心,去除红细胞层。
10.收集1119和MNB之间的细胞层,10mlMNB 洗两次,600g, 4℃10min,低减速离心11.按需要将细胞用培养基重悬到一定的浓度。
分离小鼠骨髓中的免疫细胞的方法

分离小鼠骨髓中的免疫细胞的方法小鼠骨髓免疫细胞分离骨髓是造血的场所,含有各种类型的免疫细胞,包括粒细胞、单核细胞、淋巴细胞和髓系干细胞。
分离这些细胞对于研究免疫系统、干细胞生物学和疾病机制至关重要。
以下是分离小鼠骨髓中免疫细胞的详细方法:材料:小鼠PBS(pH 7.2-7.4)细胞培养液(例如 RPMI 1640)琼脂糖琼脂(0.5% w/v)40 µm细胞过滤器50 mL离心管移液器台式离心机步骤:1. 屠宰小鼠:使用二氧化碳或异氟烷麻醉小鼠,然后通过颈椎脱臼法将其屠宰。
2. 取出股骨:将小鼠固定在工作台上,用无菌镊子和剪刀小心取出股骨。
3. 暴露骨髓:使用无菌剪刀剪开股骨两端,用 PBS 冲洗髓腔,将骨髓液冲入一个 50 mL 离心管中。
4. 过滤细胞:用 40 µm 细胞过滤器将骨髓液过滤到另一个50 mL 离心管中。
5. 离心细胞:以300 × g 的速度离心 10 分钟,除去沉淀的骨骼碎片和未裂解的细胞。
6. 收集沉淀:小心地吸出上清液,并收集沉淀的细胞。
7. 再悬浮细胞:用细胞培养液将细胞重悬浮,调整细胞密度至1-2 × 10^6 个细胞/mL。
免疫细胞的分离:分离免疫细胞需要专用的抗体和磁珠。
不同的抗体靶向不同的细胞表面标志物,使特定细胞类型与磁珠结合。
磁珠与细胞的结合强度取决于抗体的亲和力和细胞表面标志物的表达水平。
1. 抗体标记:向细胞悬液中加入抗体,孵育 30 分钟,4°C。
2. 磁珠孵育:加入与抗体匹配的磁珠,孵育 15 分钟,4°C。
3. 磁分离:将细胞悬液转移到磁分离柱上,放置在磁架上。
靶细胞将被磁珠吸附在柱上,而未标记的细胞将流出。
4. 洗涤:用 PBS 洗涤磁柱多次,除去未结合的细胞和抗体。
5. 洗脱:使用洗脱缓冲液将靶细胞从磁珠上洗脱,收集洗脱液中的细胞。
细胞分析:分离的免疫细胞可以使用流式细胞术进行分析。
荧光定量试剂盒

北京经济技术开发区宏达北路10号万源商务中心5001室 邮编:100176 北京经济技术开发区宏达北路10号万源商务中心5001室 邮编:100176电话:4006501950 传真:************-816电话:4006501950 传真:************-816AML1-ETO 荧光定量试剂盒使用说明书【产品名称】中文名:AML1-ETO 荧光定量试剂盒英文名:Leukemia related AML1-ETO fusion gene Fluorescent Quantitative PCR DetectionKit (FQ-PCR)【包装规格】 20人份/盒【用 途】本试剂盒适用于白血病AML1-ETO 融合基因定量检测,仅供科研使用,辅助临床诊断及治疗。
【储存条件】储存温度:-20℃。
避光保存。
【有 效 期】有效期:见试剂盒标签。
【原 理】本试剂盒使用荧光标记探针杂交方法,采用核酸扩增技术,对白血病BCR-ABL-190融合基因进行RNA 定量检测。
【试剂盒组分】1.2.未提供组分:淋巴细胞分离液、RPMI1640、生理盐水、离心管、PCR 反应管等耗材试剂。
3.本试剂盒中的参比品、阳性对照品和临界对照品均为克隆质粒DNA 。
4.不同批号试剂盒中的各组分不要交叉使用,以影响结果。
【适用仪器】ABI PRISM 系列Real Time PCR 仪; BIO-RAD iCycler Real Time PCR 仪; ROCHE LightCycler Real Time PCR 仪。
【样本要求】1. 本试剂盒适用于骨髓标本检测。
2. 骨髓2~3ml ,建议采用枸橼酸钠或EDTA 抗凝,不能使用肝素抗凝。
3. 建议采用进口无菌离心管及移液吸头,使用无RNase 的耗材和试剂。
北京经济技术开发区宏达北路10号万源商务中心5001室 邮编:100176 北京经济技术开发区宏达北路10号万源商务中心5001室 邮编:100176电话:4006501950 传真:************-816电话:4006501950 传真:************-816【检验方法】1.骨髓单个核细胞分离注意事项:a. 淋巴细胞分离液应置于4℃保存,使用前应从冰箱拿出待恢复至室温后使用。
分离小鼠骨髓中的免疫细胞的方法

分离小鼠骨髓中的免疫细胞的方法骨髓是一种重要的免疫器官,它主要负责成熟和存储多种不同类型的免疫细胞,如粒细胞、淋巴细胞和单核细胞等。
因此,分离小鼠骨髓中的免疫细胞对于研究免疫系统的功能和生理学意义具有重要意义。
本文将介绍一种常用的分离小鼠骨髓中免疫细胞的方法。
一、实验材料准备1.小鼠骨髓2.磷酸盐缓冲盐水(PBS)3.甘露糖4. L-精氨酸血红蛋白(LymphoprepTM)离心管二、小鼠骨髓分离1.从小鼠胫骨和股骨中分离骨髓。
用PBS冲洗骨髓,使之保持湿润。
2.将骨髓加入含有10%甘露糖的PBS中,制成单细胞悬浮液。
3.将单细胞悬浮液缓慢地加入L-精氨酸血红蛋白离心管中。
4.用Lymphoprep离心管离心,离心条件为800 g,20分钟,室温。
三、免疫细胞的分离1.离心完成后,可以看到在离心管中分层形成了三明显的界面。
上层是血浆,中层是淋巴细胞、单核细胞和粒细胞,下层是红细胞。
2.使用移液管沿着离心管壁缓慢吸取中层的淋巴细胞、单核细胞和粒细胞,并将其转移至新的离心管中。
3.加入PBS冲洗淋巴细胞、单核细胞和粒细胞,使之保持湿润。
4.用PBS洗涤细胞三次,以去除离心试剂和其他污染物。
5.将细胞转移到培养皿中,并采用适当的培养基进行培养和分离。
四、实验注意事项1.在进行分离实验时,应尽量避免产生气泡,以免对细胞的分离和纯度产生影响。
2.离心时,离心管应该尽量垂直摆放,避免出现倾斜,以免影响细胞的分层。
3.分层完成后,移液管在取出上层血浆时,应尽量避开中层的细胞,以免受到污染。
五、实验结果通过上述方法分离得到的小鼠骨髓中的免疫细胞,其纯度高,可以用于继续进行免疫学、细胞生物学方面的实验研究。
六、结论分离小鼠骨髓中的免疫细胞是一个重要的实验技术,可以为后续的免疫学研究提供重要的细胞材料。
在实际操作中,需要严格控制每一个步骤,以确保分离得到的免疫细胞的纯度和活力。
同时,也需要注意安全操作,避免对实验材料和人员产生伤害。
EBER检测试剂盒(原位杂交)

E B E R 检尝试剂盒(本位纯接)之阳早格格创做(支配之前请仔细阅读此证明书籍)检测本理战意思EBER 是EB 病毒编码的小RNA ,是EB 病毒的表黑产品,正在EB 病毒熏染的细胞核中以下拷贝数存留.根据EBER 的特有序列安排的EBER 单链 DNA 探针能特同天与EBER 靶序列互补、纯接,进而检测EB 病毒是可存留.此要领检测石蜡构造切片中的EB 病毒具备极下的特同性战敏捷性.暂时EBER 本位纯接已成为构造战细胞中EB 病毒的尺度检测要领,正在国际上广为使用.试剂盒提供的资料战试剂(注意:EBER 纯接液请-20℃保存)成 份保存要领 提供量20人份 50人份1 EBER 纯接液 -20℃ 400ul2 蛋黑酶K 4℃ 40ul 100ul3 一抗 4℃ 1ml l4 两抗4℃ 1ml l 5 HRP 散合物 4℃ 1ml l 6 DAB 底物 4℃ 1ml l 7 DAB4℃ 20ul 50ul 8 18X18mm 盖玻片 4℃/室温 20片 50片 9干盒删效液4℃/室温30ml30ml♦用户自备资料战试剂1. 55℃恒温培植箱 8. 两甲苯2. 37℃恒温培植箱 9. 酒粗3. 光教隐微镜 10. PBS(pH=7.6)4. 移液器 11. 苏木素5. 计时器12. 氨火 6. 玻片染色缸战染色架 13. 盐酸酒粗 7.干盒2个♦ 真验前需配试剂 30%干盒删效液与干盒删效液及蒸馏火,按3:7配造成30%干盒删效液备用. ♦ 真验时需配试剂 A 、1X 蛋黑酶K将蛋黑酶K 与1×PBS 按1:25的比率配造备用.(现配现用)B 、DAB 隐色液依据需要配造DAB 隐色液,以可覆盖所有构造的量为宜.与DAB 与DAB 底物,依照1:50的比率混匀,躲光保存备用.(现配现用) ♦支配步调1.切片处理:将4um 薄度的构造粘附正在APES 处理的载玻片上,切片于60-70℃烘烤60分钟以上.(修议屡屡真验共时附加阳性、阳性对于照片) 2.脱蜡及火化:(注意:使用过的两甲苯,应相映延少脱蜡时间,以包管脱蜡真足)黑酶K 消3.蛋化:甩搞切片, 将构造周围液体用滤纸吸搞, 每弛切片滴加适量1×蛋黑酶K 处事液(约50 ul ,根据构造大小删、减量), 室温孵育5分钟.蒸馏火洗涤1×1分钟,留神揩搞构造周围液体. 4.纯接:4.1 每弛切片滴加适量纯接液(约20 ul ,根据构造大小删、减量),并加盖玻片(本试剂盒配备,可根据加进纯接液量举止剪裁);4.2 搁置火干盒中,55℃恒温箱孵育60-90分钟;4.3 转至37℃孵育4-16 小时(搁置于30%干盒删效液干盒中).修议过夜(<16小时)以包管矮拷贝样本的纯接效验;4.4 48℃(PBS 预温)浸泡切片,留神移去盖玻片,继承浸泡5分钟; 4.5 48℃PBS 洗涤3x 5分钟 (沉微振荡容器);(注意:盖玻片规格应与纯接液量匹配,切片正在所有考查历程中要脆持干润状态,预防搞片)5.旗号搁大与隐色:5.1 留神揩去构造周围液体,滴加适量一抗(约50 ul ,根据构造大小删、减量),37℃,火干盒中孵育30分钟;37℃PBS 浸泡3x2分钟(沉微振荡容器);5.2 留神揩去构造周围液体,滴加适量两抗(约50 ul ,根据构造大小删、减量),室温,火干盒中孵育20分钟;室温PBS 浸泡3x2分钟(沉微振荡容器);溶液 次数×时间(分)两甲苯 3×10 100%酒粗 1 ×3 95%酒粗 1 x 3 80%酒粗 1 ×3 蒸馏火 1 x 35.3 留神揩去构造周围液体,滴加适量HRP散合物(约50 ul,根据构造大小删、减量),室温,火干盒中孵育30分钟;室温PBS浸泡3x2分钟 (沉微振荡容器).5.4 留神揩去构造周围液体,滴加适量DAB隐色液(约50 ul,根据构造大小删、减量),室温,火干盒中孵育约10分钟(分歧样本的隐色时间大概有所没有共,修议镜下瞅察隐色历程);室温PBS浸泡3x2分钟(沉微振荡容器).5.5 自去火浑洗,苏木粗复染(可用盐酸酒粗瓦解及氨火返蓝).梯度酒粗脱火,中性树胶启片.♦阳性截止推断尺度:仅为细胞核着色.胞浆战胞膜着色没有克没有及视为阳性,惟有当核团结时不妨出现胞浆阳性着色.♦其余事项:本试剂保量期为12个月.客户正在支到产品时请即时查看,如创造有中包拆破坏、试剂盒身分没有齐等产品问题,大概者正在使用历程中有所有疑问,请即时与泰普客户服务核心通联,咱们将即时为您办理.♦公司疑息:公司称呼:祸修泰普死物科教有限公司总部:祸修省祸州市金山金洲北路7号金山科技企业孵化器7号楼4层邮编:350002电话:800-804-8333,0591-2805 3600 传真:0591-2805 3700研收核心:北京市昌仄区北浑路中闭村死命科教园革新大厦A座207室邮编:102206电话:010-8072 0071 传真:010-8072 0072。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
各种动物骨髓单个核细胞分离液试剂盒
规格:200mL/kit
保存:本产品对光敏感,应该室温避光储存,保质期2年。
无菌开封后,保存于室温。
试剂盒组成:
各种动物骨髓单个核细胞分离液200mL
全血及组织稀释液200mL
细胞洗涤液200mL
单个核细胞分离方法
制备骨髓的单细胞悬液:
1.取一支适当的离心管,加入与骨髓单细胞悬液等量的分离液(分离液最少不得少于3mL,总体积不能超过离心管的三分之二,否则会影响分离效果)。
2.小心吸取单细胞悬液加于分离液液面上,注意保持两液面界面清晰。
(可以使用巴氏德吸管吸取单细胞悬液,然后小心的平铺于分离液上,因为两者的密度差异,将形成明显的分层界面。
)
3.室温,500~900g,离心20~30min。
(根据骨髓单细胞悬液的量确定离心条件,单细胞悬液量越大,离心力越大,离心时间越长,具体离心条件可以自行摸索,以达到最佳分离
效果)。
4.离心后,此时离心管中由上至下细胞分四层。
第一层为稀释液层;第
二层为环状乳白色单个核细胞层;第三层为透明分离液层;第四层为红细
胞层。
5.用吸管小心吸取第二层环状乳白色单个核细胞层至另一洁净的15mL
离心管中,向离心管中加入10ml细胞洗涤液洗涤白膜层细胞,250g,离心
10min。
6.弃上清,5mL的PBS或细胞清洗液重悬细胞,250g,离心10min。
7.重复步骤7
分层示意图
8.弃上清,细胞重悬备用。
骨髓单细胞悬液的制备方法
小动物骨髓的采集:
1.处死动物,无菌提取股骨和胫骨,剪去两端软骨,露出红色的骨髓腔(注意尽可能少的剪走骨髓腔)。
2.取1ml的无菌注射器,吸取少量的含有10%标准胎牛血清的稀释液或者是含有血清的培养基,冲洗骨髓腔以获得骨髓。
3.最终制备成2×108–1×109/ml的单细胞悬液备用。
大动物骨髓的采集:
大动物骨髓的采集可采取活体穿刺方法:先将动物麻醉、固定、局部除毛、消毒皮肤,然后估计好皮肤到骨髓的距离,把骨髓穿刺针的长度固定好。
操作人员用左手把穿刺点周围的皮肤绷紧,右手将穿刺针在穿刺点垂直刺入,轻轻左右旋转将穿刺针钻入,当穿刺针进入骨髓腔时常有落空感。
连接注射器缓慢抽吸骨髓组织,当注射器内抽到少许骨髓时即停止抽吸。
用含10%标准胎牛血清的稀释液调整细胞浓度为2×108–1×109/ml的单细胞悬液备用。
常用的骨髓穿刺点:
股骨:穿刺部位在股骨内侧面,靠下端的凹面处;
胸骨:穿刺部位是胸骨体与胸骨柄连接处;
肋骨:穿刺部位是第5~7肋骨各点的中点;
胫骨:穿刺部位是股骨内侧、靠下端的凹面处。
如果穿刺采用的是肋骨,穿刺结束后要用胶布封贴穿刺孔,防止发生气胸。
注意事项:
A.开封前颠倒混匀,本分离液为无菌产品,为延长分离液保存时间,请在无菌条件下启封,避免微生物污染。
B.分离液使用时应始终保持室温(18℃~25℃),如室内温度较低,可将分离液预热。
4℃或者是温度较低的条件下离心,可能会导致白膜层中红细胞污染加重。
C.待分离的组织要求新鲜,避免冷冻和冷藏。
D.部分塑料制品(如聚苯乙烯)因其带有的静电作用,可能会导致细胞挂壁影响分离效果。
E.如果要进一步对分离的细胞进行培养,那在制备单细胞悬液和分离过程中,注意无菌操作,避免微生物污染。
参考文献:
1.Boyum A.Separation of leucocytes from blood and bone marrow.Scand J Clin Lab Invest Suppl. 1968;97:7.
2.Ting A,Morris PJ.A technique for lymphocyte preparation from stored heparinized blood.Vox Sang.1971Jun;20(6):561-
3.
3.Boyum A.Separation of Blood Leucocytes,Granulocytes and Lymphocytes Tissue Antigens.1974; 4(4):269-7
4.
4.Weisbart RH,Webb WF,Bluestone R,Goldberg LS.A simplified method for lymphocyte separation. Vox Sang.1972;23(5):478-80.。
