第06章 电分析化学导论
II 第六章 电分析化学方法导论

二、电化学池图解表达方式与电极电位
(一)电位符号 IUPAC推荐电极的电位符号的表示方法 (1)半反应写成还原过程: Ox + ne-==Red (2)电极的符号相当于该电极与标准氢电 极组成电池时,该电极所带的静电荷的符 号。
(二)电池的图解表达方式及其它规定
Zn∣ZnSO4(α1)‖CuSO4(α2)∣Cu (1)负极(发生氧化反应)写在左边,正极(发生还 原反应)写在右边; (2)以单竖线|表示相界面;以双竖线||表示盐桥或多 孔隔膜,以逗号“,”表示同一相中存在的多种组分。 (3)电解质写于两电极之间 (4)气体或均相的电极反应,反应物本身不能构成电 极,必须以惰性金属导体作为载体。 (5)写出电池中各电解质的化学组成、物态、活度、 气压、温度。
例一
2 Ag + Hg2Cl2 2Hg + AgCl 负极:Ag + Cl- - e → AgCl 正极:Hg2Cl2 + 2e → 2Hg + 2Cl原电池Cl-(α2), Hg2Cl2(s)∣Hg(l)
(三)电极电位的测定
单个电极的电位值不能测到,因此只能选择两 个电对构成原电池,测定该电池电动势。如果 所有电极的电位都相对于同一电极,则可测定 出各电极的相对值,现规定以标准氢电极为参 比电极。 标准氢电极 待测电极
II 电分析化学方法
第六章 电分析化学导论
电分析化学 electroanalytical chemistry
电分析化学是根据物质在溶液中 的电学或电化学性质及其变化来 进行分析的方法。 以溶液的电导、电位、电流和电 量等电化学参数与被测物质含量 之间的关系作为计量基础。
电分析化学法导论

第9章电分析化学法导论【9-1】解释下列名词。
原电池,电解池,电池电动势,电极电位,液接电位,标准电位,条件电位,平衡电位,浓差极化,电化学极化,超电位,指示电极,参比电极,工作电极。
答:原电池:将化学能编为电能的装置。
电解池:将电能变为化学能的装置。
电池电动势:流过电池的电流为零或接近于零时两电极间的电位差,以E池表示。
电极电位:任何电极与标准氢电极构成原电池所测得的电动势作为该电极的电极电位。
液接电位:在两个组成不同或浓度不同的电解质溶液互相接触的液-液界面间所存在的一个微小的电位差,称为液体接界电位,简称液接电位。
标准电位:298.15K时,以水为溶剂,当氧化态和还原态活度等于1时的电极电位。
条件电位:由于电极电位受溶液离子强度、配位效应、酸效应等因素的影响,因此使用标准电极电位ϕ0有其局限性。
对于一个实际体系在某一特定条件下,该电对的氧化型总浓度和还原型总浓度均为1mol·.L-1时的实际电位的实际电位。
平衡电位:在一个可逆电极中,金属成为阳离子进入溶液以及溶液中的金属离子沉积到金属表面的速度相等时,反应达到动态平衡,亦即正逆过程的物质迁移和电荷运送速度都相同,此时该电极上的电位值称为平衡电极电位。
浓差极化:发生电极反应时,电极表面附近溶液浓度与主体溶液浓度不同所产生的现象称为浓差极化。
电化学极化:由于电极反应的速率较慢而引起的电极电位对平衡电位值的偏离现象。
超电位:由于极化,使实际电位和可逆电位之间存在差异,此差异即为超电位η。
指示电极:用于无电极反应发生的平衡体系或在测量过程中溶液浓度不发生可觉察变化体系的电极。
参比电极:在测量过程中其电极电位几乎不发生变化的电极。
工作电极:有电极反应发生电极表面溶液浓度随电极反应发生显著变化体系的电极的电极。
【9-2】盐桥的作用是什么?对盐桥中的电解质溶液应有什么要求?答:盐桥的作用是尽可能降低液接电位。
盐桥电解质的要求是:(1)正、负离子的迁移速率大致相等(如KCl,KNO3, NH4NO3等),且可达到较高浓度;(2)与半电池中溶液不发生化学反应。
电分析化学导论.

101.325 kPa的纯氢气,H2被铂黑吸附直到饱和。这时整个铂黑片仿佛是由氢
气组成,铂黑吸咐的H2和溶液中的H+构成了氢电极
标准氢电极结构示意图
电极电位的测定举例
IUPAC规定任何电极的电位是:它与标准氢电极构成原电池,
所测得的电动势作为该电极的电极电位;
电子通过外电路,由标准氢电极流向该电极,电极电位为正值;
Electrode potential: the difference between the charge on an electrode and the charge in the solution.
电 极 电 位
形成原因: 带电质点的迁移 表述形式:
Nernst方程:E=E0+[(RT)/(nF)]lnMn+
电 极 电 位
定 义: 金属-溶液界面中由于带电质点的迁移,使两相界 面的两边产生的电位差
金属可以看成是离子与自由电子组成。金属离子以点阵结构排列,电 子在其中运动。
如:锌片与ZnSO4溶液接触,金属中Zn2+的化学势大于溶液中Zn2+的化学势, Zn不断溶解到溶液中,电子被留在Zn片上,使金属带负电,溶液带正 电,两相间形成双电层。双电层的形成,破坏了原来金属和溶液两相 间的电中性,形成了电位差。由于电位差的存在,从而排斥了Zn2+继 续进入溶液,金属表面的负电荷对溶液中Zn2+又有吸引力,最终达到 动态平衡,此时两相之间的电位差就是平衡电极电位。
消除方式:盐桥
消除原理:
盐桥中饱和KCl溶液的浓度较高,且K+、Cl-迁移数接近,主 要是盐桥中K+、Cl-扩散到溶液中, K+、Cl-扩散速率相近, 使盐桥与溶液接触处产生的液接电位很小,约为1-2mV。
电分析化学导论ppt课件-2024鲜版

03
利用微纳米技术实现对生物样品的高灵敏度、高选择性检测,
如细胞内外物质的分析、生物大分子的检测等。
32
光谱技术在电分析中应用
01
光谱电化学
结合光谱技术和电化学方法,研究电极过程的动力学和机理,以及电极
材料的结构和性质。
02
表面增强拉曼光谱在电分析中的应用
利用表面增强拉曼光谱技术提高电分析的灵敏度和选择性,实现对痕量
2024/3/28
电解分析法
通过电解过程对物质进行定性和定量分 析。
库仑分析法
基于法拉第电解定律,通过测量电解过 程中所消耗的电量进行分析。
6
电分析化学在各个领域应用
环境监测
用于水质、大气、土壤等环境样品的检 测和分析。
食品工业ቤተ መጻሕፍቲ ባይዱ
用于食品营养成分、添加剂和有害物质 的分析和检测。
生物医学
在生物样品分析、药物研发和临床医学 等领域有广泛应用。
34
THANKS
2024/3/28
35
电分析化学定义与发展
利用物质的电学和电化学性质 进行表征和测量的科学。
02
发展历程
01
电分析化学定义
2024/3/28
从伏打电池的发现到现代电化学 分析技术的不断革新。
5
电分析化学研究内容
电导分析法
通过测量溶液的电导率来分析溶液中的 离子浓度。
电位分析法
利用电极电位与待测物质浓度之间的关 系进行分析。
物质的检测。
2024/3/28
03
光电化学传感器
将光电转换技术与电化学传感器相结合,构建高灵敏度、高选择性的光
电化学传感器,用于环境、生物等领域的分析检测。
6电分析化学导论

伏安分析法与极谱法
伏安分析:通过测定特殊条件下的电流—电压曲线来分 析电解质的组成和含量的一类分析方法的总称。 极谱分析:使用滴汞电极的一种特殊的伏安分析法。
6.2 电化学电池
化学电池
简单的化学电池是由两组金属-溶液体系组成的,每一个 化学电池有两个电极,分别浸入适当的电解质溶液中,用金 属导线从外部将两个电极连接起来,同时使两个电解质溶液 接触,构成电流通路。
电子通过外电路导线从一个电极流到另一个电极,在溶液 中带正负电荷的离子从一个区域移动到另一个区域以输送电 荷,最后在金属-溶液界面处发生电极反应,即离子从电极 上取得电子或将电子交给电极,发生氧化-还原反应。
1、酸碱滴定:常用pH玻璃电极作为指示电极;
2、氧化还原滴定:一般应用铂电极作为指示电极,以甘汞电 极为参比电极,氧化还原滴定都能应用电位法确定终点;
3、沉淀滴定:根据不同的沉淀反应采用不同的指示电极,例 如以硝酸银溶液滴定卤素离子时,可以用银电极作为指示电极;
4、络合滴定:以乙二胺四乙酸(EDTA)为滴定剂,铂电极为 指示电极,甘汞电极为参比电极。
第一:维持样品和标准溶液恒定的离子强度;
第二:保持试液在离子选择电极适合的pH范围内,避免 H+或OH-的干扰;
第三,使被测离子释放为可检测的游离离子。
标准加入法:分析复杂样品时用,将标准溶液加到样品溶液 中,也可以将样品溶液加到标准溶液中。
直读法:如pH计。
*pH计能否准确的测定强酸和强碱的pH值,结果有何变化?
➢ 晶体膜电极
• 均相膜电极的敏感膜是由单晶或由一种化合物和几 种化合物均匀混合的多晶压片制成;
• 非均相膜电极是由多晶中掺惰性物质经热压制成。
➢ 晶体膜电极
2024年度电分析化学导论

根据测量参数的不同,可分为恒电流 电解法、恒电位电解法、控制电位电 解法等。
14
恒电位库仑法
恒电位库仑法原理
在电解过程中,通过保持电极电位恒定,测量通过电 解池的电量,从而计算被测物质的含量。
恒电位库仑法特点
具有高的灵敏度和准确度,适用于微量和痕量分析。
恒电位库仑法应用
广泛应用于环境监测、药物分析、食品检测等领域。
03
02
电极过程控制步骤
电极过程通常包括液相传质、电子转移和化学反应等步 骤,其中速率最慢的步骤为控制步骤,决定整个电极过 程的速率。
电极极化现象
当电极上有电流通过时,电极电位会偏离平衡电位,产 生极化现象。极化程度与电流密度、电极材料、电解质 溶液性质等因素有关。
6
物质在电极上行为描述
2024/3/24
分类
根据电极类型和测量方式的不同,极谱法可分为直流极谱法、交流极谱法、方波极谱法 等。
2024/3/24
25
循环伏安法
循环伏安法是一种常用的电化学分析方法,通过控制电极电势在一定范围 内循环变化,同时测量电流随电势的变化曲线。
循环伏安法可用于研究电极反应机理、测定电极反应速率常数、研究电极 过程动力学等。
利用离子选择性电极对特定离子的选 择性响应,通过测量电极电位变化来 测定待测离子浓度的分析方法。
离子选择性电极种类
离子选择性电极的应用
广泛应用于环境监测、水质分析、食 品检验等领域。
包括玻璃膜电极、晶体膜电极、液膜 电极等。
2024/3/24
10
气体传感器法
2024/3/24
气பைடு நூலகம்传感器原理
01
利用气体传感器对特定气体的选择性响应,通过测量传感器电
电分析化学导论新版zhong

药物电化学
研究药物在生物体内的电化学行为, 为药物设计和筛选提供依据。
生物传感与成像
利用电化学方法实现生物传感和成像, 为疾病诊断和治疗提供有效手段。
电分析化学的发展趋势与展望
01
交叉学科融合
加强与其他学科的交叉融合,如 物理学、生物学、医学等,拓展
电分析化学的应用领域。
03
微型化与集成化
发展微型化和集成化的电分析系 统,实现便携式和实时检测。
生物医学研究
在生物医学研究中,离子选择性电极可用于研究生物体 内离子的浓度变化和作用机制。
04
电位分析法
电位分析法的原理
基于电化学反应的电位变化
电位分析法基于电化学反应过程中产生的电位变化,通过测量电位变化来推算反应的进行程度和物质的浓度。
平衡电位与能斯特方程
在特定条件下,电化学反应达到平衡状态时的电位称为平衡电位,其与反应物质的浓度之间满足能斯特方程。
生物电化学
结合生物学和电化学技术,研究生物分子在 电化学过程中的行为和作用机制。
微纳流控电化学
通过微纳流控技术,实现电化学检测的微型 化和集成化。
电分析化学在生命科学中的应用
生物分子检测
利用电化学方法检测生物分子,如 DNA、蛋白质和酶等。
细胞电化学
研究细胞膜电位、细胞内离子浓度等 电化学性质,揭示细胞生命活动的机 制。
塑料膜电极由塑料膜和内参比 溶液组成,对特定离子有响应 。
酶电极
酶电极由酶膜和内参比溶液组 成,对生物活性物质有响应。
离子选择性电极的应用
离子浓度的测定
离子选择性电极可用于测定溶液中特定离子的浓度。
环境监测
在环境监测中,离子选择性电极可用于检测水体、土壤 等中的离子浓度。
电分析化学概论

气敏电极
气敏电极能够直接测量气 体分子在溶液中的溶解度, 常用于溶解氧、二氧化碳 等气体的测量。
离子选择电极的应用
环境监测
离子选择电极可用于检测水体、土壤等环境样品中的离子浓度,如 pH、氟化物、氯化物等。
工业控制
在工业生产过程中,离子选择电极可用于控制和监测各种离子浓度, 如酸碱度、氯离子等。
食品分析
药物分析
用于药物成分的定性和定量分析,以及药物 代谢产物的监测。
05 电解和电合成
电解的原理和应用
原理
电解是指在电流的作用下,电解质溶 液中的阳离子在阴极上得到电子发生 还原反应,而阴离子在阳极上失去电 子发生氧化反应的过程。
应用
电解广泛应用于工业生产中,如电解 冶炼、电解精炼、电镀等。此外,电 解还可以用于制备某些化学物质,如 通过电解水制备氢气和氧气。
实现实时监测和在线分析
实时监测和在线分析是电分析化学的重要发展方向,但目前仍存在一些技术难题,如电极 稳定性、响应速度等,需要加强研究。
拓展应用领域
目前电分析化学主要应用于环境监测、生物医学等领域,但在其他领域的应用相对较少。 因此,需要进一步拓展电分析化学的应用领域,推动其在更多领域的发展和应用。
02 电极过程动力学
电极过程动力学基础
电极反应的分类
根据电极反应的特点,可以将电极反应分为可逆反应、准可逆反 应和不可逆反应。
电极反应的步骤
电极反应通常包括吸附、电荷转移和扩散等步骤,这些步骤共同决 定了电极反应的速率。
电极反应的动力学参数
动力学参数是描述电极反应速率快慢的量,包括交换电流密度、传 递系数和表观活化能等。
THANKS FOR WATCHING
感谢您的观看
电化学分析---电化学分析导论

电分析化学导论
化学电池
Electrochemical Cell
电极电位
Electrode Potential
液接电位与盐桥
Liquid Junction Potential and Salt Bridge
电极的极化与超电位
Polarization on Electrodes and Overpotential
Hg
2+
0.059V 2/Hg+ 2
lg
Ksp1, Hg2C2O4 Ksp2 , Ca2C2O4
所以 E = K +
0.059V 2
lgaca2+
(四)零类电极: 由惰性金属与含有可溶性的氧化和还原质的溶 液。 例如Pt|Fe2+,Fe3+电极,
电极反应为: 电极电位为: Fe3+ + e E= Eθ Fe2+ + 0.059V lg
5、写出下列电池的半电池反应及电池反应,计算 其电动势,该电池是电解池还是原电池?
Zn│ZnSO4(0.1mol/L) ║AgNO3(0.01mol/L) │Ag 6、下述电池的电动势为0.413V, Pt,H2(101325Pa)|HA(0.215mol/L),NaA(0.116mol/L) ║SCE Esce=0.2443V,计算弱酸HA的解离常数。 7、下述电池的电动势为0.921V, Cd |CdX2-4(0.200mol/L),X-(0.150mol/L) ║SCE EθCd2+/Cd=-0.403V,Esce=0.2443V,计算Cd2-4的形成常数。 8、下述电池的电动势为0.893V, Cd |CdX2(饱和),X-(0.02mol/L) ║SCE EθCd2+/Cd=-0.403V,Esce=0.2443V,计算CdX2的溶度积常数。
电分析化学导论PPT课件

第3页/共37页
✓1942年A. Hickling研制成功三电极恒电位仪 ✓上世纪50年代后普遍应用运算放大电路,恒电 位仪、恒电流仪和积分仪成型。为控制电位电 解和库仑分析提供方便
2 电分析方法体系的发展与完善
电分析成为独立方法分支的标志是什么呢? 就 是上述三大定量关系的建立。50 年代,极谱法灵敏 度,和电位法pH测定传导过程没有很好解决。
A. J. Bard: 拥有全球目前
最大的电化学课题组, 研究内容覆盖几乎所有的 电化学方向。
Michael Grätzel: 染料敏化太阳能 电池的创始人,在瑞士联邦洛桑工 学院,拥有一流的光电化学实验室, 除了太阳能电池外,还涉及锂离子 电池和其它半导体发光材料的研究。
第17页/共37页
Richard G. Compton 欧洲最大的电化学研究组,主要致 力于理论电化学方面的研究,包括 计算电化学、光电化学、超声电化 学以及超快电化学研究。其主体实 验室建在牛津大学。
研制各种高灵敏度、高选择性 的电极是电位分析法最活跃的 研究领域之一。
第30页/共37页
电解分析: 在恒电流或控制电位 条件下,使被测物质在电极上析出, 实现定量分离测定目的的方法。
电重量分析法: 电解过程中在阴 极上析出的物质量通常可以用称重 的方法来确定。
库仑分析法: 依据法拉第电解定 律,由电解过程中电极上通过的电 量确定电极上析出的物质量的分析 方法
第28页/共37页
分类——按其测量方式不同分类
(1)根据待测溶液的浓度 C 与某一电参数之间的关 系求得分析结果。 电参数可以是电导、电位、电流、电量等 它包括:电导、电位、极谱、库仑分析法
(2)通过测量某一电参数的突变来指示滴定分析终点 的方法,又称电滴定分析法。 包括电导滴定、电位滴定、电流滴定等
2024年电分析化学导论教案(含多场合)

电分析化学导论教案(含多场合)电分析化学导论教案一、教学目的本课程旨在让学生了解电分析化学的基本原理和方法,掌握电化学分析的基本技术,培养学生的实际操作能力和创新思维能力,为后续专业课程学习和科研工作打下坚实基础。
二、教学内容1.电分析化学概述电分析化学是研究物质在电场作用下产生的化学现象及其应用的科学。
本课程主要介绍电分析化学的基本原理、方法和技术,包括电位法、电解法、库仑法、伏安法等。
2.电化学基础知识(1)电极与电解质溶液界面现象(2)电极过程动力学(3)电极反应类型及电极电位3.电位法(1)电极电位与溶液中离子活度的关系(2)参比电极与指示电极(3)直接电位法与间接电位法4.电解法(1)电解原理与电解过程(2)电解装置与电解操作(3)电解分析法的应用5.库仑法(1)库仑滴定原理(2)库仑滴定装置与操作(3)库仑滴定法的应用6.伏安法(1)伏安分析原理(2)伏安分析仪与操作(3)伏安分析法的应用7.电分析化学新技术及应用(1)化学修饰电极(2)生物电分析化学(3)光谱电化学(4)电化学传感器三、教学方法1.理论教学:采用课堂讲授、案例分析、小组讨论等多种教学方式,使学生在理解基本原理的基础上,掌握电化学分析的方法和技术。
2.实验教学:结合理论教学,开展实验教学,培养学生的实际操作能力和创新思维能力。
3.现代教育技术:利用多媒体、网络等现代教育技术手段,丰富教学资源,提高教学效果。
四、考核方式1.平时成绩:包括课堂表现、作业、实验报告等。
2.期中考试:笔试,主要考查学生对电化学基础知识、电位法、电解法、库仑法、伏安法等理论知识的掌握。
3.期末考试:笔试,综合考查学生对电分析化学的基本原理、方法、技术的理解和应用能力。
4.实验考核:实验操作和实验报告,主要考查学生的实际操作能力和实验结果分析能力。
五、教学进度安排1.电分析化学概述(2学时)2.电化学基础知识(6学时)3.电位法(6学时)4.电解法(4学时)5.库仑法(4学时)6.伏安法(4学时)7.电分析化学新技术及应用(2学时)8.实验教学(12学时)六、教学资源1.教材:选用权威、实用的电分析化学教材。
电分析化学导论(1)

完整版课件ppt
10
6.4.5 极化电极和去极化电极
电化学分析法中还把电极区分为极化电极和 去极化电极,插入试液中的电极的电极电位完全随 外加电压改变或电极电位改变很大而产生的电流 变化很小,这种电极称为极化电极;反之,电极 电位不随外加电压改变,或电极电位改变很小而 电流变化很大这种电极称为去极化电极。因此, 电位分析中的饱和甘汞电极和离子选择电极应为 去极化电极,而库仑分析法中的二支工作电极均 为极化电极,可极谱法中的滴汞电极是极化电极, 饱和甘汞电极是去极化电极。
第6章 电分析化学导论
6.1 定义和内容
定义
依据电化学和分析化学的原理 及实验测量技术来获取物质的质和量 及状态信息的一门科学。
完整版课件ppt
1
内容
至少可概括为: ⑴成分分析和形态分析; ⑵动力学和机理分析; ⑶ 表面和界面分析等。
现有电分析方法约200种。在科学研究、 工农业生产,几乎处处都有电分析方法 的应用。
完整版课件ppt
2
6.2电分析方法的分类
经典方法:按原理命名,划分为五大类
(1)电导分析(G=1/R), (2)电位分析(E=k+SlogC), (3)库仑分析(Q=nFM), ( 4 ) 电解分析(就指电重量方法), (5)伏安和极谱法(i=kc)。
完整版课件ppt
3
6.3 发展历史与展望
发展历史可概适为四阶段
完整版课件ppt
22
化学家、化学教育家海洛夫斯基
1890年12月20日生于布拉格,
1913年获伦敦大学理学士,从此担任物理化学助教,并
电化学分析法导论
在我国早期引用Kolthoff 的定义。80年代后,提出的中文定义 为:“依据电化学和分析化学的原理及实验测量技术来获取物 质的质和量及状态信息的一门科学。”
电分析化学的发展具有悠久的历史,是与尖端科学技术 和学科的发展紧密相关的。近代电分析化学,不仅进行组成 的形态和成分含量的分析,而且对电极过程理论,生命科学、 能源科学、信息科学和环境科学的发展具有重要的作用。作 为一种分析方法,早在18世纪,就出现了电解分析和库仑滴 定法。 19世纪,出现了电导滴定法,玻璃电极测pH值和高频滴 定法。 1922年,极谱法问世,标志着电分析方法的发展进入了 新的阶段。 二十世纪六十年代,离子选择电极及酶固定化制作酶电 极相继问世。 二十世纪70年代,发展了不仅限于酶体系的各种生物传 感器之后,微电极伏安法的产生扩展了电分析化学研究的时 空范围,适应了生物分析及生命科学发展的需要。
1、工作电极 2、参比电极 3、辅助电极 或对电极
四、电流的性质与符号 IUPAC规定: 阳极电流:起纯氧化反应所产生的电流,为正值; 阴极电流:起纯还原反应所产生的电流,为负值。 我国习惯: (1)原电池:阳极起氧化反应,为负值 阴极起还原反应,为正值。
Fe 3 , Fe 2 Pt
0 .0591 lg H
电分析化学导论教案

电分析化学导论教案一、教学目标1、让学生了解电分析化学的基本概念、研究内容和应用领域。
2、使学生掌握电分析化学中常用的电化学分析方法及其原理。
3、培养学生运用电分析化学知识解决实际问题的能力。
二、教学重难点1、重点(1)电化学分析法的基本原理,包括电位分析法、伏安分析法和电解分析法。
(2)电极的分类、性质和作用。
2、难点(1)能斯特方程在电位分析中的应用。
(2)极谱分析法的原理和应用。
三、教学方法1、讲授法:讲解电分析化学的基本概念、原理和方法。
2、案例分析法:通过实际案例分析,加深学生对电分析化学应用的理解。
3、实验演示法:进行简单的实验演示,让学生直观感受电分析化学的过程。
四、教学过程1、课程导入(约 10 分钟)通过介绍一些日常生活中与电分析化学相关的现象,如电池的工作原理、金属的腐蚀与防护等,引起学生的兴趣,引出电分析化学的主题。
2、电分析化学的基本概念(约 20 分钟)(1)讲解电分析化学的定义:电分析化学是利用物质在溶液中的电化学性质及其变化来进行分析的方法。
(2)介绍电分析化学的特点:灵敏度高、选择性好、分析速度快、易于实现自动化等。
3、电化学分析法的分类(约 30 分钟)(1)电位分析法讲解电位分析法的原理:基于测量电极电位来确定物质浓度的方法。
介绍参比电极(如饱和甘汞电极)和指示电极(如玻璃电极)的作用和特点。
举例说明电位分析法在 pH 测定、离子浓度测定中的应用。
(2)伏安分析法阐述伏安分析法的基本原理:通过测量电流电压曲线进行分析的方法。
解释极谱分析法和溶出伏安法的工作过程和特点。
以重金属离子的测定为例,说明伏安分析法的应用。
(3)电解分析法讲解电解分析法的原理:通过电解使待测物质在电极上析出,然后称重或测量电量来确定其含量。
介绍控制电位电解法和恒电流电解法的操作方法和适用范围。
4、电极的分类和性质(约 20 分钟)(1)电极的分类:根据电极反应的性质,分为氧化还原电极、离子选择性电极等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2. 电分析化学的重要特征
(1)直接通过测定电流、电位、电导、电量等物理量, 在溶液中有电流或无电流流动的情况下,来研究、确 定参与反应的化学物质的量。 (2)依据测定电参数分别命名各种电分析化学方法: 如电位、电导分析法; (3)依据应用方式不同可分为: 直接法和间接法。
3. 电分析化学的特点
(1)灵敏度、准确度高,选择性好 被测物质的最低量甚至可以达到10-15 mol/L数量级。
6-1 电分析化学概述
6-1-1 电分析化学的特点 6-1-2 电分析化学的类别 6-1-3 电分析化学的应用领域
6-2 化学电池与电极电位
6-2-1 化学电池 6-2-2 电极电位与测量 6-2-3 液接电位与盐桥 6-2-4 电极与电极分类
6-1-1 电分析化学的特点
1. 什么是电分析化学
应用电化学的基本原理和实验技术,依据物质电化学性质 来测定物质组成及含量的分析方法称为电化学分析或电分析化 学。
电解产生的滴定剂与被测物作用。
3.极谱法与伏安分析(4学时)
伏安分析:通过测定特殊条件下的电流—电压曲线来分析 电解质的组成和含量的一类分析方法的总称。 极谱分析:使用滴汞电极的一种特殊的伏安分析法。曾获 得诺贝尔化学奖。
交流示波滴定装置
极谱记录装置
4. 电导分析(物理化学课程中有详细阐述)
普通电导分析:溶液与电极直接接触
6-2-1 化学电池 6-2-2 电极电位与测量 6-2-3 液接电位与盐桥 6-2-4 电极与电极分类
6-1-3 电分析化学的应用领域
1.化学平衡常数测定
2.化学反应机理研究 3.化学工业生产流程中的监测与自动控制 4.环境监测与环境信息实时发布 5.生物、药物分析
6.活体分析和监测(超微电极直接刺入生物体内)
在两种不同离子的溶液或两种不同浓度的溶液接触界面 上,存在着微小的电位差,称之为液体接界电位。 液体接界电位产生的原因:各种离子具有不同的迁移速率 而引起。
盐桥: 饱和KCl溶液 中加入3%琼脂; K+、Cl-的扩散 速度接近,液接电 位保持恒定 1-2mV。
降低液接界电位 常用KCl,KNO3,NH4NO3 以饱和KCl(~4mol/L) 溶液最佳 只能降低, 无法完全消除
2.第二类电极──金属-金属难溶盐电极
金属及其难溶盐(或络离子)所组成的电极体系, 间接反映与该金属生成难溶盐(或络离子)的阴离子的 活度。该类电极有两个相界面,常用作参比电极。 例如:Ag/AgCl电极,甘汞电极
银-氯化银电极
银丝镀上一层AgCl沉淀,浸在一定浓度 的KCl溶液中即构成了银-氯化银电极。 电极反应:AgCl + e- == Ag + Cl半电池符号:Ag,AgCl(固)KCl 电极电位(25℃): EAgCl/Ag = EAgCl/Ag - 0.0591lgaCl表 银-氯化银电极的电极电位(25℃)
目 录
6-1 电分析化学概述
6-1-1 电分析化学的特点 6-1-2 电分析化学的类别 6-1-3 电分析化学的应用领域
6-2 化学电池与电极电位
6-2-1 化学电池 6-2-2 电极电位与测量 6-2-3 液接电位与盐桥 6-2-4 电极与电极分类
6-1-2 电分析化学的类别
按IUPAC的推荐,可分为三类: (1)不涉及双电层,也不涉及电极反应。电导分析。 (2)涉及双电层,但不涉及电极反应。 (3)涉及电极反应。电解、库仑、极谱、伏安分析等。 习惯分类方法(按测量的电化学参数分类): (1)电导分析法:测量电导值; (2)电位分析法:测量电动势; (3)电解(电重量)分析法:测量电解过程电极上析出物重量; (4)库仑分析法:测量电解过程中的电量; (5)伏安分析:测量电流与电位变化曲线; (6)极谱分析:使用滴汞电极时的伏安分析。
RT ao ln nF aR
目 录
6-1 电分析化学概述
6-1-1 电分析化学的特点 6-1-2 电分析化学的类别 6-1-3 电分析化学的应用领域
6-2 化学电池与电极电位
6-2-1 化学电池 6-2-2 电极电位与测量 6-2-3 液接电位与盐桥 6-2-4 电极与电极分类
6-2-3 液体接界电位与盐桥
1. 电位分析法(4学时)
电位分析法按应用方式可为两类 : 直接电位法: 电极电位与溶液中电活性物质的活度有 关,通过测量溶液的电动势,根据能斯特方程计算被测 物质的含量;
电位滴定: 分析法用电位测量装置指示滴定分析过程 中被测组分的浓度变化,通过记录或绘制滴定曲线来确 定滴定终点的分析方法。 研制各种高灵敏度、高选择性的电极是电位分析 法最活跃的研究领域之一。
6-2-4 电极与电极分类
电极按照其组成体系和作用机理的不同,可以分为五类: 1.第一类电极 2.第二类电极
3.第三类电极
4.零类电极
5.膜电极
1.第一类电极──金属-金属离子电极
金属与该金属离子溶液组成的电极,其电极电位取决于 金属离子的活度。 Mn+ + neM EMn+ /M = E Mn+ /M + (0.0591/n)lgaMn+ 例如:Ag-AgNO3电极(银电极),Zn-ZnSO4电极(锌电极)等 电极电位为(25 oC) : EAg+/Ag = E Ag+/Ag + 0.0591lgaAg+ EZn2+/Zn = E Zn2+/Zn + (0.0591/2)lgaZn2+
Zn ZnSO4 eeeeeeZn2+ Zn2+ Zn2+ Zn2+ Zn2+ Zn2+
——平衡电极电位。
2. 电极电位的测量
无法测定单个电极的绝对电极电位;相对电极电位。 规定:将标准氢电极作为负极与待测电极组成电池,电 位差即该电极的相对电极电位,比标准氢电极的电极电位高 的为正,反之为负;
Pt|H2(101 325 Pa ),H+(1mol/dm) ¦ 2+(1 mol/dm)|Ag ¦ Ag
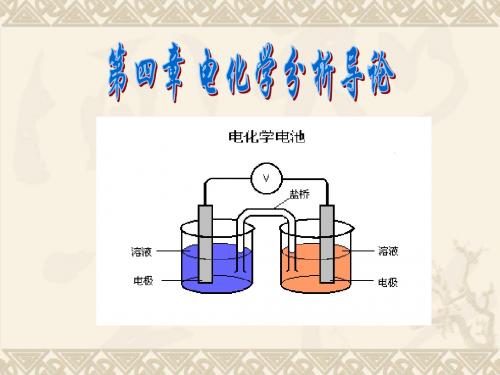
(1)左边电极进行氧化反应,右边电极进行还原反应。 (2)两相界面,包括不混溶的液液界面,用“|”表示;溶液 用盐桥连接,且消除了液接电位,用“¦¦”表示。 (3)电解质位于电极之间。 (4)反应物本身不能作为电极的,要用惰性材料作电极。 (5)溶液要标明浓(活)度,气体要标明压力温度。 (6)电池电动势:E电池=右- 左
6-2 化学电池与电极电位
6-2-1 化学电池 6-2-2 电极电位与测量 6-2-3 液接电位与盐桥 6-2-4 电极与电极分类
6-2-1 化学电池
电极:将金属放入对应的溶液后所组成 的系统。 化学电池:由若干支电极构成的系统; 化学能与电能的转换装置; 电分析化学法中涉及到两类化学电池: 原电池:自发地将化学能转变成电能; 电解电池:由外电源提供电能,使电流 通过电极,在电极上发生电极反应的装 置。 电池工作时,电流必须在电池内部和外 部流过,构成回路。 溶液中的电流:正、负离子的移动。
• 食品中水分的测定GB 5009.3-2010
• 淀粉类制品卫生标准的分析方法GB T5009.53-2003 • 食品中氟的测定GBT5009.18-2003
• 电位滴定分析奥美拉唑含量(药典法)
• 电位滴定仪测兰索拉唑含量(欧标药典)
目 录
6-1 电分析化学概述
6-1-1 电分析化学的特点 6-1-2 电分析化学的类别 6-1-3 电分析化学的应用领域
2.电解与库仑分析法(2学时)
电解分析: 在恒电流或控制电位 条件下,使被测物质在电极上析出,实 现定量分离测定目的的方法。 电重量分析法: 电解过程中在阴 极上析出的物质量通常可以用称重的方 法来确定。 库仑分析法: 依据法拉第电解定 律,由电解过程中电极上通过的电量确 定电极上析出的物质量的分析方法 电流滴定或库仑滴定: 恒电流下
素烧瓷
Ag/AgCl
饱和KCl
琼脂+KCl
思考: 素烧瓷和琼脂的作用?
目 录
6-1 电分析化学概述
6-1-1 电分析化学的特点 6-1-2 电分析化学的类别 6-1-3 电分析化学的应用领域
6-2 化学电池与电极电位
6-2-1 化学电池 6-2-2 电极电位与测量 6-2-3 液接电位与盐桥 6-2-4 电极与电极分类
电位差:+0.799 V;
银电极的标准电极电位:+0.799 V。
在298.15 K 时,以水为溶剂,当氧化态和还原态的活度等 于1 时的电极电位称为:标准电极电位。
能斯特方程(1889年W. Nernst提出)
E E0
或:
RT aRe d 0.0591 aOx lg E0 lg (T 298 .15 K ) nF aOx n aRe d
目 录
6-1 电分析化学概述
6-1-1 电分析化学的特点 6-1-2 电分析化学的类别 6-1-3 电分析化学的应用领域
6-2 化学电池与电极电位
6-2-1 化学电池 6-2-2 电极电位与测量 6-2-3 液接电位与盐桥 6-2-4 电极与电极分类
6-2-2 电极电位与测量
1.平衡电极电位
可以将金属看成离子和自由电子构成。以锌-硫酸锌为例 当锌片与硫酸锌溶液接触时,金属锌中Zn2+ 的化学势大于 溶液中Zn2+ 的化学势,则锌不断溶解到溶液中,而电子留在 锌片上。结果:金属带负电,溶液带正电;形成双电层。 双电层的形成建立了相间的电位差; 电位差排斥Zn2+继续进入溶液; 金属表面的负电荷又吸引Zn2+ ; 达到动态平衡,相间平衡电位
原电池
阳极:发生氧 化反应的电极 (负极); 阴极:发生还 原反应的电极 (正极); 阳极≠正极 阴极≠负极
