第八章 电分析化学法导论-zcq
第8章 电分析化学法

+ HgNH3 Y2- +NH4 +2e Hg+2NH3 +HY3-
库仑滴定装置示意图
库仑滴定产生的滴定剂及应用
电生滴定剂 Br2 I2 C12 Ce(Ⅳ) Mn(Ⅲ) Ag(Ⅱ) Fe(CN)64Cu(I) Fe(Ⅱ) Ag(I) EDTA(Y4- ) H+或OH介质 0.1mol/L H2SO4 + 0.2mol/L NaBr 0.1mol/L 磷酸缓冲溶液(Ph=8) +0.1 mol/L KI 2 mol/L HCl 1.5mol/L H2SO4 +0.1mol/LCe2(SO4)3 1.8mol/L H2SO4 +0.45mol/LMnSO4 5mol/L HNO3 +0.1mol/L AgNO3 0.2mol/L K3Fe(CN)6(pH=2) 0.02 mol/L CuSO4 2mol/L H2SO4 +0.6mol/L铁铵矾 0.5mol/L HClO4 0.02mol/L HgNH3Y2-+0.1mol/LNH4NO3 pH=8除氧 2mol/L Na2SO4或KCl 工作电极 Pt Pt Pt Pt Pt Au Pt Pt Pt Ag Hg Pt 测定的物质 Sb(Ⅲ),I- ,Tl(Ⅰ),U(Ⅳ) , 有机物 As(Ⅲ) ,Sb(Ⅲ) ,S2O32- ,S2– As(Ⅲ),I-,脂肪酸 Fe(II) ,Fe(CN)64草酸,Fe(Ⅱ),As(Ⅲ) As(Ⅲ),V(Ⅳ),Ce(Ⅲ),草 酸 Zn(Ⅱ) Cr(VI),V( V),IO3Cr(VI) , V( V ) , MnO4Cl- ,Br- ,ICa(II),Zn(II) ,Pb(II)等 OH-,或H+,有机酸或碱
【示例8-1】 氟离子选择电极法测定药物中的氟喹诺酮
第八章--电分析化学导论

第八章 电分析化学导论1、液接电位是怎样产生的?答:液接电位产生于具有不同电解质或浓度不同的电解质溶液界面之间,由于离子扩散通过界面的速率不同有微小的电位差产生。
2、阳极和阴极,正极和负极是怎样定义的?答:阳极和阴极是根据电极反应的性质定义的。
发生氧化反应的为阳极,发生还原反应的为阴极。
正、负极是根据电极电位高低来分类的,电极电位高的,电子流入的一极为正极,电极电位低的,电子流出的一极为负极。
3、何谓指示电极和参比电极?答:指示电极:在电化学测试过程中,溶液主体浓度不发生变化的电极; 参比电极:在测试过程中,具有恒定电位的电极。
4、写出下列电池的半电池反应及电池反应,计算其电动势,该电池是电解池还是原电池? Zn | ZnSO 4(0.1mol/L) || AgNO 3(0.01mol/L) | Ag解: 左: Zn - 2e = Zn 2+ 右: Ag + e = Ag V Zn E E Zn Zn 793.01.0lg 2059.0764.0]lg[2059.02/2-=+-=+=++θ左 V Ag E E Ag g 681.001.0lg 059.0799.0]lg[059.0/A =+=+=++θ右 E = E 右-E 左 = 0.681-(-0.793)= 1.474V > 0故是原电池。
5、下列电池的电动势为0.413VPt , H 2(101325Pa) | HA(0.215mol/L), NaA(0.116mol/L) || SCE E SCE = 0.2443V ,计算弱酸HA 的解离常数。
解:左 H 2 - 2e = 2H +因电池电动势E = E 右-E 左 ,则V E E E SCE H H 169.0413.02443.02/-=-=-=+即 V H H E E H H H H 169.0]lg[059.00]lg[059.022//-=+=+=++++θ[H +] = 1.37×10-3mol/L431039.7215.0116.01037.1][]][[---+⨯=⨯⨯==HA A H K a 或:pH = 2.86因 ][][lg HA A pK pH a -+= 代入数值求得:K a = 7.41×10-46、下述电池的电动势为0.921VCd | CdX 42-(0.200mol/L), X -(0.150mol/L) || SCESCE CdCd /解一:因 E = E 右-E 左故 V E E E SCE Cd CdX 6767.0921.02443.0/24-=-=-=-CdX 42- + 2e = Cd + 4X -V E X CdX E E CdCdX CdCdX Cd CdX 6767.0150.0200.0lg 2059.0][][lg 2059.04/424//242424-=+=+=-----θθ得:V E CdCdX 7534.0/24-=-θ又因 Cd 2+ + 2e = Cd (1) θθCdCd FE G /122+-=∆ Cd 2+ + 4X -= CdX 42-(2) θθ形K RT G ln 2-=∆CdX 42-+ 2e = Cd + 4X -(3) θθCd Cd FE G /X 3242--=∆(3) = (1) - (2) 即 ΔG 3 = ΔG 1 -ΔG 2 得:88.11298314.8303.2)7534.0403.0(964852303.2)(F 2lg //242=⨯⨯+-⨯=-=-+RTE E K CdCdX Cd Cd θθθ形K 形 = 7.6×1011 解二:因 E = E 右-E 左故 V E E E SCE Cd CdX 6767.0921.02443.0/24-=-=-=-CdX 42- + 2e = Cd + 4X -V E X CdX E E CdCdX CdCdX Cd CdX 6767.0150.0200.0lg 2059.0][][lg 2059.04/424//242424-=+=+=-----θθ得:V E Cd CdX 7534.0/24-=-θ又 Cd 2+ + 2e = Cd 424/2//][][lg2059.0]lg[2059.0222--++=+=+++X K CdX E Cd E E 形Cd Cd CdCd Cd Cd θθ当[CdX 4-] = [X -] = 1mol/L 时,上式的电位即为θCd CdX E /2 所以 形Cd Cd Cd CdX K E E lg 2059.0//22-=+θθ88.11059.0)7543.0403.0(2059.0)(2lg //242=+-=-=-+θθCdCdX Cd Cd 形E E KK 形 = 7.6×1011 7、下列电池的电动势为0.893VCd | CdX 2(饱和),X -(0.02mol/L) || SCESCE CdCd /解一:因 E = E 右-E 左故 V E E E SCE Cd CdX 6487.0893.02443.0/2-=-=-= CdX 2 + 2e = Cd + 2X -V E X E E Cd CdX Cd CdX Cd CdX 6487.002.01lg 2059.0][1lg 2059.02/2//222-=+=+=-θθ得:V E CdCdX 749.0/2-=θ又因 Cd 2+ + 2e = Cd (1) θθCdCd FE G /122+-=∆ CdX 2 = Cd 2+ + 2X -(2) θθsp K RT G ln 2-=∆CdX 2 + 2e = Cd + 2X -(3) θθCd Cd FE G /X 322-=∆(3) = (1) + (2) 即 ΔG 3 = ΔG 1 + ΔG 2 得: 73.11298314.8303.2)403.0749.0(964852303.2)(F 2lg //22-=⨯⨯+-⨯=-=+RTE E K Cd Cd Cd CdX sp θθθK sp = 1.9×10-12解法二:因 E = E 右-E 左 故 V E E E SCE Cd CdX 6487.0893.02443.0/2-=-=-= CdX 2 + 2e = Cd + 2X -V E X E E Cd CdX Cd CdX Cd CdX 6487.002.01lg 2059.0][1lg 2059.02/2//222-=+=+=-θθ得:V E Cd CdX 749.0/2-=θ又 Cd 2+ + 2e = Cd 2/2//][lg 2059.0]lg[2059.0222-++=+=+++X K E Cd E E sp Cd Cd CdCd Cd Cd θθθ当[X -] = 1mol/L 时,上式的电位即为θCd CdX E /2 所以 θθθsp Cd Cd Cd CdX K E E lg 2059.0//22+=+ 73.11059.0)403.0749.0(2059.0)(2lg //22-=+-=-=+θθθCd Cd Cd CdX sp E E KK sp = 1.9×10-12。
电分析化学法导论

第9章电分析化学法导论【9-1】解释下列名词。
原电池,电解池,电池电动势,电极电位,液接电位,标准电位,条件电位,平衡电位,浓差极化,电化学极化,超电位,指示电极,参比电极,工作电极。
答:原电池:将化学能编为电能的装置。
电解池:将电能变为化学能的装置。
电池电动势:流过电池的电流为零或接近于零时两电极间的电位差,以E池表示。
电极电位:任何电极与标准氢电极构成原电池所测得的电动势作为该电极的电极电位。
液接电位:在两个组成不同或浓度不同的电解质溶液互相接触的液-液界面间所存在的一个微小的电位差,称为液体接界电位,简称液接电位。
标准电位:298.15K时,以水为溶剂,当氧化态和还原态活度等于1时的电极电位。
条件电位:由于电极电位受溶液离子强度、配位效应、酸效应等因素的影响,因此使用标准电极电位ϕ0有其局限性。
对于一个实际体系在某一特定条件下,该电对的氧化型总浓度和还原型总浓度均为1mol·.L-1时的实际电位的实际电位。
平衡电位:在一个可逆电极中,金属成为阳离子进入溶液以及溶液中的金属离子沉积到金属表面的速度相等时,反应达到动态平衡,亦即正逆过程的物质迁移和电荷运送速度都相同,此时该电极上的电位值称为平衡电极电位。
浓差极化:发生电极反应时,电极表面附近溶液浓度与主体溶液浓度不同所产生的现象称为浓差极化。
电化学极化:由于电极反应的速率较慢而引起的电极电位对平衡电位值的偏离现象。
超电位:由于极化,使实际电位和可逆电位之间存在差异,此差异即为超电位η。
指示电极:用于无电极反应发生的平衡体系或在测量过程中溶液浓度不发生可觉察变化体系的电极。
参比电极:在测量过程中其电极电位几乎不发生变化的电极。
工作电极:有电极反应发生电极表面溶液浓度随电极反应发生显著变化体系的电极的电极。
【9-2】盐桥的作用是什么?对盐桥中的电解质溶液应有什么要求?答:盐桥的作用是尽可能降低液接电位。
盐桥电解质的要求是:(1)正、负离子的迁移速率大致相等(如KCl,KNO3, NH4NO3等),且可达到较高浓度;(2)与半电池中溶液不发生化学反应。
第八章 电分析化学导论

2021/7/14
• 标准氢电极与标准状态下的被测电极组成原 电池 ,用电位计测原电池电动势
Eθ=
正
-
负=
θ(Mn+
/
M)
-
θ(
H+
/
H2)
= (θ Mn+ / M)
θ为标准状态下的电极电位
为非标准状态下的电极电位,用能斯特 方程计算
• 在电化学中,不论是原电池,还是电解 池: 凡是发生氧化反应的为阳极 凡是发生还原反应的为阴极
• 电极反应的总反应为电池反应
(正、负极是物理学上的分类,阴阳极是 化学上常用的称呼)
2021/7/14
表8~2原电池与电解池的对比p126
原电池
电解池
电子流 动方向
由负极→正极
由阳极→阴极
电极 负极(电 正极(电 阴极(电 阳极(电 名称 子流出) 子流入) 源负极) 源正极)
第八章 电分析化学导论
Study hard !
2021/7/14
§8-1 概述
一、定义 • 电分析化学是仪器分析的一个重要
分支
• 根据物质在溶液中的电化学性质及其 变化来测定物质组分含量的方法,称 为电分析化学法。 仪器简单,应用广泛,发展迅速的 一类方法。
2021/7/14
二、分类——按其测量方式不同分类(书上)
0.0592Vlg 2
a(C2O42
)
Hg2
/
Hg
0.0592V 2
lg
KSP1
0.0592V 2
lg
KS
P2
0.0592Vlg 2
a(C
电分析化学导论新版zhong

药物电化学
研究药物在生物体内的电化学行为, 为药物设计和筛选提供依据。
生物传感与成像
利用电化学方法实现生物传感和成像, 为疾病诊断和治疗提供有效手段。
电分析化学的发展趋势与展望
01
交叉学科融合
加强与其他学科的交叉融合,如 物理学、生物学、医学等,拓展
电分析化学的应用领域。
03
微型化与集成化
发展微型化和集成化的电分析系 统,实现便携式和实时检测。
生物医学研究
在生物医学研究中,离子选择性电极可用于研究生物体 内离子的浓度变化和作用机制。
04
电位分析法
电位分析法的原理
基于电化学反应的电位变化
电位分析法基于电化学反应过程中产生的电位变化,通过测量电位变化来推算反应的进行程度和物质的浓度。
平衡电位与能斯特方程
在特定条件下,电化学反应达到平衡状态时的电位称为平衡电位,其与反应物质的浓度之间满足能斯特方程。
生物电化学
结合生物学和电化学技术,研究生物分子在 电化学过程中的行为和作用机制。
微纳流控电化学
通过微纳流控技术,实现电化学检测的微型 化和集成化。
电分析化学在生命科学中的应用
生物分子检测
利用电化学方法检测生物分子,如 DNA、蛋白质和酶等。
细胞电化学
研究细胞膜电位、细胞内离子浓度等 电化学性质,揭示细胞生命活动的机 制。
塑料膜电极由塑料膜和内参比 溶液组成,对特定离子有响应 。
酶电极
酶电极由酶膜和内参比溶液组 成,对生物活性物质有响应。
离子选择性电极的应用
离子浓度的测定
离子选择性电极可用于测定溶液中特定离子的浓度。
环境监测
在环境监测中,离子选择性电极可用于检测水体、土壤 等中的离子浓度。
第八章 电化学分析导论

O EHg2Cl/Hg EHg2 Cl/Hg 0.059 lg a (Cl )
2
电极内溶液的Cl-活度一定,甘汞电极电位固定。
表 甘汞电极的电极电位( 25℃)
0.1mol/L 甘汞电极 KCl 浓度 电极电位(V) 0.1 mol / L +0.3365 标准甘汞电极(NCE) 1.0 mol / L +0.2828 饱和甘汞电极(SCE) 饱和溶液 +0.2438
c d C D r Gm r Gm RT ln k RT ln a b A B c d C D r Gm r Gm RT ln a b A B
原电池中吉布斯自由能的降低值等于回路 所作的电功.
-Δ r G m =W=nEF
RT EE ln nF
0.1mol/LAg-AgCl 电极 KCl 浓度 电极电位(V) 0.1 mol / L +0.2880 标准 Ag-AgCl 电极 1.0 mol / L +0.2223 饱和 Ag-AgCl 电极 饱和溶液 +0.2000
温度校正,(标准Ag-AgCl电极),t ℃时的电极电位为: Et= 0.2223- 6×10-4(t-25) (V)
(1)左边是发生氧化反应的阳极,右边是发生还原反
应的阴极。
(2)“ ”表示接界面,“ ”表示盐桥。
(3)有溶液的两级需要注明浓(活)度,有气体的应 注明压力、温度,无注明的表示标准状态。
电池电动势E :E=E右-E左
例子:
+ Pt,H 2 ( p ) H( =1)Cu 2+ ( ) Cu(s)
准氢电极的电极电位高的为正,反之为负;
Pt|H2(101 325 Pa ),H+(1mol/mL)||Ag2+(1mol/mL)|Ag 电位差:+0.799 V; 银电极的标准电极电位:+0.799 V。 在298.15 K 时,以水为溶剂,当氧化态和还原态的活度等
第8章-电化学分析法导论

第8章电化学分析法导论(Chapter Introduction to Electrochemical Analysis) (2学时)教学目的和要求:1.了解电化学分析法的概念及分类。
2.了解电化学分析中常用的电极和分类。
3.熟悉自发电池和电解池。
4.掌握电极电位的计算方法。
5.了解扩散电位(液接电位和盐桥的作用)。
6.了解电解现象。
7.掌握分解电压、析出电位、过电压过电位的概念。
8.学会析出电位和分解电压的计算。
教学要点和所涵盖的知识点:电化学分析法的概念及分类;常用的电极和分类,自发电池和电解池;电极电位的计算方法,扩散电位(液接电位和盐桥的作用);电解现象(分解电压、析出电位、过电压、过电位)。
重点和难点:电解现象(分解电压、析出电位、过电压、过电位)。
一定义和内容(一)定义电化学分析法也称为电分析化学,尽管存在不同意见,一些著名学者还是提出了大多数人可接受的定义。
50年代,I.M. Kolthoff 提出:Electroanalytical Chemistry as the application of electrochemistry to analytical chemistry。
80 年代,由于分析化学的快速发展,电分析化学的内容的扩充和更新,这一定义不能准确适应,J.A.Plambeck 修正了这一定义:Electroanalytical chemistry is that branch of chemical analysis that employs electrochemical methods to obtain information related to the amounts,properties, and environments of chemical species.在我国早期引用Kolthoff 的定义。
80年代后,提出的中文定义为:“依据电化学和分析化学的原理及实验测量技术来获取物质的质和量及状态信息的一门科学。
第八章电分析化学导论3

仪器分析
Instrumental Analysis
8.3.3 极化与过电位
极化是指电流通过电极与溶液的界面时,电极电位偏离 其平衡电位的现象。电极电位与平衡电位之差称为过电位。 极化分为:浓差极化和电化学极化 (1)浓差极化 由于浓度的差异引起的极化 浓差极化是由于电解过程中电极表面附近溶液浓度与主 体溶液浓度不同所产生的极化现象。 RT
++++-+ -+ -+ -+
M不活泼
- + +- + +- + +- + +-
氧化>还原
还原>氧化
仪器分析
Instrumental Analysis +(1mol.L-1) Mn+(1mol.L-1) M Pt H (101325Pa),H 2 方法:将某一电极与标准氢电极相连接,组成一个原电池 ,测量电池的电动势。
仪器分析
Instrumental Analysis
第8 章
8.1 8.2
电分析化学引论
电分析化学概述 化学电池
8.3
8.4
基本概念和重要术语
电极的分类
MOOC: Massive(大规模的)、Open、Online、Course
仪器分析
Instrumental Analysis
8.1
电分析化学概述 应用电化学的基本原理和实验技术,依据物质 在溶液中的电化学性质及其变化规律进行分析的方 法。 Electroanalytical Chemistry as the application 电分析化学奠基人 of electrochemistry to analytical chemistry。
2024版第08章电分析化学导论

生物组织和体液中的电解质成分与生理状态密切相关。通过 测量生物样本的电导率,可获取有关生物体内部环境的信息。 例如,在临床上可利用血液电导率的测量来辅助诊断某些疾 病。
极谱分析法与伏安分
05
析法
极谱分析法基本原理及操作
基本原理
极谱分析是一种基于电解过程中电极电位与电流关系的 分析方法。在极谱分析中,待测物质在滴汞电极上发生 还原反应,产生极谱电流,通过测量电流与电位的关系, 可以确定待测物质的浓度。
伏安分析法应用举例
伏安分析法可用于测定无机物、有机物和生物样品等物 质的含量。例如,在药物分析中,可以利用伏安分析法 测定药物中的有效成分含量;在生物分析中,可以利用 伏安分析法测定生物样品中的代谢物含量。
现代电分析化学技术
06
进展
生物传感器在电分析中应用
01
生物传感器基本原理
利用生物活性物质(如酶、抗体、细胞等)与待测物质之间的特异性相
互作用,将生物化学反应转化为可测量的电信号。
02
生物传感器在电分析中的应用实例
如葡萄糖生物传感器用于糖尿病患者ቤተ መጻሕፍቲ ባይዱ血糖监测,乳酸生物传感器用于
运动医学中的乳酸测定等。
03
生物传感器的发展趋势
提高选择性、灵敏度和稳定性,实现多组分同时测定和在线实时监测。
微流控芯片技术在电分析中应用
微流控芯片技术基本原理
要点二
库仑分析法应用举例
环境水样中重金属离子的测定、食品中添加剂的测定等。
电导分析法
04
电导率测量原理及方法
电导率定义
01
电导率是物质导电能力的量度,其大小与物质中载流子的浓度
和迁移率有关。
测量原理
电化学分析法导论

铜锌电池的图解表示式为: 铜锌电池的图解表示式为: (1mol·L Zn|ZnSO4(1mol L-1)||CuSO4(1mol·L-1)|Cu Zn|Zn2+(0.1mol·L-1)||H+(1mol·L-1)|H2(101325Pa),Pt
3
(二) 按方法原理可分为三类: 二 按方法原理可分为三类: 1.以电化学参数与待测物含量之间直接关系为基础。如电 .以电化学参数与待测物含量之间直接关系为基础。 导法、电位法、库仑法、 导法、电位法、库仑法、极谱与伏安法等 。 2.转入第二相中进行测定。如电重量分析法。Ag+ →Ag .转入第二相中进行测定。如电重量分析法。 3.以电化学参量变化指示容量分析终点变化。如电位滴定 .以电化学参量变化指示容量分析终点变化。 电导滴定、电流滴定等。 法、电导滴定、电流滴定等。
据能量转换方式亦可分为两类: 据能量转换方式亦可分为两类: 原电池; 能自发地将化学能转化为电能的装置称为原电池 能自发地将化学能转化为电能的装置称为 原电池 ; 而需 要外部电源提供能量迫使电流通过, 要外部电源提供能量迫使电流通过,使电池内部发生电极反应 的装置称为电解池。 的装置称为电解池。 电解池 原电池:化学能 电能; 原电池:化学能——电能; 电能 电解池:电能 电解池:电能——化学能 化学能
5
§8-2.电分析化学的特点及应用
1.分析速度快 电化学分析法一般都具有快速的特点, 电化学分析法一般都具有快速的特点,如极谱分析法 有时一次可以同时测定数种元素, 有时一次可以同时测定数种元素,试样的预处理手续一般 也比较简单,单扫描示波极谱在7s中测一个样品。 7s中测一个样品 也比较简单,单扫描示波极谱在7s中测一个样品。 2. 灵敏度高 电化学分析法适用于痕量组分的分析,如脉冲极谱、 电化学分析法适用于痕量组分的分析,如脉冲极谱、 溶出伏安法和极谱催化波法等都具有非常高的灵敏度, 溶出伏安法和极谱催化波法等都具有非常高的灵敏度,有 的项目可测定浓度低至10-11mol.L-1, 含量为10-7%的组分。 的项目可测定浓度低至10 含量为10 的组分。
分析化学第8章电化学分析导论

8.1 化学电池
一、基本概念 二、电池表达式
电分析化学引论
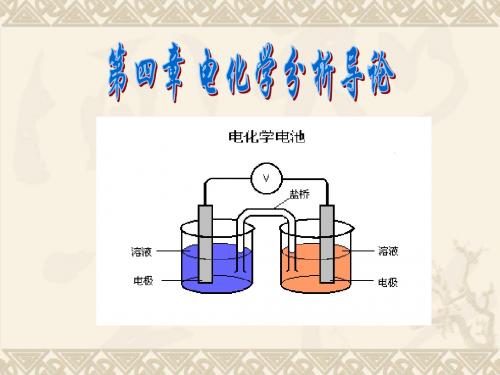
8.3 液接电位及其消除
一、 液接电位的形成 二、 液接电位的消除 盐桥 液接电位的消除—盐桥
8.2 电极电位
一、标准电极电位及其测量 二、Nernst方程式 方程式 三、条件电极电位φΘ’ 条件电极电位
8.4 电极极化与超电位
一、电极的极化 二、去极化 三、超电位η
ai = γ i ci
的活度系数, 单位埃) 其中 γi 为离子 i 的活度系数,与离子电荷 zi、离子大小 å (单位埃 单位埃 和离子强度I)有关: 和离子强度I)有关: 有关
1 I = ∑ci zi2 2
替标准电极电位ϕΘ。
lgγ ± = −0.512z [
2 i
I 1 + Ba I
0
]
实际工作中, 为方便直接求出浓度, 实际工作中 , 为方便直接求出浓度 , 常以条件电极电位 ϕ Θ’ 代
阳极 E 阴极
电池电动势: 电池电动势 E = ϕc - ϕa+ϕ液接 = ϕ右 - ϕ左+ϕ液接
例:铜锌电池,电池符号(-)Zn|ZnSO4(a1)‖CuSO4(a2) |Cu(+)
Zn电 : 电极 Cu电 : 电极 Zn Cu2+ + 2e Zn2+ + 2e Cu Zn2+ + Cu
电池反应: Zn + Cu2+
8.3
液接电位及其消除(Elimination) 液接电位及其消除
一、 液接电位的形成
当两个不同种类或不同浓度的溶液直接接触时, 当两个不同种类或不同浓度的溶液直接接触时,由于浓 度梯度或离子扩散使离子在相界面上产生迁移。 度梯度或离子扩散使离子在相界面上产生迁移。当这种迁移 速率不同时会产生电位差,称产生了液接电位。 速率不同时会产生电位差,称产生了液接电位。 它不是电极反应所产生, 它不是电极反应所产生 , 因此会影响电池电动势的测 定,实际工作中应消除。 实际工作中应消除。
第八章 电位分析法

a内
由于内参比溶液中的H 活度( 是固定的,则 由于内参比溶液中的 +活度 a内)是固定的 则: 是固定的
膜 = K+0.059lg a外
膜 = K - 0.059pH试
结论: 结论: 玻璃电极的膜电位与试样溶液中的pH成 ①玻璃电极的膜电位与试样溶液中的 成 线性关系.式中K是由玻璃电极本身性质 线性关系.式中 是由玻璃电极本身性质 决定的常数; 决定的常数; ②膜电位产生的实质:不是由于电子的得失, 膜电位产生的实质:不是由于电子的得失, 而是H 而是 +离子在溶液和硅胶层界面间进行迁 移的结果. 移的结果.
│← 玻璃电极(指示电极) 玻璃电极(指示电极) →│待测溶液 待测溶液│← 待测溶液 饱和甘汞电极(参比电极) 饱和甘汞电极(参比电极) →│
玻璃 = AgCl/Ag + 膜
L
甘汞
(1)液体接界电位L: 在两种组成不同或浓 )液体接界电位 : 度不同的溶液接触界面上, 度不同的溶液接触界面上,由于溶液中 正负离子扩散通过界面的迁移率不同所产生 的接界电位差. 的接界电位差.
电极本身不参与反 应,只是起传递 电子的作用
3+ Fe
+e
2+ Fe
Fe 3+ /Fe 2+
= Fe3+/Fe2+
θ
aFe + 0.059lg aFe
3+ 2+
四,离子选择性电极
离子选择性电极是利用电极上的 薄膜对特定离子产生选择性响应,以 薄膜对特定离子产生选择性响应, 此来测量和指示溶液中离子活度. 此来测量和指示溶液中离子活度. 具体分类见P206. 具体分类见P206.
金属— 一,金属—金属离子电极 以银电极为例: 以银电极为例: 半电池: 半电池: 电极反应: 电极反应: Ag | Ag+
电化学分析法导论
在我国早期引用Kolthoff 的定义。80年代后,提出的中文定义 为:“依据电化学和分析化学的原理及实验测量技术来获取物 质的质和量及状态信息的一门科学。”
电分析化学的发展具有悠久的历史,是与尖端科学技术 和学科的发展紧密相关的。近代电分析化学,不仅进行组成 的形态和成分含量的分析,而且对电极过程理论,生命科学、 能源科学、信息科学和环境科学的发展具有重要的作用。作 为一种分析方法,早在18世纪,就出现了电解分析和库仑滴 定法。 19世纪,出现了电导滴定法,玻璃电极测pH值和高频滴 定法。 1922年,极谱法问世,标志着电分析方法的发展进入了 新的阶段。 二十世纪六十年代,离子选择电极及酶固定化制作酶电 极相继问世。 二十世纪70年代,发展了不仅限于酶体系的各种生物传 感器之后,微电极伏安法的产生扩展了电分析化学研究的时 空范围,适应了生物分析及生命科学发展的需要。
1、工作电极 2、参比电极 3、辅助电极 或对电极
四、电流的性质与符号 IUPAC规定: 阳极电流:起纯氧化反应所产生的电流,为正值; 阴极电流:起纯还原反应所产生的电流,为负值。 我国习惯: (1)原电池:阳极起氧化反应,为负值 阴极起还原反应,为正值。
Fe 3 , Fe 2 Pt
0 .0591 lg H
第八章--电分析化学导论(2011)

用电位、电流、电导测量装置指示滴定分析过 程中被测组分的浓度变化。
滴定
电参量变化
滴定曲线
计量点
特点: 可用于酸碱、氧化还原、沉淀及络合 滴定的终点指示,可实现自动化,可 用于有色溶液。
可用于测定稀的弱酸和弱碱。
10/68
2.6 电解分析法
在恒电流或控制电位的条件下,被测物在电 极上析出,实现分离及定量测定的方法。
1. 电极电位 2. 液体接界电位 3. 极化与过电位
1. 电极电位
作为电极的金属导体浸入一定的电解质溶液中 将呈现一定的电极电位,电极电位从何而来? 电极电位的产生:在金属与溶液交界面发生了 电荷交换的结果。
31/68
1.1 扩散双电层
将一金属片浸入金属离子的水溶液中,在金
属和溶液界面间会产生 扩散双电层 。
阴极反应:必须使阴极电位比平衡电位更负。 阳极反应:必须使阳极电位比平衡电位更正。 一般而言,析出金属时过电位较小,但当析出 物为气体,尤其是H2和O2时,过电位都很大。
47/68
章节重点:
电极电位的测定方法。 液体接界电位的产生原因及消除方法。 浓差极化的产生原因与消除方法。 电化学极化的产生原因。
1.3 标准电极电位的测定
选择标准氢电极(NHE)作为标准,与被测定电
极构成原电池,并且规定标准氢电极的电位为0,测
得的电动势即为待测电极的电极电位。
Pt,H2(101325 Pa)∣H+ (a=1) ‖待测电极 目前采用的标准电极电位都是相对值,是相对 于标准氢电极的电位而言的。
37/68
Pt,H2(101325 Pa)∣H+ (a=1) ‖待测电极
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
09:25:32
3.极谱法与伏安分析
伏安分析:通过测定特殊条件下的电流—电压曲线来分 析电解质的组成和含量的一类分析方法的总称。
极谱分析:使用滴汞电极的一种特殊的伏安分析法。
09:25:32
交流示波滴定装置
4.电导分析
普通电导分析
原理:依据溶液电导与电解质关系; 应用:高纯水质分析,酸雨监测;
一、电化学分析的特点与学 习方法
characteristics and learning method of electrochemical analysis
二、电化学分析法的类别
classification of electrochemical analytical methods
三、电化学分析的应用领域
09:25:32
4. 电化学分析的学习方法
电化学分析方法繁多,应注意归纳总结。 共性问题:
溶液的电化学性质;电极性质;基本原理;一般来说, 溶液产生的电信号与检测对象的活度有关;应用均可分为直 接法和滴定(电化学装置作为终点显示装置)。
个性问题: (1)电位分析:离子选择电极与膜电位 (2)电解分析:电解过程中有电流的变化 (3)极谱分析:浓差极化 重点掌握:原理、特点与应用
09:25:32
5. 电化学分析的学习参考资料
(1)《电化学分析导论》,科学出版社,高小霞等,1986 (2)《电化学分析》,中国科大出版社,蒲国刚等,1993 (3)《电分析化学》,北师大出版社,李启隆等,1995 (4)《近代分析化学》,高等教育出版社,朱明华等,1991
09:25:32
二、电化学分析法的类别
09:25:32
第二节 化学电池
chemical cell
原电池:化学电池能自发地将本身 的化学能转变成电能。
电解池:如果实现电化学反应的能 量是由外电源提供,则这种化学电 池称电解池。
电池工作时,电流必须在电池内部和 外部流过,构成回路。 溶液中的电流:正、负离子的移动。
09:25:32
三、电池的表示方法
(1)灵敏度、准确度高,选择性好 被测物质的最低量可以达到10-12mol/L数量级。
(2)电化学仪器装置较为简单,操作方便 直接得到电信号,易传递,尤其适合于化工生产中的自动
控制和在线分析。 (3)应用广泛
传统电化学分析:无机离子的分析; 测定有机化合物也日益广泛; 有机电化学分析;药物分析; 电化学分析在药物分析中也有较多应用。 生物活体分析。
第八章 电分析化学导论
an introduction to electro-chemical analysis
09:25:32
本章教学导读
第一节 电分析化学法概述 第二节 化学电池 第三节 电极电位与液接电位 第三节 电极的种类
09:25:32
第一节
电分析化学法 概 述
generalization of electrochemical analysis
2. 电化学分析法的重要特征
(1)直接通过测定电流、电位、电导、电量等物理量, 在溶液中有电流或无电流流动的情况下,来研究、确定参与 反应的化学物质的量。
(2)依据测定电参数分别命名各种电化学分析方法: 如电位分析法、电解分析法;
(3)依据应用方式不同可分为:直接法和间接法。
09:25:32
3. 电化学分析法的特点
Zn|ZnSO4(Xmol· L-1)‖CuSO4(Ymol·L-1)|Cu 规定:
E 电池电动势计算 池 右 — 左
E池=正值 反应自发进行 E池=负值 不能自发进行
原电池 电解池
正、负极是物理学上的分类,正极—电势高的电极, 负极—电势低的电极,是电子聚集多的电极; 阴、阳极是化学上常用的称呼,阳极—发生氧化反应, 阴极—发生还原反应。
高频电导分析
特点:溶液与电极不直接接触;
09:25:32
三、电化学分析的应用领域
application fields of electrochemical analysis
1.化学平衡常数测定 2.化学反应机理研究 3பைடு நூலகம்化学工业生产流程中的监测与自动控制 4.环境监测与环境信息实时发布 5.生物、药物分析 6.活体分析和监测(超微电极直接刺入生物体内)
application field of electrochemical analysis
一、 电化学分析的特点与学习方法
characteristics and learning method of electrochemical analysis
1. 什么是电化学分析
根据物质在溶液中所呈现的电化学性质及其变化来测定 物质组成及含量的分析方法。
习惯分类方法(按测量的电化学参数分类): (1)电导分析法:测量电导值; (2)电位分析法:测量电动势; (3)电解(电重量)分析法:测量电解过程电极上析出物重量 ; (4)库仑分析法:测量电解过程中的电量; (5)伏安分析:测量电流与电位变化曲线; (6)极09:2谱5:3分2 析:使用滴汞电极时的伏安分析。
09:25:32
2.电解与库仑分析法
电解分析: 在恒电流或控制电位 条件下,使被测物质在电极上析出,实 现定量分离测定目的的方法。
电重量分析法: 电解过程中在阴 极上析出的物质量通常可以用称重的方 法来确定。
库仑分析法: 依据法拉第电解定 律,由电解过程中电极上通过的电量确 定电极上析出的物质量的分析方法
1. 电位分析法
直接电位法: 电极电位与溶液中电活 性物质的活度有关,通过测量溶液的电 动势,根据能斯特方程计算被测物质的 含量;
电位滴定法: 用电位测量装置指示 滴定分析过程中被测组分的浓度变 化,通过记录或绘制滴定曲线来确 定滴定终点的分析方法。
研制各种高灵敏度、高选择性的电极是电位分析 法最活跃的研究领域之一。
classification of electrochemical analytical methods
电化学分析的分类方法 按IUPAC的推荐,可分为三类: (1)不涉及双电层,也不涉及电极反应。电导分析。 (2)涉及双电层,但不涉及电极反应。 电位分析法。 (3)涉及电极反应。电解、库仑、极谱、伏安分析等。
