第八章 第九章 物理化学教学文稿
物 理 化 学 课程教案 - 安庆师范学院

第八章电解质溶液教学目的与要求:使学生了解和掌握理解离子在外电场下的迁移情况,明确电导、电导率、摩尔电导率、迁移数、离子淌度与离子独立移动定律等概念及其关系式,了解强电解质溶液的德拜—尤格尔互吸理论、翁萨格电导理论的基本观点与公式推导,强电解质溶液的化学势的表示方法,了解离子活度、平均活度、和平均活度系数的概念。
重点与难点:离子在外电场下的迁移情况,电导、电导率、摩尔电导率等概念,迁移数、离子淌度与离子独立移动定律等概念及其关系式,强电解质溶液的德拜—尤格尔互吸理论、翁萨格电导理论的基本观点与公式推导,强电解质溶液的化学势的表示方法,了解离子活度、平均活度、和平均活度系数的概念。
电化学是研究电能与化学能相互转化以及相关规律的科学。
电化学在各行业中的应用:1.电解金属、冶炼―电解铜以及其他金属,电镀。
电解法合成化学物质。
2.化学电源—化学电池。
3.金属的腐蚀机理研究及腐蚀的防护。
4.在基础理论研究中的应用。
电化学科学的内容:电解质溶液理论,可逆电化学过程,非平衡电化学过程。
§8.1电化学的基本概念和法拉第定律基本概念导体的分类:第一类导体(电子导电体),金属,石墨,导电能力随温度的升高而降低。
第二类导体(离子导体),电解质溶液,导电能力随温度的升高而增加。
电化学装置:电解池,将电能转化为化学能的装置。
原电池:将化学能转化为电能的装置。
电极的分类:正极和负极――以电势高低来划分。
阴极和阳极――以电极反应来划分。
电化学装置的结构和特点:电解池:(1)CuCl溶液的电解电极反应:阳极(氧化) ()()g Cl e aq Cl 221→+-阴极(还原)()s Cu e Cu 21212→++总反应:()()g Cl s Cu CuCl22212121+→离子的迁移方向:正离子向负极移动,负离子向正极移动(离子受电场力的作用)。
电池: 44CuSO ZnSO -电池电池反应:正极(阴极) ()()s Cu e aq Cu →++22负极(阳极) ()()aq Zne s Zn +→-22总反应 ()()()()s Cu aq Zn aq Cu s Zn +→+++22离子的迁移方向:正离子向正极移动,负离子向负极移动(离子受化学 力的作用)。
物理化学第八章 界面现象
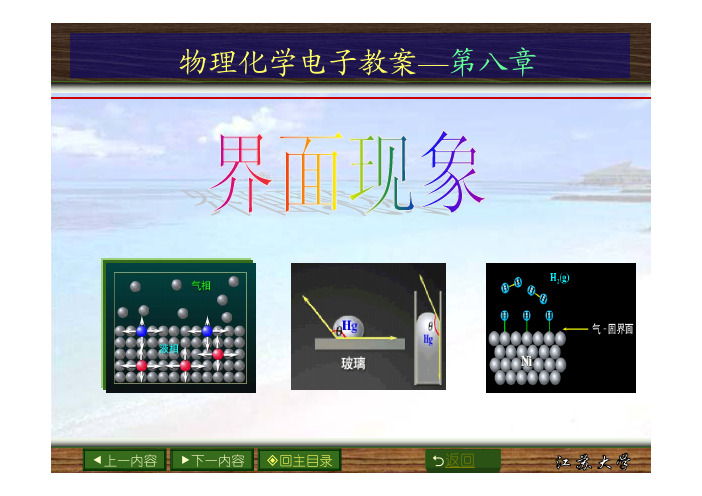
物理化学电子教案—第八章e上一内容f下一内容回主目录2返回表面和界面(surface and interface)界面是指两相接触的约几个分子厚度的过渡 区,若其中一相为气体,这种界面通常称为表面。
严格讲表面应是液体和固体与其饱和蒸气之间 的界面,但习惯上把液体或固体与空气的界面称为 液体或固体的表面。
常见的界面有:气-液界面,气-固界面,液-液 界面,液-固界面,固-固界面。
e上一内容 f下一内容 回主目录2返回表面和界面(surface and interface)常见的界面 有: 1. 气-液界面e上一内容f下一内容回主目录2返回表面和界面(surface and interface)2.气-固界面e上一内容f下一内容回主目录2返回表面和界面(surface and interface)3.液-液界面e上一内容f下一内容回主目录2返回表面和界面(surface and interface)4.液-固界面e上一内容f下一内容回主目录2返回表面和界面(surface and interface)5.固-固界面e上一内容f下一内容回主目录2返回界面现象的本质表面层分子与内部分子相比,它们所处的环境不同。
体相内部分子所受四周邻近相同分子的作用力是对 称的,各个方向的力彼此抵销; 但是处在界面层的分子,一方面受到体相内相同 物质分子的作用,另一方面受到性质不同的另一相中 物质分子的作用,其作用力未必能相互抵销,因此, 界面层会显示出一些独特的性质。
对于单组分体系,这种特性主要来自于同一物质 在不同相中的密度不同;对于多组分体系,则特性来 自于界面层的组成与任一相的组成均不相同。
e上一内容 f下一内容 回主目录2返回界面现象的本质最简单的例子是液体及其蒸气组成的表面。
液体内部分子所受的力可以 彼此抵销,但表面分子受到体相 分子的拉力大,受到气相分子的 拉力小(因为气相密度低),所 以表面分子受到被拉入体相的作 用力。
2、《物理化学》教学大纲(化学专业)

《物理化学》课程教学大纲一、课程基本信息(一)课程中文名称:物理化学(二)课程英文名称:Physical Chemistry(三)课程代码:(四)课程属性及模块:专业必修课(五)授课学院:理学院(六)开课学院:理学院(七)教材及参考书目教材:《物理化学》(第五版)上册,傅献彩,沈文霞等编,高等教育出版社,2005年《物理化学》(第五版)下册,傅献彩,沈文霞等编,高等教育出版社,2006年参考书:《物理化学核心教程》(第二版),沈文霞编,科学出版社,2009年《物理化学》,万洪文,詹正坤主编,高等教育出版社,2009年《物理化学简明教程》(第四版),印永嘉等编,高等教育出版社,2009年《物理化学学习指导》,孙德坤沈文霞等编,高等教育出版社,2009年《物理化学核心教程学习指导》,沈文霞等编,科学出版社,2009年《化学热力学基础》,李大珍编,北京师范大学出版社,1982年《物理化学》,朱文涛编,清华大学出版社,1995年《物理化学教程》(修订版),姚允斌,朱志昂编,湖南科技出版社,1995年(八)课程定位及课程简介《物理化学》是化学及相关学科的理论基础。
是化学、化工、冶金、材料等专业本科生必修的专业主干基础课之一。
它是从化学现象与物理现象的联系入手,借助数学、物理学等基础科学的理论及其提供的实验手段,来探求化学变化中最具普遍性的基本规律的一门学科。
它是先行课程无机化学、分析化学、有机化学普适规律的理论归纳和定量探讨,是后续专业知识深造和科研工作的理论基础,也是连接化学与其它学科的桥梁。
(九)课程设计基本理念依据“以学生为中心”的教育教学理念,本课程的教学目的主要是:(1)使学生在已学过的一些先行课程(无机化学、有机化学、分析化学、高等数学、普通物理学)的基础上,对化学运动作理论和定量探讨。
(2)使学生能系统地掌握物理化学的基本知识和基本原理,加深对自然现象本质的认识;(3)使学生学会物理化学的科学思维方法,培养学生提出问题、研究问题的能力,培养他们获取知识并用来解决实际问题的能力。
物理化学课程简介及教学大纲

“物理化学”课程简介及教学大纲课程代码:课程名称:物理化学课程类别:学科基础课总学时/学分:80 / 3+2 (其中含实验或实践学时:48 )开课学期:每学年第一和第二学期适用对象:化工类专业本科生先修课程:高等数学、普通物理学、无机化学、分析化学和有机化学内容简介:物理化学也称为理论化学,是化学的重要分支之一。
物理化学是用数学和物理学的方法研究化学中最具有普遍性的一般规律。
本课程介绍研究化学变化和相变化的平衡规律和化学反应的速率规律的宏观层次理论方法,从微观到宏观层次的研究方法和多相系统的研究方法等。
包括热力学三大定律和基本方程、统计热力学、多组分系统热力学、相平衡、化学平衡、电化学、化学反应动力学、表面现象和胶体等。
一、课程性质、目的和任务【课程性质】物理化学是学生在具备了必要的高等数学、普通物理、无机化学、分析化学等基础知识之后必修的理论基础课,是应用化学、化学工程、生物化学等专业的一门主干基础理论课程,同时也是后继化学专业课程的基础。
【教学目的】通过本课程的学习使学生建立一个系统、完整的物理化学基本理论和方法的框架,掌握热力学、动力学、电化学、统计热力学中的普遍规律和实验方法;在强化基础的同时,逐步培养学生的思维能力和创造能力。
【教学任务】本课程共分十章:热力学第一定律、热力学第二定律、统计热力学初步、溶液理论、相平衡、化学平衡、电化学、化学动力学、表面现象、胶体化学。
本课程重点在于化学基础理论、基本知识的教学,在阐述基本原理时应着重讲清整个问题的思路、介绍问题的提出背景和形成理论的思维方法,使学生学到有关知识的同时能学到探索问题的思路和方法,培养解决问题的能力;在基础层次上选择有代表性的科学研究成果和实际,着眼于前沿涉及的新思想和新方法。
二、课程教学内容及要求绪论§ 1物理化学的学科特点和发展史§2物理化学的研究内容和研究方法§ 3 必要的数学知识§4物理化学的学习方法和学习要求【基本要求】1. 了解学生的心理特点和学科特点,探讨物理化学的学习方法,使学生确立学好物理化学的信心。
物理化学思电子教案—第九章

由此可看出,用平滑铂电极时,实际的 E分解 常大于E理论 。 即使将溶液、导线和接触点的电阻降到可忽略不计的程度,分
解电压还是大于原电池电动势。这主要是由于析出电极电势偏
离平衡电极电势的原因。为了对每一个电极上的过程进行深入 的研究,应当研究电流密度与电极电势的关系。
平衡电极电势 析出电极电势
E理论 实际E分解
此电池的电动势与外加电压相反,称为反电动势。
下面分析一下电流-电压曲线:
当开始施加外电压时,
几乎无电流通过,阴、阳极
电 流
上无H2 (g) 和Cl2(g)放出。
I
3
随着E的增大,电极表面
产生少量氢气和氯气,但压 力低于大气压,无法逸出。
2
1
所产生的氢气和氯构成了
E分解
电压E
原电池,外加电压必须克服这 测定分解电压时的电流-电压曲线 反电动势,继续增加电压,I
实际分解电压
要使电解池顺利地进行连续反应,除了克服作 为原电池时的可逆电动势外,还要克服由于极化在 阴、阳极上产生的超电势 (阴 ) 和 (阳 ) ,以及克服电 池电阻所产生的电位降 I R 。这三者的加和就称为实 际分解电压。
E ( 分 解 ) E ( 可 逆 ) E ( 不 可 逆 ) I R
电解质 浓度 c / mol ·dm-3 电解产物
E分解 /V
E理论/ V
HCl
1
HNO3
1
H2SO4
0.5
NaOH
1
CdSO4
0.5
NiCl2
0.5
H2 + Cl2
1.31
1.37
H2 + .67
1.23
H2 + O2
《无机化学》电子教案

《无机化学》电子教案第一章:绪论1.1 课程介绍了解无机化学的定义、范围和重要性了解无机化学的发展历程和现状了解无机化学与其他学科的联系1.2 基本概念物质、元素、化合物、离子、分子等基本概念原子结构、电子排布、离子键、共价键等基本概念1.3 化学方程式化学方程式的表示方法和平衡原理化学反应的类型和特点第二章:原子结构与元素周期律2.1 原子结构原子核的结构和组成电子云和电子轨道原子的大小和质量2.2 元素周期律元素周期表的排列原理和结构主族元素、过渡元素和稀有气体元素的特点元素周期律的应用2.3 化学键离子键的形成和特点共价键的形成和特点金属键的形成和特点第三章:氧化还原反应3.1 氧化还原反应的基本概念氧化还原反应的定义和特点氧化剂、还原剂、氧化数等基本概念3.2 电子转移和电荷守恒电子转移的类型和特点电荷守恒定律的应用3.3 氧化还原反应的平衡和动力学氧化还原反应的平衡常数和影响因素氧化还原反应的动力学原理和方法第四章:溶液与离子反应4.1 溶液的基本概念溶液的定义和分类溶剂的选择和溶解能力4.2 离子反应的基本概念离子反应的定义和特点离子反应的类型和规律4.3 离子反应的平衡和动力学离子反应的平衡常数和影响因素离子反应的动力学原理和方法第五章:化学键与晶体结构5.1 化学键的类型和特点离子键的形成和特点共价键的形成和特点金属键的形成和特点5.2 晶体结构的基本概念晶体的定义和分类晶格和晶胞的结构5.3 晶体结构的类型和特点离子晶体的结构特点和性质共价晶体的结构特点和性质金属晶体的结构特点和性质第六章:有机化学基础6.1 有机化合物的基本概念有机化合物的定义和特点有机化合物的命名规则6.2 有机化合物的结构碳原子的四价键特性有机化合物的立体化学6.3 有机化合物的性质有机化合物的物理性质有机化合物的化学性质第七章:有机化学反应7.1 有机化合物的合成反应加成反应、消除反应、取代反应等基本反应类型有机合成策略和催化方法7.2 有机化合物的分解反应热分解、光分解、氧化分解等反应类型有机化合物的稳定性7.3 有机化合物的转化反应醇、醚、酮等官能团的转化反应芳香族化合物的反应第八章:分析化学基础8.1 分析化学的基本概念分析化学的目标和任务分析化学的方法和分类8.2 定量分析方法滴定分析、原子吸收光谱法、质谱法等数据处理和误差分析8.3 定性分析方法光谱分析、色谱分析、电化学分析等定性分析的步骤和技巧第九章:物理化学基础9.1 热力学基本概念系统、状态、过程等基本概念能量、功、热量等基本物理量9.2 热力学定律热力学第一定律和第二定律熵和自由能的概念9.3 动力学基本概念反应速率和平衡常数化学动力学的级数和机理第十章:化学实验技能10.1 实验基本操作实验仪器的使用和维护实验安全常识和事故处理10.2 实验方案的设计与实施实验目的和步骤的制定实验数据的记录和分析实验报告的结构和内容实验结果的图表展示和讨论重点和难点解析重点环节1:原子结构与元素周期律原子结构的理解和电子轨道的概念是理解后续化学反应的基础。
物理化学-第九章 胶体-教案

稳定性等特征决定了其基本性质。本章重点介绍了其光学性质(丁达尔效应)、动力学性质(布朗运动、扩散)
和电学性质(电泳、电渗);此外还介绍了溶胶的稳定与聚沉,电解质对溶胶稳定与聚沉的影响。
溶胶的特征:1)特定分散度:1~100nm。2)高度分散多相性。3)热力学不稳定性。
第二部分、简介:本章主要内容(多媒体介绍)1mi;溶胶的基本特征及重要性质(动力性质、
光学性质、电学性质)
本章目的要求:(多媒体介绍)1min
掌握胶体的概念、基本类型;溶胶的基本特征;溶胶的动力性质、光学性质、电学性质。
熟悉溶胶的分类;憎液溶胶相对稳定的原因。
通过两个实验来观察胶体的电学性质。电泳以及电渗。
电动现象说明:溶胶质点与介质分别带电,在电场中发生移动(流动电势),或移动时产生电场(流动电势)
并介绍电泳的应用。
四、溶胶的稳定性与聚沉
说明:溶胶是热力学不稳定系统,但在动力学上又是稳定的原因。
强调:溶胶稳定的原因:
1.动力稳定性(扩散力)。2.胶粒表面带电(静电斥力)。3.溶剂化作用。4.添加高分子保护。
3.溶胶有哪些性质?4.胶粒发生布朗运动的实质是什么?
课后作业:P342—7, 10
附:指导教师意见
指导教师签名:年月日
昆明医科大学海源学院基础教学部化学教研室
溶胶的性质:1)光学性质:丁达尔现象。2)动力学性质:布朗运动。3)电学性质:溶胶胶粒和介质都带电。
热力学不稳定,动力学稳定的原因:1)热力学因素:高分散度,比表面能大,有自发聚集倾向。2)动力学因素:动力稳定性,表面带电,溶剂化,添加高分子保护。
物理化学说课学习教案

03物理化学是研究物质的物理现象和化学变化之间关系的科学,是化学的重要分支。
物理化学的定义包括热力学、动力学、电化学、表面化学、胶体化学等,涉及物质的结构、性质、能量转化和反应机理等方面。
物理化学的研究内容物理化学是化学的理论基础,对于深入理解化学现象和本质,以及推动化学学科的发展具有重要意义。
物理化学在化学科学中的地位物理化学课程概述01知识目标掌握物理化学的基本概念和原理,理解物质的结构、性质、能量转化和反应机理等方面的知识。
02能力目标具备运用物理化学知识分析和解决问题的能力,以及进行实验设计和数据处理的能力。
03素质目标培养学生的科学思维、创新意识和实践能力,提高学生的综合素质和适应未来发展的能力。
教学目标与要求教材选用及特点教材选用选用国内外知名物理化学教材,如《物理化学》、《Physical Chemistry》等。
教材特点系统性强,内容全面,注重理论与实践的结合,强调物理化学在各个领域的应用。
同时,教材配备了丰富的例题、习题和实验内容,有助于学生巩固知识和提高能力。
胶体化学与界面现象胶体的制备与性质,界面现象如吸附、润湿等。
原电池、电解池的工作原理,电极过程动力学等。
化学平衡沉淀溶解平衡、酸碱平衡、配位平衡等。
热力学基础包括热力学第一、第二定律的阐述,以及其在物理化学中的应用。
化学动力学基础反应速率的定义,速率方程和反应机理的介绍。
教学内容安排通过教师的系统讲解,使学生掌握物理化学的基本概念和原理。
讲授法鼓励学生提出问题和观点,通过小组讨论和全班交流,深化对知识点的理解。
讨论法通过实验操作和数据分析,培养学生的实践能力和科学思维。
实验法利用PPT 、动画、视频等多媒体手段,使抽象的理论知识更加形象生动。
多媒体辅助教学法教学方法与手段难点:热力学第二定律的理解和应用,复杂反应的动力学分析,多相平衡的计算。
•针对热力学第二定律,通过具体实例和计算加深理解。
•在多相平衡计算中,注重基本概念的讲解和计算方法的训练。
《物理化学教案》

《物理化学教案》word版第一章:引言1.1 教案目标让学生了解物理化学的定义和研究范围。
使学生了解物理化学在实际生活和科学研究中的应用。
1.2 教学内容物理化学的定义和研究范围。
物理化学的实际应用举例。
1.3 教学方法采用讲授法,讲解物理化学的定义和研究范围。
采用案例分析法,分析物理化学在实际生活中的应用。
1.4 教学步骤引入新课,讲解物理化学的定义和研究范围。
分析物理化学在实际生活中的应用,如气象、材料、能源等领域的应用。
1.5 作业与评估让学生写一篇关于物理化学在实际生活中的应用的小论文。
对学生的论文进行评估,了解学生对物理化学应用的理解程度。
第二章:热力学第一定律2.1 教案目标让学生理解热力学第一定律的定义和表达式。
使学生能够运用热力学第一定律解决实际问题。
2.2 教学内容热力学第一定律的定义和表达式。
热力学第一定律的实际应用。
2.3 教学方法采用讲授法,讲解热力学第一定律的定义和表达式。
采用例题解析法,分析热力学第一定律的实际应用。
2.4 教学步骤引入新课,讲解热力学第一定律的定义和表达式。
通过例题解析,让学生掌握热力学第一定律的应用方法。
2.5 作业与评估让学生解决一些实际问题,运用热力学第一定律进行计算。
对学生的作业进行评估,了解学生对热力学第一定律的理解程度。
第三章:理想气体状态方程3.1 教案目标让学生理解理想气体状态方程的定义和表达式。
使学生能够运用理想气体状态方程解决实际问题。
3.2 教学内容理想气体状态方程的定义和表达式。
理想气体状态方程的实际应用。
3.3 教学方法采用讲授法,讲解理想气体状态方程的定义和表达式。
采用例题解析法,分析理想气体状态方程的实际应用。
3.4 教学步骤引入新课,讲解理想气体状态方程的定义和表达式。
通过例题解析,让学生掌握理想气体状态方程的应用方法。
3.5 作业与评估让学生解决一些实际问题,运用理想气体状态方程进行计算。
对学生的作业进行评估,了解学生对理想气体状态方程的理解程度。
物理化学电子教案第八章

上一内容 下一内容 回主目录
2020/10/22
反应速率(rate of reaction)
现以合成氨的气相等容反应为例 N2+3H2=2NH3
上一内容 下一内容 回主目录
2020/10/22
反应速率(rate of reaction)
• 应当指出:
1. 凡提到反应速率时,必须指明反应的计量方程式。
(2) Cl H2 HCl H (3) H Cl2 HCl Cl (4) 2Cl M Cl2 M
k2[Cl][H2 ] k3[H][Cl2 ] k4[Cl]2[M]
上一内容 下一内容 回主目录
2020/10/22
总包反应(overall reaction)
我们通常所写的化学方程式只代表反应的化学 计量式,而并不代表反应的真正历程。如果一个 化学计量式代表了若干个基元反应的总结果,那 这种反应称为总包反应或总反应。
热力学与动力学的关联
虽然热力学和动力学是研究化学反应的两个独立步骤, 但它们之间并非是毫无关联的。如果没有热力学的预言,
上一内容 下一内容 回主目录
2020/10/22
8.1 化学动力学的任务和目的
则动力学的研究将是盲目的,有些反应,可以用测量热 效应的方法来研究反应速率(如细胞的新陈代谢、水泥 的水合过程、环氧树脂的固化等);而对另外一些反应, 可用动力学的方法来测定热力学函数值,如燃烧过程中 的重要自由基C2H*的生成热可借助动力学方法测量(由 于自由基C2H*的活性很高、寿命短,无法用热力学方法 测量)。
R P
速度
速率
d[R] 0 dt
d[P] 0 dt
d[R] d[P] 0 dt dt
上一内容 下一内容 回主目录
物理化学》电子教案上册

《物理化学》电子教案上册第一章:引言1.1 课程介绍了解物理化学的课程背景、意义和目的。
理解物理化学的基本概念和研究方法。
1.2 物理化学的发展历程回顾物理化学的发展历程,了解其重要里程碑和成就。
介绍著名物理化学家和他们对物理化学的贡献。
1.3 学习目标和要求明确学习目标,包括知识、技能和态度。
提出学习要求,包括课堂参与、作业和考核。
第二章:物质的量与状态2.1 物质的量引入物质的量的概念,解释摩尔和阿伏伽德罗常数。
学习物质的量的计算和转换,包括摩尔质量、物质的量浓度等。
2.2 状态介绍理想气体状态方程,理解压力、体积和温度之间的关系。
学习物质的相变,包括固态、液态和气态的性质和变化。
2.3 物质的量与状态的计算练习计算物质的量与状态之间的关系,包括理想气体状态方程的运用。
分析实际问题,应用物质的量与状态的计算方法。
第三章:热力学第一定律3.1 能量守恒定律复习能量守恒定律的基本原理,理解能量的转化和守恒。
学习能量的单位和国际制,了解能量的量纲和换算关系。
3.2 内能和热量引入内能的概念,理解内能的定义和计算方法。
学习热量的传递方式,包括传导、对流和辐射。
3.3 热力学第一定律阐述热力学第一定律的内容,理解能量守恒与热力学第一定律的关系。
应用热力学第一定律解决实际问题,进行能量的计算和分析。
第四章:热力学第二定律4.1 熵的概念引入熵的概念,解释熵的定义和物理意义。
学习熵的计算方法和熵变的表达式。
4.2 热力学第二定律的表述阐述热力学第二定律的不同表述,包括熵增原理和克劳修斯定律。
理解热力学第二定律的本质和意义。
4.3 热力学第二定律的应用学习热力学第二定律在实际问题中的应用,包括热机和制冷机的效率计算。
分析热力学第二定律对自然界和工程实践的影响。
第五章:溶液的性质5.1 溶液的定义和组成引入溶液的概念,理解溶液的组成和特点。
学习溶质和溶剂的分类及它们之间的相互作用。
5.2 溶液的浓度和渗透压介绍溶液的浓度表示方法,包括摩尔浓度和质量浓度。
物理化学电子教案第九章
靠坐标原点(O点)一方,随着原子核间距变小,势能急剧升高,是一个陡峭的势能峰。
在D点方向,随着rAB和rBC的增大,势能逐渐升高,这平缓上升的能量高原的顶端是三个孤立原子的势能,即D点。
反应物R经过马鞍点T到生成物P,走的是一条能量最低通道。
势能面投影图
三原子分子的核间距
势能面
对于反应:
令∠ABC=180o, EP=EP(rAB,rBC)。
随着核间距rAB和rBC的变化,势能也随之改变。
这些不同点在空间构成高低不平的曲面,称为势能面,如图所示。
势能面
图中R点是反应物BC分子的基态,随着A原子的靠近,势能沿着RT线升高,到达T点形成活化络合物。
随着C原子的离去,势能沿着TP线下降,到P点是生成物AB分子的稳态。
D点是完全离解为A,B,C原子时的势能;OEP一侧,是原子间的相斥能,也很高。
势能面
势能面的类型
目前常见的势能面有两种:
一种是Eyring和Polanyi利用London对三原子体系的量子力学势能近似式画出的势能面称为London-Eyring-Polanyi势能面,简称LEP势能面。
理论的共同点是:首先选定一个微观模型,用气体分子运动论(碰撞理论)或量子力学(过渡态理论)的方法,并经过统计平均,导出宏观动力学中速率系数的计算公式。
由于所采用模型的局限性,使计算值与实验值不能完全吻合,还必须引入一些校正因子,使理论的应用受到一定的限制。
两个分子的一次碰撞过程
碰撞参数用来描述粒子碰撞激烈的程度,通常用字母b表示。
通过A球质心,画平行于 的平行线,两平行线间的距离就是碰撞参数b 。数值上:
在硬球碰撞示意图上,A和B两个球的连心线 等于两个球的半径之和,它与相对速度 之间的夹角为 。
物理化学电子教案第九章
扩散双电层模型
电极表面
2
d
x
接触电势
电子逸出功 —— 电子从金属表面逸出时,
为了克服表面势垒必须做的功。
逸出功的大小既与金属材料有关,又与金属 的表面状态有关。
不同金属相互接触时,由于电子的逸出功不 同,相互逸入的电子数不同,在界面上电子分布 不均匀,由此产生的电势差称为接触电势。
液体接界电势
组成可逆电池的必要条件
Zn(s)|ZnSO4||HCl|AgCl(s) | Ag(s)
作原电池 净反应
() 1 Zn(s) 1 Zn2+ e
2
2
() AgCl(s) e Ag(s) Cl
1 Zn(s) AgCl(s) 1 Zn2 Cl Ag(s)
2
2
作电解池
阴极: 1 Zn2 e 1 Zn(s)
2
2
O (g) 2
4H (a )
4e
2H 2 O(l)
O (g) 2H O 4e 4OH (a )
2
2
Cl (a ) | Cl (g) | Pt
2
Na (a )ㅣNa(Hg)(a)
Cl (g) 2e 2Cl (a )
2
Na+ (a ) nHg(l) e = Na(Hg)(a)
第二类电极的电极反应
2
2
阳极:Ag(s) Cl AgCl(s) e
净反应:
Ag(s)
1 2
ZnCl2
1 2
Zn(s)
AgCl(s)
可逆电极的类型
⑴第一类电极
金属与其阳离子组成的电极 氢电极 氧电极 卤素电极 汞齐电极
⑵第二类电极
金属-难溶盐及其阴离子组成的电极 金属-难溶氧化物电极
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第八章电解质溶液4.在298K时,用Ag∣AgCl为电极,电解KCl的水溶液。
通电前溶液中KCl的质量分数为ω(KCl)=1.4941*10-3,通电后在质量为120.99g的阴极部溶液中ω(KCl)=1.9404*10-3,串联在电路中的银库伦计有160.24mg的Ag(s)沉积出来。
试分别求K+和Clˉ的迁移数。
解:通电后,阴极部含K+的物质的量为==mol=3.149*10-3moln终通电前后,阴极部水的量不变。
则可设通电前阴极部溶液的质量为m,通电前:m水=m-m*ω(KCl)= m-m*1.9404*10-3通电后:m水=m-m*ω(KCl)=120.99-120.99*1.9404*10-3则有:m-m*1.9404*10-3=120.99-120.99*1.9404*10-3得:m =故:通电前阴极部KCl的质量为m(KCl)=m*ω(KCl)= *1.4941*10-3=0.1807g则通电前,阴极部含K+的物质的量为n始= =mol= 2.424*10-3 mol通电前后,阴极部K+的物质的量的变化仅是由K+的迁入所引起的由n终=n始+n迁-n电得:n迁=n终-n始+n电= 3.149*10-3mol-2.424*10-3 mol+0 = 7.25*10-4mol 由库伦计可得:n电= = mol=1.485*10-3mol所以K+和Cl-的迁移数分别为:t(K+)= = =0.49t(Cl-)= 1-0.49=0.516.以银为电极点解氰化银钾(KCN+AgCN)溶液时,Ag(s)在阴极上析出。
每通过1mol电子的电荷量,阴极部失去1.40mol的Ag+和0.80mol的CN-,得到0.60mol的K+。
试求:(1)氰化银钾络合物的化学表示式[Ag n(CN)m]z-中n,m,z的值。
(2)氰化银钾络合物中正负离子的迁移数。
解:(1)通电时,配离子移向阳极,每通过1mol电子的电荷量,应有1mol Ag+在阴极还原析出,据题意,则有(1.4-1.0)mol的Ag+与CN-配合称负离子移向阳极,同时,阴极部失去0.8mol的CN-,所以:=故:n =1,m = 2,z =1(2)由题意可知:n电=1mol,n迁=0.6mol,故:t(K+)= =0.6t[Ag(CN)2]- =1-t(K+)=1-0.6=0.48.298K时,在用界面移动法测定离子迁移数的迁移管中,首先注入一定浓度的某有色离子溶液,然后在其上面小心的注入浓度为0.01065 mol/dm3的HCl水溶液,使其间形成一明显的分界面。
通入11.54 mA的电流,历时22 min,界面移动了15cm。
已知迁移管的内径为1.0cm,试求H+的迁移数。
解:H+迁移的物质的量为:n迁 = CV =C*(πr2)*h=0.01065*103*3.1415*(0.5*10-2)2*15*10-2mol=1.255*10-4mol则,H+的迁移数为:t(H+)= = = =0.79511.用实验测定不同浓度KCl溶液的电导率的标准方法为:273.15K时,在(1),(2)两个电导池中分别盛以不同液体并测其电阻。
当在(1)中盛Hg(l)时,测得电阻为0.99895Ω[1Ω是273.15K时,截面积为1.0mm2,长为1062.936mm的Hg(l)的电阻]。
当(1)和(2)中均盛以浓度约为3mol/dm3的H2SO4溶液时,测得(2)的电阻为(1)的0.107811倍。
若在(2)中盛以浓度为1.0mol/dm3的KCl溶液时,测得电阻为17565Ω。
试求:(1)电导池(1)的电导池常数。
(2)在273.15K时,该KCl溶液的电导率。
解:(1)由R=ρ*Hg的电阻率ρ==Ω/m=9.408*10-7Ω/m则对于电导池(1)有:R=ρ=ρ*K cell(1)=9.408*10-7Ω/m *K cell(1)=0.99895Ω得:K cell(1)=1.062*106m-1(2)由K cell=κ*R 得且两电导池溶液相同则κ1=κ2= = ==得 K cell(2)=1.145*105m-1则,在273.15K时,该KCl 溶液的电导率为κ= = S/m=6.519S/m14.在某电导池中先后充以浓度为0.001mol/dm3的HCl,NaCl和NaNO3,分别测得电阻为468Ω,1580Ω和1650Ω。
已知NaNO3溶液的摩尔电导率为Λm(NaNO3)=1.21*10-2S﹒m2﹒mol-1,设这些都是强电解质,其摩尔电导率不随浓度而变。
试计算:(1)浓度为0.001mol/dm3的NaNO3溶液的电导率。
(2)该电导池的常数K cell。
(3)此电导池如充以浓度为0.001mol﹒dm-3 HNO3溶液时的电阻及该HNO3溶液的摩尔电导率。
解:(1)NaNO3溶液的电导率为:κ=Λm(NaNO3)*c =1.21*10-2*0.001*103 S﹒m-1=1.21*10-2S﹒m-1(2)电导池常数为:K cell =κ(NaNO3)* R(NaNO3)=1.21*10-2 *1650 m-1 =19.97m-1(3)Λm(HNO3)=Λm(H+)+Λm(NO3-)=[Λm(H+)+Λm(Cl-)]+[Λm(Na+)+Λm(NO3-)]-[Λm(Na+)+Λm(Cl-)]=Λm(HCl)+Λm(NaNO3)-Λm(NaCl)其中:Λm(HCl)= = = S﹒m2﹒mol-1=4.27*10-2S﹒m2﹒mol-1 Λm(NaCl)= = = S﹒m2﹒mol-1=1.26*10-2S﹒m2﹒mol-1故:Λm(HNO3)=Λm(HCl)+Λm(NaNO3)-Λm(NaCl)=4.27*10-2 S﹒m2﹒mol-1+1.21*10-2S﹒m2﹒mol-1-1.26*10-2 S﹒m2﹒mol-1 =4.22*10-2S﹒m2﹒mol-1则R(HNO3)= = = =473Ω15.298K时测得SrSO4饱和水溶液的电导率为κ(SrSO4)=1.482*10-2S﹒m-1,该温度时水的电导率为κ(H2O)=1.496*10-4S﹒m-1,试计算在该条件下SrSO4在水中的饱和溶液的浓度。
解:由题可知:κ(SrSO4)=κ(溶液)-κ(H2O)=(1.482*10-2-1.496*10-4)S﹒m-1=1.467*10-2S﹒m-1同时有:κ(SrSO4)=Λm(SrSO4)*c(SrSO4)=1.467*10-2 S﹒m-1其中:Λm(SrSO4)=2Λm(SrSO4)=2[Λm(Sr2+)+Λm(SO42-)]=2(59.46*10-4+79.8*10-4)S﹒m2﹒mol-1 =2.785*10-2S﹒m2﹒mol-1故:c(SrSO4)= = mol﹒m-3=0.5268mol﹒m-318.根据如下数据,求H2O(l)在298K时解离城H+和OH-并达到平衡时的解离度和离子积常数K wΘ,已知298K时,纯水的电导率为κ(H2O)=5.5*10-6S﹒m-1,Λm∞(H+)=3.498*10-2S﹒m2﹒mol-1,Λm∞(OH-)=1.98*10-2 S﹒m2﹒mol-1,水的密度为997.09kg﹒m-3解:纯水的无限稀释摩尔电导率为:Λm∞(H2O)=Λm∞(H+)+Λm∞(OH-)=(3.498*10-2+1.98*10-2)S﹒m2﹒mol-1=5.478*10-2S﹒m2﹒mol-1纯水的摩尔电导率为:Λm(H2O)= = = S﹒m2﹒mol-1=9.94*10-11S﹒m2﹒mol-1 故水的解离度为:а= = =1.815*10-9K wΘ=﹒ =其中:c(H+)=c(OH-)=c(H2O)﹒а=﹒а= *1.815*10-9mol﹒m3=1.004*10-4mol﹒m3=1.004*10-7mol﹒dm3故:K wΘ= =(1.004*10-7)2=1.009*10-1419.在298K时,浓度为0.01mol﹒dm3的CH3COOH溶液在某电导池中测得其电阻为2220Ω,已知该电导池常数为K cell=36.7m-1,试求在该条件下CH3COOH的解离度和解离平衡常数。
解:由K cell=κ﹒R得:κ(HAc)= = =1.65*10-2S﹒m-1则:Λm(HAc)== S﹒m2﹒mol-1=1.65*10-3S﹒m2﹒mol-1而:Λm∞(HAc)=Λm∞(H+)+Λm∞(Ac-)=(3.4982+0.409)*10-2S﹒m2﹒mol-1 =3.9072*10-2 S﹒m2﹒mol-1故:а= = =0.0422KаΘ= = = 1.86*10-524.分别计算下列各溶液的离子强度,设所有电解质的浓度均为0.025mol﹒kg-1(1)NaCl (2)MgCl2 (3)CuSO4 (4)LaCl3(5)NaCl和LaCl3的混合溶液,浓度各为0.025mol﹒kg-1解:I=Σm B z B2(1)I= (0.025*12+0.025*(-1)2)mol﹒kg-1=0.025mol﹒kg-1(2)I=(0.025*22+0.025*2*(-1)2)mol﹒kg-1=0.75mol﹒kg-1(3)I=(0.025*22+0.025*(-2)2)mol﹒kg-1=0.10mol﹒kg-1(4)I=(0.025*32+0.025*3*(-1)2)mol﹒kg-1=0.15 mol﹒kg-1(5)I=(0.025*12+0.025*32+0.025*4*(-1)2)mol﹒kg-1=0.175 mol﹒kg-125.分别计算下列两个溶液的离子平均质量摩尔浓度m±,离子平均活度a±以及电解质的活度a B,浓度均为0.01mol﹒kg-1(1)NaCl(γ±=0.904) (2)K2SO4(γ±=0.715)(3)CuSO4(γ±=0.444) (4)K3[Fe(CN)6](γ±=0.571)解:(1)m±=(m+ν+m-ν-)1/ν=(0.011*0.011)1/2mol﹒kg-1=0.01mol﹒kg-1a±= =0.904*0.01=9.04*10-3a B=(a±)ν=(9.04*10-3)2=8.17*10-5(2)m±=(m+ν+ m-ν-)1/ν=(0.022*0.011)1/3mol﹒kg-1=0.01587 mol﹒kg-1a±= =0.715*0.01587=1.135*10-2a B=(a±)ν=(1.135*10-2)3=1.462*10-6(3) m±=(m+ν+ m-ν-)1/ν=(0.011*0.011)1/2mol﹒kg-1=0.01 mol﹒kg-1a±= =0.01*0.444=4.44*10-3a B=(a±)ν=(4.44*10-3)2=1.971*10-5(4) m±=(m+ν+ m-ν-)1/ν=(0.033*0.011)1/4mol﹒kg-1=2.28*10-2mol﹒kg-1a±= =0.571*2.28*10-2=1.302*10-2a B=(a±)ν=(1.302*10-2)4=2.874*10-830.在298K时,醋酸HAc的解离平衡常数为KΘ=1.8*10-5,试计算在下列不同情况下醋酸在浓度为1.0mol﹒kg-1时的解离度。
