初中化学物质间的相互转化关系总结
初中化学知识点归纳化学反应中的电子转移和离子转移

初中化学知识点归纳化学反应中的电子转移和离子转移初中化学知识点归纳:化学反应中的电子转移和离子转移化学反应是化学变化过程中发生的一种现象,它可以用来解释物质之间的相互作用和转化。
在化学反应中,电子转移和离子转移是两种常见的转化方式。
本文将从理论基础、反应类型和应用等方面对化学反应中的电子转移和离子转移进行归纳。
一、电子转移电子转移反应是指在化学反应中,发生氧化还原过程时,电子从一个物质转移到另一个物质的过程。
电子转移反应可以分为两类:氧化反应和还原反应。
1. 氧化反应氧化反应是指物质中的元素或化合物失去电子的过程。
氧化反应中,电子从被氧化物转移到氧化剂上。
常见的氧化反应有金属与非金属氧化物反应、金属与非金属的氧化酸性氧化反应等。
以金属与非金属氧化物反应为例:Cu + O2 -> CuO在这个反应中,铜原子失去了2个电子,被氧化为铜离子(Cu2+);氧化剂氧气则接受了这两个电子。
2. 还原反应还原反应是指物质中的元素或化合物获得电子的过程。
还原反应中,电子从还原剂转移到被还原物上。
常见的还原反应有金属离子的还原反应、非金属离子的还原反应等。
以金属离子的还原反应为例:Zn2+ + 2e- -> Zn在这个反应中,锌离子(Zn2+)接受了两个电子,被还原为锌原子。
二、离子转移离子转移反应是指在化学反应中,正离子和负离子之间发生离子的交换过程。
离子转移反应常见于酸碱中和反应和盐类生成反应。
1. 酸碱中和反应酸碱中和反应是指酸和碱反应产生盐和水的反应。
其中,酸是指能够释放氢离子(H+),碱是指能够释放氢氧化物离子(OH-)的物质。
酸碱反应中,H+离子和OH-离子结合生成水,同时生成盐。
以硫酸和氢氧化钠的反应为例:H2SO4 + 2NaOH -> Na2SO4 + 2H2O在这个反应中,硫酸中的氢离子和氢氧化钠中的氢氧化物离子组成水,生成盐Na2SO4。
2. 盐类生成反应盐类生成反应是指反应中离子的交换产生盐的反应。
中考复习 [初中化学解题思路与训练] 酸、碱、盐、氧化物之间的相互转化
![中考复习 [初中化学解题思路与训练] 酸、碱、盐、氧化物之间的相互转化](https://img.taocdn.com/s3/m/04286a7ace2f0066f53322c9.png)
第12讲酸、碱、盐、氧化物之间的相互转化【知识要点】1.单质、氧化物、酸、碱、盐之间的相互转化关系金属单质→某些金属氧化物→碱→盐例如:Ca→CaO→Ca(OH)2→CaCO3非金属单质某些非金属氧化物→酸→盐盐例如:C→CO2→H2CO3→CaCO3酸、碱、盐溶液之间可以发生复分解反应。
判断酸、碱、盐溶液中两种化合物之间能发生复分解反应的依据是:反应物互相交换成分,生成的另外两种化合物中有一种是沉淀或是气体或是水。
某些非金属氧化物可与水发生化合反应生成对应的酸,如CO2、SO3。
CO2+H2O==H2CO3SO3+H2O==H2SO4某些金属氧化物可以与水发生化合反应生成对应的可溶性碱,如CaO、Na2O等。
CaO+H2O==Ca(OH)2Na2O+H2O==2NaOH2.化学反应的现象之一是颜色的变化,要熟记一些常见物质的颜色(1)溶液的颜色①蓝色溶液:含Cu2+的溶液,如CuSO4溶液、CuCl2溶液(带绿色)。
②浅绿色溶液:含Fe2+的溶液,如FeSO4溶液、FeCl2溶液。
(2)沉淀的颜色①不溶于水也不溶于稀硝酸的白色沉淀物是AgCl、BaSO4。
②不溶于水但能溶于酸,且能产生大量气泡,生成的气体能使澄清石灰水变浑浊的白色沉淀物是CaCO3、MgCO3、BaCO3。
⑤不溶于水的蓝色沉淀物是Cu(OH)2。
④不溶于水的红褐色沉淀物是Fe(OH)3。
⑤不溶于水的白色沉淀物是Mg(OH)2、Al(OH)3。
【试题精析】1.(2009年广州)A、B、C、D、E五瓶无色透明溶液,分别是HCl溶液、Na2CO3溶液、MgCl2溶液、NaNO3溶液、NaOH溶液中的一种。
分别进行下列实验:I.将A分别滴入B、C、D、E中,均没有明显现象。
II.将B分别滴入A、C、D、E中,C、E中均产生白色沉淀,其余没有明显现象。
III.将C分别滴入A、B、D、E中,B中产生白色沉淀,D中有气泡冒出,其余没有明显现象。
初中化学知识点归纳物质的分子的转化和物质的离子的转化

初中化学知识点归纳物质的分子的转化和物质的离子的转化初中化学知识点归纳:物质的分子转化和物质的离子转化化学是研究物质的性质、组成以及变化规律的科学领域。
在初中化学学习中,我们将重点关注物质的分子转化和物质的离子转化。
本文将对这两个知识点进行归纳和总结。
一、物质的分子转化1. 分子的组成和性质分子是由两个或更多原子通过共享电子而形成的。
不同物质的分子由不同种类的原子组成,并且各有特定的化学性质。
例如,在水分子(H2O)中,两个氢原子与一个氧原子通过共享电子结合在一起,形成了一个稳定的分子。
2. 化学反应中的分子转化化学反应是物质发生变化的过程。
在化学反应中,原有的分子会分解或重新组合,形成新的物质。
例如,当燃气与氧气反应时,它们的分子将发生转化,生成二氧化碳和水。
化学方程式可以用来描述这个过程:CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)这里的(g)表示气体的状态。
3. 物质的存在状态和分子转化物质在不同的条件下会存在不同的存在状态,如固体、液体和气体。
在分子转化的过程中,物质的存在状态也会发生变化。
例如,当水升华时,液态水分子会转化为气态水分子,而在水的冷凝过程中,气态水分子会重新转化为液态水分子。
二、物质的离子转化1. 离子的组成和性质离子是由失去或获得电子的原子或分子形成的带电粒子。
阳离子带有正电荷,而阴离子带有负电荷。
离子的形成通常发生在电离过程中,其中能量的输入使得原子或分子中的电子发生转移。
2. 电离和离子化电离是指原子或分子中的一个或多个电子被移出,形成带电的离子。
在水中,许多化合物会发生电离反应,形成离子溶液。
例如,氯化钠溶解在水中会产生钠离子(Na+)和氯离子(Cl-):NaCl(s) → Na+(aq) + Cl-(aq)这里的(s)和(aq)分别表示固体和溶液的状态。
3. 离子反应和化学方程式离子在化学反应中的转化通常涉及离子之间的组合、分解和交换。
这些反应可以用化学方程式来表示。
九年级上册科学第二章物质的转化难题梳理

物质的转化专题一、物质间的转化规律一些金属氧化物(如氧化钾、氧化钙、氧化钠、氧化钡)可以与水反应生成可溶性碱,但对应的碱不能加热分解生成金属氧化物和水。
难溶性碱(如氢氧化铜)可以加热分解生成金属氧化物和水,但对应的金属氧化物不能与水反应生成相应的碱。
两种情况不能混淆。
铁单质与溶液反应只能生成正二价铁离子(浅绿色),氧化铁与酸反应后的产物中铁元素显正三价(黄色)。
1、下表所列各组物质中,物质之间按箭头方向通过一步反应就能实现如图所示转化的是()2、甲、乙、丙、丁四种物质在一定条件下能发生如下反应:甲+乙丙+丁(1)若甲、丙为化合物,乙、丁为单质,则上述反应的基本反应类型是,写出一个符合该反应类型的方程式:。
(2)若甲、乙、丙、丁均为化合物,且甲溶液呈蓝色,乙为烧碱,则乙的化学式为,反应发生时观察到的现象是。
(3)若甲、乙、丙、丁均为化合物,且丙为水,丁为盐,则该反应(“一定”或“不一定”)是中和反应,理由是。
(4)若甲、乙、丙为化合物,丁为单质,且乙、丙是组成元素相同的气体,该反应在工业上的用途是。
3、下列物质是初中化学中常见物质,其相互转化关系如图(气体D是一种剧毒性气体,部分生成物和反应条件省略).请回答:(1)物质D的化学式为;(2)溶液H中的溶质属于(选填“单质”、“氧化物”、“酸”、“碱”或“盐”);(3)反应①的化学方程式为,反应②的化学方程式可能是.专题二、C、H2、CO还原金属氧化物在还原金属氧化物实验中,通入的气体(如H2、CO等)要“早出晚归”,这是为了防止可燃性气体与空气混合加热发生爆炸。
酒精灯(或酒精喷灯)要“迟到早退”,这是为了防止反应得到的灼热的金属(如Cu、Fe等)被空气中的氧气重新氧化。
物质制备时要注意一是选择的反应发生的速率要适中,二是反应物是否常见易得,三是生成物易分离。
工业上还应考虑成本。
1、如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是()A. 甲实验试管口向下倾斜可防止氢气逸出B. 乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生C. 甲、乙两实验中,都应先通入气体,再使试管、玻璃管均匀受热,以防止发生爆炸D. 甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应2、用以下装置进行H2、C、CO还原CuO的实验并检验产物。
第二节 单质、氧化物、酸、碱、盐相互转化规律

第2节 单质、氧化物、酸、碱、盐相互转化规律知识回顾各物质都具有一定的性质,同时各物质之间都相互联系,即有一定的相互转化规律。
1.金属(1)与氧气反应生成金属氧化物。
如:MgO O Mg 222点燃+;CuO O Cu 222∆+(2)活泼金属与酸反应生成盐和氢气。
如:↑+==+2442H FeSO SO H Fe ;↑+==+222H MgCI HCI Mg 金属与盐溶液反应生成新盐和新金属。
如:44FeSO Cu CuSO Fe +==+;Ag NO Cu Cu AgNO 2)(2233+==+。
2.非金属(1)与氧气反应生成非金属氧化物。
如:O H O H 22222点燃+;22SO O S 点燃+(2)与金属反应生成无氧酸盐。
NaCI CI Na 222点燃+;FeS S Fe ∆+3.碱性氧化物(1)与水反应生成碱。
如:22)(OH Ca O H CaO ==+。
(2)与酸反应生成盐和水。
如:O H SO Fe SO H O Fe 234242323)(3+==+(3)与酸性氧化物反应生成含氧酸盐。
如:32CaSiO SiO CaO 高温+4.酸性氧化物(1)与水反应生成酸。
如:3222CO H O H CO ==+。
(2)与碱反应生成盐和水。
如:O H CaCO OH Ca CO 2322)(+↓==+(3)与碱性氧化物反应生成含氧酸盐。
如:32CaSiO SiO CaO 高温+5.酸(1)与活泼金属反应生成盐和氢气。
如:↑+==+2442H ZnSO SO H Zn(2)与碱性氧化物反应生成盐和水。
如:O H FeCI HCI O Fe 2332326+==+。
(3)与碱反应生成盐和水。
如:4224222SO Na O H NaOH SO H +==+(4)与某些盐反应生成新盐和新酸。
如:33HNO AgCI AgNO HCI +↓==+6.碱(1)与酸性氧化物反应生成盐和水。
如: O H SO Na SO NaOH 2+==+(2)与酸反应生成盐和水。
初中化学物质与性质知识点总结

初中化学物质与性质知识点总结化学是一门研究物质和物质之间相互转化的科学。
在化学学习的过程中,我们需要掌握物质与性质之间的关系,这对于理解化学现象和解决实际问题具有重要的意义。
本文将针对初中化学中物质与性质的知识点进行总结。
一、物质的分类在化学中,物质可以分为纯物质和混合物两大类。
纯物质是由同种类型的粒子组成的物质,能够通过化学方法进行进一步的分解。
混合物是由不同种类型的粒子组成的物质,不能通过化学方法进行分解。
纯物质又可分为元素和化合物。
元素是由由具有相同原子数目的原子组成的物质,化合物是由不同种类的元素通过化学反应结合而成。
二、物质的性质物质的性质可以分为物理性质和化学性质两类。
1.物理性质物理性质是物质本身的性质,不改变物质的组成。
常见的物理性质包括颜色、形状、硬度、密度、熔点、沸点等。
通过观察这些物理性质,我们可以对物质进行初步的鉴别和分类。
2.化学性质化学性质是物质与其他物质发生化学反应时所表现出的性质。
化学性质常常与物质的组成和结构有关。
例如,金属与非金属的化合物在化学性质上有明显的差异,金属常具有良好的导电性和导热性,而非金属则常具有不良导电性和导热性。
三、物质之间的相互转化在化学反应中,物质可以发生不同的转化过程。
以下列举几种常见的物质之间的转化方式:1.原子与离子的转化通过化学反应,原子可以失去或获得电子,从而转化为离子。
离子具有电荷,根据电荷的正负,离子可以分为阳离子和阴离子。
离子转化常常伴随着物质的化学性质的变化。
2.金属与非金属的转化金属和非金属在化学性质上有着明显的差异。
金属与非金属的化合物常常通过氧化还原反应进行转化。
金属通常会失去电子生成阳离子,而非金属则会接受电子生成阴离子。
3.酸与碱的中和反应酸和碱是化学中常见的两类物质。
其中,酸可以释放氢离子(H+),碱可以释放氢氧根离子(OH-)。
当酸和碱按一定的比例混合时会发生中和反应,生成盐和水。
四、物质的保存定律化学反应中物质的质量是不会发生变化的,这就是物质的保存定律。
初中化学物质间的相互转化关系总结

初中化学物质间的相互转化关系总结
一、物质分类
1、合成反应
合成反应是将两种或以上的原料物质或物质组合成一种新物质的化学反应。
如,饱和的氯气与水混合反应,会形成氯化氢:
Cl2+H2O→HCl+HClO。
2、分解反应
分解反应是将一种物质分解成两种或以上的物质,它的原料也是一种物质。
如,水解硫酸铵,会分解成硫酸和氨气:NH4HSO4→NH3+H2SO4
3、变性反应
变性反应在原料不变的情况下,对物质进行一系列的变化。
如,氧化反应是通过氧化剂对另一种物质进行氧化,从而产生一种新的物质。
如铁粉(氧化剂)+柠檬汁(被氧化物)→柠檬汁(氧化后)+Fe2O3
二、物质间的相互转化关系
1、氧、氢和水之间的相互转化
氧气与氢气的反应能够产生水,即2H2+O2=2H2O。
水可以通过电解反应分解成水分子的氢原子和氧原子,即2H2O=2H2+O2
2、碳和氧的相互转化
碳(C)与氧(O2)可以通过燃烧反应产生二氧化碳(CO2):
C+O2=CO2、二氧化碳能够通过光合作用被转化为有机物质,如糖:
CO2+H2O→C6H12O6+O2
3、硫化物和酸的相互转化
硫化物与酸可以通过熔融硫酸盐反应产生硫酸,如:
2Na2S+H2SO4→Na2SO4+2H2S。
硫酸可以由含硫的碱性物质中通过水解反应分解成硫化物,如:2NaHSO4→Na2S+H2SO4。
初中化学知识点归纳物质的三态及其转化

初中化学知识点归纳物质的三态及其转化初中化学知识点归纳:物质的三态及其转化物质的三态指的是固态、液态和气态。
不同的物质在不同的条件下会呈现出不同的物态。
本文将对物质的三态及其转化进行简单的归纳和介绍。
一、固态固态是物质最常见的一种物态,其特点是分子排列相对紧密、间距较小且相互之间保持着一定的排列规律。
固态物质不易变形,有一定的形状和体积,即固定的容积和形状。
同时,在固态下,分子的运动较为有限,只是微小振动。
固态物质的两个重要概念是晶体和非晶体。
晶体是由原子、分子或离子按照一定的规则排列而成的,具有明显的平面面对称性和长距离周期性。
非晶体则没有明显的长程周期性,分子之间的排列较为无序。
二、液态液态是另一种常见的物质物态,其特点是分子之间相互间距比较大,能够流动。
液态物质的形状受容器限制,但体积能够变化。
在液态状态下,分子的运动比固态更为剧烈,有较大幅度的运动和相互之间的碰撞。
液态物质可以通过升温或者降温来改变其状态,比如水在常温下是液态,但当温度升高到100摄氏度时,水会沸腾变为气态;相反,当水温降到0摄氏度以下时,水则会结冰变为固态。
三、气态气态是物质的另一种常见状态,其特点是分子之间的间距比较大,分子的运动速度非常快。
气态物质没有固定的形状和体积,会充满整个容器,并且可以自由扩散和均匀混合。
气态物质的状态转化主要基于温度和压力的变化。
当温度升高或者压力降低时,物质会从液态转变为气态,这个过程称为蒸发或汽化。
相反,如果温度降低或者压力升高,气态物质会冷却并且凝结成液态或固态。
四、物质的三态转化物质的三态之间可以通过改变温度和压力来实现相互转化。
例如,固体可以通过加热使其升温转化为液体,这个过程称为熔化;液体通过降温可以转化为固体,这个过程称为凝固。
相应地,气体可以通过降温和增加压力来转化为液体,这个过程称为冷凝;液体通过加热可以转化为气体,这个过程称为汽化。
物质的三态转化与相变热密切相关,相变热是物质在状态转化过程中吸收或者释放的热量。
初三化学 化学方程式汇总以及物质之间的转化

初中化学方程式大全【化合反应】1、镁在空气中燃烧:2Mg+O22MgO2、铁在氧气中燃烧:3Fe+2O2Fe3O43、铝在空气中燃烧:4Al+3O22Al2O34、氢气在空气中燃烧:2H2+O22H2O5、红磷在空气中燃烧:4P+5O22P2O56、硫粉在空气中燃烧: S+O2SO27、碳在氧气中充分燃烧:C+O2CO28、碳在氧气中不充分燃烧:2C+O22CO9、二氧化碳通过灼热碳层: C+CO22CO10、一氧化碳在氧气中燃烧:2CO+O22CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O H2CO312、生石灰溶于水:CaO+H2O Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl22NaCl【分解反应】15、实验室用双氧水制氧气:2H2O2 2H2O+O2↑16、加热高锰酸钾:2KMnO4 K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O 2H2↑+O2↑18、碳酸不稳定而分解:H2CO3H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3CaO+CO2↑【置换反应】20、铁和硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu21、锌和稀硫酸反应(实验室制氢气):Zn+H2SO4ZnSO4+H2↑22、镁和稀盐酸反应:Mg+2HClMgC l2+H2↑23、氢气还原氧化铜:H2+CuO Cu+H2O24、木炭还原氧化铜:C+2CuO 2Cu+CO2↑25、水蒸气通过灼热碳层:H2O+C H2+CO26、焦炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑【其他】27.氢氧化钠溶液与硫酸铜溶液反应:2NaOH+CuSO4Cu(OH)2↓+Na2SO428、甲烷在空气中燃烧:CH4+2O2CO2+2H2O29、酒精在空气中燃烧:C2H5OH+3O22CO2+3H2O30、一氧化碳还原氧化铜:CO+CuO Cu+CO231、一氧化碳还原氧化铁:3CO+Fe2O32Fe+3CO232、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO2==CaCO3↓+H2O33、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+CO2Na2CO3+H2O34、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3+2HClCaCl2+H2O+CO2↑35、碳酸钠与浓盐酸反应(泡沫灭火器的原理):Na2CO3+2HCl2NaCl+H2O+CO2↑一.物质与氧气的反应:⑴单质与氧气的反应:1. 镁在空气中燃烧:2Mg+O22MgO2. 铁在氧气中燃烧:3Fe+2O2Fe3O43. 铜在空气中受热:2Cu+O22CuO4. 铝在空气中燃烧:4Al+3O22Al2O35. 氢气中空气中燃烧:2H2+O22H2O6. 红磷在空气中燃烧:4P+5O22P2O57. 硫粉在空气中燃烧: S+O2SO28. 碳在氧气中充分燃烧:C+O2CO29. 碳在氧气中不充分燃烧:2C+O22CO ⑵化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O22CO211. 甲烷在空气中燃烧:CH4+2O2CO2+2H2O12. 酒精在空气中燃烧:C2H5OH+3O22CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分解:2H2O 2H2↑+O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3 2CuO+H2O+CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 2KCl+3O2↑16. 加热高锰酸钾:2KMnO4K2MnO4+ MnO2 +O2↑17. 碳酸不稳定而分解:H2CO3 H2O+CO2↑18. 高温煅烧石灰石:CaCO3 CaO+CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+CuO Cu+H2O20. 木炭还原氧化铜:C+2CuO 2Cu+CO2↑21. 焦炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑22. 焦炭还原四氧化三铁:2C+Fe3O43Fe+2CO2↑23. 一氧化碳还原氧化铜:CO+CuO Cu+CO224. 一氧化碳还原氧化铁:3CO+Fe2O32Fe+3CO225. 一氧化碳还原四氧化三铁:4CO+Fe3O43Fe+4CO2四.单质、氧化物、酸、碱、盐的相互关系⑴金属单质 + 酸 -------- 盐 + 氢气(置换反应)26. 锌和稀硫酸Zn+H2SO4ZnSO4+H2↑27. 铁和稀硫酸Fe+H2SO4FeSO4+H2↑28. 镁和稀硫酸Mg+H2SO4MgSO4+H2↑29. 铝和稀硫酸2Al+3H2SO4Al2(SO4)3+3H2↑30. 锌和稀盐酸Zn+2HCl ZnCl2+H2↑31. 铁和稀盐酸Fe+2HCl FeCl2+H2↑32. 镁和稀盐酸Mg+2HCl MgCl2+H2↑33. 铝和稀盐酸2Al+6HCl2AlCl3+3H2↑⑵金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu35. 锌和硫酸铜溶液反应:Zn+CuSO4ZnSO4+Cu36. 铜和硝酸汞溶液反应:Cu+Hg(NO3)2Cu(NO3)2+Hg⑶碱性氧化物 +酸 -------- 盐 + 水37. 氧化铁和稀盐酸反应:Fe2O3+6HCl2FeCl3+3H2O38. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4Fe2(SO4)3+3H2O39. 氧化铜和稀盐酸反应:CuO+2HCl CuCl2+H2O40. 氧化铜和稀硫酸反应:CuO+H2SO4CuSO4+H2O41. 氧化镁和稀硫酸反应:MgO+H2SO4MgSO4+H2O42. 氧化钙和稀盐酸反应:CaO+2HCl CaCl2+H2O⑷酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH+CO2Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH+SO2Na2SO3+H2O 45.苛性钠吸收三氧化硫气体:2NaOH+SO3Na2SO4+H2O 46.消石灰放在空气中变质:Ca(OH)2+CO2CaCO3↓+H2O47. 消石灰吸收二氧化硫:Ca(OH)2+SO2CaSO3↓+H2O⑸酸 + 碱———盐 + 水48.盐酸和烧碱起反应:HCl+NaOH NaCl+H2O49. 盐酸和氢氧化钾反应:HCl+KOH KCl+H2O50.盐酸和氢氧化铜反应:2HCl+Cu(OH)2CuCl2+2H2O51. 盐酸和氢氧化钙反应:2HCl+Ca(OH)2CaCl2+2H2O52. 盐酸和氢氧化铁反应:3HCl+Fe(OH)3FeCl3+3H2O53.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3AlCl3+3H2O54.硫酸和烧碱反应:H2SO4+2NaOH Na2SO4+2H2O55.硫酸和氢氧化钾反应:H2SO4+2KOH K2SO4+2H2O56.硫酸和氢氧化铜反应:H2SO4+Cu(OH)2CuSO4+2H2O57.硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3Fe2(SO4)3+ 6H2O58.硝酸和烧碱反应:HNO3+NaOH NaNO3+H2O⑹酸 + 盐 -------- 另一种酸 + 另一种盐59.大理石与稀盐酸反应:CaCO3+2HCl CaCl2+H2O+CO2↑60.碳酸钠与稀盐酸反应: Na2CO3+2HCl2NaCl+H2O+CO2↑61.碳酸镁与稀盐酸反应: MgCO3+2HCl MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反应:HCl+AgNO3AgCl↓+HNO363.硫酸和碳酸钠反应:Na2CO3+H2SO4Na2SO4+H2O+CO2↑64.硫酸和氯化钡溶液反应:H2SO4+BaCl2BaSO4↓+2HCl⑺碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH+CuSO4Cu(OH)2↓+Na2SO4 66.氢氧化钠与氯化铁:3NaOH+FeCl3Fe(OH)3↓+3NaCl 67.氢氧化钠与氯化镁:2NaOH+MgCl2Mg(OH)2↓+2NaCl68. 氢氧化钠与氯化铜:2NaOH+CuCl2Cu(OH)2↓+2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3CaCO3↓+2NaOH⑻盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl+AgNO3AgCl↓+NaNO3 71.硫酸钠和氯化钡:Na2SO4+BaCl2BaSO4↓+2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+H2O H2CO373.生石灰溶于水:CaO+H2O Ca(OH)274.氧化钠溶于水:Na2O+H2O2NaOH75.三氧化硫溶于水:SO3+H2O H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O CuSO4+5H2O77.无水硫酸铜作干燥剂:CuSO4+5H2O CuSO4·5H2O化学方程式【反应现象应用】2Mg+O22MgO剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O22HgO银白液体、生成红色固体拉瓦锡实验2Cu+O22CuO红色金属变为黑色固体4Al+3O22Al2O3银白金属变为白色固体3Fe+2O2Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热C+O2CO2剧烈燃烧、白光、放热、使石灰水变浑浊S+O2SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O22H2O淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O22P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O22H2O+CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O22H2O+4CO2蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO32KCl+3O2↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4 K2MnO4+MnO2+O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgO 2Hg+O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O 2H2↑+O2↑水通电分解为氢气和氧气电解水Cu2(OH)2CO32CuO+H2O+CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3NH3↑+H2O+CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4Fe+H2SO4FeSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4MgSO4+H2↑有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4Al2(SO4)3+3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H22Fe+3H2O红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H23Fe+4H2O黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2W+3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2Mo+3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl22NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H 2+Cl22HCl 苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH Cu(OH)2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C+O22CO煤炉中常见反应、空气污染物之一、煤气中毒原因2CO+O22CO2蓝色火焰煤气燃烧C+CuO 2Cu+CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 4Fe+3CO2↑冶炼金属Fe3O4+2C 3Fe+2CO2↑冶炼金属C+CO22COCO2+H2O H2CO3碳酸使石蕊变红证明碳酸的酸性H 2CO3CO2↑+H2O石蕊红色褪去Ca(OH)2+CO2CaCO3↓+H2O澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2Ca(HCO3)2白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2CaCO3↓+H2O+CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3 Na2CO3+H2O+CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3CaO+CO2↑工业制备二氧化碳和生石灰CaCO3+2HCl CaCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4Na2SO4+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl2NaCl+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl MgCl2+H2O+CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO+CO Cu+CO2黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO 2Fe+3CO2冶炼金属原理Fe3O4+4CO 3Fe+4CO2冶炼金属原理WO3+3CO W+3CO2冶炼金属原理CH3COOH+NaOH CH3COONa+H2O2CH3OH+3O22CO2+4H2OC 2H5OH+3O22CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4Cu+FeSO4银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4Fe+MgSO4溶液由浅绿色为无色Cu+Hg(NO3)2Hg+Cu(NO3)2Cu+2AgNO32Ag+Cu(NO3)2红色金属表面覆盖一层银白色物质镀银Zn+CuSO4Cu+ZnSO4青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl2FeCl3+3H2O铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl2AlCl3+3H2O白色固体溶解Na2O+2HCl2NaCl+H2O白色固体溶解CuO+2HCl CuCl2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HCl ZnCl2+H2O白色固体溶解MgO+2HCl MgCl2+H2O白色固体溶解CaO+2HCl CaCl2+H2O白色固体溶解NaOH+HCl NaCl+H2O白色固体溶解Cu(OH)2+2HCl CuCl2+2H2O蓝色固体溶解Mg(OH)2+2HCl MgCl2+2H2O白色固体溶解Al(OH)3+3HCl AlCl3+3H2O白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl FeCl3+3H2O红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl CaCl2+2H2OHCl+AgNO3AgCl↓+HNO3生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4Al2(SO4)3+3H2O白色固体溶解CuO+H2SO4CuSO4+H2O黑色固体溶解、溶液呈蓝色ZnO+H2SO4ZnSO4+H2O白色固体溶解MgO+H2SO4MgSO4+H2O白色固体溶解2NaOH+H2SO4Na2SO4+2H2OCu(OH)2+H2SO4CuSO4+2H2O蓝色固体溶解Ca(OH)2+H2SO4CaSO4+2H2OMg(OH)2+H2SO4MgSO4+2H2O白色固体溶解2Al(OH)3+3H2SO4Al2(SO4)3+3H2O白色固体溶解2Fe(OH)3+3H2SO4Fe2(SO4)3+3H2O红褐色沉淀溶解、溶液呈黄色Ba(OH)2+H2SO4BaSO4↓+2H2O生成白色沉淀、不溶解于稀硝酸检验SO42-的原理BaCl2+H2SO4BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42-的原理Ba(NO3)2+H2SO4BaSO4↓+2HNO3生成白色沉淀、不溶解于稀硝酸检验SO42-的原理Na2O+2HNO32NaNO3+H2O白色固体溶解CuO+2HNO3Cu(NO3)2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HNO3Zn(NO3)2+H2O白色固体溶解MgO+2HNO3Mg(NO3)2+H2O白色固体溶解CaO+2HNO3Ca(NO3)2+H2O白色固体溶解NaOH+HNO3NaNO3+H2OCu(OH)2+2HNO3Cu(NO3)2+2H2O蓝色固体溶解Mg(OH)2+2HNO3Mg(NO3)2+2H2O白色固体溶解Al(OH)3+3HNO3Al(NO3)3+3H2O白色固体溶解Ca(OH)2+2HNO3Ca(NO3)2+2H2OFe(OH)3+3HNO3Fe(NO3)3+3H2O红褐色沉淀溶解、溶液呈黄色3NaOH+H3PO43H2O+Na3PO43NH3+H3PO4(NH4)3PO42NaOH+CO2Na2CO3+H2O吸收CO、O2、H2中的CO22NaOH+SO2Na2SO3+H2O 2NaOH+SO3Na2SO4+H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH Fe(OH)3↓+3NaCl溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH Al(OH)3↓+3NaCl有白色沉淀生成MgCl2+2NaOH Mg(OH)2↓+2NaClCuCl2+2NaOH Cu(OH)2↓+2NaCl溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O Ca(OH)2白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2CaSO3↓+H2O有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3CaCO3↓+2NaOH有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3BaCO3↓+2NaOH有白色沉淀生成Ca(OH)2+K2CO3CaCO3↓+2KOH有白色沉淀生成CuSO4·5H2O CuSO4+5H2O蓝色晶体变为白色粉末CuSO4+5H2O CuSO4·5H2O白色粉末变为蓝色晶体检验物质中是否含有水AgNO3+NaCl AgCl↓+NaNO3白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2+Na2SO4BaSO4↓+2NaCl白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3CaCO3↓+2NaCl有白色沉淀生成MgCl2+Ba(OH)2BaCl2+Mg(OH)2↓有白色沉淀生成CaCO3+2HCl CaCl2+H2O+CO2↑MgCO3+2HCl MgCl2+H2O+ CO2↑NH4NO3+NaOH NaNO3+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+KOH KCl+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 Fe3O43. 铜在空气中受热:2Cu + O2 2CuO4. 铝在空气中燃烧:4Al + 3O2 2Al2O35. 氢气中空气中燃烧:2H2 + O2 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 2P2O57. 硫粉在空气中燃烧: S + O2SO28. 碳在氧气中充分燃烧:C + O2CO29. 碳在氧气中不充分燃烧:2C + O2 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 2CO211. 甲烷在空气中燃烧:CH4 + 2O2CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O22CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO Hg+ O2 ↑14.加热高锰酸钾:2KMnO4 K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 2H2↑+ O2↑17.生石灰溶于水:CaO + H2O Ca(OH)218.二氧化碳可溶于水: H2O + CO2H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2 2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO Cu + H2O22. 镁还原氧化铜:Mg + CuO Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2 CO224.木炭还原氧化铜:C+ 2CuO2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O34Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 CO227.煤炉的中层:CO2 + C 2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3H2O + CO2↑31.二氧化碳可溶于水: H2O + CO2H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3 CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2CaCO3↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO Cu + CO235.一氧化碳的可燃性:2CO + O2 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2 2CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O2 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O22MgO41.铁在氧气中燃烧:3Fe + 2O2 Fe3O442. 铜在空气中受热:2Cu + O2 2CuO43. 铝在空气中形成氧化膜:4Al + 3O22Al2O3(2)金属单质 + 酸 -------- 盐 + 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2Cu(NO3)2 + Hg (3)金属铁的治炼原理:55.3CO+ 2Fe2O34Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4CuSO4 + H2O(3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH Na2SO4 + 2H2O(4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl2NaCl+ H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2BaSO4↓+ 2HCl 2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:2NaOH + CO2Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3Na2SO4 + H2O 71.消石灰放在空气中变质:Ca(OH)2 + CO2CaCO3 ↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2CaSO3↓+ H2O(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液) + 金属单质------- 另一种金属 + 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl NaCl + H2O + CO2↑(3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3CaCO3↓+ 2NaOH(4)盐 + 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3AgCl↓ + NaNO378.硫酸钠和氯化钡:Na2SO4 + BaCl2BaSO4↓ + 2NaCl一、初中化学物质的转化关系1、氧气、氧化物、酸、氢气、水H2OKMnO4↘↓↑↗CO、CO2↗SO2 H2SO4H2O2 →→P2O5 + Mg Al Zn Fe→ H2→H2O↘MgO HClKClO3↗↓↘Al2O3Fe3O42、碳与碳的化合物3、氢氧化钠、碳酸钠、氯化钠+ CO2↗ Na2SO4 → BaSO4↓(白)NaOH → Na2CO3 → CaCO3↓(白)(变质)↘ NaCl → AgCl↓(白)4、含钙化合物的关系:↙↗―――――――↘↖CaCO3→CaO→Ca(OH)2→CaCl2↖CO2↙5、氧化钡、氢氧化钡与硫酸钡↗BaCl2→ BaSO4↓(白)BaO → Ba(OH)2↗↘ + CuS O4↘Cu(OH)2↓(蓝)6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵CuO↗ CO2↙↘Ca(HCO3)2 →CaCO3→CaO CuSO4.5H2O→CuSO4→ Cu ↘H2O↗Na2CO3↗NH3 →NH3.H2O NaHCO3 →CO2 NH4HCO3→ H2O↘H2O → H2CO3↘ CO2 →H2CO37、铝、镁、锌、铁、铜及其化合物↗ZnSO4↖↗ AlCl3↖Zn → ZnO Al → Al2O3 ↘ZnCl2↙↘Al2(SO4)3↙Fe Al↗MgCl2↖↙﹉﹉﹉﹉↗ CuCl2↘↖Mg → MgO Cu ←→CuO Cu(OH)2↘MgSO4↙↖____↘ CuSO4↗↙Fe Al↙ FeCl3↖ C CO H2Mg Al↗FeSO4Fe(OH)3 Fe2O3←――――→ Fe↖Fe2(SO4)3↙O2 H2O ↘ FeCl2二、物质之间的转化关系的分析推断题。
物质转化规律

物质的分类和转化规律一.物质的转化规律:1.金属+氧==金属氧化物2.金属氧化物+还原剂=金属+非金属氧化物①CuO+H2== 现象:,H2还原优点是反应生成物之一是,且产物较纯净。
②CuO+CO== (CO有剧毒,实验时一定)③2CuO+C;现象:(虽然C的还原能力强于H2,但固体还原剂与氧化物的充分接触程度没有固体与气体还原剂充分,自然反应温度就比H2要高,最好使用酒精喷灯或加罩的酒精灯。
C要稍微过量。
)④2Fe2O3+3C;⑤Fe2O3+3CO;(加热时一定要持续高温)⑥Fe2O3+3H2 ;现象:3.金属氧化物+水==碱4.碱==金属氧化物+水5.非金属+氧==非金属氧化物①氢气在空气中燃烧:2H2+O2现象:相关知识点: (1)氢气是一种常见的还原剂; (2)点燃前,一定要检验它的纯度否则会爆炸。
②红磷在空气中燃烧:4P+5O2现象:相关知识点: (1)烟是固体小颗粒;雾是液体小颗粒. (2)测量氧气在空气中的体积分数。
(3)可做烟雾弹。
③硫粉在空气中燃烧: S+O2现象:在空气中是发出微弱的火焰,在氧气中是发出明亮的火焰. 有强烈气味。
相关知识点:(1)反应后的产物可用紫色的石蕊试液来检验(紫色变成红色);(2)SO2污染空气,要用溶液进行尾气处理。
(3)SO2是气体,所以测量氧气在空气中的体积分数,若将水改为溶液,也可以测量氧气在空气中的体积分数。
④碳在氧气中充分燃烧:C+O2现象:在空气中是发出 ,在氧气中是发出。
相关知识点:反应后的产物可用来进行检验.⑤碳在氧气中不充分燃烧:2C+O26.非金属氧化物 + 活泼金属 == 非金属+金属氧化物①金属钠与水反应:2Na+2H2O== ,现象:浮(钠块浮在水面上)、游(钠块在水面上无规则游动)、熔(钠块熔化为小球)、响(发出嘶嘶的响声)、红(使滴入酚酞试液的溶液变红)②金属镁与CO2反应:2Mg+CO22MgO+C 现象:发出白光,有白色粉末(MgO)生成,有黑色固体(C)生成,同时放出大量的热。
初中化学物质转化关系图
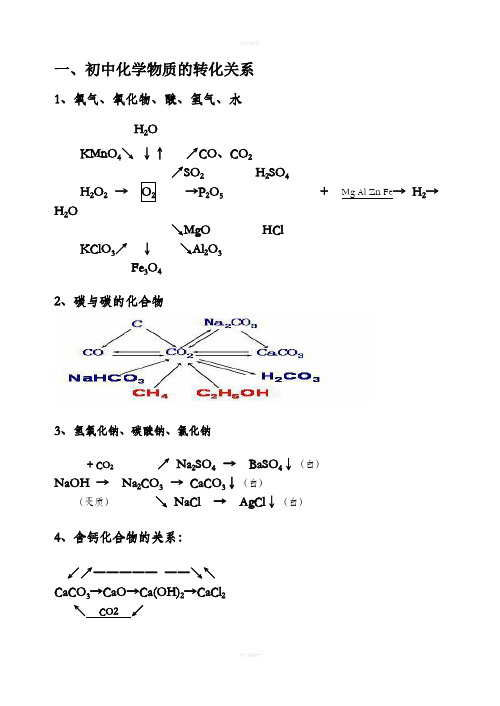
↗ Na2SO4 → BaSO4↓(白)
NaOH → Na2CO3 → CaCO3↓(白)
(变质)
↘ NaCl → AgCl↓(白)
4、含钙化合物的关系:
↙↗――――― ――↘↖ CaCO3→CaO→Ca(OH)2→CaCl2
↖ CO2 ↙
-可编辑-
精品教育
5、氧化钡、氢氧化钡与硫酸钡
↗BaCl2 → BaSO4↓(白)
精品教育
一、初中化学物质的转化关系
1、氧气、氧化物、酸、氢气、水
H2O
KMnO4↘ ↓↑ ↗CO、CO2
↗SO2
H2Sቤተ መጻሕፍቲ ባይዱ4
H2O2 → O2
→P2O5
H2O
↘MgO
HCl
KClO3↗ ↓ Fe3O4
↘Al2O3
2、碳与碳的化合物
+ Mg Al Zn Fe→ H2→
3、氢氧化钠、碳酸钠、氯化钠
+ CO2
BaO → Ba(OH)2
↗
↘ + CuSO4
↘Cu(OH)2↓(蓝)
6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵
CuO ↙↘ CuSO4.5H2O→CuSO4→ Cu
↗ CO2 Ca(HCO3)2 → CaCO3→CaO
↘ H2O
↗Na2CO3 NaHCO3 →CO2
↘H2O →
H2CO3
↗ NH3 → NH3.H2O NH4HCO3 → H2O
-可编辑-
精品教育
Fe Al
↙ FeCl3 ↖
Fe(OH)3
Fe2O3
↖Fe2(SO4)3↙
C CO H2 Mg Al
←――――→
O2 H2O
初中化学27.初高中化学衔接——物质间的相互转化

初高中化学衔接——物质间的相互转化初中化学所涉及的元素化合物知识主要包括以O 2、H 2、C 、S 、P 等为代表的非金属单质,以Fe 为代表的金属单质,以CO 、CO 2等为代表的非金属氧化物,以Fe 2O 3 、CuO 等为代表的金属氧化物,以及酸、碱、盐等。
这些物质之间的相互关系可以通过物质间相互转化关系图(即八圈图)。
1. 各类物质相同转化关系图(俗称八圈图)在上图中所涉及的反应规律可简记为: 两条纵线通到底(七条规律)(1)~(7) 四条横线相联系(四条规律)(8)~(11) 六条交叉成网络(六条规律)(12)~(17) 17条规律须牢记 反应规律 示例纵向:(1)金属+−−−→−∆/2点燃O 金属氧化物(碱性氧化物) O Na O Na 2224=+ CuO O Cu 222∆+(2)碱性氧化物(可溶)+水→碱(可溶)NaOH O H O Na 222=+(3)碱(难溶)−−−→−∆高温/碱氧(难溶) + 水∆==2)(OH Cu O H CuO 2+(4)酸+碱→盐+水O H PO Na PO H NaOH 2434333+=+O H CuSO SO H OH Cu 244222)(+=+(5)非金属+−−→−点燃2O 非金属氧化物(酸性氧化物) 22CO O C 点燃+ 522254O P O P 点燃+(6)酸性氧化物(易溶)+水→酸(易溶)3222CO H O H CO =+ 4325223PO H O H O P =+(7)酸(易挥发 / 难溶)→酸氧+水(易挥发 / 难溶)↑+=2232CO O H CO H 2232SiO O H SiO H +∆从纵向来看,金属→碱性氧化物→碱→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:(8)金属+非金属→(无氧酸)盐NaCl Cl Na 222点燃+(9)碱氧+酸氧→(含氧酸)盐32CaSiO SiO CaO 高温+(10)含氧酸盐→碱氧+酸氧↑+23CO CaO CaCO 高温(11)盐+盐→两种新盐↓+=+AgCl NaNO AgNO NaCl 33交叉:(12)酸+碱氧→盐+水O H CuSO CuO SO H 2442+=+(13)碱+酸氧→盐+水O H CO Na CO NaOH 23222+=+(14)酸+盐→新酸+新盐32423242CO H SO Na CO Na SO H +=+↑+=2232CO O H CO H (15)碱+盐→新碱+新盐↓+=+2424)(2OH Cu SO Na CuSO NaOH(16)金属+酸→盐+↑2H↑+=+2442)(H ZnSO SO H Zn 稀(17)金属+盐→新盐+新金属44ZnSO Cu CuSO Zn +=+以上十七条规律的应用: (1)可知某物质的性质。
第34课 物质间的循环和转化

是
()
图 345 A.X 是 N2 B.分离空气属于物理变化 C.尿素属于氮肥 D.煤与氧气的反应吸收热量 【答案】 D
专题一 关于一步反应实现的题型
中考试题经常出现要求一步反应完成的试题类型。解 决此类问题,需要掌握物质相互关系的普遍规律与特殊要 求。比如,金属和酸反应能得到氢气,该金属在活动性顺 序表中必须排在氢前面;碱和盐反应能得到新碱和新盐, 参与反应的碱和盐必须可溶; 当物质间发生复分解反应 时,必须满足复分解反应的条件;金属氧化物与水反应能 得到相应的碱,该金属氧化物必须是活泼金属的氧化物如 Na2O、K2O、CaO 等。
铜和氯化镁五种物质的反应与
转化关系,“ —” 表示两种物质
之间能发生化学反应,“→”表
示在一定条件下的物质转化。
(1)A 物质是 (填化学式)。
(2)C 与 E 反应的基本类型是
。
(3)从物质反应规律分析,在单质、氧化物、酸、碱和
盐中,能与 B 反应生成 D 的物质有 (填序号)。
①2 类 ②3 类 ③4 类 ④5 类
3.碳、氧循环之间的关系(如图 341): 图 341
二、物质间的相互转化
1.金属、金属氧化物、碱之间的转化关系:金属→金属 氧化物→碱,如:Ca→CaO→Ca(OH)2。
2.非金属、非金属氧化物、酸之间的转化关系:非金属 →非金属氧化物→酸,如:C→CO2→H2CO3。
3.物质之间的相互转化关系(如图 342): 图 342
A.HgO→Hg
B.NaNO3→NaCl
C.K2CO3→BaCO3 D.P→P2O5
【答案】 B
3.(2018·安徽)为实现二氧化碳的绿色利用,科学家用固
碳酶作催化剂设计了如图 343 所示转化过程。下列说来自法正确的是()
[难点聚焦]单质、氧化物、酸、碱、盐之间的转化关系
![[难点聚焦]单质、氧化物、酸、碱、盐之间的转化关系](https://img.taocdn.com/s3/m/21fb0da3a26925c52dc5bf26.png)
[难点聚焦]单质、氧化物、酸、碱、盐之间的转化关系[难点聚焦]单质、氧化物、酸、碱、盐之间的转化关系盐和金属金属非金属碱性氧化物酸性氧化物碱酸盐盐盐(无氧酸盐)盐(含氧酸盐)盐和水碱和盐酸和盐两种新盐盐和氢气+酸+碱(16)(1)+O2(7)(17)+O2(4)(17)(8)(2)+H2O-H2O(3)(11)(12)(5)+H2O-H2O(6)(15)(9)(14)(13)(10)物、酸、碱、盐五大类,但对于书写化学方程式来说,将物质分为七类更好:金属、非金属、碱性氧化物、酸性氧化物、酸、碱、盐。
一般把它叫做“八圈图”(如上图)。
物质间的相互关系也是物质间的反应规律,必须牢牢掌握!2.发掘“八圈图”的内涵。
⑴表示物质间的纵横衍变关系,如从金属或非金属如何衍变成盐;⑵表示15个基本反应规律(9条连线和6个箭头);⑶表示物质的性质(除了跟指示剂反应这一性质在图中无法表示外,图中酸没有打箭头的4根线表示的是酸的性质,其余类推!);⑷表示物质(特别是盐)的制法;15个反应中至少有10个与盐有关,俗称“十大成盐”规律!3.使用“八圈图”的注意事项。
⑴各类物质的相互关系图并非无所不含,有以下一些规律未能体现:H2、C、CO还原CuO或Fe2O3;CuSO4转化为胆矾晶体;碳酸(氢)盐的分解;酸式盐与正盐的转换规律等。
⑵复分解反应规律的条件:可溶的反应物,能生成沉淀、气体或水。
⑶置换反应规律的条件:金属活动顺序强换弱。
判断金属与酸反应时:金属必须排在H前面;酸不可用硝酸、浓硫酸。
判断金属与盐反应时:必须同时满足“排在前面的金属;可溶性盐”。
例题:小梅同学学习了单质、氧化物、酸、碱、盐性质后,发现许多不同类别的物质反应时能生产盐,于是她构建了下图所示的知识网络图。
铜及其化合物在工业上有重要的应用。
借助网络图回答:(1)写出用酸和碱生产硫酸铜的化学方程式:。
(2)请你把图中①②处补充完整,要求不能与图中已有信息重复。
初中化学专题3 八圈图及物质的转化
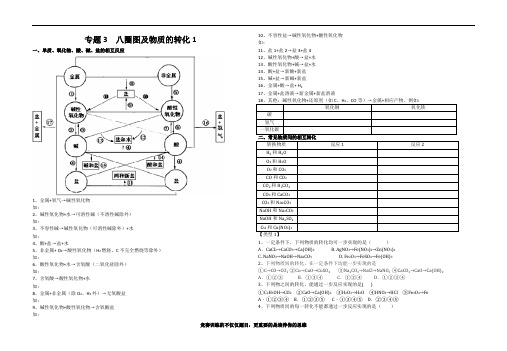
专题3 八圈图及物质的转化1一、单质、氧化物、酸、碱、盐的相互反应1、金属+氧气→碱性氧化物如:2、碱性氧化物+水→可溶性碱(不溶性碱除外)如:3、不容性碱→碱性氧化物(可溶性碱除外)+水如:4、酸+盐→盐+水5、非金属+ O2→酸性氧化物(H2燃烧、C不完全燃烧等除外)如:6、酸性氧化物+水→含氧酸(二氧化硅除外)如:7、含氧酸→酸性氧化物+水如:8、金属+非金属(除O2、H2外)→无氧酸盐如:9、碱性氧化物+酸性氧化物→含氧酸盐如:10、不容性盐→碱性氧化物+酸性氧化物如:11、盐1+盐2→盐3+盐412、碱性氧化物+酸→盐+水13、酸性氧化物+碱→盐+水14、酸+盐→新酸+新盐15、碱+盐→新碱+新盐16、金属+酸→盐+ H217、金属+盐溶液→新金属+新盐溶液1、一定条件下,下列物质的转化均可一步实现的是()A.CaCl2→CaCO3→Ca(OH)2 B. AgNO3→Fe(NO3)2→Zn(NO3)2C. NaNO3→NaOH→Na2CO3D. Fe2O3→FeSO4→Fe(OH)32、下列物质间的转化,在一定条件下均能一步实现的是①C→CO→CO2 ②Cu→CuO→CuSO4 ③Na2CO3→NaCl→NaNO3 ④CaCO3→CaO→Ca(OH)2 A.①②③B.①③④C.①②④ D.①②③④3、下列物之间的转化,能通过一步反应实现的是( )①C2H5OH→CO2②CaO→Ca(OH)2③H2O2→H2O④HNO3→HCl⑤Fe3O4→Fe A.①②③④ B.①②③⑤ C.①③④⑤ D.②③④⑤4、下列物质间的每一转化不能..都通过一步反应实现的是()A.CuO→Cu→CuO B.NaOH→H2O→NaOH C.O2→Fe3O4→O2D.Fe→FeCl2→Fe5、下列物质间的每一转化不能都通过一步反应实现的是()A.Ca→CaO→CaCl2B.NaOH→Na2CO3→NaClC.O2→CuO→Cu(OH)2D.C→CO2→Na2CO36、下列转化能一步完成的()① CH4→CO2 ②HNO3→HCl ③CaO→Ca(OH)2 ④Ba(OH)2→NaOH ⑤C→CuA.①③④⑤ B.②③④⑤ C.①②④⑤ D.①②③④7、下列转化能一步完成的是()①CaCO3→CO2②HCl→NaCl③CaO→Ca(OH)2④Ca(OH)2→NaOH⑤CuO→Cu.A.①②③④⑤B.②③④⑤C.①②④⑤D.①②③④8、下列转化能一步完成的是()①Ba(OH)2→NaOH②CuO→Cu(OH)2 ③HNO3→HCl④SO2→Na2SO3.A.①④ B.②③ C.③④ D.只有④9、下列物质之间的转化能够实现的是()10、下列物质间的转化关系正确的是()A.①②B.②③ C.①③ D.①②③【类型2】1、现有Fe、CuO、MgCl2、Ca(OH)2、稀H2SO4等五种物质,在常温下它们两两相互发生的化学反应有()A.7个B.6个C.5个D.4个2、现有氧化铁、稀硫酸、氢氧化钠溶液、氯化钡溶液和碳酸钾溶液五种物质,在常温下它们两两相互发生的化学反应有()A.4个B.5个C.6个D.7个3、现有Zn、Fe2O3、MgCl2、Cu(OH)2、稀H2SO4等五种物质,在常温下它们两两相互发生的化学反应有()A.3个B.4个C.5个D.6个4、对于化学反应X + Na2CO3 == 2Y+ CaCO3↓的分析错误的是()A.该反应属于复分解反应B.Y中一定含有钠元素C.X一定是熟石灰D.X中阴离子化合价是—1价5、对于复分解反应:X+2NaOH2Y+Cu(OH)2↓,下列分析中正确的是()A.X一定是CuCl2B.相对分子质量大小:X>Y C.Y可能是H2O D.Y可能是Na2SO4【类型3】1、下列各组变化中,每一转化在一定条件下均能一步实现的是()A.①和② B.②和③ C.①和③ D.①②③2、下列各组物质间通过一步反应就能实现如图所示的转化,则甲、乙、丙可能分别是()A.NaOH、NaCl、NaNO3B.CO、CO2、H2 CO3C.CaO、Ca(OH)2、CaCO3D.H2O2、H2O、O23、(2013•徐州一模)下列各组中物质间的转化不都是通过一步反应实现的是()4、下列各组物质间通过一步反应就能实现如右图转化,则甲、乙、丙可能是()A.KOH KCl KNO3B.CuO CuCl2Cu(OH)2C.C CO2COD.H2O2H2O O25、(2014·宿迁)下列物质的三角转化关系中都能按箭头方向一步实现的是( )A.① B.①② C.①②③ D.②③6、下列各组转化中,一定条件下均能一步实现的组合是()A.①②B.②③C.①③D.①②③专题3 八圈图及物质的转化2【类型3】7、下列有关说法正确的是( ) A .实现CO CO 2的相互转化,都只有一种途径B .Al 可以实现单质氧化物碱C .实现C CO 的转化,都利用了碳的可燃性D .实现H 2OO 2相互转化,化学反应的基本类型不同8、比较归纳是化学学习中常用的一种方法.以下是C 、CH 4、CO 三种物质转化为CO 2的转化关系,即:①C→CO 2②CH 4→CO 2③CO→CO 2,对它们的比较归纳正确的是( )A .三种转化发生的都是化合反应B .三种物质都只能跟氧气反应转化为二氧化碳C .三种物质都可以在点燃条件下转化为二氧化碳D .三种转化所有的生成物在常温下都是气体 9、(2014黄冈市)已知甲、乙、丙、丁是初中化学中的四种常见物质,丁是甲与乙、乙与丙反应的生成物之一(反应条件均已略去),转化关系如图:(1)常温下,若乙为红色粉末,甲为黑色粉末,则丙的化学式是______,甲与乙反应的化学方程式为______。
2022年中考专题1物质的相互反应与转化

(2)C与F反应的基本类型是___________。
(3)C→D反应的化学方程式为______________。
(4)空间站迎来了首批访问者,他们搭乘的载人舱X与连接验C成功对接(如上图所示),则载人舱X代表的物质可能是_____(填序号)。
A.CB.CO2C.Fe2O3D.CaCO3
3.(2020·江苏淮安)节能减排中“减排”的关键是减少CO2的排放,而“减排”的重要手段是合理利用CO2。科学家利用CO2为原料制取炭黑的流程如图。下列说法不正确的是(B)
A.过程2的变化中太阳能转化为化学能B.过程1和过程2的变化都属于分解反应
C.此流程中有炭黑生成,还有氧气生成D.此流程还需要解决炭黑和FO3
NaOH溶液
C
稀盐酸
Ca(OH)2溶液
D
稀盐酸
AgNO3溶液
2.(2020·湖南岳阳)初中化学中几种常见物质之间的相互关系如图所示,“一”表示相连两物质能发生反应,“→”表示物质之间存在转化关系,以下说法不可能的是(B)
A.若甲为单质,其他物质可以 氧化物
B.若甲为氧化物,其他物质可以是酸
A.大理石和物质C均可作建筑材料
B.物质B有吸水性,易跟水起化合反应
C.物质A可用来配制农药波尔多液和改良酸性土壤
D.C溶液较长时间放在空气中表面会有一层白膜(若水没有减少),则溶液的溶质质量分数变小
7.(2020·湖北天门仙桃潜江江汉油田)甲、乙、丙三种物质的转化关系为,下表中不符合该转化关系的一组物质是(C)
(1)A的化学式_____________,B属于_____________(选填“酸、碱、盐、单质、氧化物”)。
(2)写出C+E反应的化学方程式_________________,E的用途___________(写一种)。
