氧化钠和过氧化钠
氧化钠和过氧化钠有什么区别

氧化钠和过氧化钠都是化学品,它们的化学结构和性质存在明显的区别。
氧化钠,也称作氢氧化钠,化学式为NaOH,是一种强碱性化合物。
在水中溶解时可以产生一种含有氢氧根离子的碱性溶液,常被用于化学实验室、制皂、清洁和腐蚀性处理等方面。
氢氧化钠的化学性质稳定,不易挥发,但在接触金属或有机物质时可以发生剧烈的反应。
过氧化钠,化学式为Na2O2,是一种过氧化物,常被用作漂白剂和氧化剂。
过氧化钠在水中分解时会放出氧气,并产生氢氧根离子和过氧化氢根离子。
过氧化钠在接触到容易被氧化的物质时可以发生激烈的氧化反应,因为它本身是一种强氧化剂。
氢氧化钠和过氧化钠之间的最大区别在于它们的化学结构。
氢氧化钠是硷金属钠和氢氧根离子的化合物,而过氧化钠则是氧气和钠离子之间的过氧化物。
这两种化合物在实际应用中也有着不同的用途和化学反应,需要根据具体情况进行选择和使用。
氧化钠与过氧化钠

氧化钠与过氧化钠
碱—氢氧化钠与过氧化钠
1、氢氧化钠
氢氧化钠是一种习惯上把NaHCO3称作碳酸钠,是一种白色粉末状或实心结晶体,具有易溶于水,无色透明溶液的特性,还具有滴定性、水解性和抗风化作用等特点,常用于食品工业、除气液卤、处理和缓冲剂,以及科学仪器、电气工程和冶金等方面。
2、过氧化钠
过氧化钠是一种习惯上把Na2CO3称作碳酸氢钠,为白色固体,易溶于水,是最常用的氧化剂之一,具有可逆性、热稳定性、抗污染、氧化力强等特点,常用于非金属原料加速氧化铝,处理和控制发酵,缓冲介质和金属材料综合加工等工艺过程。
3、氢氧化钠与过氧化钠的区别
(1)氢氧化钠具有滴定性、水解性和抗风化作用等特点,而过氧化钠具有可逆性、热稳定性、抗污染、氧化力强等特点。
(2)对过氧化钠的滴定反应,不会产生CO2;而氢氧化钠滴定反应,
会产生CO2。
(3)氢氧化钠的分子量比过氧化钠的分子量小,且氢氧化钠滴定反应
之后,余下的氢氧化钠中含有残留氧化剂,而过氧化钠滴定反应之后,它没有余留氧化剂。
(4)氢氧化钠溶液是强中性,而过氧化钠溶液具有意外的强酸性,所以,氢氧化钠溶液可以用来缓冲发酵,而过氧化钠则不宜用来缓冲发酵。
(5)氢氧化钠的溶解度比过氧化钠的溶解度要高得多,而过氧化钠的
溶解度是氢氧化钠的一半。
综上所述,氢氧化钠与过氧化钠的主要区别就是具有不同的特性,以
及溶解度、滴定反应、氢氧化钠含有残留氧化剂等方面的不同。
氧化钠、过氧化钠和碳酸钠的物化性质

1.氧化钠Na2OO,白色固体(白色无定形片状或粉末)。
不燃,具腐氧化钠,分子式为Na2蚀性、强刺激性,可致人体灼伤。
对人体有强烈刺激性和腐蚀性。
对湿敏感。
在暗红炽热时熔融,到400℃以上时分解成过氧化钠和金属钠。
遇水起剧烈化合反应,形成氢氧化钠。
相对密度2.27。
用作脱氢剂,化学反应的聚合或缩合剂。
外观与性状:白色无定形片状或粉末。
熔点(℃): 1132沸点(℃):1275 (升华)相对密度(水=1): 2.27克每立方厘米闪点(℃):1036爆炸上限%(V/V):87%爆炸下限%(V/V):38%热力学函数(298.15K,100kPa):标准摩尔生成热ΔfHmθ(kJ·mol-1):-414.2标准摩尔生成吉布斯自由能Δf Gmθ(kJ·mol-1):-375.5标准熵Smθ(J·mol^-1·K^-1):75.1主要用途:用作聚合、缩合剂及脱氢剂。
与水的反应Na2O+H2O=2NaOH与二氧化碳反应Na2O+CO2=Na2CO3制氧化钠4Na+O2=2Na2O2.过氧化钠Na2O2过氧化钠,77.99。
工业品为淡黄粉末,加热则颜色变深,比重2.805,表观密度0.5-0.7g/cm3,熔点460℃(分解),分解温度657℃(分解),分解时放出氧气,极易吸湿,与水和含有水蒸汽的二氧化碳均发生放热反应,并放出氧气,与易燃有机物接触易发生燃烧,高温下有强烈腐蚀性。
工业级有效氧含量≥35.5%,氧化钙为3.5±0.5%。
和超氧化物组成混合药剂做为生氧剂,用于宇航、海底勘探、高原作业、矿山救援、消防救火、潜艇航行和医学卫生,过氧化钠还广泛用作漂白剂,氧化剂、去臭剂,杀菌剂及矿石分析。
过氧化钠不是碱性氧化物,但也可与水、二氧化碳,酸反应,反应过程中均有氧气放出,化学方程式分别为:2Na2O2+2H2O==4NaOH+O2↑2Na2O2+2CO2==2Na2CO3+O22Na2O2+4HCl==4NaCl+2H2O+O2↑3.碳酸钠(纯碱)Na2CO3【化学式】Na2CO3,106【俗名】块碱、纯碱、苏打(Soda) 、碱面、口碱(历史上,一般经张家口和古北口转运全国,因此又有“口碱”之说。
(完整)氧化钠和过氧化钠公开课

第二节 几种重要的金属化合物第一课时 钠的重要化合物——《氧化钠和过氧化钠》授课老师:杨秋玲一、教学目标1、知识与技能:了解氧化钠和过氧化钠的性质,掌握过氧化钠的性质。
2、过程与方法:通过观察实验现象,积累分析实验的方法。
3、情感态度和价值观:通过感受化学世界的奇妙,提高学习化学的兴趣. 二、教学重点:氧化钠和过氧化钠的性质 三、教学难点:过氧化钠的性质 四、教学过程 1、氧化钠(Na 2O )知识回顾:用化学方程式写出Na 2O 和Na 2O 2的形成,颜色,状态。
△ 学生板书:4Na+O 2=2Na 2O ; 2Na+O 2 ==== Na 2O 2钠暴露在空气中生成白色的固体氧化钠,在空气中加热剧烈燃烧,发出黄色火焰,生成淡黄色固体过氧化钠。
思考与交流:氧化钠的性质与氧化钙的相似,写出Na 2O 与H 2O 和CO 2反应的化学方程式。
学生板书:Na 2O + H 2O = 2NaOH ; Na 2O + CO 2 = Na 2CO 32、过氧化钠(Na 2O 2)Na 2O 2是否能类似于Na 2O 与H 2O 和CO 2反应呢? 实验——“滴水生火” 思考:为什么棉花会燃烧起来?引导:燃烧需要什么条件?可燃物、温度达到着火点、有助燃的物质原因:Na 2O 2和H 2O 反应放出大量的热,并且有氧气生成。
Na 2O 2和H 2O 反应是否还有其他产物?如何验证? 学生:还有NaOH 生成。
用酚酞溶液检验.实验3-5:将少量Na 2O 2置于试管中,加少量水后,将带火星的木条置于试管口,再向反应后的溶液滴加酚酞溶液,观察现象。
再振荡试管,溶液颜色又有什么变化?现象:加水后试管中有大量气体生成。
带火星木条复燃,试管外壁发热。
滴加酚酞,溶液变红;振荡后,溶液很快褪色。
结论:有O 2生成。
反应放热,有碱生成。
Na 2O 2具有漂白作用,作漂白剂。
请一个同学来写出Na 2O 2和H 2O 反应的化学方程式。
考点突破:钠的氧化物——氧化钠和过氧化钠
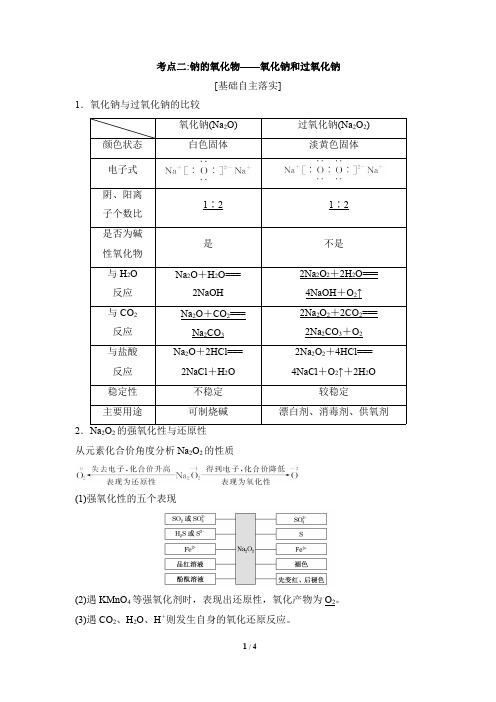
考点二:钠的氧化物——氧化钠和过氧化钠[基础自主落实]1.氧化钠与过氧化钠的比较氧化钠(Na 2O)过氧化钠(Na 2O 2)颜色状态白色固体淡黄色固体电子式阴、阳离子个数比1∶21∶2是否为碱性氧化物是不是与H 2O 反应Na 2O +H 2O===2NaOH 2Na 2O 2+2H 2O===4NaOH +O 2↑与CO 2反应Na 2O +CO 2===Na 2CO 32Na 2O 2+2CO 2===2Na 2CO 3+O 2与盐酸反应Na 2O +2HCl===2NaCl +H 2O 2Na 2O 2+4HCl===4NaCl +O 2↑+2H 2O稳定性不稳定较稳定主要用途可制烧碱漂白剂、消毒剂、供氧剂2.Na 2O 2的强氧化性与还原性从元素化合价角度分析Na 2O 2的性质(1)强氧化性的五个表现(2)遇KMnO 4等强氧化剂时,表现出还原性,氧化产物为O 2。
(3)遇CO 2、H 2O 、H +则发生自身的氧化还原反应。
小题热身1.判断正误(正确的打“√”,错误的打“×”)。
(1)氧化钠、过氧化钠均为碱性氧化物(×)(2)1mol Na2O2固体中含离子总数为4N A(×)(3)Na2O2溶于水产生O2的离子方程式为Na2O2+H2O===2Na++2OH-+O2↑(×)(4)Na2O2的电子式为(×)(5)1mol钠与氧气反应生成Na2O或Na2O2时,失去的电子数目均为N A(√)(6)Na2O2与H2O反应时,Na2O2既是还原剂又是氧化剂(√)(7)Na2O2在潮湿的空气中放置一段时间,最终产物是NaOH(×)(8)7.8g Na2O2与足量的CO2反应,转移电子的个数为0.2N A(×)2.如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。
钠及其氧化物的物质的量均为0.1mol,水的质量为100g。
氧化钠和过氧化钠的电子式

氧化钠和过氧化钠的电子式
氧化钠的电子式如图所示:
钠离子的最外层有一个电子,氧离子的最外层有六个电子;
两个钠离子失去两个电子与氧离子结合生成氧化钠。
氧化钠,化学式Na2O,分子量61.979,灰白色无定形片状或粉末,熔点1275℃,沸点1950℃,密度为2.3克每立方厘米。
氧化钠对湿敏感,易潮解,遇水起剧烈化合反应,形成氢氧化钠。
氧化钠在暗红炽热时熔融,在大于400摄氏度时分解为过氧化钠和钠单质。
氧化钠不燃,具腐蚀性、强刺激性,可致人体灼伤。
扩展资料:
氧化钠的性质:
化学性质
1、与水反应
氧化钠可以与水发生化合反应,生成氢氧化钠和水;
生成的氢氧化钠可以继续与氯化铝,硫酸铜等反应。
氧化钠能与酸反应,生成对应的钠盐与水;
若氧化钠过量,则过量的氧化钠会继续与水反应生成氢氧化钠。
3.自身分解
氧化钠在大于400摄氏度的条件下会分解为过氧化钠和钠单质。
4.与氧气反应
氧化钠在常温下和在加热的条件下均可氧化成过氧化钠。
氧化钠和过氧化钠的制备

氧化钠和过氧化钠的制备嘿,大家好,今天咱们聊聊氧化钠和过氧化钠的制备。
听起来是不是有点复杂?别担心,咱们轻松聊。
氧化钠,这可是咱们生活中常见的化合物之一,主要用在玻璃制造、化学合成和肥料里。
它的外观呢,白色的结晶,摸上去就像是细腻的盐。
这玩意儿可不简单,制备起来可是有点讲究的。
想象一下,咱们先得准备一些金属钠,平常咱们可没见过这东西,嘿嘿,它可是那种反应激烈的家伙,跟水一接触就“砰”的一下冒泡,简直是太好玩了。
你得小心,不然一不小心就能把厨房变成实验室,变成小型的火山喷发。
然后呢,咱们得把钠放在一个密闭的环境里,加入氧气。
这个反应过程可真有趣,钠和氧气碰撞,瞬间发出耀眼的光,像极了烟花,这一瞬间就能让你忘了其他的烦恼,安全第一,别盯着看太久哦!咱们说说过氧化钠。
听名字就知道,它跟氧有关系。
这个家伙可是比氧化钠多了一个氧元素,所以性质也不太一样。
过氧化钠是一种非常有用的化合物,特别是在水处理和氧化反应中,简直是个好帮手。
制备过氧化钠的第一步,得从氢氧化钠开始,嘿,咱们之前提到的氧化钠可以帮忙。
想象一下,把氢氧化钠和氧气混合,接着加热,这过程就像做饭一样,得小心火候,不然可就糟了。
加热后,氢氧化钠和氧气反应,就能得到过氧化钠。
注意,这个反应可不是随便做的,得在控制好的条件下进行,咱们可不想在家里闹出一场小火灾。
可能有的小伙伴会问,这两种化合物有什么不同呢?好吧,咱们简单来聊聊。
氧化钠主要是以离子形式存在的,反应比较温和,主要用在工业上。
而过氧化钠呢,反应性可强多了,尤其是在有机化学中,氧化性超级强,能把一些简单的物质转化成更复杂的化合物。
这就好比氧化钠是个温柔的大哥哥,而过氧化钠就是那个热情似火的小弟弟,随时准备出手。
说到用途,氧化钠在玻璃生产中那可是不可或缺的角色,没有它,玻璃的质量可得打折扣。
想象一下,工厂里大锅大锅地熬制玻璃,氧化钠像是调味料,给玻璃的透明度加分。
而过氧化钠呢,在水处理过程中起到净化的作用,能把水里的杂质给清除得干干净净,像个忠实的小助手,默默奉献。
氧化钠到过氧化钠的化学方程

氧化钠到过氧化钠的化学方程氧化钠(Na2O)到过氧化钠(Na2O2)的化学方程:2 Na2O + O2 → 2 Na2O2【引言】化学方程是描述化学反应中产生或消耗的物质的符号表示法。
在化学方程中,反应物写在箭头的左侧,生成物写在箭头的右侧。
在这篇文章中,我们将探讨从氧化钠到过氧化钠的化学反应,并分析该反应的深度和广度。
【正文】1. 氧化钠(Na2O)是一种由氧和钠元素组成的化合物。
它通常以白色粉末或晶体的形式存在,并具有强碱性。
氧化钠可以通过将纯碳酸钠(Na2CO3)加热至高温来制备。
在该反应中,碳酸钠分解为氧化钠和二氧化碳:Na2CO3 → Na2O + CO22. 过氧化钠(Na2O2)是一种由氧和钠元素组成的过氧化物。
它呈现为白色结晶,是一种强氧化剂和漂白剂。
氧化钠和空气中的氧气可以反应生成过氧化钠。
该反应可以用如下化学方程式表示:2 Na2O + O2 → 2 Na2O23. 分析这个化学方程,我们可以看到氧化钠中的钠元素的氧化状态从+1变为+2,而氧气中的氧元素的氧化状态则从0变为-1。
这说明氧化钠被氧化为过氧化钠,而氧气则被还原为过氧化钠中的氧。
这是一种氧化还原反应(redox)。
4. 氧化还原反应是许多化学变化中常见的一种类型。
它涉及到物质之间的电子转移。
在这个例子中,氧化钠中的钠原子失去了一个电子,被氧气中的氧原子接收。
这种电子转移反应可以通过化学键的形成和断裂来实现。
5. 过氧化钠的产生具有一定的实际意义和应用价值。
过氧化钠广泛用作漂白剂和消毒剂,在化学工业中扮演着重要的角色。
它也被用于环境保护和水处理领域,以及医药和食品工业中。
【总结】通过分析氧化钠到过氧化钠的化学反应,我们深入了解了氧化还原反应的机制和意义。
通过电子转移和化学键的形成和断裂,氧化钠中的钠元素被氧气中的氧元素氧化,生成过氧化钠。
我们还了解到过氧化钠在漂白剂、消毒剂和其他应用领域中的重要性。
【个人观点】氧化还原反应是化学中重要的反应类型之一。
钠的两种重要的氧化物——氧化钠和过氧化钠

钠的两种重要的氧化物——氧化钠和过氧化钠氧化钠和过氧化钠的比较难点提取Na2O2与CO2和H2O反应的五大关系1.物质的量的关系无论是CO2或H2O的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O与放出O2的物质的量之比均为2∶1。
2.气体体积关系若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量为原混合气体体积的12,即为生成氧气的量。
3.固体质量关系相当于固体Na2O2只吸收了CO2中的“CO”,H2O中的“H2”;可以看做发生相应的反应:Na2O2+CO===Na2CO3,Na2O2+H2===2NaOH(实际上两反应都不能发生)。
4.电子转移关系当Na2O2与CO2、H2O反应时,每产生1 mol O2转移2 mol e-。
5.先后顺序关系一定量的Na2O2与一定量的CO2和H2O(g)的混合物的反应,可看做Na2O2先与CO2反应,待CO2反应完全后,Na2O2再与H2O(g)发生反应。
【互动思考】1.判断正误,正确的划“√”,错误的划“×”(1)过氧化钠能与水反应,所以过氧化钠可以做气体的干燥剂()(2)过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂()(3)78 g Na2O2中含阴离子的个数是2 N A()(4)Na2O2与H2O反应制备O2的离子方程式:Na2O2+H2O===2Na++2OH-+O2↑()(5)Na2O、Na2O2组成元素相同,与CO2反应产物也相同()(6)Na2O2的电子式为()(7)1 mol钠与氧气反应生成Na2O或Na2O2时,失去的电子数目均为N A()(8)1 mol Na2O2与足量CO2反应时,转移2N A个电子()答案(1)×(2)√(3)×(4)×(5)×(6)×(7)√(8)×2.如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。
氧化钠和过氧化钠与二氧化碳反应

氧化钠和过氧化钠与二氧化碳反应
氧化钠(Na2O)和过氧化钠(Na2O2)与二氧化碳(CO2)可以
发生不同的化学反应。
首先,让我们讨论氧化钠和二氧化碳的反应。
氧化钠与二氧化碳反应会生成碳酸钠(Na2CO3)和释放出热量。
这
个反应可以用化学方程式表示为,Na2O + CO2 → Na2CO3。
接下来,让我们看看过氧化钠和二氧化碳的反应。
过氧化钠和
二氧化碳反应会生成碳酸钠和氧气。
这个反应可以用化学方程式表
示为,2Na2O2 + 2CO2 → 2Na2CO3 + O2。
这两种反应都是重要的化学反应,碳酸钠是一种常见的化合物,在工业生产和日常生活中都有广泛的用途。
这些反应也是化学实验
室中常见的实验内容,对于理解化学反应的特性和原理具有重要意义。
除了化学方程式之外,我们还可以从能量变化、物质的性质变
化等角度来分析这些反应。
例如,氧化钠和过氧化钠与二氧化碳反
应都涉及到能量的释放或吸收,这些能量变化对于工业生产和能源
利用具有重要意义。
此外,我们还可以探讨这些反应在环境保护和
资源利用方面的应用,以及它们在化工生产中的重要性。
总之,氧化钠和过氧化钠与二氧化碳的反应是化学领域中重要的反应之一,它们涉及到能量变化、物质转化等多个方面,对于我们理解化学原理和应用具有重要意义。
新人教版必修1氧化钠和过氧化钠

(2)与二氧化碳反应(化学方程式): _2_N_a_2_O_2+_2_C_O_2_=_=_=_=_2_N_a_2_C_O_3+_O_2_。
【微思考】 (1)过氧化钠是不是碱性氧化物?为什么? 提示:不是。碱性氧化物和酸反应时只生成盐和水,而 Na2O2与酸反应还有 O2生成。
(2)有一包淡黄色粉末,如何验证其为过氧化钠? 提示:可利用过氧化钠易与水反应生成氧气进行验证。 取少量粉末,滴加少量蒸馏水,观察,有能使带火星的木 条复燃的气体产生则为过氧化钠。
3.用途 (1)供氧剂:可用于呼吸面具或潜水艇中作为氧气的来 源。 (2)强氧化剂。
知识点一 氧化钠和过氧化钠的性质比较 【重点释疑】
化学式
颜色 状态 氧元素的 化合价
Na2O 白色 固体
-2价
Na2O2 淡黄色
固体
-1价
化学式 属类 生成条件 热稳定性 与H2O 反应
Na2O 碱性氧化物 常温下缓慢氧化 不稳定,易转化为Na2O2 Na2O+H2O====
2NaOH
Na2O2 非碱性氧化物 (过氧化物) 燃烧或加热
较稳定
2Na2O2+2H2O==== 4NaOH+O2↑
化学式 与CO2 反应 主要用途
Na2O Na2O+CO2====
Na2CO3 用于制取Na2CO3
Na2O2
2Na2O2+2CO2==== 2Na2CO3+O2
强氧化剂、漂白剂、 供氧剂
第2课时 氧化钠和过氧化钠
一、氧化钠的性质
1.物理性质 颜色:_白__色__;状态:_粉__末__状__固__体__。
2.化学性质
写出序号表示的化学方程式: ①_N_a_2_O_+_H2_O_=_=_=_=_2_N_a_O_H_。 ②_N_a_2O_+_C_O_2_=_=_=_=_N_a_2_C_O_3 。
新版高中化学讲义:氧化钠和过氧化钠

颜色 阴阳离子个数比 氧元素的化合价 是否为碱性氧化物
与 H2O 反应 与 CO2 反应 与盐酸反应 氧化性/漂白性
主要用途
Na2O 白色 1∶2
-2 是 Na2O + H2O === 2NaOH Na2O + CO2 === Na2CO3 Na2O + 2HCl === 2NaCl + H2O 无 制备 NaOH
(2)a g CO 在 O2 中完全燃烧,将其燃烧产物通过足量的 Na2O2 固体,Na2O2 固体质量增加多少克?
(3)如果是 a g H2 和 CO 的混合气体在 O2 中完全燃烧,产物通过足量 Na2O2 呢?
(4)若 a g 某物质 O2 中完全燃烧,产物通过足量的 Na2O2 固体,Na2O2 固体增加 a g,那么,该物质需 要满足什么条件?
Na2O2 淡黄色 1∶2
-1 否 2Na2O2 + 2H2O === 4NaOH + O2↑ 2Na2O2 + 2CO2 === 2Na2CO3 + O2 2Na2O2 + 4HCl === 4NaCl + 2H2O + O2↑ 有 强氧化剂、漂白剂、供氧剂
题型一:氧化钠和过氧化钠的基本性质
【例 1】(2021·全国高一课时练习)下列关于钠的氧化物的说法正确的是 A.向包有 Na2O2 粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明 Na2O2 与 H2O 反应放热且有氧气 生成 B.Na2O 与 Na2O2 中阳、阴离子的个数比不相同 C.将金属钠切开,表面变暗,最终得到淡黄色固体 D.保持温度不变,向饱和烧碱溶液中加入 2 g Na2O2,充分反应后,溶液中 Na+浓度增大 【答案】A 【详解】 A.脱脂棉燃烧需要具备两个条件,一是氧气助燃,二是达到着火点,该现象能够说明时放热反应且有氧气 生成,A 正确;
氧化钠与过氧化钠性质比较

3.氧化钠与二氧化碳反应,生成碳酸钠
Na2O + CO2 = Na2CO3
-1
二 过氧化钠 (Na2O2)
过氧化钠可做氧化剂,也可做还原剂
? Na2O2 + H2O = ? Na2O2 + CO2 = ? Na2O2 + HCl =
? Na2O2 + H2O =
Na2O2
H2O
(1)有O2生成
可以使带火星的木条复燃
(2)有碱生成 酚酞溶液
实验原理:
得2e-
-1
-2 0
2 Na2O2 + 2H2O === 4NaOH + O2↑
失2e-
Na2O2在这个反应中充当了什么角色呢? 既是氧化剂,又是还原剂。
滴
水 生
H2O
火
Na2O2
棉花
? Na2O2 + CO2 =
CaO + 2HCl = CaCl2
+
H2O
得到对应的 盐和水
碱性氧化物: 指与水反应只生成相应价态的碱的氧化物; 或与酸反应只生成盐和水的氧化物
氧化钠(NaO)属于碱性氧化物;
-2
一 氧化钠(Na2O)
1.氧化钠溶于水,反应生成氢氧化钠
Na2O + H2O = 2NaOH
2.氧化钠与盐酸反应,生成得到氯化钠和水
氧化钠与过氧化钠性质的比较
常温
4Na +O2 === 2Na2O (白色) 2 Na +O2 === Na2O2 (淡黄色)
MgO、CaO等为常见的碱性氧化物;
MgO + H2O = Mg(OH)2 CaO + H2O = Ca(OH)2
氧化钠与过氧化钠在空气中的最终产物

氧化钠与过氧化钠在空气中的最终产物氧化钠和过氧化钠,这两个名字听上去就像是化学课上的老朋友了。
大家可能觉得它们跟生活没啥关系,但其实它们在空气中的反应可是有点意思哦。
想象一下,你在厨房里忙碌,突然拿起一包白白的氧化钠,心里琢磨着“这玩意儿能干嘛呢?”然后又瞥见了那瓶闪闪发光的过氧化钠。
你心里一动,觉得这两个家伙可以来一次“化学碰撞”,看看会发生什么!氧化钠在空气中可不是个“老好人”,它容易吸水,变得湿湿的,有点像冬天里受了寒的可怜小动物。
它跟水发生反应,形成氢氧化钠,真是水来土掩,风来雨遮,没一会儿就变得黏糊糊的。
不过,咱们这时候的过氧化钠就显得有些高冷了,它对水的吸引力可没那么强。
可一旦它碰上了水,哇,反应就像是火星撞地球,瞬间释放出大量的氧气,这场面可谓是壮观!说到这里,氧化钠和过氧化钠在空气中最后会变成什么呢?大家可得听好了,最后的产品主要是氧化钠和氢氧化钠。
想象一下,一个白色的小粒子慢慢地融化成液体,再被空气中的水汽包围,最终在阳光下散发出淡淡的光辉,简直就是化学界的“美男子”了!而过氧化钠则是另一种风格,它一边释放氧气,一边让周围的环境变得活跃,仿佛在举办一场盛大的派对。
不过,别以为这俩家伙在空气中就安分守己了哦!氧化钠在空气中还会与二氧化碳反应,生成碳酸钠。
这下可好,空气中又添了一位新成员,大家开始一起跳舞,搞得你也忍不住想要加入。
过氧化钠也是个不甘寂寞的角色,它会在空气中被分解,生成氧气和氢氧化钠,让整个反应过程就像是一出热闹的戏剧,高兴迭起。
说到这里,想必大家对这两位化学家伙有了更深的了解。
它们在空气中的反应,宛如人生中的百态,时而平静,时而激烈,简直让人目不暇接!想象一下,当你在厨房里煮东西时,这些化学反应正在悄悄进行。
你可能完全没察觉,但它们却在默默地影响着你的生活。
每一口食物、每一口水,都在和这些小粒子打着交道,真是神奇得让人心生敬畏!所以啊,生活中的化学反应不仅仅是枯燥的实验室工作,它们无时无刻不在你我身边,跟我们一起共舞。
氧化钠过氧化钠教学设计

氧化钠过氧化钠教学设计哎呀,今天咱们聊聊氧化钠和过氧化钠,这可不是小事情哦,大家可要竖起耳朵听好了。
氧化钠,听名字就感觉高大上,对吧?它是钠和氧的结合,化学式就是Na₂O,别小看这个家伙,它可是咱们生活中挺常见的东西。
就像咱们吃的盐,虽然它的化学性质可是复杂得很。
这氧化钠其实是白色的固体,溶于水之后会变得很强碱性,接触到皮肤可别大意,那可真是要哭鼻子的感觉。
小伙伴们,化学实验的时候一定要注意安全哦,手套、护目镜一个都不能少。
说到过氧化钠,那就更有趣了,大家知道吗,它的化学式是Na₂O₂,听上去是不是有点神秘?它可不仅仅是氧化钠的升级版,过氧化钠是个活泼的小家伙,特别容易与水反应,分解的时候可是会释放出氧气,想象一下,像个小火箭一样,嗖的一声飞出去,真是太酷了!而且过氧化钠在医疗和工业上都有用处,比如消毒、漂白,嘿嘿,可以说是个多面手。
那咱们接着聊聊它们的反应,大家想象一下,氧化钠和水结合,会发生什么呢?没错,反应出来的氢氧化钠,俗称火碱,真是让人头疼的小家伙。
那味道啊,简直能让人流泪。
但是,过氧化钠和水结合,就不一样了,释放出氧气的同时,还有氢氧化钠,这可真是一个化学小惊喜,简直就像打开了万花筒,五颜六色的反应层出不穷。
在实验室里,氧化钠和过氧化钠的使用也是各有千秋。
氧化钠在制作玻璃和陶瓷中,扮演着重要角色,就像打杂的小工,默默无闻但不可或缺。
而过氧化钠,作为漂白剂和氧化剂,用途广泛得很,像个万事通,跑到哪里都能派上用场。
不过,使用它们的时候可要小心,尤其是过氧化钠,别让它接触到皮肤,真是“身在福中不知福”的道理了。
咱们说说这些化合物在生活中的存在。
大家听过“生活在阳光下”这句老话吧,过氧化钠就像阳光一样,在消毒和漂白中发挥着作用,给我们的生活带来洁净和光明。
想想看,清洁剂里常常能见到它的身影,让咱们的衣服亮亮堂堂、白白净净。
氧化钠则是个安静的后盾,默默地支持着各种工业生产,虽然平常不显山露水,但没有它,很多东西可就不那么顺利了。
氧化钠过氧化钠

氧化钠过氧化钠氧化钠(Sodium oxide)是一种化学物质,化学式为Na2O。
过氧化钠(Sodium peroxide)则是氧化钠的一种氧化物,化学式为Na2O2。
两者在化学性质上有所不同,下文将分别介绍氧化钠和过氧化钠的特点和应用。
一、氧化钠氧化钠是一种无色晶体,具有盐味。
它可通过金属钠与氧气反应得到,反应方程式为2Na + O2 → 2Na2O。
氧化钠在常温下不溶于水,但会与水反应生成钠氢氧化物(NaOH),反应方程式为Na2O + H2O → 2NaOH。
因此,氧化钠是一种较强的碱性物质。
氧化钠具有多种应用。
首先,它可作为玻璃的主要原料之一。
玻璃是由石英砂、氧化钠和氧化钙等原料熔融后冷却而成的。
氧化钠在玻璃制造过程中起到熔融剂的作用,能够降低熔融温度,促进原料的熔融和混合。
其次,氧化钠还可用于制备其他化学物质,如钠化合物、洗涤剂和肥料等。
此外,氧化钠在冶金工业中也有重要应用,可以用于提取金属铝和钛等。
二、过氧化钠过氧化钠是一种白色晶体,具有强烈的氧化性。
它可通过氧化钠与氧气反应得到,反应方程式为2Na2O + O2 → 2Na2O2。
过氧化钠在常温下微溶于水,会与水反应生成过氧化氢(H2O2),反应方程式为Na2O2 + 2H2O → 2NaOH + H2O2。
因此,过氧化钠是一种较强的氧化剂。
过氧化钠具有多种应用。
首先,它可用作化学试剂,用于有机合成反应中的氧化剂。
过氧化钠可以氧化醇、醛、酮等有机物,生成相应的酸、酮、酯等产物。
其次,过氧化钠还可用于环境保护领域,用作水处理剂和废水处理剂。
过氧化钠能够分解有机废水中的有毒物质,起到净化水体的作用。
此外,过氧化钠还可用于医药行业,用作漂白剂和消毒剂。
过氧化钠能够有效杀灭细菌和病毒,保障医疗卫生的安全。
氧化钠和过氧化钠是两种不同的化学物质。
氧化钠是一种碱性物质,主要用于玻璃制造和化学制剂的生产。
过氧化钠是一种氧化剂,主要用于有机合成、环境保护和医药卫生等领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2008年中国发生了一件大事,就是第29届奥运会!你看过在现场或者电视上看过开幕式吗你还记得那绚烂、耀眼、美丽的焰火吗有绽放的笑脸、有牡丹组成的奔腾巨龙、有29个象征着奥林匹克从希腊走进北京的大脚印、、、你们知道这些五颜六色的焰火是怎么制造出来的吗它就来源于我们今天所学的内容。
下面我们就来踏上寻秘之旅吧!●新知预习1.钠是一种活泼的金属元素,在自然界中以________态的形式存在。
2.氧化钠是________氧化物,能与盐酸、H2O、CO2等反应。
氧化钠与水反应的化学方程式为__________________________。
氧化钠与二氧化碳反应的化学方程式为________________________。
3.过氧化钠与水反应的化学方程式为___________________________________,过氧化钠与二氧化碳反应的化学方程式为_______________________________,因此过氧化钠可作为呼吸面具或潜水艇中________的来源。
从上面两个反应可以看出过氧化钠不属于________氧化物。
4.碳酸钠俗名纯碱,也叫________。
从类别上看属于________,它的水溶液呈碱性。
5.碳酸氢钠俗名________。
从类别上看属于盐,它的水溶液呈________。
碳酸氢钠不稳定,受热易分解,化学方程式为_____________________________________________,此反应可用来鉴别碳酸钠和碳酸氢钠。
6.钠元素焰色反应是________色,钾元素焰色反应是________色(透过蓝色的钴玻璃)。
利用焰色反应检验某种金属元素的步骤是:__________、__________、________、烧、洗。
●自主探究1.Na2O与Na2O2哪个更稳定提示:稳定性往往与活泼性相反,即越易与其他物质反应,其稳定性越差。
氧化钠受热可转变成过氧化钠,说明其稳定性较差。
常温下,Na在空气中会发生变化,生成Na2O;加热时,则生成Na2O2。
Na2O受热时,会继续反应,生成Na2O2。
从反应条件和反应过程中可看出:Na2O2更稳定。
2.焰色反应表现出的是物质的化学性质吗提示:不是,它表现出的是元素单质或化合物的物理性质。
●细品教材1.实验探究:过氧化钠的化学性质[实验1]过氧化钠与水的反应实验步骤:将水滴入盛有少量过氧化钠的试管中,立即把带火星的木条放在试管口,检验生成的气体,用手轻摸试管的外壁,然后向反应后的溶液中滴入酚酞溶液,观察现象。
实验现象:滴入水后有大量气泡产生;气体使带火星的木条复燃,试管外壁发热;向溶液中滴入酚酞溶液后,溶液颜色变红。
实验结论:过氧化钠和水反应生成了氧气和烧碱NaOH,同时放出热量。
化学方程式:2Na2O2+2H2O===4NaOH+O2↑离子方程式:2Na2O2+2H2O===4Na++4OH-+O2↑[实验2]过氧化钠与二氧化碳的反应实验步骤:取一块棉花拉开铺平,取一勺过氧化钠放在棉花上,用棉花将过氧化钠包成蓬松的棉团,放在石棉网上,用导气管不断向棉花吹气实验现象:棉花燃烧起来。
实验结论:过氧化钠和二氧化碳反应生成了氧气,同时放出大量的热量,使棉花燃烧。
化学方程式:2Na2O2+2CO2===2Na2CO3+O2。
温馨提示:①过氧化钠与水反应时,不仅生成对应的碱,还生成氧气,这说明过氧化钠不是碱性氧化物。
Na2O2与水反应是比较特殊的氧化还原反应:Na2O2在反应中既作氧化剂,又作还原剂,且二者比例为1 :1。
水在反应中既不作氧化剂,又不作还原剂。
②由于过氧化钠与水反应的程度非常大,所以当过氧化钠与水溶液反应时,都是先与水反应,生成的产物再与溶质反应。
如将少量的过氧化钠投入到硫酸铜溶液中,首先发生过氧化钠与水的反应,生成氧气和氢氧化钠;由于氢氧化钠与硫酸铜反应生成氢氧化铜沉淀,所以最后的产物是氢氧化铜、硫酸钠和氧气。
例1 (2014·试题调研)下列关于Na2O和Na2O2的叙述中正确的是( )A.都是白色固体 B.阴、阳离子个数比不相同C.都能与水反应形成强碱溶液 D.都是强氧化剂【解析】Na2O2和Na2O虽然组成元素相同,但其结构、性质上的差异很大。
Na2O是白色粉末,Na2O2是淡黄色粉末。
Na2O中Na+与O2-个数比为2 :1,Na2O2中Na+与O2-2个数比为2 :1。
它们都能与水反应生成氢氧化钠溶液。
Na2O中氧元素价态为最低价(-2),无氧化性,Na2O2中氧元素价态为中间价(-1),具有氧化性、还原性,是强氧化剂。
例2.(2014·试题调研)下面是比较过氧化钠和氧化钠性质异同点的有关叙述,其中错误的是( )A.过氧化钠和氧化钠长期置于空气中最终所得固体产物相同B.过氧化钠和氧化钠都能与二氧化碳或水发生化合反应C.过氧化钠和氧化钠与水反应都有氢氧化钠生成D.过氧化钠是强氧化剂,而氧化钠只是一种碱性氧化物【解析】因2Na2O2+2H2O===4NaOH+O2↑;2Na2O2+2CO2===2Na2CO3+O2,Na2O+H2O===2NaOH;Na2O+CO2===Na2CO3,故C项正确,B项错;置于空气中,最终都变为碳酸钠白色粉末,故A项正确;D项显然也正确。
3.Na 2O 2与CO 2、H 2O 反应的几个重要关系 2CO 2+2Na 2O 2===2Na 2CO 3+O 2 2H 2O +2Na 2O 2===4NaOH +O 2↑ (1)物质的量关系。
无论是CO 2或H 2O 的单一物质还是两者的混合物,通过足量的Na 2O 2时CO 2或H 2O 与放出O 2的物质的量之比都为21。
(2)电子转移关系。
当Na 2O 2与CO 2或H 2O 反应时,每产生1 mol O 2转移2 mol e -。
(3)先后顺序关系。
Na 2O 2与一定量CO 2和H 2O(g)的混合物反应时,可看作Na 2O 2先与CO 2反应,待CO 2消耗完后,Na 2O 2再与H 2O 发生反应。
(4)气体体积关系——气体体积差量法。
气体体积关系:CO 2和水蒸气的混合气体或两者的单一气体通过足量Na 2O 2时,气体的体积变为原来的12,即生成O 2的体积。
ΔV =12V (CO 2)=V (O 2);ΔV =12V (H 2O)=V (O 2)。
(5)固体质量关系——固体质量差量法。
每有2 mol CO2参与反应,固体质量增加56 g,相当于2 mol CO的质量;每有2 mol H2O参与反应,固体质量增加4 g,相当于2 mol H2的质量。
即CO2、H2O(g)分别与足量Na2O2反应时,固体增加的质量分别相当于与CO2、H2O等物质的量的CO、H2的质量。
据此引申可得,若H2或CO或者通式符合(CO)m(H2)n(m=0,1,2…,n=0,1,2…)的物质在O2中燃烧,将其产物通过足量Na2O2固体,反应完全后,固体增加的质量等于与O2反应的物质的质量。
练习题1、Na2O和 Na2O2在下列哪一点性质上是相似的( B )A 颜色B 水溶液的酸碱性C 氧化性D 漂白性2、Na2O和 Na2O2的共同点是(B)A 均为淡黄色固体 B均能与水反应 C均含O2 D均与CO2生成 O2过氧化钠具强氧化性,遇木炭、铝粉等还原性物质可燃烧,下列有关说法不正确的是(B)A 过氧化钠晶体中,阴离子与阳离子的个数之比:1:1B熔融过氧化钠时不能用石英坩埚C过氧化钠与木炭、铝粉反应时,过氧化钠均表现出强氧化性D过氧化钠与二氧化硫反应时可生成硫酸钠解析:A、过氧化钠晶体中,过氧化钠是由钠离子和过氧根离子构成,阴离子与阳离子的个数之比为1:2,故A错;B、过氧化钠和二氧化硅反应,熔融过氧化钠时不可使用石英坩埚,故B 对;C、过氧化钠具有强氧化性,铝、碳具有还原性,过氧化钠氧化铝、碳表现强氧化性,故C对;D、过氧化钠具有氧化性,二氧化硫具有还原性,过氧化钠与二氧化硫反应时可生成硫酸钠Na2O2+SO2=Na2SO4,故D正确;故选A.4、下列对于Na2O和 Na2O2的比较正确的一项是( C )A Na2O和 Na2O2都是钠的氧化物,都是碱性氧化物B Na2O和 Na2O2都是易溶于水(与水反应)的白色固体C Na2O2在和CO2的反应中既是氧化剂又是还原剂D Na2O2与水反应时,1molNa2O2转移2mol电子5、下列金属化合物中最方便用于潜水艇舱内供氧的是(D)A KMnO4 B KClO3C KNO3D Na2O26、NA代表阿伏加德罗常数,常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,对该反应的分析,错误的是( C )A、反应前后物质中阴、阳离子数目保持不变B、反应前后总物质的量减少C、反应中转移了NA电子并生成了氧气D、反应的二氧化碳和生成的氧气体积之比为2:17、(2013•闸北区二模)Na2O2、Cl2和SO2均能使品红溶液褪色(N A为阿A.Na2O2、Cl2、SO2使品红溶液褪色的原理相同B.标准状况下,1 mol Na2O2和反应,转移电子数目为NAC.等物质的量的Cl2和SO2同时通入品红溶液中,品红褪色更快D.在Na2O2中阴阳离子所含的电子数目相等生成无色物质,据此判断反应原理是否相同;B.过氧化钠和二氧化碳的反应为2Na2O2+2CO2=Na2CO3+O2,根据过氧化钠和转移电子之间的关系式计算;C.SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,发生:SO2+Cl2+2H2O=H2SO4+2HCl,不再具有漂白性;D.过氧化钠中阴阳离子分别是O22-和Na+.8、什么是碱性氧化物 Na2O和 Na2O2 都能与水反应生成NaOH,所以Na2O和 Na2O2 都是碱性氧化物,你同意这种观点吗答:能与酸反应生成盐和水的氧化物是碱性氧化物,且只能生成盐和水,不能有其他物质生成。
Na2O与盐酸反应生成盐和水,是碱性氧化物,而 Na2O2 与酸反应生成盐和水之外,还有O2 ,所以 Na2O2 不属于碱性氧化物。
9写出Na2O2 与水反应的分步反应式和总反应式,以及标出电子转移方向和数目、氧化剂、还原剂、氧化产物、还原产物。
若2molNa2O2 与水反应,转移多少电子,生成多少O2 那生成又需要多少Na2O2答:过氧化钠与水的反应分两步进行:⑴产生过氧化氢 Na2O2+2H2O=2NaOH+H2O2⑵过氧化氢分解 2H2O2=2H2O+O2↑过氧化钠与水的反应放出的热,使生成的过氧化氢分解为氧气和水10、通过过氧化钠与水制取氧气,你还能回忆出初中学过的制取氧气的方法吗两个实验有什么不同答:两个实验室用固体反应物制取氧气的化学方程式:(2)实验室中用液体双氧水制取氧气2H2O2 MnO22H2O+O2↑(3)固液反应不加热装置:Na2O2 与水反应制取氧气2Na2O2+2H2O=4NaOH+O2↑11、 Na2O2与氢硫酸H2S反应方程式:(1)氢硫酸少量分步:2Na2O2+2H2O==4NaOH+O2↑2H2S+O2==2H2O+2S↓合反应: Na2O2+H2S==2NaO H+S↓(2)氢硫酸过量2H2S+Na2O2===Na2S+2H2O12、.(1)Na2O2常作漂白剂,向品红试液(一种红色色素)中加入Na2O2有何现象(2)向酚酞的水中加入Na2O2有何现象。
