肌酐测定试剂盒(苦味酸法)产品技术要求beiken
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求baiding

肌酐测定试剂盒(肌氨酸氧化酶法)适用范围:本试剂用于体外定量测定人血清中肌酐的含量。
1.1 包装规格
产品组成:
2.1 外观
2.1.1 试剂1为淡黄色透明液体,无混浊,无未溶解物。
2.1.2 试剂2为淡粉色透明液体,无混浊,无未溶解物。
2.1.3 校准品为无色透明液体, 无未溶解物。
2.1.4 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量
液体试剂的净含量不少于标示值。
2.3 试剂空白吸光度
A≤0.080(光径1.0cm,548nm±20nm 波长)。
2.4 分析灵敏度
测定100μmol/L样本,吸光度变化在0.010~0.030范围内。
2.5 线性区间
2.5.1 [5.6,1500]μmol/L(37℃)。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.990。
2.5.2 [5.6,50]μmol/L范围内,线性绝对偏差应不超过±5μmol/L;(50,1500]μmol/L范围内,线性相对偏差应不超过±10%。
2.6 精密度
2.6.1 重复性
变异系数CV≤5%。
2.6.2 批间差
批间相对极差≤8%。
2.7 准确度
相对偏差在±10%范围内(测试国际参考物质SRM 909c (NIST))。
2.8 稳定性
原装试剂2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应应符合2.1、2.3、2.4、2.5、2.6.1、和2.7要求。
肌酐(CREA)测定试剂盒(肌氨酸氧化酶法)产品技术要求derui
肌酐(CREA)测定试剂盒
2、性能指标
2.1外观和性状
外观和性状应符合表2要求。
表2 试剂盒内各组分的外观性状
2.2试剂空白吸光度
试剂以生理盐水为空白时,波长546 nm,光径1.0 cm,温度37℃,吸光度≤0.5。
2.3分析灵敏度
试剂盒测试浓度为100 μmol/L被测物时,吸光度变化值≥0.02。
2.4线性范围
2.4.1试剂盒在30~3000μmol/L区间(范围)内,其回归系数r≥0.990。
2.4.2相对偏差或绝对偏差应符合表3要求。
表 3 相对偏差或绝对偏差
2.5精密度
2.5.1试剂盒重复性CV 值应≤5.0%。
2.5.2试剂盒批间相对极差(R)应≤10.0%。
2.6准确度
相对偏差(Bias%)应在有证参考物质靶值±10%以内。
2.7液体装量
试剂盒不同规格的净含量应不少于其标示量。
1。
肌酐检测试剂盒(酶法)产品技术要求
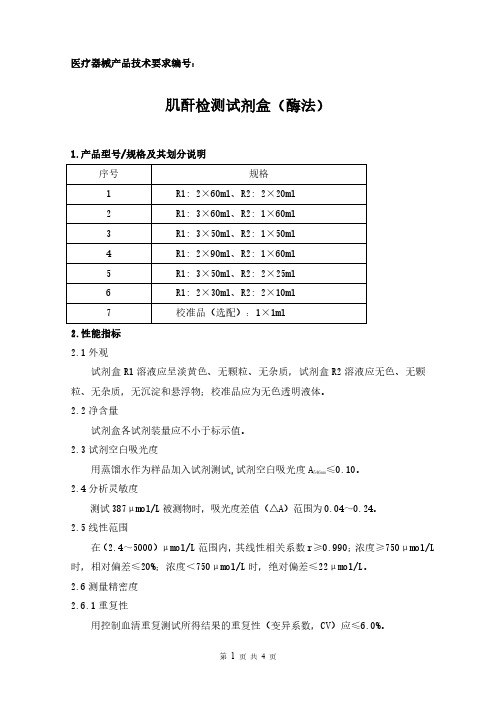
医疗器械产品技术要求编号:肌酐检测试剂盒(酶法)1.产品型号/规格及其划分说明序号规格1R1:2×60ml、R2:2×20ml2R1:3×60ml、R2:1×60ml3R1:3×50ml、R2:1×50ml4R1:2×90ml、R2:1×60ml5R1:3×50ml、R2:2×25ml6R1:2×30ml、R2:2×10ml7校准品(选配):1×1ml2.性能指标2.1外观试剂盒R1溶液应呈淡黄色、无颗粒、无杂质,试剂盒R2溶液应无色、无颗粒、无杂质,无沉淀和悬浮物;校准品应为无色透明液体。
2.2净含量试剂盒各试剂装量应不小于标示值。
2.3试剂空白吸光度用蒸馏水作为样品加入试剂测试,试剂空白吸光度A≤0.10。
546nm2.4分析灵敏度测试387μmol/L被测物时,吸光度差值(△A)范围为0.04~0.24。
2.5线性范围在(2.4~5000)μmol/L范围内,其线性相关系数r≥0.990;浓度≥750μmol/L 时,相对偏差≤20%;浓度<750μmol/L时,绝对偏差≤22μmol/L。
2.6测量精密度2.6.1重复性用控制血清重复测试所得结果的重复性(变异系数,CV)应≤6.0%。
2.6.2批间差批间差应≤10.0%。
2.7准确度用参考物质进行测试,其相对偏差应≤10.0%。
3.检验方法仪器基本要求a)波长:546nm;温度:37℃±1℃。
b)全自动生化分析仪。
测试方法按说明书规定,因不同机型使用试剂最终浓度相同。
在此推荐以本公司BECKMAN或HITACHI全自动生化分析仪进行测试。
3.1外观和性状目测检查,应符合2.1的要求。
3.2净含量用通用量具进行测量,应符合2.2的要求。
3.3试剂空白吸光度用蒸馏水作为样品测试试剂(盒),在测试波长546nm下,记录测试启动时的吸光度(A1)和约5min(t)后的吸光度(A2),A2测试结果即为试剂空白吸光度测定值,应符合2.3的要求。
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求meigaoyi

肌酐测定试剂盒(肌氨酸氧化酶法) 适用范围:用于体外定量检测人血清中肌酐的浓度。
1.1包装规格a) 试剂1:2×45ml,试剂2:2×15ml;b)试剂1:7×65ml,试剂2:3×50ml;c)试剂1:3×60ml,试剂2: 3×20ml;d) 试剂1:2×300ml,试剂2:2×100ml;e) 试剂1:12×16.8ml,试剂2:12×5.6ml;f) 试剂1:2×54ml,试剂2:2×18ml;g)试剂1:1×30ml,试剂2:1×10ml。
1.2主要组成成分试剂1主要组成成分试剂2主要组成成分2.1外观和性状2.1.1试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2试剂1应为淡黄色透明溶液;试剂2应为无色或淡黄色透明溶液。
2.2净含量应不低于试剂瓶标示装量。
2.3试剂空白测定试剂空白吸光度,应<0.2;2.4分析灵敏度测试100umol/L的被测物时,吸光度变化(△A)应不低于0.010。
2.5准确度测定值与靶值相对偏差不超过±10%。
2.6精密度2.6.1重复性重复测定高值浓度的样品,变异系数(CV)应不超过5%。
2.6.2批间差抽取3个不同批号试剂,对同一浓度样品进行重复检测,试剂盒批间相对极差应不大于10%。
2.7线性试剂线性在(30,9000)umol/L区间内:2.7.1线性回归的相关系数(r)应不低于0.990;2.7.2(70,9000)umol/L区间内,相对偏差不超过±10%。
2.7.3(30,70]umol/L区间内,绝对偏差不超过±7umol/L。
2.8 稳定性该产品在2℃~8℃条件下贮存有效期为18个月,取效期末的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6.1、2.7之规定。
肌酐测定试剂盒(肌氨酸氧化酶法,液体Ⅰ型)产品技术要求

肌酐测定试剂盒(肌氨酸氧化酶法,液体Ⅰ型)适用范围:本产品用于体外定量测定人血清中肌酐的浓度。
1.1 规格液体双剂型试剂1(R1):60mL×2,试剂2(R2):30mL×2;试剂1(R1):80mL×2,试剂2(R2):40mL×2。
1.2 规格划分说明根据净含量划分规格。
1.3 主要组成成分试剂盒由试剂1(R1)液体和试剂2(R2)液体组成。
1.3.1 试剂1(R1)液体:肌酸脒基水解酶 60KU/L肌氨酸氧化酶21KU/L稳定剂1.3.2 试剂2(R2)液体:肌酐氨基水解酶390KU/L4-氨基安替吡啉90mg/dL过氧化物酶 20KU/L2.1 外观试剂盒中各组件的外观应满足:a) 试剂1(R1)应为淡黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
b) 试剂2(R2)应为无色或淡黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长546nm(540nm~560nm)(光径1cm)处,试剂空白吸光度(A)应≤0.200。
2.4 准确度测定GBW09174 ,相对偏差应不超过±10%。
2.5 分析灵敏度对应于浓度为100μmol/L的Cre所引起的吸光度差值(△A)的绝对值应在0.015~0.028的范围内。
2.6 重复性重复测试血清样本或质控品,变异系数(CV)应≤5%。
2.7 批间差测定血清样本或质控品,批间差(R)应≤6%。
2.8 线性范围在[22,3000]μmol/L范围内,线性相关系数(r)应≥0.990;在(60,3000]μmol/L范围内,线性相对偏差应不超过±10%;在[22,60]μmol/L范围内,线性绝对偏差应不超过±6μmol/L。
2.9 试剂稳定性2.9.1效期稳定性:原包装的试剂盒在2℃~8℃避光贮存,有效期为12个月。
肌酐测定试剂盒(苦味酸法)产品技术要求huayuyikang

肌酐测定试剂盒(苦味酸法)适用范围:本试剂用于体外定量测定人血清或尿液中肌酐的含量。
1.1 产品型号/规格试剂1:1×20ml、试剂2:1×5ml;试剂1:1×40ml、试剂2:1×10ml;试剂1:2×40ml、试剂2:2×10ml;试剂1:4×40ml、试剂2:4×10ml;试剂1:8×40ml、试剂2:8×10ml;试剂1:1×80ml、试剂2:1×20ml;试剂1:2×80ml、试剂2:2×20ml;试剂1:5×80ml、试剂2:5×20ml;试剂1:3×60ml、试剂2:1×45ml;试剂1:6×70ml、试剂2:3×35ml;试剂1:5×40ml、试剂2:1×50ml;试剂1:8×50ml、试剂2:2×50ml;试剂1:4×80ml、试剂2:4×20ml;试剂1:4×50ml、试剂2:1×50ml;1.2 划分说明试剂1:NaOH 300mmol/L试剂2:苦味酸 0.5mol/L2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰、准确、牢固。
2.1.2 试剂1应为无色液体;试剂2应为黄色澄清液体。
2.2 净含量不少于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在光径1 cm、主波长505 nm下,以蒸馏水为检测样本时,吸光度应不大于0.600。
2.3.2 试剂空白吸光度变化率在光径1 cm、主波长505 nm下,以蒸馏水为检测样本时,吸光度变化率(△A/min)不大于0.010。
2.4 分析灵敏度肌酐含量为100 μmol/L时,测定吸光度变化率(△A/min)应在0.031—0.056范围内。
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求haomai

肌酐测定试剂盒(肌氨酸氧化酶法)适用范围:本试剂用于体外定量测定人血清中肌酐(CRE)的含量。
1.1包装规格序号规格1 试剂1:1×45ml;试剂2:1×15ml;校准品:1×3ml。
2 试剂1:2×60ml;试剂2:2×20ml;校准品:1×3ml。
3 试剂1:4×60ml;试剂2:4×20ml;校准品:1×3ml。
4 试剂1:5×60ml;试剂2:5×20ml;校准品:1×3ml。
5 试剂1:6×60ml;试剂2:6×20ml;校准品:1×3ml。
6 试剂1:5×18ml;试剂2:5×6ml;校准品:1×3ml。
7 试剂1:15L;试剂2:5L。
1.2主要组成成分本试剂由试剂1(R1)、试剂2(R2)和校准品(STD)组成试剂1(R1):N, N-双(4-磺丁基)-3-甲基苯胺二钠盐(TODB) 2.49g/L、肌酸酶0.3ku/L、肌氨酸氧化酶 0.1ku/L试剂2(R2): 4-氨基安替比林 0.46g/L、叠氮钠 1.0g/L、肌酐酶 0.5ku/L、过氧化物酶 0.16ku/L校准品:肌酐(基质:水溶液:浓度:176.8umol/L)2.1 外观试剂盒外观应整洁,文字符号标识清晰;R1为淡黄色透明液体,R2为无色至淡黄色液体,校准品为无色透明液体。
液体试剂不得有沉淀和絮状物。
2.2 装量试剂瓶内液体装量应不少于标示值。
2.3 空白吸光度以生理盐水为样品,在37℃、546nm波长、1cm光径条件下,吸光度≤0.25。
2.4 分析灵敏度浓度为100μmol/L的样本,吸光度差值△A>0.01。
2.5 准确性相对偏差应不大于10%。
2.6 重复性用不同浓度的两个样本进行检测,各重复检测10次,其批内变异系数(CV)应不超过5%。
Roche P模块 肌酐(苦味酸)说明书

质控: 质控使用“订单信息”中列出的材料。 可添加其他适用的质控品。 血清/血浆 使用上面列出的未稀释血清质控材料进行 质控。 可添加其他适用的质控品。 尿液 使用上面列出的 Precinorm PUC 和 Precipath PUC 进行质控。 可添加其他适用的质控品。 应根据各实验室的具体要求采用适合的质 控间隔和限值。检测值应在设定的范围 内。若质控值在设定范围外,各实验室应 采取相应措施。 按可用的政府规章和地方法规进行质控。
稀释液 (NaCl)
6µL 144µL
2µL 180µL
10µL 115µL
cobas c 111 系统-检测设定
血清、血浆和尿液应用参数
测定模式
吸光度
Abs.计算模式
动态
反应方向
上升
波长 A/B
512/583 nm
计算结果 第一次/最后一次 21/26
血清/血浆
补偿
-18µmol/L (-0.2mg/dL)
波长(副/主) 反应方向
单位
试剂移液 R1 R3
样本 样本容量
正常 减少 增加
10µL 10µL 10µL
速率法 A
10/27-37-15-23 (STAT 4/12-19)
570/505nm
上升
µmol/L (mg/dL,mmol/L)
稀释 样本稀释
样本
30µL
样本
样本稀释
样本容量
样本
稀释液 (NaCl)
正常
10µL 6µL 144µL
减少
10µL 2µL 180µL
增加
10µL 10µL 115µL
cobas c 311 系统-检测设定 血清和血浆应用参数
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求wantaiderui

肌酐测定试剂盒(肌氨酸氧化酶法)适用范围:用于体外定量测定人血清中肌酐的浓度。
1.1包装规格试剂1:68mL×6 、试剂2:45mL×3;试剂1:45mL×3 、试剂2:45mL×1;试剂1:45mL×4 、试剂2:30mL×2;试剂1:45mL×1 、试剂2:15mL×1;试剂1:45mL×3 、试剂2:15mL×3;试剂1:15mL×1、试剂2:5mL×1;1300测试/盒(试剂1:69mL×2、试剂2:23mL×2);2600测试/盒(试剂1:69mL×4、试剂2:23mL×4);1700测试/盒(试剂1:90mL×2、试剂2:30mL×2);840测试/盒(试剂1:22mL×4、试剂2:15mL×2);840测试/盒(试剂1:45mL×2、试剂2:15mL×2);950测试/盒(试剂1:24mL×2、试剂2:8mL×2);1000测试/盒(试剂1:44mL×4、试剂2:30mL×2);1260测试/盒(试剂1:45mL×3、试剂2:44mL×1);600测试/盒(试剂1:44mL×1、试剂2:15mL×1);2320测试/盒(试剂1:74mL×4、试剂2:28mL×4)。
1.2组成成分试剂1:肌酐酰基水解酶>40KU/L抗坏血酸氧化酶 >2KU/L肌胺酸氧化酶>8KU/L过氧化氢酶 >110KU/LN-乙基-N-(2-羟基-3-磺丙基)-3-甲基苯胺 1.5mM 试剂2:肌酐胺基水解酶 >450KU/L4-氨基安替比林 2.5mM过氧化物酶>55KU/L2.1试剂装量应不低于瓶签标示装量。
肌酐测定试剂盒(苦味酸法)产品技术要求zsbk0

肌酐测定试剂盒(苦味酸法)适用范围:本产品用于体外定量测定人血清中肌酐的浓度。
1.1包装规格液体型试剂1(R1):100mL×1,试剂2(R2):100mL×1,校准品:2mL×1。
1.2主要组成成分试剂1(R1)液体:氢氧化钠 0.32mol/L试剂2(R2)液体:苦味酸 35mmol/L校准品液体:水溶液基质(1个浓度)肌酐校准品定值范围100μmol/L~150μmol/L(每批定值,详见值单) 2.1 外观试剂盒中各组件的外观应满足:2.1.1试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.1.2试剂2(R2)应为橘黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.1.3校准品应为无色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长505nm(480nm~520nm)(光径1cm)处,试剂空白吸光度(A)应≤0.350,试剂空白吸光度变化率(△A/min)应≤0.035。
2.4准确度测定GBW09174,测定结果的相对偏差应不超过±10%。
2.5分析灵敏度对应于浓度为100μmol/L的肌酐所产生的吸光度差值(△A)应在0.011~0.070的范围内。
2.6重复性重复测试高、中、低浓度样本,变异系数(CV)应≤5%。
2.7批间差测试同一样本,批间差(R)应≤5%。
2.8线性范围在[22,880]μmol/L范围内,线性相关系数(r)应≥0.990;在(80,880]μmol/L范围内,线性相对偏差应不超过±10%;在[22,80]μmol/L范围内,线性绝对偏差应不超过±8μmol/L。
2.9试剂稳定性2.9.1效期稳定性原包装的试剂盒在2℃~8℃避光贮存,有效期为16个月。
试剂有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8 的要求。
肌酐(CRE)测定试剂盒(苦味酸法)产品技术要求lideman

肌酐(CRE)测定试剂盒(苦味酸法) 适用范围:本产品用于体外定量测定人血清中肌酐的含量。
1.1包装规格试剂1(R1):2×80mL、试剂2(R2):2×80mL;试剂1(R1):3×60mL、试剂2(R2):3×60mL;试剂1(R1):2×40mL、试剂2(R2):2×40mL;试剂1(R1):2×80mL、试剂2(R2):2×16mL;试剂1(R1):2×60mL、试剂2(R2):2×20mL;试剂1(R1):4×60mL、试剂2(R2):1×60mL;试剂1(R1):1×10mL、试剂2(R2):1×10mL;试剂1(R1):1×60mL、试剂2(R2):1×60mL;试剂1(R1):2×30mL、试剂2(R2):2×30mL;试剂1(R1):3×61mL、试剂2(R2):3×61mL。
校准品(选配):1×3mL。
1.2主要组成成分1.2.1试剂组成表1 试剂组成1.2.2校准品的组成:单水平液体校准品,在水基质中添加肌酐(纯度:大于95%)。
定值范围:(50~300)μmol/L。
注:校准品浓度具有批特异性,具体浓度见标签。
2.1 外观液体双试剂:试剂1(R1)为无色澄清液体,试剂2(R2)为桔黄色澄清液体。
校准品:无色至浅黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度在37℃、(505nm±10%)范围内的波长、1cm光径条件下,试剂空白吸光度应<0.3 ABS。
2.4 分析灵敏度浓度为132.6μmol/L时,吸光度变化范围应在(0.004~0.02)ABS之间。
2.5 线性在(0,2210]μmol/L线性范围内,线性相关系数r2≥0.995。
肌酐测定试剂盒(肌氨酸氧化酶法,液体Ⅰ型)产品技术要求zhongshengbeikong

肌酐测定试剂盒(肌氨酸氧化酶法,液体Ⅰ型)适用范围:本产品与ABBOTT ARCHITECT c4000/c8000/c16000全自动生化分析仪配套使用,用于体外定量测定人血清中肌酐的浓度。
1.1 规格液体双剂型试剂1(R1):60mL×2,试剂2(R2):30mL×2;试剂1(R1):80mL×2,试剂2(R2):40mL×2。
1.2 规格划分说明根据净含量划分规格。
1.3 主要组成成分试剂盒由试剂1(R1)液体和试剂2(R2)液体组成。
1.3.1 试剂1(R1)液体:肌酸脒基水解酶 60KU/L肌氨酸氧化酶21KU/L稳定剂1.3.2 试剂2(R2)液体:肌酐氨基水解酶 390KU/L4-氨基安替吡啉 90mg/dL过氧化物酶 20KU/L2.1 外观试剂盒中各组件的外观应满足:a) 试剂1(R1)应为淡黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
b) 试剂2(R2)应为无色或淡黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长546nm(540nm~560nm)(光径1cm)处,试剂空白吸光度(A)应≤0.200。
2.4 准确度测定GBW09174 ,相对偏差应不超过±10%。
2.5 分析灵敏度对应于浓度为100μmol/L的Cre所引起的吸光度差值(△A)的绝对值应在0.015~0.028的范围内。
2.6 重复性重复测试血清样本或质控品,变异系数(CV)应≤5%。
2.7 批间差测定血清样本或质控品,批间差(R)应≤6%。
2.8 线性范围在[22,3000]μmol/L范围内,线性相关系数(r)应≥0.990;在(60,3000]μmol/L范围内,线性相对偏差应不超过±10%;在[22,60]μmol/L范围内,线性绝对偏差应不超过±6μmol/L。
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求smxkm

肌酐测定试剂盒(肌氨酸氧化酶法)组成:试剂1(R1)主要成分:Good’ s缓冲液(pH 7.0~9.0)25mmol/L、肌酸酶≥40KU/L、肌氨酸氧化酶≥20KU/L、显色(TOOS)0.02 mmol/L;试剂2(R2)主要成分:Good’ s缓冲液(pH 7.0~9.0)100mmol/L、4-氨酰安替比林(4-AAP)0.02mmol/L、肌酐酶≥300KU/L、过氧化物酶(POD)≥5KU/L。
适用范围:用于体外定量检测人血清中肌酐的浓度。
1.1规格a) 试剂1:2×45ml,试剂2:2×15ml;b) 试剂1:2×54ml,试剂2:2×18ml;c) 试剂1:2×300ml,试剂2:2×100ml;d) 试剂1:3×60ml,试剂2:3×20ml;e) 试剂1:4×45ml,试剂2:4×15ml;f) 试剂1:6×70ml,试剂2:6×35ml;g) 试剂1:7×65ml,试剂2:3×50ml;h) 试剂1:12×16.8ml,试剂2:12×5.6ml;i) 试剂1:1×30ml,试剂2:1×10ml;j) 试剂1:2×30ml,试剂2:2×10ml;k) 试剂1:6×16.8ml,试剂2:6×5.6ml;l) 试剂1:1×45ml,试剂2:1×15ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 外观外包装完整无破损,标签清晰;试剂1应为淡黄色透明溶液;试剂2应为无色或淡黄色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白在550nm处测定试剂空白吸光度,应<0.2。
2.4 分析灵敏度测定浓度为100μmol/L的样品,吸光度变化(ΔA)应不低于0.015。
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求jiuqiang

肌酐测定试剂盒(肌氨酸氧化酶法)适用范围:用于体外定量测定人血清、血浆及尿液中肌酐的含量。
1.1 包装规格包装规格见表1。
表1 包装规格1.2 主要组成成分主要组成成分见表2。
表2 主要组成成分2.1 外观试剂1为黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白吸光度试剂空白:A546nm(主)/A700nm(副)下测定空白吸光度应≤0.1500。
2.4 准确度用国际参考物质SRM909,对试剂盒进行测试,其测量结果的相对偏差应不超过±10%。
2.5 分析灵敏度样本浓度为100μmol/L时,其吸光度变化在0.0140~0.0310之间。
2.6 线性区间测试血清或血浆样本,试剂线性在[30,1500]μmol/L(37℃)区间内:a)线性相关系数︱r︱应不小于0.990;b)[30,70]μmol/L区间内,线性绝对偏差应不超过±7μmol/L;(70,1500]μmol/L区间内,线性相对偏差应不超过±10%。
2.7 精密度2.7.1 重复性用血清样品或质控样品重复测试所得结果的变异系数(CV)应不大于5%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 稳定性试剂盒在2℃~8℃密封避光保存,有效期为12个月。
取到效期后的样品检测外观、线性区间、准确度,应符合2.1、2.4、2.6的要求。
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求lepu

肌酐测定试剂盒(肌氨酸氧化酶法) 适用范围:用于体外定量测定人血清中的肌酐含量。
1.1 规格试剂1: 60mL×2,试剂2: 20mL×2;试剂1: 60mL×4,试剂2: 20mL×4;试剂1: 45mL×1,试剂2: 15mL×1;试剂1: 3L×1, 试剂2: 1L×1;试剂1: 15L×1, 试剂2: 5L×1;试剂1: 30mL×3,试剂2: 10mL×3。
1.2主要组成成分试剂1主要组分:试剂2主要组分:2.1 外观试剂1:淡黄色透明溶液;试剂2:无色或淡黄色透明溶液。
外包装完好、无破损,标签完好、字迹清晰。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白在550nm处测定试剂空白吸光度,应<0.2。
2.4 分析灵敏度测试100umol/L的被测物时,吸光度变化(ΔA)应不低于0.001。
2.5 准确度测定参考物质(GBW09170),相对偏差应不超过±10%。
2.6 重复性用高、中、低三个浓度的样本重复测试,变异系数(CV)应不超过5%。
2.7 线性在[30,1500]umol/L(37℃)区间内:线性回归的相关系数|r|应不小于0.990。
[30,70]umol/L区间内线性偏差应不超过±7umol/L;(70,1500]umol/L区间内,线性偏差应不超过±10%。
2.8 批间差用3个不同批号试剂分别测试样本,相对极差应不大于10%。
2.9 稳定性取在2℃~8℃条件下贮存达到18个月后的试剂进行检测,检测结果应符合2.1、2.3、2.4、2.5、2.6、2.7的要求。
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求aiweide

肌酐测定试剂盒(肌氨酸氧化酶法)适用范围:用于体外定量测定人血清中肌酐的含量
1.1 包装规格
a)试剂1:2×45mL,试剂2:2×15mL;
b)试剂1:4×60mL,试剂2:4×20mL;
c)试剂1:2×60mL,试剂2:2×20mL。
1.2主要组成成分
1.2.1试剂1主要组分
1.2.2试剂2主要组份
2.1 外观
试剂1:黄色澄清液体;
试剂2:无色澄清液体。
2.2 试剂装量
应不低于试剂瓶标示装量。
2.3 试剂空白吸光度
在546nm波长处测定试剂空白吸光度,应<0.1。
2.4 分析灵敏度
测定CRE含量为1mmol/L样本时,其△A应为0.5081~0.6210。
2.5线性范围
2.5.1 在[10,8000] μmol/L范围内,线性回归的确定系数应不低于0.990。
2.5.2 测试浓度在[10,800]μmol/L范围内线性绝对偏差不超过±5μmol/L。
测试浓度在(800,8000] μmol/L范围内线性相对偏差应不超过±10%。
2.6 测量精密度
2.6.1 重复性:用三个水平质控血清重复测试其变异系数(CV)应不超过5%。
2.6.2 批间差:抽取3个不同批号的试剂,对同一份样本进行重复测定,相对极差≤10%。
2.7 准确度
以国家标准物质为检测样本时,测定结果相对偏差不超过±10%。
2.8 稳定性
取在2℃~8℃条件下贮存达到18个月的试剂进行检测,应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
肌酐检测试剂盒(苦味酸法)产品技术要求
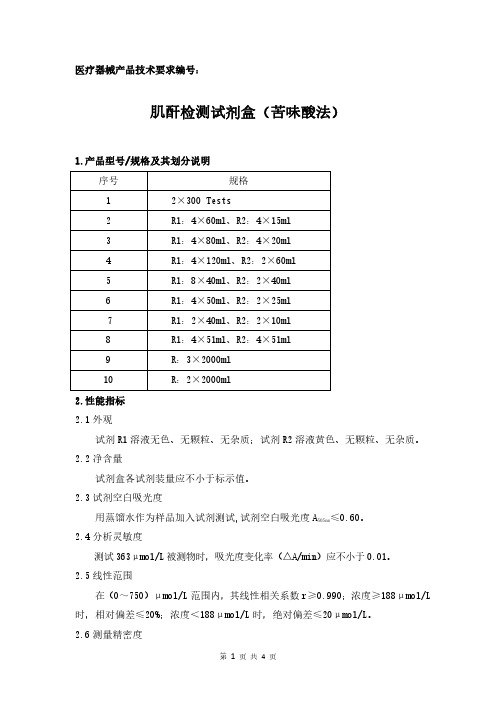
医疗器械产品技术要求编号:肌酐检测试剂盒(苦味酸法)1.产品型号/规格及其划分说明序号规格12×300Tests2R1:4×60ml、R2:4×15ml3R1:4×80ml、R2:4×20ml4R1:4×120ml、R2:2×60ml5R1:8×40ml、R2:2×40ml6R1:4×50ml、R2:2×25ml7R1:2×40ml、R2:2×10ml8R1:4×51ml、R2:4×51ml9R:3×2000ml10R:2×2000ml2.性能指标2.1外观试剂R1溶液无色、无颗粒、无杂质;试剂R2溶液黄色、无颗粒、无杂质。
2.2净含量试剂盒各试剂装量应不小于标示值。
2.3试剂空白吸光度≤0.60。
用蒸馏水作为样品加入试剂测试,试剂空白吸光度A505nm2.4分析灵敏度测试363μmol/L被测物时,吸光度变化率(△A/min)应不小于0.01。
2.5线性范围在(0~750)μmol/L范围内,其线性相关系数r≥0.990;浓度≥188μmol/L 时,相对偏差≤20%;浓度<188μmol/L时,绝对偏差≤20μmol/L。
2.6测量精密度2.6.1重复性用控制血清重复测试所得结果的重复性(变异系数,CV)应≤6.0%。
2.6.2批间差批间差应≤10.0%。
2.7准确度用参考物质进行测试,其相对偏差应≤10.0%。
3.检验方法仪器基本要求a)波长:505nm;温度:37℃±1℃。
b)全自动生化分析仪。
测试方法按说明书规定,因不同机型使用试剂最终浓度相同。
在此推荐以本公司BECKMAN或HITACHI全自动生化分析仪进行测试。
3.1外观和性状目测检查,试剂R1、R2溶液性状应符合2.1的规定。
3.2净含量用通用量具进行测量,应符合2.2的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
肌酐测定试剂盒(苦味酸法)
适用范围:本产品用于体外定量测定人血清中肌酐(CRE)的含量。
1.1包装规格
表1 包装规格
1.2产品组成成分
试剂盒由液体试剂A和B组成,各组成成分见表2。
表2 试剂盒组成
2.1外观
试剂A为黄色、试剂B为无色溶液,无沉淀剂絮状悬浮物,外包装完整无破损。
2.2净含量
试剂的净含量不少于标示值。
2.3 试剂空白
2.3.1试剂空白吸光度
用试剂盒测试蒸馏水,在500nm的波长测试时,测定吸光度值≤0.600。
2.3.2 试剂空白吸光度变化率
用试剂盒测试蒸馏水,在500nm的波长测试时,引起的吸光度变化率△A/min≤0.005。
2.4 分析灵敏度
测试一定浓度的肌酐,2.6µmol/L的肌酐引起的吸光度变化值应≥0.0007。
2.5 线性范围
本产品的线性范围是[2.6,1770]µmol/L或[0.03,20]mg/dL,线性相关系数r ≥0.990,在[2.6,200]µmol/L或[0.03,2]mg/dL范围内的绝对偏差不超过±
20µmol/L或0.2mg/dL,在[200,1770]µmol/L或[2,20]mg/dL范围内的相对偏差应不超过±10%。
2.6 重复性
2.6.1批内重复性
用高、中、低三个水平浓度的质控品重复测试所得结果的精密度(CV)≤10%。
2.6.2批间差
用同一水平质控品分别测试3个不同批号的试剂盒,其相对偏差≤10%。
2.7准确度
测试标准物质(编号:GBW09174、GBW09171、GBW09175),所得准确度偏差不超过±10%。
2.8 稳定性
试剂盒贮存在2℃~30℃条件下,有效期为24个月。
产品在有效期末一个月内测试2.3、2.4、2.5、2.6.1、2.7,结果符合各项要求。
