肌酐测定试剂盒(苦味酸法)产品技术要求baiding
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求baiding

肌酐测定试剂盒(肌氨酸氧化酶法)适用范围:本试剂用于体外定量测定人血清中肌酐的含量。
1.1 包装规格
产品组成:
2.1 外观
2.1.1 试剂1为淡黄色透明液体,无混浊,无未溶解物。
2.1.2 试剂2为淡粉色透明液体,无混浊,无未溶解物。
2.1.3 校准品为无色透明液体, 无未溶解物。
2.1.4 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量
液体试剂的净含量不少于标示值。
2.3 试剂空白吸光度
A≤0.080(光径1.0cm,548nm±20nm 波长)。
2.4 分析灵敏度
测定100μmol/L样本,吸光度变化在0.010~0.030范围内。
2.5 线性区间
2.5.1 [5.6,1500]μmol/L(37℃)。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.990。
2.5.2 [5.6,50]μmol/L范围内,线性绝对偏差应不超过±5μmol/L;(50,1500]μmol/L范围内,线性相对偏差应不超过±10%。
2.6 精密度
2.6.1 重复性
变异系数CV≤5%。
2.6.2 批间差
批间相对极差≤8%。
2.7 准确度
相对偏差在±10%范围内(测试国际参考物质SRM 909c (NIST))。
2.8 稳定性
原装试剂2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应应符合2.1、2.3、2.4、2.5、2.6.1、和2.7要求。
肌酐测定试剂盒(苦味酸法)产品技术要求beiken
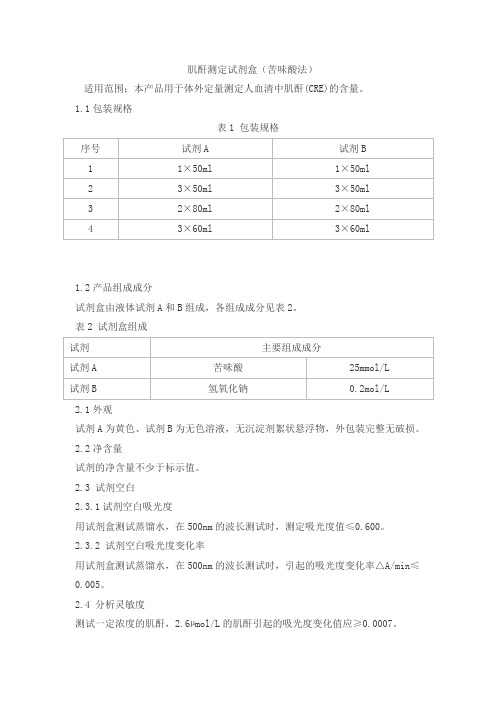
肌酐测定试剂盒(苦味酸法)适用范围:本产品用于体外定量测定人血清中肌酐(CRE)的含量。
1.1包装规格表1 包装规格1.2产品组成成分试剂盒由液体试剂A和B组成,各组成成分见表2。
表2 试剂盒组成2.1外观试剂A为黄色、试剂B为无色溶液,无沉淀剂絮状悬浮物,外包装完整无破损。
2.2净含量试剂的净含量不少于标示值。
2.3 试剂空白2.3.1试剂空白吸光度用试剂盒测试蒸馏水,在500nm的波长测试时,测定吸光度值≤0.600。
2.3.2 试剂空白吸光度变化率用试剂盒测试蒸馏水,在500nm的波长测试时,引起的吸光度变化率△A/min≤0.005。
2.4 分析灵敏度测试一定浓度的肌酐,2.6µmol/L的肌酐引起的吸光度变化值应≥0.0007。
2.5 线性范围本产品的线性范围是[2.6,1770]µmol/L或[0.03,20]mg/dL,线性相关系数r ≥0.990,在[2.6,200]µmol/L或[0.03,2]mg/dL范围内的绝对偏差不超过±20µmol/L或0.2mg/dL,在[200,1770]µmol/L或[2,20]mg/dL范围内的相对偏差应不超过±10%。
2.6 重复性2.6.1批内重复性用高、中、低三个水平浓度的质控品重复测试所得结果的精密度(CV)≤10%。
2.6.2批间差用同一水平质控品分别测试3个不同批号的试剂盒,其相对偏差≤10%。
2.7准确度测试标准物质(编号:GBW09174、GBW09171、GBW09175),所得准确度偏差不超过±10%。
2.8 稳定性试剂盒贮存在2℃~30℃条件下,有效期为24个月。
产品在有效期末一个月内测试2.3、2.4、2.5、2.6.1、2.7,结果符合各项要求。
肌酐检测试剂盒(酶法)产品技术要求
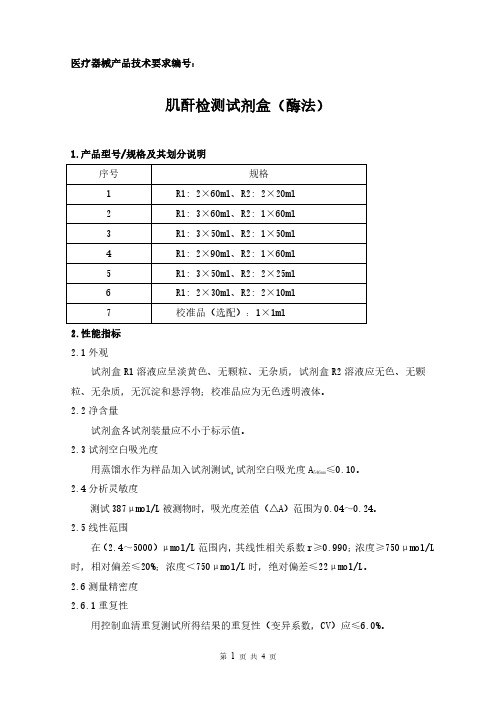
医疗器械产品技术要求编号:肌酐检测试剂盒(酶法)1.产品型号/规格及其划分说明序号规格1R1:2×60ml、R2:2×20ml2R1:3×60ml、R2:1×60ml3R1:3×50ml、R2:1×50ml4R1:2×90ml、R2:1×60ml5R1:3×50ml、R2:2×25ml6R1:2×30ml、R2:2×10ml7校准品(选配):1×1ml2.性能指标2.1外观试剂盒R1溶液应呈淡黄色、无颗粒、无杂质,试剂盒R2溶液应无色、无颗粒、无杂质,无沉淀和悬浮物;校准品应为无色透明液体。
2.2净含量试剂盒各试剂装量应不小于标示值。
2.3试剂空白吸光度用蒸馏水作为样品加入试剂测试,试剂空白吸光度A≤0.10。
546nm2.4分析灵敏度测试387μmol/L被测物时,吸光度差值(△A)范围为0.04~0.24。
2.5线性范围在(2.4~5000)μmol/L范围内,其线性相关系数r≥0.990;浓度≥750μmol/L 时,相对偏差≤20%;浓度<750μmol/L时,绝对偏差≤22μmol/L。
2.6测量精密度2.6.1重复性用控制血清重复测试所得结果的重复性(变异系数,CV)应≤6.0%。
2.6.2批间差批间差应≤10.0%。
2.7准确度用参考物质进行测试,其相对偏差应≤10.0%。
3.检验方法仪器基本要求a)波长:546nm;温度:37℃±1℃。
b)全自动生化分析仪。
测试方法按说明书规定,因不同机型使用试剂最终浓度相同。
在此推荐以本公司BECKMAN或HITACHI全自动生化分析仪进行测试。
3.1外观和性状目测检查,应符合2.1的要求。
3.2净含量用通用量具进行测量,应符合2.2的要求。
3.3试剂空白吸光度用蒸馏水作为样品测试试剂(盒),在测试波长546nm下,记录测试启动时的吸光度(A1)和约5min(t)后的吸光度(A2),A2测试结果即为试剂空白吸光度测定值,应符合2.3的要求。
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求meigaoyi

肌酐测定试剂盒(肌氨酸氧化酶法) 适用范围:用于体外定量检测人血清中肌酐的浓度。
1.1包装规格a) 试剂1:2×45ml,试剂2:2×15ml;b)试剂1:7×65ml,试剂2:3×50ml;c)试剂1:3×60ml,试剂2: 3×20ml;d) 试剂1:2×300ml,试剂2:2×100ml;e) 试剂1:12×16.8ml,试剂2:12×5.6ml;f) 试剂1:2×54ml,试剂2:2×18ml;g)试剂1:1×30ml,试剂2:1×10ml。
1.2主要组成成分试剂1主要组成成分试剂2主要组成成分2.1外观和性状2.1.1试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2试剂1应为淡黄色透明溶液;试剂2应为无色或淡黄色透明溶液。
2.2净含量应不低于试剂瓶标示装量。
2.3试剂空白测定试剂空白吸光度,应<0.2;2.4分析灵敏度测试100umol/L的被测物时,吸光度变化(△A)应不低于0.010。
2.5准确度测定值与靶值相对偏差不超过±10%。
2.6精密度2.6.1重复性重复测定高值浓度的样品,变异系数(CV)应不超过5%。
2.6.2批间差抽取3个不同批号试剂,对同一浓度样品进行重复检测,试剂盒批间相对极差应不大于10%。
2.7线性试剂线性在(30,9000)umol/L区间内:2.7.1线性回归的相关系数(r)应不低于0.990;2.7.2(70,9000)umol/L区间内,相对偏差不超过±10%。
2.7.3(30,70]umol/L区间内,绝对偏差不超过±7umol/L。
2.8 稳定性该产品在2℃~8℃条件下贮存有效期为18个月,取效期末的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6.1、2.7之规定。
肌酐测定试剂盒(肌氨酸氧化酶法,液体Ⅰ型)产品技术要求

肌酐测定试剂盒(肌氨酸氧化酶法,液体Ⅰ型)适用范围:本产品用于体外定量测定人血清中肌酐的浓度。
1.1 规格液体双剂型试剂1(R1):60mL×2,试剂2(R2):30mL×2;试剂1(R1):80mL×2,试剂2(R2):40mL×2。
1.2 规格划分说明根据净含量划分规格。
1.3 主要组成成分试剂盒由试剂1(R1)液体和试剂2(R2)液体组成。
1.3.1 试剂1(R1)液体:肌酸脒基水解酶 60KU/L肌氨酸氧化酶21KU/L稳定剂1.3.2 试剂2(R2)液体:肌酐氨基水解酶390KU/L4-氨基安替吡啉90mg/dL过氧化物酶 20KU/L2.1 外观试剂盒中各组件的外观应满足:a) 试剂1(R1)应为淡黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
b) 试剂2(R2)应为无色或淡黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长546nm(540nm~560nm)(光径1cm)处,试剂空白吸光度(A)应≤0.200。
2.4 准确度测定GBW09174 ,相对偏差应不超过±10%。
2.5 分析灵敏度对应于浓度为100μmol/L的Cre所引起的吸光度差值(△A)的绝对值应在0.015~0.028的范围内。
2.6 重复性重复测试血清样本或质控品,变异系数(CV)应≤5%。
2.7 批间差测定血清样本或质控品,批间差(R)应≤6%。
2.8 线性范围在[22,3000]μmol/L范围内,线性相关系数(r)应≥0.990;在(60,3000]μmol/L范围内,线性相对偏差应不超过±10%;在[22,60]μmol/L范围内,线性绝对偏差应不超过±6μmol/L。
2.9 试剂稳定性2.9.1效期稳定性:原包装的试剂盒在2℃~8℃避光贮存,有效期为12个月。
肌酐(CREA)测定试剂盒(肌氨酸氧化酶法)产品技术要求mairui

2性能指标
2.1外观
试剂应为清澈透明的液体,无沉淀、悬浮物和絮状物。
2.2净含量
液体试剂的净含量应不少于标示值。
2.3试剂空白吸光度
试剂以水为空白在37 ℃ 1 ℃,546nm 波长条件下,吸光度应小于0.2 A。
2.4分析灵敏度
当样本浓度为60μmol/L 时,吸光度变化应不小于0.016 A。
2.5线性范围
试剂盒在(10~7000)μmol/L 范围内:
a)线性相关系数r 应不小于0.9900;
b)当样本浓度不大于390 μmol/L 时,线性绝对偏差应不大于±39.0 μmol/L;当样本浓度大于390 μmol/L时,线性相对偏差应不大于±10.0%。
2.6测量精密度
2.6.1重复性
变异系数:CV 应不大于 3.0%。
2.6.2批间差
相对偏差:R 应不大于 5.0%。
2.7准确度
测定校准品,测定结果与靶值的相对偏差应不大于±10.0%。
2.8分析特异性
血红蛋白浓度在100 mg/dL 内、抗坏血酸浓度在30 mg/dL 内、内源性酯浓度在250 mg/dL 内、胆红素浓度在20 mg/dL 内,对试剂检测结果的偏差影响应在±10%以内。
2.9校准品均一性
试剂盒校准品的均一性:CV 应不大于 3.0%。
1。
肌酐测定试剂盒(苦味酸法)产品技术要求huayuyikang

肌酐测定试剂盒(苦味酸法)适用范围:本试剂用于体外定量测定人血清或尿液中肌酐的含量。
1.1 产品型号/规格试剂1:1×20ml、试剂2:1×5ml;试剂1:1×40ml、试剂2:1×10ml;试剂1:2×40ml、试剂2:2×10ml;试剂1:4×40ml、试剂2:4×10ml;试剂1:8×40ml、试剂2:8×10ml;试剂1:1×80ml、试剂2:1×20ml;试剂1:2×80ml、试剂2:2×20ml;试剂1:5×80ml、试剂2:5×20ml;试剂1:3×60ml、试剂2:1×45ml;试剂1:6×70ml、试剂2:3×35ml;试剂1:5×40ml、试剂2:1×50ml;试剂1:8×50ml、试剂2:2×50ml;试剂1:4×80ml、试剂2:4×20ml;试剂1:4×50ml、试剂2:1×50ml;1.2 划分说明试剂1:NaOH 300mmol/L试剂2:苦味酸 0.5mol/L2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;中文包装标签应清晰、准确、牢固。
2.1.2 试剂1应为无色液体;试剂2应为黄色澄清液体。
2.2 净含量不少于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在光径1 cm、主波长505 nm下,以蒸馏水为检测样本时,吸光度应不大于0.600。
2.3.2 试剂空白吸光度变化率在光径1 cm、主波长505 nm下,以蒸馏水为检测样本时,吸光度变化率(△A/min)不大于0.010。
2.4 分析灵敏度肌酐含量为100 μmol/L时,测定吸光度变化率(△A/min)应在0.031—0.056范围内。
肌酐(CRE)测定试剂盒(肌氨酸氧化酶法)产品技术要求lideman

肌酐(CRE)测定试剂盒(肌氨酸氧化酶法)适用范围:本产品用于体外定量测定人血清中肌酐的含量。
1.1规格试剂1(R1):2×60mL,试剂2(R2):2×20mL;试剂1(R1):4×60mL,试剂2(R2):2×40mL;试剂1(R1):3×40mL,试剂2(R2):3×10mL;试剂1(R1):2×300mL,试剂2(R2):1×200mL;试剂1(R1):2×80mL,试剂2(R2):2×16mL;试剂1(R1):2×60mL,试剂2(R2):2×12mL;试剂1(R1):5×60mL,试剂2(R2):5×12mL;试剂1(R1):5×60mL,试剂2(R2):5×20mL;试剂1(R1):2×40mL,试剂2(R2):1×16mL;试剂1(R1):3×60mL,试剂2(R2):3×60mL;试剂1(R1):2×80mL,试剂2(R2):2×80mL;试剂1(R1):2×40mL,试剂2(R2):2×40mL;试剂1(R1):1×18mL,试剂2(R2):1×6mL ;试剂1(R1):2×45mL,试剂2(R2):2×15mL。
512T:试剂1(R1):134.4mL,试剂2(R):44.8mL。
校准品(选配):1×3mL。
1.2 组成1.2.1试剂组成试剂1(R1)(以下简称R1)试剂2(R2)(以下简称R2)表1 试剂组成1.2.2校准品的组成:单水平的液体校准品,在水基质中添加肌酐(纯度:大于95)%;定值范围:(400-500)μmol/L。
2.1 外观液体双试剂:R1为浅黄色澄清液体,R2为浅黄色澄清液体。
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求haomai

肌酐测定试剂盒(肌氨酸氧化酶法)适用范围:本试剂用于体外定量测定人血清中肌酐(CRE)的含量。
1.1包装规格序号规格1 试剂1:1×45ml;试剂2:1×15ml;校准品:1×3ml。
2 试剂1:2×60ml;试剂2:2×20ml;校准品:1×3ml。
3 试剂1:4×60ml;试剂2:4×20ml;校准品:1×3ml。
4 试剂1:5×60ml;试剂2:5×20ml;校准品:1×3ml。
5 试剂1:6×60ml;试剂2:6×20ml;校准品:1×3ml。
6 试剂1:5×18ml;试剂2:5×6ml;校准品:1×3ml。
7 试剂1:15L;试剂2:5L。
1.2主要组成成分本试剂由试剂1(R1)、试剂2(R2)和校准品(STD)组成试剂1(R1):N, N-双(4-磺丁基)-3-甲基苯胺二钠盐(TODB) 2.49g/L、肌酸酶0.3ku/L、肌氨酸氧化酶 0.1ku/L试剂2(R2): 4-氨基安替比林 0.46g/L、叠氮钠 1.0g/L、肌酐酶 0.5ku/L、过氧化物酶 0.16ku/L校准品:肌酐(基质:水溶液:浓度:176.8umol/L)2.1 外观试剂盒外观应整洁,文字符号标识清晰;R1为淡黄色透明液体,R2为无色至淡黄色液体,校准品为无色透明液体。
液体试剂不得有沉淀和絮状物。
2.2 装量试剂瓶内液体装量应不少于标示值。
2.3 空白吸光度以生理盐水为样品,在37℃、546nm波长、1cm光径条件下,吸光度≤0.25。
2.4 分析灵敏度浓度为100μmol/L的样本,吸光度差值△A>0.01。
2.5 准确性相对偏差应不大于10%。
2.6 重复性用不同浓度的两个样本进行检测,各重复检测10次,其批内变异系数(CV)应不超过5%。
Roche P模块 肌酐(苦味酸)说明书

质控: 质控使用“订单信息”中列出的材料。 可添加其他适用的质控品。 血清/血浆 使用上面列出的未稀释血清质控材料进行 质控。 可添加其他适用的质控品。 尿液 使用上面列出的 Precinorm PUC 和 Precipath PUC 进行质控。 可添加其他适用的质控品。 应根据各实验室的具体要求采用适合的质 控间隔和限值。检测值应在设定的范围 内。若质控值在设定范围外,各实验室应 采取相应措施。 按可用的政府规章和地方法规进行质控。
稀释液 (NaCl)
6µL 144µL
2µL 180µL
10µL 115µL
cobas c 111 系统-检测设定
血清、血浆和尿液应用参数
测定模式
吸光度
Abs.计算模式
动态
反应方向
上升
波长 A/B
512/583 nm
计算结果 第一次/最后一次 21/26
血清/血浆
补偿
-18µmol/L (-0.2mg/dL)
波长(副/主) 反应方向
单位
试剂移液 R1 R3
样本 样本容量
正常 减少 增加
10µL 10µL 10µL
速率法 A
10/27-37-15-23 (STAT 4/12-19)
570/505nm
上升
µmol/L (mg/dL,mmol/L)
稀释 样本稀释
样本
30µL
样本
样本稀释
样本容量
样本
稀释液 (NaCl)
正常
10µL 6µL 144µL
减少
10µL 2µL 180µL
增加
10µL 10µL 115µL
cobas c 311 系统-检测设定 血清和血浆应用参数
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求汇松科技

肌酐测定试剂盒(肌氨酸氧化酶法)
1.性能指标
1.1.外观
1.1.1.包装外观
a)试剂盒应无任何破损、图案和文字应清晰、准确。
b)试剂盒内的试剂包装无破损,组分齐全、完整,液体无渗漏。
c)标签外观完整,牢固无脱落,标签标识内容清晰、无污迹。
1.1.
2.试剂外观
试剂R1 应为无色至淡黄色、澄清、无异物的液体。
试剂R2 应为无色至淡黄色、澄清、无异物的液体。
质控品为无色至淡黄色、透明澄清、无异物的液体。
1.2.装液量
试剂装液量应不少于下表的装量:
1.3.使用性能
1.3.1.试剂空白吸光度
试剂空白吸光度应小于等于0.3A。
1.3.
2.分析灵敏度
分析灵敏度应大于等于0.005A。
1.3.3.线性范围
1.3.3.1.线性区间
尿液检测范围为10μmol/L ~8840μmol/L,线性相关系数r 应不低于0.990;
1.3.3.
2.线性偏差
在[10,100]μmol/L 范围内线性绝对偏差应不超过10μmol/L,在(100,8840]μmol/L 范围内线性相对偏差应不超过±10%。
1.3.4.精密度
1.3.4.1.重复性
变异系数(CV)应不超过5%。
1.3.4.
2.批间差
相对极差(R)应不超过10%。
1.3.5.准确度
相对偏差应不超过标示值±10%。
1.3.6.质控品均一性
变异系数(CV)应不超过10%。
1.3.7.质控品准确度
相对偏差应不超过标示值±10%。
肌酐测定试剂盒(苦味酸法)产品技术要求zsbk0

肌酐测定试剂盒(苦味酸法)适用范围:本产品用于体外定量测定人血清中肌酐的浓度。
1.1包装规格液体型试剂1(R1):100mL×1,试剂2(R2):100mL×1,校准品:2mL×1。
1.2主要组成成分试剂1(R1)液体:氢氧化钠 0.32mol/L试剂2(R2)液体:苦味酸 35mmol/L校准品液体:水溶液基质(1个浓度)肌酐校准品定值范围100μmol/L~150μmol/L(每批定值,详见值单) 2.1 外观试剂盒中各组件的外观应满足:2.1.1试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.1.2试剂2(R2)应为橘黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.1.3校准品应为无色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长505nm(480nm~520nm)(光径1cm)处,试剂空白吸光度(A)应≤0.350,试剂空白吸光度变化率(△A/min)应≤0.035。
2.4准确度测定GBW09174,测定结果的相对偏差应不超过±10%。
2.5分析灵敏度对应于浓度为100μmol/L的肌酐所产生的吸光度差值(△A)应在0.011~0.070的范围内。
2.6重复性重复测试高、中、低浓度样本,变异系数(CV)应≤5%。
2.7批间差测试同一样本,批间差(R)应≤5%。
2.8线性范围在[22,880]μmol/L范围内,线性相关系数(r)应≥0.990;在(80,880]μmol/L范围内,线性相对偏差应不超过±10%;在[22,80]μmol/L范围内,线性绝对偏差应不超过±8μmol/L。
2.9试剂稳定性2.9.1效期稳定性原包装的试剂盒在2℃~8℃避光贮存,有效期为16个月。
试剂有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8 的要求。
肌酐(CRE)测定试剂盒(苦味酸法)产品技术要求lideman

肌酐(CRE)测定试剂盒(苦味酸法) 适用范围:本产品用于体外定量测定人血清中肌酐的含量。
1.1包装规格试剂1(R1):2×80mL、试剂2(R2):2×80mL;试剂1(R1):3×60mL、试剂2(R2):3×60mL;试剂1(R1):2×40mL、试剂2(R2):2×40mL;试剂1(R1):2×80mL、试剂2(R2):2×16mL;试剂1(R1):2×60mL、试剂2(R2):2×20mL;试剂1(R1):4×60mL、试剂2(R2):1×60mL;试剂1(R1):1×10mL、试剂2(R2):1×10mL;试剂1(R1):1×60mL、试剂2(R2):1×60mL;试剂1(R1):2×30mL、试剂2(R2):2×30mL;试剂1(R1):3×61mL、试剂2(R2):3×61mL。
校准品(选配):1×3mL。
1.2主要组成成分1.2.1试剂组成表1 试剂组成1.2.2校准品的组成:单水平液体校准品,在水基质中添加肌酐(纯度:大于95%)。
定值范围:(50~300)μmol/L。
注:校准品浓度具有批特异性,具体浓度见标签。
2.1 外观液体双试剂:试剂1(R1)为无色澄清液体,试剂2(R2)为桔黄色澄清液体。
校准品:无色至浅黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度在37℃、(505nm±10%)范围内的波长、1cm光径条件下,试剂空白吸光度应<0.3 ABS。
2.4 分析灵敏度浓度为132.6μmol/L时,吸光度变化范围应在(0.004~0.02)ABS之间。
2.5 线性在(0,2210]μmol/L线性范围内,线性相关系数r2≥0.995。
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求smxkm

肌酐测定试剂盒(肌氨酸氧化酶法)组成:试剂1(R1)主要成分:Good’ s缓冲液(pH 7.0~9.0)25mmol/L、肌酸酶≥40KU/L、肌氨酸氧化酶≥20KU/L、显色(TOOS)0.02 mmol/L;试剂2(R2)主要成分:Good’ s缓冲液(pH 7.0~9.0)100mmol/L、4-氨酰安替比林(4-AAP)0.02mmol/L、肌酐酶≥300KU/L、过氧化物酶(POD)≥5KU/L。
适用范围:用于体外定量检测人血清中肌酐的浓度。
1.1规格a) 试剂1:2×45ml,试剂2:2×15ml;b) 试剂1:2×54ml,试剂2:2×18ml;c) 试剂1:2×300ml,试剂2:2×100ml;d) 试剂1:3×60ml,试剂2:3×20ml;e) 试剂1:4×45ml,试剂2:4×15ml;f) 试剂1:6×70ml,试剂2:6×35ml;g) 试剂1:7×65ml,试剂2:3×50ml;h) 试剂1:12×16.8ml,试剂2:12×5.6ml;i) 试剂1:1×30ml,试剂2:1×10ml;j) 试剂1:2×30ml,试剂2:2×10ml;k) 试剂1:6×16.8ml,试剂2:6×5.6ml;l) 试剂1:1×45ml,试剂2:1×15ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 外观外包装完整无破损,标签清晰;试剂1应为淡黄色透明溶液;试剂2应为无色或淡黄色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白在550nm处测定试剂空白吸光度,应<0.2。
2.4 分析灵敏度测定浓度为100μmol/L的样品,吸光度变化(ΔA)应不低于0.015。
肌酐试剂盒-苦味酸法企业标准

医疗器械产品企业标准(建议稿)肌酐试剂盒苦味酸法CREATININE REAGENT KITPICRIC ACID Method2005-02-27发布2005-02-28实施深圳市德朝电子技术有限公司发布前言血清肌酐试剂盒目前无国家标准和行业标准,本公司制定本标准作为组织生产、质量检定和营销活动的依据。
本标准的编写格式按照GB/T1.1-2000《标准化工作导则第1部分:标准的结构和编写规则》、GB/T1.2-2002《标准化工作导则第2部分:标准中规范性技术要素内容的确定方法》。
本标准自2005年8月27日起实施本标准由深圳市德朝电子技术有限公司质量部提出并起草。
本标准起草单位:深圳市德朝电子技术有限公司。
本标准主要起草人:肌酐试剂盒1、范围本标准规定了肌酐试剂盒的要求、试验方法、检验规则、标志、标签、使用说明书、包装、运输及贮存等要求。
本标准适用于体外定量检测人血清、血浆或尿液中肌酐的浓度。
本产品适用于各种类型的半自动、全自动临床生化分析仪。
2、规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB 191-2000 包装储运图示标志GB 9969.1-1998 工业产品使用说明书总则3、试剂组成液体双试剂试剂A:RA,试剂B:RB4、方法原理血清样本中的肌酐与碱性苦味酸反应生成红色Janovski复合物(Jaffe反应),该反应为非特异性反应,可与其它物质发生作用。
本试剂采用速率法,增强了反应的特异性。
主要干扰物为头孢霉素。
反应过程中形成的红色复合物与样本中肌酐浓度成正比,可在波长500~520nm处进行测定,双光束分析时,空白波长可设在550~600nm。
5、技术要求5.1、外观肌酐试剂外观应符合:试剂A为亮黄色澄清液体,试剂B为无色澄清液体。
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求lepu

肌酐测定试剂盒(肌氨酸氧化酶法) 适用范围:用于体外定量测定人血清中的肌酐含量。
1.1 规格试剂1: 60mL×2,试剂2: 20mL×2;试剂1: 60mL×4,试剂2: 20mL×4;试剂1: 45mL×1,试剂2: 15mL×1;试剂1: 3L×1, 试剂2: 1L×1;试剂1: 15L×1, 试剂2: 5L×1;试剂1: 30mL×3,试剂2: 10mL×3。
1.2主要组成成分试剂1主要组分:试剂2主要组分:2.1 外观试剂1:淡黄色透明溶液;试剂2:无色或淡黄色透明溶液。
外包装完好、无破损,标签完好、字迹清晰。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白在550nm处测定试剂空白吸光度,应<0.2。
2.4 分析灵敏度测试100umol/L的被测物时,吸光度变化(ΔA)应不低于0.001。
2.5 准确度测定参考物质(GBW09170),相对偏差应不超过±10%。
2.6 重复性用高、中、低三个浓度的样本重复测试,变异系数(CV)应不超过5%。
2.7 线性在[30,1500]umol/L(37℃)区间内:线性回归的相关系数|r|应不小于0.990。
[30,70]umol/L区间内线性偏差应不超过±7umol/L;(70,1500]umol/L区间内,线性偏差应不超过±10%。
2.8 批间差用3个不同批号试剂分别测试样本,相对极差应不大于10%。
2.9 稳定性取在2℃~8℃条件下贮存达到18个月后的试剂进行检测,检测结果应符合2.1、2.3、2.4、2.5、2.6、2.7的要求。
艾威德肌酐(CRE)测定试剂盒(肌氨酸氧化酶法)说明书

肌酐(CRE)测定试剂盒(肌氨酸氧化酶法)说明书【产品名称】肌酐(CRE)测定试剂盒(肌氨酸氧化酶法)【包装规格】a)试剂1:2×45mL试剂2:2×15mLb)试剂1:4×60mL试剂2:4×20mLc)试剂1:2×60mL试剂2:2×20mL【预期用途】用于体外定量测定人血清中肌酐的含量。
肌酐经肾小球过滤后不被肾小管重吸收,通过肾小管排泄。
在肾脏疾病初期,血清肌酐值通常不升高,直至肾脏实质性损害,血清肌酐值才升高。
在正常肾脏血流量的条件下,肌酐值如升高至176~353μmol/L,提示为中度至严重的肾损害。
测定肌酐常用于晚期肾脏病的辅助诊断[1]。
【检验原理】肌酐经肌酐酶水解成肌酸,肌酸经过肌酸酶水解成肌氨酸,肌氨酸被肌氨酸氧化酶氧化生成过氧化氢。
过氧化氢与过氧化物酶、4-氨基安替比林、N-乙基-N-(3-磺丙基)-3-甲氧基苯胺钠盐反应,生成有色染料。
该染料在546nm 波长下的吸光度增加量与血清中的肌酐的含量成正相关。
【主要组成成分】试剂1主要组分缓冲液100mmol/L ESPAS(N-乙基-N-(3-磺丙基)-3-甲氧基苯胺钠盐) 1.5mmol/L抗坏血酸氧化酶>2KU/L肌氨酸氧化酶>8KU/L肌酸脒基水解酶>40KU/L试剂2主要组分缓冲液100mmol/L肌酐胺基水解酶≥450KU/L POD(过氧化物酶)≥55KU/L4-AA(4-氨基安替比林) 2.5mmol/L 注:不同批号试剂盒中各组分未经试验不可互换。
【储存条件及有效期】1.试剂原包装在2~8℃储存,有效期为18个月,生产日期、有效期见标签。
2.开口后的试剂在仪器仓中(2~8℃)可稳定30天。
【适用仪器】艾威德AS-420/AS-660/AS-1200;日立HITACHI7020型/7060型/7180型/7600型/LABOSPECT008AS型;贝克曼AU400/AU480/AU640/AU680/ AU2700/AU5400/AU5800/AU5811/AU5821;佳能TBA-FX8/TBA-120FR/ TBA-2000FR;罗氏cobas8000c702/cobas8000c701/cobas8000c502;西门子SIEMENS ADVIA1800/ADVIA2400;雅培ABBOTT ARCHITECTc8000/ARCHITECT c16000/ARCHITECT ci8200;西森美康SYSMEX BM6010/C;科华KHB卓越310/卓越330/卓越400/卓越450/ZY-1200/ZY-1280;迪瑞CS-240/CS-T300/CS-300B/CS-380/CS-400A/CS-400B/CS-600A/ CS-600B/CS-800A/CS-800B/CS-1200/CS-1200ISE/CS-1300B/CS-1400;迈瑞MINDRAY BS-220/BS-330/BS-350E/BS-380/BS-390/BS-400/BS-430/BS-600/ BS-800/BS-2000M;颐兰贝ES-200/ES-380/ES-480;赛诺迈德SUNMATIK-9050型;雷杜Chemray420;英诺华D280;特康TC6010L;锦瑞GS400;普康6066。
肌酐测定试剂盒(肌氨酸氧化酶法)产品技术要求aiweide

肌酐测定试剂盒(肌氨酸氧化酶法)适用范围:用于体外定量测定人血清中肌酐的含量
1.1 包装规格
a)试剂1:2×45mL,试剂2:2×15mL;
b)试剂1:4×60mL,试剂2:4×20mL;
c)试剂1:2×60mL,试剂2:2×20mL。
1.2主要组成成分
1.2.1试剂1主要组分
1.2.2试剂2主要组份
2.1 外观
试剂1:黄色澄清液体;
试剂2:无色澄清液体。
2.2 试剂装量
应不低于试剂瓶标示装量。
2.3 试剂空白吸光度
在546nm波长处测定试剂空白吸光度,应<0.1。
2.4 分析灵敏度
测定CRE含量为1mmol/L样本时,其△A应为0.5081~0.6210。
2.5线性范围
2.5.1 在[10,8000] μmol/L范围内,线性回归的确定系数应不低于0.990。
2.5.2 测试浓度在[10,800]μmol/L范围内线性绝对偏差不超过±5μmol/L。
测试浓度在(800,8000] μmol/L范围内线性相对偏差应不超过±10%。
2.6 测量精密度
2.6.1 重复性:用三个水平质控血清重复测试其变异系数(CV)应不超过5%。
2.6.2 批间差:抽取3个不同批号的试剂,对同一份样本进行重复测定,相对极差≤10%。
2.7 准确度
以国家标准物质为检测样本时,测定结果相对偏差不超过±10%。
2.8 稳定性
取在2℃~8℃条件下贮存达到18个月的试剂进行检测,应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
肌酐检测试剂盒(苦味酸法)产品技术要求
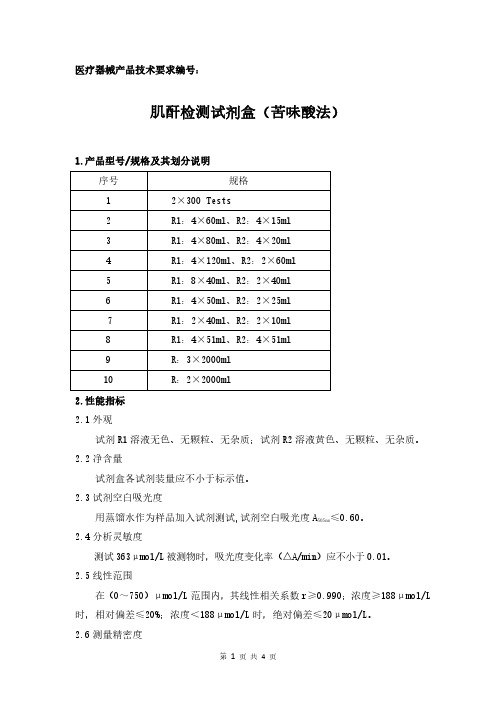
医疗器械产品技术要求编号:肌酐检测试剂盒(苦味酸法)1.产品型号/规格及其划分说明序号规格12×300Tests2R1:4×60ml、R2:4×15ml3R1:4×80ml、R2:4×20ml4R1:4×120ml、R2:2×60ml5R1:8×40ml、R2:2×40ml6R1:4×50ml、R2:2×25ml7R1:2×40ml、R2:2×10ml8R1:4×51ml、R2:4×51ml9R:3×2000ml10R:2×2000ml2.性能指标2.1外观试剂R1溶液无色、无颗粒、无杂质;试剂R2溶液黄色、无颗粒、无杂质。
2.2净含量试剂盒各试剂装量应不小于标示值。
2.3试剂空白吸光度≤0.60。
用蒸馏水作为样品加入试剂测试,试剂空白吸光度A505nm2.4分析灵敏度测试363μmol/L被测物时,吸光度变化率(△A/min)应不小于0.01。
2.5线性范围在(0~750)μmol/L范围内,其线性相关系数r≥0.990;浓度≥188μmol/L 时,相对偏差≤20%;浓度<188μmol/L时,绝对偏差≤20μmol/L。
2.6测量精密度2.6.1重复性用控制血清重复测试所得结果的重复性(变异系数,CV)应≤6.0%。
2.6.2批间差批间差应≤10.0%。
2.7准确度用参考物质进行测试,其相对偏差应≤10.0%。
3.检验方法仪器基本要求a)波长:505nm;温度:37℃±1℃。
b)全自动生化分析仪。
测试方法按说明书规定,因不同机型使用试剂最终浓度相同。
在此推荐以本公司BECKMAN或HITACHI全自动生化分析仪进行测试。
3.1外观和性状目测检查,试剂R1、R2溶液性状应符合2.1的规定。
3.2净含量用通用量具进行测量,应符合2.2的要求。
肌酐测定试剂盒(苦味酸法)产品技术要求北检·新创源

肌酐测定试剂盒(苦味酸法)适用范围:本产品用于体外定量测定人血清中肌酐的含量。
1.1规格具体产品规格见下表:1.2组成成分苦味酸≥20mmol/L氢氧化钠≥700mmol/L表面活性剂适量2.1 外观2.1.1 外包装完整无破损;2.1.2 试剂:黄色澄清透明液体。
2.2 净含量净含量不低于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在波长500nm、37℃条件下, 试剂空白吸光度应小于0.5;2.3.2 试剂空白吸光度变化率在波长500nm、37℃条件下,试剂空白吸光度变化率应不大于0.004。
2.4 线性2.4.1 线性范围[25,1000]μmol/L,相关系数r不小于0.990。
2.4.2 线性偏差[25,1000]μmol/L线性范围内,相对偏差不超过±10%。
2.5 分析灵敏度检测浓度为133μmol/L的样本时,吸光度变化率应不小于0.01。
2.6 重复性测试(30±3)μmol/L、(120±12)μmol/L和(500±50)μmol/L 的血清样本,重复测试至少10次,CV≤8%。
2.7 批间差用三个不同批号的试剂测试(120±12)μmol/L的同一样本,重复测试3次,相对极差R≤8%。
2.8 准确度测定GBW09174标准物质,测定结果应不超过标示值的±10%。
2.9 稳定性原包装试剂2~8℃避光储存,有效期12个月。
取到效期后两个月内产品进行检测, 检测结果应符合2.1 、2.3、2.4、2.5、2.6和2.8的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
肌酐测定试剂盒(苦味酸法)
适用范围:本试剂用于体外定量测定人血清中肌酐的含量。
1.1产品型号
产品组成:
2.1 外观
2.1.1 试剂1为无色透明液体,无混浊,无未溶解物。
2.1.2 试剂2为黄色透明液体,无混浊,无未溶解物。
2.1.3 校准品为无色透明液体,无混浊,无未溶解物。
2.1.4 标签内容清晰,字迹牢固不易脱落。
2.2 试剂装量
液体试剂的净含量不少于标示值。
2.3 试剂空白吸光度
A≤0.60(光径1.0cm,500nm±20nm 波长)。
2.4 分析灵敏度
测定100μmol/L被样本,吸光度变化在0.04~0.07范围内。
2.5 线性区间
2.5.1 [20,880]μmol/L。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)应不低于0.990。
2.5.2 [20,100]μmol/L范围内,线性绝对偏差应不超过±10μmol/L;(100,880]μmol/L范围内,线性相对偏差应不超过±10%。
2.6 精密度
2.6.1 重复性
变异系数CV≤5%。
2.6.2 批间差
批间相对极差≤6%。
2.7 准确度
相对偏差在±10%范围内(测试国际参考物质SRM 909c (NIST))。
2.8 稳定性
原装试剂2℃~8℃保存,有效期12个月,有效期满后2个月内测定结果应符合2.1、2.3、2.4、2.5、2.6.1、和2.7要求。
