无菌和植入性医疗器械试点企业和品种名单
无菌和植入性医疗器械使用单位检查表

器械名称
购入医疗器械经营企业名称
购入时间
1
2
3
4
存在主要问题:
检查组处理意见:
检查组成员签字:
组长
组员
被检查单位:
(盖章)
企业负责人签字:年月日
检查时间:
备注
企业需提供:1、生产许可证复印件或经营许可证复印件或执业许可证复印件2、其他有关材料和证据。
4
对无菌和植入类医疗器械是否建立并执行使用前质量检查制度
5
是否对植入和介入类的器械建立使用记录,使用记录是否永久保存,相关资料是否纳入信息化管理系统,确保相关信息具有可追溯性等
6
储存设施、条件是否符合要求
7
使用过的一次性无菌医疗器械是否按照规定销毁,并有记录
8
自2017年1月至今是否在黑龙江省公共资源交易平台网上集中采购医用耗材(如是,填写下面相关信息)
无菌和植入性医疗器械使用单位检查表
单位名称
单位级别
序号
检查项目
是或否
1
立覆盖购进验收等质量管理全过程的使用质量管理制度
2
是否按规定对医疗器械采购实行统一管理,是否严格查验供货商资质和产品证明文件
3
是否对购进医疗器械进行查验并妥善保存相关记录和资料
XX县无菌和植入性医疗器械监督检查实施方案

县无菌和植入性医疗器械监督检查实施方案嘿,各位,我要分享的是一份关于“县无菌和植入性医疗器械监督检查实施方案”的详细计划。
咱们就直接进入主题,边想边说,力求让这份方案既专业又接地气。
监督检查的目的和意义。
咱们都知道,无菌和植入性医疗器械的质量安全直接关系到患者生命安全,所以这个监督检查就是为了确保这些医疗器械的质量,降低患者风险。
简单来说,就是让患者放心使用,让咱们的工作更有保障。
一、监督检查对象1.所有在县范围内生产、经营、使用的无菌和植入性医疗器械的企业和医疗机构。
2.重点监管那些高风险、易出现问题、有投诉举报的产品和企业。
二、监督检查内容1.生产和经营企业的资质审核。
看看这些企业有没有合法的生产许可证、经营许可证,以及相关人员的资质证书。
2.生产过程监管。
检查企业生产环境是否符合GMP要求,生产设备是否正常运行,生产工艺是否合理。
3.质量控制。
查看企业是否建立完善的质量管理体系,对产品进行严格的质量检测。
4.销售和使用环节监管。
检查医疗机构是否从合法渠道采购医疗器械,是否按照规定储存和使用。
5.用户投诉和不良事件监测。
对用户的投诉和不良事件进行及时处理和反馈。
三、监督检查方式1.现场检查。
组织专家团队,对企业和医疗机构进行现场检查,发现问题现场指出,督促整改。
2.抽样检测。
对无菌和植入性医疗器械进行定期和不定期的抽样检测,确保产品质量。
3.信息化监管。
利用大数据、云计算等技术手段,对医疗器械的生产、经营、使用情况进行实时监控。
4.社会监督。
鼓励社会各界参与监督,对存在问题的企业和产品进行举报。
四、监督检查时间安排1.第一阶段:2023年1月至2023年3月,开展全面排查,摸清底数。
2.第二阶段:2023年4月至2023月,对排查出的问题进行整改,确保整改到位。
3.第三阶段:2023年4月至2023年12月,持续开展监督检查,巩固成果。
五、监督检查组织保障1.建立健全组织机构。
成立由县政府分管领导为组长,相关部门负责人为成员的监督检查领导小组,负责协调、指导、监督各项工作。
无菌植入性医疗器械

无菌植入性医疗器械1、植入器材骨板、骨钉、骨针、骨棒、脊柱内固定器材、结扎丝、聚離器、骨蜡、骨修复材料、脑动脉瘤夹、银夹、血管吻合夹(器)、整形材料、心脏或组织修补材料、眼内充填材料、节育环、神经补片2、植入性人工器官人工食道、人工血管、人工椎体、人工关节、人工尿道、人工瓣膜、人工肾、义乳、人工颅骨、人工颌骨、人工心脏、人工肌腱、人工耳蜗、人工肛门封闭器3、接触式人工器官人工喉、人工皮肤、人工角膜4、支架血管支架、前列腺支架、胆道支架、食道支架5、器官辅助装置植入式助听器、人工肝支持装置助听器、外挂式人工喉植入性医疗器械:通过外科手段全部或部分插入人体或自然腔口中或替代上表皮或眼表而,并在体内至少存留30天,且只能通过外科或内科手段取出。
女小骨钉、骨板、人工器官、心脏支架等;介入医疗器械:通过外科手段插入人体或自然腔口中,进行短时间的治疗或检查,治疗或检查完毕即取岀。
女口:血管内造影导管、球囊扩张导管、中心静脉导管、动静脉测压导管、一次性介入治疗仪探头等检查对象全省植入、介入类医疗器械经营企业。
植入、介入类医疗器械为:III类:6846植入材料和人工器官、6877介入材料。
检查内容(1)进货渠道是否合法,是否有相关证明材料;(2)产品是否有购进、验收、使用记录,是否与管理制度一致;(3)说明书、标签和包装标识与注册证是否一致。
是否存在经营无注册证、套用注册证、无合格证明、过期、失效医疗器械的不法行为;产品是否存在擅自扩大产品适用范擅自围,改变产品所使用的材料,擅自改变被许可的品种的情况;(4)是否建立不良事件报告制度;(5)是否实施电子信息化管理,是否建立并严格执行植入、介入类医疗器械全程可追溯的管理制度。
河北省重点监控医疗器械产品及企业目录

医用羊肠线
石家庄市华烨肠衣有限公司
石家庄市局
6
PGA可吸收性缝合线
7
PLA防粘连凝胶
石家庄市瑞诺生物医学材料有限公司
石家庄市局
省重点监管
8
医用几丁糖
石家庄亿生堂医用品有限公司
9
医用透明质酸钠凝胶
河北常山生化药业股份有限公司
华北制药金坦生物技术股份有限公司
10
一次性使用紫外线透疗血液容器
辛集市康业医疗器械厂
三
植入人体的医疗器械
21
葡聚糖栓塞微球
河北海森医疗器械有限公司
石家庄市局
省重点监管
省重点监管
22
医用羟基磷灰石义眼台
石家庄市科兴新技术产品有限公司
23
皮下埋藏灌注器
河北科光医疗器械有限公司
24
HBIC人工牙种植体
河北医科大学厚朴口腔种植科技中心
25
植入式给药装置
石家庄市诺尔康医疗器械有限公司
26
骨圆针
秦皇岛市局
省重点监管
18
可吸收即溶纱布
河北金天生物医药有限公司
张家口市局
二
医用防护用品、避孕套
19
医用防护口罩
涿州福美神盾生物科技有限公司
保定市局
国家重点监管
20
橡胶避孕套
河北鸿发乳胶制品有限公司
河北安琪胶业有限公司
河北同乐乳胶制品有限公司
河北康宁胶业有限公司
河北双健乳胶制品有限公司
保定多福纳胶业有限公司
衡水康达医疗器械有限公司
衡水市局
27
脑动脉瘤夹
沧州康华医疗器械有限公司
沧州市局四Leabharlann 第三类医疗器械28
医疗器械经营重点监管品种目录
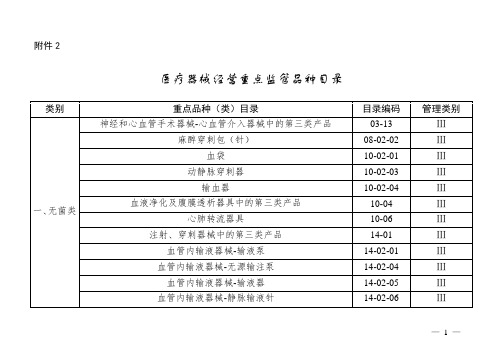
Ⅲ
骨接合植入物
13-01
Ⅲ
运动损伤软组织修复重建及置换植入物
13-02
Ⅲ
脊柱植入物
13-03
Ⅲ
关节置换植入物
13-04
Ⅲ
骨科填充和修复材料
13-05
Ⅲ
神经内/外科植入物
13-06
Ⅲ
心血管植入物
13-07
Ⅲ
耳鼻喉植入物
13-08
Ⅲ
整形及普通外科植入物
13-09
Ⅲ
组织工程支架材料
16-06-01
Ⅲ
五、防护类
防护口罩
14-14-01
Ⅱ
防护服
14-14-02
Ⅱ
六、仪器设备类
呼吸设备中的第三类产品
08-01
Ⅲ
麻醉机
08-02-01
Ⅲ
急救设备中的第三类产品
08-03
Ⅲ
电位治疗设备中的第三类产品
09-01-01
Ⅲ
血液净化及腹膜透析设备中的第三类产品
10-03
Ⅲ
心肺转流用泵
10-05-01
Ⅲ
13-10
Ⅲ
其他
13-11
Ⅲ
眼科植入物
16-07
Ⅲ
口腔植入及组织重建材料中的第三类产品
17-08
Ⅲ
三、体外诊断试剂类
人传染高致病性病原微生物(第一、二类危害/第三、四级防护)检测相关的试剂
6840
Ⅲ
与血型、组织配型相关的试剂
6840
Ⅲ
其他需要冷链储运的第三类体外诊断试剂
6840
Ⅲ
四、角膜接触镜类
医疗器械GMP附录之植入性医疗器械

附件
医疗器械生产质量管理规范附录
植入性医疗器械
第一部分范围和原则
1.1 本附录适用于植入性的有源医疗器械和无源医疗器械,但不适用于组织工程植入物中生物技术组成部分和除齿科种植体外的其他齿科植入物。
1.2 本附录是对植入性医疗器械生产质量管理规范的特殊要求。
1.3 植入性的无菌医疗器械,生产中应当最大限度地降低污染,以保证医疗器械不受污染或能有效排除污染。
植入性的非无菌医疗器械,其生产环境的设臵应当满足产品质量的要求。
第二部分特殊要求
2.1 人员
2.1.1 植入性的动物源医疗器械和同种异体医疗器械的生产、技术和质量管理人员应当具有相应的生物学、生物化学、微生物学、医学、免疫学等专业知识,并具有相应的实践经验,以确保具备在生产、质量管理中履行职责的能力。
2.1.2 凡在洁净室(区)工作的人员应当定期进行卫生和微
—1—
生物学基础知识、洁净作业等方面培训。
临时进入洁净室(区)的人员,应当对其进行指导和监督。
四川监管医疗器械生产企业名单-2019年

成都市高新区(西区) 天勤东街66号
韦德
Ⅱ类:6841-4-血液化验设备和器具,
6856-1-供氧系统,6864-2-敷料、护
7
川食药监械生 产许20150039
号
创材料,6865-4-表面缝合材料, 6866-4-导管、引流管,6866-5-呼吸 麻醉或通气用气管插管,6866-6-肠
道插管
成都市新津事丰医疗 器械有限公司
附表2-1:
2019年四川省四级监管医疗器械生产企业名单
序号
生产企业许可证 号
生产范围
企业名称
注册地址
生产地址
法人代表
1
川食药监械生产 许(2014)第
0034号
第三类(含第二类):6866医用高分 子材料及制品;6845体外循环及血液
处理设备
四川绵竹鸿基制药有 限责任公司
四川省绵竹市江 苏工业园区成青
15
川食药监械生产 许20160004号
Ⅲ类:6845-4-血液净化设备和血液 净化器具;6845-6-体液处理设备;
6866-1-输液、输血器具及管路
四川南格尔生物科技 有限公司
简阳市东溪镇奎 星路28号
1.四川省简阳市东溪镇 奎星路28号;2.成都高 新区庆云村五组55号石
羊工业园2#厂房四层
16
线缝合器,6809-6-一次性使用管型
13
川食药监械生产 许20150057号
痔吻合器,6815--注射穿刺器械, 6841-4-血液化验设备和器具,68561-供氧系统,6863-5-永久性充填材
四川双陆医疗器械有 限公司
天府新区仁寿视 高经济开发区兴
园路
天府新区仁寿视高经济 开发区兴园路
一次性无菌医疗器械生产企业名单-常州市无菌医疗器械生产企

常州市康心医疗器械有限公司
10
常州市康迪医用吻合器有限公司
11
常州市新康悦医疗器械有限公司
12
常州华森医疗器械有限公司
金坛市
13
金坛市康达医疗器材制造有限公司
14
金坛市金城南瑶塑玻仪器厂
15
江苏康友医用器械有限公司
16
金坛市康兴医疗器械有限公司
17
江苏爱潘克斯医疗器械有限公司
武进区
18
常州市延陵电子设备有限公司
19
常州市悦康医疗器材有限公司
20
江苏康进医疗器材有限公司
21
常州市回春医疗器材有限公司
22
常州市通达医疗器材有限公司
23
江苏亿乐医疗用品有限公司
24
江苏吉春医用器材有限公司
25
江苏康华医疗器材有限公司
26
常州市双马医疗器材有限公司
27
常州市乐佳医疗器械有限公司
28
常州晓春医疗器材有限公司
辖区
序号
企业名称
附件2
常州市一次性无菌医疗器械生产企业名单
辖区
序号
企业名称
市区
1
常州市新能源吻合器总厂有限公司
2
常州药物研究所
3
常州市三联星海医疗器械制造有限公司
4
常州瑞索斯医疗设备有限公司
新北区
5
常州龙虎医疗器材有限公司
6
常州市龙莱富医用质料有限公司
7
常州朗生医疗器械工程有限公司
8
常州新区佳森医用支架器械有限公司
39
常州市华伟医疗用品有限公司
40
常州市振兴医疗器材有限公司
41
中国医疗器械类企业名单汇总

中国医疗器械类企业名单汇总中国作为全球第二大经济体,日益发展壮大的医疗器械行业在其经济发展中扮演了重要的角色。
近年来,中国医疗器械企业逐渐崛起,不仅国内市场占有率逐渐增加,而且在国际市场也开始崭露头角。
本文将对目前中国医疗器械类企业进行名单汇总,并简要介绍其中一些具有代表性的企业。
在中国医疗器械行业,最具知名度和影响力的企业莫过于迈瑞医疗。
迈瑞医疗成立于2007年,总部位于江苏南京,是中国最大的医疗器械制造企业之一。
公司以研发、生产、销售医疗设备和提供相关服务为主,产品涉及麻醉、重症监护、高端影像、家庭医疗等多个领域。
迈瑞医疗秉持着“为生命而尽力”的理念,不断创新技术,提升产品质量,为患者提供更好的医疗保障。
另一家备受关注的医疗器械企业是卫宁健康。
卫宁健康成立于1999年,总部位于北京,是中国领先的医疗器械集团。
该企业拥有完整的产业链布局,从医疗器械生产、销售到医疗服务等各个环节都有涉足。
公司致力于将科技与医疗结合,通过创新的产品和服务满足人们对健康的需求。
卫宁健康不仅在中国市场占有一席之地,而且也积极拓展国际市场,成为中国医疗器械企业的典范之一。
除了迈瑞医疗和卫宁健康,中国还有许多其他优秀的医疗器械企业。
比如微创医疗,该公司成立于1999年,总部位于江苏苏州。
微创医疗致力于手术器械和介入治疗产品的研发和生产,并在全球范围内提供高品质的医疗设备。
公司秉承创新驱动的理念,不断推陈出新,为患者提供更安全、更有效的医疗方案。
此外,还有广泰医疗、和记黄埔医疗、正海生物医药等一系列中国医疗器械企业也值得关注。
这些企业在不同领域都展现了强大的竞争力和创新能力。
无论是改善手术技术、提高疾病诊断能力,还是提供便捷的家庭医疗服务,这些企业都在为人们的健康保驾护航。
当然,中国医疗器械企业仍然面临许多挑战。
首先,国内市场竞争激烈,企业需要不断创新、提升产品质量,才能在市场中立于不败之地。
其次,国际市场的开拓也是一个重要的任务。
医疗器械企业名录(大全)

标题:医疗器械企业名录(大全)一、引言医疗器械产业是当今世界发展最快的行业之一,随着科技的不断进步,医疗器械产品种类日益丰富,应用范围逐步扩大。
本文将为您详细梳理我国医疗器械企业的名录,以便您更好地了解行业现状和发展趋势。
二、医疗器械企业名录1. 企业A企业A成立于上世纪80年代,是我国最早从事医疗器械研发、生产和销售的企业之一。
企业A以技术创新为核心,拥有多项国内外专利,产品涵盖医用影像、体外诊断、微创手术等多个领域。
企业A 的销售网络遍布全球,为世界各地的医疗机构提供优质的产品和服务。
2. 企业B企业B成立于2000年,是一家集研发、生产、销售和服务于一体的医疗器械企业。
企业B专注于医用耗材、高分子材料等领域,产品广泛应用于心血管、神经外科、骨科等手术。
企业B拥有国际一流的生产设备和严格的质量管理体系,确保产品质量达到国际标准。
3. 企业C企业C成立于1995年,是一家专业从事家用医疗器械研发、生产和销售的高新技术企业。
企业C以家用医疗设备为主导,产品包括血压计、血糖仪、体温计等,为消费者提供全方位的健康监测解决方案。
企业C凭借优良的品质和完善的售后服务,赢得了广泛的市场认可。
4. 企业D企业D成立于2005年,是一家专注于生物医学工程领域的高新技术企业。
企业D以研发为主导,致力于生物材料、组织工程、人工器官等前沿技术的研究与产业化。
企业D的产品广泛应用于临床治疗、康复、美容等领域,为患者提供更多治疗选择。
5. 企业E企业E成立于2010年,是一家以研发为核心的高新技术企业。
企业E专注于微创手术设备、医用激光设备等领域,产品具有创伤小、恢复快、疗效好等特点。
企业E拥有国际化的研发团队,不断推动医疗器械行业的创新与发展。
三、总结本文为您梳理了我国医疗器械企业的名录,涵盖了医用影像、体外诊断、微创手术、家用医疗器械等多个领域。
这些企业在技术创新、产品质量、市场开拓等方面均有突出表现,为我国医疗器械产业的发展做出了重要贡献。
新冠防治急需医学装备目录(第一批)
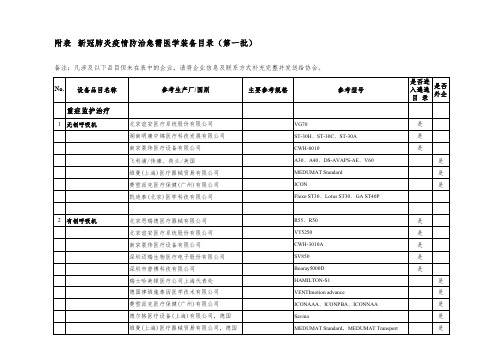
附表新冠肺炎疫情防治急需医学装备目录(第一批)备注:凡涉及以下品目但未在表中的企业,请将企业信息及联系方式补充完整并发送给协会。
附表新冠肺炎疫情防治急需医学装备目录(第一批)备注:凡涉及以下品目但未在表中的企业,请将企业信息及联系方式补充完整并发送给协会。
附表新冠肺炎疫情防治急需医学装备目录(第一批)备注:凡涉及以下品目但未在表中的企业,请将企业信息及联系方式补充完整并发送给协会。
附表新冠肺炎疫情防治急需医学装备目录(第一批)备注:凡涉及以下品目但未在表中的企业,请将企业信息及联系方式补充完整并发送给协会。
附表新冠肺炎疫情防治急需医学装备目录(第一批)备注:凡涉及以下品目但未在表中的企业,请将企业信息及联系方式补充完整并发送给协会。
附表新冠肺炎疫情防治急需医学装备目录(第一批)备注:凡涉及以下品目但未在表中的企业,请将企业信息及联系方式补充完整并发送给协会。
附表新冠肺炎疫情防治急需医学装备目录(第一批)备注:凡涉及以下品目但未在表中的企业,请将企业信息及联系方式补充完整并发送给协会。
附表新冠肺炎疫情防治急需医学装备目录(第一批)备注:凡涉及以下品目但未在表中的企业,请将企业信息及联系方式补充完整并发送给协会。
附表新冠肺炎疫情防治急需医学装备目录(第一批)备注:凡涉及以下品目但未在表中的企业,请将企业信息及联系方式补充完整并发送给协会。
附表新冠肺炎疫情防治急需医学装备目录(第一批)备注:凡涉及以下品目但未在表中的企业,请将企业信息及联系方式补充完整并发送给协会。
附表新冠肺炎疫情防治急需医学装备目录(第一批)备注:凡涉及以下品目但未在表中的企业,请将企业信息及联系方式补充完整并发送给协会。
附表新冠肺炎疫情防治急需医学装备目录(第一批)备注:凡涉及以下品目但未在表中的企业,请将企业信息及联系方式补充完整并发送给协会。
附表新冠肺炎疫情防治急需医学装备目录(第一批)备注:凡涉及以下品目但未在表中的企业,请将企业信息及联系方式补充完整并发送给协会。
医疗器械生产企业质量管理体系规范(医疗器械GMP)

试点要求
5、所在辖区的省级药监局选派一名观察员。 观察员不履行现场检查职责,承担协调、沟 通等。 6、检查员的业务水平是否能够满足现场检查 需要,是关系到现场检查质量的关键环节。
7、检查员要勤正廉洁,实事求是,首先学习 吃透?标准?的真正含义和内容。 8、在试点检查中及时发现问题,并汇总反 馈。
2.国家局组织经过培训的检查员进行现场检 查。
在检查过程中与企业座谈、开展问卷调 查,进一步了解标准可行性及各类企业到达规 范的程度。对生产企业发放“医疗器械质量体 系管理标准情况调查表〞 。调查表包括企业
对 现制定条款到达程度、需要哪些改造〔硬软 件〕,所需资金,存在主要困难和问题等。
〔三〕总结阶段〔2007年4月底-5月初〕
1.汇总试点情况,由检查组和企业所在地省 局共同进行,形成试点总结报告。
2.国家局召开总结会议,进行全面总结。
〔五〕试点文本
➢?标准?是总体要求,不作为检查要求。 ➢ 在?标准?根底上制定的无菌和植入性医 ➢疗器械?实施细那么?是对两类企业的具体
要 ➢求,企业应按其自查并到达要求。
试点文本条款要求
举例:
1、采购过程的要求,在标准第二十六条除了 提出YY/T 0287中“采购过程〞的要求外,还 增加了对委托生产的法规要求,要求符合12号 令?医疗器械生产监督管理方法?的有关规定。
2、在设计开发确认方面,标准第二十二条增 加了进行临床试验应符合5号令?医疗器械临床 试验规定?的要求。
3、设计开发更改,标准第二十三条增加了 “中选用的材料、零件或产品功能的改变可
➢标准共有条款86条,无菌医疗器械实施细 那么93条,植入性医疗器械实施细那么104 条。总那么与两个实施细那么有重复的条 款。
无菌和植入性医疗器械试点企业和品种名单
试点企业名称
试点产品名称
40
四川大学生物材料工程研究中心
磷酸钙涂层人工髋关节、骨诱导人工骨、羟基磷灰石生物活性陶瓷
41
四川国纳科技有限公司
医用纳米羟基磷灰石/聚酰胺66复合骨充填材料
42
北京市意华健科贸有限责任公司
珊瑚羟基磷灰石植入材料
43
北京莱顿生物材料有限公司
钛合金喷涂羟基磷灰石牙种植体
44
28
珠海丽珠医用生物材料有限公司
PGA医用可吸收缝线缝针、一次性使用血液灌流器、DNA免疫吸附柱
29
广州市卫信工贸有限公司
医用粘贴膜、自粘无菌敷料、一次性使用创面无菌敷料
30
稳健实业(深圳)有限公司
产包、接触性创面敷贴
31
四川南格尔生物医学股份有限公司
一次性使用输液器、一次性使用单采血浆分离器、一次性使用塑料血袋、血液成分分离机
一次性使用无菌中心静脉导管、一次性使用麻醉穿刺包、一次性使用腹腔穿刺包、一次性使用骨髓穿刺包、一次性使用无菌腰椎穿刺包、一次性使用无菌胸腔穿刺包、输液泵、旋塞、输液接头、麻醉穿刺包、胸腔穿刺包
25
广州华南医疗用品有限公司
一次性使用塑料血袋、一次性使用无菌注射器、一次性使用输液器(配套自用静脉输液针)、一次性使用输血器、一次性使用静脉输液针
26
广东龙心医疗器械有限公司
一次性使用无菌医疗器械、镇疼泵、血管支架、透析嚣、导管
27
深圳市益心达医学新技术有限公司
一次性使用无菌血管内导管:球囊扩张导管、一次性使用麻醉穿刺包、一次性使用无菌血管内导管辅件:导丝、一次性使用无菌血管内导管:中心静脉导管、一次性使用无菌血管内导管:造影导管、一次性使用三通旋塞、一次性使用无菌导管鞘、一次性使用单向阀多通器、一次性使用输注泵
京药监备—24(械)无菌和植入性医疗器械生产质量管理规范检查程序

无菌和植入性医疗器械生产质量管理规范检查程序项目名称:无菌和植入性医疗器械生产质量管理规范检查程序编号:京药监备—24(械)办理机关:北京市药品监督管理局[委托北京市药品监督管理局医疗器械技术审评中心(以下简称市器审中心)]依据:1.《医疗器械监督管理条例》(中华人民共和国国务院令第276号)2.《医疗器械注册管理办法》(国家食品药品监督管理局令第16号第第七条、第八条、第九条)3.《关于印发医疗器械生产质量管理规范(试行)的通知》(国食药监械[2009]833号)4.《关于印发医疗器械生产质量管理规范检查管理办法(试行)的通知》(国食药监械[2009]834号)5.《关于印发医疗器械生产质量管理规范无菌医疗器械实施细则和检查评定标准(试行)的通知》(国食药监械[2009]835号)6.《关于印发医疗器械生产质量管理规范植入性医疗器械实施细则和检查评定标准(试行)的通知》(国食药监械[2009]836号)7. 《关于发布部分高风险医疗器械品种的通知》(食药监办械[2009]131号)收费标准:不收费期限:自接收材料之日起55个工作日(不含送达期限)接受接收材料2 个工作日材料审查和现场检查48个工作日核准5个工作日适用范围:无菌和植入性医疗器械生产质量管理规范检查办理程序:一、申请与接收1.对于申请产品中既包括无菌产品也包括植入性产品的,企业应分别进行申请;2.对于申请产品中既包括由国家食品药品监督管理局药品认证管理中心负责检查的产品也包括北京市药品监督管理局负责检查的,企业应分别申请。
申请无菌和植入性医疗器械质量体系检查的基本条件:1. 企业应按照医疗器械生产质量管理规范的要求建立质量管理体系,并运行至少3个月以上;2. 通过试运行,已完成生产设备、生产工艺、洁净车间等相关验证、确认工作;3. 已完成产品设计验证,并取得由法定检测机构出具的医疗器械产品注册检验报告;4.已完成产品设计确认;5. 已对照有关要求完成自查、整改。
医疗器械分类目录

医疗器械分类目录根据国家食品药品监督管理局2002年发布的《医疗器械分类目录》,将医疗器械经营企业经营范围划分以下类别。
(一)器械类:6801、6802、6803、6804、6805、6806、6807、6808、6809、6810、6812、6813、6816、6820、6827。
(二)设备、器具类:6821(Ⅱ类)、6822(Ⅱ类)6823、6824、6825、6826、6831、6834、6840、6841、6845、6854、6855、6856、6857、6858。
(三)大型医用设备类:6824、6825、6828、6830、6832、6833。
(四)植入、介入及人工器官类:6821(Ⅲ类)、6822(Ⅲ类)6846、6877。
(五)医用材料类:6863、6864、6865、6866(6866-1除外)。
(六)体外诊断试剂类:6840。
(七)一次性无菌类:6815、6866。
(八)软件类:6870。
(九)验配类:角膜接触镜、助听器、角膜接触镜及护理液。
6801基础外科手术器械6802显微外科手术器械6803神经外科手术器械6804眼科手术器械6805耳鼻喉科手术器械6806口腔科手术器械6807胸腔心血管外科手术器械6808腹部外科手术器械6809泌尿肛肠外科手术器械6810矫形外科(骨科)手术器械6812妇产科用手术器械6813计划生育手术器械6815注射穿刺器械6816烧伤(整形)科手术器械6820普通诊察器械6821 医用电子仪器设备6822 医用光学器具、仪器及内窥镜设备6823医用超声仪器及有关设备6824医用激光仪器设备6825医用高频仪器设备6826物理治疗及康复设备6827中医器械6828医用磁共振设备6830医用X射线设备6831医用X射线附属设备及部件6832医用高能射线设备6833医用核素设备6834医用射线防护用品、装置6840临床检验分析仪器6841医用化验和基础设备器具6845体外循环及血液处理设备6846植入材料和人工器官6854手术室、急救室、诊疗室设备及器具6855口腔科设备及器具6856病房护理设备及器具6857消毒和灭菌设备及器具6858医用冷疗、低温、冷藏设备及器具6863口腔科材料6864医用卫生材料及敷料6865医用缝合材料及粘合剂6866医用高分子材料及制品6870 软件6877介入器材附加不作为医疗器械管理。
无菌和植入性医疗器械产品的生产环境有何要求?

无菌和植入性医疗器械产品的生产环境有何要求?常见的无菌和植入性医疗器械产品的生产环境有何要求?对于无菌和植入性医疗器械,设置实验室应当遵循何原则?无菌和植入性医疗器械生产企业是否可以对产品进行参数放行?接下来,就带你了解一下吧!1.对于无菌和植入性医疗器械,设置实验室应当遵循何原则?应当分别建立万级下局部百级的无菌检验室、微生物限度室和阳性对照室(包括人流、物流相对独立)。
2.无菌和植入性医疗器械生产企业是否可以对产品进行参数放行?对于自行具备产品灭菌能力的无菌、植入性医疗器械生产企业,其出厂检验项目规定对产品进行无菌检验,可按照规定执行。
如规定检测生物指示剂(菌片),在对灭菌过程进行科学验证基础上,可采取检测菌片方式进行产品放行。
3.常见的无菌和植入性医疗器械产品的生产环境有何要求?(1)一次性使用静脉注射针生产环境应当为10万级;静脉留置导管生产环境应当为万级;角膜接触镜(隐形眼镜)生产环境至少为30万级,角膜接触镜(隐形眼镜)用护理液灌装等生产工序至少在万级下局部百级环境下进行;对于没有热原(或内毒素)和微粒要求的产品,如医用口罩、医用乳胶手套等产品,其生产环境至少为30万级。
(2)吻合器(钉)应当按照植入性医疗器械附录执行;栓塞剂应当按照植入性医疗器械附录执行;人工皮肤应当按照植入性医疗器械附录执行;可吸收材料应当按照植入性医疗器械附录执行;角膜接触镜(隐形眼镜)、角膜接触镜(隐形眼镜)用护理液产品应当按照无菌医疗器械附录执行。
(3)植入和介入到血管内及需要在万级下的局部百级洁净间内进行后续加工(如灌装封等)的无菌医疗器械或单包装出厂的配件,其(不清洗)零部件的加工、末道清洗、组装、初包装及其封口等生产区域应当不低于万级洁净度级别。
如:血管内支架、封堵器、起搏电极、人工血管、血管内导管、支架输送系统等。
(4)植入到人体组织、与血液、骨髓腔或非自然腔道直接或间接接入的无菌医疗器械或单包装出厂的配件,其(不清洗)零部件的加工、未道清洗、组装、初包装及其封口等生产区域应当不低于10万级洁净度级别。
无菌类医疗器械有哪些[一次性使用无菌医疗器械专项整治情况调研报告范文]
![无菌类医疗器械有哪些[一次性使用无菌医疗器械专项整治情况调研报告范文]](https://img.taocdn.com/s3/m/91640d3b3868011ca300a6c30c2259010202f30f.png)
无菌类医疗器械有哪些[一次性使用无菌医疗器械专项整治情况调研报告范文]一、专项整治工作的阶段性成果一次性使用无菌医疗器械在临床上应用广泛,是人们防病治病的重要器具。
这次重点专项整治的产品是:一次性使用无菌注射器、输液器、输血器、滴定管式输液器、注射针、静脉输液针、血袋、采血器。
1、提高认识,加大监管力度保证一次性使用无菌医疗器械的安全使用,确保医疗废弃物的无害化处置,是关系到广大人民群众身体健康和城市卫生安全的大事,是上海建立与完善社会主义市场经济体系的重要内容。
根据这个指导思想和总体要求,两年来,市政府有关部门把专项整治一次性使用无菌医疗器械作为监管工作的重点,加强监管意识,强化监管力度。
市药监局去年进行了三次稽查行动,检查了医疗机构、企业事业单位医务室共2268个单位;今年以来,结合年检,又对一次性使用无菌医疗器械专项整治制定了监督检查方案,做到每季度有监督检查分析。
在抗击SARS期间,市药监局每三天组织一次现场检查,强化监管,以确保产品质量,确保使用安全。
市卫生局加强对医疗机构一次性使用无菌医疗器械的监督执法工作。
去年下半年,对各级各类医疗机构共889家,一次性使用医疗用品的管理情况进行了专项监督检查,市和区县卫生监督机构出动卫生监督员678人次,对医疗机构在一次性使用医疗用品的采购、使用后毁形、废弃物的消毒、流转、收集储存和集中处理等环节进行了逐一进行检查。
对不符合要求的,责成整改。
杜绝未经毁形、消毒的一次性使用无菌医疗器械流向社会,给社会带来危害。
经过督查及整改,一些在使用、处置上存在问题的工厂医务室、学校卫生室、村卫生室基本符合要求。
2、制定规范性文件,推进规范化监管为了加强对一次性使用无菌医疗器械的专项监管,建立长效管理机制,实施长效管理,相关的主管部门根据传染病防治法、消毒管理办法等法律、法规,针对检查中发现的问题和管理上的薄弱环节,制定了相应的规范性文件。
市药监局组织起草了《上海市一次性使用无菌医疗器械生产经营监督管理的若干规定》和《上海市一次性使用无菌医疗器械使用监督管理若干规定》,这两项规定草案已进入立法听证程序。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
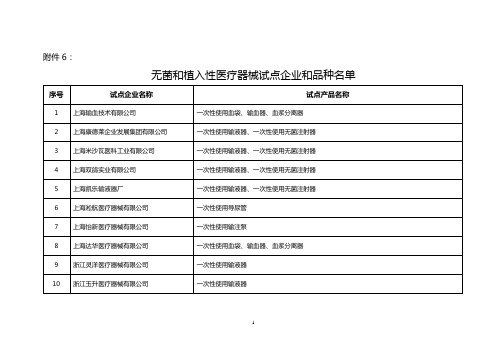
附件6:
无菌和植入性医疗器械试点企业和品种名单
序号试点企业名称试点产品名称
1 上海输血技术有限公司一次性使用血袋、输血器、血浆分离器
2 上海康德莱企业发展集团有限公司一次性使用输液器、一次性使用无菌注射器
3 上海米沙瓦医科工业有限公司一次性使用输液器、一次性使用无菌注射器
4 上海双鸽实业有限公司一次性使用输液器、一次性使用无菌注射器
5 上海凯乐输液器厂一次性使用输液器、一次性使用无菌注射器
6 上海淞航医疗器械有限公司一次性使用导尿管
7 上海怡新医疗器械有限公司一次性使用输注泵
8 上海达华医疗器械有限公司一次性使用血袋、输血器、血浆分离器
9 浙江灵洋医疗器械有限公司一次性使用输液器
10 浙江玉升医疗器械有限公司一次性使用输液器
11 浙江康康医疗器械有限公司一次性使用输液器
12 浙江康德莱医疗器械股份有限公司一次性使用输液器
13 温州市贝普科技有限公司一次性使用输液器
14 浙江伏尔特医疗器械有限公司一次性使用输注泵
15 浙江苏嘉医疗器械股份有限公司一次性使用镇痛泵、一次性使用电子控制镇痛泵
16 杭州健群医疗器械有限公司一次性使用微量注射泵
17 陕西正源科技发展有限责任公司血浆分离器
18 西安西京医疗用品有限公司氧合器
19 西安医用塑料器材厂一次性使用输液器
20 西安申兰生物医学工程有限公司氧合器
21 西安依诺医疗器械有限公司一次性使用输注泵
22 陕西沃源科技有限责任公司血浆分离器
23 佛山市捷港医疗用品有限公司心脏二尖瓣球囊扩张导管
24 佛山特种医用导管有限责任公司一次性使用无菌中心静脉导管、一次性使用麻醉穿刺包、一次性使用腹腔穿刺包、一次性使用骨髓穿刺包、一次性使用无菌腰椎穿刺包、一次性使用无菌胸腔穿刺包、输液泵、旋塞、输液接头、麻醉穿刺包、胸腔穿刺包
25 广州华南医疗用品有限公司一次性使用塑料血袋、一次性使用无菌注射器、一次性使用输液器(配套自用静脉输液针)、一次性使用输血器、一次性使用静脉输液针
26 广东龙心医疗器械有限公司一次性使用无菌医疗器械、镇疼泵、血管支架、透析嚣、导管
27 深圳市益心达医学新技术有限公司一次性使用无菌血管内导管:球囊扩张导管、一次性使用麻醉穿刺包、一次性使用无菌血管内导管辅件:导丝、一次性使用无菌血管内导管:中心静脉导管、一次性使用无菌血管内导管:造影导管、一次性使用三通旋塞、一次性使用无菌导管鞘、一次性使用单向阀多通器、一次性使用输注泵
28 珠海丽珠医用生物材料有限公司 PGA医用可吸收缝线缝针、一次性使用血液灌流器、DNA免疫吸附柱
29 广州市卫信工贸有限公司医用粘贴膜、自粘无菌敷料、一次性使用创面无菌敷料
30 稳健实业(深圳)有限公司产包、接触性创面敷贴
31 四川南格尔生物医学股份有限公司一次性使用输液器、一次性使用单采血浆分离器、一次性使用塑料血袋、血液成分分离机
32 常州奥斯迈医疗器械有限公司金属接骨板、带锁髓内钉
33 常州市康辉医疗器械有限公司接骨钢板、接骨螺钉、接骨钢针(克氏针)、脊柱矫形内固定器、金属矫形用针、金属异形接骨板、鹅头钉钢板、肱骨分叉交锁髓内钉、交锁髓内钉等骨科器械及外科器械
34 创生医疗器械(江苏)有限公司股、胫骨带锁髓内钉、伽玛骨有远近端瞄准装置、带锁髓内钉、接骨板、接骨螺钉
35 苏州欣荣博而特医疗器械有限公司骨科内固定材料及配套工具、接骨板、接骨螺钉、髓内钉
36 苏州市双羊医疗器械有限公司钛合金接骨板、接骨螺钉
37 苏州市兴达医械制造有限公司金属直型接骨板、金属加压接骨螺钉
38 南京欧加农制药有限公司宫内节育器
39 成都迪康中科生物医学材料有限公司可吸收骨折内固定螺钉、可吸收骨内固定夹板系统
40 四川大学生物材料工程研究中心磷酸钙涂层人工髋关节、骨诱导人工骨、羟基磷灰石生物活性陶瓷
41 四川国纳科技有限公司医用纳米羟基磷灰石/聚酰胺66复合骨充填材料
42 北京市意华健科贸有限责任公司珊瑚羟基磷灰石植入材料
43 北京莱顿生物材料有限公司钛合金喷涂羟基磷灰石牙种植体
44 北京市富乐科技开发有限公司脊柱内固定系统,脊柱内固定钢板,固定针,空心钉
45 北京蒙太因医疗器械有限公司 LB型髋臼,JT系列髋关节假体,JY型股骨柄(金枪鱼柄),JT-JZ银枪鱼型髋关节假体
46 北京鑫康辰医学科技发展有限公司同种异体骨
47 北京盛引信利医疗科技有限责任公司 MI型智能宫内节育器
48 天津市人立骨科器械有限公司骨板、骨针
49 天津市威曼生物材料有限公司骨板、骨针、骨钉
50 天津市金兴达实业有限公司骨板、骨针、骨钉
51 天津市和杰医疗器械有限公司宫内节育器。
