荧光寿命测试技术-时域或频域
荧光寿命的定义

荧光寿命的定义简介荧光寿命是描述荧光物质发光时间的一个重要参数。
随着光学技术的快速发展,对荧光寿命的研究也越来越深入。
荧光寿命在许多领域中都有广泛的应用,如生物物理学、材料科学、化学等。
本文将对荧光寿命的定义进行详细探讨,包括荧光寿命的概念、测量方法和影响因素等。
荧光寿命的概念荧光寿命是指荧光物质由受激态回到基态所需的时间。
当荧光物质受到外界激发能量时,部分电子会从基态跃迁到激发态,形成受激态。
随后,受激态上的电子会自发地跃迁回到基态,释放出能量并产生荧光。
荧光寿命是受激态电子从激发态回到基态所需的平均时间。
荧光寿命的长短与荧光物质的性质密切相关,它可以通过荧光寿命测量仪器来获得。
荧光寿命的测量方法有许多方法可以用来测量荧光寿命,其中最常用的方法是荧光寿命衰减法。
该方法通过测量荧光强度随时间的衰减曲线来得到荧光寿命。
具体操作步骤如下: 1. 准备样品:选择合适的荧光物质作为样品,并将其制备成适当的形式,如溶液、薄膜等。
2. 激发样品:使用合适的激发源,如激光器或荧光灯,对样品进行激发。
激发波长通常与样品的吸收峰相匹配。
3. 收集荧光信号:使用荧光探测器收集样品发出的荧光信号,并将其转化为电信号。
4. 记录荧光信号随时间的变化:使用荧光寿命测量仪器记录荧光信号随时间的变化,并得到荧光强度随时间的衰减曲线。
5. 拟合曲线:利用合适的数学模型,如指数衰减模型,对荧光衰减曲线进行拟合,从而得到荧光寿命。
影响荧光寿命的因素荧光寿命受到多种因素的影响,其中包括以下几个方面: 1. 荧光物质的性质:荧光物质的分子结构和化学组成对荧光寿命有重要影响。
不同的分子结构会导致不同的荧光激发和退激发机制,从而影响荧光寿命的长短。
2. 温度:温度是影响荧光寿命的重要因素。
一般情况下,荧光寿命会随着温度的升高而缩短。
这是因为温度的升高会增加分子的振动和动力学速率,从而加快荧光退激发的速率。
3. 溶剂效应:溶剂对荧光寿命也有较大影响。
荧光寿命_论文-自然科学论文

荧光寿命荧光寿命( FLT)检测摘要这个技术手册介绍了荧光寿命( FLT)这种新技术的基本原理。
从这本技术手册里,我们可以简单的了解与这项技术相关的理论基础和与之配合的实验条件,以及通过一项应用实例讨论了如何对实验中所获得的数据进行解析和归类的方法。
•微孔板技术在高通量筛选中的价值使用者利用一个 marker或者是标记物受光激发后,通过一台普通的微孔板阅读器,就可以监测生化和生物反应进程。
常用的读取模式包括检测吸收光,荧光强度(FI),荧光偏振(FP),时间分辨荧光(TRF)。
一般没有方法能够包含所有可能的分析模式,如果达到这样的高分析程度,需要一个配套的方法能够覆盖尽可能宽的实验范围。
尽管如此,,还是会有一种方法被优选选择,通过它能够得到更可靠的数据,更高端的信息,以及迅速的读取数据。
荧光寿命被定义成荧光分析在回到基态之前驻留在激发态的时间。
荧光寿命对荧光标记物周围的微环境高度敏感。
当标记一个反应对,由于化学反应改变这个反应对的状态(例如在酶反应体系中)或者是发生了与其他结合伴侣的结合(例如受体 -配体的结合),将影响到上面所提到的微环境。
无论如何,检测荧光寿命将直接指示反应环境。
这类信号要远远强于通常会影响其它探测方法的干扰信号,因此它将为市场需求加入巨大的推动力。
Tecan Ultran Evolution detection platform已经融入了对荧光寿命的检测。
除了已经发展的各种检测方法以外,这项新技术使得Ultran Evolution技术平台具有更强的市场应用前景。
2.荧光寿命测定的原理用 Ultra Evolution测定荧光寿命采用的一种方法,称作时间关联的单光子计数(TCSPC)。
实验的基本流程显示在图1。
一个脉冲激光器重复激发样品。
调节激发脉冲的强度,使得对于任何一个脉冲,在探测器上只有一个光子被计数。
按照测量的激光脉冲和探测器感应之间的这段时间,将计数值引入已用荧光计数和时间绘制的柱状图。
荧光寿命测定

·632 ·
化学通报 2001 年 第 10 期 http :ΠΠwww. chemistrymag. org
的分子体积 ( V0 ) ,根据 Perrin 方程来计算荧光寿命[4] ,虽然这种方法所用仪器比较简单 ,但测定过
数有限 ,因此测量精度较差 。1980 年后多频相技术得到发展 ,相调制技术测定荧光寿命的精度也随之
提高 ,从而使复杂体系荧光寿命测定成为可能。但同时仪器也变得昂贵 ,实验测定难度也相应增大。
113 频闪技术[9]
频闪技术也叫脉冲取样 技 术 ( Pulse Sam2
pling Techniques) ,仪器工作原理示于图 3 ( a) 。
首先商品化 。此外 ,Edinburgh Instruments、IBH、HORIBA 等公司也在生产基于 TCSPC 的时间分辨荧
光光谱仪 。
TCSPC 的工作原理如图 1 所示 ,光源发出的脉冲光引起起始光电倍增管产生电信号 ,该信号通
过恒分信号甄别器 1 启动时辐转换器工作 ,时幅转换器产生一个随时间线性增长的电压信号 。另
除了直接应用之外 ,荧光寿命测定还是其它时间分辨荧光技术的基础 。例如基于荧光寿命测 定的荧光猝灭技术可以研究猝灭剂与荧光标记物或探针相互靠近的难易 ,从而对所研究体系中探 针或标记物所处微环境的性质作出判断 。基于荧光寿命测定的时间分辨荧光光谱可以用来研究激 发态发生的分子内或分子间作用以及作用发生的快慢 。另外 ,非辐射能量转移 、时间分辨荧光各向 异性等主要荧光技术都离不开荧光寿命测定 。因此本文拟对荧光寿命测定的主要方法 、各种方法 的原理 、特点以及荧光寿命测定的主要应用进行介绍 。
荧光寿命测定方法

荧光的发射是一个统计过程,很少有荧光分子刚好在τ(荧光寿命)时刻 发射荧光,荧光寿命仅反映荧光强度衰减到其起始值1/e所需的时间。 在被测的微弱随机光场作用下,光检测计光阴极发射光电子,其行为可 用双随机泊松点过程来描述,光电子时间统计特性可用多重概率密度 求平均来得到
式中:tj=to+tj0 得到光检测方程
二、测定荧光寿命的几种方法
荧光寿命测定的现代方法主要有以下几种: 时间相关单光子记数法(Time-Correlated Single-Photon Counting ,TCSPC) 频闪技术(Strobe Techniques) 相调制法(Phase Modulation Methods) 条纹相机法(Streak Cameras) 上转换法(Upcon-version Methods)
均寿命τ 。 τ =1/A21
一、荧光寿命的概念
假定一个无限窄的脉冲光(δ函数) 激发n0 个原子到其激发态,处于激发态的 原子将通过辐射或非辐射跃迁返回基态。假定两种衰减跃迁速率分别为Γ 和knr ,则激发态衰减速率可表示为 d n ( t)/d t= - (Γ + knr ) n ( t) 其中n ( t) 表示时间t 时激发态原子的数目,由此可得到激发态物质的单指数 衰减方程。 n ( t) = n0 exp ( - t/τ) 式中τ为荧光寿命。荧光强度正比于衰减的激发态分子数,因此可将上式改 写为: I ( t) = I0 exp ( - t/τ) 其中I0 是时间为零时的荧光强度。于是,荧光寿命定义为衰减总速率的倒数: τ = (Γ + knr ) - 1 也就是说荧光强度衰减到初始强度的1/e 时所需要的时间就是该荧光物质 在测定条件下的荧光寿命。
荧光寿命的测定方法
荧光光谱分析技术使用技巧

荧光光谱分析技术使用技巧荧光光谱分析技术是一种非常重要的科学技术,在化学、生物、材料领域广泛应用。
它通过测量和分析物质在激发光照射下发射的荧光信号,来获取物质的结构、性质和浓度等信息。
本文将介绍荧光光谱分析技术的使用技巧。
一、样品处理的注意事项在进行荧光光谱分析前,样品处理是一个重要的环节,需要注意以下几点:1. 避免样品的污染和氧化。
在处理样品时要尽量避免接触有机溶剂、金属和空气等,以免影响荧光信号的准确测量。
2. 控制好样品的浓度。
样品的浓度过高会引起荧光信号的饱和,而过低则会导致信号的弱化,影响结果的准确性。
3. 选择适当的溶剂。
溶剂的选择直接影响样品的溶解度和荧光强度。
需要根据样品的性质选择合适的溶剂,保证样品的稳定性和溶解度。
二、选择适当的激发光源和检测器荧光光谱分析需要使用适当的激发光源来激发样品产生荧光信号,并选择合适的检测器来接收和检测荧光信号。
1. 激发光源的选择要合理。
激发光源的种类繁多,如氘灯、氙灯、激光器等,需要根据样品的特性和要求选择适当的激发光源。
例如,对于有机化合物的荧光分析,一般选择底压汞灯作为激发光源。
2. 检测器的选择也很关键。
常用的检测器有光电倍增管(PMT)、光电二极管(PD)和 CCD 像元阵列等。
对于荧光光谱分析,PMT 是最常用的检测器,因为它具有高灵敏度、广泛的工作范围和快速的响应速度。
三、光谱数据的处理和分析在荧光光谱分析中,光谱数据的处理和分析是非常重要的。
常用的处理和分析方法有:1. 光谱图的平滑和峰谷分析。
对于噪声较多的光谱图,可以利用滤波等算法对其进行平滑处理,提高信号的清晰度。
同时,对于峰值的分析,可以采用峰谷法或拟合法来获取峰值的位置和强度等信息。
2. 荧光寿命测量。
荧光寿命是荧光分析中的一个重要参数,可以通过测量样品的荧光衰减曲线得到。
常用的测量方法有时域荧光测量和频域荧光测量等,可以获得样品在不同浓度和条件下的荧光寿命。
3. 数据的统计和分析。
荧光寿命测定的现代方法与应用

荧光寿命测定的现代方法与应用房 喻 王 辉(陕西师范大学化学系 西安 710062)摘 要 介绍了时间相关单光子计数、相调制和频闪等三种现代荧光寿命测定方法的工作原理,指出了各种方法的优点和局限性;介绍了时间相关单光子计数实验数据的处理方法;概述了时间分辨荧光技术在化学和生命科学中的应用。
关键词 荧光寿命 单光子计数 相调制法 频闪技术Abstract The principles and characteristics of s ome of the m odern techniques,including time2correlated single2 photon counting(T CSPC),phase m odulation and strobe techniques,for fluorescence lifetime measurements have been briefly introduced.The advantages and disadvantages of each method have als o been pointed out.The comm on method used for the analysis of the fluorescence decay,taking T CSPC as an example,has been discussed in detail.On the basis of these introductions,the applications of time2res olved fluorescence techniques in chemical and biological re2 search have been overviewed.K ey w ords Fluorescence lifetime,T ime2correlated single photon counting,Phase m odulation methods,S trobe techniques荧光是分子吸收能量后其基态电子被激发到单线激发态后由第一单线激发态回到基态时所发生的,而荧光寿命是指分子在单线激发态所平均停留的时间。
荧光寿命成像技术FLIM

生物光子学大作业作业名称:荧光寿命成像技术FLIM 姓名:曾扬舰学号:完成日期:2016.6.28荧光寿命成像技术FLIM摘要:荧光寿命显微成像技术(FLIM)技术是一种新颖的荧光成像技术,具有其他荧光成像技术无法代替的优异性能,是生物医学工程领域的研究热点。
频域调制、门控探测和时间相关单光子计数是FLIM的几种主要实现方法。
综述了这些计数的原理、研究现状和已取得的部分成果,比较了这三种方法的时间分辨率和成像速度等参数的优劣。
宽场FLIM更适用于延时成像和实时成像。
荧光偏振各向异性成像和内窥镜FLIM技术都是FLIM技术很有前景的应用方向。
Fluorescence Lifetime Imaging Microscopy(FLIM)Why lifetime Imaging?The fluorescence lifetime is the signature of a fluorescent material ;It is the exponential decay in emission after the excitation of a fluorescent material has been stopped. FLIM is a technique to map the spatial distribution of lifetimes within microscopic images and it allows measurements in living cells as well as in fixed.Because of the fact that some phenomena do affect fluorescence lifetimes, the lifetime is used to detect these phenomena leading to various applications such as; lon imaging ,oxygen imaging, probing microenvironment, and medical dlagnosis.Frequency domain methodThe homodyne frequency domain FLIM method requires amodulated light source and a modulated detector.In the LIFE system these are the LED and the intensified CCD camere. Both are modulated at exactly the same frequency,but with an adjustable diffrence in phase.These two parameters depend on the fluorescence lifetime of the sample and the modulation frequency and are measured to calculate the flurescence lifetime in each pixel of the image.1、基本概念荧光是分子吸收能量后使得其基态电子被激发到单线激发态后由第一单线激发态回到基态时所发生的辐射复合发出的光。
荧光寿命数据的相量分析及其应用

荧光寿命数据的相量分析及其应用*林丹樱† 牛敬敬 刘雄波 张潇 张娇 于斌 屈军乐‡(深圳大学物理与光电工程学院, 光电子器件与系统教育部/广东省重点实验室, 深圳 518060)(2020 年4 月15日收到; 2020 年5 月14日收到修改稿)荧光寿命显微成像技术(fluorescence lifetime imaging microscopy, FLIM)具有特异性强、灵敏度高、可定量测量等优点, 被广泛应用于生物医学、材料学等领域的研究. 为使FLIM技术更好地适用于高通量数据的快速分析, 近年来涌现出多种荧光寿命分析的新算法. 其中, 相量分析法(phasor analysis, PA)通过将时间域的拟合转化为频率域的直接计算来获得荧光寿命值, 与传统的最小二乘拟合法相比, 不仅更加简便快速,适用于低光子数情形, 而且便于使数据内容可视化和对数据进行聚类分析, 因此越来越受到科研人员的青睐.本文详细阐述了相量分析法的基本原理及运用方法, 并在此基础上介绍了该方法在细胞代谢状态测量、蛋白质相互作用研究、细胞微环境测量, 以及辅助病理诊断和提高超分辨成像分辨率等方面的应用, 着重讨论了PA法在这些FLIM应用实例中的优势所在, 为相关领域的研究提供有益的参考. 最后, 对荧光寿命数据的相量分析及其应用的发展方向进行展望.关键词:荧光寿命显微成像, 数据分析, 相量分析法, 生物医学应用PACS:87.64.–t, 87.64.M–, 87.64.kv, 87.85.Pq DOI: 10.7498/aps.69.202005541 引 言随着荧光标记技术的快速发展, 荧光显微成像技术已成为生物医学研究领域不可或缺的工具之一. 荧光寿命作为荧光的一个重要参量, 反映了荧光分子从激发态回到基态的退激发速率, 是荧光分子的固有特性, 其变化能非常灵敏地反映荧光分子所处微环境(如细胞微环境中的温度、黏度、pH值、离子浓度等)的变化情况[1]. 同时由于荧光寿命的测量可不受荧光探针浓度、激发光强度、光漂白等因素的影响, 相比强度测量更有利于实现定量化, 因此探测样品中荧光寿命的分布和变化的荧光寿命显微成像技术(fluorescence lifetime imaging microscopy, FLIM)常常被应用于定量测量细胞内的一些生物物理和生物化学参数[2,3], 或气溶胶的黏度测量等[4]. 另一方面, 许多荧光团分子具有相似的荧光光谱, 假如利用它们对样品中不同的结构进行特异性标记, 直接从光谱上很难分离, 但利用它们荧光寿命不同的特点, 可借助FLIM技术对其荧光进行区分, 从而实现多结构的同时标记和成像. 这些特点使得FLIM在生命科学研究中有着越来越广泛的应用.一般而言, FLIM中荧光寿命的测量方法有时域法与频域法两类, 其中频域法使用周期调制的连续光激发样品, 检测荧光信号相对激发光的振幅和相位变化来计算样品的荧光寿命; 时域法采用高重复频率的飞秒脉冲激光激发样品, 利用门控技术、* 国家重点研发计划(批准号: 2017YFA0700500)、国家自然科学基金(批准号: 61775144, 61975131, 61620106016, 61525503, 61835009)、广东省高等学校科技创新(重点)项目(批准号: 2016KCXTD007)、广东省自然科学基金(批准号: 2018A030313362)和深圳市基础研究项目(批准号: JCYJ20170818144012025, JCYJ20170818141701667, JCYJ20170412105003520)资助的课题.† 通信作者. E-mail: dylin@‡ 通信作者. E-mail: jlqu@© 2020 中国物理学会 Chinese Physical Society 扫描相机技术、时间相关单光子计数(time-correlated single photon counting, TCSPC)技术等记录脉冲过后荧光信号的衰减过程并拟合或计算荧光寿命. 因此, 不管对于哪种类型的FLIM, 荧光寿命数据的处理都是非常关键的一环. 例如, 时域法荧光寿命数据最常用的处理方法是非线性最小二乘(nonlinear least-squares, NL-LS)拟合法,即选择一种衰减模型(单指数、双指数或多指数衰减)对每个像素点的测量数据进行曲线拟合, 然后分析出各衰减组分的荧光寿命值. 但是这种方法要求衰减模型的选择要合适, 同时要求每个像素点要采集足够多的光子数(通常 >1000)才能够进行有效拟合[5]. 这就使得基于这种数据处理方法的FLIM技术在应用上受到了相应的限制. 例如, TCSPC-FLIM通常需要在激发光较弱的情况下进行成像, 以避免相邻两个脉冲之间检测到的光子数多于1而导致的光子堆积问题, 因此要求每个像素点采集足够多的光子数就需要延长采集时间, 由此带来的问题就是获得一幅荧光寿命图像的时间相对较长, 成像速度受限, 无法应用于一些荧光寿命变化速度较快的场合.因此, 针对这些问题, 研究者们开发出了其他的算法, 例如相量分析(phasor analysis, PA)[6]、极大似然估计(maximum likelihood estimate, MLE)[7]、一阶矩(the first moment, M1)[8]、贝叶斯分析(Bayesian analysis, BA)[9]、压缩感知(compressed sensing, CS)[10]等, 这些方法可通过降低寿命分析对光子数的要求从而间接地提高FLIM技术的成像速度[11]. 其中, PA法通过将时域信息变换到频域, 可直接计算得到荧光寿命值,简单快速, 无需拟合, 且在低光子数情况下也能得到比较准确的寿命值, 适合于快速FLIM成像. 另一方面, PA法生成的相量图能将具有相似荧光衰减特性的荧光团分子所对应的像素点显示在相邻区域, 形成一定的簇状分布, 这种特点使得利用该方法可以更方便地对数据进行可视化和聚类分析,因此结合PA法的FLIM技术(phasor-FLIM)越来越受到科研人员的青睐, 在生命科学和生物医学研究中应用越来越广泛.本文首先详细阐述phasor-FLIM的基本原理及使用方法, 并在此基础上介绍该技术应用于细胞代谢状态测量、蛋白质相互作用研究、细胞微环境测量以及辅助病理诊断和提高超分辨成像分辨率等方面的最新研究进展, 最后对其发展前景进行展望.2 Phasor-FLIM的基本原理如前所述, FLIM技术中荧光寿命的测量通常分为频域法和时域法[1,6]. 这两种方法在数学意义上互为傅里叶变换, 但它们获取荧光寿命信息的方式不同, 得到的数据内容和形式不同, 从而数据处理方法一般也不同. 频域法一般使用正弦调制的连续光激发样品, 测量得到的是具有相同频率的荧光信号, 但由于荧光寿命的影响, 荧光信号的振幅和相位相比激发光均发生了变化, 因此通过计算荧光信号相对激发光的振幅调制度变化和相位延迟可计算得到荧光寿命. 而时域法则需要采用高重复频率的飞秒脉冲激光激发样品, 利用前面提到的门控技术、扫描相机或TCSPC技术等直接或间接记录脉冲过后的荧光衰减过程, 得到的是荧光强度(或光子数)随时间的变化关系, 因此一般可通过曲线拟合得到荧光寿命.PA法最先被用于处理频域FLIM技术得到的荧光寿命数据, 其相量由频域FLIM测量得到的解调系数和相位延迟来构建, 是原始数据的直接表达[12]. PA法同样适用于时域FLIM数据的分析,但需要先将时域的荧光衰减变换到频域. 由于时域FLIM中的TCSPC-FLIM目前应用最为广泛,因此PA法在该技术中的应用也是报道得最多的.以下分别介绍这两类技术中PA法分析荧光寿命的基本原理, 并结合荧光相量图的特点阐述其典型的应用思路.2.1 频域法FLIM及其相量分析在频域FLIM中, 激发光常采用正弦调制的连续光源, 如激光、氙灯、LED灯等, 激发光强可描述为其中E(0)和E(t)分别为起始时刻和t时刻的激发光强度, M E = a/A为激发光的强度调制度(a和A分别是激发光的振幅和平均强度, 如图1(a)所示), w为调制的角频率. 利用该激发光激发标记有荧光团的样品后, 所检测到的荧光也是正弦调制的, 且其频率与激发光相同, 但强度调制度会降低,相位也有一定延迟. 如果荧光衰减符合单指数衰减规律, 则荧光光强可描述为相应地, I (0)和I (t )分别为起始时刻和t 时刻的荧光强度, M F = b /B 为荧光的强度调制度(b 和B 分别是荧光的振幅和平均强度, 如图1(a)所示), f 为相位延迟或相移. 通过测量相移f 和解调系数M = MF /M E , 即可计算出相应的荧光寿命, 即:可以证明[12,13], 当荧光的衰减过程符合单指数衰减规律(即I (t ) = I (0)e –t /t , t 为寿命)时, (3)式和(4)式算得的寿命t f 和t m 是相等的, 理论上只需要计算其中一个即可. 但假如荧光的衰减过程是两个或多个单指数衰减过程的组合(即双指数衰减或多指数衰减), 则情况更加复杂, 通常需要先在不同调制频率w i 下重复测量多组f i 和M i , 并通过以下公式先计算出等效相移和解调系数再求解寿命, 即:其中f i 为第i 个调制频率测得的光强占总光强的比例.1984年, Jameson 等[13]利用相量的概念对频域法FLIM 得到的数据进行几何表示, 他们利用单个像素点对应的解调系数M 和相移f 来构建一个相量, 即以M 作为该相量的模, 以f 作为该相量的辐角, 则可以认为相量与像素点是一一对应的, 相量图上一个相量的端点就代表了一个像素点的全部荧光寿命信息(如图1(b)所示). 该相量在实轴和虚轴的分量可用Weber 符号表示[14], 即:对于单指数衰减情形, 由(3)式和(4)式可得到cos f = M , 因此可以得到:即以坐标(G , S )表示的相量端点被约束在圆心位于(0.5, 0)处、半径为0.5的半圆上. 半圆上的每个点表示不同的寿命, 寿命值从左到右递减, 其中(1, 0)表示接近零的寿命, (0, 0)表示无限长的寿命, 如图1(b)所示.I (t )=I (0)∑jαj e −t /τj 而如果一个像素点处的荧光衰减过程为多个单指数衰减过程的叠加(即 ,其中t j 表示第j 个单指数衰减组分的寿命, a j 表示该组分的占比), 则根据衰减组分间的线性叠加性质, 其在相量图上对应的相量端点应位于半圆以内[15], 即多指数衰减过程对应的G 和S 应为:1C o u n t s Arrival time(b)(a)(d)(c)图 1 荧光寿命的测量方法及相量分析(PA)法示意图 (a)频域法测量原理示意图; (b)单指数衰减的寿命相量示例图; (c)双指数衰减的寿命相量示例图; (d)时间相关单光子计数(TCSPC)测量原理示意图Fig. 1. Schematic diagram of fluorescence lifetime measurement and phasor analysis (PA): (a) Frequency domain method; (b) life-time phasor of single-exponential decay; (c) lifetime phasor of bi-exponential decay; (d) time-correlated single photon counting (TC-SPC) method.几何意义上, 多指数衰减过程对应的相量端点应位于其各个单指数衰减组分对应的寿命相量端点连接组成的集合内. 如图1(c)中, 双指数衰减过程对应的寿命相量端点(蓝色)落在半圆以内, 位于两个单指数衰减组分对应的寿命相量端点(绿色)的连线上, 且与两端点的距离(p 1, p 2)由两个组分的占比(a 1, a 2)决定.2.2 时域法FLIM 及其相量分析PA 法同样适用于时域法FLIM 数据的分析.这里以目前应用最广泛的TCSPC-FLIM 技术为例. 如图1(d)所示, TCSPC 将每一次脉冲信号作为一个信号周期, 每个周期内当探测到第一个荧光光子时就在其到达时间对应的时间通道中进行计数, 经过多次累积即可建立一个反映荧光衰减过程的光子数-时间分布直方图, 用于求解荧光寿命.2008年, Digman 等[16]将Weber [14]于1981年提出的荧光脉冲响应的傅里叶分析方法用于TCSPC 技术, 并使用以下关系式计算相量端点坐标, 也可以将每个像素的全部荧光衰减信息转换为相量图上的单个点, 即:其中G (w )和S (w )分别是荧光脉冲响应傅里叶频谱的实部和虚部, 这里用作寿命相量的两个分量;I (t )是脉冲过后t 时刻的荧光光强, w 是脉冲激光的角频率, T 是周期长度(实际可取动态范围),n 是谐波的阶次, 一般情况下取基频分量, 即n =1. 因为TCSPC 是在N 个离散的时间通道t k 中记录荧光衰减分布直方图的, 因此上述积分运算可转化为求和计算:其中C k 是第k 个时间通道记录的光子数,I =∑Nk=1C k 是所有时间通道记录的总光子数.如果荧光脉冲响应呈单指数衰减规律, 则代入(11)式可得G (w )和S (w )与荧光寿命t 的关系为:可以验证, G , S 仍然满足(8)式的关系, 即单指数衰减情形下以坐标(G , S )表示的相量端点仍被约束在圆心位于(0.5, 0)处、半径为0.5的半圆上, 与频域法得到的相量图一致.而如果荧光脉冲响应是呈多指数衰减的, 则同样根据线性叠加关系可知, 坐标(G , S )表示的相量端点也位于半圆以内, 其中双指数衰减过程对应的相量端点也在其两个单指数衰减组分对应的相量端点连线上, 与频域法得到的结论一致.2.3 相量图的特点及其典型应用思路如前所述, 对于满足单指数衰减规律的情形,荧光寿命相量图上以坐标(G , S )表示的相量端点被约束在圆心位于(0.5, 0)处、半径为0.5的半圆上, 而多指数衰减过程的相量端点则位于半圆以内, 具体地说, 是位于各单指数衰减组分相量端点连接组成的集合内. 例如, 对于双指数衰减情形,其寿命相量端点位于两个单指数衰减组分相量端点的连线上, 且位置与两个组分的占比有关. 相量图的这些特点, 使得其在荧光寿命数据的定量分析、可视化和聚类分析方面有很大优势.如前所述, 荧光寿命反映的是荧光分子从激发态回到基态的退激发速率, 因此当处于激发态的荧光分子所处的微环境不同, 或者荧光分子与其他分子发生相互作用和能量转移时, 荧光寿命会发生灵敏的变化. 所以, 许多荧光团存在两个甚至两个以上的衰减速率, 分别对应于荧光团的不同状态, 例如细胞内的还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NADH)处于自由态时(主要位于细胞质中)的荧光寿命为几百皮秒(t 1), 与蛋白质绑定后处于结合态时(主要位于线粒体中)的荧光寿命则达到几纳秒(t 2)[6].2005年Brid 等[17]利用干扰NADH/NAD+比例的代谢药物氰化钾(Potassium cyanide, KCN)阻断细胞的呼吸作用, 证明了细胞中自由态和结合态NADH 的占比与NADH / NAD+比例有关, 从而提出利用FLIM 测量自由态和结合态NADH 的比例, 来间接获得活细胞内的NADH/NAD+比例.NADH 与其氧化形式NAD+作为生物体内许多氧化还原反应的辅酶参与生命活动并相互转化, 它们之间的平衡反映了氧化磷酸化和糖酵解的比率, 因此NADH/NAD+比例及其变化可用于监测细胞代谢方式的变化. 对于细胞内NADH/NAD+比例的探测, 传统的方法有酶循环法、毛细管电泳法、质谱分析法等, 但这些方法只适用于对细胞提取物进行检测. 直接对细胞内NADH/NAD+比例进行探测也可以采用荧光强度成像的方法, 这是因为NADH 发荧光而NAD+不发荧光. 但由于荧光团浓度的不均一性以及自由态和结合态NADH 荧光量子产率的不同, 基于强度成像的NADH/NAD+测量结果通常存在较大误差. Brid 等[17]的工作为定量监测活细胞内NADH/NAD+的比例提供了一种新的思路, 即通过FLIM 定量测量自由态和结合态NADH 的比例来间接获得NADH/NAD+比例. 他们的研究还表明, 当NADH/NAD+比例发生变化时, 自由态和结合态NADH 的荧光寿命值(即t 1和t 2)几乎保持恒定, 变化的是它们各自的占比(即a 1和a 2). 多指数衰减情形的寿命相量与其各个单指数衰减组分寿命相量之间的线性关系,使得采用了PA 法分析荧光寿命的phasor-FLIM 特别适合于在已知单指数衰减组分寿命的前提下, 对多组分尤其是双组分中不同组分的占比进行定量分析. 所以, phasor-FLIM 的典型应用之一, 就是根据寿命相量端点的位置对NADH 两种寿命组分的占比进行定量分析, 从而用于细胞代谢状态的测量[18−27].此外, 在利用荧光共振能量转移(fluorescence resonance energy transfer, FRET)对蛋白质相互作用进行研究的FLIM-FRET 实验, 以及一些利用FLIM 研究细胞微环境参量变化的场合, 也会涉及到双指数衰减甚至多指数衰减及其组分占比的变化, 因此phasor-FLIM 在这些应用中的报道近几年也多了起来[28−34].其次, PA 法生成的相量图中, 具有相似荧光衰减特征的像素点所对应的相量端点会显示在相近的位置, 因而形成一定的簇状分布(如图2(a)和图2(b)所示), 称为“相量簇”. 同一个相量簇对应于具有相似荧光衰减特性的多个像素点, 但这些像素点在样品中的分布可以是不连续的, 和它们的空间分布并没有直接联系. 利用该特点, 可在相量图上选取感兴趣的相量簇, 并通过其对应关系找到相量簇中各相量端点所对应的像素点在样品上的位置, 就可以方便地将样品中具有相似荧光寿命特征的区域标记出来(如图2(c)所示), 还可以进一步对这些荧光寿命特征相似的区域进行聚类分析, 从而为研究一些生物医学问题带来极大的便利[18−20].倘若对不同的相量簇对应的像素点赋以不同的伪彩色, 则利用该方法还可以方便地实现荧光寿命图像的多色显示(如图2(d)所示), 从而起到辅助病理判断等作用[35−37]. 最近, 这种利用PA 法对荧光寿命的分布进行聚类分析的方法还被应用于辅助提高基于受激辐射耗尽(stimulated emission depletion, STED)的超分辨成像的分辨率[38−40].综上, 目前phasor-FLIM 的应用可以用图3来表示. 以下将举例说明phasor-FLIM 的应用研究进展.Fluorescence intensity image Lifetime phasor plotPhasor -mapped FLIM image Phasor analysis(d)(c)图 2 Phasor-FLIM 的应用思路示意图 (a)包含未处理寿命信息的荧光强度图; (b)经PA 法分析得到的寿命相量图; (c)对寿命相量直接进行分析; (d)通过相量聚类分析和伪彩色标记得到的荧光寿命图Fig. 2. Schematic diagram of phasor-FLIM application:(a) Fluorescence intensity image with untreated lifetime in-formation; (b) lifetime phasor plot obtained by PA analysis;(c) direct analysis of lifetime phasors; (d) phasor-mapped FLIM image based on phasor clustering analysis and pseudo-color assignment.3 Phasor-FLIM的应用研究进展3.1 基于NADH的细胞代谢应用研究细胞的能量主要来自细胞呼吸, 正常细胞或正常分化的细胞在有氧条件下采用糖酵解进行代谢,缺氧条件下通过氧化磷酸化进行代谢. 而高度增殖的细胞(如癌细胞或干细胞)即使在氧气充足的条件下也多选择糖酵解作为主要的产能方式, 这种现象被称为“Warburg效应”[41]. 而这种细胞代谢方式的不同导致两者所含NADH的浓度和状态存在差异. 因此基于前面提到的NADH处于两种不同状态具有不同荧光寿命的特性, 以NADH作为内源荧光标志物的双光子FLIM成像常被用于研究正常细胞、干细胞、癌细胞以及其他疾病发生时细胞的代谢差异, 而结合了PA法的phasor-FLIM 可方便地实现活组织中单细胞代谢表型的观测, 在细胞分化和增殖、疾病的机理研究和诊断等方面均具有很好的应用前景, 目前也取得了一些重要的应用研究进展.细胞分化和增殖过程会改变糖酵解和氧化磷酸化之间的平衡, 所以代谢变化可用于研究细胞分化和增殖状态. Stringari等[18−20]通过对细胞内包括NADH在内的各种内源性荧光标志物进行FLIM成像, 并利用PA法对FLIM图像进行分割,可以区分胶原蛋白、视黄醇、视黄酸, 以及处于自由态和结合态的NADH. 他们对小肠进行双光子FLIM成像并对利用PA法得到的寿命相量簇进行聚类分析, 用来识别高度增殖的小肠干细胞, 通过代谢状态对小肠干细胞和分化的后代进行分类分析, 以监测与代谢变化相关的生理(病理)过程.Lee等[21]对白细胞和白血病细胞进行FLIM成像,因为白血病细胞快速增殖, 糖酵解占主导地位, 寿命相量簇向短寿命方向移动, 利用PA法定量分析自由态和结合态NADH比例的变化, 可从血液中快速筛选和分离白血病细胞. 与传统的生物分子诊断技术相比, 这种基于phasor-FLIM的单细胞筛查方法对细胞友好, 具有临床筛选血液细胞的潜力. 细胞外基质(extracellular matrix, ECM)是所有组织必不可少的动态组成部分, 并通过提供机械和生化信号来直接影响细胞行为. ECM的变化可以改变组织的动态平衡, 从而潜在地促进细胞转化和肿瘤的发生. Romero-Lopez等[22]将正常细胞接种在提取自正常人结肠和转移至肝脏的结肠肿瘤的ECM中, 利用phasor-FLIM技术定量分析了自由态和结合态NADH的比例, 结果发现接种在肿瘤ECM中的细胞比接种在正常ECM中的细胞具有更高的游离NADH水平, 糖酵解速率较高, 表明ECM在癌细胞及其相关脉管系统的生长中起到了重要作用.由于许多疾病的发病机制与细胞代谢也有着密切的关联, phasor-FLIM在疾病的机理研究及诊断方面也有不少应用实例. 例如, 亨廷顿病(Huntington’s disease, HD)是一种常染色体神经退行性疾病, 能量代谢障碍是HD的主要发病机制. Sameni等[23]使用phasor-FLIM来定量测量HD中自由态和结合态NADH的比例变化, 作为活细胞代谢变化的间接测量, 用以研究HD发病机制, 结果表明HD的代谢障碍为糖酵解增加, 导致氧化应激和细胞死亡. 这种定量分析的方法可用于筛选HD组织并进行潜在的药物筛选, 对诊断和治疗疾病具有重要意义. 阿兹海默症(Alzheimer’sPhasor-FLIMMetabolism FRET Microenvironment Pathology p-STED BoundNADH (OXPHOS)FreeNADH(Glycolysis)Low FRETHigh FRETDonorMeasuredAutofluoresencepH 7.8pH 5.4Structure 1SelectedAbandoned图 3 Phasor-FLIM 的应用分类示意图Fig. 3. Application classification diagram of phasor-FLIM.disease, AD)是一种老年人多发的神经退行性疾病, 与抗氧化保护降低和线粒体功能障碍有关.Dong 等[24,25]使用双光子激发FLIM 技术结合PA 法定量分析了老年小鼠海马区神经元游离NADH 的水平, 结果发现随着年龄的增加, 游离的NADH 浓度降低, 氧化磷酸化占据主导地位,AD 进一步恶化, 而还原性治疗可恢复老年小鼠及AD 小鼠神经元中游离NADH 的水平. Hato 等[26]则采用类似的方法对活体小鼠肾脏进行双光子FLIM 成像, 使用PA 法分析肾脏中的代谢变化,提供了一种研究肾脏疾病代谢的方法. Datta 等[27]通过双光子FLIM 对人诱导多能干细胞分化的心肌细胞(human induced pluripotent stem cell-derived cardiomyocytes, hiPS-CMs)进行成像, 检测缺氧和线粒体毒性药物氰化钾病理刺激下代谢状态的变化. 如图4所示, 缺氧状态下和用药物刺激时hiPS-CMs 的寿命相量分布向自由态NADH 的方向移动, 代谢方式转变为糖酵解. 这种非侵入性成像技术有助于研究心脏病的发病机理和治疗方法[27].3.2 基于FLIM-FRET 的蛋白互作研究当一个荧光分子(供体)的荧光发射光谱与另一个荧光分子(受体)的激发光谱相重叠, 且两者间的距离合适(一般为6—10 nm)时, 供体的激发能诱发受体发出荧光, 同时其自身的荧光强度发生衰减, 称为FRET 效应. 由于该效应发生的程度(即FRET 效率)与供体和受体的距离紧密相关,该效应常被用于研究蛋白质间的相互作用(简称“蛋白互作”). 具体的做法是将供体荧光分子和受体荧光分子分别标记于两个蛋白质分子上, 通过测量FRET 效率来反映两个蛋白质之间的距离, 从而反映其是否发生相互作用以及相互作用的程度.从荧光寿命的角度看, 当FRET 效应发生时, 由于供体将能量转移到受体上, 供体的荧光寿命将变短. 考虑到FLIM 测量不受光漂白等因素的影响,利用FLIM 进行FRET 效率的测量比测量荧光强度变化的方法要更加准确, 因此FLIM-FRET 已被广泛应用于蛋白互作的研究. 发生和不发生FRET(或者说FRET 效率很高和很低)两种状态下供体的寿命可认为是不变的, 相当于两个单指数衰减组分, 因此根据PA 法的分析, 两种状态下得到的寿命相量应位于半圆上. 而当部分供体发生FRET 时, 总体的荧光衰减满足双指数衰减规律,寿命相量端点将位于上述两个单组分寿命相量端点的连线上, 且到两端的距离与两种组分的占比有关, 由此可方便地计算出FERT 效率. 2012年和2013年, Hinde 等[28,29]利用phasor-FLIM 和FRET 监测了小G 蛋白与RBD 蛋白在溶血磷脂酸(lysophosphatidic acid, LPA)刺激下相互作用的变化, 结果表明, 在荧光强度图像看不出明显差异的情况下, FLIM 图像和PA 定量分析均显示小G 蛋白与RBD 蛋白的标签蛋白EPCF 和Critine 在LPA 刺激下FRET 效率显著增加(如图5所示). Lou 等[30]在共表达H2B-eGFP 和H2B-mCherryrry 两种荧光蛋白的Hela 细胞中利用phasor-FLIM 测得的FRET 效率对核小体的紧实度进行了量化, 用于定量反应DNA 的损伤情况.Cell 1Cell 2Cell 2Cell 1NADH FLIM map Fluorescence intensity U n t r e a t e d c e l l sT r e a t e d c e l l sABBound NADHFree NADHPhasor distribution1.00.5000.5 1.0AB LDH-bound NADHFree NADH in solution图 4 Phasor-FLIM 用于分析细胞在缺氧和线粒体毒性药物氰化钾刺激下NADH/NAD+比例的变化, 研究代谢状态的转变[27]Fig. 4. Phasor-FLIM was used to analyze the change of NADH/NAD+ ratio under the stimulation of hypoxia and mitochondrial toxic drug potassium cyanide, for studying the change of metabolic state of cells [27].。
荧光寿命测定方法

三、时间相关的单光子计数方法TCSPC
降低激光功率,使每一个激光脉冲所含能量足够小,以至于每次激发样 品时或者仅有1个荧光光子到达探测器的光阴极,或者没有。假如100 个激光脉冲激发样品,所发出的荧光光子仅能使光阴极平均发射1个 光电 子。光子q重概率密度则变成单个光电子概率密度:
E4 E3 E2
(10-8s) (10-3s)
E4 E3 E2
h
E1
E1
一、荧光寿命的概念
自发辐射:处于高能级E2的原子自发地向低能级E1跃迁,并发射出一个频
率为 υ=( E2- E1 )/h的光子。
自发跃迁几率:发光材料在单位时间内,从高能级上产生自发辐射的发光
粒子数密度占高能级总粒子数密度的比值 A21=(dn21/dt)sp/n2
三、时间相关单光子计数方法TCSPC
时间相关单光子计数技术首先由 Bollinger、Bennett、Koechlin 三人在六十 年代为检测被射线激发的闪烁体发光而建立的,后来人们把它应用到荧光 寿命的测量。
四、TCSPC技术优缺点
• TCSPC 法的突出优点在于灵敏度高、测定结果准确、系统误差 小,是目前最流行的荧光寿命测定方法; • 实际测定中,必须调节样品的荧光强度,确保每次激发后最多只有 一个荧光光子到达终止光电倍增管。否则会引起“堆积效应” (Pileup Effect); • 对于量子效率较高的样品,需要限制激发光强度,即减小多个光 电子同时到达的概率; • 这种方法所用仪器结构复杂、价格昂贵、而且测定速度慢,无法满 足某些特殊体系荧光寿命测定的要求。
Pf(t) ≈ <λ(t)> = αI(t)
只要测得单个光电子到达时间概率分布,也就得到了微弱光场衰变曲线。 利用窗口鉴别器开设时间窗口,可以很方便地测量激发后不同时间区 间的荧光光谱,就得到了时间分辨荧光光谱。利用非线性最小二乘法、 矩法、Laplace 变换法、最大熵法以及正弦变换法等拟合曲线得到结果。
荧光寿命谱

荧光寿命谱
荧光寿命谱(Fluorescence Lifetime Spectrum)是一种用于研究物质荧光特性的光谱技术。
荧光寿命是指荧光物质在激发态下的寿命,它与物质的化学结构和所处环境密切相关。
通过测量荧光寿命,可以获取关于物质结构、性质和微观环境的信息。
荧光寿命谱测量技术主要包括时域和频域两种方法:
1. 时域荧光寿命测量:通过测量荧光信号随时间的变化,得到荧光寿命。
这种方法通常采用时间相关单光子计数(Time-Correlated Single Photon Counting,TCSPC)技术,可以测量寿命范围从几十皮秒到几秒的荧光过程。
2. 频域荧光寿命测量:通过测量荧光信号在激发光源频率范围内的变化,得到荧光寿命。
这种方法通常采用相调制(Phase Modulation)和频闪(Frequency Flash)等技术,可以测量寿命范围从几十兆赫兹到几十吉赫兹的荧光过程。
荧光寿命谱在物理学、化学、生物学、材料科学等领域有广泛的应用。
例如,在生物医学研究中,通过测量荧光寿命谱可以研究生物分子之间的相互作用、蛋白质的构象变化等;在材料科学中,可以研究材料的电子结构和光学性质等。
荧光寿命法
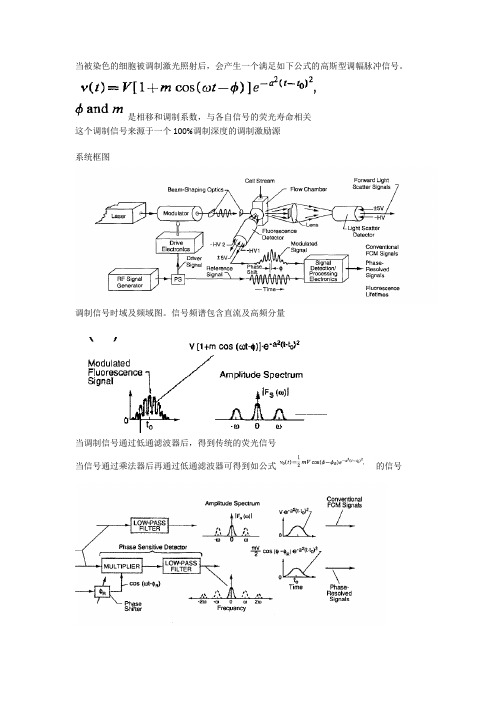
当被染色的细胞被调制激光照射后,会产生一个满足如下公式的高斯型调幅脉冲信号。
是相移和调制系数,与各自信号的荧光寿命相关
这个调制信号来源于一个100%调制深度的调制激励源
系统框图
调制信号时域及频域图。
信号频谱包含直流及高频分量
当调制信号通过低通滤波器后,得到传统的荧光信号
当信号通过乘法器后再通过低通滤波器可得到如公式的信号
荧光寿命涛与参考信号频率欧米伽的关系如公式
当参考信号费r为零时,cos费就是荧光信号时延通过移向90度可得两个信号,相除可得涛
当有两种染色信号时,信号如下
通过改变费r可得如下信号
可达到消除另一种荧光信号的目的。
时间分辨荧光技术与荧光寿命测量

第23卷第4期大学化学2008年8月今日化学时间分辨荧光技术与荧光寿命测量李东旭许潇李娜李克安北京大学化学与分子工程学院北京100871 摘要意义及应用。
介绍了时间分辨荧光技术与荧光寿命的测量方法、时间分辨荧光技术有基于时域和基于频域两种测量方法。
由于时间分辨结果数据包含有比稳态荧光数据更多的信息近年来时间分辨荧光技术已成为生物化学与生物物理领域的主要研究工具之一。
荧光寿命成像技术可以同时获得分子状态以及空间分布的信息在生物学仪器及应用等方面简要介绍时间分和医学领域也得到了越来越广泛的应用。
以下将从原理、辨荧光以及荧光寿命测量技术。
1 荧光及荧光寿命的基本原理分子吸光后去活化的原理与过程可以直观的用P errin Jablonsky图表示图1是一种简化表示。
简言之分子中处于单线态基态电子能级S 0 的电子依据 F rank Condon规则吸收一定波长的光子后被激发至单线态激发态电子能级一般是S 1 态中的某一振动能级这一过- 15 - 12 - 10程约10 s 在经历短暂的振动弛豫过程后约10 10 s 会有大量电子在S 1 态的最低振动能态积累。
这一状态的电子会有几种释放能量回到基态S0 态的途径包括振动弛豫在内的这些途径被统称为去活化的过程。
若能量释放的过程中伴随着光子的放出则称为辐射去活若只是通过碰撞等途径释放能量而没有光子放出则称为无辐射去活。
图1 Perrin Jab lon sky 简图荧光发射即为一种常见的辐射去活过程它通常是指电子发生自S1 态至S 0 态的跃迁同- 10 - 7时放出光子的过程这一过程的时间通常在10 10 。
s 利用光学仪器检测荧光发射的强度随时间的变化即可得到体系的荧光寿命信息。
1 无辐射去活过程有以下几种途径: 内转换指的是电子在具有相同多重度的电子能态间发- 11 - 9生跃迁的过程时间通常在10 至10 s 系间跨越指的是电子在不同多重度的能态间发生- 10 - 8跃迁的过程如单线态S 1 至三线态T 1 的跃迁其时间通常在10 10 s 荧光猝灭指的是激发分子通过分子间的相互作用和能量转换从而释放能量的过程也称作外转换。
荧光寿命测定方法.

五、荧光寿命测定中可能存在的问题
• 当荧光寿命值与仪器自身响应时间为同一量级时,实测结果为二 者的卷积,需要对结果进行解卷积,扣除系统响应时间的影响。 • 发光材料自身存在荧光俘获效应,尽量减小样品厚度。
谢谢大家!
均寿命τ 。 τ =1/A21
一、荧光寿命的概念
假定一个无限窄的脉冲光(δ函数) 激发n0 个原子到其激发态,处于激发态的 原子将通过辐射或非辐射跃迁返回基态。假定两种衰减跃迁速率分别为Γ 和knr ,则激发态衰减速率可表示为 d n ( t)/d t= - (Γ + knr ) n ( t) 其中n ( t) 表示时间t 时激发态原子的数目,由此可得到激发态物质的单指数 衰减方程。 n ( t) = n0 exp ( - t/τ) 式中τ为荧光寿命。荧光强度正比于衰减的激发态分子数,因此可将上式改 写为: I ( t) = I0 exp ( - t/τ) 其中I0 是时间为零时的荧光强度。于是,荧光寿命定义为衰减总速率的倒数: τ = (Γ + knr ) - 1 也就是说荧光强度衰减到初始强度的1/e 时所需要的时间就是该荧光物质 在测定条件下的荧光寿命。
Pf(t) ≈ <λ(t)> = αI(t) 只要测得单个光电子到达时间概率分布,也就得到了微弱光场衰变曲线。 利用窗口鉴别器开设时间窗口,可以很方便地测量激发后不同时间区间 的荧光光谱,就得到了时间分辨荧光光谱。利用非线性最小二乘法、矩 法、Laplace 变换法、最大熵法以及正弦变换法等拟合曲线得到结果。
一、荧光寿命的概念
自发辐射跃迁的过程是一种只与原子本身的性质有关,与辐射场无关的自
发过程。A21的大小与原子处在E2能级上的平均寿命τ 2有关。 E2能级上的粒子数密度n2随时间的变化率
时间分辨荧光技术与荧光寿命测量

维普资讯
第2 卷 第4 3 期
比稳态荧光数据更多的信息 , 近年来 , 时间分辨荧光技术 已成为生物化学与生物物理领域的主 要研究工具之一。荧光寿命成像技术可以同时获得分 子状态以及空 间分布的信息 , 在生物学 和医学领域也得到了越来越广泛 的应用。以下将从原理、 仪器及应用等方面 , 简要介绍时问分
辨荧 光 以及 荧 光寿命 测 量技 术 。
会 立 即消失 , 而是会 逐 渐衰 减 至 0 。基 于 以上原 理 , 以对 一个 理想 体 系 的荧 光衰 减 进行 严 格 可
的数 学 推导 。
对于荧光物质 A的稀溶液 , 设其浓度为 [ ] m l L ) 假设所有 A分子所处的环境近 A ( o・ , 似, 则溶液中所有 A分子的荧光衰减途径相 同。有一束时间很短的脉 冲光 , 若其持续时间与 过程 中涉 及 的速率 常数 相 比可 忽略不 计 , 则可 认为 其 时间宽 度 为 0, 这种 理 想 的线 光 源被 称作
跃迁 的过程 , 如单线态 s 至三线态 的跃迁 , 其时间通常在 1 。 1 一s荧光猝 灭指 的是 0 ~0 ;
激 发分 子通 过分 子间 的相互 作 用和 能量 转换 , 而释放 能 量 的过程 , 从 也称 作外 转换 。这 些无 辐
射去活过程在决定体系的荧光寿命时起非常重要的作用。 此外 , 电子跃 迁至 态后 , 也有 一 定几 率 以放 出光子 的形 式跃 迁 至 s 态 , 作磷 光 发 射 ; 。 称
基于时间相关单光子计数的荧光寿命成像技术

第2 2卷第 8期
21 0 0年 8月
强 激 光 与 粒 子 束
H I H PO W ER LA S G ER A N D PA RT I CLE BEA M S
Vo. 2,NO 8 12 .
A ug ., 2 1 00
文章 编 号 : 1 0 — 3 2 2 1 ) 8 1 3 — 4 0 14 2 ( 0 0 0 —7 10
同时 记 录 荧 光 光 子 数 , 以 提 高计 数效 率 和信 息 量 , 可 以在 稳 态 图像 中 分 离 不 同荧 光 团 , 成 4维 图像 。并 可 还 形
采 用 多 光 子 激 发技 术 , 用 长 波 长 光源 发 出 的两 个 或 多 个 光 子 可 以 激 发 出一 个 短 波 长 的光 子 。多 个 光 子 必 须 利 几 乎 同 时 到 达激 发 点 ,才能 提供 被 激 发 分 子 足 够 的 能 量 以产 生 荧 光 。多 光 子 激 发 波 长 较 长 , 物 组 织 对 其 散 生 射 减 小 , 而 可 以 穿 透 到更 深 层 的组 织 , 而提 高荧 光 成 像 深 度 和 空 间 分 辨 力 , 减 少 对 活 体 样 品 的损 伤 。 因 从 并 关键 词 : 荧 光 寿命 ; 时 间 相 关 单光 子 计 数 ; 多 光子 激 发 ; 多 波 长 成像
发光 强 度 衰减 过 程 时 间 的不 同 , 获得 荧 光 团分 子 内 部 的 能级 结 构 , 来 同时 可 用来 区分 样 品 中的 不 同分 发光强 度衰减 函数定 量 图能对荧 光分 子 团及 其周 围 的环 境产 生很高 的 区分 度 , 故荧 光 成 像技术 在生 物组织 的功能性 成像 中特别 有效 。x射线 是现 在最 常 用 的分析 检 测癌 症 和其 它 疾病 的工具 , 是 但 x射 线 的危 险性 和局 限性是众 所周知 的 , 现在还 没有一 种 安全 技术 能 够代 替 它进 行 软组 织成 像 。荧 光 寿命成 像 由于其 完全 非侵人 性 、 无损 性 、 电离化辐射 , 非 以及 能够 显示组 织 中各 种化 学组 分 , 因而能提供 有用 的功能 信 息 ] 。荧光 寿命成 像技术 是通 过样 品微环境 内荧 光寿命 的测 量 以反映微 结构 与微环 境 的不 同,因此 需将 荧光 寿命测量 和显微 测量 结合起 来 , 具有 高 的时空 分辨力 , 进行 生 物活 体测 量 。因此 该技 术在 生 物 物理 、 能 4 ] 生物 化 学及 临床 医学 诊断 等领域 具有较好 的应 用前 景 。国际上从 2 O世纪 8 0年代 末才 开始荧 光寿命 成像显 微技术 方 面 的研 究工作 , 但发 展较快 , 已取得一 些研 究成果 。最早 从 事荧光 寿命成 像显微 技术 方面研究 的是 日本 的 并
荧光共振能量转移-荧光寿命显微成像(FRET-FLIM)技术在生命科学研究中的应用进展

Vol 41, No. 4, pp 1023-1031April !2021第41卷,第4期2021 年 4 月光谱学与光谱分析SpectroscopyandSpectralAnalysis荧光共振能量转移■荧光寿命显微成像(FRET-FLIM )技术在生命科学研究中的应用进展罗淋淋123!牛敬敬3!莫蓓莘林丹樱3!刘琳1 ' 2*1深圳大学生命与海洋科学学院,广东省植物表观遗传学重点实验室,广东深圳5180602.深圳大学龙华生物产业创新研究院,广东深圳5180603 深圳大学物理与光电工程学院!广东 深圳 518060摘 要 细胞是动植物结构和生命活动的基本单位$细胞过程的一个重要特点就是其生化组分在时空调控上的相互作用关系$然而,利用传统的生化方法(如酵母双杂交系统、pull-down 系统等)很难在空间上评估活细胞内分子间的相互作用$光学技术的快速发展,为研究活细胞中生物分子的时空动态提供了新的遗传 研究工具,其中荧光共振能量转移-荧光寿命显微成像(FRET-FLIM )技术在实时探测分析活细胞中生物大分子构象变化和分子间动态相互作用过程具有独特的优势,如:实现对活细胞的实时“可视化”研究,同时具有高时空分辨率&检测更加灵敏、结果可信度高&且基于简易的数学运算完成简单快捷的分析程序$介绍 FRET-FLIM 技术的理论背景知识,对比了该技术与传统蛋白相互作用技术研究的利弊,同时归纳了其在蛋白相互作用、细胞生物学和疾病诊断等方面的最新应用研究进展,最后总结和讨论了 FRET-FLIM 技术的未来发展趋势,以期能够为揭示活细胞的结构和细胞过程相关研究提供新的见解$关键词 荧光共振能量转移&荧光寿命显微成像&蛋白相互作用&疾病诊断中图分类号:O433.4文献标识码:RDOI : 10. 3964/j. issn. 1000-0593(2021)04-1023-09引言随着人类对生命现象本质的探究,科学家对生命科学问题的研究日益深入,这推动了非生物学科(如数学、化学、物理学、信息科学等)与生命科学相互交叉和相互融合的热潮$20世纪90年代,商用共聚焦显微镜的问世为研究活细胞中不同蛋白的共表达提供了便利的工具(1)$与传统宽场成像方法相比,共聚焦显微镜的光学分辨率和视觉对比度都大幅提高,能够呈现高质量的彩色图像,但是其空间分辨率仍无法 突破衍射极限(大约200 nm ),因而无法用于研究生物分子 间的相互作用$ 2006年以后,许多超分辨率成像技术应运而生,如受激发射损耗显微术(stimulated emission depletion,STED )、 结 构 光 照 明 显 微 术 (structure i l uminationmicroscopy , SIM )、光激活定位显微术(photoactivatable localization microscopy , PALM )和随机光学重构显微术(stochasticopticalreconstruction microscopy !STORM ) 等!收稿日期:2020-03-30,修订日期:2020-07-12基金项目:国家重点研发计划项目(2016YFD0101803),广东省创新创业团队项目(2014ZT05S078),广东省基础与应用研究基金项目(2019A1515011222),深圳市基础研究面上项目(JCYJ20190808112207542)资助作者简介:罗淋淋,1988年生,深圳大学生命与海洋科学学院光生物学博士研究生e-mail : 1in S luo@163. com通讯作者e-mail %linliu @它们的分辨率都能突破衍射极限,最高空间分辨率可达到10nm ,使光学显微镜步入纳米时代[24) $超分辨成像技术由于其高成像分辨率的优势对科学家在活细胞分子水平上的研究 起到了显著的促进作用,如活细胞内生物大分子结构的观察,遗传信息的编码及表达的研究,都对生命过程和疾病发 生机理的理解具有重要的意义(5-7] $然而,这些成像技术仅能较好地获取其结构特征,对体内蛋白质-蛋白质的相互作用所体现的生物功能信息分析特异性不强$荧光寿命显微成像(fluorescence lifetime imaging micros copy , FLIM )技术是研究细胞内生命活动状态的一种非常可靠的方法$荧光寿命是荧光团在返回基态之前处于激发态的 平均时间,是荧光团的固有性质,与样品浓度、样品吸收、 光漂白和激光激发强度等因素无关(切,相反地,荧光寿命对荧光团所处的微环境非常敏感,如细胞中温度、pH 值分 布、离子浓度、氧浓度、分子结合或溶液疏水性等,因而它能十分灵敏地反映激发态分子与周围微环境的相互作用及能量转移(10)$ FLIM 技术就是对荧光探针分子的荧光寿命进行1024光谱学与光谱分析第41卷成像,能实现对细胞内诸多生化参数的定量测量,尤其是结合了荧光共振能量转移(forster resonance energy transfer, FRET)的FRET-FLIM技术$FRET本身不是一种成像技术,而是一个物理过程,指两个携带不同荧光基团的大分子之间或同一分子的不同荧光团之间通过电偶极相互作用所发生的非辐射能量转移(1「12)。
荧光发射和荧光寿命 [lifetime] 的工作原理
![荧光发射和荧光寿命 [lifetime] 的工作原理](https://img.taocdn.com/s3/m/dc72b890b04e852458fb770bf78a6529647d35b5.png)
荧光发射和荧光寿命[lifetime] 的工作原理
荧光发射和荧光寿命是荧光分析技术中的重要概念,其工作原理如下:
1. 荧光发射:荧光是分子在吸收能量后,从基态跃迁到激发态,然后从激发态回到基态时所产生的光辐射。
在这个过程中,分子吸收光子能量,从基态(S0)跃迁到激发态(S1)。
根据Frank-Condon规则,分子在吸收特定波长的光子后,被激发到单线态的激发态电子能级
S1中的某一个振动能级上。
这个过程的时间约为10-15秒。
2. 荧光寿命:荧光寿命是指分子在激发态停留的平均时间,它表示粒子在激发态存在的平均时间。
荧光寿命与荧光物质的自身结构和所处的微环境(如极性、粘度等)有关,而与激发光强度、荧光团浓度等因素无关。
当激发停止后,分子激发出的荧光强度降到激发最大强度时的1/e所需的时间被称为荧光寿命。
3. 荧光寿命成像技术:通过时间分辨荧光寿命成像显微镜(Fluorescence lifetime imaging microscopy, FLIM)对样品进行荧光寿命成像,可以对样品所在的微环境中的许多物理参数(如氧压、溶液疏水性等)及生物化学参数(如pH值、离子浓度等)进行定量测量。
此外,荧光寿命成像技术还可以同时获得分子状态和空间分布的信息。
4. 测量荧光寿命的主要技术:时间相关单光子计数法(Time-Correlated Single-Photon Counting, TCSPC)是目前测量荧光寿命的主要技术。
其工作原理是使用窄脉冲激光激发样品,然后检测样品发出的第一个荧光光子到达光信号接收器的时间。
通过将该时间成比例地转化为对应的电压脉冲,并进一步分析电压脉冲,可以获得荧光寿命的信息。
几种激光及同步辐射相关的时间分辨方法发展

镕口章*^寿☆Ⅻ*
第四章荧光寿命测试
41引言
荧光发射r能级图如图4-l所示)发生在吸光之后约IO8s,在此时间内会发生许多时间差异的分子过程,而这些过程会影响荧光化合物的光谱特征【lI。据此建立的时间分辨荧光光谱技术,对于复杂多组分荧光体混合物的分析和许多生物化学现象的研究大有帮助,是研究原子、分子和凝聚态物质檄发动力学,特别是发光动力学的有力工具124]。
利用TCSPC测试荧光寿命需要脉冲光源,具有皮秒/飞秒脉冲宽度的高重频锁模激光器在出现之初就被用干荧光寿命测试10“,但激发光源限定于几个特定的激光波长。同步辐射也是一种具有时间结构的快脉冲光源,而且波长连续可调,在上世纪70年代,人们已经开始利用同步辐射开展荧光寿命测试方面的工作肛”o 类似于荧光寿命测试等同步辐射时间分辨实验的开展往往需要各种具有特定时间结构的束团注入模式。图4-2是欧洲同步辐射光源(EsRF)为r开展pump.probe 实验而设计的几种束团注入模式㈦。北京同步辐射装置(BSRF)是依托于北京正负电子对撞机II(BEPCII)的第一代兼用光源。脉冲宽度~150ps,单柬团脉冲间隔
荧光寿命动 态范围

荧光寿命动态范围全文共四篇示例,供读者参考第一篇示例:荧光是一种具有很多应用领域的光学现象,它可以在暗光环境下发出明亮的光线。
荧光的特性之一就是其寿命动态范围,即从荧光开始发射到其完全消退的时间范围。
荧光寿命动态范围是荧光体的一个重要特性,可以提供关于荧光体性能和化学环境的信息。
荧光寿命是一个描述荧光体衰减速度的参数,通常以纳秒(ns)为单位。
荧光寿命动态范围指的是荧光体从开始发射光线到光线完全消失的时间间隔范围。
荧光寿命动态范围的大小取决于荧光体的结构和环境条件。
荧光体的化学环境、光谱性质和物理状态都可以对其寿命动态范围产生影响。
荧光寿命动态范围的大小对于许多领域都是至关重要的。
在生物医学领域,荧光探针的寿命动态范围可以提供关于生物样本中分子运动、相互作用和环境的信息。
荧光寿命动态范围还可以用于研究生物体内的分子动力学过程,如蛋白质折叠和解离过程等。
在材料科学领域,荧光寿命动态范围可以用于表征具有不同结构和组成的材料的光学性质。
荧光体的寿命动态范围的变化可以提供关于材料的组织和结构的重要信息。
在化学分析领域,荧光寿命动态范围可以用于检测和鉴定物质的化学特性,如分子浓度和结构等。
荧光寿命动态范围的测量通常通过荧光寿命成像技术来进行。
这种技术能够在空间上分辨荧光体的寿命动态范围,并提供关于物质的微观结构和环境的信息。
荧光寿命成像技术通常结合其他光学技术,如荧光共振能量转移(FRET)和激光诱导荧光(LIF)等,以提供更加全面的信息。
除了生物医学、材料科学和化学分析领域外,荧光寿命动态范围还在环境监测、食品安全和光学通信等领域得到广泛应用。
荧光寿命动态范围的测量具有高灵敏度和高分辨率,可以提供关于物质的细微变化的信息。
荧光寿命动态范围是荧光体的重要特性,对于理解荧光体的性能和应用具有重要意义。
随着技术的不断发展和应用领域的不断拓展,荧光寿命动态范围将在各个领域发挥越来越重要的作用,为人类社会的发展带来更多的益处。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Which Fluorescence Lifetime System is Best for You?Why Measure Lifetimes?The information from a steady-state scan (a plot of fluorescence intensity versus wavelength) represents the averaged behavior of what occurs during the entire scan. Fluorescence itself, how-ever, occurs on the nanosecond timescale. There-fore, if you could take snapshots at that speed, you would learn much more about the mecha-nisms that lead to chemical or biochemical proc-esses—hence the appeal of lifetime spectro-fluorometers.For example, among the experiments possi-ble with lifetime instruments include: •Determination of the environment that the sample molecules inhabit, e.g., viscosity, pH, temperature, polarity, salvation, etc. •Uncovering the size and shape of the sample molecules, and the distances between differ-ent parts of the molecules.•Learning about the contributions of each component in a mixture of sample mole-cules, through time-resolved spectra of over-lapping emissions.How to Measure Fluorescence LifetimesThere are two complementary techniques of lifetime measurement: the time domain and the frequency domain.In the time domain (Fig.1), a short pulse of light excites the sample, and the subsequent fluo-rescence emission is recorded as a function of time. This usually occurs on the nanosecond timescale.In the frequency domain (Fig. 2), the sample is excited by a modulated source of light. The fluorescence emitted by the sample has a similar waveform, but is modulated and phase-shifted from the excitation curve. Both modulation (M) and phase-shift (φ) are determined by the life-time of the sample emission; that lifetime can be calculated from the observed modulation and phase-shift.Both of these domains yield equivalent data. But, as we shall see, each method has advantages for measurement under certain conditions. This Application Note examines the time and fre-quency domains in more detail, in order to help you decide more easily which technique suits your sample conditions.Fig. 1. Actual pulsed light-source (gray) and sample response (black), showing the grad-ual decay of fluorescence intensity with time.A single-exponential fit (dotted) gives a life-time of 1.309 ± 0.003 ns.Fig. 2. Excitation (black) and sample re-sponse (gray), illustrating the phase-angle shift (φ) and demodulation ratio (M).SPEX® Fluorescence GroupF-10Fluorescence Decay LawBoth the time- and frequency-domain meth-ods take advantage of the fluorescence decay law , which is based on first-order kinetics. The decay law postulates that if a population of mole-cules is instantaneously excited when photons are absorbed, then the excited population—and hence the fluorescence intensity as a function of time, I (t )—gradually decays to the ground state. Decay kinetics can be described byταte t I −=)(where α is the intensity at time t = 0, t is the time after the absorption, and τ is the lifetime, that is, when the fraction of the population of molecules in the excited state (and the fluorescence inten-sity) has decreased by a factor of 1/e, or ~37%. Note that before absorption, I (t ) = 0.This fluorescence decay law implies that all excited molecules exist in a homogenous envi-ronment, as is true for many single-exponential fluorescence lifetime standards in solution 1,2. Apart from such standards, however, single-ex-ponential decays are usually a real-life exception, because most populations of excited molecules do not exist in homogeneous environments, and can be influenced by various factors, including the presence of quenchers , energy-transfer proc-esses among members of the population, and dif-ferent rates of molecular rotation. Hence, in most instances, multi-exponential or non-exponential forms of the decay-law equation must be applied.Time DomainTime-domain measurements are based on the assumption that, when photons are absorbed, the molecules can be excited in an infinitely brief moment. This idea is commonly known as the delta or δ-pulse . The δ-pulse idea is used to in-terpret data obtained with real pulsed light-sources with measurable pulse-widths. In prac-tice, the time-dependent profile of the light-pulse is reconvolved with the decay-law function. Re-convolution assumes that the δ-pulses are con-tinuous functions, so that the observed decay is the convolution integral of the decays from all δ-pulses initiated during the finite pulse-width 3.Fig. 3. Time-Correlated Single-Photon-Counting fluorometer. A pulsed light Source excites the Sample repetitively. The sample emission is observed by a Detector, while the excitation flashes are detected by a syn-chronization module (SYNC). A constant-fraction discriminator (CFD) responds to only the first photon detected (small ar-rows)—independent of its amplitude—from the detector. This first photon from sample emission is the stop signal for the Time-to-Amplitude Converter (TAC). The excitation pulses trigger the start signals. The Multi-Channel Analyzer (MCA) records repetitive start-stop signals of the single-photon events from the TAC, to generate a histo-gram of photon counts as a function of time-channel units. The lifetime is calculated from this histogram.There are many ways to record time-domain data, such as streak cameras, boxcar integrators,19202122232425262728TIME, CHANNELSCumulative histogramMonochroma-Sample chamberand so forth. Most agree, however, that the method of single-photon counting is, by far, su-perior.T ime-C orrelated S ingle-P hoton C ounting (TCSPC) measurements are shown in Fig. 3. TCSPC uses a pulsed light-source and a circuit to detect single-photon events at a detector. In a repetitive series of many start-stop signals from the circuitry, a binned histogram in time chan-nels of single-photon counts is gradually gener-ated.TCSPC relies on a principle of Poissonian statistics, that only one photon can be counted at a time and in any one channel, to avoid skewing the time-dependent statistics in photon-pile-up. Pile-up thus limits the data-acquisition rate of TCSPC to a few (typically 1–2) percent of the repetition rate. In practice, the single-photon limit is not a major hindrance because the pile-up limit can be monitored during the experiment, and decay times with sufficient photon counts in can be obtained in seconds to minutes with repe-tition rates in the MHz range. In addition, the Poissonian nature of the statistics allows the data to be rigorously analyzed.Frequency DomainThe fluorescence decay parameters in the de-cay law’s impulse function may be obtained based on the relation of a sinusoidally modulated excitation beam to the fluorescence emission re-sponse (Fig. 2). The emission occurs at the same frequency as the excitation. Because of the loss of electron energy (Stokes’ shift) between exci-tation and emission, the emission waveform is demodulated and phase-shifted in comparison to the excitation. Thus the demodulation ratio (M) and phase-angle shift (φ) constitute two separate observable parameters that are both directly re-lated, via a Fourier transformation4, to the initial fluorescence intensity, α, and lifetime, τ, for a population of fluorophores.Frequency-domain measurements are best performed using M ulti-F requency C ross-C orre-lation phase-and-modulation (MFCC), shown in Fig. 4. A modulated beam excites the sample. The fluorescence emission is detected by a P ho-to M ultiplier T ube (PMT) modulated at the same base radio-frequency as the master plus a low cross-correlation frequency (a few Hz). The base-frequency signals are filtered to reveal the cross-correlation frequency signal, which con-tains all the same demodulation (M) and phase-angle shift (φ) information as the fluorescence emission.Fig. 4. Multi-Frequency Cross-Correlation fluorometer. An unmodulated light Source emits a spectrum of continuous-wave light. The excitation monochromator (Excit. Mono.) selects an excitation wavelength. An amplified (Amp 1) master synthesizer (Mas-ter) drives the Pockels cell (Pockels) at a base frequency, Rf, which modulates the excitation beam. The modulated beam ex-cites the Sample, causing the sample to emit modulated fluorescence also at the base Rf. An emission monochromator (Emis. Mono.) selects one wavelength of modulated fluorescence. The photomultiplier tube (PMT) is modulated by an amplified (Amp 2) slave synthesizer (Slave) at the base Rf plus a low-frequency cross-correla-tion note (∆f). The sample emission at Rf cancels the slave Rf+∆f frequencies to yield the ∆f signal containing the same phase-an-gle shift (φ) and demodulation ratio (M) as the Rf fluorescence.SampleExcit.AMPLITUDE∆fUsually the sample is scanned over a range (10–16) of frequencies because of the intrinsic limitations of resolving mixtures using only one frequency. In theory, for a single-exponential emitter, one should observe the same lifetime using the observed φ and M at any given fre-quency4,5. However, for mixtures of components, φ is biased towards the faster decay components and M is weighted toward the slower compo-nents. Hence, resolving separate fluorescence lifetime parameters for mixtures requires a range of frequencies to be statistically valid. On the other hand, the MFCC technique is not con-strained by the Poissonian single-photon detec-tion limits of TCSPC. Therefore, rapid acquisi-tion at a high signal-to-noise ratio to resolve complex mixtures is possible.Which Method is Best for Your Sample?In principle, both methods can yield identical results for a wide variety of experimental sam-ples and conditions. A user may choose one Spex®-IBH fluorescence lifetime instrument method over the other for a variety of reasons: The frequency domain, for example, is compatible with a strong, tunable continuous-wave xenon excitation source that seamlessly covers a wide spectral range. With the frequency domain, lifetimes as short as 10 picoseconds can be measured with a continuous source, tunable from the UV to the near-IR. All other conditions being equal, frequency domain is usually faster than time domain.Time-domain instruments have no conti-nuously tunable, pulsed source from the UV to IR, so the choice of excitation wavelength is more limited. Because of pulse-width, lifetimes are usually limited to no shorter than just under a nanosecond with a flash lamp, though they can operate at picosecond timeframes with inexpen-sive diode sources. On the other hand, TCSPC is compatible with precise and inexpensive pulsed light-emitting diodes and diode-laser sources. The single-photon detection method is preferred when photon emission is too weak for fre-quency-domain detection. There is a sacrifice in available wavelengths for UV excitation, impor-tant for some biological samples, when the flash lamp is used, and may be inconvenient and slow.Most important for you, Jobin Yvon, uniting Spex® and IBH, now offers both time- and fre-quency-domain instruments to optimize your re-search time and effort. The choice is yours. Copyright © 2004 Jobin Yvon, Inc.1 R.A. Lampert, et al., Anal. Chem.,55:68–73, 1983.2 J.R. Lakowicz, et al., J. Fluor., 1(2):87–93, 1991.3 G. Hungerford and D.J.S. Birch, Meas. Sci. Tech., 7:121–135, 1996.4 D.M. Jameson and T.L. Hazlett, Biophysical and Bio-chemical Aspects of Fluorescence Spectroscopy, Plenum Press, New York, pp. 105–133, 1991.5 E. Gratton, et al., Ann. Rev. Biophys. Bioeng., 13:105–124, 1984.In the USA:Jobin Yvon Inc.3880 Park Avenue, Edison, NJ 08820 In France: Japan: +81 (0) 3 58230140 Tel:+1-732-494-8660 16-18, rue du Canal China: +86 (0) 10 6849 2216 Fax: +1-732-549-5157 91165 Longjumeau cedex Germany: +49 (0) 89 462317-0 E-Mail: info@ Tel: +33 (0) 1 64 54 13 00 Italy: +39 0 2 576047621-800-533-5946Fax: +33 (0) 1 69 09 93 19 U.K.: +44 (0) 8204 8142。
