专题01强碱滴定二元弱酸曲线 2019高考复习专题——酸碱中和滴定曲线大全Word版含解析
《酸碱中和滴定曲线
弱酸滴定强碱及强酸滴定弱碱 滴定曲线

弱酸滴定强碱及强酸滴定弱碱滴定曲线滴定是一种常见的化学分析方法,广泛应用于化学实验室和工业生产中。
在滴定过程中,通过反应物溶液滴加到待测物溶液中,以确定待测物质的浓度。
其中包括弱酸滴定强碱和强酸滴定弱碱两种常见的滴定方法。
弱酸滴定强碱是指在滴定过程中,将一种弱酸溶液滴加至待测的强碱溶液中,以确定强碱溶液的浓度。
这种滴定方法的滴定曲线可以分为四个阶段:起始阶段、中间阶段、转折点和终点。
起始阶段:在起始阶段,弱酸溶液被快速加入强碱溶液中,反应迅速进行。
在此过程中,强碱快速与弱酸反应生成水和盐。
由于酸性物质的存在,溶液呈酸性pH值,通常在2-4之间。
中间阶段:当酸性物质被完全中和时,溶液的pH值开始增加。
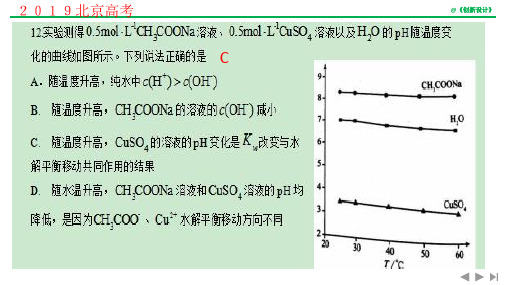
这是因为在此阶段,盐已经完全溶解,并且水分子中的H+离子逐渐减少,从而导致溶液的酸性减弱。
此时,滴定曲线的斜率较缓,pH值从4逐渐增加到7左右。
转折点:转折点是指滴定曲线上的一个重要特征点,也是弱酸滴定强碱的指示剂的变色点。
在转折点之前,溶液呈酸性,且pH值低于7;而在转折点之后,溶液呈弱碱性,pH值高于7。
在转折点附近,溶液的酸碱性质发生突变,指示剂也会发生颜色变化。
终点:终点是滴定曲线的最后一个特征点,也是滴定过程中的目标点。
在终点,弱酸与强碱的摩尔比例为1:1,也就是说,弱酸溶液完全中和了强碱溶液。
此时,滴定曲线的斜率变为水平状态,pH值达到7,溶液呈中性。
强酸滴定弱碱是指将一种强酸溶液滴加至待测的弱碱溶液中,以确定弱碱溶液的浓度。
与弱酸滴定强碱相比,强酸滴定弱碱的滴定曲线略有不同。
滴定曲线可以分为三个阶段:起始阶段、中间阶段和终点。
起始阶段:在起始阶段,强酸溶液被滴加到弱碱溶液中,快速发生中和反应。
在此过程中,强酸与弱碱反应生成水和盐。
由于酸性物质的存在,溶液呈酸性pH值,通常在2-4之间。
中间阶段:当强酸与弱碱反应完全中和时,溶液的pH值开始增加。
这是因为在此阶段,盐已经完全溶解,并且水分子中的H+离子逐渐减少,从而导致溶液的酸性减弱。
酸碱滴定法酸碱滴定曲线全

3)化学计量点
NaOH和HAc定量完全反应,滴定产物为NaAc,Ac1碱性不太弱,则
用最简式计算(P155)
c(OH )/c
K
b
c0
/
c
K
w
c0
/
c
K a
1.001014 0.05 1.8 105
5.3106
pOH 5.27
pH 4.30
3.化学计量点
加入NaOH溶液20.00mL时
c(H )/c c(OH )/c KW 107.00 pH 7.00
4.化学计量点后
加入NaOH溶液20.02mL时
c(OH ) 0.1000mol L-1 20.02mL 20.00mL 5.00105 mol L-1 20.00mL 20.02mL
pH 14.00 5.27 8.73
4)化学计量点后
加入NaOH过量后,溶液的pH由过量的NaOH决定。 加入20.02mL的NaOH后
c(OH 1) (20.02mL 20.00mL) 0.1000mol L1 5.0105 molL1 20.00mL 20.02mL
pOH 4.30 pH 14.00 4.30 9.70
c(H ) 2.001010 mol L-1 pH 9.70
氢氧化钠溶液滴定盐酸溶液时,体系的pH变化
V(NaOH)/mL HCl被滴定% c(H+)
pH 0.00
0.00
0.00
1.00×10-1 1.00
18.00 19.80
90.00 99.00
5.26×10-3 2.28 5.02×10-4 3.30
2)滴定开始至化学计量点
高二化学知识点酸碱中和反应的滴定曲线解析

高二化学知识点酸碱中和反应的滴定曲线解析酸碱中和反应是化学中常见的反应类型之一,它涉及到酸和碱之间的中和反应,而滴定曲线则是研究这类反应的重要工具。
本文将对高二化学中酸碱中和反应的滴定曲线进行详细解析,以帮助读者更好地理解和掌握这一知识点。
一、滴定曲线的基本概念滴定曲线是指在滴定过程中,酸碱溶液体积的变化与酸碱反应进程的关系所绘制出的曲线。
它通常是通过将一种已知浓度的溶液(称为滴定液)滴加到待测溶液中,使两者发生中和反应,观察并记录酸碱溶液体积变化的过程。
根据反应的性质不同,滴定曲线可以分为强酸与强碱的滴定曲线、弱酸与强碱的滴定曲线以及弱酸与弱碱的滴定曲线。
在本文中,我们将主要讨论强酸与强碱的滴定曲线。
二、滴定曲线的特点及解析1. 初始阶段滴定反应开始时,滴定液以小滴加入待测溶液中,此时待测溶液的pH值较低。
滴定曲线的第一段通常表现为水平直线或轻微的上升趋势,并在该段上方有一个较大的峰值,这是由于待测溶液的酸性较强,滴定液与其反应后,pH值上升较慢。
2. 中间阶段当滴定液继续滴加进入待测溶液时,酸和碱的等浓度点逐渐接近,滴定曲线会出现一个非常陡峭的区域,称为“垂直区”。
在这个区域内,pH值变化很快,对应的体积变化也非常明显。
这是由于滴定液与待测溶液中酸碱反应达到接近等当点(酸碱滴度相等)。
3. 终点阶段滴定曲线的终点处于“垂直区”的最后部分,即pH值随着滴定液的加入呈现急剧上升趋势。
此时,滴定液与待测溶液中的酸性物质完全中和,达到了反应的终点。
可以通过加入指示剂来辅助判断滴定曲线的终点位置,常用的指示剂有酚酞、溴酸亚铁等。
三、滴定曲线中的重要参数1. 滴定终点滴定终点是指滴定反应达到完成的时刻,通常是指观察到滴定溶液的颜色突变或者指示剂的溶色变化。
在滴定曲线中,滴定终点对应于曲线的最陡峭点,也就是pH值变化最为显著的位置。
2. 等当点等当点是指当酸和碱摩尔数相等时,滴定反应的中和点。
对于强酸与强碱的滴定曲线而言,等当点的pH值为7。
专题10 酸滴定碱的曲线-2019高考复习专题——酸碱中和滴定曲线大全(原卷版)

1.常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数δ(X)随-1g(OH-)变化的关系如图所示。
下列叙述错误的是A. 反应N2H62++N2H4=2N2H5+的pK=90(已知pK=lgK)B. N2H5Cl溶液中存在:c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+)C. N2H5Cl溶液中c(H+)>c(OH-)D. K b1(N2H4)=10-62.某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。
向10mL稀B(OH)2溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液POH[POH=-lgc(OH)-]变化的关系如图,以下说法正确的是A. 交点a处对应加入的盐酸溶液的体积为5mLB. 当加入的盐酸溶液的体积为10mL时存在c(Cl-)>c(B(OH)+)>c(H+)>c(OH-)>c(B2+)C. 交点b处c(OH)=6.4×10-5D. 当加入的盐酸溶液的体积为15mL时存在:c(Cl-)+c(OH-)= c(B2+)+c(B(OH)+)+ c(H+),3.已知常温下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.01mol/L的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示。
下列说法错误的是A. n=7B. 水的电离程度先增大再减小C. 常温下,0.01mol/L的氨水溶液中NH3·H2O的电离度为3.98%D. Y点溶液中c(NH3·H2O)+(OH-)=c(CH3COO-)+c(H+)4.常温下用0. 1000 mol/L的盐酸分别逐滴加入到20.00 mL 0.1000 mol/L的三种一元碱XOH、MOH、YOH 溶液中,溶液的pH随加入盐酸体积的变化如图所示。
2020高考化学一轮复习酸碱中和滴定曲线大全专题01强碱滴定二元弱酸曲线练习

【2019最新】精选高考化学一轮复习酸碱中和滴定曲线大全专题01强碱滴定二元弱酸曲线练习1.常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1NaOH溶液。
有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。
根据图示判断,下列说法正确的是( )A. H2A在水中的电离方程式是:H2A===H++HA-、HA-H++A2-B. 等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性C. 当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH -)D. 当V(NaOH)=30 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)【答案】C2.已知:pKa= -lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。
常温下,用0.1mol/LNaOH溶液滴定20mL 0.1mol/L H2SO3溶液的滴定曲线如图所示。
下列说法不正确的是A. A点所得溶液中:Vo等于lOmLB. B点所得溶液中:C. C点所得溶液中:D. D点所得溶液中水解平衡常数【答案】A【解析】分析:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,结合亚硫酸的电离平衡常数分析;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,根据溶液中电荷守恒分析;C.根据亚硫酸的电离平衡常数结合电荷守恒分析;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,根据水解常数与电离常数的关系计算。
详解:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,H2SO3的一级电离平衡常数为Ka1=c(H+)c(HSO3−)/c(H2SO3)=10-1.85mol/L,所以c(H+)=Ka1,表明溶液中c(NaHSO3)=c(H2SO3),若恰好是10mLNaOH,由于此时溶液显酸性,则所得溶液中c(H2SO3)<c(NaHSO3),因此所加NaOH体积需<10mL,才能使溶液中c(NaHSO3)=c(H2SO3),即V0<10mL,A错误;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,为第一个滴定终点,溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3−)+2c(SO32-)+c(OH-),B 正确;C.H2SO3的二级电离平衡常数为Ka2=c(H+)c(SO32-)/c(HSO3−)=10-7.19mol/L,C 点溶液的pH=7.19,即溶液中c(H+)=10-7.19mol/L,则c(H+)=Ka2,表明溶液中c(SO32-)=c(HSO3−),溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3−)+2c(SO32-)+c(OH-),溶液显碱性,则溶液中c(Na+)>3c(HSO3−),C正确;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,为第二个滴定终点,此时亚硫酸钠水解使溶液显碱性,则Kh1=Kw/Ka2=10−14/10−7.19=10-6.81,D正确。
专题01 强碱滴定二元弱酸曲线-2019高考复习专题——酸碱中和滴定曲线大全(解析版)

1.常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1NaOH溶液。
有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。
根据图示判断,下列说法正确的是()A. H2A在水中的电离方程式是:H2A===H++HA-、HA-H++A2-B. 等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性C. 当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH-)D. 当V(NaOH)=30 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)【答案】C2.已知:pK a= -lgK a,25℃时,H2SO3的pK a1=1.85,pK a2=7.19。
常温下,用0.1mol/LNaOH溶液滴定20mL0.1mol/L H2SO3溶液的滴定曲线如图所示。
下列说法不正确的是A. A点所得溶液中:V o等于lOmLB. B点所得溶液中:C. C点所得溶液中:D. D点所得溶液中水解平衡常数【答案】A【解析】分析:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,结合亚硫酸的电离平衡常数分析;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,根据溶液中电荷守恒分析;C.根据亚硫酸的电离平衡常数结合电荷守恒分析;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,根据水解常数与电离常数的关系计算。
详解:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,H2SO3的一级电离平衡常数为K a1=c(H+)c(HSO3−)/c(H2SO3)=10-1.85mol/L,所以c(H+)=K a1,表明溶液中c(NaHSO3)=c(H2SO3),若恰好是10mLNaOH,由于此时溶液显酸性,则所得溶液中c(H2SO3)<c(NaHSO3),因此所加NaOH体积需<10mL,才能使溶液中c(NaHSO3)=c(H2SO3),即V0<10mL,A错误;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,为第一个滴定终点,溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3−)+2c(SO32-)+c(OH-),B正确;C.H2SO3的二级电离平衡常数为K a2=c(H+)c(SO32-)/c(HSO3−)=10-7.19mol/L,C点溶液的pH=7.19,即溶液中c(H+)=10-7.19mol/L,则c(H+)=K a2,表明溶液中c(SO32-)=c(HSO3−),溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3−)+2c(SO32-)+c(OH-),溶液显碱性,则溶液中c(Na+)>3c(HSO3−),C正确;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,为第二个滴定终点,此时亚硫酸钠水解使溶液显碱性,则K h1=K w/K a2=10−14/10−7.19=10-6.81,D正确。
专题09 强碱滴定三元酸曲线-2019高考复习专题——酸碱中和滴定曲线大全(原卷版)

1.砷(As)是一些工厂和矿山废水中的污染元素。
常温下,H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与加NaOH溶液调节pH的关系如图所示(已知:p K a=-lg K a),下列说法错误的是A. Na2HAsO4溶液显碱性B. H3AsO4溶液p K a2为2.2C. m点对应溶液中由水电离出的c(OH-)为10-2.5mol·L-1D. n点对应溶液中离子浓度关系为:c(Na+)>c(HAsO42-)=c(H2AsO4-)>c(H+)=c(OH-)2.25℃时,向10mL0.1mol·L-1H3AsO4水溶液滴加0.1 mol·L-1NaOH溶液,含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如下图,下列说法错误的是A. H3AsO4H2AsO4-+H+的电离常数为10-2.2B. b点所处溶液中:c(Na+)=3c(H2AsO4-)+3c(AsO43-)C. 水的电离程度:a>b>cD. HAsO4-的水解程度大于电离程度3.亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。
向1L0.1mol·L-1 H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各种微粒物质的量分数与溶液的pH 关系如下图所示。
下列说法正确的是( )A. H3AsO3的电离常数K a1的数量级为10-9B. pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2OC. M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33- )+c(H3AsO3)= 0.1mol·L-1D. pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)4.常温下,某酸H3A水溶液中含A的各种粒子的分布分数(平衡时某种粒子的浓度占各粒子浓度之和的分数)与pH关系图如下所示,下列说法正确的是A. NaH2A水溶液呈碱性B. H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+c(HA2-)+c(A3-)C. 向H3A溶液中加入一定量的NaOH溶液至pH=5时,D. 向H3A溶液中加入氨水使PH从5→9发生的主要离子反应是:H2A-+OH-=HA2-+H2O5.亚砷酸(H3AsO3)可以用于治疗白血病,在溶液中存在多种微粒形态。
2019年秋高三化学复习强化练习题——酸碱中和滴定曲线分析(word版,解析)

2019年秋高三化学复习强化练习题——酸碱中和滴定曲线分析(word版,解析)2019年年年年年年年年年年年年——年年年年年年年年年年一、单选题(本大题共30小题,共30.0分)1.在常温下,向100mL0.01mol/LHA溶液中逐滴加入0.02mol/LMOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计)。
下列叙述正确的是()A. MA溶液的pH>7B. K点时加水稀释溶液,c(H+)减小C. 在N点,c(A−)=c(M+)+c(MOH)D. 在K点,c(M+)>c(A−)>c(OH−)>c(H+)2.298K时,在20.0mL0.10mol⋅L−1氨水中滴入0.10mol⋅L−1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。
已知0.10mol⋅L−1氨水的电离度为1.32%,下列有关叙述正确的是()A. 该滴定过程应该选择酚酞作为指示剂B. M点对应的盐酸体积为20.0mLC. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)D. N点处的溶液中pH<123.25℃时,用浓度为0.01mol·L−1的HA溶液滴定20mL浓度为0.01mol·L−1的NaOH溶液,滴定曲线如图所示。
下列说法错误的是()A.应选用酚酞作指示剂B. M点溶液中存在:c(Na+)>c(A−)C. Ka(HA)≈2×10−8D. N点溶液中存在:c(OH−)−c(H+)=c(HA)4.常温下,用0.1000mol⋅L−1的盐酸滴定20.00mL0.1000mol⋅L−1的Na2A溶液,溶液的pH与所加盐酸体积的变化关系如图所示。
下列叙述错误的是()A. 常温下,K a2(H2A)的数量级为10−11B. c点溶液中:c(Na+)=2c(A2−)+c (HA−)+c(Cl−)1/ 22C. 水的电离程度:a>b>d>cD. a点溶液中:c(Na+)>c(A2−)>c(OH−)>c(HA−)5.25℃时,向20.00mL的NaOH溶液中逐滴加入某浓度的CH3COOH溶液。
酸碱滴定法滴定曲线

+ 酚酞 甲基橙 + H+ 2H+ pH = 4.0
HCO3 需 1 H+ 结果偏低
H2CO3 需 2H+ 无影响
22
结论:终点时溶液的pH值越低,CO2影响越 小。pH 5时CO2影响可忽略。
• 对于强酸强碱的相互滴定,当浓度 > 0.1 mol / L时,宜采用甲基橙作指示剂,以减少CO2 的 影响;否则应煮沸溶液并配制不含CO2的碱溶 液。 • 对弱酸的滴定,化学计量点在碱性范围, CO2 的影响较大,宜采用同一指示剂在同一条件下 进行标定和测定。
pKa3(12.32)
HPO42pHsp2= 9.7
PO43-
pKb3(11.84)
pKb2(6.79)
pKb1(1.68)
pHsp1= 4.7 MR至橙(5.0)
(同浓度NaH2PO4参比)
百里酚酞至无色(9.4)
15
HCl 滴定0.10mol· L-1 Na2CO3
pH
甲酚红-百里酚蓝 粉8.2-8.4紫
[OH‒]=c过量(NaOH)
5
0.10mol· L-1 NaOH滴定0.10mol· L-1 HAc (20.00mL , Ka(HAc) = 10-4.76)
NaOH mL 0 10.00 18.00 19.80 19.96 19.98 20.00 20.02 20.04 20.20 22.00 T% 0 50.0 90.0 99.0 99.8 99.9 100.0 100.1 100.2 101.0 110.0 组成 HA HA+AHA+AHA+AHA+AHA+AAA-+OHA-+OHA-+OHA-+OHpH(HAc) 2.88 4.76 5.71 6.67 7.46 7.76 8.73 9.70 10.00 与滴定 10.70 强酸一 6 11.68 致
滴定曲线PPT课件

2
CHCl
2 V橙 m试
V酚 25.00 250.0
M Na2CO3 1000
100
1/ 2 0.2500 46.62 106.0
7.020 25.00 1000 100
250.0
87.99
答:样品中氢氧化钠的含量为4.00%,碳 酸钠钠的含量为87.99%。
第24页/共25页
感谢观看!
第10页/共25页
化学分析法计算的基本公式
•
mB
CAVA M B 1000 ab
mB
b a
CA VA M B
1000
a mB
CA
b
MB VA
1000
a mB
VA
b
MB CA
1000
公式中的符号意义如前所述。
第11页/共25页
化学分析法计算的基本公式
• 两种溶液间的关系:
CAVA CBVB
CNH4SCN为0.09350 mol/L。
第19页/共25页
例题2
• 称取混和碱7.020g,用容量瓶制成250mL 试液。用移液管移取2份各为25.00mL的试液, 第一份加酚酞指示剂,用0.2500mol/L HCl溶液 滴定至终点,耗用 26.12mL,第二份加甲基橙 指示剂,用同样盐酸溶液滴定,耗用49.43mL。 求混合碱组分物质的含量。
可得:
C AgNO 3
CV NaCl VAgNO3
• = 0.09350× 1/1.008 = 0.09276 mol/L
• •
同样的,也有:
C C VV NH4SCN
AgNO3
AgNO3 NH 4SCN
• = 0.09276 × 1.008/0.992 = 0.09358 mol/L
专题02 酸度曲线-2019高考复习专题——酸碱中和滴定曲线大全(原卷版)

1.化学上常用AG 表示溶液中的。
25℃时,用0.100 mol/L盐酸溶液滴定10mL0.1 mol/L MOH溶液,滴定曲线如下图所示。
下列说法正确的是A. 该流定过程可选择酚酞作为指示剂B. 溶液中由水电离的c(H+): C点>D点C. C点时加入盐酸溶液的体积等于10 mLD. 若B点加入的盐酸溶液体积为5 mL,所得榕液中: c(M+) +c(H+)= c(MOH)+ c(OH-)2.化学上常用AG 表示溶液中的。
25℃时,用0.100 mol/L 的NaOH溶液滴定20.00 mL 0.100mol/L 的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是A. 随着NaOH 溶液的加入,增大B. 25 ℃时,HNO2的电离常数Ka≈1.0×C. b 点溶液中存在D. a、b、c、d、e五点的溶液中,水的电离程度最大的点是d3.25℃时,NH4+的水解平衡常数为K b=5.556×10 -10。
该温度下,用0.100 mol·L-1的氨水滴定10.00ml 0.050说法正确的是A. H2A的电离方程式为H2A H++A2-B. 25℃时,K b(NH3·H2O)=1.8×10-5C. P点时加入氨水的体积为10 mLD. 向H2A溶液中滴加氨水的过程中,水的电离程度逐渐减小4.已知:25℃时,K b(NH3·H2O) =1. 8×10-5,该温度下,用0.100 mol·L-1的氨水滴定10.00 mL0.100mol·L-1的一元酸HA 的溶液,滴定过程中加入氨水的体积(V) 与溶液中lg的关系如右图所示。
下列说法不正确的是A. a=10B. HA 为强酸C. 25℃时,NH4+的水解平衡常数为×10-9D. 当滴入氨水的体积V =20mL时,溶液中存在c(NH4+)>c( A-)5.若用AG表示溶液的酸度,其表达式为。
酸碱中和滴定曲线

酸碱中和滴定曲线x酸碱中和滴定曲线酸碱中和滴定曲线是指,当滴定中和反应进行时,在反应过程中pH值的变化情况。
它是一条曲线,反映了酸碱反应过程中pH值的变化趋势。
酸碱中和曲线有6种不同形式:(1)单项酸型滴定:在单项酸型滴定过程中,滴定剂是一种基质,酸的浓度不会改变,pH值随着滴定剂的浓度增加而逐渐升高,直到它到达它的最大值(即弱酸碱点),然后稳定在一个水平,随着滴定剂的添加,pH值不再变化。
(2)单项碱型滴定:在单项碱型滴定过程中,滴定剂是一种碱,碱的浓度不会改变,pH值随着滴定剂的浓度增加而逐渐降低,直到它到达它的最低值(即弱酸碱点),然后稳定在一个水平,随着滴定剂的添加,pH值不再变化。
(3)酸碱双项滴定:在酸碱双项滴定中,酸和碱的浓度同时改变。
其中,随着滴定剂的添加,pH值先上升,直到达到它的最高值(即中和点),然后下降,直到达到它的最低值(即弱酸碱点),然后稳定在一个水平,随着滴定剂的添加,pH值不再变化。
(4)自发滴定:自发滴定是一种特殊的滴定反应,它可以用来表征该体系的自净能力。
在自发滴定过程中,pH值先上升,直到达到它的最高值(即中和点),然后下降,直到达到它的最低值(即弱酸碱点),然后稳定在一个水平,随着自发滴定反应的进行,pH值不会发生明显变化。
(5)复合滴定:复合滴定是一种复杂的滴定反应,参与滴定的物质不止一种,可能有多种酸、碱或其它物质同时参与滴定反应。
在复合滴定过程中,pH值先上升,直到达到它的最高值(即最弱碱中和点),然后下降,直到达到它的最低值(即最弱酸碱点),然后稳定在一个水平,随着滴定剂的添加,pH值不再变化。
(6)比较滴定:比较滴定是指将两种不同的滴定剂进行滴定,以获得滴定剂的酸碱力。
滴定剂的酸碱力越高,其pH值变化的范围就越大,也就是说,随着滴定剂的添加,pH值变化范围越大。
总之,酸碱中和滴定曲线主要表征滴定反应中pH值的变化趋势,可以为更准确地判断物质的酸碱性提供参考依据。
专题03 酸滴定盐或碱滴定盐曲线-2019高考复习专题——酸碱中和滴定曲线大全(原卷版)

1.在常温下,用0.1000 mol/L的盐酸滴定25 mL 0.100 mol/Lna2CO3溶液,所得滴定曲线如下图所示。
下列相关微粒浓度间的关系不正确的是A. a点: c(CO32-) >c(Cl-)> c(HCO3-)B. b点: c(Na+)+c(H+)= c(Cl-)+ c(HCO3-)+2c(CO32-)+c(OH-)C. c点: c(OH-)+ c(CO32-)= c(H+) +c(H2CO3)D. d点: c(Cl-)= c(Na+)2.H2RO3是一种二元酸,常温下用1L1mol·L-1 Na2RO3溶液吸收RO2气体,溶液的pH随RO2气体的物质的量的变化如图所示。
下列说法正确的是A. a点溶液中2c(Na+)=3c(RO32-)B. 向b点溶液中加水可使溶液的pH由6.2升高到7.4C. 常温下,NaHRO3溶液中c(HRO3-)>c(RO32-)>c(H2RO3)D. 当吸收RO2的溶液呈中性时,c(Na+)=c(RO32-)+c(HRO3-)3.常温时,配制一组c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1的混合溶液,溶液中c(CO32-)、c(HCO3-)与pH的关系如图所示。
下列说法中错误的是(己知:CO32-+H2O HCO3-+OH- K=2×10-4,1g5=0.7)A. a 点的溶液中:c(HCO 3-)> c(H 2CO 3)+c(CO 32-)B. b 点横坐标数值大约为10.3C. c 点的溶液中:c(Na +)<2c(CO 32-)十c(HCO 3-)D. 溶液中水的电离程度:a<b<c4.25℃时,向Na 2CO 3溶液中滴入盐酸,混合溶液的pH 与离子浓度变化的关系如图所示。
己知:lgX=lg()2-3-3CO (HCO c c )或lg()-323HCO (H CO c c ),下列叙述正确的是A. 曲线m 表示pH 与()-323HCO (H CO c c )的变化关系 B. 当溶液呈中性时,c (Na +)= ()-3HCO c +2()2-3CO cC. Ka 1(H 2CO 3)=1.0×10-6.4D. 25℃时,CO 32-+H 2O-3HCO +OH -的平衡常数为1.0×10-7.6 5.常温下,用0. 1000 mol·L -1的盐酸滴定20.00 mL 未知浓度的Na 2CO 3溶液,溶液的pH 与所加盐酸的体积关系如图所示(饱和H 2CO 3溶液pH=5.6)。
酸碱滴定曲线图

B.M点对应的盐酸体积为20.0mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
三、强碱滴定弱酸曲线图的应用
【典例3】常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液,滴定曲线如图。下列说法正确的是( )
3.D【解析】强碱滴定弱酸的突跃小,且恰好中和时溶液处于弱碱性(生成的强碱弱酸盐水解呈碱性),若选择指示剂,只能选择碱性范围内变色的酚酞。识图:滴定曲线中的点①处是滴入10.00mLNaOH溶液中和后得到等量的CH3COOH与CH3COONa的混合溶液,由电荷守恒知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),CH3COOH的电离程度大于CH3COONa的水解程度,c(Na+)>c(CH3COOH),A错;点②处是pH=7的CH3COONa与少量CH3COOH的混合溶液,c(OH-)=c(H+),由电荷守恒知:c(Na+)=c(CH3COO-),B错;点③处是CH3COONa的弱碱性溶液,c(CH3COO-)>c(OH-),C错;点①之前加入少量的NaOH溶液时,可以得到少量CH3COONa与较多量CH3COOH的混合溶液,离子浓度会出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),正确答案为D。
8.C【解析】邻苯二甲酸氢钾为二元弱酸酸式盐,溶液呈酸性,向邻苯二甲酸氢钾溶液中加入氢氧化钠溶液,两者反应生成邻苯二甲酸钾和邻苯二甲酸钠,溶液中离子浓度增大,导电性增强,邻苯二甲酸钾和邻苯二甲酸钠为强碱弱酸盐,邻苯二甲酸根在溶液中水解使溶液呈碱性。A项、向邻苯二甲酸氢钾溶液中加入氢氧化钠溶液,两者反应生成邻苯二甲酸钾和邻苯二甲酸钠,溶液中Na+和A2—的浓度增大。由图像可知,溶液导电性增强,说明导电能力与离子浓度和种类有关,故A正确;
酸碱中和滴定曲线

酸碱中和滴定曲线引言酸碱中和滴定曲线是化学分析中常用的一种实验方法,通过滴定过程中溶液的pH 值变化,可以推断酸碱溶液的浓度。
本文将对酸碱中和滴定曲线的原理、滴定曲线的类型和如何解读滴定曲线进行详细探讨。
原理酸碱滴定是一种定量分析方法,通过滴定溶液A(滴定液)与溶液B(被滴定液)反应,测定溶液B中的酸或碱的浓度。
滴定过程中,用一种称为指示剂的化学物质来指示滴定终点。
当滴定终点达到时,指示剂的颜色发生明显变化。
在滴定过程中,溶液A(或称为滴定剂)一般是已知浓度的酸或碱,溶液B是未知浓度的酸或碱溶液。
滴定过程中,溶液A先加入到溶液B中,然后通过滴定管滴加溶液A,同时不断搅拌,直到出现指示剂颜色变化的终点。
通过记录溶液A的用量和滴定过程中溶液B的pH值变化,可以绘制出酸碱中和滴定曲线。
酸碱中和滴定曲线的类型酸碱中和滴定曲线根据溶液B的性质可以分为以下几类:强酸强碱滴定曲线强酸强碱滴定曲线是最常见的滴定曲线类型。
在滴定的早期阶段,溶液B中的酸性物质呈现出快速的pH变化,直到滴定终点出现。
滴定终点时,溶液B的pH值迅速增加。
强酸弱碱滴定曲线强酸弱碱滴定曲线与强酸强碱滴定曲线相似,但在滴定终点的pH值上升速度更缓慢。
这是因为弱碱的缓冲能力较强,使得pH值变化的速率减慢。
弱酸强碱滴定曲线弱酸强碱滴定曲线与强酸弱碱滴定曲线相似,但在滴定终点的pH值上升速度更快。
这是因为强碱可以更快地中和弱酸,使得溶液B的pH值快速增加。
弱酸弱碱滴定曲线弱酸弱碱滴定曲线是变化最为缓慢的一种类型,滴定终点的pH变化较小,很难观察到明显的颜色变化。
如何解读滴定曲线解读滴定曲线是分析滴定过程中酸碱浓度变化的一种重要方法。
以下是解读滴定曲线的一般步骤:1.确定滴定终点:滴定终点是指溶液B中的酸碱中和反应完成的位置。
在滴定曲线上,滴定终点通常是曲线最陡峭的位置,对应于pH值的最大变化。
2.计算滴定终点的pH值:根据滴定曲线,可以通过查找滴定终点对应的体积和pH值来计算滴定终点的pH值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1NaOH溶液。
有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。
根据图示判断,下列说法正确的是()
A. H2A在水中的电离方程式是:H2A===H++HA-、HA-H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性
C. 当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH-)
D. 当V(NaOH)=30 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(A2-)>c(H +)>c(OH-)
【答案】C
2.已知:pK a= -lgK a,25℃时,H2SO3的pK a1=1.85,pK a2=7.19。
常温下,用0.1mol/LNaOH溶液滴定20mL 0.1mol/L H2SO3溶液的滴定曲线如图所示。
下列说法不正确的是
A. A点所得溶液中:V o等于lOmL
B. B点所得溶液中:
C. C点所得溶液中:
D. D点所得溶液中水解平衡常数
【答案】A
【解析】分析:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,结合亚硫酸的电离。
